-
Medical journals
- Career
Pilotní analýza exprese PD-L1 u pacientek s ovariálním karcinomem léčených chemoterapií na bázi platiny
Authors: J. Hausnerová 1; L. Ehrlichová 2; P. Ovesná 3; E. Gazárková 4; J. Chlubnová 2; K. Matulová 1; Luboš Minář 4; Vít Weinberger 4; Markéta Bednaříková 2
Authors‘ workplace: Ústav patologie, LF MU a FN Brno 1; Interní hematologická a onkologická klinika LF MU a FN Brno 2; Institut bio statistiky a analýz, MU Brno 3; Gynekologická a porodnická klinika LF MU a FN Brno 4
Published in: Klin Onkol 2022; 35(Supplementum 1): 135-137
Category: Article
Overview
Východiska: V současnosti nejsou k dispozici jednoznačná data o prevalenci a významu imunohistochemického (IHC) stanovení ligandu 1 receptoru programované buněčné smrti (programmed death ligand-1 – PD-L1) u ovariálního karcinomu (ovarian cancer – OC). V rámci našeho projektu komplexního profilování pacientek s OC léčených chemoterapií založené na platinovém derivátu (P-CHT) jsme se proto zaměřili kromě jiného i na analýzu IHC exprese PD-L1. Materiál a metody: Z klinické databáze pacientek léčených ve FN Brno pro OC v letech 2010–2020 byla dle předem definovaných kritérií identifikována retrospektivní kohorta celkem 50 pacientek léčených minimálně šesti cykly chemoterapie na bázi platiny (P-CHT) v rámci primární systémové léčby. U všech pacientek byla provedena IHC analýza PD-L1 (klon 22C3, Agilent) na vzorcích tumoru odebraných před zahájením P-CHT a byla vyhodnocena míra PD-L1 exprese dle TPS (% pozitivních nádorových elementů) a CPS (kombinované pozitivní skóre hodnocené jako počet všech pozitivních nádorových buněk, lymfocytů a makrofágů dělený počtem vitálních nádorových buněk a násobený číslem100). Výsledky: Z celkového počtu 50 pacientek mělo 25 pacientek P-rezistentní onemocnění (medián doby bez progrese onemocnění (platinum treatment free interval – TFIp) 1 měsíc a celkového přežití (overall survival – OS) 10 měsíců) a 25 pacientek P-senzitivní onemocnění (zprogredovalo 15 (60 %) pacientek s TFIp 14 měsíců, OS 51 měsíců). V obou kohortách bylo rovnoměrné zastoupení pacientek podle histotypu, stadia v době diagnózy a rozsahu cytoredukce v rámci primární léčby. V P-rezistentní kohortě byly výsledky následující: TPS negativní u 24 (96 %), TPS pozitivní u jedné (4 %), CPS < 1 u 13 (52 %), CPS 1–10 u devíti (36 %) a CPS 10–100 u tří (12 %) pacientek. V P-senzitivní kohortě mělo TPS negativní 23 pacientek (92 %), TPS pozitivní byly dvě pacientky (8 %), CPS < 1 mělo 12 (48 %) pacientek, CPS 1–10 celkem sedm (28 %) pacientek a šest (24 %) pacientek mělo hodnotu CPS v rozmezí 10–100. Závěr: Na konferenci budou prezentovány výsledky rozšířených analýz korelace PD-L1 exprese se základními klinicko-patologickými charakteristikami pacientek.
Klíčová slova:
imunohistochemie – karcinom ovaria – protilátka anti-PD-L1
Úvod
Navzdory relativně vysoké procentuální úspěšnosti primární léčby spočívající v radikálním chirurgickém výkonu a v systémové léčbě zůstává prognóza karcinomu ovaria (ovarian carcinoma – OC) velmi nepříznivá, celkové 5leté přežití pacientek nedosahuje 50 % [1]. Hlavní příčina spočívá v primární nebo dříve či později získané chemorezistenci podmiňující neúčinnost standardní systémové léčby. Zásadní vliv na prognózu onemocnění i odpověď na léčbu má vedle molekulárních charakteristik tumoru také schopnost imunitního systému reagovat na přítomnost nádoru. Mezi hlavní determinanty nádorového mikroprostředí, které charakterizují stupeň aktivace imunitního systému hostitele, patří přítomnost, nebo absence tumor-infiltrujících lymfocytů (TILs) a ligandu 1 receptoru programované buněčné smrti (programmed death ligand-1 – PD-L1) [2]. PD-L1 (exprimovaný mj. na povrchu nádorových buněk) tvoří spolu s proteinem PD-1 (nacházejícím se na povrchu efektorových buněk imunitního systému) součást jednoho z klíčových imunoregulačních mechanizmů, který umožňuje nádorovým buňkám v případě overexprese PD-L1 uniknout z dohledu imunitního systému [3]. Dosud publikovaná data o prevalenci a prognostickém významu PD-L1 u OC ale nejsou jednoznačná. Podle výsledků některých studií je přítomnost PD-L1 spojena s horší prognózou, jiné studie naopak dokladují asociaci s lepší prognózou a podle dalších studií nebyla mezi expresí PD-L1 a prognózou žádná významná souvislost statisticky prokázána [4–9]. Mezi hlavní příčiny dosud nekonkluzivních dat patří vedle heterogenity PD-L1 exprese v nádorové tkáni především absence jednoznačné shody na metodice imunohistochemického (IHC) hodnocení PD-L1 u OC, ať již ve výběru optimální protilátky, nebo kritérií pro pozitivitu [10].
V rámci výzkumného projektu, jehož cílem je identifikace prediktivních biomarkerů na základě komplexního genomického a imunohistochemického profilování u pacientek s OC léčených chemoterapií založené na platinovém derivátu (P-CHT), jsme se proto kromě jiného zaměřili na analýzu exprese PD-L1.
Materiál a metody
Na základě souhlasu Etické komise FN Brno byly z klinické databáze FN Brno identifikovány všechny pacientky léčené P-CHT v rámci primární systémové léčby pro OC v letech 2010–2020. Do finálního výběru retrospektivní kohorty celkem 50 pacientek byly vybrány pacientky se srovnatelnými hlavními prognostickými parametry (histologický typ, stadium v době diagnózy, rozsah primární cytoredukce), lišící se pouze odpovědí na léčbu P-CHT. Kritéria pro platina-senzitivitu (PS) a platina-rezistenci (PR) byla stanovena klinicky, a to na základě časového intervalu mezi datem poslední aplikace P-CHT a datem stanovení progrese, resp. poslední kontroly (platinum therapy free interval – TFIp). Z archivu Ústavu patologie FN Brno byly následně vybrány reprezentativní vzorky tumoru odebrané pacientkám před zahájením systémové léčby, fixované formalinem a zalité v parafínu. Pro IHC analýzy byla použita anti-PD-L1 protilátka klon 22C3 (Agilent). Míra exprese PD-L1 byla vyhodnocena stanovením skóre pozitivity nádorových buněk (TPS; % pozitivních nádorových elementů) a kombinovaného skóre pozitivity (CPS; počet všech pozitivních nádorových buněk, lymfocytů a makrofágů dělený počtem vitálních nádorových buněk a násobený číslem100).
Výsledky
Z celkového počtu 50 pacientek mělo 25 pacientek PR onemocnění (medián TFIp 1 měsíc a medián celkového přežití (overall survival – OS) 10 měsíců) a 25 pacientek PS onemocnění (bez progrese po dobu min. 2 let od P-CHT celkem 10 pacientek (40 %), s progresí 15 (60 %) pacientek s mediánem TFIp 14 měsíců, OS 51 měsíců). V obou kohortách bylo rovnoměrné zastoupení pacientek podle histologického typu, stadia v době diagnózy a rozsahu cytoredukce v rámci primární léčby (tab. 1). V celém souboru bez ohledu na odpověď na léčbu P-CHT byly výsledky exprese PD-L1 následující: TPS pozitivní u 3 (6 %) a negativní u 47 (94 %) pacientek; CPS < 1 u 25 (50 %) pacientek, CPS v rozmezí 1–10 u 16 (32 %) pacientek a v rozmezí 10–100 u 9 (18 %) pacientek. V PR kohortě bylo TPS negativní u 24 (96 %) pacientek, TPS pozitivní u 1 (4 %) pacientky, CPS < 1 u 13 (52 %) pacientek, CPS v rozmezí 1–10 u 9 (36 %) pacientek a v rozmezí 10–100 u 3 (12 %) pacientek. V PS kohortě mělo TPS negativní 23 (92 %) pacientek, TPS pozitivita byla prokázána u 2 (8 %) pacientek, CPS < 1 mělo 12 (48 %) pacientek, CPS v rozmezí 1–10 u celkem 7 (28 %) pacientek a 6 (24 %) pacientek mělo hodnotu CPS v rozmezí 10–100 (tab. 2).
Table 1. Klinické charakteristiky retrospektivní kohorty pacientek (n = 50). 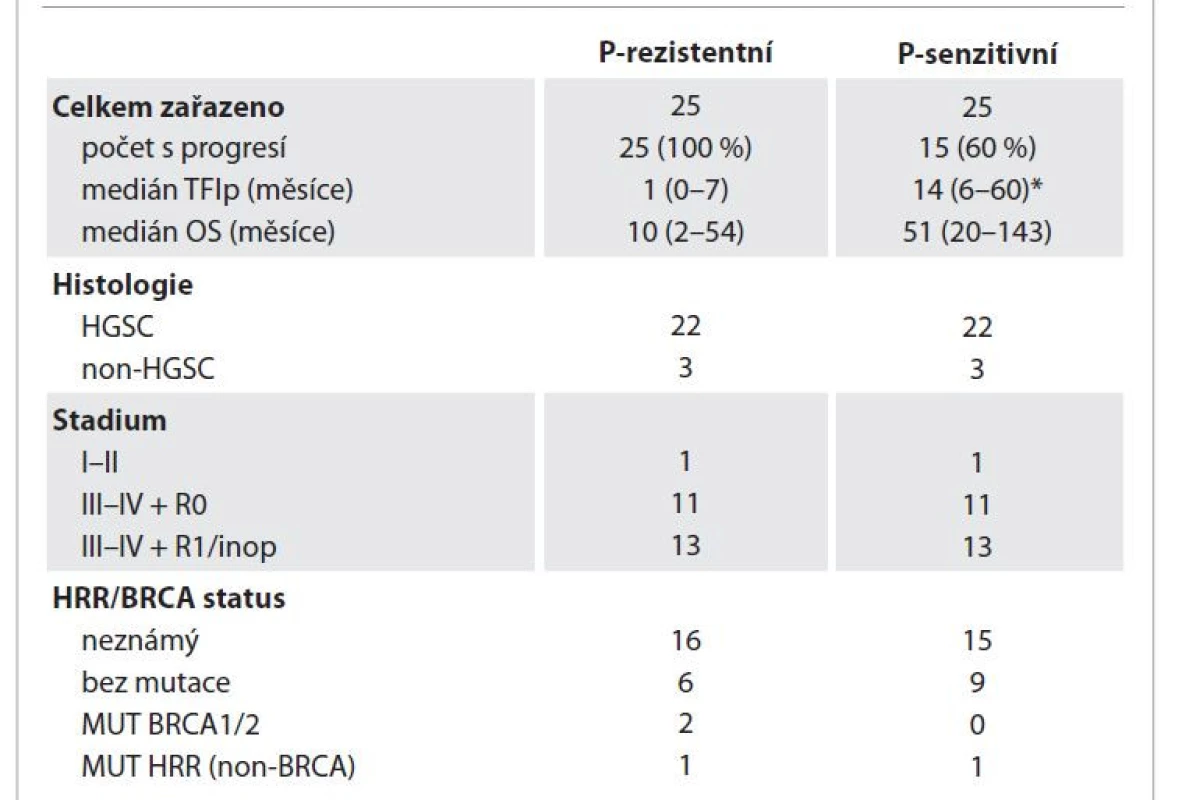
*pro pacientky s progresí/recidivou, HGSC – high-grade serózní karcinom, MUT BRCA1/2 – mutace v genu BRCA1 nebo BRCA2, MUT HRR (non-BRCA) – mutace v genu systému oprav poškozené DNA homologní rekombinací (mimo BRCA1/2), non-HGSC – non high-grade serózní karcinom, OS – celkové přežití (od data diagnózy k datu úmrtí/poslední kontroly 31. 5. 2022), P – platina, R0 – nulové makroskopické reziduum, R1/inop (nenulové makroskopickém reziduum/bez cytoredukce), TFIp – doba bez progrese onemocnění po ukončení chemoterapie na bázi platiny (časový interval mezi datem poslední aplikace CHT s platinou a datem stanovení progrese, resp. poslední kontroly (31. 5. 2022) Table 2. Výsledky imunohistochemických analýz exprese PD-L1. 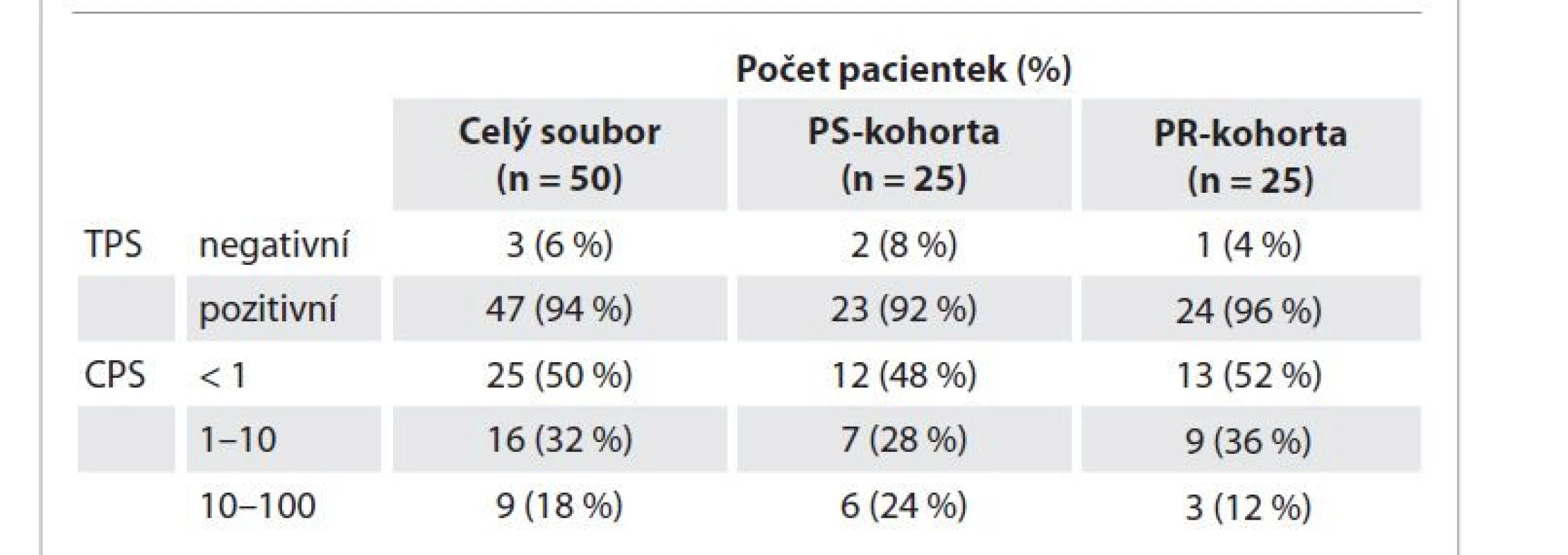
CPS – kombinované skóre pozitivity, n – počet, PS – platina-senzitivní, PD-L1 – ligand 1 receptoru programované buněčné smrti, PR – platina-rezistentní, TPS – skóre pozitivity nádorových buněk Závěr
Při zvolené metodice imunohistochemických analýz exprese PD-L1 u pacientek s ovariálním karcinomem bylo ve všech případech dosaženo hodnotitelných výsledků. Exprese PD-L1 vykazovala výraznou heterogenitu, byla pozorována na různých buněčných elementech s variabilní intenzitou. Povšechně byla častěji patrná pozitivita imunitních buněk v porovnání s nádorovými buňkami. Na konferenci budou prezentovány výsledky rozšířených analýz korelace PD-L1 exprese se základními klinicko-patologickými charakteristikami pacientek.
MUDr. Markéta Bednaříková
Interní hematologická
a onkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail:
bednarikova.marketa@fnbrno.cz
Obdrženo/Submitted: 14. 7. 2022
Přijato/Accepted: 5. 9. 2022
Sources
1. Sung H, Ferlay J, Siegel RL et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clin 2021; 71(3): 209–249. doi: 10.3322/ caac.21660.
2. Teng MW, Ngiow SF, Ribas A et al. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Res 2015; 75(11): 2139–2145. doi: 10.1158/ 0008-5472.CAN-15-0255.
3. Marincola FM, Jaffee EM, Hicklin DJ et al. Escape of human solid tumors from T–cell recognition: molecular mechanisms and functional significance. Adv Immunol 1999; 74 : 181–273. doi: 10.1016/ S0065-2776(08)60911-6.
4. Hwang WT, Adams SF, Tahirovic E et al. Prognostic significance of tumor-infiltrating T cells in ovarian cancer: a meta-analysis. Gynecol Oncol 2012; 124(2): 192–198. doi: 10.1016/ j.ygyno.2011.09.039.
5. Gottlieb CE, Mills AM, Cross JV et al. Tumor-associated macrophage expression of PD-L1 in implants of high grade serous ovarian carcinoma: a comparison of matched primary and metastatic tumors. Gynecol Oncol 2017; 144(3): 607–612. doi: 10.1016/ j.ygyno.2016.12.021
6. Chen H, Molberg K, Strickland AL et al. PD-L1 expression and CD8+ tumor-infiltrating lymphocytes in different types of tubo-ovarian carcinoma and their prognostic value in high-grade serous carcinoma. Am J Surg Pathol 2020; 44(8): 1050–1060. doi: 10.1097/ PAS.0000000000001503.
7. Xue C, Xu Y, Ye W et al. Expression of PD-L1 in ovarian cancer and its synergistic antitumor effect with PARP inhibitor. Gynecol Oncol 2020; 157(1): 222–233. doi: 10.1016/ j.ygyno.2019.12.012.
8. Eymerit-Morin C, Ilenko A, Gaillard T et al. PD-L1 expression with QR1 and E1L3N antibodies according to histological ovarian cancer subtype: a series of 232 cases. Eur J Histochem 2021; 65(1): 3185. doi: 10.4081/ ejh.2021.3185.
9. Buderath P, Mairinger F, Mairinger E et al. Prognostic significance of PD-1 and PD-L1 positive tumor-infiltrating immune cells in ovarian carcinoma. Int J Gynecol Cancer 2019; 29(9): 1389–1395. doi: 10.1136/ ijgc-2019-000 609.
10. Yu J, Wang X, Teng F et al. PD-L1 expression in human cancers and its association with clinical outcomes. OTT 2016; 9 : 5023–5039. doi: 10.2147/ OTT.S105862.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2022 Issue Supplementum 1-
All articles in this issue
- Editorial
- I. Onkologická prevence a screening
- II. Organizace a financování zdravotní péče
- III. Epidemiologie nádorů, klinické registry, zdravotnická informatika
- IV. Follow-up, sledování onkologických pacientů
- V. Vzdělávání, kvalita a bezpečnost v onkologické praxi
- VI. Diagnostické metody v onkologii a biobanking
- VII. Onkochirurgie, rekonstrukční chirurgie
- VIII. Radioterapeutické metody a radiofarmaka
- IX. Systémová protinádorová léčba
- X. Precizní medicína a personalizovaný přístup v onkologii
- XI. Imunoonkologie
- XII. Nežádoucí účinky protinádorové léčby a podpůrná léčba
- XIII. Paliativní péče a symptomatická léčba
- XIV. Nutriční podpora v onkologii
- XV. Ošetřovatelská péče a rehabilitace
- XVI. Psychosociální péče
- XVII. Hereditární nádorové syndromy
- XVIII. Nádory prsu
- XIX. Nádory kůže a maligní melanom
- XX. Nádory jícnu a žaludku
- XXI. Nádory tlustého střeva a konečníku
- XXII. Nádory slinivky, jater a žlučových cest
- XXIII. Nádory skeletu a sarkomy
- XXIV. Nádory hlavy a krku
- XXV. Nádory hrudníku, plic, průdušek a pleury
- XXVI. Gynekologická onkologie
- XXVII. Uroonkologie
- XXVIII. Neuroendokrinní a endokrinní nádory
- XXIX. Nádory nervového systému
- XXX. Hematoonkologie
- XXXI. Nádory dětí, adolescentů a mladých dospělých
- XXXII. Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- XXXIII. Základní, aplikovaný a klinický výzkum v onkologii
- XXXIV. Biologie nádorů
- XXXV. Integrativní přístupy v onkologii
- XXXVI. Umělá inteligence v onkologii
- XXXVII. Covid-19
- XXXVIII. Varia (ostatní, jinde nezařazené příspěvky)
- MicroRNAs as potential prognostic and predictive biomarkers in patients with atypical meningioma
- Pilot analysis of the PD-L1 expression in ovarian cancer patients treated with platinum-based chemotherapy
- Sequencing of long non-coding RNAs in exosomes of colorectal cancer patients
- Targeted RNA sequencing-based fusion gene analysis as a tool for diagnostics and therapeutic planning in pediatric cancer patients with solid tumors
- Sequencing of microRNAs in brain metastases as a new diagnostic tool
- Retrospective study of patients with tubo-ovarian cancers (n = 510) and an analysis of main factors influencing PFS and OS – the experience of a comprehensive oncology center during 2010–2019
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- VIII. Radioterapeutické metody a radiofarmaka
- IV. Follow-up, sledování onkologických pacientů
- XXVIII. Neuroendokrinní a endokrinní nádory
- XXXVI. Umělá inteligence v onkologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

