-
Medical journals
- Career
Kardiovaskulárne komplikácie u pacientov po alogénnej transplantácii krvotvorných buniek – úloha kardiomarkerov
Authors: Ľ. Harvanová 1,2; V. Lábska 1; E. Bojtárová 1; M. Hrubiško 1,2; A. Bátorová 1; J. Dúbrava 3; J. Gergeľ 4; B. Mladosievičová 5
Authors‘ workplace: Klinika hematológie a transfuziológie LF UK, LF SZU a UN Bratislava 1; Katedra hematológie a transfuziológie, Slovenská zdravotnícka univerzita, Bratislava, Slovenská republika 2; Oddelenie funkčnej diagnostiky, UN Bratislava 3; Oddelenie klinickej biochémie, Medirex, Bratislava 4; Ústav patologickej fyziológie, LF UK, Bratislava 5
Published in: Klin Onkol 2022; 35(6): 454-460
Category: Original Articles
doi: https://doi.org/10.48095/ccko2022454Overview
Východiská: Alogénna transplantácia kmeňových krvotvorných buniek (TKB) sa stala liečebnou modalitou pre mnohé malígne a nemalígne ochorenia. Počet dlhodobo prežívajúcich pacientov sa neustále zvyšuje. Transplantácia môže zapríčiniť poškodenia rôznych orgánov a tkanív – od minimálnych potenciálne progredujúcich subklinických zmien až po život ohrozujúce stavy. Cieľom tejto práce bolo vyhodnotiť prognostickú hodnotu vysokosenzitívneho kardiálneho troponínu T (hs-cTnT) a N-terminálneho fragmentu mozgového nátriuretického peptidu (NT-proBNP) v diagnostike kardiotoxicity, ako aj včasnej identifikácie vysokorizikových pacientov z hľadiska možného vzniku kardiálnej komplikácie po alogénnej TKB. Súbor pacientov a metódy: Súbor tvorilo 63 pacientov s hematologickými malignitami s mediánom veku 37 rokov v čase alogénnej TKB. Kardiálne biomarkery boli vyšetrované pred podaním prípravného režimu (PR) a deň +1, +14 a +30 po TKB. Systolická a diastolická funkcia bola vyhodnotená echokardiograficky pred podaním PR a 1 mesiac po TKB. Výsledky: Zmeny v koncentráciách NT-proBNP a hs-cTnT v priebehu 30 dní po TKB boli štatisticky významné (p < 0,001 vs. p = 0,02). U 7 pacientov (11,1 %) sa objavila kardiovaskulárna komplikácia, ktorá bola definovaná ako arytmia, perikardiálny výpotok s tamponádou srdca a srdcové zlyhanie. Multivariantnou analýzou sme zistili, že najsilnejším prognostickým faktorom kardiálnych komplikácií bolo súčasné pretrvávanie zvýšených hodnôt NT-proBNP a hs-cTnT s odstupom 14 dní od TKB (p < 0,0001). Pri súčasnej pozitivite obidvoch kardiálnych markerov v deň +14 po TKB bola zaznamenaná najlepšia hodnota oblasti pod krivkou (area under the curve – AUC) (0,95). Záver: Opakované meranie plazmatických koncentrácií NT-proBNP a hs-cTnT môže byť užitočným markerom pre včasnú detekciu poškodenia srdca u pacientov liečených alogénnou TKB a môže identifikovať pacientov s vysokým rizikom rozvoja kardiotoxicity. Súčasná pozitivita obidvoch kardiomarkerov bola silnejším prognostickým markerom ako len pozitivita jedného z nich.
Klíčová slova:
kardiotoxicita – alogénna transplantácia kmeňových krvotvorných buniek – kardiálne biomarkery – akútne komplikácie
Úvod
Transplantácia kmeňových krvotvorných buniek (TKB) má nezastupiteľné miesto v liečbe závažných hematologických ochorení a stala sa potenciálne kuratívnou liečebnou modalitou. Pokrok v liečbe a podpornej starostlivosti o pacientov s malígnymi a nemalígnymi hematologickými ochoreniami vyústil nielen do ich zlepšeného celkového prežívania, ale aj do zvyšujúceho sa počtu prežívajúcich pacientov. Ročne sa realizuje celosvetovo asi 50 000 transplantácií. Očakáva sa, že počet dlhodobo prežívajúcich pacientov sa viac ako zdvojnásobí z 242 000 v roku 2020 na viac ako pol milióna v roku 2030 [1].
Transplantácie krvotvorných buniek môžu zapríčiniť poškodenia rôznych orgánov a tkanív – od minimálnych potenciálne progredujúcich subklinických zmien až po život ohrozujúce stavy. Kardiotoxicita môže viesť až k ohrozeniu života po TKB. Carver et al definovali včasnú kardiotoxicitu po TKB ako kardiotoxicitu vznikajúcu počas podávania prípravného režimu a s odstupom do 100 dní od TKB [2].
Údaje o výskyte kardiovaskulárnych (KVS) komplikácií sa v jednotlivých štúdiách líšia, incidencia je udávaná od 1 % až po 43 % [3]. Riziko úmrtia z kardiovaskulárnej príčiny po TKB je 1,7–2,3 násobne vyššie ako v bežnej populácii [4]. Medzi včasné kardiovaskulárne komplikácie po TKB patrí srdcové zlyhanie, arytmie, koronárna artériová choroba, ischémia a tromboembolizmus [5].
Medzi hlavné rizikové faktory akútnej kardiotoxicity patrí kumulatívna dávka antracyklínov (ANT) a ich podanie s časovým odstupom menej ako 60 dní pred TKB, počet cyklov chemoterapie (CHT) pred TKB, cyklofosfamid v prípravnom režime, anamnéza srdcového ochorenia alebo reakcia štepu proti hostiteľovi (graft versus host disease – GvHD) [6].
Včasná identifikácia rizikových pacientov z hľadiska možného rozvoja kardiotoxicity predstavuje primárny cieľ hematoonkológov a kardiológov. Najvhodnejšia metóda, ktorá by dokázala detekovať a monitorovať progresiu kardiotoxicity by mala mať vysokú špecificitu a senzitivitu, neinvazívnosť, opakovateľnosť, ľahkú reprodukovateľnosť, nezávislosť od záťažových podmienok a finančnú nenáročnosť. V súčasnosti používané neinvazívne diagnostické postupy zahŕňajú hodnotenie ejekčnej frakcie ľavej komory (EFĽK) pomocou echokardiografického vyšetrenia, ktorá však ukázala nízku diagnostickú senzitivitu a nízku prediktívnu hodnotu v detekcii subklinickej kardiotoxicity. Odhalenie subklinických foriem kardiotoxicity si vyžaduje pravidelné sledovanie pacientov a monitorovanie parametrov, ktoré môžu včas upozorniť na postihnutie srdca. Na druhej strane, nie všetci pacienti si vyžadujú časté opakované vyšetrenie EFĽK, nakoľko to môže mať negatívny vplyv na celkové náklady zdravotnej starostlivosti [7].
V súčasnosti sa hľadajú diagnostické metódy, ktoré by včas identifikovali pacientov ohrozených rozvojom kardiotoxicity. Cieľom tejto práce bolo zistiť prognostickú úlohu kardiálnych biomarkerov – vysokosenzitívneho kardiálneho troponínu T (hs-cTnT) a N-terminálneho fragmentu nátriuretického peptidu typu B (NT-proBNP) vo včasnej detekcii kardiovaskulárnych komplikácií po alogénnej TKB.
Súbor pacientov
Súbor tvorilo 63 dospelých pacientov (39 mužov a 24 žien), ktorí podstúpili TKB na Klinike hematológie a transfuziológie LF UK, LF SZU a UN Bratislava. Medián veku v čase transplantácie bol 37 rokov (rozsah 19–67 rokov). Štyridsaťštyri (69,8 %) pacientov bolo pred TKB liečených ANT s mediánom kumulatívnej dávky (prepočítanej na doxorubicín) 250 mg/m2 (rozsah 100–520 mg/m2), 20 pacientov dostalo rádioterapiu (RT) na centrálny nervový systém (CNS) v celkovej dávke 24 Gy a 2 pacienti RT na mediastinum v celkovej dávke 24 Gy. Zdrojom kmeňových krvotvorných buniek bola kostná dreň u 4 pacientov a periférne kmeňové krvotvorné bunky (PKB) u 59 pacientov. Darcom krvotvorných buniek bol HLA-zhodný súrodenec v 27 prípadoch a nepríbuzenský darca v 36 prípadoch. Väčšina pacientov (80,9 %) mala myeloablatívny prípravný režim. V rámci profylaxie GvHD dostávali pacienti cyklosporín A s metotrexátom. Akútna GvHD sa objavila u 22 pacientov a liečba pozostávala z posilnenia imunosupresívnej terapie kortikosteroidom alebo mykofenolát mofetilom. Piati pacienti boli pred TKB liečení na artériovú hypertenziu, 3 pacienti mali diabetes mellitus a 18 pacientov hyperlipidémiu. Charakteristiky pacientov sú uvedené v tab. 1.
Table 1. Charakteristika súboru pacientov. 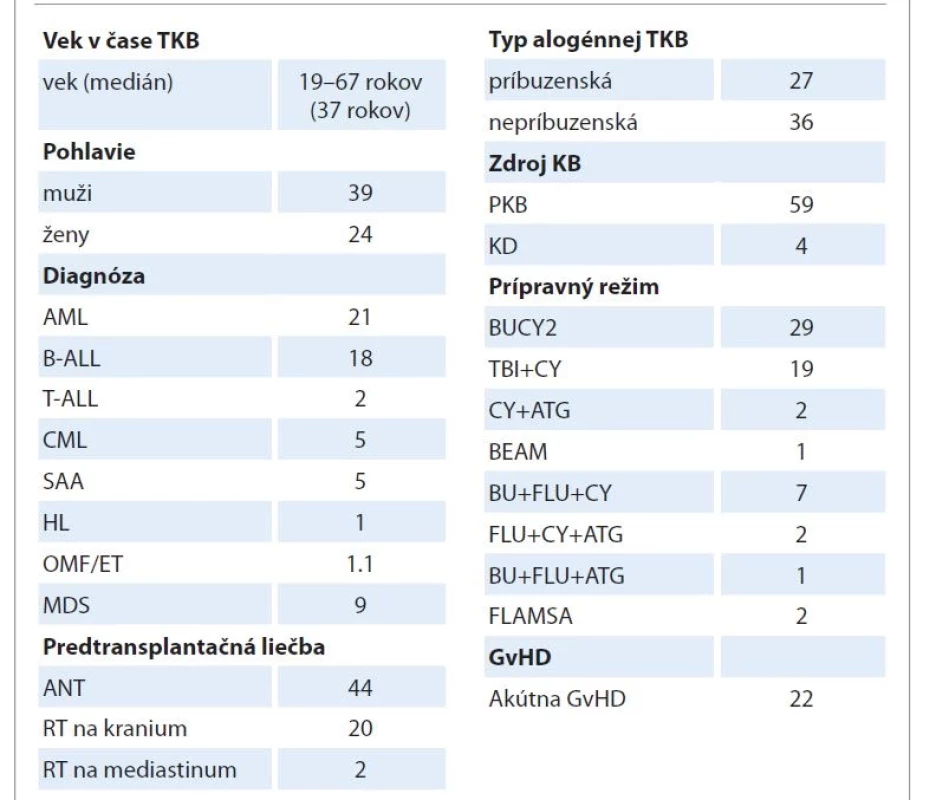
AML – akútna myeloblastová leukémia, ALL – akútna lymfoblastová leukémia, ANT – antracyklín, ATG – antitymocytový globulín, BU – busulfan, CML – chronická myeloidná leukémia, CY – cyklofosfamid, FLU – fludarabín, GvHD – reakcia štepu proti hostiteľovi, MDS – myelodysplastický syndróm, OMF – osteomyelofibróza, PNH – paroxyzmálna nočná hemoglobínúria, RT – radioterapia, SAA – ťažká aplastická anémia, TBI – celotelové ožiarenie, TKB – transplantácia kmeňových krvotvorných buniek Práca bola schválená Etickou komisiou Univerzitnej nemocnice v Bratislave. Každý pacient bol poučený a podpísal informovaný súhlas.
Metódy
Analýzy kardiálnych markerov
Spolu bolo vyšetrených 252 vzoriek u 63 pacientov. Vyšetrenie kardiálnych markerov prebiehalo v spolupráci s Oddelením klinickej biochémie Univerzitnej nemocnice Bratislava. Vzorky venóznej krvi boli odoberané z centrálneho venózneho katétra približne o 6 : 00 hodine. Opakované merania plazmatických hladín NT-proBNP a hs-cTnT sme realizovali pred zahájením prípravného režimu (PR), 1 deň po TKB (D + 1), 14 dní po TKB (D + 14) a 30 dní po TKB (D + 30). Plazmatické koncentrácie kardiomarkerov boli vyšetrené ihneď v deň odberu prostredníctvom elektrochemiluminiscenčnej imunoanalýzy s použitím analyzátora Elecsys 2010 (Roche Diagnostics) pomocou diagnostickej súpravy Elecsys hs TnT STAT (Roche Diagnostics) a Elecsys NT-proBNP (Roche Diagnostics). Hodnoty vylučujúce poškodenie kardiomyocytu pre hs-cTnT boli < 0,014 μg/l a hodnoty vylučujúce akútne srdcové zlyhanie pre NT-proBNP boli pod 450 ng/l u ľudí do 50 rokov a pod 900 ng/l u ľudí vo veku 50–75 rokov.
Systolické a diastolické echokardiografické parametre
Echokardiografické vyšetrenia boli realizované pred podaním prípravného režimu a 1 mesiac po TKB v spolupráci s Oddelením funkčnej diagnostiky Univerzitnej nemocnice. Systolická funkcia bola sledovaná prostredníctvom EFĽK, diastolická funkcia bola hodnotená prostredníctvom vrcholovej rýchlosti plnenia ľavej komory vo včasnej diastole (E), vrcholovej rýchlosti plnenia ĽK v čase predsieňovej systoly (A), pomeru E/A, deceleračného času včasného diastolického plnenia ĽK (DT) a času izovolumetrickej relaxácie ĽK (IRVT).
Štatistická analýza
Základné charakteristiky súboru pacientov, ako vek v čase TKB a kumulatívna dávka ANT, boli vyjadrené ako medián a rozsah. Premenné hodnoty (echokardiografické parametre) boli vyjadrené ako priemer ± smerodajná odchýlka (standard deviation – SD). Hodnoty NT-proBNP a hs-cTnT boli vyjadrené ako medián a medzikvartilové rozpätie. V prípade nepreukázania normality rozloženia parametrov sme na porovnanie použili Mann-Whitneyov test a Wilcoxonov test, pri preukázaní normality rozloženia parametrov sme použili Studentov t-test. Pre porovnávanie viacerých skupín alebo viacerých hodnôt nameraných u jedného pacienta sme použili Kruskal-Wallisov test a test repeated mesures ANOVA. Asociácie medzi premennými boli vyhodnocované prostredníctvom Spearmannovho korelačného koeficientu. Signifikantnosť vybraných rizikových faktorov bola vyhodnocovaná pomocou multivariantnej logistickej regresie. Charakteristiky jednotlivých diagnostických testov boli vyhodnocované prostredníctvom ROC (Receiver Operating Characteristic) kriviek. Na štatistické spracovanie sme použili štatistický program MedCalc verzia 14. Za signifikantný rozdiel sme považovali pravdepodobnosť nulovej hypotézy <5 % (p < 0,05).
Výsledky
V našom súbore sme klinicky významnú kardiotoxicitu definovanú ako arytmiu, perikardiálny výpotok s tamponádou a srdcové zlyhanie zaznamenali u 7 pacientov. Prevalencia kardiotoxicity bola 11,1 %, u 1 pacienta viedla k úmrtiu a u 1 pacienta neumožnila pokračovanie v protinádorovej liečbe.
V skupine pacientov s klinickou kardiotoxicitou sme zaznamenali signifikantne vyššie hodnoty NT-proBNP v deň +1 a deň +14 po TKB (graf 1). Signifikantné zmeny hodnôt hs-cTnT u pacientov s a bez klinicky významnej kardiotoxicity zobrazuje graf 2.
Graph 1. Hodnoty N-terminálneho fragmentu mozgového nátriuretického peptidu typu B (NT-proBNP) u pacientov s klinickou kardiotoxicitou a bez nej. 
Graph 2. Hodnoty vysokosenzitívneho kardiálneho troponínu T (hs-cTnT) u pacientov s klinickou kardiotoxicitou a bez nej. 
Jednotlivé parametre systolickej a diastolickej funkcie sú uvedené v tab. 2. V našom súbore sme zaznamenali signifikantný pokles pomeru E/A a EFĽK po TKB.
Table 2. Parametre systolickej a diastolickej funkcie pred a po TKB. 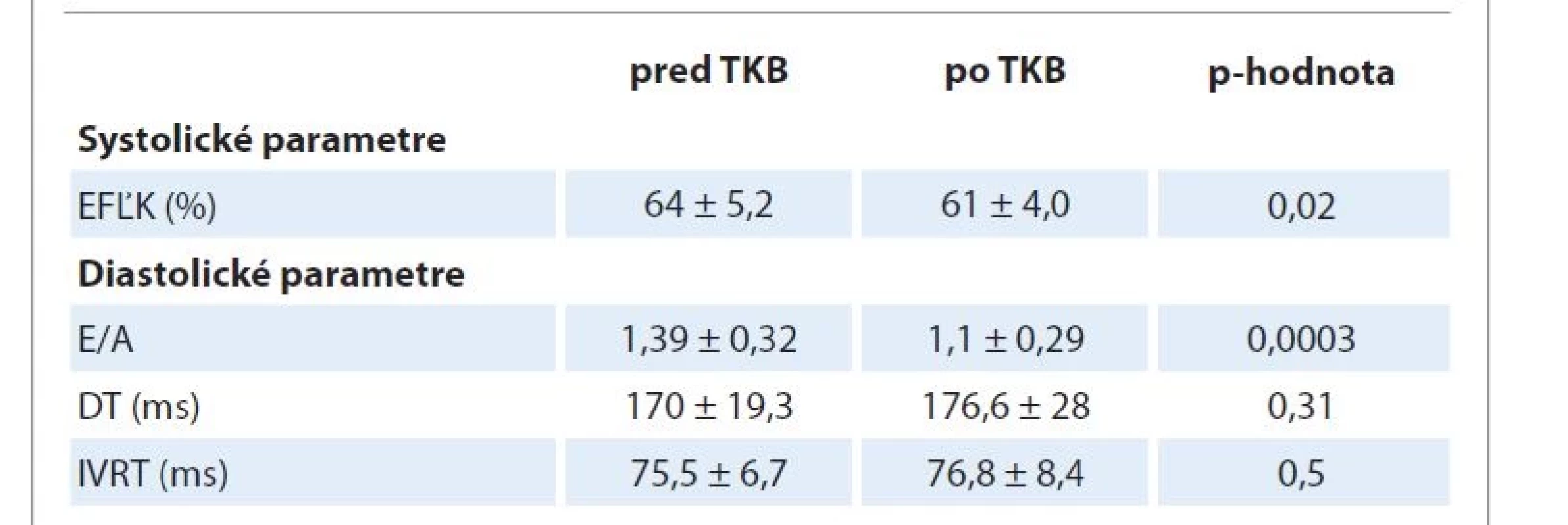
DT – deceleračný čas včasného diastolického plnenia ľavej komory, E/A – pomer vrcholovej rýchlosti plnenia ľavej komory vo včasnej diastole a v čase predsieňovej systoly, EFĽK – ejekčná frakcia ľavej komory, IVRT – čas izovolumetrickej relaxácie ľavej komory,TKB – transplantácia kmeňových krvotvorných buniek Na základe multivariantnej analýzy nám ako silný prognostický faktor klinickej kardiotoxicity po TKB vyšli abnormálne hodnoty NT-proBNP v deň +14 (p = 0,0002), hodnoty hs-cTnT v deň +14 (p = 0,03) a súčasná pozitivita obidvoch kardiomarkerov v deň +14 (p < 0,0001). S týmito prognostickými faktormi sme ďalej pracovali pri vyhodnocovaní jednotlivých charakteristík diagnostických testov (tab. 3).
Table 3. Porovnanie vlastností jednotlivých diagnostických testov. 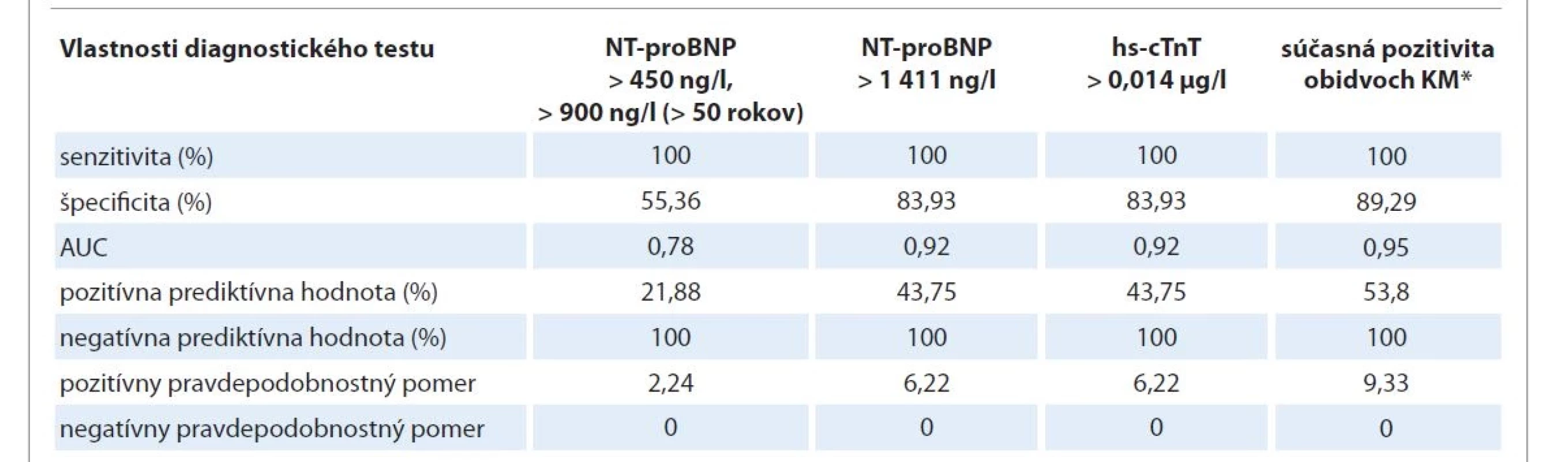
* hodnoty kardiomarkerov nad referenčné hodnoty, AUC – oblasť pod krivkou, hs-cTnT – vysokosenzitívny kardiálny troponín T, NT-proBNP – N-terminálny fragment mozgového nátriuretického peptidu typu B Charakteristiky jednotlivých diagnostických testov
Najvyššia hodnota AUC (area under curve, plocha pod ROC krivkou – receiver operating characteristic curve) pre NT-proBNP bola nameraná na deň +14 po TKB (AUC = 0,92) so senzitivitou 100 % (95 % CI 59,0–100,0) a špecificitou 83,93 % (95 % CI 71,7–92,4) pri cut-off hodnote > 1 411 ng/l. Vysokosenzitívny troponín T tiež dosiahol najvyššiu hodnotu AUC nameranú v deň +14 po TKB (AUC = 0,92). Senzitivita cut-off hodnoty > 0,014 µg/l pre hs-cTnT bola v tomto čase 100 % (95 % CI 59,9–100,0) a špecificita 83,93 % (95 % CI 71,4–92,4).
Pri súčasnej pozitivite obidvoch kardiálnych markerov (nad referenčné hodnoty) v deň +14 po TKB bola podľa analýzy ROC krivky zaznamenaná najlepšia hodnota AUC (AUC = 0,95). Senzitivita bola 100 % (95 % CI 59,0–100,0) a súčasne došlo k zvýšeniu špecificity na 89,29 % (95 % CI 78,12–95,97).
Diskusia
V predloženej prospektívnej práci sme zisťovali abnormality a dynamiku kardiálnych markerov, výskyt klinickej kardiotoxicity a možnosti jej včasnej detekcie u pacientov liečených alogénnou TKB. Principiálnym zistením bolo, že KVS komplikácie a následky boli rôzneho stupňa od minimálnych prechodných zmien kardiálnych biomarkerov cez perzistujúce abnormality biomarkerov, echokardiografické abnormality až po život ohrozujúcu kardiotoxicitu, ktorá u jednej pacientky skončila exitom a u druhého pacienta neumožnila pokračovanie v protinádorovej liečbe.
V klinickej praxi však nie je možné sledovanie všetkých pacientov z hľadiska možného rozvoja kardiotoxicity. Preto je vhodná riziková stratifikácia pacientov a zvýšenú pozornosť venovať hlavne vysokorizikovým pacientom. V rámci rizikovej stratifikácie by mohli byť užitočné práve kardiálne biomarkery. Zistili sme, že súčasná pozitivita biomarkerov (NT-proBNP a hs-cTnT) v deň +14 po TKB by mohla vyčleniť skupinu pacientov vysokorizikových z rozvoja kardiotoxicity. Táto diagnostická metóda mala v našej práci vysokú senzitivitu a špecificitu.
V súčasnosti medzi štandardné metódy monitorovania kardiálnej funkcie počas protinádorovej liečby patrí hodnotenie EFĽK, ktorá však môže podhodnotiť včasné poškodenie srdca, pretože kompenzačné mechanizmy srdca udržujú EFĽK v norme už v čase objavenia sa abnormalít kardiomyocytov [8]. Preto je potreba hľadania nových neinvazívnych, vysokosenzitívnych a finančne nenáročných metód na včasnú identifikáciu vysokorizikových pacientov.
V nedávno publikovanej práci u takmer 600 pacientov po alogénnej TKB sledovali autori vplyv podávania potransplantačného cyklofosfofamidu na rozvoj akútnej kardiotoxicity po TKB. Medzi signifikantné prediktory akútnej kardiotoxicity do 100 dní po TKB patril vek > 55 rokov, anamnéza hypertenzie, arytmie, diabetu a kardiálnej komorbidity. Naopak prípravný režim ani GvHD profylaxia nepatrili medzi prediktory kardiotoxicity. Kumulatívna incidencia akútnej kardiotoxicity stúpala s výškou skóre a dosahovala 19 % u pacientov s 3 alebo 4 rizikovými faktormi [9].
Armenian et al sledovali rozvoj KVS komplikácií u 1 930 pacientov, ktorí podstúpili TKB a prežili aspoň 1 rok po TKB. Medzi rizikové faktory KVS komplikácií patrila kumulatívna dávka ANT ≥ 250 mg/m2, ožiarenie mediastina, vek > 50 rokov, anamnéza hypertenzie, diabetu a fajčenia. Pacienti s prítomnosťou ≤ 3 rizikových faktorov boli zaradení do nízkeho rizika, s 4–5 rizikovými faktormi do stredného rizika a prítomnosť 6 faktorov zaradila pacientov do vysokého rizika. Desaťročná kumulatívna incidencia KVS príhod bola 3,7 % u pacientov s nízkym rizikom, 9,9 % pri strednom a 26,2 % pri vysokom riziku [10].
V súbore 216 pacientov, ktorí podstúpili haploidentickú transplantáciu s prípravným režimom pozostávajúcim z busulfanu, cyklofosfamidu a anti - T-lymfocytárneho globulínu malo 5,6 % pacientov kardiálnu toxicitu 3. a 4. stup - ňa. Medzi nezávislé rizikové prediktory závažnej kardiotoxicity patrilo pretransplantačné ECOG skóre (≥ 2), abnormality ST segmentu a T-vlny na EKG, hyperlipidémia a dávka cyklofosfamidu (≥ 1,8 g/m2/deň). Incidencia závažnej kardiotoxicity bola 50,0 %, 6 % a 1,3 % pre pacientov vo vysokom riziku (s prítomnosťou 3–4 rizikových faktorov), v strednom riziku (2 faktory) a nízkom riziku (0–1 faktor) (p < 0,001) [11].
V súčasnosti sa hľadajú neinvazívne a finančne nenáročné diagnostické metódy, ktoré by včas identifikovali pacientov ohrozených rozvojom kardiotoxicity. Význam kardiálnych troponínov a nátriuretických peptidov je nepopierateľný a väčšina literárnych údajov ako aj Európska kardiologická spoločnosť ich meranie odporúča pri rizikovej stratifikácii, diagnostike včasného KVS ochorenia počas onkologickej liečby aj po jej ukončení, tiež pri identifikácii onkologických pacientov, ktorí môžu mať benefit z kardioprotektívnej liečby, a reálna je aj ich prognostická hodnota pri identifikácii tých pacientov, ktorí budú potrebovať dlhodobé sledovanie KVS ochorenia [12–14].
Nátriuretické peptidy sú syntetizované v kardiomyocyte ako odpoveď na tlakové a objemové preťaženie. Viacero prác potvrdilo signifikantný vzostup nátriuretických peptidov krátko po TKB, ako aj ich perzistujúce elevácie vo včasnom potransplantačnom období [15]. Iniciálny vzostup hladiny NT-proBNP po TKB môže byť odrazom poškodenia srdca spôsobeného podaným prípravným režimom a akútnym objemovým preťažením následkom masívnej hydratácie, prítomnosti dimetylsulfoxidu v transplantáte a použitia kostnej drene ako zdroja krvotvorných buniek. Prípravný režim navyše spôsobuje aktiváciu endotelových buniek a makrofágov s následným uvoľnením zápalových cytokínov ako sú tumor nekrotizujúci faktor (TNF-a) alebo interleukíny (IL) 1 a 6. Zápalové cytokíny môžu hrať dôležitú úlohu v patogenéze srdcového zlyhávania inhibíciou kontraktility myokardu, navodením hypertrofie myokardu a apoptózy kardiomyocytu [16]. Na druhej strane je však známe, že nátriuretické peptidy môžu byť produkované aj nádorovou bunkou bez prítomnosti kardiálneho zlyhávania. Syntéza proBNP môže byť stimulovaná zápalovými cytokínmi, ako je TNF, a niektorými interleukínmi produkovanými nádorom. NT-proBNP a troponín T môžu byť cenné markery nielen kardiálneho poškodenia počas chemoterapie, ale aj prognózy onkologických chorôb [17].
Vzostup v koncentrácii kardiálnych troponínov je odrazom štrukturálneho poškodenia myocytu a aj minimálne abnormality v hladinách cTnT sa môžu spájať s akútnym poškodením myokardu. Pri poškodení kardiomyocytu sa troponín uvoľňuje z cytoplazmy do séra a je ľahko detekovateľný. Väčšina troponínu je však naviazaná na aktín a uvoľňuje sa pomaly, čo umožňuje detekovať nielen akútne, ale aj prebiehajúce poškodenie [18]. Pre chemoterapiou navodenú kardiotoxicitu, ktorá je spojená s neischemickou etiológiou, sú typické nízke a perzistujúce elevácie odrážajúce pokračujúce poškodzovanie myokardu. Tieto vlastnosti troponínu a vývin vysokosenzitívnych testov ho predisponujú na biomarker včasnej detekcie kardiotoxicity.
Iba málo prác sledovalo prediktívnu úlohu kardiomarkerov v detekcii kardiotoxicity. Sandri et al na základe perzistujúcich abnormalít NT-proBNP s odstupom 72 hodín po vysokodávkovanom cyklofosfamide vyčlenili vysokorizikovú skupinu pacientov, v ktorej došlo súčasne k zhoršeniu parametrov systolickej a diastolickej funkcie [19]. Podobne aj Coghlan et al vo svojich odporúčaniach pre pacientov s amyloidózou definovali pacientov s perzistujúcim zvýšením hladiny NT-proBNP nad dvojnásobok normy za vysokorizikových z hľadiska možného rozvoja kardiotoxicity [20]. V práci zahŕňajúcej 37 pacientov po alogénnej TKB autori identifikovali vysokorizikovú skupinu pacientov, ktorá bola ohrozená kardiovaskulárnou komplikáciou v priebehu 6 mesiacov po TKB. Za rizikovú skupinu boli považovaní pacienti s perzistujúcimi eleváciami NT-proBNP a hs-cTnT s odstupom 14 dní po transplantácii [21].
Aj napriek mnohým štúdiám zameraným na význam kardiomarkerov v detekcii kardiotoxicity, stále neexistujú všeobecne akceptované závery pre klinickú prax. Mnohé práce zahŕňajú len malé počty vyšetrovaných pacientov, s rôznymi malignitami, v rôznom štádiu ochorenia a liečenými rôznymi protinádorovými liekmi. Navyše rôzne štúdie vyšetrujú rôzne nátriuretické peptidy (ANP, NT-proANP, BNP alebo NT-proBNP), používajú rôznu metodiku ich stanovenia s inými,,cut-off ” hodnotami a odberom vzoriek v rôznych časových intervaloch v závislosti od podania protinádorovej liečby.
Vstupné meranie kardiomarkerov – nátriuretických peptidov a troponínov – je obzvlášť dôležité, najmä ak sú prítomné u pacienta ďalšie KVS ochorenia, ktoré môžu spôsobiť zvýšenie týchto iniciálnych hodnôt. Z toho dôvodu, aby sa zmeny v dynamike vyšetrovaných kardiomarkerov mohli správne použiť na interpretáciu nových kardiálnych komplikácií. Izolovaná elevácia biochemických kardiomarkerov nikdy alebo len zriedka oprávňuje k ukončeniu protinádorovej liečby. Mala by viesť k diskusii medzi onkológom a kardiológom ohľadom možného benefitu a možného poškodenia ďalšou protinádorovou liečbou. Na základe elevácií kardiomarkerov by sa mala zvýšiť frekvencia monitorovania pacienta, zahájiť kardioprotektívna liečba alebo doplniť ďalšie kardiologické vyšetrenia [14]. Hodnotenie významu kardiovaskulárnych komplikácií onkologickej liečby však patrí do rúk onkológa.
Záver
Súčasná pozitivita abnormálnych hodnôt NT-proBNP a hs-cTnT s časovým odstupom 14 dní po TKB bola spojená s vysokým rizikom rozvoja kardiovaskulárnych komplikácií. Naše zistenia prispeli k lepšej rizikovej stratifikácii pacientov po liečbe, pričom považujeme za žiaduce, aby sa aspoň pacientom s abnormalitami kardiálnych enzýmov venovala dôslednejšia dlhodobá starostlivosť. Potrebné sú však väčšie prospektívne a multicentrické štúdie na definovanie prognostickej úlohy kardiomarkerov v detekcii kardiotoxicity v uvedenej vybranej skupine pacientov.
doc. MUDr. Ľubica Harvanová, PhD.
Klinika hematológie
a transfuziológie LF UK, LF SZU a UN
Antolská 11
Bratislava 85107
Slovenská republika
e-mail: lubica.roziakova@gmail.com
Submitted/Obdŕžané: 18. 2. 2021
Accepted/Prijaté: 3. 5. 2021
Sources
1. Saunders IM, Tan M, Koura D et al. Long-term follow-up of hematopoietic stem cell transplant survivors: a focus on screening, monitoring, and therapeutics. Pharmacotherapy 2020; 40 (8): 808–841. doi: 10.1002/phar.2443.
2. Carver JR, Desai CJ. Cardiovascular toxicity of antitumor drugs: dimension of the problem in adult settings. In: Minotti G. Cardiotoxicity of non-cardiovascular drugs. Wiley 2010 : 127–199.
3. Tuzovic M, Mead M, Young PA et al. Cardiac complications in the adult bone marrow transplant patient. Curr Oncol Rep 2019; 21 (3): 28. doi: 10.1007/s11912-019-07 74-6.
4. Vanderwalde AM, Sun CL, Laddaran L et al. Conditional survival and cause-specific mortality after autologous hematopoietic cell transplantation for hematological malignancies. Leukemia 2013; 27 (5): 1139–1145. doi: 10.1038/leu.2012.311.
5. Yoon JH, Kim HJ, Lee EJ et al. Early left ventricular dysfunction in children after hematopoietic stem cell transplantation for acute leukemia: a case control study using speckle tracking echocardiography. Korean Circ J 2015; 45 (1): 51–58. doi: 10.4070/kcj.2015.45.1.51.
6. Armenian SH, Sun CL, Mills G et al. Predictors of late cardiovascular complications in survivors of hematopoietic cell transplantation. Biol Blood Marrow Transplant 2010; 16 (8): 1138–1144. doi: 10.1016/j.bbmt.2010.02.021.
7. Harvanová Ľ. Diagnostika kardiotoxicity. In: Harvanová Ľ. Kardiovaskulárne komplikácie pri mnohopočetnom myelóme. Bratislava: Herba 2021 : 89–108.
8. Albini A, Pennesi G, Donatelli F et al. Cardiotoxicity of anticancer drugs: the need for cardio-oncology and cardio-oncological prevention. J Natl Canc Inst 2010; 102 (1): 14–25. doi: 10.1093/jnci/djp440.
9. Yeh J, Whited L, Saliba RM et al. Cardiac toxicity after matched allogeneic hematopoietic cell transplant in the posttransplant cyclophosphamide era. Blood Adv 2021; 5 (24): 5599–5607. doi: 10.1182/bloodadvances.2021004 846.
10. Armenian SH, Yang D, Teh JB et al. Prediction of cardiovascular disease among hematopoietic cell transplantation survivors. Blood Adv 2018; 2 (14): 1756–1764. doi: 10.1182/bloodadvances.2018019117.
11. Xu ZL, Xu LP, Zhang YY et al. Incidence and predictors of severe cardiotoxicity in patients with severe aplastic anaemia after haploidentical haematopoietic stem cell transplantation. Bone Marrow Transplant 2019; 54 (10): 1694–1700. doi: 10.1038/s41409-019-0509-1.
12. De Boer RA, Daniels LB, Maisel AS et al. State of the art: newer biomarkers in heart failure. Eur J Heart Fail 2015; 17 (6): 559–569. doi: 10.1002/ejhf.273.
13. Balážová K, Kubincová D. Current possibilities of early detection of cardiotoxicity of cytostatic treatment. Klin Onkol 2020; 33 (3): 208–213. doi: 10.14735/amko2020 208.
14. Pudil R, Mueller C, Čelutkiene J et al. Role of serum biomarkers in cancer patients receiving cardiotoxic cancer therapies: a position statement from the Cardio-Oncology Study Group of the Heart Failure Association and the Cardio-Oncology Council of the European Society of Cardiology. Eur J Heart Fail 2020; 22 (11): 1966–1983. doi: 10.1002/ejhf.2017.
15. Roziakova L, Bojtarova E, Mistrik M et al. Serial measurements of cardiac biomarkers in patients after allogeneic hematopoietic stem cell transplantation. J Exp Clin Cancer Res 2012; 31 (1): 13. doi: 10.1186/1756-9966 - 31-13.
16. Bujak M, Frangogiannis NG. The role of IL-1 in the pathogenesis of heart disease. Arch Immunol Ther Exp (Warsz) 2009; 57 (3): 165–176. doi: 10.1007/s00005-009-0024-y.
17. Chovanec J, Chovanec M, Mego M. Levels of NT-proBNP and troponin T in cancer patients – mini-review. Klin Onkol 2020; 33 (3): 171–176. doi: 10.14735/amko2020171.
18. Lipshultz SE, Scully RE, Lipsitz SR et al. Assessment of dexrazoxane as a cardioprotectant in doxorubicin-treated children with high-risk acute lymphoblastic leukaemia: long-term follow-up of a prospective, randomised, multicentre trial. Lancet Oncol 2010; 11 (10): 950–961. doi: 10.1016/S1470-2045 (10) 70204-7.
19. Sandri MT, Salvatici M, Cardinale D et al. N-terminal pro-B-type natriuretic peptide after high-dose chemotherapy: a marker predictive of cardiac dysfunction? Clin Chem 2005; 51 (8): 1405–1410. doi: 10.1373/clinchem. 2005.050153.
20. Coghlan JG, Handler CE, Kottaridis PD. Cardiac assessment of patients for haematopoietic stem cell transplantation. Best Pract Res Clin Haematol 2007; 20 (2): 247–263. doi: 10.1016/j.beha.2006.09.005.
21. Roziakova L, Mistrik M, Batorova A et al. Can we predict clinical cardiotoxicity with cardiac biomarkers in patients after haematopoietic stem cell transplantation? Cardiovasc Toxicol 2015; 15 (3): 210–216. doi: 10.1007/s12012-014-9286-7.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2022 Issue 6-
All articles in this issue
- Editorial
- Fekální mikrobiální transplantace – nová možnost ovlivnění výsledků terapie onkologických pacientů
- Prognostické a prediktivní faktory meningeomů mozku
- Informace z České onkologické společnosti
- Kardiovaskulárne komplikácie u pacientov po alogénnej transplantácii krvotvorných buniek – úloha kardiomarkerov
- Aktuality z odborného tisku
- Souhra klinické onkologie, radiační onkologie a chirurgie v léčbě pacientů s nádory GIT
- Tebentafusp
- Porovnání účinnosti aferézy periferních kmenových buněk na separátorech krevních buněk
- Rekonstrukce a analýza sítě circRNA-miRNA-mRNA v patologii karcinomu plic
- Výhody a omezení 3D organoidů a ex vivo kultivace nádorových tkání v personalizované medicíně pro karcinom prostaty
- Benigní lymfoidní hyperplazie imitující oligometastázu nemalobuněčného karcinomu plic po stereotaktické ablační radioterapii
- Fatální myokarditida po první dávce nivolumabu
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické a prediktivní faktory meningeomů mozku
- Výhody a omezení 3D organoidů a ex vivo kultivace nádorových tkání v personalizované medicíně pro karcinom prostaty
- Fekální mikrobiální transplantace – nová možnost ovlivnění výsledků terapie onkologických pacientů
- Fatální myokarditida po první dávce nivolumabu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

