-
Medical journals
- Career
Hepatocelulární karcinom – zobrazovací metody a intervence pod kontrolou zobrazovacích metod
Authors: prof. MUDr. Ferda Jiří, Ph.D. 1; MUDr. Ferdová Eva 1; doc. MUDr. Mírka Hynek, Ph.D. 1; Duras Petr 1; prof. MUDr. Fínek Jindřich, Ph.D. 2
Authors‘ workplace: Klinika zobrazovacích metod LF UK a FN Plzeň 1; Onkologická a radioterapeutická klinika LF UK a FN Plzeň 2
Published in: Klin Onkol 2020; 33(Supplementum 3): 5-12
Category: Review
doi: https://doi.org/10.14735/amko20203S5Overview
Výběr zobrazovacích metod u hepatocelulárního karcinomu (HCC) závisí především na klinické otázce, u podezření na HCC slouží k vyšetření zpravidla v 1. linii ultrasonografie následovaná provedením výpočetní tomografie. V pokročilé diferenciální diagnostice a se zaměřením na posouzení stagingu a případného biologického chování jsou dalšími metodami magnetická rezonance s podáním hepatospecifické kontrastní látky nebo hybridní metody – pozitronová emisní tomografie s výpočetní tomografií nebo pozitronová emisní tomografie s magnetickou rezonancí s podáním 18F-fluorodeoxyglukózy nebo 18F-fluorocholinu. V terapii HCC je možno využívat intervenční metody lokálně destrukční, především radiofrekvenční ablaci nebo transarteriální chemoembolizaci, příp. radioembolizaci.
Klíčová slova:
hepatocelulární karcinom – výpočetní tomografie – magnetická rezonance – pozitronová emisní tomografie – hybridní zobrazovací metody
Úvod
Zobrazovací metody se u hepatocelulárního karcinomu (HCC) využívají k detekci onemocnění, k stanovení stagingu a dále k diferenciální diagnostice mezi HCC a podobnými afekcemi nenádorového i nádorového původu. Ze zobrazovacích metod je využívána ultrasonografie (USG), vč. podání echokontrastní látky (contrast-enhanced ultrasound – CEUS), dále výpočetní tomografie (CT) v podobě vícefázového vyšetření po intravenózním podání kontrastní látky [1–3], magnetická rezonance (MR) s využitím hepatospecifické kontrastní látky a dále metody hybridního zobrazení s pozitronovou emisní tomografií (PET) – PET/CT a PET/MR) s použitím 18F-fluorodeoxyglukózy (18F-FDG) nebo 18F-fluorocholinu (18F-FCH) [4–6]. Pod kontrolou zobrazovacích metod se provádí odběr bioptického vzorku ke stanovení histologické diagnózy a dále se provádějí pod kontrolou zobrazovacích metod terapeutické výkony s lokálním účinkem, jako je radiofrekvenční ablace, alkoholizace, chemoembolizace a radioembolizace.
Základní vlastností HCC, o níž se opírají diagnostické metody radiodiagnostiky, je hypervaskularizace. HCC je jedním z nádorů typických vznikem patologické vaskularizace, která v jaterním parenchymu vyvolává lokální nerovnováhu mezi portálním a arteriálním jaterním zásobením. Typická nádorová tkáň HCC vykazuje velmi časné a bohaté nasycení extracelulárními kontrastními látkami v tzv. arteriální fázi, po níž následuje relativně rychlé vymývání extracelulární kontrastní látky ve fázi portální či fázi vyrovnání nasycení (ekvilibria). Tato arteriální hypervaskularizace se podílí na specifickém obrazu v CEUS, CT i MR, ale podílí se i na redistribuci látek v jaterním parenchymu, která má specifické důsledky pro rozložení radiofarmaka 18F-FCH nebo i specifické distribuci radioembolizačního materiálu.
Hepatocelulární karcinom zahrnuje poměrně heterogenní skupinu manifestace onemocnění s výskytem solitárních nádorových ložisek, ložisek vícečetných, mnohočetných i difuzní infiltrace nádorovou tkání v části jaterního parenchymu. V části případů se současně objevuje invaze do venózních struktur, zejména do vena portae hepatis, ale v některých případech i do jaterních žil nebo až do dolní duté žíly. Kromě charakteristických vzorců růstu zahrnuje také HCC varianty dobře diferencované, hůře diferencované, nebo dokonce anaplastické a smíšené formy, které mohou vyvolávat také některé specifické nálezy u zobrazovacích metod. K posouzení stupně diferenciace je možné využívat jednak MR s posouzením schopnosti akumulace hepatospecifické kontrastní látky na bázi gadolinia, nebo lze použít metody molekulárního zobrazení pomocí hybridních metod PET/CT nebo PET/MR s podáním 18F-FDG nebo18F-FCH.
Ultrasonografie
Ultrasonografické vyšetření (USG) je základní vyšetřovací metodou u onemocnění jaterního parenchymu, a to jak u difuzního, tak u ložiskového. V zobrazování HCC hraje USG ústřední roli zejména v diferenciální diagnostice ložiskových procesů, jakými jsou cysty, jaterní hemangiomy a také ložiskové procesy podobné HCC – fokální nodulární hyperplazie (FNH) a hepatocelulární adenom (HCA), v neposlední řadě sekundární jaterní nádory a nádory cholangiogenního původu.
V cílené diagnostice HCC se uplatňuje podání echokontrastní látky na bázi fluoridu sírového, která je čistě intravaskulární kontrastní látkou a dovoluje po nitrožilním podání zobrazit arteriální hypervaskularizaci s typickým vymýváním (wash-out) v pozdnějších fázích. Vzhledem k poměrně charakteristickému chování FNH, kdy hypervaskularizace v ložisku přetrvává a vyrovnává se s okolím jaterním parenchymem, je možné odlišit tyto ložiskové procesy od ložisek podezřelých z HCC. Nevýhodou USG je do jisté míry subjektivita metody, resp. závislost na zkušenostech vyšetřujícího, a dále některé podobné rysy chování HCC, HCA a také některých nádorových procesů, jako jsou metastázy hypervaskularizovaných nádorů nebo intrahepatální cholangiocelulární karcinom.
Výpočetní tomografie
Vyšetření CT se při podezření na HCC provádí min. v arteriální a portální fázi sycení po intravenózní aplikaci jodové kontrastní látky. Výhoda CT je izotropní rozlišení v libovolné rovině a možnost provést trojrozměrnou rekonstrukci cévního zásobení jater a také přesné určení segmentární anatomie jater před eventuálním chirurgickým výkonem. Typický HCC se výrazně sytí v arteriální fázi, ve fázi portální se objevuje často již lehké snížení denzity nádorové tkáně zvýrazněné bohatým nasycením okolního jaterního parenchymu. V pozdější fázi se objevuje časnější vymývání kontrastní látky, u solitárních ložisek bývá přítomna i pseudokapsula. V arteriální fázi bývá u větších ložisek přítomna také tzv. patologická vaskularizace, tedy nerovné, nepravidelné cévy, které nerespektují přirozenou architekturu jaterních lalůčků a vykazují i známky arterioportální zkratové cirkulace. Z dat získaných v arteriální fázi lze provést trojrozměrnou rekonstrukci CT angiografie (CTA), která má význam zejména při plánování výkonů intervenční radiologie, jakými jsou embolizace, chemoembolizace nebo radioembolizace. CTA dovoluje zobrazit arteriální kmeny, které se podílejí na zásobení jater, a to vč. častějších variant – a. hepatica odstupující z a. mesenterica superior, nebo i variant méně častých –akcesorní jaterní tepny odstupující z a. gastrica sinistra či dokonce parietální tepny podílející se na zásobení HCC, jako jsou a. phrenica inferior nebo interkostální tepny.
Kombinace arteriální a portální fáze zobrazení má zásadní přínos také při odhalení intravaskulární invaze nádorové tkáně [3,7]. Nejčastěji bývá cílem invaze portální žíla, kdy v arteriální fázi nástřiku je zřetelné nasycení nádorové tkáně, naopak v portální fázi (s maximálním sycením portálního systému) dochází k demaskování již hypodenzního nádorového trombu jako defektu v kontrastní náplni žilního kmene. Častým nálezem u HCC je také portální hypertenze, a to jak následkem jaterní cirhózy (jako predisponujícího onemocnění ke vzniku HCC), tak i následkem okluze portálního řečiště. Portální hypertenze je významným limitujícím faktorem u některých chirurgických výkonů, a to zejména je-li přítomna centripetální kolateralizace stěnou žlučovodů v podobě portální biliopatie. U portální biliopatie se při okluzi kmene portální žíly rozšiřují varikózně pleteně Saintova a Petrénova plexu a poranění těchto kolaterál mohou být fatální komplikací při chirurgickém výkonu. Dalšími častými kolaterálami u nemocných s HCC je rekanalizace umbilikální žíly nebo rozšíření gastroepiploické žíly.
Kromě nádorové tkáně v játrech a kromě cévních změn je CT také vhodná ke stanovení uzlinových metastáz, které se vyskytují u HCC v portální skupině uzlin, ale také ve skupinách uzlin pod bránicí nebo těsně nad bránicí. Uzlinové metastázy jsou typicky hypervaskularizované, podobně jako vlastní nádorová tkáň.
Význam CT je také v diferenciální diagnostice ložisek v jaterním parenchymu, podobně jako je tomu u USG, kdy problematickým procesem zůstává stále HCA.
U pacientů s léčeným HCC je CT nejjednodušším způsobem hodnocení odpovědi na terapii. Nelze využívat prostá kritéria RECIST (kritéria pro hodnocení odpovědi na léčbu solidních tumorů – Response Evaluation Criteria in Solid Tumors), neboť při léčbě HCC se účinek nehodnotí pouhou geometrickou velikostní odpovědí na terapii, ale poklesem nebo vymizením výše uváděné typické hypervaskularizace (Choi-kritéria). CT je základní metodou v hodnocení terapie anti-VEGF preparáty (sorafenib), ale i po chemoembolizační, radioembolizační i lokálně destrukční terapii. Viz obr. 1 a 2.
Image 1. Vyšetření CT ukazuje typické chování hepatocelulárního karcinomu, hypervaskularizaci v arteriální fázi a vymývání ve fázi portální. Nález u mladé 24leté ženy charakteru typického fi brolamelárního karcinomu s postižením levého laloku a také s uzlinovými metastázami v portální skupině. 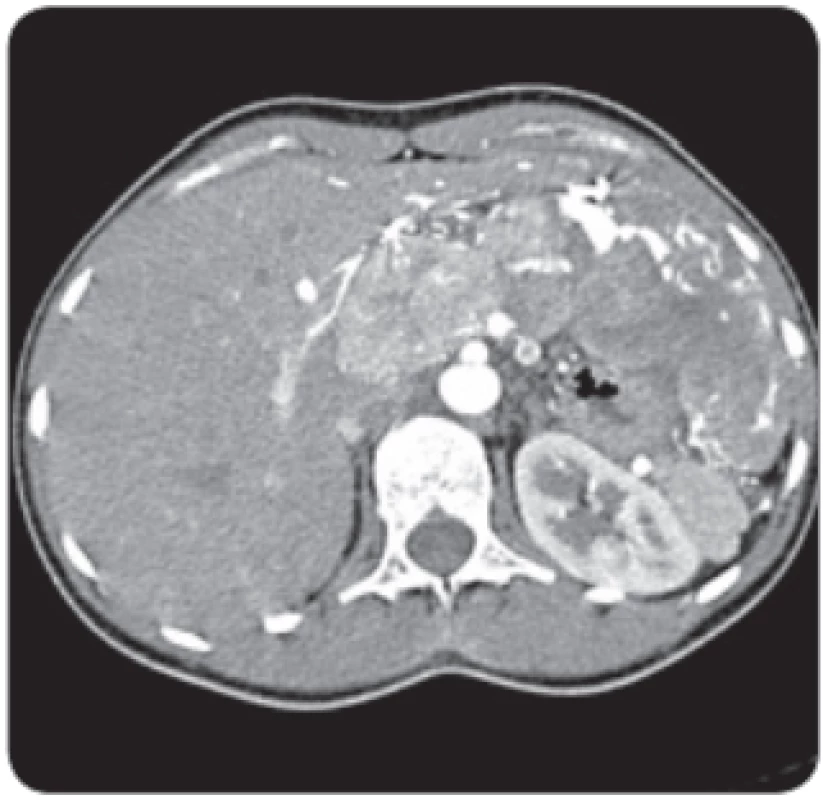
Image 2. A, B. Vyšetření CT objemného heterogenního hepatocelulárního karcinomu v terénu steatofi brózy v pravém jaterním laloku s hypervaskularizací v arteriální fázi a s vymýváním v portální fázi. 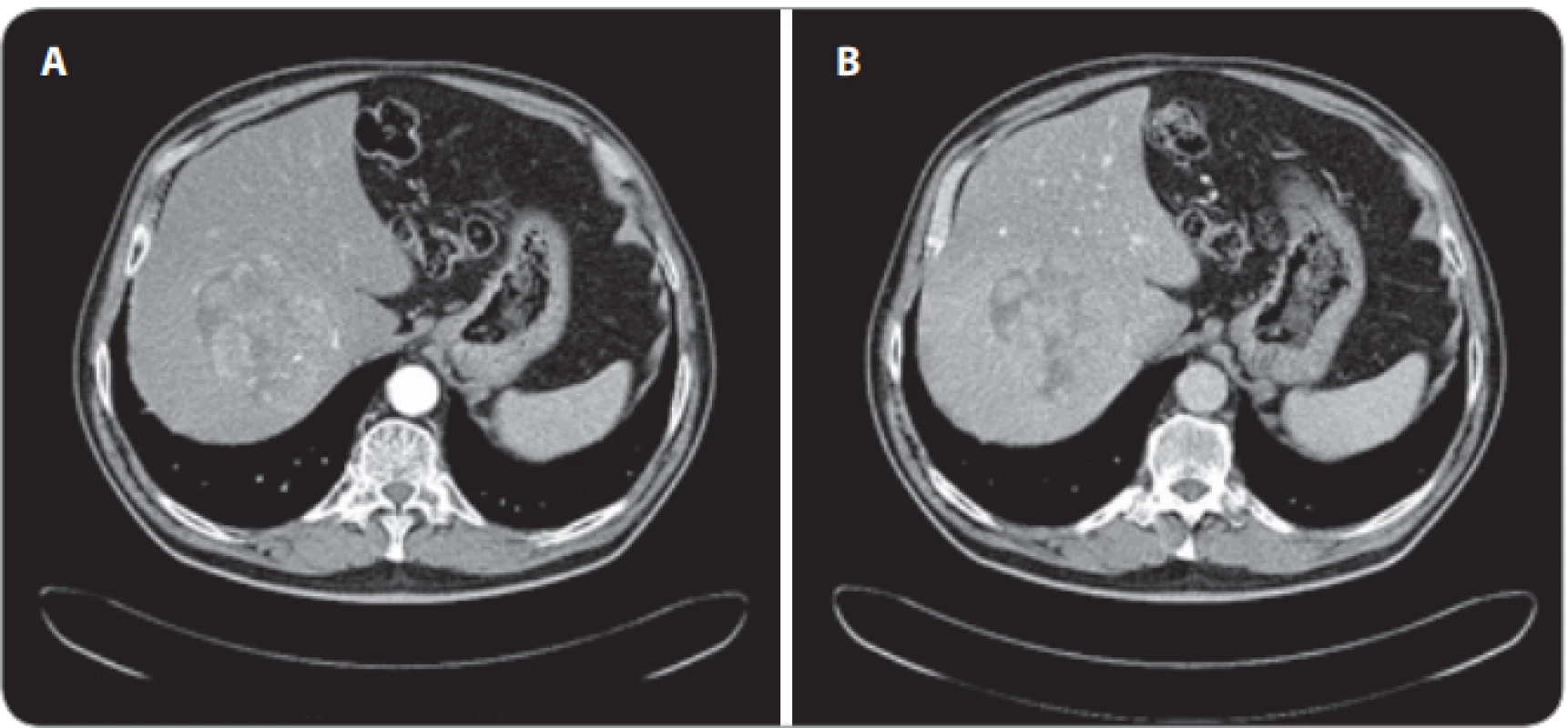
Magnetická rezonance
Výhodou MR ve srovnání s CT je u zobrazení jater, kromě absence použití ionizujícího záření, možnost použít intracelulární kontrastní látku. Při zobrazení jater se používá látka, jejíž acetátový zbytek dovoluje využít afinitu hepatocytů k lipofilním substancím, kyselina gadoxetoctová (acidum gadoxeticum) se tedy na rozdíl od jiných látek akumuluje ve funkčně zralých hepatocytech, které zabezpečují její biliární exkreci. Hepatospecifická fáze zobrazení nastává v odstupu 10–20 min za současné dobré funkce extracelulární kontrastní látky v časné fázi zobrazení.
Hepatocelulární karcinom se pomocí hepatospecifické kontrastní látky zobrazuje dynamicky v T1 vážených zobrazeních gradientního echa, v časných fázích arteriální, portální a vyrovnané distribuce se sycení tkáně HCC podobá CEUS nebo CT. V pozdních akumulačních neboli hepatospecifických fázích je rozdíl mezi chováním dobře diferencované a hůře nebo špatně diferencované tkáně HCC. Dobře diferencované HCC mají do určité míry zachovanou schopnost hepatospecifickou kontrastní látku akumulovat, naproti tomu špatně diferencované typy již postrádají enzymatický aparát nutný k vychytávání lipofilních látek, a tak se jejich tkáň v hepatospecifické fázi jeví jako hypointenzní, neakumulující kontrastní látku.
Kromě kontrastního zobrazení s hepatospecifickou kontrastní látkou se v diagnostice HCC a zejména v diferenciální diagnostice ostatních lézí, jako je FNH nebo HCA, uplatňuje také difuzní vážení (diffusion-weighted image – DWI). Charakteristický špatně diferencovaný HCC je tvořen malými buňkami a malým mezibuněčným prostorem, proto se v difuzním zobrazení jeví jako oblast snížené mobility vodních molekul neboli oblast restrikce difuze. Difuzní zobrazení lze využít i ve vyhledávání menších uzlů HCC nebo dysplastických uzlů, nebo naopak k posuzování změny struktury nádorové tkáně účinkem protinádorové terapie. Dobrý účinek terapie se projevuje vzestupem mobility vodních molekul – usnadněním difuze.
V diferenciálně diagnostické indikaci HCC vyniká MR v odlišení fokální nodulární hyperplazie, která se projevuje extrémním zvýšením signálu tkáně v hepatospecifické fázi zobrazení nad úroveň okolního jaterního parenchymu, dále dovoluje odlišit některé hepatocelulární adenomy, pokud je v nich přítomnost rozpadových produktů hemoglobinu po krvácení. Do jisté míry přispívá MR i k odlišení intrahepatálního cholangiocelulárního karcinomu, u nějž se objevuje pozdní sycení a přetrvávající nasycení fibrózní matrix v nádorové tkáni. U některých predisponujících difuzních onemocnění, která přispívá ke vzniku HCC – jaterní fibrosteatóza, cirhóza nebo hemochromatóza – dovoluje vyšší tkáňový kontrast a/nebo průkaz specifických látek (tuk, železo) k odlišení těchto onemocnění a k detekci ložiskového postižení v patologicky změněném terénu.
Hybridní metody PET/CT a PET/MR
Hybridní metody kombinují výhody zobrazení radiologických, jak bylo uvedeno ve výše uvedených částech textu, s výhodami molekulárního zobrazení. HCC se zčásti podobá tkáni, ze které vychází, zčásti se od ní metabolicky liší. K zobrazení tkáně HCC lze využít zejména dvou radiofarmak: 18F-FCH – markeru metabolizmu lipidů a 18F-FDG – markeru glykolýzy [6–9].
18F-FCH je látka lipidové povahy, která jednak mapuje místa, kde se tvoří buněčné membrány, jednak tkáně, kde je vyšší obrat látek tukové povahy obecně. Jeho distribuce se v těle děje poměrně rychle, za cca 15 min je již rovnovážná, je velmi závislá na lokálních perfuzních poměrech a na setrvalé schopnosti akumulovat látky lipidové povahy. V játrech se tedy velice typicky objevuje nejvyšší míra akumulace 18F-FCH v místech s nejvyšší perfuzí. Nejvyšší perfuze je ve fokální nodulární hyperplazii, tam se charakteristicky objevují velice vysoké akumulace této látky, podobně zvýšený obrat je zaznamenáván v dysplastických uzlech a ve tkáni dobře diferencovaného HCC v játrech. Špatně diferencované HCC akumulují 18F-FCH méně než okolní jaterní parenchym (zejména pokud je jaterní parenchym postižen přestavbovým procesem u aktivních změn cirhotického charakteru), protože špatně diferencovaný typ HCC není schopen lipofilní látky aktivně z krevního řečiště vychytávat. 18F-FCH je možné využít i k detekci metastatického rozsevu v uzlinách, plicích nebo skeletu. V diferenciální diagnostice jaterních ložiskových procesů se uplatňuje také negativní zobrazení pomocí 18F-FCH – absence akumulace pomáhá v odlišení hepatocelulárního adenomu a dále ložisek jiné povahy, jako je cholangiogenní karcinom a sekundární jaterní nádory.
18F-FDG je v obecné rovině nejužívanějším radiofarmakem pro PET vůbec a také u HCC má její využití svoje opodstatnění. Jelikož akumulace 18F-FDG a 18F-FCH jsou u dobře a špatně diferencovaného HCC zrcadlové, je u špatně diferencovaných HCC detekovatelná vysoká akumulace 18F-FDG, ale nízká akumulace 18F-FCH, jak bylo uvedeno výše. Podle chování HCC po podání 18F-FDG rozděluje Okazumi tři základní typy [6]. Ve špatně diferencovaných HCC je vyšší aktivita hexokinázy (savčí izoenzym HKII) a naopak snížená aktivita glukóza-6-fosfatázy, a tak jsou tyto histologické typy HCC vysoce akumulující FDG (Okazumi typ 1). V normální jaterní buňce je nízká aktivita glukózového transportéru i glukóza-6-fosfatázy, proto je akumulace glukózy v normálních játrech intermediální. Je-li shodná aktivita enzymů i v HCC, nelze jej od okolí odlišit (Okazumi typ 2). Ve vztahu k normální jaterní tkáni se jeví HCC jako méně akumulující FDG v případě, že je v nádorové tkáni vyšší aktivita glukóza-6-fosfatázy než v okolních normálních hepatocytech (Okazumi typ 3). Zajímavým úkazem je však chování dobře diferencovaných karcinomů ve fázi metastatické diseminace a také invaze do v. portae. Pokud se nádorová tkáň dobře diferencovaného HCC dostává mimo svoje vlastní prostředí jater, konvertuje se jeho metabolizmus ke glykolýze a jeho metastázy zvýšeně akumulují 18F -FDG – zejména se tak chovají kostní metastázy [6].
Obě výše uvedená radiofarmaka mají využití jak u hybridního zobrazení PET/CT, tak PET/MR. PET/CT je u HCC bezpodmínečně nutné provádět s podáním jodové kontrastní látky v arteriální i portální fázi, tak aby bylo možné využít všech předností uvedených v části věnované CT. Vyšetření bez podání jodové kontrastní látky je nevhodné. PET/MR v sobě spojuje výhody plnohodnotného zobrazení MR s cíleným zobrazením PET jater, kdy je možné využít prodloužení akvizice PET obrazů a současně i dechovou synchronizaci. Dechová synchronizace dovoluje přesnější odlišení rozdílů v metabolické aktivitě jednotlivých částí jaterního parenchymu, a to vč. ložiskových procesů. Viz obr. 3–6.
Image 3. A–C. Vyšetření PET/CT s podáním 18F-fl uorodeoxyglukózy u špatně diferencovaného karcinomu, který vznikl v terénu jaterní cirhózy, ve vena portae hepatis se vyskytuje nádorový trombus, který vykazuje podobně jako nádor vysokou úroveň glykolýzy. Kolem jater je přítomen ascites. 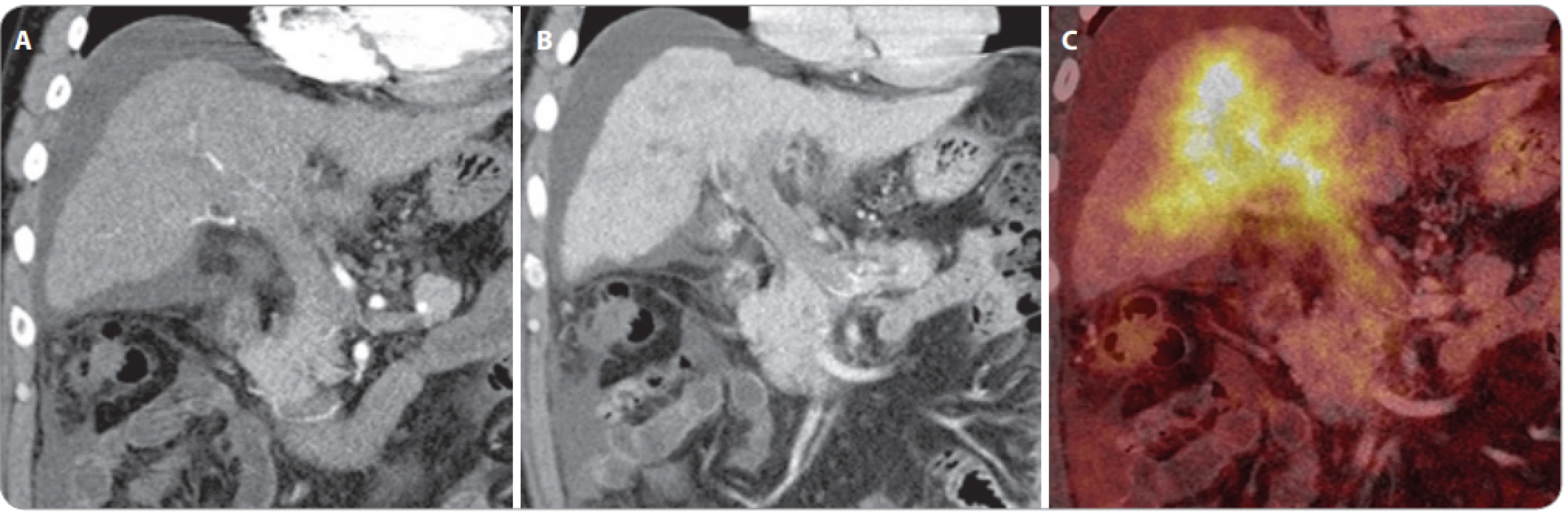
Image 4. Vyšetření PET/CT s podáním 18F-fl uorodeoxyglukózy u dobře diferencovaného karcinomu, vyšetření PET/CT po chemoembolizaci ukazuje, že část hepatocelulárního karcinomu nekrotizovala, ale část nádorové tkáně po obvodu je viabilní. 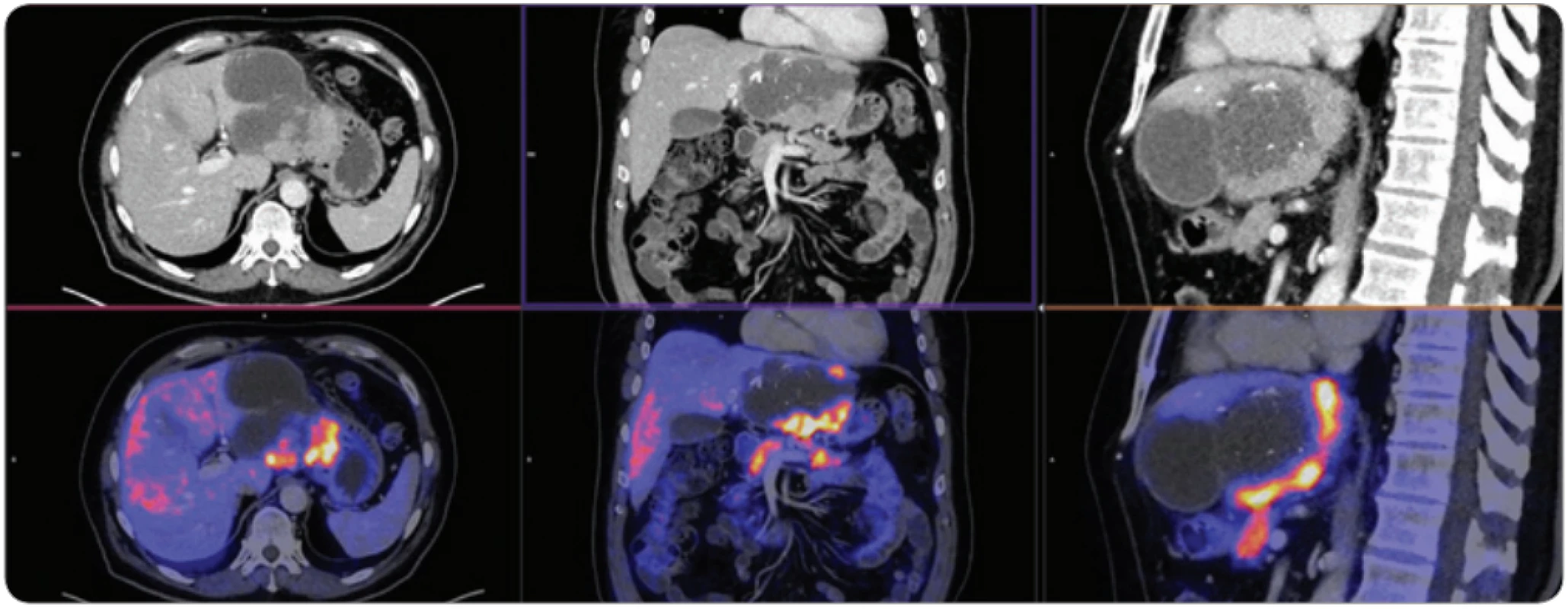
Image 5. Vyšetření PET/MR s podáním 18F-fl uorodeoxyglukózy a gadoliniové hepatospecifi cké kontrastní látky pro MR, vyšetření u dobře diferencovaného multifokálního hepatocelulárního karcinomu. 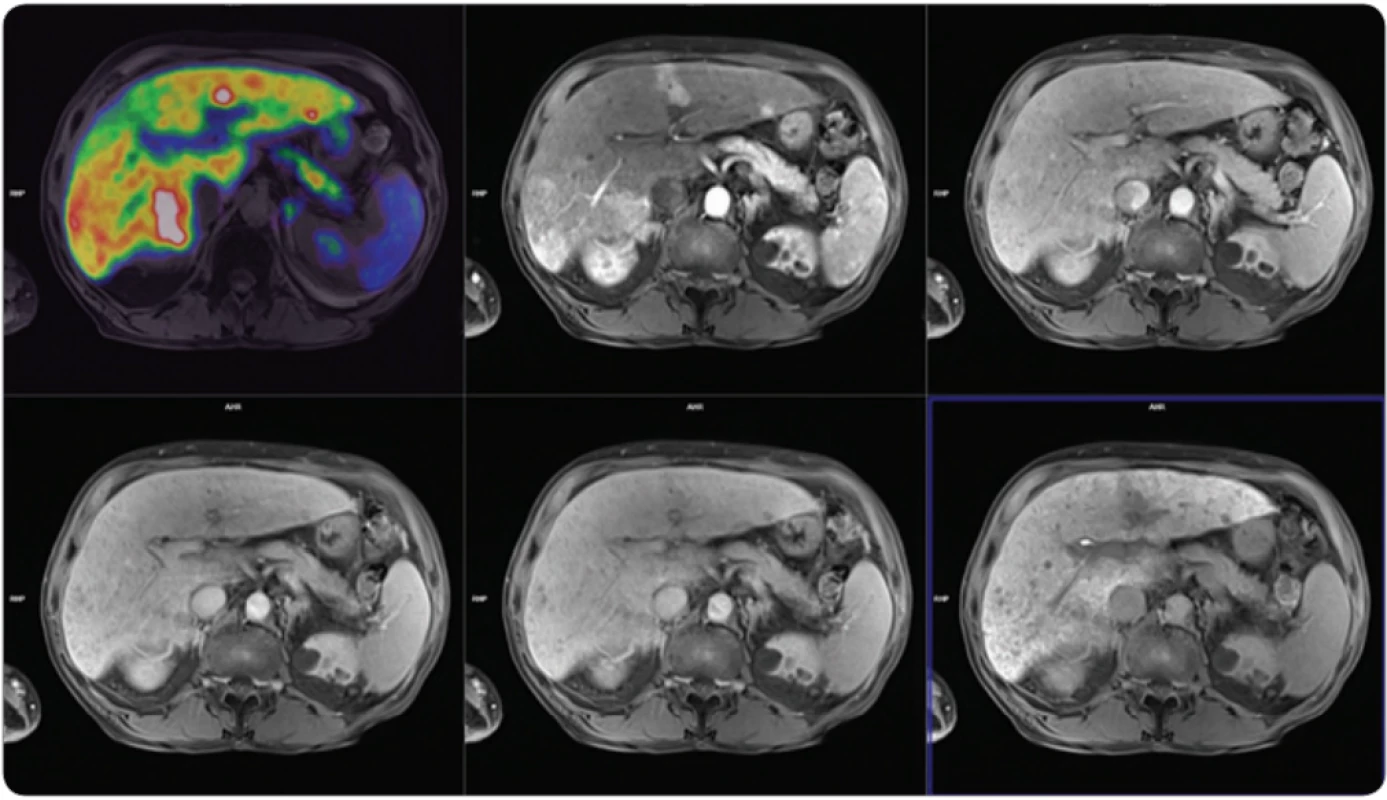
Image 6. A. Selektivní arteriografi e hepatocelulárního karcinomu, stav před radioembolizací (horní řada). 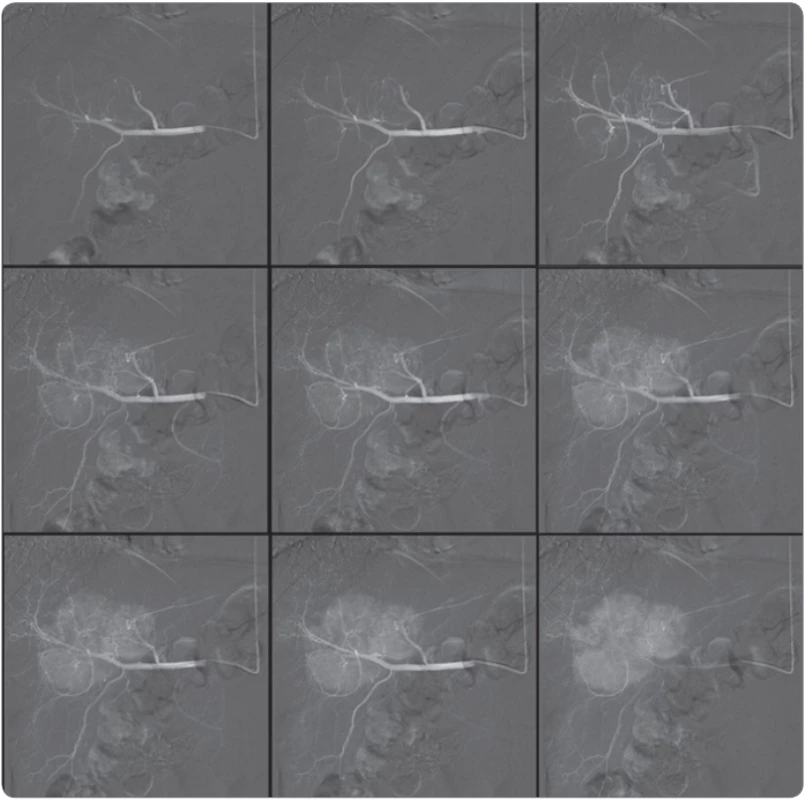
Obr. 6B. Selektivní arteriografi e hepatocelulárního karcinomu, stav po radioembolizaci (dolní řada). Nádorová tkáň zcela vymizela, je nahrazena nekrózou. 
Intervenční radiologie a terapie HCC
Biopsie
Biopsie u jaterních nádorů spočívá v odběru vzorku tkáně k histologickému vyšetření; odebírání vzorku tenkou jehlou na cytologii u HCC nemá jakýkoli smysl, není z něj možné diagnózu stanovit. Důležitou roli hraje především v diagnostice HCC. Perkutánní biopsii je možné provést pod CT či USG kontrolou. Výhodou USG je možnost navigace v reálném čase, což výkon výrazně urychluje. Pokud se ale patologická léze nachází v oblasti, která není ultrazvukem dobře zobrazitelná, používá se k navádění CT. K odběru dostatečného množství materiálu se používají „core-cut“ jehly. Výkon se provádí za sterilních podmínek v lokální anestezii. Nejprve je vyhledáno vhodné místo pro vpich bioptické jehly. Poté se provede dezinfekce kůže a sterilní zakrytí okolí místa výkonu. Po injekci lokálního anestetika se do patologického útvaru zavede bioptická jehla a získá se materiál, který je umístěn do fixačního roztoku nebo na sklíčko a je odeslán do patologické laboratoře. Po skončení výkonu se ještě provede kontrolní vyšetření k vyloučení komplikací. Při biopsii z jaterních ložisek volíme trajektorii vpichu tak, aby byla část tkáně normálního nebo relativně normálního vzhledu mezi povrchem jater a ložiskem podezřelým z HCC.
Lokální transhepatální ablace
Nejstarší metodou je přímá transhepatální aplikace absolutního alkoholu, tzv. alkoholizace; v současnosti se prakticky neprovádí a je nahrazena jinými lokálními destrukčními výkony. Termální ablace je metodou lokální léčby nádorů založenou na působení vysoké nebo nízké teploty. Existuje více technik termální ablace, z nichž nejčastěji je využívána radiofrekvenční ablace (RFA). Dalšími možnostmi jsou např. kryoablace (působení chladu), mikrovlnná a laserová ablace (působící teplem). RFA využívá vysokofrekvenční střídavý proud (350–500 kHz), který způsobí rozkmitání iontů a vznik frikčního (třecího) tepla. Ve tkáni se zvýší teplota na 55–100 °C, což má za následek vznik koagulační nekrózy. Radiofrekvenční energie se aplikuje pomocí elektrody zavedené přímo do nádorové tkáně HCC. Elektrody mají různé tvary – jehly, svazku jehel nebo deštníčku. Jsou zaváděny přes kůži pod kontrolou CT nebo USG. Zavedení se provádí stejným způsobem jako při biopsii. RFA se také využívá při laparoskopických a otevřených operačních výkonech, kdy je zaváděna pod kontrolou zraku a hmatu nebo pomocí peroperační USG. Optimální velikost ložisek pro RFA je do 3 cm, s větší velikostí účinnost metody klesá.
Transarteriální embolizační metody
Endovaskulární intervenční radiologické metody využívají okluze cévního řečiště nádoru buď za účelem kontroly krvácení z nádoru k jeho zastavení, nebo častěji za účelem paliativní léčby. U nemocných je možné provést transarteriální embolizaci cestou superselektivní katetrizace tepny přívodné k vlastnímu nádoru, zpravidla po předchozím superselektivním zavedení vodicího katétru do a. hepatica propria. U paliativní léčby HCC nestačí uzavření mikrovaskulárního řečiště a vyvolání ischemie použitím neaktivních mikročástic. Používají se proto speciální embolizační materiály uvolňující chemoterapeutikum – transarteriální chemoembolizace (TACE) nebo emitující záření beta-minus (nejčastěji 90-ytrium – 90Y) – transarteriální radioembolizace (TARE) [9–15].
Chemoembolizace je metoda léčby jaterních nádorů, kdy se na aplikované médium (mikročástice nebo lipiodol) naváže chemoterapeutikum – nejčastěji je používán doxorubicin u HCC na rozdíl od irinotekanu vhodného u metastáz kolorektálního karcinomu do jater. Při chemoembolizaci se tak kombinuje účinek ischemie a vysoké lokální dávky chemoterapeutika, tedy vysoce lokálně účinné chemoterapie. Chemoembolizační výkony se provádějí jako transarteriální chemoembolizace pomocí částic uvolňujících doxorubicin (např. DC Bead, Biocompatibles, Farnham, UK) o velikostech 100–300 µm. Jak již bylo výše uvedeno, je možné provést i prostou embolizaci jako kontrolu krvácení masivně krvácejícího HCC, pak lze embolizaci nádoru provést i směsí olejové kontrastní látky s n-butyl-2-kyanoakrylátem (Lipiodol, Guerbet, Paris, Francie / Histoacryl, B-Braun Medical, Melsungen, Německo).
Radioembolizace je metoda embolizace jaterních nádorů, kdy jsou podány katétrem do teritoria postiženého jaterním nádorem mikročástice s beta-minus zářičem 90Y. Léčebným účinkem je brachyterapeutické ozáření nádorové tkáně, nikoli ischemizace tkáně. Indikacemi může být kromě HCC také jaterní diseminace kolorektálního karcinomu. TARE využívá odlišnosti v perfuzi jaterní tkáně a perfuzi jaterních nádorů, transarteriální aplikace radioaktivního materiálu do nádorové tkáně umožňuje využití brachyterapeutického efektu radionuklidu s rozpadem typu beta minus. Výkon nazývaný radioembolizace je komplexní způsob léčby, který v sobě zahrnuje praktickou aplikaci všech současných postupů radiobiologie a zobrazovacích metod, jde o výkon mimořádně náročný na logistické, technologické i personální zabezpečení. První literární zmínky o užití u větší skupiny pacientů s HCC byly publikovány v roce 2002 [9–12] a v současnosti je jednou z alternativ léčby chirurgicky neléčitelného HCC, nicméně naráží na problémy úhrady terapie ze strany zdravotních pojišťoven, i když jeho včasné provedení má u lokálně neodstranitelných nádorů vynikající výsledky u lézí solitárních, někdy i s kurativním účinkem, u multifokálních nádorů je možné výkon opakovat.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
prof. MUDr. Jiří Ferda, Ph.D.
Klinika zobrazovacích metod LF UK a FN Plzeň
Alej Svobody 80
304 60 Plzeň-Lochotín
e-mail: ferda@fnplzen.cz
Obdrženo/Submitted: 1. 7. 2020
Sources
1. Murakami T, Kim T, Takamura M et al. Hypervascular hepatocellular carcinoma: detection with double arterial phase multi-detector row helical CT. Radiology 2001; 218 (3): 763–767. doi: 10.1148/radiology.218.3.r01mr39763.
2. Tajima T, Honda H, Taguchi K et al. Sequential hemodynamic changes in hepatocellular carcinoma and dysplastic nodules: CT angiography and pathologic correlation. Am J Roentgenol 2002; 178 (4): 552–554. doi: 10.2214/ajr.178.4.1780885.
3. Ferda J, Mírka H, Třeška V et al. Diagnostika hepatocelulárního karcinomu dvoufázovou výpočetní tomografií, porovnání přínosu dvouřadého a šestnáctiřadého výpočetního tomografu. Čes Radiol 2003; 57 : 319–324.
4. Delbeke D, Martin WH, Sandler MP et al. Evaluation of benign vs malignant hepatic lesions with positron emission tomography. Arch Surg 1998 : 133 (5): 510–515. doi: 10.1001/archsurg.133.5.510.
5. Khan MA, Combs CS, Brunt EM et al. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma. J Hepatol 2000; 32 (5): 792–797. doi: 10.1016/s0168-8278 (00) 80248-2.
6. Okazumi S, Isono K, Enomoto K et al. Evaluation of liver tumors with fluorine-18-fluorodeoxyglucose PET: characterisation of tumor and assessment of effect of treatment. J Nucl Med 1992; 33 (3): 333–339.
7. Lee JD, Yun M, Lee JM et al. Analysis of gene expression profiles of hepatocellular carcinomas with regard to 18F-fluorodeoxyglucose uptake pattern on positron emission tomography. Eur J Nucl Med Mol Imaging 2004; 31 (12): 1621–1630. doi: 10.1007/s00259-004-1602-1.
8. Talbot JN, Gutman F, Fartoux L et al. PET/CT in patiens with hepatocellular carcinoma using [18F] fluorocholine: preliminary comparison with [18F] FDG PET/CT. Eur J Nucl Med Mol Imaging 2006; 33 (11): 1285–1289. doi: 10.1007/s00259-006-0164-9.
9. Ferda J, Ferdová E, Baxa J et al. The role of 18F-FDG accumulation and arterial enhancement as biomarkers in the assessment of typing, grading and staging of hepatocellular carcinoma using 18F-FDG-PET/CT with integrated dual-phase CT angiography. Anticancer Res 2015; 35 (4): 2241–2246.
10. Mirka H, Duras P, Baxa J et al. Contribution of computed tomographic angiography to pretreatment planning of radio-embolization of liver tumors. Anticancer Res 2018; 38 (7): 3825–3829. doi: 10.21873/anticanres.12666.
11. Liu DM, Salem R, Bui JT et al. Angiographic considerations in patients undergoing liver-directed therapy. J Vasc Interv Radiol 2005; 16 (7): 911–935. doi: 10.1097/01.RVI.0000164324.79242.B2.
12. Salem R, Thurston KG, Carr BI et al. Yttrium-90 microspheres: radiation therapy for unresectable liver cancer. J Vasc Interv Radiol 2002; 13 (9 Pt 2): S223–S224.
13. Coldwell D, Sangro B, Wasan H et al. General selection criteria of patients for radioembolization of liver tumors: an international working group report. Am J Clin Oncol 2011; 34 (3): 337–341. doi: 10.1097/COC.0b013e3181ec61bb.
14. Maleux G, Heye S, Vaninbroukx J et al. Angiographic considerations in patients undergoing liver-directed radioembolization with 90Y microspheres. Acta Gastroenterol Belg 2010; 73 (4): 489–496.
15. Dezarn WA, Cessna JT, DeWerd LA et al. Recommendations of the American Association of Physicists in Medicine on dosimetry, imaging, and quality assurance procedures for 90Y microsphere brachytherapy in the treatment of hepatic malignancies. Med Phys 2011; 38 (8): 4824–4845. doi: 10.1118/1.3608909.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue Supplementum 3-
All articles in this issue
- Editorial
- Hepatocellular carcinoma – imaging methods and imaging guided therapy
- Hepatocellular carcinoma from the view of a transplant surgeon
- Current treatment options for hepatocellular carcinoma
- Hepatocellular carcinoma future treatment options
- Surgical treatment of hepatocellular carcinoma
- Hepatocellular carcinoma from the view of gastroenterologist/hepatologist
- Shrnutí
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hepatocellular carcinoma future treatment options
- Current treatment options for hepatocellular carcinoma
- Hepatocellular carcinoma – imaging methods and imaging guided therapy
- Hepatocellular carcinoma from the view of gastroenterologist/hepatologist
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

