-
Medical journals
- Career
Prognostické faktory přežití u pacientů s hepatocelulárním karcinomem léčených pomocí transarteriální chemoembolizace
Authors: Tomáš Rohan 1; Michal Uher 2; Peter Matkulčík 1; Jan Zavadil 1; Lenka Ostřížková 3; Igor Kiss 4; Tomáš Andrašina 1; Vlastimil Válek 1
Authors‘ workplace: Klinika radiologie a nukleární medicíny LF MU a FN Brno2 Institut biostatistiky a analýz, LF MU Brno 1; Interní hematologická a onkologická klinika FN Brno4 Masarykův onkologický ústav, Brno 3
Published in: Klin Onkol 2020; 33(3): 214-219
Category: Original Articles
doi: https://doi.org/10.14735/amko2020214Overview
Cíle: Identifikace prognostických faktorů přežití hepatocelulárních karcinomů (HCC) léčených transarteriální chemoembolizací (TACE) v komplexním onkologickém centru v letech 2005–2018.
Východiska: Transarteriální chemoembolizace je u hepatocelulárního karcinomu indikována ve stadiu B dle Barcelona Liver Cancer Clinic (BLCC). Toto stadium nicméně zahrnuje velmi rozsáhlou skupinu pacientů nevhodných pro kurativní výkon, kteří jsou v dobrém klinickém stavu a není u nich přítomné mimojaterní postižení. Cílem této retrospektivní analýzy je identifikovat faktory ovlivňující přežití pacientů a na základě těchto rizikových faktorů pacienty dle prognózy stratifikovat do podskupin.
Materiály a metody: Do retrospektivní analýzy byli zařazeni všichni pacienti s HCC indikovaní k TACE, kteří prošli onkologickou indikační komisí komplexního onkologického centra v letech 2005–2018. Hodnoceno bylo celkové přežití od 1. výkonu TACE, v rámci jedno - a vícerozměrných analýz byly zkoumanými faktory přežití: rozsah primárního tumoru v době indikace TACE (velikost ložiska, jedno/více ložisek, uni/bilobární postižení), přítomnost a etiologie cirhózy a závažnost jaterního onemocnění (dle Child-Pugh klasifikace), přítomnost komplikací nádorového onemocnění nebo cirhózy (trombóza portální žíly a její rozsah) a historie jiné invazivní léčby (resekce, perkutánní ablace). Sledováno bylo celkové přežití pacientů s HCC v závislosti na roce diagnózy a roce 1. TACE (log-rank test).
Výsledky: Z celkem 382 pacientů bylo 157 pacientů (29 žen) léčeno TACE (celkem 540 výkonů, medián 3 na pacienta). Nejvýznamnějším rizikovým faktorem přežití byla přítomnost trombózy portální žíly (poměr rizik – hazard ratio (HR) = 3,279), bilobární postižení (HR = 2,257), velikost ložiska (HR = 1,125/cm) a Child-Pugh B při chronickém onemocnění jater (HR = 1,922). Na základě těchto rizikových faktorů je možné pacienty stratifikovat do 3 prognostických skupin s významně odlišným mediánem přežití (52,1 vs. 21,5 vs. 9,0 měsíce).
Závěr: Na základě retrospektivní analýzy byly identifikovány prediktivní faktory celkového přežití u pacientů s HCC léčených TACE; na základě těchto faktorů lze pacienty stratifikovat do 3 odlišných prognostických skupin.
Klíčová slova:
hepatocelulární karcinom – transarteriální chemoembolizace – analýza přežití – rizikové faktory
Úvod
Hepatocelulární karcinom (HCC) je celosvětově nejrozšířenější primární maligní nádor jater. Ve většině případů se vyskytuje v terénu chronického onemocnění jater a i přes pokroky v léčbě je spojen s velmi špatnou prognózou. Pro staging se v Evropě nejčastěji využívá systém Barcelona Liver Cancer Clinic (BLCC), který zohledňuje celkový stav pacienta a funkci jater [1]. Na základě BLCC jsou pak pacienti s cirhózou rozdělení do kategorií 0 a A–D, pro které je doporučenými postupy stanoven vhodný typ léčby. Transarteriální chemoembolizace (TACE) je u HCC indikována v intermediálním stadiu B dle BLCC, které je definované jako 2–3 ložiska > 3 cm nebo vícečetná ložiska u pacientů s Child-Pugh A nebo B a s celkovým dobrým stavem (performance status dle Eastern Cooperative Oncology Group (ECOG) = 0) [1,2]. Japonská doporučení dále rozšiřují indikace k TACE na pacienty mladší 65 let s Child-Pugh C a nádorovým trombem 2. a 3. větve portální žíly [2,3].
Dle evropských (European Association for the Study of the Liver – EASL) a amerických doporučených postupů TACE nepřináší benefit pro pacienty u dekompenzované jaterní cirhózy (Child-Pugh ≥ B8) a u rozsáhlého tumorózního postižení obou laloků jater. Riziko jaterního selhání po výkonu výrazně zvyšuje trombóza portální žíly v segmentální úrovni; výkon není možné provést také v případech, kdy nastanou technické problémy při dosažení intraarteriálního přístupu [4]. Relativní kontraindikací je renální selhání, závažné kardiovaskulární komorbidity a neléčené jícnové varixy.
Rozhodující vliv na indikaci léčby HCC mají onkologické indikační komise jednotlivých komplexních onkologických center, které zohledňují nejen rozsah onemocnění, ale také individuální stav pacienta, jeho priority a technické možnosti onkologických center.
Cílem této retrospektivní analýzy je zjistit význam definovaných rizikových faktorů na přežití pacientů s HCC léčených TACE a stratifikace pacientů do skupin s odlišnou prognózou.
Materiály a metody
Do analýzy byli zařazeni všichni pacienti s HCC, kteří byli v letech 2005–2018 na základě rozhodnutí onkologické indikační komise komplexního onkologického centra léčeni TACE. Analyzováno bylo přežití od 1. výkonu TACE v závislosti na definovaných rizikových faktorech přítomných na zobrazovacích metodách v čase indikace TACE (multifázické CT nebo magnetická rezonance (magnetic resonance imaging – MRI)), v rámci retrospektivní analýzy vyhodnoceno dvěma operátory). Zaznamenána byla přítomnost jednoho/více ložisek, uni/bilobární postižení, velikost největšího ložiska (axiálně na postkontrastním CT/MRI), přítomnost a rozsah trombózy větví portální žíly. Ze zápisů onkologické indikační komise nebo nemocničního informačního systému byly získány informace o přítomnosti chronického jaterního onemocnění či cirhózy, o jejich etiologii a o stavu funkce jater (skóre Child-Pugh). Na základě výsledků přežití při definovaných rizikových faktorech byli pacienti stratifikováni do 3 skupin: s dobrou, střední a špatnou prognózou.
Dále bylo analyzováno přežití pacientů od 1. TACE v závislosti na přítomnosti chronického onemocnění jater.
Soubor byl dle roku zahájení TACE rozdělen na 2 přibližně stejné skupiny pacientů s cílem porovnat výsledky léčby v čase.
Ze statistických metod byla použita základní deskriptivní statistika, Kaplanova-Meierova metoda a log rank test k analýze přežití a Coxův regresní model ke stanovení relativního rizika jednotlivých prediktivních faktorů. U spojitých proměnných je uveden průměr (± směrodatná odchylka) a medián (dolní a horní kvartil) a významnost rozdílu je testována Mannovým-Whitneyho testem. U kategoriálních proměnných je uvedena absolutní a relativní četnost a p-hodnota významnosti Fisherova exaktního testu.
Výsledky
Do analýzy bylo zařazeno 157 pacientů léčených TACE z celkem 382 pacientů s HCC prezentovaných na onkologické indikační komisi v letech 2005–2018. Celkem bylo provedeno 540 TACE s mediánem 3 výkony na pacienta. Podrobnější charakteristiky pacientů jsou uvedeny v tab. 1.
Table 1. Základní charakteristiky pacientů s hepatocelulárním karcinomem. 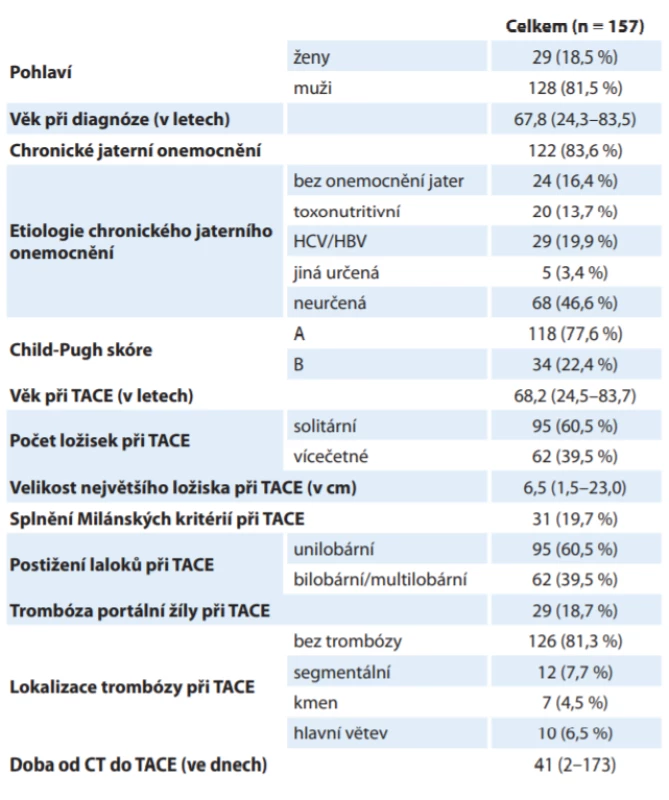
CT – výpočetní tomografi e, HBV – virus hepatitidy B, HCV – virus hepatitidy C, TACE – transarteriální chemoembolizace Analýza definovala hlavní rizikové faktory přežití pacientů s HCC léčených TACE: chronické jaterní onemocnění kategorie Child-Pugh B (HR = 1,922 ve vícerozměrném modelu očištěném o vlivy jiných rizikových faktorů, p = 0,013), bilobární postižení (HR = 2,257; p < 0,001), velikost největšího ložiska v cm (HR = 1,125 při nárůstu o 1 cm; p < 0,001) a přítomnost trombózy kmene nebo hlavních větví portální žíly (HR 3,279; p < 0,001). Při zohlednění všech definovaných rizikových faktorů nebyl rok 1. TACE signifikantní z hlediska přežití (p = 0,076). Přehled rizikových faktorů a relativního rizika je shrnut v tab. 2.
Table 2. Sledované rizikové faktory a jejich relativní rizika. 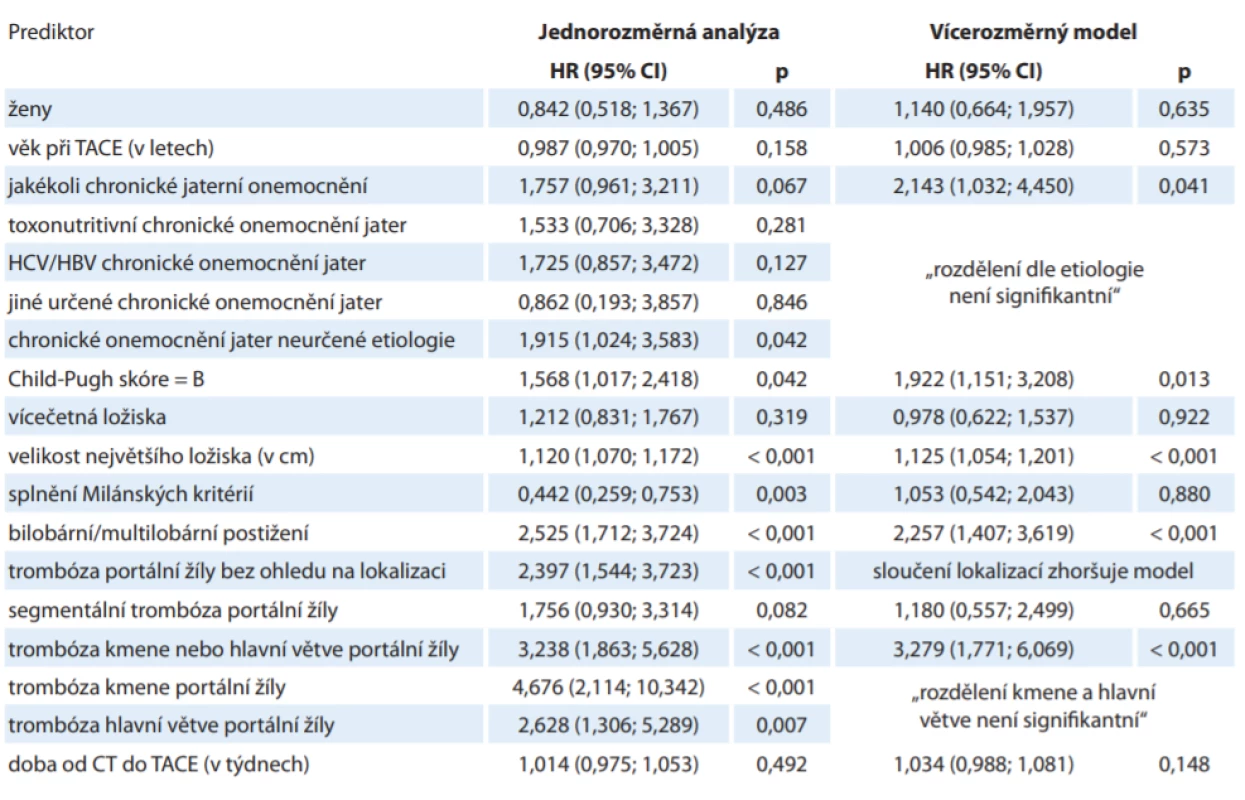
CT – výpočetní tomografi e, HBV – virus hepatitidy B, HCV – virus hepatitidy C, HR – poměr rizik, CI – interval spolehlivosti, TACE – transarteriální chemoembolizace Nebyl pozorován signifikantní rozdíl v přežití v závislosti na etiologii chronického onemocnění jater. Relativní nízký poměr rizik (HR = 1,180) byl pozorován při trombóze segmentálních větví portální žíly.
Pacienti byli v závislosti na přítomnosti definovaných rizikových faktorů a prognóze stratifikováni do 3 skupin. Dobrou prognózu měli pacienti s unilobárním postižením s největším ložiskem < 7 cm, bez trombózy kmene či hlavních větví portální žíly a s dobrou jaterní funkcí (Child-Pugh A); medián přežití u této skupiny (n = 41) byl 52,1 měsíce. Průměrnou prognózu měli pacienti s alespoň jedním z definovaných rizikových faktorů (tj. bilobární postižení nebo trombóza kmene či hlavních větví portální žíly nebo velikost největšího ložiska > 7 cm nebo Child-Pugh B). Medián přežití u této skupiny (n = 81) byl 21,5 měsíce. Špatnou prognózu (medián 9 měsíců) měli pacienti s více než jedním z definovaných rizikových faktorů, přičemž dolní hranicí pro velikost ložiska bylo 12 cm (tab. 2, schéma 1).
Schéma 1. Stratifikace pacientů s HCC léčených TACE do 3 prognostických skupin na základě rizikových faktorů. 
HCC – hepatocelulární karcinom, HR – poměr rizik, CI – interval spolehlivosti, TACE – transarteriální chemoembolizace Pacienti se známým chronickým onemocněním jater nebo cirhózou neznámé etiologie dosahovali nesignifikantně kratšího přežití než bez něj (20,0 vs. 35,3 měsíce; p = 0,078), přestože měli v době diagnózy menší ložiska (medián 6,0 vs. 9,5 cm; p = 0,009). Rozdíly mezi ostatními sledovanými charakteristikami nebyly signifikantní (graf 1).
Graph 1. Kaplanova-Meierova křivka přežití HCC léčených TACE u pacientů s chronickým onemocněním jater a bez něj 
HCC – hepatocelulární karcinom, TACE – transarteriální chemoembolizace Na základě roku výkonu 1. TACE byli pacienti rozděleni na 2 skupiny: A) před rokem 2015 (n = 85) a B) v letech 2015–2018 (n = 72), přičemž počty perkutánních ablací (p = 0,830) a resekcí ložisek (p = 0,574) se u obou skupin signifikantně nelišily. Medián přežití od 1. TACE byl celkově 21,1 měsíce, přičemž před rokem 2015 to bylo 17,1 měsíce a od roku 2015 pak 43,1 měsíce (p < 0,001). Medián přežití od diagnózy HCC byl celkem 29,7 měsíce, před rokem 2015 23,4 měsíce a od roku 2015 43,8 měsíce (p < 0,001). Pacienti v letech 2015–2018 byli signifikantně starší (medián 70,4 vs. 64,3 roku; p < 0,001), ale měli signifikantně menší ložiska (medián 5,5 cm vs. 7,0 cm; p = 0,005), méně častou přítomnost chronického jaterního onemocnění (71,2 % vs. 93,8 %; p < 0,001) a menší počet trombózy portální žíly (6,9 vs. 28,9 %; p < 0,001) (graf 2).
Graph 2. Kaplanova-Meierova křivka přežití pacientů od 1. TACE před a po roce 2015. 
TACE – transarteriální chemoembolizace Diskuze
V analýze byl prokázán velký vliv selekce pacientů na prognózu léčby HCC transarteriální chemoembolizací, které odpovídal nárůst mediánu přežití od roku 2015 na 43,1 měsíce oproti předchozím 17,1 měsíce. V souladu s dostupnými studiemi byla jedním z nejvýznamnějších rizikových faktorů velikost největšího ložiska. V recentní čínské multicentrické studii jsou místo hodnot 7 a 12 cm doporučeny hodnoty 6 a 12 cm [5], naopak HAP skóre (Hepatoma Arterial Embolisation Prognostic Score) kombinující zobrazovací a laboratorní metody udává jako prognosticky významnou hranici velikosti HCC 7 cm [6,7]. V této analýze, na rozdíl od dostupných studií, není uvažován počet ložisek, ale uni/bilobární postižení jater, které více zohledňuje i technické možnosti selektivní či neselektivní transarteriální chemoembolizace. Transarteriální chemoembolizaci lze u jednoho či několika málo ložisek provést selektivně až superselektivně cestou přívodné tepny, naopak u víceložiskového postižení se obvykle provádí neselektivně do pravé nebo levé jaterní tepny (obvykle pouze jedna strana v jednom sezení pro riziko selhání jater). S rostoucí velikostí ložiska je spojená častější přítomnost A-V zkratů (snižují účinnost embolizace), rostoucí embolizovaný objem (vede k relativně nižší koncentraci doxorubicinu), vyšší četnost satelitních ložisek a častější trombózy portální žíly.
Analýza potvrdila velký prognostický význam trombózy portální žíly a jejich větví, podobně jako studie dostupné v literatuře [8]. V souladu s rozsáhlou japonskou studií bylo i v našem souboru pozorováno klesající riziko s perifernější trombózou větví portální žíly [9]. Lze tedy uplatnit pravidlo, že čím je trombóza portální žíly periferněji, tím je negativní vliv na prognózu menší.
Pozitivním jevem je prodlužující se přežití v letech 2015–2018, které je dané lepší selekcí pacientů, pravděpodobně z důvodu časnějšího záchytu onemocnění a zpřesnění indikací onkologické indikační komise (pacienti s rozsáhlým onemocněním jsou směřováni rovnou k biologické léčbě). Daří se tak naplňovat doporučení EASL, která v roce 2012 předpokládala přežití pacientů léčených TACE 20 měsíců a v roce 2018 již 30 měsíců [1,10].
V souvislosti s lepším přežitím v letech 2015–2018 je překvapivý fakt, že pacienti v této skupině byli signifikantně starší (medián 70,4 vs. 64,3; p < 0,001). To může být způsobeno důslednější selekcí perspektivních pacientů v dobrém biologickém stavu a jejich směřováním do komplexních onkologických center. Dále hraje roli i zavedení rutinního použití cone-beam CT na našem pracovišti v roce 2016. Cone-beam CT s vysokou citlivostí zachytí i drobná ložiska HCC, která je možné embolizovat, a vede tak k lepšímu celkovému přežití a doby do progrese [11]. Na prodloužení přežití má pravděpodobně vliv také lepší dostupnost systémové léčby po selhání TACE.
Limitací studie je nehomogenní soubor zahrnující pacienty s chronickým onemocněním jater i bez něj. Vlastní význam TACE v léčbě HCC by lépe znázornil údaj doby do progrese onemocnění než celkové přežití pacientů; pro nedostatek dat tato analýza ale nebyla provedena. Soubor je dále limitován na jedno komplexní onkologické centrum, a výsledky tak nelze bez výhrad aplikovat na ostatní komplexní onkologická centra v ČR. Data o přežití pacientů s HCC léčených TACE za roky 2010–2016 neprokázala statisticky významné rozdíly v přežití jednotlivých regionů ČR v závislosti na frekvenci prováděné radiologické intervenční léčby [12]. Nicméně pro významné prodloužení přežití v letech 2015–2018 bude nutné tato data aktualizovat. Komorbidity a předčasná úmrtí z jiných příčin nebyly v analýze rovněž respektovány.
Dále nebyly ve studii brány v úvahu odlišné typy embolizačních částic, protože dle dostupné literatury nebyl prokázán jejich vliv na přežití pacientů s HCC léčených TACE [1].
Závěr
Na základě retrospektivní analýzy byly identifikovány prognostické faktory přežití HCC po TACE a pacienti byli na základě těchto faktorů rozděleni do 3 prognostických skupin. Nejlepší prognózu měli pacienti s dobrou jaterní funkcí (Child-Pugh A), bez trombózy větví portální žíly, s unilobárním postižením a velikostí největšího ložiska do 7 cm. U této prognostické skupiny lze dosáhnout mediánu přežití více než 50 měsíců. I přes přítomnost jednoho definovaného rizikového faktoru lze dosáhnout mediánu přežití téměř 2 roky (21,5 měsíce). Je otázkou, zda TACE přináší benefit pacientům s velkými ložisky HCC s více rizikovými faktory (medián přežití 9 měsíců).
Tato publikace vznikla na Masarykově univerzitě v rámci projektů „Význam radiologických intervencí a pokročilých zobrazovacích metod v diagnostice a léčbě onkologických pacientů“ (MUNI/A/1488/2019) podpořených z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2019. Dále podpořeno MZ ČR – RVO (FNBr, 65269705). Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
This publication was created at Masaryk University in the framework of the projects „Importance of radiologic interventions and advanced imaging methods in the diagnostics and therapy of oncologic patients“ ((MUNI/A/1488/2019) fi nanced from the funds of specifi c grants supporting university research and provided by the Ministry of Education, Youth and Sports in 2019. Further supported by the Ministry of Health of the Czech Republic – funds for Development of Research Organisation (FNBr, 65269705). The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Tomáš Rohan
Klinika radiologie a nukleární medicíny LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: rohan.tomas@fnbrno.cz
Obdrženo/Submitted: 7. 1. 2020
Přijato/Accepted: 2. 2. 2020
Sources
1. Galle PR, Forner A, Llovet JM et al. EASL clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69 (1): 182–236. doi: 10.1016/j.jhep.2018.03.019.
2. Horikawa M, Miyayama S, Irie T et al. Development of conventional transarterial chemoembolization for hepatocellular carcinomas in japan: historical, strategic, and technical review. Am J Roentgenol 2015; 205 (4): 764–773. doi: 10.2214/AJR.15.14825.
3. Kudo M. Management of hepatocellular carcinoma in Japan as a world-leading model. Liver Cancer 2018; 7 (2): 134–47. doi: 10.1159/000484619.
4. Facciorusso A. Drug-eluting beads transarterial chemoembolization for hepatocellular carcinoma: Current state of the art. World J Gastroenterol 2018; 24 (2): 161–169. doi: 10.3748/wjg.v24.i2.161.
5. Wang Q, Xia D, Bai W et al. Development of a prognostic score for recommended TACE candidates with hepatocellular carcinoma: A multicentre observational study. J Hepatol. 2019; 70 (5): 893–903. doi: 10.1016/j.jhep.2019.01.013.
6. Sieghart W, Hucke F, Peck-Radosavljevic M. Transarterial chemoembolization: Modalities, indication, and patient selection. J Hepatol 2015; 62 (5): 1187–1195. doi: 10.1016/j.jhep.2015.02.010.
7. Kadalayil L, Benini R, Pallan L et al. A simple prognostic scoring system for patients receiving transarterial embolisation for hepatocellular cancer. Ann Oncol 2013; 24 (10): 2565–2570. doi: 10.1093/annonc/mdt247.
8. Raoul JL, Forner A, Bolondi L et al. Updated use of TACE for hepatocellular carcinoma treatment: How and when to use it based on clinical evidence. Cancer Treat Rev 2019; 72 : 28–36. doi: 10.1016/j.ctrv.2018.11.002.
9. Katagiri S, Yamamoto M. Multidisciplinary treatments for hepatocellular carcinoma with major portal vein tumor thrombus. Surg Today 2014; 44 (2): 219–226. doi: 10.1007/s00595-013-0585-6.
10. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. [online]. Available from https: //www.journal-of-hepatology.eu/article/S0168-8278 (11) 00873-7/fulltext.
11. Iwazawa J, Ohue S, Hashimoto N et al. Survival after C-arm CT-assisted chemoembolization of unresectable hepatocellular carcinoma. Eur J Radiol 2012; 81 (12): 3985–3992. doi: 10.1016/j.ejrad.2012.08.012.
12. Rohan T, Andrašina T, Uher M et al. Chemoembolization for treatment of hepatocellular carcinoma – national registry-based analysis. Klin Onkol 2019; 32 (Suppl 1): S160–S163.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 3-
All articles in this issue
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Súčasné možnosti včasného záchytu kardiotoxicity cytostatickej liečby
- Prognostické faktory přežití u pacientů s hepatocelulárním karcinomem léčených pomocí transarteriální chemoembolizace
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Dlouhodobý efekt erlotinibu u pacienta s nemalobuněčným karcinomem plic ve 3. linii protinádorové léčby – kazuistika
- Terapie trifluridinem/tipiracilem a regorafenibem u pacientů s předléčeným metastatickým kolorektálním karcinomem – zkušenosti z České republiky
- Editorial
- Aktuality z odborného tisku
- Predstavujeme nové knihy
- Oncology in pictures
- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Vztah mezi polymorfismem XPG rs17655G>C a XPF rs1799801T>C a náchylností k malignímu melanomu kůže: důkazy ze studie případů a kontrol, systematický přehled a metaanalýza
- Vztah profilu exprese genu FOXR2 a markerů epitelo-mezenchymální tranzice u epiteliálního karcinomu vaječníků
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

