-
Medical journals
- Career
Dlouhodobý efekt erlotinibu u pacienta s nemalobuněčným karcinomem plic ve 3. linii protinádorové léčby – kazuistika
Authors: Nela Šťastná; Lenka Jakubíková; doc. MUDr. Kristián Brat, Ph.D.
Authors‘ workplace: Klinika nemocí plicních a tuberkulózy LF MU a FN Brno
Published in: Klin Onkol 2020; 33(3): 226-229
Category: Case Report
doi: https://doi.org/10.14735/amko2020226Overview
Východiska: Maligní tumory trachey, plic a bronchů jsou druhým nejčastějším typem novotvarů v České republice. Přibližně tři čtvrtiny případů jsou diagnostikovány v pokročilém stadiu (IIIB–IV) a ve skupině onkologických onemocnění jsou jednou z nejčastějších příčin úmrtí. Určité zlepšení prognostického výhledu přináší cílená onkologická léčba. Tyrozinkinázové inhibitory 1. a 2. generace (gefitinib, erlotinib, afatinib) jsou v České republice indikovány v 1. linii protinádorové léčby u pacientů s nemalobuněčným plicním karcinomem ve stadiu lokálně pokročilém a metastazujícím, s prokázanými aktivačními mutacemi genu pro receptor epidermálního růstového faktoru. Erlotinib je navíc indikován k léčbě ve 2. a 3. linii protinádorové léčby, po zdokumentovaném selhání předchozí chemoterapie.
Případ: Prezentujeme kazuistiku 70letého pacienta s adenokarcinomem plic a senzitivní mutací v exonu 19 genu pro receptor epidermálního růstového faktoru, v klinickém stadiu IV (dle 7. vydání TNM klasifikace), která demonstruje dlouhodobou stabilizaci nádoru u pacientů na terapii erlotinibem po selhání léčby gefitinibem v 1. linii léčby a chemoterapie (karboplatina-bevacizumab-paklitaxel) ve 2. linii. Stabilizace onemocnění při léčbě erlotinibem trvá již 48 měsíců i přesto, že pro nežádoucí účinky (vyrážka na obličeji) byla dávka erlotinibu snížena na 100 mg/den.
Závěr: Zatímco účinnost gefitinibu v této kazuistice byla srovnatelná s výsledky klinických hodnocení, tak z užívání erlotinibu pacient profituje již zhruba v 5násobném časovém intervalu, než je doba do progrese pozorovaná v klinických studiích. Zajímavý je i značný rozdíl v účinku těchto dvou tyrozinkinázových inhibitorů, které doposud v klinických hodnoceních vykazovaly srovnatelnou účinnost.
Klíčová slova:
adenokarcinom plic – cílená léčba – erlotinib – gefitinib – tyrozinkinázové inhibitory
Úvod
Maligní tumory plic jsou jedny z nejčastějších typů zhoubných nádorů v dospělé populaci. Ve vyspělých zemích jsou podle International Agency for Research on Cancer v roce 2018 nádory plic, bronchů a trachey nejčastější příčinou úmrtí ze všech nádorových onemocnění [1]. Relativní 5leté přežití těchto typů nádorů se pohybuje pod 10 % [2]. Dle statistik Ústavu zdravotnických informací a statistiky ČR za rok 2017 byla incidence všech typů karcinomů plic a bronchů 62,3/100 000 obyvatel, mortalita byla 53,2/100 000. Tyto hodnoty stagnují v období posledních 10 let [3]. Zatímco u mužů má incidence tendenci k poklesu, u ženského pohlaví v čase výrazně roste. Incidence karcinomu plic v ČR je 13. nejvyšší na celém světě [3].
Histologicky jsou bronchogenní nádory nejčastěji epiteliálního původu (karcinomy). Pro jejich biologicky odlišné vlastnosti je zásadní dělení na nádory malobuněčné (small-cell lung cancer – SCLC; 20–25 %) a nemalobuněčné (non-small-cell lung cancer – NSCLC; 75–80 %). NSCLC obecně rostou pomaleji, metastazují později, ale také jsou rezistentnější k chemoterapii a radioterapii.
Do cílené léčby (biologická léčba) NSCLC spadají monoklonální protilátky a inhibitory tyrozinkináz (tyrosine kinase inhibitors – TKI). TKI jsou malé molekuly, které se vážou na intracelulární tyrozinkinázovou doménu receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR). Tím zabraňují přenosu signálu, který je zodpovědný za regulaci buněčné proliferace, diferenciace a apoptózy. EGFR se vyskytují na povrchu respiračního epitelu, epiteliálních buněk kůže a sliznice zažívacího traktu, z čehož vyplývají možné nežádoucí účinky (exantém a průjmy). Za zvýšenou aktivaci EGFR jsou zodpovědné tzv. aktivační mutace v genu pro EGFR (nejčastěji delece v exonu 19 a inzerce L858R v exonu 21). Na léčbu TKI může vznikat rezistence, za kterou je nejčastěji zodpovědná získaná mutace T790M v exonu 20. Mutace v genech pro EGFR jsou častější v asijské populaci pacientů s NSCLC, u žen, nekuřáků a u pacientů s adenokarcinomem [4].
Znalost mutačního stavu EGFR je v dnešní době stěžejní pro zahájení adekvátní léčby 1. linie u pacientů s histologickým typem adenokarcinomu, velkobuněčného karcinomu a nespecifikovaného typu. Pokud je prokázána přítomnost aktivační mutace genu pro EGFR, je indikována léčba TKI v 1. linii protinádorové léčby. Jejich současné podávání s chemoterapií není indikováno. Pokud u pacientů dojde k progresi onemocnění, je při prokázání mutace T790M možno podávat preparát osimertinib. Erlotinib lze též podávat ve 2. a vyšší linii u pacientů s pokročilým NSCLC po selhání předchozí terapie. Základem chemoterapie u pacientů bez aktivačních mutací je platinový derivát v kombinaci s cytostatikem 3. generace – vinorelbin, gemcitabin, paklitaxel, docetaxel, pemetrexed.
Kazuistika
Sedmdesátiletý muž, celoživotní nekuřák, s dosud němou plicní anamnézou a bez interních komorbidit byl došetřován pro náhodný nález pravostranného fluidothoraxu (obr. 1). Dušnost pacient pozoroval pouze při větší fyzické námaze. Na našem pracovišti byla v září 2014 2× provedena pleurální punkce bakteriálně sterilní tekutiny, biochemicky charakteru exsudátu. Cytologicky byly prokázány buňky adenokarcinomu s aktivační mutací v genu pro EGFR v exonu 19. Dle vyšetření výpočetní tomografií (computed tomography – CT) hrudníku byl popsán cárovitý tumor nepravidelného tvaru v segmentech 7, 9 a 10 pravé plíce s vícečetnými kalcifikacemi a lymfadenopatií v oblasti pravého plicního hilu. Dále byl přítomen masivní pravostranný fluidothorax a ložisko pravé nadledviny nejasné biologické povahy. Nález byl zhodnocen jako nádorové postižení – adenokarcinom dolního laloku pravé plíce s maligním pleurálním výpotkem a suspektní metastázou v pravé nadledvině, dle 7. vydání TNM klasifikace T3N1M1a, klinické stadium IV. Bronchoskopicky nebyl prokázán žádný patologický endobronchiální nález. Sérové hladiny nádorových markerů byly v normě. Performance status pacienta byl 0, proto byla v listopadu 2014 zahájena 1. linie protinádorové léčby gefitinibem v dávce 250 mg/den. Léčba byla komplikována exantémem obličeje nízkého stupně závažnosti. Na kontrolním CT hrudníku za 6 měsíců od zahájení léčby byla popsána jednoznačná progrese velikosti nádorové infiltrace pravé plíce a také progrese velikosti ložiska pravé nadledviny. V květnu 2015 proto byla zahájena léčba 2. linie protinádorové léčby v kombinaci karboplatina AUC5 (425 mg intravenózně (i. v.)) + bevacizumab 7,5 mg/kg tělesné hmotnosti (600 mg i. v.) + paklitaxel 175 mg/m² (330 mg i. v.). Performance status pacienta byl i nadále 0. Po čtyřech cyklech chemoterapie však byla na kontrolním CT hrudníku popsána opětovná progrese fluidothoraxu, velikosti nádorové infiltrace a lymfatických uzlin (obr. 2). Byly odebrány biologické vzorky, přítomnost rezistentní mutace T790M ale nebyla prokázána. V září 2015 proto byla zahájena terapie erlotinibem v dávce 150 mg/den. Pro pustulózní exantém obličeje stupně 3 byla dávka erlotinibu snížena na 100 mg/den, po 5 měsících byla vyrážka již pouze stupně 1 a po 1 roce užívání byl nemocný kompletně bez vyrážky či jiných nežádoucích účinků. Průběžná kontrolní CT hrudníku prokazují trvající efekt léčby charakteru stabilní nemoci (obr. 3), proto bylo pokračováno ve stejné terapii. V září 2019 (po 4 letech léčby erlotinibem) je pacient nadále v dobré kondici a léčbu toleruje velmi dobře.
Image 1. Vstupní skiagram hrudníku před zahájením léčby. 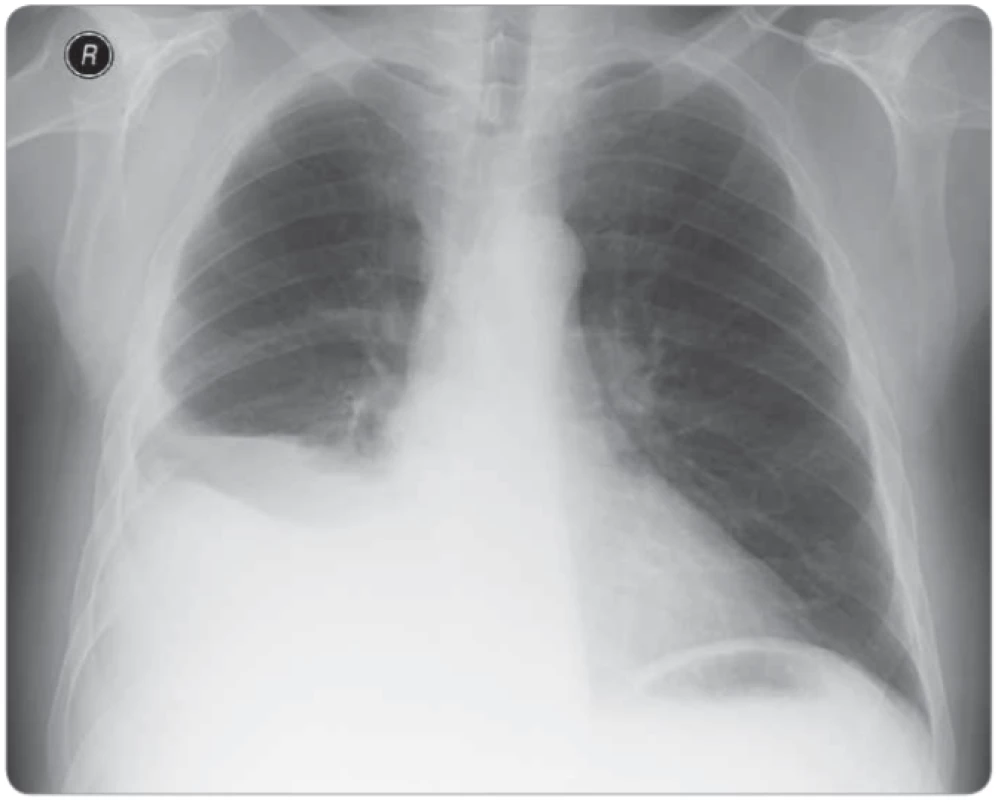
Image 2. CT hrudníku po selhání 2. linie léčby s velikostní progresí tumoru, lymfatických uzlin i množství pleurálního výpotku. 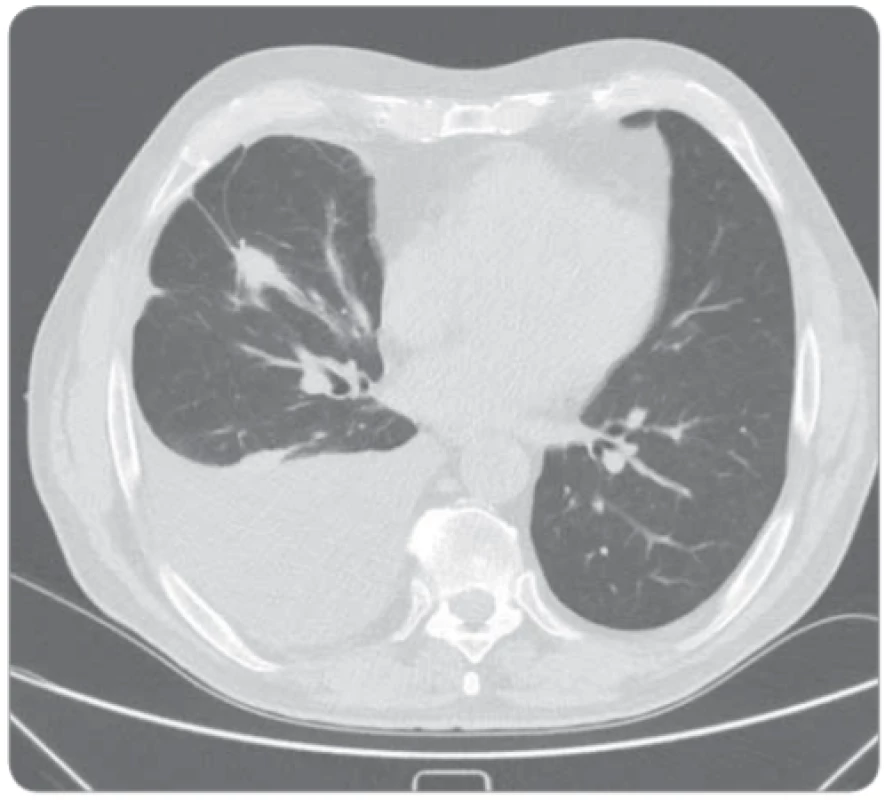
Image 3. CT hrudníku po 4 letech trvání léčby erlotinibem, bez progrese velikosti tumorózní infiltrace a bez nových metastatických ložisek 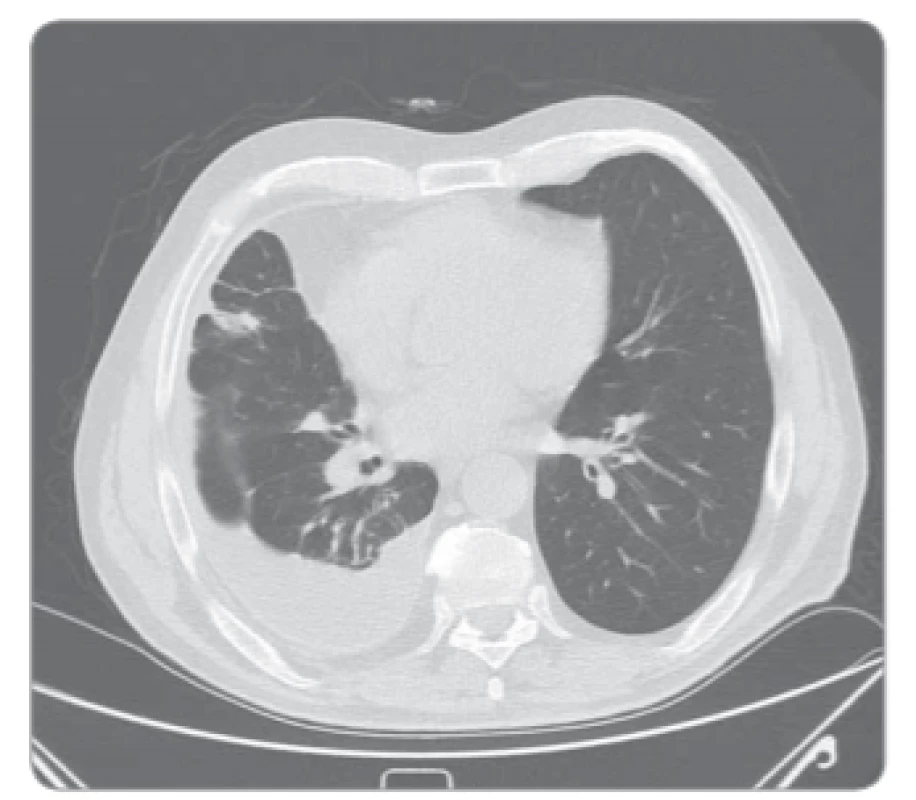
Diskuze
Gefitinib byl prvním lékem schváleným Úřadem pro kontrolu potravin a léčiv Spojených států amerických k léčbě NSCLC ze skupiny TKI [5]. Schválen byl na základě asijské studie IPASS, kde byla účinnost přípravku srovnávána s chemoterapií v kombinaci karboplatina/paklitaxel [6]. Dvanáctiměsíčního období doby do progrese (progression-free survival – PFS) ve skupině dosáhlo 24,9 % pacientů, ve skupině s chemoterapií pouze 6,7 % [6]. Při rozdělení pacientů na základě EGFR statusu bylo zjištěno, že z gefitinibu signifikantně profitovala skupina pacientů s průkazem aktivační mutace genu pro EGFR, co se PFS a objektivní léčebné odpovědi (objective response rate – ORR) týče (ORR 71,2 vs. 47,3 %) [6].
Naproti tomu ve studii EURTAC [7] byl prokázán léčebný přínos erlotinibu ve všech skupinách pacientů s adenokarcinomem, bez ohledu na jejich mutační status. V této studii provedené výhradně na vzorku evropské populace byl srovnáván efekt erlotinibu se standardní chemoterapií s platinovým dubletem (cisplatina/docetaxel nebo gemcitabin, event. karboplatina) v 1. linii protinádorové léčby. Primárním endpointem studie byla rovněž PFS. V rameni s erlotinibem bylo dosaženo mediánu 9,7 měsíce, v rameni s chemoterapií pouze 5,2 měsíce (HR 0,37; p < 0,0001).
Tyto studie prokazovaly účinnost TKI vůči cytostatickým režimům. Méně studií se však zabývalo srovnáváním jednotlivých TKI mezi sebou. Jednou z nich byla korejská studie z roku 2014 porovnávající účinnost terapie gefitinibem v dávce 250 mg/den a erlotinibem v dávce 150 mg/den v 1. linii léčby u 242 EGFR pozitivních pacientů s NSCLC [8]. Ve studii byla pozorována srovnatelná léčebná odpověď jak pro gefitinib i erlotinib (ORR 76,9 vs. 74,4 %; p = 0,575), tak pro PFS (medián 11,7 vs. 9,6 měsíce; p = 0,056). Při rozdělení pacientů podle linie léčby rovněž nebyly zjištěny signifikantní rozdíly. V 1. linii léčby gefitinibu vs. erlotinibu byla délka PFS 11,7 vs. 14,5 měsíce (p = 0,507), celkové přežití (overall survival – OS) v případě gefitinibu bylo 24,5 měsíce, OS skupiny s erlotinibem nebyl v době ukončení studie dosažen. V 2. nebo vyšší linii léčby byl PFS 13,1 měsíce pro gefitinib, 10,1 měsíce pro erlotinib (p = 0,082). Statisticky nevýznamný rozdíl délky PFS prokázal srovnatelnou klinickou účinnost gefitinibu a erlotinibu.
Rozdílný výsledek nepřinesla ani recentní studie kolektivu Yang et al z roku 2017 provedená na srovnatelné kohortě nemocných [9]. TKI (gefitinib 250 mg/den vs. erlotinib 150 mg/den) pouze v 1. linii léčby prokázal medián PFS 10,4 vs. 13,0 měsíce. Obdobně statisticky nesignifikantní byl OS rozdíl 20,1 vs. 22,9 měsíce a taktéž ORR. Signifikantní rozdíl byl však nalezen v podskupině s mutací v exonu 19, kde ORR dosáhlo 62,2 vs. 43,5 % (p = 0,003) ve srovnání s mutací v exonu 21 u pacientů léčených gefitinibem či erlotinibem.
Porovnání účinku zmíněných dvou zástupců TKI v 2. linii po selhání chemoterapie hodnotila další korejská studie kolektivu Kim et al [4]. Výsledky byly opět statisticky nesignifikantní, tentokrát však lehce favorizovaly gefitinib (ORR 47,9 vs. 39,6 %; p = 0,269; PFS 4,9 vs. 3,1 měsíce; p = 0,336). Výraznější léčebné odpovědi pacienti v obou ramenech dosáhli v případě, kdy se u nich vyskytla vyrážka, ve srovnání s pacienty bez exantému (ORR 55,4 vs. 19,4 %; p < 0,005).
Závěr
Ve studiích srovnávajících účinnost jednotlivých TKI 1. generace u pacientů s EGFR pozitivní mutací nebyla prokázána superiorita gefitinibu vůči erlotinibu. V popsané kazuistice však délka PFS onemocnění trvá již 48 měsíců při léčbě erlotinibem, a to i navzdory tomu, že pro nežádoucí účinky exantému byla dávka snížena na 100 mg/den.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Nela Šťastná
Klinika nemocí plicních a tuberkulózy FN Brno
Jihlavská 20
Brno 625 00
e-mail: stastna.nela@fnbrno.cz
Obdrženo/Submitted: 27. 10. 2019
Přijato/Accepted: 15. 1. 2020
Sources
1. Bray F, Ferlay J, Soerjomataram I et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68 (6): 394–424. doi: 10.3322/caac.21492.
2. Novotvary 2016 ČR. [online]. Dostupné z: https: //www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/novotvary.
3. Incidence a mortalita – vývoj v čase. [online]. Dostupné z: https: //www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/novotvary.
4. Kim ST, Uhm JE, Lee J et al. Randomized phase II study of gefitinib versus erlotinib in patients with advanced non-small cell lung cancer who failed previous chemotherapy. Lung Cancer 2012; 75 (1): 82–88. doi: 10.1016/j.lungcan.2011.05.022.
5. Cohen MH. FDA drug approval summary: Gefitinib (ZD1839) (Iressa (R)) tablets. Oncologist 2003; 8 (4): 303–306. doi: 10.1634/theoncologist.2010-0257.
6. Mok TS, Wu YL, Thongprasert S et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361 (10): 947–957. doi: 10.1056/NEJMoa0810699.
7. Rosell R, Carcereny E, Gervais R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC). A multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13 (3): 239–246. doi: 10.1016/S1470–2045 (11) 70393-X.
8. Lim SH, Lee JY, Sun JM et al. Comparison of clinical outcomes following gefitinib and erlotinib treatment in non-small-cell lung cancer patients harboring an epidermal growth factor receptor mutation in either exon 19 or 21. J Thorac Oncol 2014; 9 (4): 506–511. doi: 10.1097/JTO.0000000000000095.
9. Yang JJ, Zhou Q, Yan HH et al. A phase III randomised controlled trial of erlotinib vs gefitinib in advanced non--small cell lung cancer with EGFR mutations. Br J Cancer 2017; 116 (5): 568–574. doi: 10.1038/bjc.2016.456.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 3-
All articles in this issue
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Súčasné možnosti včasného záchytu kardiotoxicity cytostatickej liečby
- Prognostické faktory přežití u pacientů s hepatocelulárním karcinomem léčených pomocí transarteriální chemoembolizace
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Dlouhodobý efekt erlotinibu u pacienta s nemalobuněčným karcinomem plic ve 3. linii protinádorové léčby – kazuistika
- Terapie trifluridinem/tipiracilem a regorafenibem u pacientů s předléčeným metastatickým kolorektálním karcinomem – zkušenosti z České republiky
- Editorial
- Aktuality z odborného tisku
- Predstavujeme nové knihy
- Oncology in pictures
- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Vztah mezi polymorfismem XPG rs17655G>C a XPF rs1799801T>C a náchylností k malignímu melanomu kůže: důkazy ze studie případů a kontrol, systematický přehled a metaanalýza
- Vztah profilu exprese genu FOXR2 a markerů epitelo-mezenchymální tranzice u epiteliálního karcinomu vaječníků
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

