-
Medical journals
- Career
Management imunitně podmíněné endokrinopatie při protinádorové léčbě checkpoint inhibitory
Authors: R. Lakomý 1; A. Poprach 1; T. Kazda 2
Authors‘ workplace: Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno 1; Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno 2
Published in: Klin Onkol 2020; 33(1): 15-19
Category: Review
doi: https://doi.org/10.14735/amko202015Overview
Moderní imunoterapie s checkpoint inhibitory se stala základním pilířem v léčbě řady nádorů. Klinický efekt je často doprovázen imunitně podmíněnými vedlejšími účinky. Jedná se principiálně o zcela jiný typ nežádoucích účinků vycházející z vlastní podstaty léčby. S rostoucím počtem léčených pacientů přibývá i četnost vedlejších účinků. Situace se stává ještě složitější s příchodem kombinované imunoterapie. I když byla dobře popsána kinetika nástupu a trvání této specifické toxicity, je třeba dbát zvýšené opatrnosti. V klinické praxi se často objevují případy s atypickými průběhy. Neznalost problematiky pak může vést k podcenění příznaků a poškození pacienta. Imunitně podmíněné vedlejší účinky se vyznačují svojí variabilitou, postižen může být kterýkoliv orgán. Vedle kožní, střevní a jaterní toxicity je imunitně podmíněná endokrinopatie další poměrně frekventní toxicitou. Nejčastěji bývá postižena štítná žláza, hypofýza a nadledviny. Symptomy nastupující endokrinopatie bývají často nespecifické, což může dělat potíže při diferenciální diagnostice. Většina toxicit je naštěstí stupně 1 a 2, ale v běžné klinické praxi musíme být připraveni na život ohrožující stavy, jako je nadledvinová krize nebo diabetes mellitus I. typu s ketoacidózou. Podání vysokých dávek kortikoidů s cílem zachránit funkci endokrinní žlázy je sporné. Základem léčby je dlouhodobá hormonální substituce, protože imunitně podmíněné endokrinopatie jsou na rozdíl od jiných toxicit často nevratné. Důležitá je úzká spolupráce s endokrinologem.
Klíčová slova:
imunoterapie – léková toxicita – hypofyzitida – tyroiditida
Úvod
Endokrinní toxicita v souvislosti s moderní imunoterapií onkologických onemocnění často probíhá pod obrazem nespecifických potíží. Ve většině případů není závažná, nevyžaduje delší přerušení nebo ukončení léčby a je zvládnutelná hormonální substitucí. Jsou však situace, kdy pacient může být v ohrožení života. Mortalita je ve srovnání s jinými imunitně podmíněnými nežádoucími účinky naštěstí nízká (< 5 % všech endokrinopatií) [1]. Cílem příspěvku je poukázat na nejčastější typy endokrinní toxicity u moderní imunoterapie a shrnout základní doporučení z pohledu diagnostiky a léčby.
Kazuistika pacienta s imunitně podmíněnou hypofyzitidou se sekundárním útlumem tyreotropní, adrenokortikotropní a gonadotropní osy
Pacient ve věku 64 let, původně s nízce rizikovým maligním melanomem zad, po primární excizi (pT1aN0M0), byl referován na našem pracovišti v říjnu 2017 ke zvážení další léčby po radikálním odstranění intranzitní podkožní metastázy nad pravým žeberním obloukem. Pacient byl v klinicky výborném výkonnostním stavu, bez laboratorních anomálií a s vyloučením možného duplicitního melanomu. Z interních komorbidit byl pacient zatížen pouze arteriální hypertenzí. V polovině listopadu 2017 byla zahájena adjuvantní léčba s nivolumabem + ipilimumabem/placebem v rámci klinické studie CA209-915. Přibližně po 4 měsících od započetí léčby se pacient dostavil ke kontrole pro několik dnů rozvíjející se těžkou únavu, celkovou slabost, nechutenství a návaly horka s bolestí hlavy. Ze základního objektivního vyšetření dominovalo zpomalené psychomotorické tempo a arteriální hypotenze. Laboratorně i klinicky nebyly přítomny známky infektu. Vzhledem k podezření na projev nežádoucího účinku imunoterapie byl pacient přijat k hospitalizaci. Vstupně byl doplněn endokrinologický screening s nálezem útlumu tyreotropní, adrenokortikotropní a gonadotropní osy – tyreotropní hormon (thyroid stimulating hormone – TSH) 0,04 mIU/l (norma 0,35–4,94), volný tyroxin (free T4 – fT4) 11,69 pmol/l (norma 9,01–19,05), adrenokortikotropní hormon (adrenocorticotropic hormone – ACTH) < 9,0 ng/l (norma 0–46), kortizol 3 nmol/l (norma 166–507), testosteron 2,27 nmol/l (norma 7,66–24,82). Vstupně proběhlo i neurologické vyšetření – bez známek neurodeficitu svědčícího pro centrální či periferní topiku. V úvodu hospitalizace byla vysazena antihypertenziva, byly podávány infuze s krystaloidy a zahájena kortikoterapie solu-medrolem intravenózně (i.v.) v úvodní dávce 1 mg/kg i.v., po 3 dnech byl převeden na perorální aplikaci prednisonu 1 mg/kg/den. Po nasazení kortikoidů došlo k promptní úpravě klinického stavu pacienta. Cílené vyšetření magnetickou rezonancí (magnetic resonance imaging – MRI) zaměřené na hypofýzu, provedené druhý den po přijetí, neprokázalo patologii. Ve spolupráci s endokrinologem byl postupně vysazován prednison a po 1 měsíci byl pacient převeden na substituční léčbu hydrokortizonem v perorální dávce 30 mg/den (20 mg ráno, 10 mg odpoledne). Současně s touto substitucí probíhala i terapie euthyroxem (75 μg/den). Pokračování adjuvantní imunoterapie bylo pro závažnou formu toxicity (stupeň 3) ukončeno. V současné době je pacient (listopad 2019) bez potíží, na chronické substituční terapii hydrokortizonem a euthyroxem. A je nadále bez známek relapsu základního onemocnění.
Epidemiologie
Incidence endokrinopatií u moderní imunoterapie se napříč studiemi a různými publikacemi liší. Důvodem mohou být často nespecifické klinické projevy, které se dávají do souvislosti s vlastním onemocněním nebo jiným vedlejším účinkem. Kvůli tomu nemusí být řada endokrinopatií diagnostikována a je zde vysoká pravděpodobnost, že reálná incidence této toxicity je podstatně vyšší.
K nejčastěji primárně postiženým orgánům patří štítná žláza a hypofýza. Postižení hypofýzy je pak důvodem sekundární dysfunkce dalších endokrinních žláz. Převážná většina endokrinopatií je nízkého stupně závažnosti, asymptomatické nebo mírně symptomatické (stupeň 1 a 2), ale mohou se objevit i závažné toxicity vyžadující hospitalizaci (stupeň 3) a život ohrožující stavy (stupeň 4), jako je nadledvinková krize.
Incidence tyreopatie, stejně jako dalších toxicit, je u ipilimumabu dávkově závislá. Při dávce 3 mg/kg je uváděna v rozmezí 1–5 %, při dávkách 10 mg/kg až 10 % [2–4]. U anti-PD-1 protilátek podávaných v monoterapii (nivolumab, pembrolizumab) je její výskyt vyšší a pohybuje se v rozmezí 5–10 % [5,6]. A ještě vyšší je při kombinaci ipilimumabu a nivolumabu – do 20 % [3]. Vyšší pravděpodobnost rozvoje tyreopatie mají pacienti se vstupně pozitivními autoprotilátkami (např. proti tyreoidální peroxidáze), s anamnézou onemocnění štítné žlázy nebo po prodělané radioterapii na oblast krku [7]. Vyšetření autoprotilátek před zahájením imunoterapie se dnes standardně neprovádí.
Postižení hypofýzy (při hypofyzitidě) je u podávání samotných anti-PD-1 protilátek vzácné. U ipilimumabu v dávce 3 mg/kg jsme se s ní na našem pracovišti již setkali (pravděpodobnost cca 1 %, obr. 1, 2) a určitě s ní musíme počítat při použití kombinace ipilimumabu a nivolumabu (incidence cca 10 %) [2–4].
Image 1. Akutní hypofyzitida po ipilimumabu. 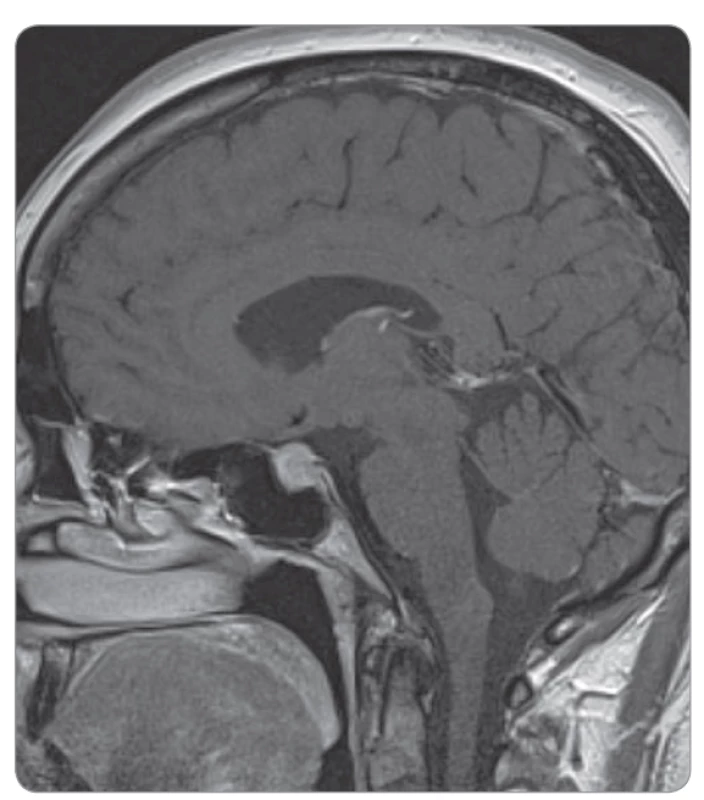
Image 2. Regrese otoku hypofýzy po 1 měsíci. 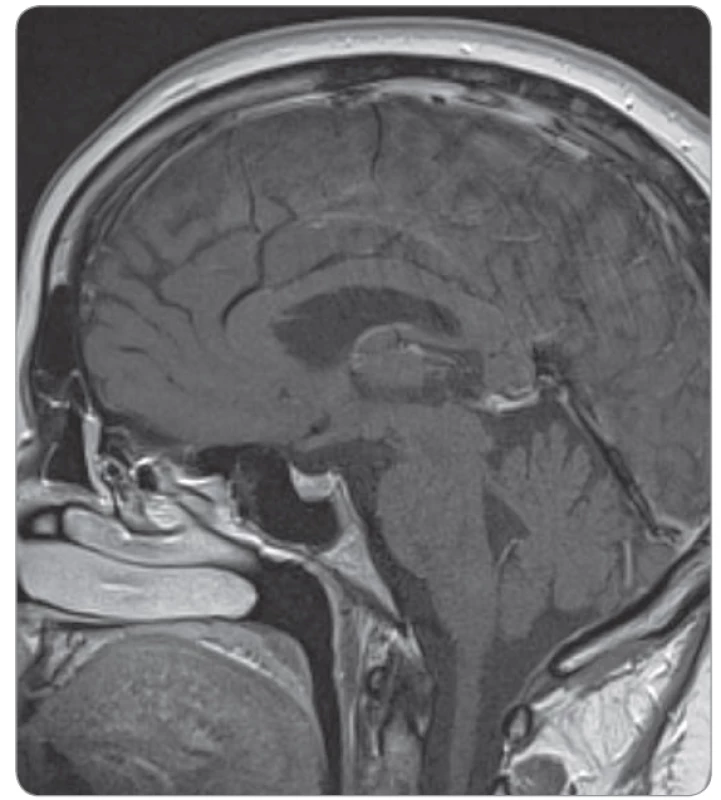
Výskyt dalších endokrinopatií, jako je primární adrenální insuficience, hypoparatyreóza nebo diabetes mellitus I. typu, je vzácný (do 1 %) [8]. Medián doby nástupu endokrinopatií je kolem 3. měsíce od započetí léčby, ale interval je velmi variabilní a k rozvoji může dojít kdykoliv, i za několik měsíců po ukončení imunoterapie. Jedná se o dlouhodobě trvající toxicitu (zvláště hypotyreóza, sekundární insuficience nadledvin), která je často ireverzibilní a může vyžadovat trvalou hormonální substituční léčbu [5,9].
Klinický obraz a diagnostika
Klinický obraz endokrinopatií je často nespecifický. V rámci diferenciální diagnostiky je nutno vyloučit jinou etiologii potíží (progrese nádorového onemocnění, metastatické postižení endokrinního orgánu, jiná poléková etiologie – např. glukokortikoidy a další).
Hypertyreóza a hypotyreóza
Postižení funkce štítné žlázy může být primární (častěji po anti-PD-1/L1 protilátkách) nebo sekundární při hypofyzitidě (častěji po ipilimumabu +/ − anti-PD-1 protilátka). Můžeme se setkat s hypertyreózou nebo častější hypotyreózou.
Při hypertyreóze může být v popředí potíží nervozita, neklid, nespavost, tachykardie, srdeční arytmie, teplá vlhká kůže a úbytek na váze. Hypertyreóza často přechází do hypotyreózy (do několika týdnů). Pokud přetrvává hypertyreóza, tak je nutno ve spolupráci s endokrinologem vyloučit Gravesovu-Basedowovu nemoc (protilátky proti TSH receptoru, mladší ženy, orbitopatie, ultrazvuk štítné žlázy s Dopplerem – typická hypervaskularizace). Pro hypotyreózu je naopak typická únava, spavost, zimomřivost, nabírání na váze, deprese, neuropatie, myalgie, suchá kůže, hypomimie, otoky a zácpa.
K základním vyšetřením patří odběr hladiny hormonů – TSH a fT4. Pro vysokou pravděpodobnost vzniku tyreopatie se odběry provádějí pravidelně – vstupně před léčbou, poté 1× měsíčně prvních 6 měsíců léčby, dále je možno interval mezi odběry při absenci klinických potíží prodloužit na 3 měsíce, s nutnou kontrolou i po ukončení imunoterapie (alespoň 6 měsíců). Pro plně vyvinutou hypertyreózu při tyreoiditidě je typické vysoké fT4 a nízké TSH (negativní zpětná vazba), naopak u primární hypotyreózy je fT4 nízké a TSH vysoké. U sekundární hypotyreózy při hypopituitarizmu důsledkem hypofyzitidy je nízké TSH i nízké fT4. Je nutné si uvědomit, že systém stimulací a zpětných vazeb (hypotalamus – hypofýza – štítná žláza) je dynamický a změny v hormonálních hladinách jsou pozvolné (např. ještě normální hladina fT4 a stoupající TSH svědčí pro počínající rozvoj hypotyreózy). V těchto případech je třeba odběr v kratším intervalu opakovat.
Při tyreopatii dále provádíme odběry na autoprotilátky – proti tyreoideální peroxidáze, proti tyreoglobulinu, doplňujeme ultrazvuk štítné žlázy. Další vyšetření provádíme dle doporučení endokrinologa (diferenciální diagnostika jiné příčiny, např. horký uzel štítné žlázy).
Hypofyzitida a hypopituitarizmus
Hypofyzitida se sekundární insuficiencí nadledvin může být závažný stav. Až třetina případů může probíhat pod obrazem toxicity stupně 3 a 4 (vážná toxicita vyžadující hospitalizaci a život ohrožující toxicita).
Symptomy mohou být lokální ze zvětšené hypofýzy při zánětu (bolesti hlavy, zrakové poruchy – rozmazané vidění, výpadky zorného pole) a systémové ze sekundární dysfunkce hypofýzou řízených endokrinních orgánů (adrenální insuficience, hypotyreóza, hypogonadizmus). Systémové příznaky bývají často nespecifické, např. únava, slabost, nevolnost, zvracení, nechutenství, bolesti břicha, průjem, bolesti svalů, kloubů, psychické změny, teploty, hypotenze, hyponatremie, dehydratace.
K základním diagnostickým vyšetřením patří krevní odběr zaměřený na hormonální profil – fT4, TSH, ranní kortizol, ACTH, folikuly stimulující hormon, luteinizační hormon, testosteron, estradiol (premenopauzální ženy), +/ − prolaktin. ACTH stimulační test bývá v úvodu nepřínosný (nadleviny fungují, jen nemají stimul z hypofýzy). V rámci diferenciální diagnostiky je nutné odlišit iatrogenní hypokortikalizmus při podávání exogenních kortikoidů, např. z důvodu řešení jiné toxicity – kvůli negativní zpětné vazbě je často přítomný útlum celé osy (hypotalamus – hypofýza – nadledviny). Mezi další vyšetřované parametry patří krevní obraz s diferenciálním rozpočtem bílých krvinek, biochemie séra vč. C-reaktivního proteinu. Je nutné vyloučit závažný infekt a při přetrvávajícím podezření na hypofyzitidu provést co nejdříve MRI vyšetření (odložené vyšetření je často již negativní), případně oční vyšetření s perimetrem.
Vzhledem k potenciálnímu riziku spojenému s hypofyzitidou je stav nutno řešit ve spolupráci s endokrinologem. Pro vyšší riziko hypofyzitidy při kombinaci ipilimumabu a anti-PD-1 protilátek je dnes doporučováno kromě fT4 a TSH také pravidelně kontrolovat ACTH a ranní kortizol (u anti-PD-1/L1 protilátek v monoterapii stačí dále jen fT4 a TSH) [7,10].
Diabetes mellitus I. typu
Inzulin dependentní diabetes mellitus s poškozením buněk Langerhansových ostrůvků pankreatu se vyskytuje vzácně (< 1 %), častější je po anti-PD-1/L1 protilátkách než po ipilimumabu. Klinicky je přítomna hyperglykemie, polyurie, polydipsie, dehydratace, ketoacidóza. Je nutno odlišit diabetes inzulin dependentní od non-dependentního. V rámci diferenciální diagnostiky se kromě C-peptidu provádí odběry na autoprotilátky proti glutamátdekarboxyláze (anti-GAD65) a proti buňkám ostrůvků pankreatu [11].
Léčba toxicity
Hypertyreóza a hypotyreóza
Při diagnostikované hypertyreóze se v její léčbě řídíme podle přítomnosti symptomů. Pokud je přítomna tachykardie, nasadíme beta-blokátory (atenolol, metoprolol), u kardiaků nebo při bolestivém otoku štítné žlázy můžeme krátkodobě podávat prednison tablety perorálně ( p. o.) 0,5–1 mg/kg/den, většinou ale nejsou potřeba. Tyreostatika se používají výjimečně (Gravesova-Basedowova hypertyreóza) a vždy ve spolupráci s endokrinologem. Velká většina hypertyreóz během několika týdnů přechází do hypotyreózy, při níž je naopak nutná dlouhodobá substituční léčba. K úpravě funkce štítné žlázy dochází jen cca u třetiny pacientů. Základem léčby hypotyreózy je substituce levothyroxinem s iniciální dávkou 25–50 μg/den, na lačno, s postupným navyšováním do normalizace TSH (kontrola TSH 1× měsíčně). U starších pacientů a kardiaků začínáme vždy menší dávkou a zvyšujeme pomaleji. Pokud řešíme sekundární hypotyreózu a současnou insuficienci nadledvin, tak nejdříve provádíme substituci kortikoidy a až za několik dnů nasadíme levothyroxin, abychom se vyvarovali rizika adrenální krize. U asymptomatického pacienta (vč. absence únavy) s elevací TSH < 10 U/l při normální hodnotě fT4 můžeme se substitucí počkat (subklinická hypotyreóza) [7,10,11]. Imunoterapie se v obou případech tyreopatií dočasně přerušuje jen v případě významných symptomů. Po adekvátní substituci hormonů a ústupu potíží se k léčbě můžeme vrátit. Tyreopatie bývá výjimečně důvodem k trvalému ukončení imunoterapie.
Hypofyzitida a hypopituitarizmus
Základem je hormonální substituce, dle útlumu konkrétní hormonální osy (sekundární adrenální insuficience, sekundární hypotyreóza, sekundární hypogonadizmus). Nejčastěji je nutno podávat glukokortikoidy s mineralokortikoidní aktivitou (např. hydrokortizon 15–20 mg ráno a 10 mg odpoledne nebo večer) a levothyroxin tablety 50–100 μg/den. U mladých pacientů lze zvážit také substituci pohlavních hormonů. Sekundární hypotyreóza a hypogonadizmus se mohou upravit, útlum adrenokortikotropní osy bývá trvalý s nutností celoživotní substituce. Vysoké dávky kortikoidů jsou rezervovány jen pro vážné stavy v úvodu hypofyzitidy – bolesti hlavy, zrakové či jiné neurologické potíže, MRI nález zvětšené hypofýzy. K zaléčení akutních symptomů je možno podat metylprednisolon v infuzi i.v. 1–2 mg/kg/den nebo prednison tablety p. o. 1–2 mg/kg/den po dobu 1–2 týdnů a po ústupu potíží pacienta převést na dlouhodobou hormonální substituci [12]. V případě adrenální krize s hypotenzí je doporučována hospitalizace na jednotce intenzivní péče (život ohrožující stav!). Okamžitě se podávají i.v. kortikoidy s mineralokortikoidní aktivitou (hydrokortizon 100 mg i.v. každých 6–8 hod), infuze s NaCl a glukózou, nutná je monitorace vitálních funkcí a vyloučení sepse. Následně po stabilizaci stavu je opět nutná dlouhodobá substituce p. o. hydrokortizonem (20–30 mg/den p. o. s navýšením při stresových situacích, infekcích či teplotách 2–4×). Pacient musí být veden u endokrinologa, musí být řádně edukován o případné úpravě dávek glukokortikoidů v zátěžových situacích. Závažná porucha funkce nadledvin (stupeň toxicity 3 a 4) je důvodem pro ukončení imunoterapie.
Diabetes mellitus I. typu
Základem je substituční léčba inzulinem (celoživotní), kortikoidy v úvodu nejsou indikovány, vysoce pravděpodobně nepomohou, naopak mohou zhoršit kompenzaci diabetu. Léčba imunoterapií po nastavení dávek inzulinu může pokračovat [11].
Obecná doporučení pro přerušení nebo trvalé ukončení imunoonkologické léčby
Při asymptomatické endokrinopatii (pouze patologický laboratorní nález) je možno v léčbě pokračovat. Při symptomatické endokrinopatii se léčba s imunoterapií přerušuje. Po nastavení hormonální substituční léčby a ústupu symptomů lze u převážné většiny pacientů v imunoterapii pokračovat. Pouze u nadledvinkové nedostatečnosti stupně 3 a 4 a ostatních endokrinopatií stupně 4 je doporučováno zvážit trvalé ukončení léčby.
Závěr
Endokrinní toxicita se v mnohém liší od jiných imunitně podmíněných toxicit. Její nástup může být opožděný a trvání dlouhodobé až celoživotní. S příchodem kombinované imunoterapie se výskyt endokrinopatií zvýší a budeme se častěji potýkat s vážnými stavy jako je hypofyzitida a sekundární nadledvinková nedostatečnost. Kortikoidy jako imunosupresivum jsou indikovány výjimečně. Hlavní roli hraje dobře vedená hormonální substituce ve spolupráci s endokrinologem. Špatně řešená endokrinopatie zbytečně zhoršuje kvalitu života pacienta a jeho toleranci k léčbě.
Práce byla podpořena MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radek Lakomý, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lakomy@mou.cz
Obdrženo: 3. 10. 2019
Přijato: 11. 11. 2019
Sources
1. Wang DY, Salem JE, Cohen JV et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncol 2018; 4 (12): 1721–1728. doi: 10.1001/jamaoncol.2018.3923.
2. Lakomý R, Poprach A. Sideeffects of modern immunotherapy and how to solve them in the clinics. Klin Onkol 2015; 28 (Suppl 4): 4S103–4S114. doi: 10.14735/amko20154S103.
3. Larkin J, Chiarion-Sileni V, Gonzalez R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373 (1): 23–34. doi: 10.1056/NEJMoa1504030.
4. Eggermont AM, Chiarion Sileni V, Grob JJ et al. Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. N Engl J Med 2016; 375 (19): 1845–1855. doi: 10.1056/NEJMoa1611299.
5. Weber JS, Hodi FS, Wolchok JD et al. Safety profile of nivolumab monotherapy: a pooled analysis of patients with advanced melanoma. J Clin Oncol 2017; 35 (7): 785–792. doi: 10.1200/JCO.2015.66.1389.
6. Robert C, Schachter J, Long GV et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015; 372 (26): 2521–2532. doi: 10.1056/NEJMoa1503093.
7. Cukier P, Santini FC, Scaranti M et al. Endocrine side effects of cancer immunotherapy. Endocr Relat Cancer 2017; 24 (12): 331–347. doi: 10.1530/ERC-17-0358.
8. Mellati M, Eaton KD, Brooks-Worrell BM et al. Anti-PD-1 and antiPDL-1 monoclonal antibodies causing type 1 diabetes. Diabetes Care 2015; 38 (9): 137–138. doi: 10.2337/dc15-0889.
9. Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012; 30 (21): 2691–2697. doi: 10.1200/JCO.2012.41.6750.
10. Girotra M, Hansen A, Farooki A et al. The current understanding of the endocrine effects from immune checkpoint inhibitors and recommendations for management. JNCI Cancer Spectr 2018; 2 (3): pky021. doi: 10.1093/jncics/pky021.
11. Haanen JB, Carbonnel F, Robert C et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): 119–142. doi: 10.1093/annonc/mdx225.
12. Sznol M, Postow MA, Davies MJ et al. Endocrine-related adverse events associated with immune checkpoint blockade and expert insights on their management. Cancer Treat Rev; 58 : 70–76. doi: 10.1016/j.ctrv.2017.06. 002.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 1-
All articles in this issue
- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- Management imunitně podmíněné endokrinopatie při protinádorové léčbě checkpoint inhibitory
- Toxicita imunoonkologické léčby – myokarditida
- Gastrointestinální toxicita imunoterapie
- Renální toxicita imunoonkologické léčby
- Význam fibroblastů asociovaných s nádorem při patogenezi karcinomů v oblasti hlavy a krku
- Dlouhodobé klinické výsledky IGRT karcinomu prostaty
- Expresia ligandu receptora programovanej bunkovej smrti 1 v bio psii nemalobunkového karcinómu pľúc a jej asociácia s tumor infi ltrujúcimi lymfocytmi a stupňom dezmoplázie
- Novinky z genetiky, molekulární biologie a klinické onkologie sarkomů
- Editorial
- Aktuality z odborného tisku
- Důležitá role STAT3 v biologii chronické lymfocytární leukemie
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- Důležitá role STAT3 v biologii chronické lymfocytární leukemie
- Toxicita imunoonkologické léčby – myokarditida
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

