-
Medical journals
- Career
Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
Authors: Martinková Veronika; Trčka Filip; Vojtěšek Bořivoj; Müller Petr
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2018; 31(Supplementum 2): 46-54
Category: Review
doi: https://doi.org/10.14735/amko20182S46Overview
Východiska:
Vysoký proliferační potenciál a genetická nestabilita nádorových buněk je spojena se zvýšenou produkcí mutovaných a konformačně nestabilních proteinů. Nadměrná proteosyntéza spolu se zvýšeným metabolickým obratem vytvářejí stresové podmínky, které musí nádorová buňka trvale kompenzovat. Nádorové buňky se tak stávají závislé na udržování proteinové homeostázy zahrnující kontrolu kvality proteinů, jejich skládání, transport a stabilizaci. Tyto funkce jsou zajišťovány molekulárními chaperony, které jsou u nádorů reprezentovány především stresovými proteiny HSP70 a HSP90. Jejich exprese a aktivita je významně zvýšena ve všech maligních nádorech, kde spolu s dalšími proteiny nazývanými kochaperony vytváří multiproteinové komplexy. Aktivita HSP70 a HSP90 je nezbytná pro udržení maligního fenotypu tím, že se podílí na stabilizaci četných onkoproteinů, podporuje proliferaci a inhibuje apoptózu. V tomto ohledu představují proteiny teplotního šoku důležitý cíl využitelný v protinádorové terapii, neboť jejich inhibice umožňuje souběžnou inaktivaci řady signálních drah důležitých pro přežití nádorové buňky. Ačkoli bylo v uplynulém desetiletí vyvinuto několik specifických inhibitorů HSP90, jejich protinádorová aktivita je značně limitována vzhledem k indukci proteinů HSP70, které umožňují buňkám přežít. Vývoj inhibitorů HSP70 představuje novou výzvu v terapii cílené na inhibici proteostatických mechanizmů nádorových buněk.
Cíl:
Cílem tohoto článku je shrnout informace o struktuře HSP70 a jeho roli při udržování proteinové homeostázy v normálních a nádorových buňkách. Článek popisuje mechanizmy inhibice HSP70 pomocí nízkomolekulárních sloučenin a jejich potenciální aplikace v cílené protinádorové terapii.
Klíčová slova:
HSP70 – stresové proteiny – molekulární chaperony – buněčný stres – nádory – skládání proteinu
Úvod
Genetické změny a vysoký proliferační potenciál vedou u nádorových buněk ke zvýšené proteosyntéze a nadprodukci konformačně nestabilních proteinů. Pro nádorové buňky je proto nezbytné aktivovat mechanizmy udržující proteinovou homeostázu. Mezi základní mechanizmy kontrolující kvalitu a množství proteinu v buňce patří ubiquitin-proteazomový systém, autofagie a molekulární chaperony. Zatímco první dva jmenované mechanizmy slouží k degradaci proteinů, molekulární chaperony umožňují skládání a stabilizaci řady mutovaných proonkogenních proteinů nezbytných pro proliferaci nádorových buněk. V průběhu maligní transformace se tak nádorová buňka stává závislá na zvýšené aktivitě molekulárních chaperonů. Mezi nejčastěji zastoupené chaperony patří stresové proteiny teplotního šoku (heat-shock proteins – HSPs) reprezentované několika proteinovými rodinami rozdělenými podle molekulové hmotnosti.
HSP70 tvoří rodinu sekvenčně konzervovaných molekulárních chaperonů s molekulovou hmotností 70 kDa [1]. V lidském genomu je tato rodina reprezentována minimálně 13 různými geny kódujícími strukturně a funkčně podobné proteiny, které dohromady tvoří až 2 % buněčného proteomu [2]. Mezi nejdůležitější konstitutivně exprimované izoformy patří HSPA8 v cytosolu a jádře, HSPA5 v endoplazmatickém retikulu a HSPA9 v mitochondriích. Exprese indukovaná stresem je pak charakteristická pro HSPA1A a HSPA1B lokalizované v cytoplazmě i jádře [1]. Za fyziologických podmínek napomáhá HSP70 nově vznikajícím proteinům získat nativní konformaci. Dále je zapojen do vnitrobuněčného transportu proteinů, degradaci poškozených proteinů a asistuje při opětovném skládání chybně složených proteinů. Úloha HSP70 je nezastupitelná při stresových podmínkách (hypoxie, teplotní šok, UV záření apod.), které způsobují poškození konformace proteinů či jejich agregaci. HSP70 následně rozpoznává hydrofobní aminokyseliny poškozeného proteinu, na které se naváže, zabrání jeho agregaci a s využitím energie z hydrolýzy adenozintrifosfátu (adenosine triphosphate – ATP) umožňuje denaturovaným proteinům získávat nativní konformaci. Díky těmto funkcím je HSP70 zapojen do udržení protei-nové homeostázy během fyziologických i stresových podmínek. Tuto rozsáhlou škálu funkcí však HSP70 nezastává samostatně. Proteiny, které se při těchto procesech s molekulárními chaperony asociují a napomáhají jejich funkci, jsou označovány jako kochaperony [3,4].
V tomto článku je skupina proteinů, které patří mezi HSPs 70, označována souhrnně jako HSP70 a pokud bylo v textu potřeba uvést konkrétní izoformu, je označena podle oficiálního názvu genu (tab. 1).
Table 1. Lidské proteiny patřící do rodiny HSP70. 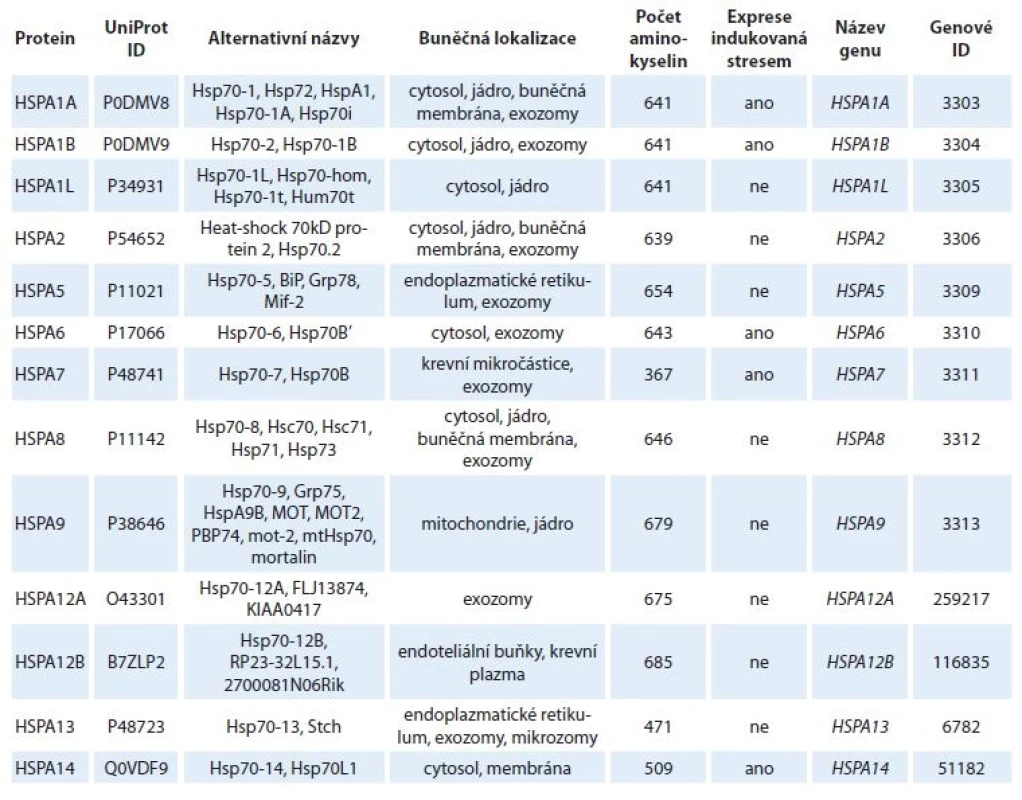
Struktura a ATPázový cyklus HSP70
Protein HSP70 je tvořen N-koncovou nukleotid vazebnou doménou (nukleotide-binding domain – NBD), 44 kDa a C-koncovou substrát vazebnou doménou (substrate-binding domain – SBD), 28 kDa (obr. 1a). NBD je dále členěna na subdomény IA/B a IIA/B, jejichž prostorové uspořádání vytváří kavitu pro vazbu ATP/adenozindifosfát (adenosine diphosphate ADP) v koordinaci s vazbou hořečnatého a draselného kationtu (obr. 1b) [5,6]. SBD se skládá ze dvou subdomén. Vlastní vazebné místo pro substrát je utvářeno v subdoméně se strukturou β-skládaného listu. Subdoména SBD tvořená soustavou α-helixů má pak funkci „víka“, které stabilizuje vazbu substrátu (obr. 1b). NBD a SBD domény jsou spojeny krátkou, vysoce konzervovanou hydrofobní sekvencí – linkerem (obr. 1a), který hraje významnou roli při regulaci alosterických strukturních změn v molekule HSP70 vyvolaných vazbou ATP [7].
Image 1. Struktura HSP70. 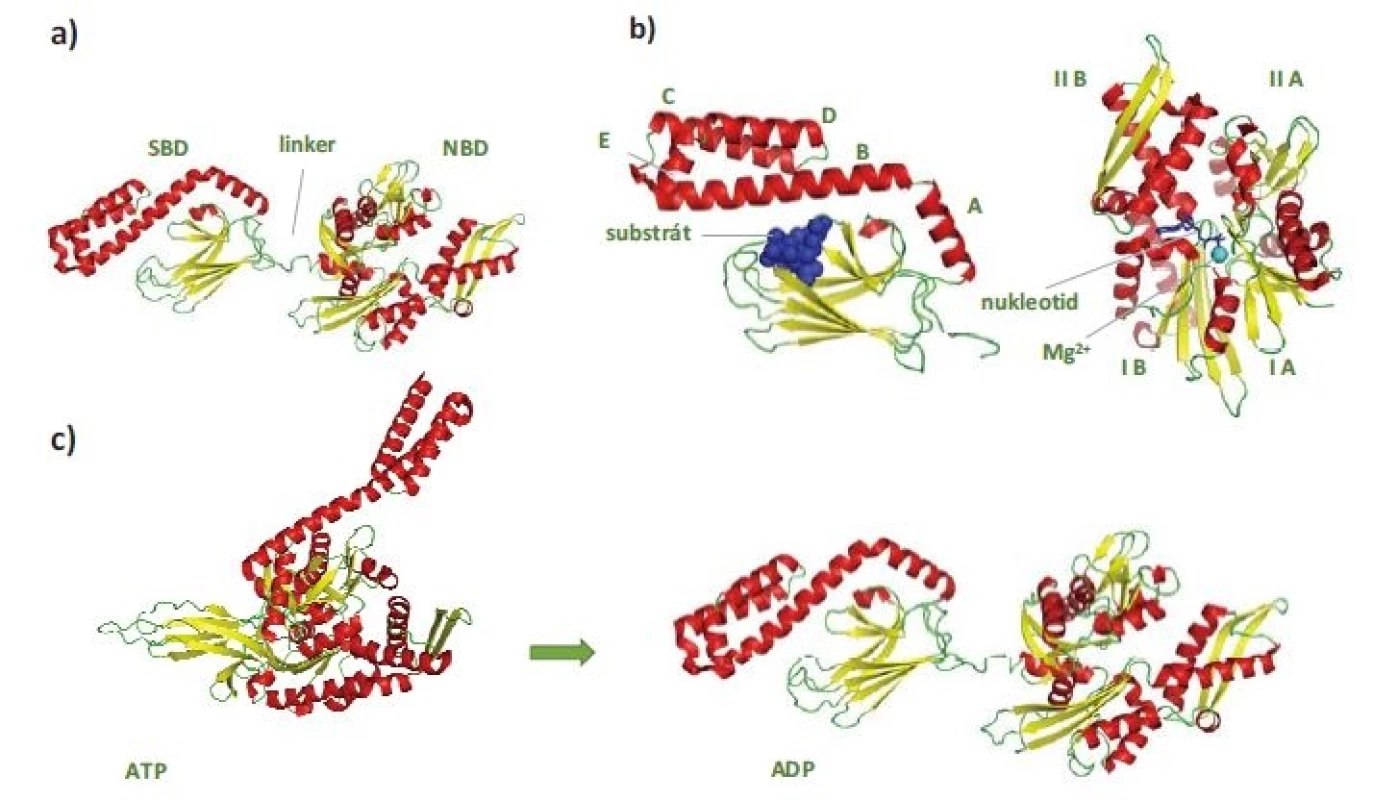
Červeně jsou označeny α-helixy, žlutě struktury β-skládaného listu, zeleně nestrukturované oblasti a modře peptidový substrát, nukleotid a hořečnatý kationt. a) Na obrázku je znázorněna celá krystalová struktura HSP70 (PDB: 2KHO). Protein se skládá ze SBD a NBD, které navzájem spojuje linker. b) Detailní pohled na strukturu substrát vazebné domény nalevo (PDB: 1DKZ) a nukleotid vazebné domény napravo (PDB: 4B9Q). c) Schematické zobrazení výrazných strukturních změn v HSP70 po hydrolýze ATP. Nejvýraznější změny můžeme na první pohled pozorovat u SBD (PDB: 4JNE, 2KHO).
SBD – substrát vazebná doména, NBD – nukleotid vazebná doména, ATP – adenozintrifosfát, ADP – adenozindifosfátV nepřítomnosti ATP se NBD a SBD domény HSP70 chovají jako nezávislé a SBD doména vykazuje vysokou afinitu k substrátu – vzniká tzv. uzavřená konformace SBD (obr. 1c) [4]. Vazba ATP do NBD vede k částečnému splynutí („docking“) NBD a SBD domén regulovanému linkerovou sekvencí. Tím dochází ke snížení afinity substrátu k SBD, která se tak nachází v tzv. otevřené konformaci. Hydrolýza ATP na ADP uvádí molekulu HSP70 opět do stavu s „uzavřenou konformací“ SBD. Průchod proteinu HSP70 ATPázovým cyklem je usnadňován jeho interakcí s proteiny HSP40, které se váží na rozhraní NBD-SBD domén HSP70 v ATP-vázaném stavu, a spolu se substrátem, který transportují do SBD, katalyzují hydrolýzu ATP a vznik „uzavřené konformace“ SBD s navázaným substrátem (obr. 2). Spontánní uvolnění ADP z NBD je pomalý proces, který výrazně urychlují proteiny s funkcí NEF (nucleotide-exchange factor). Výměna ADP za ATP vede ke vzniku „otevřené konformace“ SBD a uvolnění substrátu, čímž se HSP70 navrací na začátek ATPázového cyklu [8,9]. Typickými substráty HSP70 jsou krátké hydrofobní peptidové motivy obklopené pozitivně nabitými aminokyselinami, které jsou po denaturaci proteinů exponovány na jejich povrchu [10].
Image 2. ATPázový cyklus HSP70. 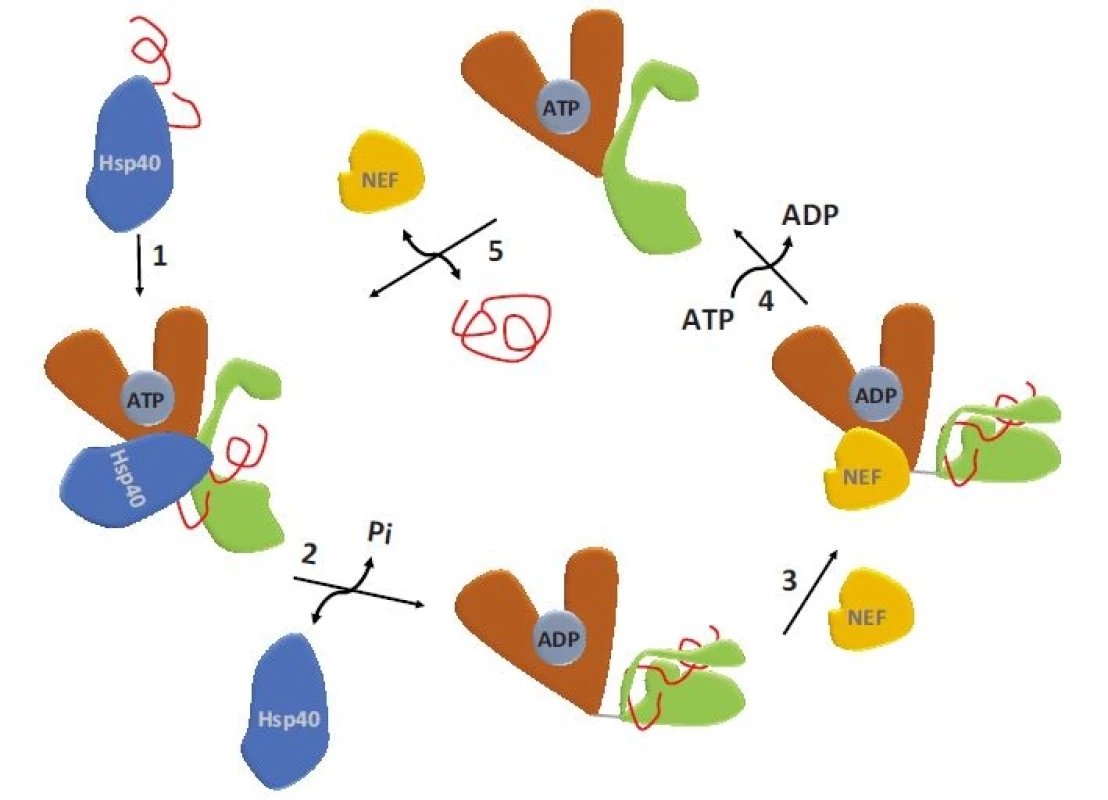
1 – klientský protein je dopraven kochaperonem do SBD HSP70, 2 – vazba HSP40 způsobí rozsáhlé konformační změny, které způsobí hydrolýzu ATP a uzavření klientského proteinu v SBD, 3 – konformačními změnami dojde k odhalení vazebného místa pro NEF, 4 – vazbou NEF je umožněna výměna ADP za ATP, 5 – navázání ATP způsobí konformační změny vedoucí k uvolnění složeného klientského proteinu.
SBD – substrát vazebná doména, ATP – adenozintrifosfát, NEF – nukleotid výměnný faktor, ADP – adenozindifosfátRegulace exprese HSP70
Přestože jsou proteiny HSP70 silně exprimovány ve všech buněčných typech, je jejich exprese významně zvyšována působením buněčného stresu. Zvýšení genové exprese HSP70 a dalších stresových proteinů je centrálním protektivním mechanizmem kompenzujícím působení proteotoxického stresu u všech eukaryotických organizmů. Klíčovou roli v regulaci genové exprese hraje evolučně konzervovaný transkripční faktor HSF1 (heat-shock factor) [11]. Tento transkripční program je označován jako odpověď na tepelný šok (heat-shock response – HSR). Aktivita HSF1 vede ke zvýšené expresi některých molekulárních chaperonů, kochaperonů i dalších proteinů, které obsahují ve svých promotorech tzv. elementy tepelného šoku (heat-shock elementy – HSE). Jedná se o krátké sekvenční motivy DNA, na které se váže HSF1 [12]. Aktivita HSF1 je řízena jeho lokalizací a trimerizací. HSF1 je v nestresovaných buňkách přítomen v cytoplazmě jako monomer. Stresové podmínky vyvolávají trimerizaci HSF1 a jeho přesun do jádra, kde spouští expresi daných genů. Aktivita HSF1 je řízena zpětnou vazbou – spuštěním exprese HSE-regulovaných genů nastane rovněž zvýšení hladiny HSP90 a HSP70, jejichž přítomnost negativně ovlivňuje aktivaci HSF1 [13].
Úloha HSP70 v patologii nádorů
HSPA1A a HSPA1B patří mezi inducibilní izoformy HSP70, jejichž exprese je významně zvýšena u všech nádorů [14]. Ze souhrnných údajů o těchto inducibilních izoformách vyplývá, že tyto chaperony mohou hrát kauzální roli při zahájení maligní transformace. Konkrétně bylo zjištěno, že zvýšená exprese HSPA1A podporuje tumorigenicitu u buněk myšího fibrosarkomu a navozuje u nich rezistenci vůči cytotoxickému působení imunitních buněk [15]. Zvýšení exprese inducibilní izoformy HSP70 podporuje tvorbu T buněčného lymfomu u transgenních myší. U imortalizovaných fibroblastů Rat-1 bylo prokázáno, že nadměrná exprese HSPA1A způsobuje ztrátu kontaktní inhibice a vyvolává vznik nádorů při implantaci do myší. Naopak snížení exprese tohoto genu vede u těchto buněk ke ztrátě tumorigenních vlastností. Proonkogenní působení inducibilní HSP70 se uplatňuje rovněž v patogenezi nádorů prsu (breast cancer – BC). Bylo ukázáno, že zvýšení exprese HSPA1A je nezbytné pro maligní transformaci vyvolanou onkogenem HER2. Zvýšená exprese HSPA1A je charakteristická pro většinu maligních nádorů, u nichž koreluje s mírou dediferenciace (grade) a horší prognózou [16]. Nádorové buňky potřebují HSPA1A např. k inhibici apoptózy a senescence, ale i k posílení autofagie (obr. 3) [17]. HSPA1A potlačuje apoptózu inhibicí její vnitřní i vnější dráhy. U vnitřní dráhy je HSP70 vázán na BAX (člen proapoptotické rodiny BCL-2), čímž zabraňuje jeho translokaci do mitochondrií [18]. Dalším mechanizmem, kterým HSPA1A zabraňuje spuštění apoptózy, je inhibice proapoptotického proteinu APAF1 (apoptotic protease activating factor 1). HSPA1A se váže na APAF1 a zabraňuje tak jeho oligomerizaci, která je nutná pro tvorbu apoptozomu a aktivaci kaspázy 9 [19]. HSP70 rovněž inhibuje aktivaci vnější apoptotické dráhy vazbou k receptorům smrti. HSPA1A blokuje signalizaci zprostředkovanou apoptózou indukující ligand patřící do skupiny tumor nekrotizujícího faktoru (tumor necrosis factor-related apoptosis-inducing ligand – TRAIL) tím, že tvoří komplex s receptory DR4 a DR5 a znemožňuje tak tvorbu DISC (death-inducing signaling complex) u Bcr-Abl pozitivních buněk [20]. Programovanou buněčnou smrt závislou na kaspázách ovlivňuje HSPA1A interakcí s apoptózou indukujícím faktorem (AIF), čímž blokuje kondenzaci chromatinu řízenou AIF [21]. HSPA1A dále inhibuje i kaskádu dějů řízenou mitogenem aktivovanými proteinkinázami (mitogen-activated protein – MAP), vč. např. c-Jun [22]. Kromě inhibičního vlivu HSP70 na apoptózu byl dokumentován i jeho vliv na senescenci nádorových buněk. Bylo prokázáno, že vysoká exprese inducibilních izoforem HSP70 je nutná pro zabránění senescence v nádorových buňkách. Snížení exprese HSPA1A pomocí siRNA vedlo k navození senescence doprovázené aktivací nádorového supresorového proteinu p53 a zvýšenou expresí proteinu p21 [23]. Snížení exprese HSPA1A v nádorových buňkách může rovněž indukovat senescenci nezávislou na p53, a to díky schopnosti HSPA1A ovlivňovat signalizaci zprostředkovanou onkogenními kinázami PI3K, RAS a ERK [24]. Obdobné závěry vyplývají i z prací, které ukázaly, že inducibilní izoformy HSP70 jsou nezbytné pro nádorovou transformaci zprostředkovanou onkoproteinem HER2/neu a snížení jejich exprese vede k navození senescence [25].
Image 3. Příklady proonkogenního působení HSP70. 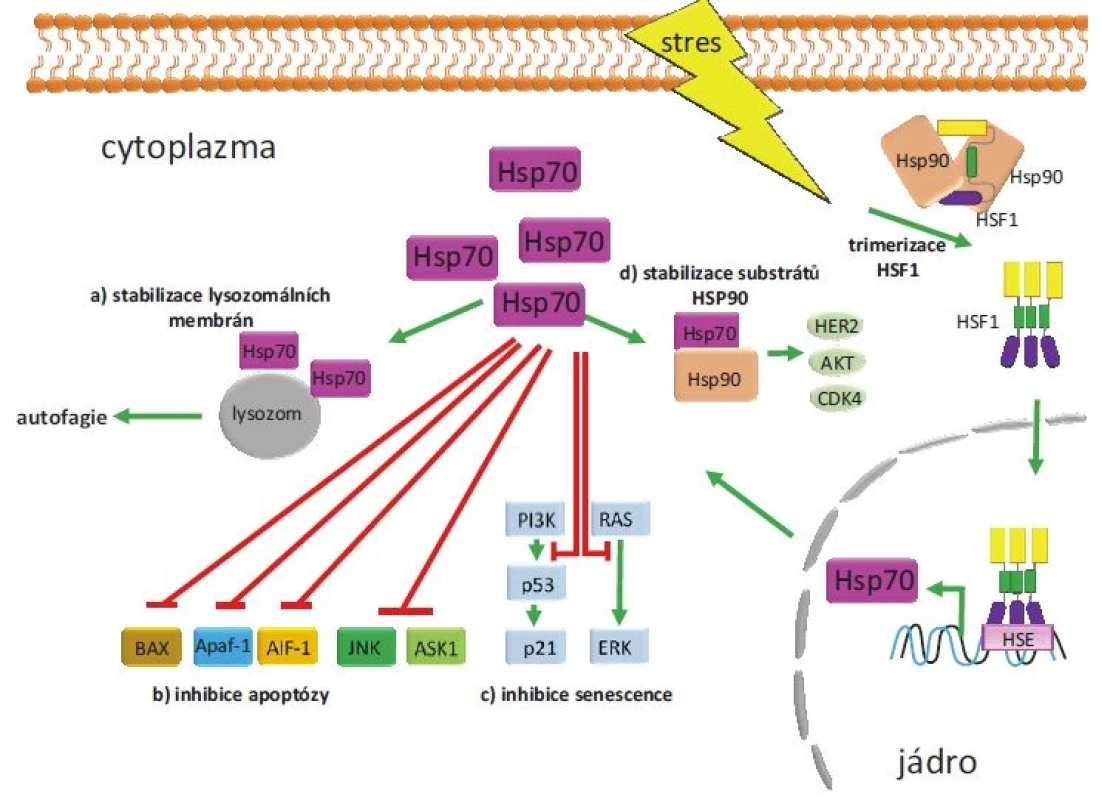
Nádorové buňky jsou neustále vystavovány stresu (hypoxie, zánět, změna pH apod.), který aktivuje transkripční faktor HSF1 zodpovědný za zvýšenou expresi HSP70. Zvýšené množství proteinu HSP70 podporuje nádorovou transformaci na několika úrovních. a) Stabilizuje membrány lysozomů, čímž podporuje autofagii. b) Několika způsoby inhibuje vnější i vnitřní dráhu apoptózy. Zabraňuje translokaci BAX do mitochondrií, interakcí s APAF1 inhibuje vznik apoptozomu, zabraňuje kondenzaci chromatinu řízenou AIF-1 a inhibuje i děje řízené některými kinázami. c) Blokuje senescenci závislou i nezávislou na proteinu p53. d) Spolu s HSP90 se podílí na maturaci řady onkogenních proteinů vč. HER2, CDK4 a AKT. Zvýšená exprese HSPA1A koreluje se zvýšenou proliferací nádoru, s klinickým stadiem a špatnou prognózou pacientů s nemalobuněčným karcinomem plic (non-small cell lung cancer – NSCLC) [26], BC, endometria [27], kolorektálním karcinomem [28], hepatocelulárním karcinomem [29] a karcinomem prostaty [30]. U pacientů s akutní myeloidní leukemií s charakteristickou expresí Bcr-Abl je zvýšená exprese HSPA1A spojována s rezistencí k imatinibu [31,32].
Plazmatická membrána nádorových buněk často obsahuje zvýšené množství HSPA1A [33]. Nádory s vysokým obsahem membránového HSPA1A jsou obecně vysoce rezistentní k chemoterapii a to často kvůli inhibici signálních drah JNK, ERK a NF-κB [34]. U metastáz je hustota membránového HSPA1A vyšší v porovnání s primárním tumorem, což naznačuje schopnost membránového HSPA1A usnadnit proces metastazování. V souladu s těmito poznatky byla vyšší hustota membránového HSPA1A spojena s nepříznivou prognózou a sníženým celkovým přežitím pacientů s rektálním karcinomem a spinocelulárním karcinomem plic [35,36].
Kromě cytoprotektivních účinků se změněná exprese nebo funkce HSPA1A podílí také na vývoji dalších onemocnění, která jsou spojena s defekty v konformaci či skládání proteinů. Mezi tato onemocnění patří např. Parkinsonova a Alzheimerova choroba [4].
Inhibice HSP70
V současnosti jsou neustále vyvíjeny nové strategie pro úspěšnou léčbu maligních onemocnění. Základním konceptem úspěšné chemoterapie je narušení procesu, který je pro nádorovou buňku klíčový. Podobně jako genotoxické látky využívají u nádorů zvýšený metabolizmus nukleových kyselin, můžeme zvýšenou proteosyntézu a přítomnost nestabilních proteinů v nádorových buňkách využít k cílené protinádorové léčbě. Dosavadní vývoj protinádorové terapie založené na narušení proteinové homeostázy se soustředil zejména na vývoj nízkomolekulárních látek inhibujících proteazom a stresový protein HSP90. Ačkoli bylo v uplynulém desetiletí vyvinuto několik specifických inhibitorů HSP90, jejich protinádorová aktivita je značně limitována kvůli indukci proteinů HSP70, které zabraňují navození buněčné smrti a umožňují buňkám přežít. Syntéza selektivních inhibitorů HSP70 tak představuje novou výzvu v terapii cílené na inhibici proteostatických mechanizmů nádorových buněk [37–39].
Vhodným mechanizmem účinku inhibitorů HSP70 je jejich vazba do substrát a nukleotid vazebné domény a také narušení protein-proteinových interakcí mezi HSP70 a jeho kochaperony [40]. Doposud bylo nalezeno několik inhibitorů, u nichž byla potvrzena jejich vazba do struktury HSP70 (tab. 2). Míra aktivity inhibitorů a síla vazby látek k HSP70 byla charakterizována pomocí inhibiční konstanty IC50 (koncentrace inhibitoru, při které dojde ke snížení odpovědi na 50 %), střední efektivní koncentrace EC50 (koncentrace látky, při které nastane snížení definované odpovědi na polovinu) nebo disociační konstanty Kd (síla vazby mezi inhibitorem a HSP70) (tab. 2).
Table 2. Látky modulující aktivitu HSP70. 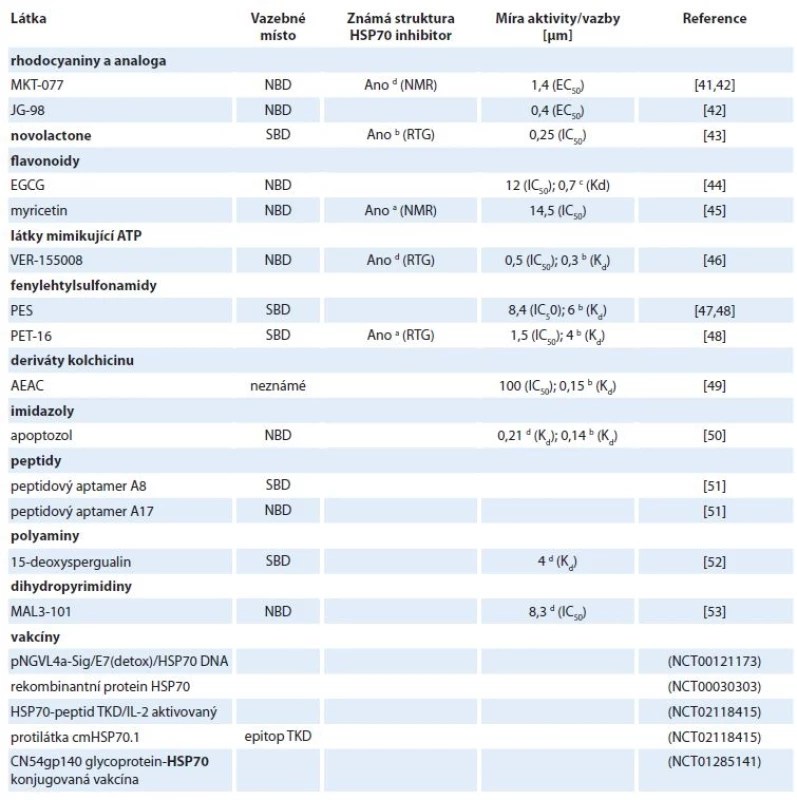
NMR – spektroskopie nukleární magnetické rezonance, EGCG – epigalokatechin galát, ATP – adenozintrifosfát, SBD – substrát vazebná doména, NBD – nukleotid vazebná doména, TKD – peptid o aminokyselinové sekvenci: TKDNNLLGRFELSG
a dnaK, b HSPA1, c HSPA5, d HSPA8MKT-077 a jeho deriváty
Jedním z prvních nalezených inhibitorů HSP70 je kladně nabité rhodacyaninové barvivo MKT-077, které se váže poblíž vazebného místa pro ATP v nukleotid vazebné doméně mitochondriálního HSPA9. Za selektivitu MKT-077 je zodpovědná i jeho kationtová povaha, díky čemuž je akumulován protonovým gradientem v mitochondriích rychle se dělících nádorových buněk [41,54]. Později byla také pomocí spektroskopie nukleární magnetické rezonance potvrzena vazba mezi MKT-077 a HSPA8. Inhibitor je zde vázán do negativně nabité kapsy v blízkosti nukleotid vazebného místa. Díky jeho selektivní vazbě pouze do ADP stavu HSPA8 začal být MKT-077 klasifikován jako alosterický inhibitor [54]. Jeho protinádorový efekt byl pozorován např. u inhibice proliferace nádorových buněčných linií prsu, střeva a močového měchýře (IC50 ~ 1–5 μm) a zároveň nebyla pozorována toxicita u zdravých buněk ledvin [41]. Inhibitor MKT-077 postoupil do fáze I klinických testů, v níž byly pacientům aplikovány každodenně infuze o dávce 30–50 mg/m2 po dobu 3 týdnů. U řady pacientů však byla pozorována renální toxicita a zároveň bylo zjištěno, že dochází k rychlé metabolizaci MKT-077, čímž nemohlo být v séru dosaženo požadované terapeutické hladiny [55].
Nestabilita MKT-077 je způsobena především oxidací benzothiazolového a pyridinového kruhu. Lepší stability za současného udržení dobré antiproliferační aktivity bylo dosaženo systematickými susbstitucemi, přičemž nejlepší výsledky vykazovala látka se zaměněným pyridinovým kruhem za thiazolový heterocyklus se současnými substitucemi malých molekul (na benzothiazolovém a thiazolovém kruhu). Aplikací vzniklé látky JG-98 na buňky prsního adenokarcinomu MDA-MB-231 byly zjištěny EC50 = 0,4 μm a > 7× lepší mikrozomální stabilita – 37 min. Později byl JG-98 identifikován jako alosterický inhibitor interakce HSP70/BAG3 [42,56].
Novolactone
Haasan et al hledali dráhy a konkrétní geny, které ovlivňuje přírodní látka novolactone prostřednictvím screeningu přežívání heterozygotických a homozygotikých delečních mutantů kvasinek vystavených této látce. Při bližším zkoumání biochemických vlastností kvasinkového i lidského HSP70 po jejich ovlivnění novolactonem bylo objeveno, že se jedná o alosterický inhibitor, který se kovalentně váže na Glu444 v SBD HSPA1A. Studium chování HSPA1A inhibovaného novolactonem přineslo nové poznatky o alosterické komunikaci NBD a SBD domén [43]. Zmíněný inhibitor je proto užitečným nástrojem pro pochopení fungování chaperonů in vitro i in vivo a v neposlední řadě také novým potenciálním léčivem.
Inhibitory s flavonoidní strukturou
Epigalokatechin galát (epigallocatechin gallate – EGCG) je přírodní polyfenolický flavonoid ze zeleného čaje, u něhož byla pomocí afinitní chromatografie zjištěna interakce s NBD endoplazmatického HSPA5 (Kd = 0,7 μm) [44]. Dalším inhibitorem s flavonoidní strukturou je myricetin, který taktéž inhibuje ATPázovou aktivitu HSP70. Detailnější mechanizmus jeho účinku byl popsán u bakteriálního HSP70 – DnaK. Myricetin inhibuje interakci DnaK s kochaperonem DnaJ (HSP40), čímž blokuje ATPázový cyklus DnaK [45].
Látky mimikující ATP
Williamson et al v roce 2009 s využitím krystalové struktury komplexu ATP a HSPA8/BAG1 navrhli a připravili sérii 8-a 8,5‘-substituovaných derivátů adenozinu. Následnými systematickými modifikacemi těchto inhibitorů v poloze C8 a 5‘ bylo dosaženo hodnoty IC50 = 0,5 μm u látky, která dostala název VER-155008. Krystalová struktura komplexu VER-155008-HSPA8 odhalila stabilizaci inhibitoru v NBD HSPA8 prostřednictvím několika π-π interakcí mezi Arg272, aromatickými kruhy obou substituentů a Tyr15 [46]. Doposud byla u této látky prokázána inhibice proliferace nádorových linií prsu a střeva s GI50 v rozmezí 5,3–14,4 μm. U linie BT474 (BC) VER-155008 indukuje kaspázami-3/7 závislou apoptózu, kdežto u linie HCT116 (karcinom střeva) způsobuje apoptózu nezávislou na systému kaspáz-3/7 [57].
2-phenylethynesulfonamid
Nízkomolekulární látka 2-phenylethynesulfonamid (PES) (známá též pod názvem pfithtrin-μ) zabraňovala akumulaci p53 v mitochondriích, nebyly však známy jeho přímé intracelulární cíle. Prostřednictvím biotinylovaného PES a afinitní precipitace byl jako intracelulární cíl tohoto inhibitoru nalezen HSPA1A. Vazebné místo pro PES bylo pomocí deleční mutageneze identifikováno v substrát vazebné doméně HSP70 [47]. PES vykazuje cytotoxicitu vůči širokému spektru solidních nádorů bez ohledu na jejich status p53 a zvýšenou expresi antiapoptotického Bcl-xL. PES způsobuje poškození procesu degradace makromolekul pomocí autofagie a lysozomů, což vede k nahromadění nesprávně složených a agregovaných proteinů, vč. substrátů HSP90 a následně k buněčné smrti [58].
AEAC
AEAC je syntetický derivát kolchicinu inhibující HSPA1A. Bližší charakterizace mechanizmu účinku prokázala inhibici vazby substrátu a poškození HSP70-řízeného refoldingu. Prozatím existují na základě in silico predikcí tři potenciální místa vazby inhibitoru AEAC – jedno v NBD a dvě v SBD. Ačkoliv byla naměřena nanomolární afinita mezi AEAC a HSPA1A in vitro a in silico, nebyl pozorován výrazný vliv podání AEAC na viabilitu nádorových buněk krysího glioblastomu (C6) a melanomu (B16). Současné podání AEAC a doxorubicinu však signifikantně zesílilo protinádorový efekt doxorubicinu [49].
Apoptozol
Apoptozol byl nalezen při screeningu knihovny imidazolových látek s apoptotickým účinkem. Při bližším zkoumání bylo zjištěno, že se specificky váže do NBD HSPA1A a HSPA8 [50,59]. Mechanizmus účinku tohoto inhibitoru spočívá v přerušení interakce mezi HSP70 a jeho substrátem APAF1. Tato událost vede k aktivaci buněčné smrti závislé na kaspázách. Využití apoptozolu k potenciální protinádorové terapii podporuje studie na myších xenograftech, u nichž bylo pozorováno zmenšení nádoru bez vlivu na viabilitu myší [59].
Využití HSP70 v imunoterapii
Kromě nízkomolekulárních látek inhibujících HSP70 jsou v posledních letech také intenzivně studovány imunogenní vlastnosti chaperonů. V personalizované medicíně hledají své uplatnění komplexy HSP70-substrátový peptid izolované z nádorů konkrétního pacienta i lidský rekombinantní protein HSPA1A [60–62]. Ke zdolání nádorů pomocí imunitní odpovědi však existuje mnohem víc způsobů: a) imunizace komplexem HSP70-HPV16 oE7 antigenem vede k aktivaci imunitní odpovědi řízené CD8+ buňkami; b) exozomy z nádorových buněk nadmíru produkující HSP70 aktivují zrání dendritických buněk a odpověď řízenou buňkami CD4+ a CD8+ a c) komplexy HSP70 s tumor asociovanými antigeny izolované z fúzních dendritických a nádorových buněk způsobují odpověď řízenou T lymfocyty doprovázenou indukcí efektorových i paměťových T buněk [60,63,64].
V současnosti probíhá několik klinických testů sledujících imunogenní vlastnosti HSP70. V prvním klinickém testu byla hledána míra odpovědi imunitního systému pacientů s chronickou myeloidní leukemií (CML) v chronické fázi na vakcínu vyrobenou z jejich vlastního nádoru. Vakcína byla připravena z přečištěného HSPA1A a na základě výsledků byla reinfúze autologních NK (natural killer) buněk aktivovaných HSPA1A shledána za bezpečnou [65]. Díky úspěšným testům z fáze I, probíhá v kombinaci s chemoradioterapií fáze II u pacientů s NSCLC (NCT02118415). Odlišná vakcína pNGVL4a-Sig/E7 (detox) /HSP70 DNA byla testována u pacientek s cervikální intraepiteliální neoplazií [66]. Ve fázi I klinického testování je také sledován rekombinantní protein HSP70 při léčbě CML v chronické fázi (NCT00030303).
Závěr
Zvýšení genetické nestability a proliferační aktivity nádorových buněk klade velké nároky na buněčný proteostatický aparát, jehož centrální složkou jsou molekulární chaperony HSP90 a HSP70. Úspěšné zavedení inhibice HSP90 do nádorové terapie je komplikováno komplexností buněčného chaperonového systému, který na inhibici HSP90 reaguje zvýšením exprese chaperonů rodiny HSP70. Objevení či design selektivního inhibitoru HSP70 s vysokou afinitou a jeho kombinované použití s inhibitory HSP90 představuje nadějnou strategii při léčbě nádorových onemocnění. Klíčové je zejména zacílení na stresem-indukovanou izoformu HSPA1A, jejíž zvýšená exprese je charakteristická pro nádorové buňky.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Veronika Martinková
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: veronika.martinkova@mou.cz
Přijato: 16. 08. 2018
Sources
1. Daugaard M, Rohde M and Jäättelä M. The heat shock protein 70 family: Highly homologous proteins with overlapping and distinct functions. FEBS Lett 2007; 581 (19): 3702–3710. doi: 10.1016/j.febslet.2007.05.039.
2. Zylicz M and Wawrzynow A. Insights into the function of Hsp70 chaperones. IUBMB Life 2001; 51 (5): 283–287. doi: 10.1080/152165401317190770.
3. Ďurech M, Vojtěšek B and Müller P. The many roles of molecular chaperones and co-chaperones in tumor biology. Klin Onkol 2012; 25 (Suppl 2): 45–49.
4. Mayer MP and Bukau B. Hsp70 chaperones: Cellular functions and molecular mechanism. Cell Mol Life Sci 2005; 62 (6): 670–684. doi: 10.1007/s00018-004-4464-6.
5. Flaherty KM, DeLuca-Flaherty C, McKay DB. 3-dimensional structure of the ATPase fragment of a 70K heat-shock cognate protein. Nature 1990; 346 (6285): 623–628. doi: 10.1038/346623a0.
6. Kityk R, Kopp J, Sinning I et al. Structure and dynamics of the ATP-bound open conformation of Hsp70 chaperones. Mol Cell 2012; 48 (6): 863–874. doi: 10.1016/j.molcel.2012.09.023.
7. Aprile FA, Dhulesia A, Stengel F et al. Hsp70 oligomerization is mediated by an interaction between the interdomain linker and the substrate-binding domain. PLoS One 2013; 8 (6): e67961. doi: 10.1371/journal.pone.0067961.
8. Mayer MP. Hsp70 chaperone dynamics and molecular mechanism. Trends Biochem Sci 2013; 38 (10): 507–514. doi: 10.1016/j.tibs.2013.08.001.
9. Kampinga HH and Craig EA. The HSP70 chaperone machinery: J proteins as drivers of functional specificity. Nat Rev Mol Cell Biol 2010; 11 (8): 579–592. doi: 10.1038/nrm2941.
10. Rüdiger S, Germeroth L, Schneider-Mergener J et al. Substrate specificity of the DnaK chaperone determined by screening cellulose-bound peptide libraries. EMBO J 1997; 16 (7): 1501–1507. doi: 10.1093/emboj/16.7.1501.
11. Powers MV, Workman P. Inhibitors of the heat shock response: biology and pharmacology. FEBS Lett 2007; 581 (19): 3758–3769. doi: 10.1016/j.febslet.2007.05.040.
12. Shi YH, Mosser DD, Morimoto RI et al. Molecular chaperones as HSF1-specific transcriptional repressors. Gene Dev 1998; 12 (5): 654–666.
13. Zheng X, Krakowiak J, Patel N et al. Dynamic control of Hsf1 during heat shock by a chaperone switch and phosphorylation. Elife 2016; 5: e18638. doi: 10.7554/eLife.18638.
14. Ferrarini M, Heltai S, Zocchi MR et al. Unusual expression and localization of heat-shock proteins in human tumor-cells. Int J Cancer 1992; 51 (4): 613–619.
15. Jaattela M. Over-expression of Hsp70 confers tumorigenicity to mouse fibrosarcoma cells. Int J Cancer 1995; 60 (5): 689–693.
16. Sherman MY and Gabai VL. Hsp70 in cancer: back to the future. Oncogene 2015; 34 (32): 4153–4161. doi: 10.1038/onc.2014.349.
17. Murphy ME. The HSP70 family and cancer. Carcinogenesis 2013; 34 (6): 1181–1188. doi: 10.1093/carcin/bgt111.
18. Stankiewicz AR, Lachapelle G, Foo CP et al. Hsp70 inhibits heat-induced apoptosis upstream of mitochondria by preventing Bax translocation. J Biol Chem 2005; 280 (46): 38729–38739. doi: 10.1074/jbc.M509497200.
19. Saleh A, Srinivasula SM, Balkir L et al. Negative regulation of the Apaf-1 apoptosome by Hsp70. Nat Cell Biol 2000; 2 (8): 476–483. doi: 10.1038/35019510.
20. Guo F, Sigua C, Bali P et al. Mechanistic role of heat shock protein 70 in Bcr-Abl-mediated resistance to apoptosis in human acute leukemia cells. Blood 2005; 105 (3): 1246–1255. doi: 10.1182/blood-2004-05-2041.
21. Ravagnan L, Gurbuxani S, Susin SA et al. Heat-shock protein 70 antagonizes apoptosis-inducing factor. Nat Cell Biol 2001; 3 (9): 839–843. doi: 10.1038/ncb0901-839.
22. Gabai VL, Meriin AB, Mosser DD et al. Hsp70 prevents activation of stress kinases – A novel pathway of cellular thermotolerance. J Biol Chem 1997; 272 (29): 18033–18037.
23. Yaglom JA, Gabai VL and Sherman MY. High levels of heat shock protein Hsp72 in cancer cells suppress default senescence pathways. Cancer Res 2007; 67 (5): 2373–2381. doi: 10.1158/0008-5472.CAN-06-3796.
24. Gabai VL, Yaglom JA, Waldman T et al. Heat shock protein Hsp72 controls oncogene-induced senescence pathways in cancer cells. Mol Cell Biol 2009; 29 (2): 559–569. doi: 10.1128/MCB.01041-08.
25. Meng L, Hunt C, Yaglom JA et al. Heat shock protein Hsp72 plays an essential role in Her2-induced mammary tumorigenesis. Oncogene 2011; 30 (25): 2836–2845. doi: 10.1038/onc.2011.5.
26. Malusecka E, Zborek A, Krzyzowska-Gruca S et al. Expression of heat shock proteins HSP70 and HSP27 in primary non-small cell lung carcinomas. An immunohistochemical study. Anticancer Res 2001; 21 (2A): 1015–1021.
27. Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperon 2005; 10 (2): 86–103.
28. Hwang TS, Han HS, Choi HK et al. Differential, stagedependent expression of Hsp70, Hsp110 and Bcl-2 in colorectal cancer. J Gastroen Hepatol 2003; 18 (6): 690–700.
29. Chuma M, Sakamoto M, Yamazaki K et al. Expression profiling in multistage hepatocarcinogenesis: Identification of HSP70 as a molecular marker of early hepatocellular carcinoma. Hepatology 2003; 37 (1): 198–207. doi: 10.1053/jhep.2003.50022.
30. Kurahashi T, Miyake H, Hara I et al. Expression of major heat shock proteins in prostate cancer: Correlation with clinicopathological outcomes in patients undergoing radical prostatectomy. J Urology 2007; 177 (2): 757–761. doi: 10.1016/j.juro.2006.09.073.
31. Thomas X, Campos L, Mounier C et al. Expression of heat-shock proteins is associated with major adverse prognostic factors in acute myeloid leukemia. Leukemia Res 2005; 29 (9): 1049–1058. doi: 10.1016/j.leukres.2005.02.010.
32. Ray S, Lu Y, Kaufmann SH et al. Genomic mechanisms of p210 (BCR-ABL) signaling – Induction of heat shock protein 70 through the GATA response element confers resistance to paclitaxel-induced apoptosis. J Biol Chem 2004; 279 (34): 35604–35615. doi: 10.1074/jbc.M401851200.
33. Multhoff G, Botzler C, Wiesnet M et al. A stress-inducible 72-kDa heat-shock protein (Hsp72) is expresses on the surface of human tumor-cells, but not on normalcells. Int J Cancer 1995; 61 (2): 272–279.
34. Pocaly M, Lagarde V, Etienne G et al. Overexpression of the heat-shock protein 70 is associated to imatinib resistance in chronic myeloid leukemia. Leukemia 2007; 21 (1): 93–101. doi: 10.1038/sj.leu.2404463.
35. Juhasz K, Lipp AM, Nimmervoll B et al. The complex function of Hsp70 in metastatic cancer. Cancers 2014; 6 (1): 42–66. doi: 10.3390/cancers6010042.
36. Pfister K, Radons J, Busch R et al. Patient survival by Hsp70 membrane phenotype – association with different routes of metastasis. Cancer 2007; 110 (4): 926–935. doi: 10.1002/cncr.22864.
37. Guo F, Rocha K, Bali P et al. Abrogation of heat shock protein 70 induction as a strategy, to increase antileukemia activity of heat shock protein 90 inhibitor 17-allylamino-demethoxy geldanamycin. Cancer Res 2005; 65 (22): 10536–10544. doi: 10.1158/0008-5472.CAN-05-1799.
38. Grossin L, Etienne S, Gaborit N et al. Induction of heat shock protein 70 (Hsp70) by proteasome inhibitor MG 132 protects articular chondrocytes from cellular death in vitro and in vivo. Biorheology 2004; 41 (3–4): 521–534.
39. Sadekova S, Lehnert S, Chow TY. Induction of PBP74/mortalin/Grp75, a member of the hsp70 family, by low doses of ionizing radiation: a possible role in induced radioresistance. Int J Radioat Biol 1997; 72 (6): 653–660.
40. Massey AJ. ATPases as drug targets: Insights from heat shock proteins 70 and 90. J Med Chem 2010; 53 (20): 7280–7286. doi: 10.1021/jm100342z.
41. Koya K, Li Y, Wang H et al. MKT-077, a novel rhodacyanine dye in clinical trials, exhibits anticarcinoma activity in preclinical studies based on selective mitochondrial accumulation. Cancer Res 1996; 56 (3): 538–543.
42. Li XK, Srinivasan SR, Connarn J et al. Analogues of the allosteric heat shock protein 70 (Hsp70) inhibitor, MKT-077, as anti-cancer agents. Acs Med Chem Lett 2013; 4 (11): 1042–1047. doi: 10.1021/ml400204n.
43. Hassan AQ, Kirby CA, Zhou W et al. The Novolactone natural product disrupts the allosteric regulation of Hsp70. Chem Biol 2015; 22 (1): 87–97. doi: 10.1016/j.chembiol.2014.11.007.
44. Ermakova SP, Kang BS, Choi BY et al. (-) -epigallocatechin gallate overcomes resistance to etoposide-induced cell death by targeting the molecular chaperone glucose-regulated protein 78. Cancer Res 2006; 66 (18): 9260–9269. doi: 10.1158/0008-5472.CAN-06-1586.
45. Chang L, Miyata Y, Ung PM et al. Chemical screens against a reconstituted multiprotein complex: Myricetin blocks DnaJ regulation of DnaK through an allosteric mechanism. Chem Biol 2011; 18 (2): 210–221. doi: 10.1016/j.chembiol.2010.12.010.
46. Williamson DS, Borgognoni J, Clay A et al. Novel adenosine-derived inhibitors of 70 kDa Heat Shock Protein, discovered through structure-based design. J Med Chem 2009; 52 (6) 1510-1513. doi: 10.1021/jm801627a.
47. Leu JI, Pimkina J, Frank A et al. A small molecule inhibitor of inducible heat shock protein 70. Mol Cell 2009; 36 (1): 15–27. doi: 10.1016/j.molcel.2009.09.023.
48. Leu JIJ, Zhang P, Murphy ME et al. Structural basis for the inhibition of HSP70 and DnaK chaperones by small-molecule targeting of a C-terminal allosteric pocket. ACS Chem Biol 2014; 9 (11): 2508–2516. doi: 10.1021/cb500236y.
49. Lazarev VF, Sverchinsky DV, Mikhaylova ER et al. Sensitizing tumor cells to conventional drugs: HSP70 chaperone inhibitors, their selection and application in cancer models. Cell Death Dis 2018; 9 (2): 41–52. doi: 10.1038/s41419-017-0160-y.
50. Williams DR, Ko SK, Park S et al. An apoptosis-inducing small molecule that binds to heat shock protein 70. Angew Chem Int Edit 2008; 47 (39): 7466–7469. doi: 10.1002/anie.200802801.
51. Rerole AL, Gobbo J, De Thonel A et al. Peptides and aptamers targeting HSP70: A novel approach for anticancer chemotherapy. Cancer Res 2011; 71 (2): 484–495. doi: 10.1158/0008-5472.CAN-10-1443.
52. Nadler SG, Tepper MA, Schacter B et al. Interaction of the immunosuppressant deosyxpergualin with member of the Hsp70 family of heat-shock proteins. Science 1992; 258 (5081): 484–486.
53. Fewell SW, Day BW and Brodsky JL. Identification of an inhibitor of hsc70-mediated protein translocation and ATP hydrolysis. J Biol Chem 2001; 276 (2): 910–914. doi: 10.1074/jbc.M008535200.
54. Rousaki A, Miyata Y, Jinwal UK et al. Allosteric drugs: the interaction of antitumor compound MKT-077 with human Hsp70 chaperones. J Mol Biol 2011; 411 (3): 614–632. doi: 10.1016/j.jmb.2011.06.003.
55. Propper DJ, Braybrooke JP, Taylor DJ et al. Phase I trial of the selective mitochondrial toxin MKT 077 in chemo-resistant solid tumours. Ann Oncol 1999; 10 (8): 923–927.
56. Li XK, Colvin T, Rauch JN et al. Validation of the Hsp70-Bag3 protein-protein interaction as a potential therapeutic target in cancer. Mol Cancer Ther 2015; 14 (3): 642–648. doi: 10.1158/1535-7163.MCT-14-0650.
57. Massey AJ, Williamson DS, Browne H et al. A novel, small molecule inhibitor of Hsc70/Hsp70 potentiates Hsp90 inhibitor induced apoptosis in HCT116 colon carcinoma cells. Cancer Chemoth Pharm 2010; 66 (3): 535–545. doi: 10.1007/s00280-009-1194-3.
58. Leu JI, Pimkina J, Pandey P et al. HSP70 Inhibition by the small-molecule 2-phenylethynesulfonamide impairs protein clearance pathways in tumor cells. Mol Cancer Res 2011; 9 (7): 936–947. doi: 10.1158/1541-7786.MCR-11-0019.
59. Ko SK, Kim J, Na DC et al. A small molecule inhibitor of ATPase activity of HSP70 induces apoptosis and has antitumor activities. Chem Biol 2015; 22 (3): 391–403. doi: 10.1016/j.chembiol.2015.02.004.
60. Enomoto Y, Bharti A, Khaleque AA et al. Enhanced immunogenicity of heat shock protein 70 peptide complexes from dendritic cell-tumor fusion cells. J Immunol 2006; 177 (9): 5946–5955.
61. Guzhova IV and Margulis BA. HSP70-based anti-cancer immunotherapy. Hum Vacc Immunother 2016; 12 (10): 2529–2535.
62. McNulty S, Colaco CA, Blandford LE et al. Heat-shock proteins as dendritic cell-targeting vaccines – getting warmer. Immunology 2013; 139 (4): 407–415. doi: 10.1111/imm.12104.
63. Zong JB, Wang C, Liu B et al. Human hsp70 and HPV16 oE7 fusion protein vaccine induces an effective antitumor efficacy. Oncol Rep 2013; 30 (1): 407–412. doi: 10.3892/or.2013.2445.
64. Xie YF, Bai O, Zhang H et al. Membrane-bound HSP70-engineered myeloma cell-derived exosomes stimulate more efficient CD8 (+) CTL – and NK-mediated antitumour immunity than exosomes released from heat-shocked tumour cells expressing cytoplasmic HSP70. J Cell Mol Med 2010; 14 (11): 2655–2666. doi: 10.1111/j.1582-4934.2009.00851.x.
65. Krause SW, Gastpar R, Andreesen R et al. Treatment of colon and lung cancer patients with ex vivo heat shock protein 70-peptide-activated, autologous natural killer cells: a clinical phase I trial. Clin Cancer Res 2004; 10 (11): 3699–3707. doi: 10.1158/1078-0432.CCR-03-0683.
66. Trimble CL, Peng S, Kos F et al. A phase i trial of a human papillomavirus DNA vaccine for HPV16+ cervical intraepithelial neoplasia 2/3. Clin Cancer Res 2009; 15 (1): 361–367. doi: 10.1158/1078-0432.CCR-08-1725.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue Supplementum 2-
All articles in this issue
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Současné metody analýzy mikroRNA
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

