-
Medical journals
- Career
Metastatické postižení hypofýzy
Authors: V. Novák 1; L. Hrabálek 1; M. Hampl 1; J. Hoza 2; Z. Fryšák 3; M. Vaverka 1
Authors‘ workplace: Neurochirurgická klinika LF UP a FN Olomouc 1; Otolaryngologická klinika LF UP a FN Olomouc 2; III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc 3
Published in: Klin Onkol 2017; 30(4): 273-281
Category: Review
doi: https://doi.org/10.14735/amko2017273Overview
Východiska:
Metastatické postižení hypofýzy je vzácnou komplikací generalizovaných nádorových onemocnění. Z celkového počtu pacientů operovaných pro intraselární nebo paraselární tumor tvoří metastatické postižení hypofýzy 1 % pacientů. Iniciálním příznakem bývá diabetes insipidus, který je naopak vzácností u adenomů hypofýzy.Materiál a metody:
Cílem předkládané publikace je prezentace dvou případů pacientů s diagnostikovaným metastatickým postižením hypofýzy a systematický přehled literatury. Pomocí databáze PubMed jsme vyhledali anglicky psané publikace zabývající se tematikou metastatického postižení hypofýzy od roku 1957 do roku 2016.Výsledky:
Nalezeno bylo 131 publikací, které dohromady poskytly údaje o 259 pacientech. Soubor tvořilo 121 mužů a 138 žen. Průměrný věk byl 57,3 roku. Nejčastěji metastazoval karcinom prsu (24,6 %) a plic (23,8 %) následovány karcinomem štítné žlázy (11,3 %), karcinomem ledvin (7,8 %), hepatocelulárním karcinomem (4,3 %), kolorektálním karcinomem (3,5 %) a maligním melanomem (3,5 %). Mezi nejfrekventovanější iniciální symptomy patřily projevy diabetu insipidu (39,6 %), deficit adenohypofýzy (44,9 %), poruchy perimetru (51,6 %), bolesti hlavy (37,6 %), parézy okohybných nervů (33,5 %) a pseudoprolaktinemie (16,7 %). Nejčastěji zvolenou léčebnou modalitou byla radioterapie (67,8 %) s chirurgickou léčbou (63,9 %). Průměrná doba přežití od stanovení metastatického postižení byla 11,8 měsíce.Závěr:
Terapie metastatického postižení hypofýzy kombinuje chirurgii, radioterapii, chemoterapii a hormonální léčbu. Chirurgická terapie – sama nebo v kombinaci s radioterapií – nevede k celkovému prodloužení přežití, ale zmírňuje příznaky a zlepšuje kvalitu života.Klíčová slova:
metastázy hypofýzy – diabetes insipidus – hypopituitarizmus – transsfenoidální chirurgieÚvod
První zmínky popisující výskyt metastatického postižení hypofýzy pocházejí od Benjamina z roku 1857. Diagnóza byla stanovena při pitvě u pacienta, který zemřel na melanom [1]. Metastázy hypofýzy se v klinické praxi vyskytují vzácně a tvoří 1 % z operovaných nádorů hypofýzy [2–4]. Podle japonského registru nádorů mozku se intrakraniální metastázy nacházejí v hypofýze s frekvencí 0,4 % [5]. Častější výskyt je popisován v pitevních vzorcích s incidencí 0,14–28,1 % [4,6]. Nejčastějšími primárními nádory jsou tumory prsu (6–39,7 %) a nádory plic (23–36,8 %) [4,6–10]. Ostatní primární nádory, jako jsou nádory ledvin (2,6–7 %), gastrointestinálního traktu (6,3 %), prostaty (5 %), melanomu (2,4 %) a štítné žlázy (2,17 %) se již vyskytují vzácněji [4,6,9]. V literatuře jsou popisovány i raritní nálezy jako metastáza rabdomyosarkomu nebo současné postižení hypofýzy metastázou karcinomu plic a adenomem hypofýzy [11,12].
Kazuistika 1
Muž ve věku 65 let léčený pro spinocelulární karcinom levé plíce s prorůstáním do mediastina (T4 N2–3 M0, IIIB), který právě podstupoval konkomitantní chemoradioterapii, byl vyšetřen pro rozvoj polydipsie a polyurie. Příjem tekutin dosahoval až 8 l denně. Hypernatremie (147 mmol/l, norma 136–145 mmol/l), hyperchloremie (110 mmol/l, norma 98–107 mmol/l) a nízká specifická hmotnost moči (1 003 kg/m3, norma 1 005–1 030 kg/m3) potvrzovaly diagnózu centrálního diabetu insipidu (cDI). Po podání desmopresinu (Minirin®) se klinické a laboratorní hodnoty normalizovaly. Byla doplněna magnetická rezonance mozku (MRI) s nálezem intraselární a supraselární expanze hypofýzy (obr. 1) a bylo vysloveno podezření na adenom, resp. metastatické postižení hypofýzy. Endokrinologické vyšetření neprokázalo hypofunkci předního laloku hypofýzy a mírně zvýšená hodnota prolaktinu vylučovala prolaktinom (441 mIU/l, norma 72–407 mIU/l). Počítačový perimetr prokázal absolutní skotomy v periferiích obou horních kvadrantů bilaterálně. Na základě klinického obrazu a provedených vyšetření jsme pacienta indikovali k operačnímu výkonu.
Image 1. MRI hypofýzy (T1 vážené sagitální skeny s kontrastní látkou). Patrná intra- a supraselární tumorózní expanze. 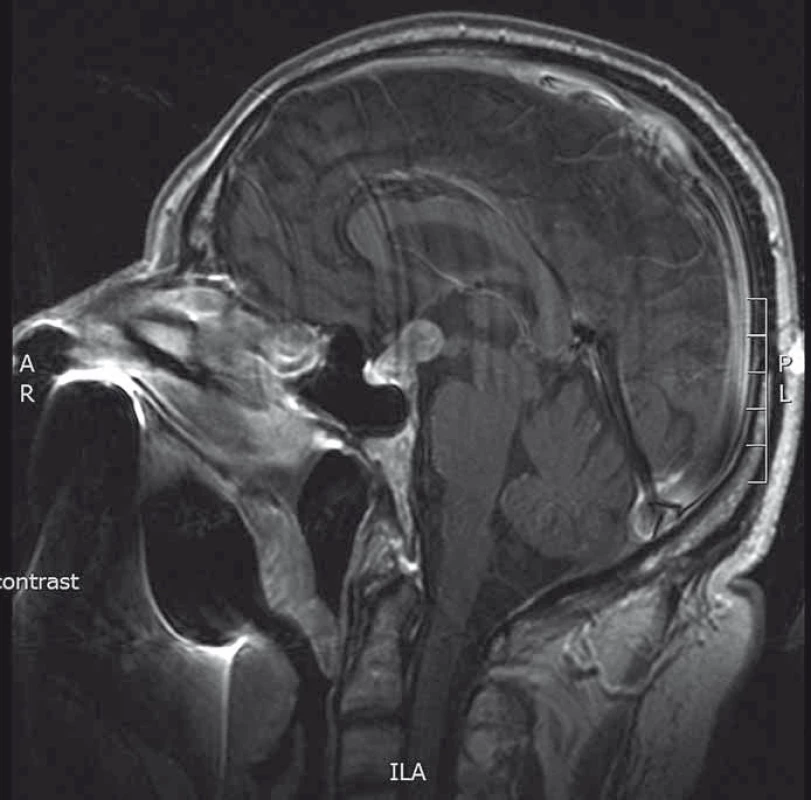
Zvolen byl endoskopický transnazální přístup. Operační zákrok byl proveden ve spolupráci neurochirurga a otorinolaryngologa. Po lateralizaci nosních skořep následovala resekce dorzální části septa. Po odloučení sliznice septa v oblasti rhinobaze byl nalezen kostní defekt, přes který je patrný masivní únik mozkomíšního moku (obr. 2). Následně byl standardně dokončen přístup do sfenoidální dutiny a odstraněna přední část tureckého sedla. Po durotomii byly kompletně exstirpovány tužší šedavé hmoty lokalizované intraselárně. Při supraselární exploraci již nenacházíme tumorózní hmoty.
Image 2. Peroperační snímek (Storz, Německo, 30° optika). Únik mozkomíšního moku z oblasti rinobaze po odloučení sliznice. 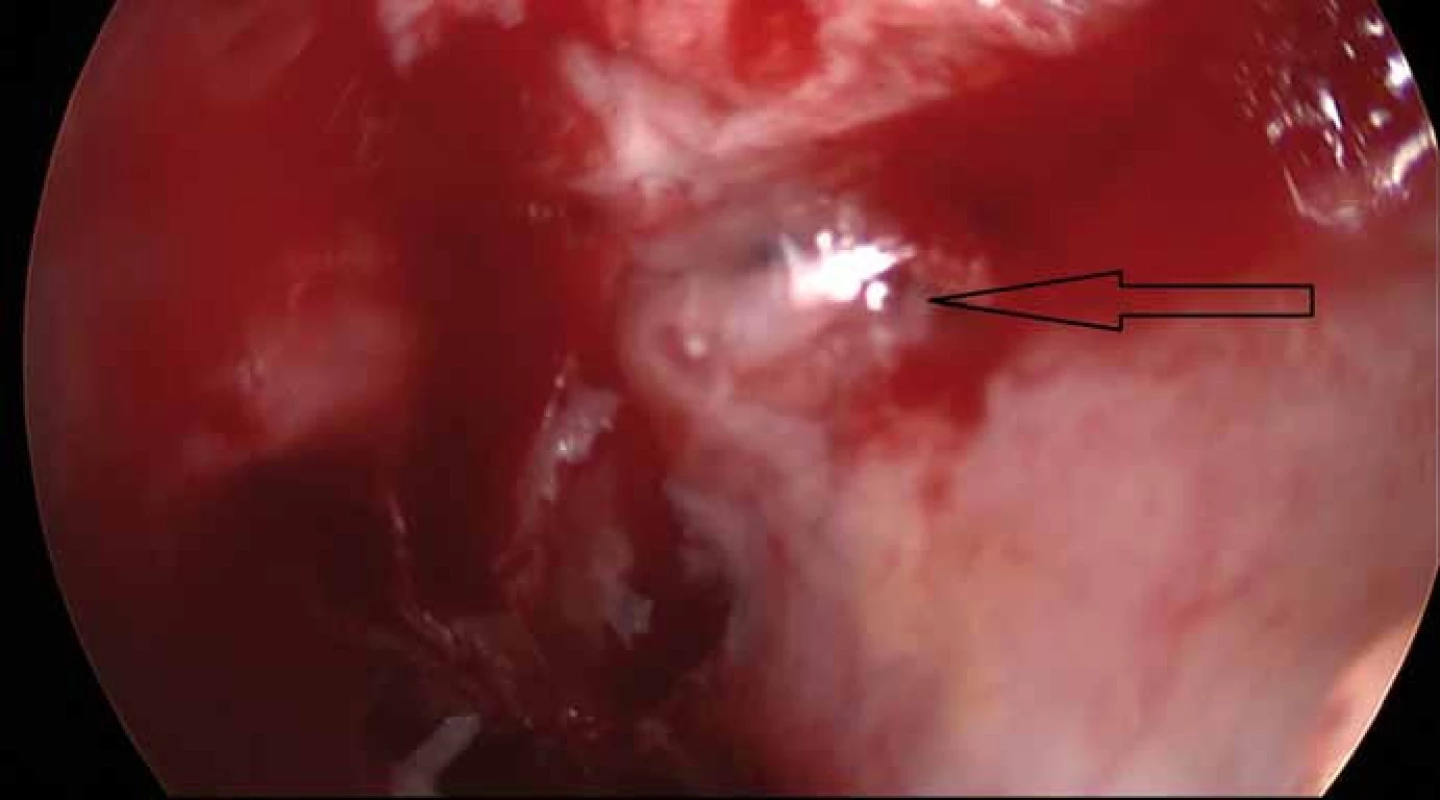
Plastiku sfenoidální dutiny a ektopického likvorového defektu jsme provedli pomocí fascie lata, svalu a tkáňového lepidla (Tisseel®).
Pacient byl po operaci sledován na jednotce intenzivní péče, kde byla zavedena lumbální drenáž. Během hospitalizace se již likvorea neobjevila. Pacient po operaci uvedl subjektivní zlepšení zraku. Histologické vyšetření prokázalo spinocelulární karcinom a pacienta jsme předali v dobrém stavu k další onkologické terapii.
Při pooperačním endokrinologickém vyšetření byl prokázán panhypopituitarizmus s nutností hormonální substituce. Kontrolní MRI vyšetření mozku bylo provedeno za 1 měsíc s nálezem progredujícího intra-a supraselárního nádoru s propagací do thalamu (obr. 3A). Neurochirurgická operace již nebyla indikována. Pacient následně podstoupil stereotaktickou radioterapii v celkové dávce 36 Gy. Na kontrolním MRI zůstal rozsah tumorózní expanze hypofýzy stacionární, ale objevila se další solitární metastáza v oblasti levé inzuly (obr. 3B). Pacient umírá za 3 měsíce od operace pro celkovou progresi základního onemocnění.
Image 3. A. MRI hypofýzy (T1 vážené sagitální skeny s kontrastní látkou). Stav po transfenoidální operaci. Progrese velikosti tumorózní expanze. B. MRI hypofýzy (T1 vážené axiální skeny s kontrastní látkou). Stav po radioterapii. Supraselární tumorózní expanze, menší tumorózní ložisko v oblasti inzuly vlevo. 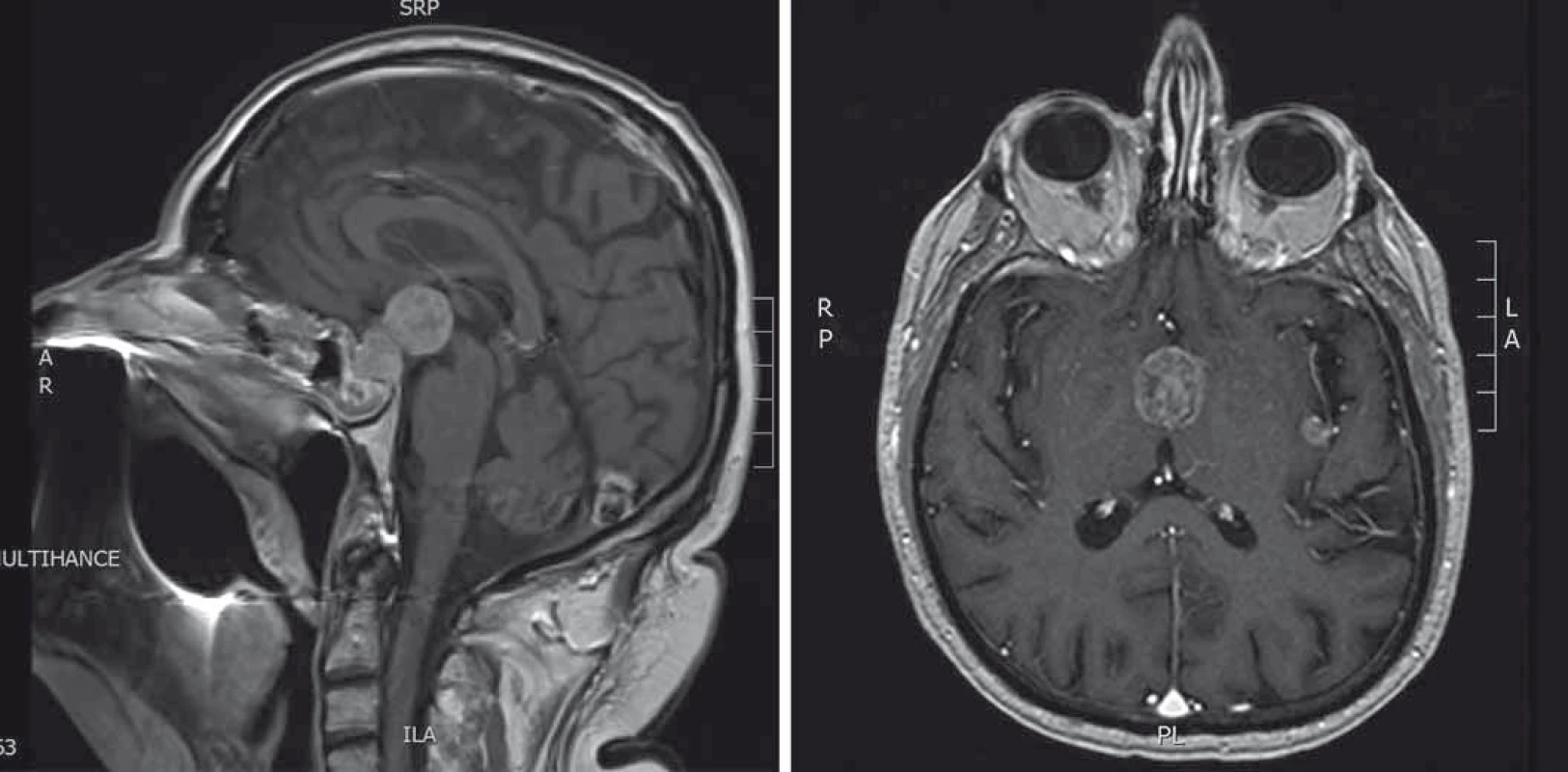
Kazuistika 2
Žena ve věku 70 let vyšetřována pro narůstající únavový syndrom, nechutenství, profuzní pocení, rozvoj polyurie a polydipsie. Příjem tekutin dosahoval až 10 l denně. Hypernatremie (151 mmol/l, norma 136–145 mmol/l), hyperchloremie (116 mmol/l, norma 98–107 mmol/l) a úprava po aplikaci desmopresinu (Minirin®) potvrdily diagnózu diabetu insipidu. V klinickém nálezu dominovala generalizovaná lymfadenopatie. Pozitronová emisní tomografie potvrzuje přítomnost nádorové viabilní tkáně v lymfatických uzlinách a ve skeletu. Následná ultrasonografie prsu naznačuje diagnózu inflamatorního karcinomu prsu, která je poté histologicky verifikována. MRI vyšetření mozku odhaluje intra-a supraselární tumorózní infiltraci tvaru přesýpacích hodin s infiltrací infundibula, která dosahuje spodiny III. komory mozkové (obr. 4). Endokrinologické vyšetření prokazuje panhypopituitarizmus a centrální diabetes insipidus. Vzhledem k obtížné spolupráci není pacientka schopná podstoupit vyšetření počítačovým perimetrem. Na základě radiologického a klinického stavu byla stanovena diagnóza metastatického postižení hypofýzy. Vzhledem k pokročilosti onemocnění nebyla indikována neurochirurgická intervence a pacientka podstoupila paliativní radioterapii mozku v celkové dávce 30 Gy. Pacientka umírá za 2 měsíce od stanovení metastatického postižení hypofýzy.
V obou námi prezentovaných případech pacienti podepsali informovaný souhlas s publikováním jejich případu a obrazové dokumentace.
Image 4. MRI hypofýzy (T1 vážené sagitální skeny s kontrastní látkou). Selární tumorózní expanze tvaru přesýpacích hodin. 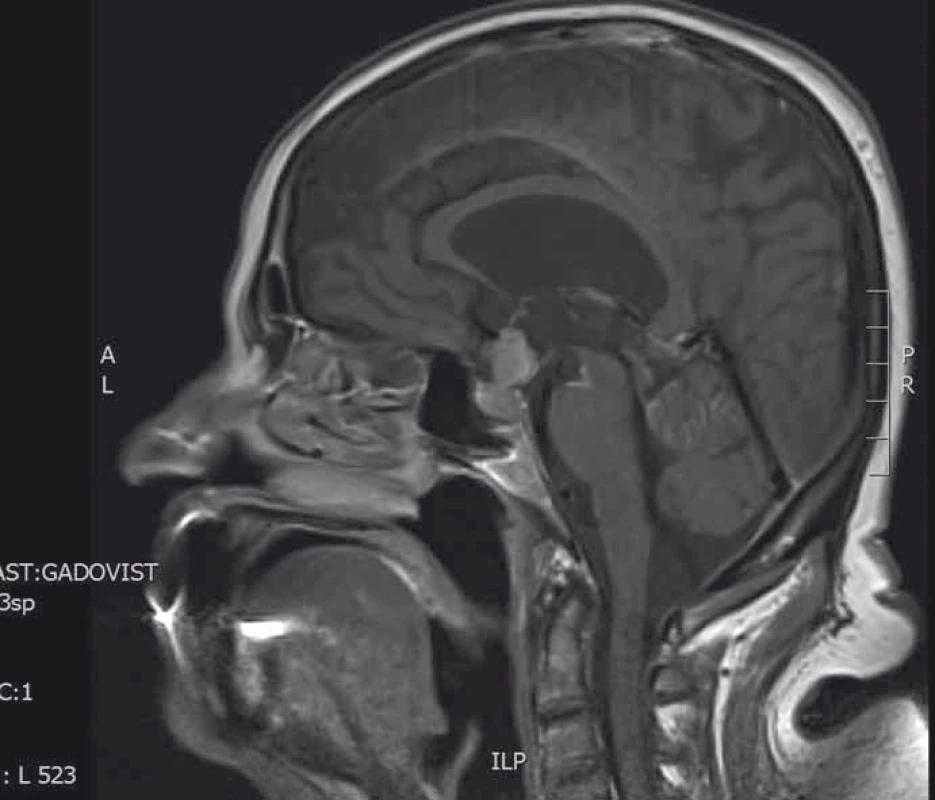
Metodika
Pomocí databáze PubMed jsme vyhledali pouze anglicky psané publikace zabývající se tematikou metastatického postižení hypofýzy od roku 1957 do roku 2016. Klíčová slova byla „pituitary metastasis“ nebo „hypophyseal metastasis“. Do studie byly zahrnuty pouze původní kazuistiky nebo série případů, přehledové články nebyly zařazeny do studie. Po zadání klíčových slov bylo vyhledáno 529 odkazů, stanovená kritéria splňovalo 131 publikací [2,11,13–141]. Všechny publikace byly vyhledány v plné podobě a podrobně vyhodnoceny.
Získaná data obsahovala věk, pohlaví, iniciální klinické a laboratorní příznaky v době stanovení metastatického postižení hypofýzy (diabetes insipidus, deficit adenohypofýzy, pseudoprolaktinemii, poruchu perimetru nebo zrakové ostrosti, parézu okohybných nervů a bolest hlavy), zvolenou terapii, délku přežití od stanovení metastatického postižení hypofýzy a histologický typ primárního nádoru.
Soubor byl zpracován pomocí deskriptivní statistiky. Do souboru nebyly zahrnuty dvě námi prezentované kazuistiky.
Výsledky
Zhodnoceno bylo 131 publikací, které dohromady poskytly údaje o 259 pa-cientech (tab. 1).
Četnost jednotlivých histologických typů nádoru metastazujících do tkáně hypofýzy je uvedena v tab. 2. Nejčastěji metastazoval karcinom prsu (24,6 %) a plic (23,8 %).
Průměrný věk, věkové rozpětí, pohlaví, iniciální příznaky, zvolenou léčebnou modalitu a dobu přežití od stanovení diagnózy metastatického postižení hypofýzy uvádí tab. 3.
Table 1. Přehled publikovaných prací metastatického postižení hypofýzy. 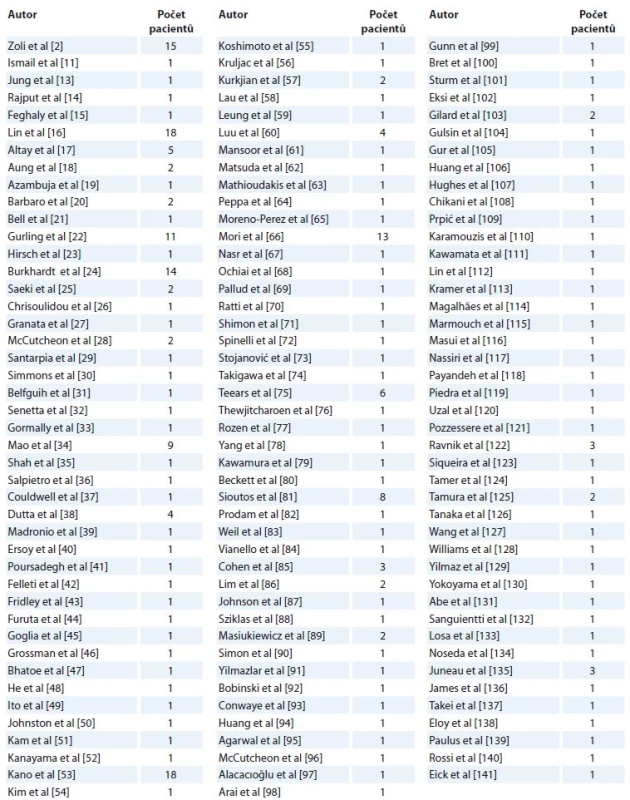
Table 2. Histologický přehled a četnost metastazujících nádorů. 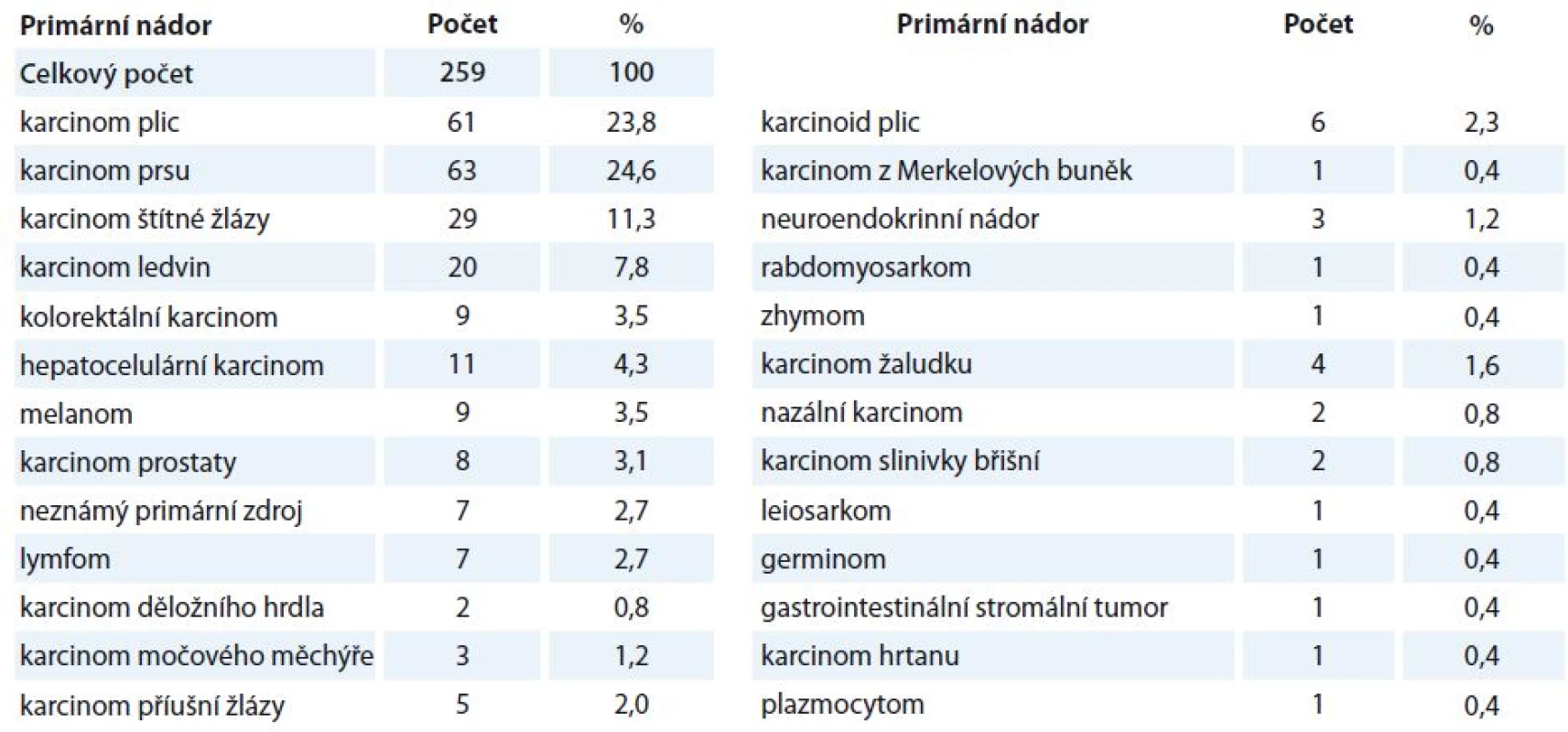
Table 3. Přehled demografických dat, klinických příznaků, zvolené terapie a délky přežití. 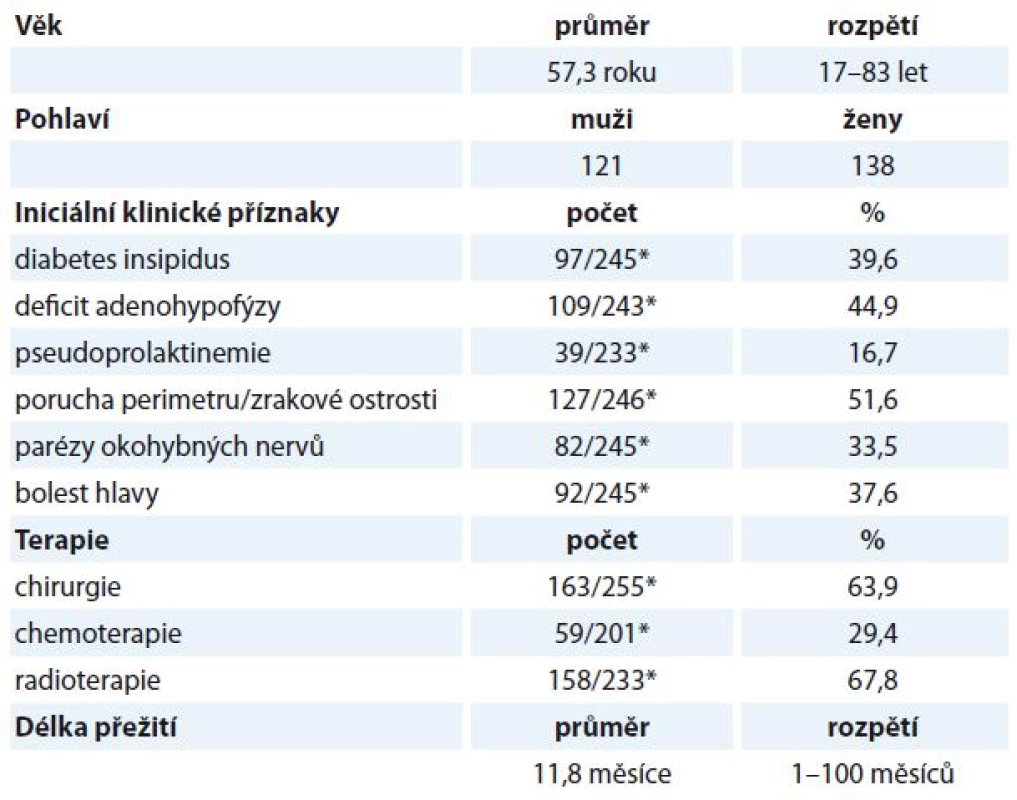
*počet pacientů se zjištěnými klinickými příznaky/počet studií s dostupnými údaji Diskuze
Autoři předkládají dvě kazuistiky a systematický přehled literatury raritního metastatického postižení hypofýzy u pacientů s generalizovaným nádorovým onemocněním. V prvním případě se jednalo o muže s generalizací spinocelulárního karcinomu plic. Ve druhém případě šlo o ženu s metastatickým karcinomem prsu. V obou případech byl iniciálním příznakem centrální diabetes insipidus. Nejčastěji metastazujícími nádory do hypofýzy jsou karcinomy prsu (24,6 %), karcinom plic (23,8 %) a karcinom štítné žlázy (11,3 %). Nejfrekventovanějšími iniciálními příznaky jsou projevy diabetu insipidu, zhoršení vizu a porušená endokrinní funkce předního laloku hypofýzy.
Charakteristickým klinickým příznakem pro metastatické postižení hypofýzy je centrální diabetes insipidus, který se projevuje hypotonickou polyurií a polydypsií způsobenou nedostatečnou sekrecí antidiuretického hormonu zadním lalokem hypofýzy [13,142]. Tento syndrom se vyskytuje s incidencí 39,6 %. Aby došlo k vyjádření klinických příznaků cDI, je nutná destrukce více než 50 % supraopticko-hypotalamického traktu nebo většiny zadního laloku hypofýzy [143]. Většina nádoru metastaticky postihuje zadní lalok hypofýzy s četností až 85 %. Vysvětluje se to zejména způsobem cévního zásobení zadního laloku hypofýzy. Neurohypofýza je vyživována přímo systémovým krevním zásobením, a tím se liší od adenohypofýzy, která je zásobena nepřímo cestou portálního řečiště [144]. Diabetes insipidus se vyskytuje jako průvodní příznak pouze u 1 % pacientů postižených adenomem hypofýzy, a proto je důležitým symptomem k odlišení adenomu od metastatického postižení hypofýzy [3,4,6,145]. Metastatické postižení předního laloku je méně časté a může být způsobeno cestou portálního krevního řečiště, přímým prorůstáním ze zadního laloku nebo šířením z baze lební [14]. Klinickým projevem je různě vyjádřený hypopituitarizmus. Karcinomy prsu tvoří výjimku v preferenci metastazovat do předního laloku hypofýzy. Tato skutečnost souvisí s tím, že prostředí adenohypofýzy bohaté na hormony, resp. prolaktin, podporuje růst nádorových buněk karcinomu prsu [10]. Ostatní příznaky jsou již méně specifické pro metastatické postižení. Patří sem poruchy zraku, parézy okohybných nervů, bolest hlavy, nauzea, zvracení, hyperprolaktinemie, nechutenství, úbytek na váze nebo různě vyjádřená porucha vědomí [4]. Feghaly et al publikovali ztrátu libida jako prvotní projev metastatického postižení hypofýzy [15].
Předoperační odlišení adenomu od metastázy hypofýzy zůstává velmi obtížné a neexistují jednoznačná radiologická kritéria, která by to umožnila. Většina metastáz je příliš malá na to, aby způsobily klinické nebo radiologické příznaky [12]. Prostá skiaskopie lebky není dostatečně specifická a pouze nás může upozornit na přítomnost patologického děje v oblasti tureckého sedla. K příznakům patří zejména rozšíření, sklerotizace nebo destrukce spodiny tureckého sedla [7,10]. Mnohem cennější informace nám přináší vyšetření počítačovou tomografií (CT), resp. vyšetření MRI. CT vyšetření obvykle prokazuje izodenzní nebo hyperdenzní útvar, který se homogenně nebo nehomogenně (hemoragie, cystická degenerace nebo nekrózy) sytí po podání kontrastní látky [4]. Nejčastějšími nálezy u metastatického postižení hypofýzy při MRI vyšetření jsou ztluštění stopky hypofýzy, ztráta hypersignality neurohypofýzy, izosignalita na T1 i T2 vážených skenech, invaze do kavernózního splavu, sutkovitý tvar nebo zaškrcení tumoru v místě diafragmatického hiátu, infiltrace hypotalamu nebo optického nervu, zvýšené sycení tvrdé pleny mozkové a sklerotické změny v okolí tureckého sedla [2,9,11]. Habu et al publikovali retrospektivní dotazníkovou studii s kohortou 185 pacientů s metastatickým postižením hypofýzy a nejtypičtějším nálezem byla ztráta hypersignality neurohypofýzy (82,3 %) a ztluštění stopky hypofýzy [9]. Hypersignalita neurohypofýzy je vysvětlována vyšší koncentrací fosfolipidů nebo přítomností sekrečních granul v pituicitech. A proto by ztráta hypersignality na T1 vážených skenech mohla být charakteristickým znakem metastatického postižení zadního laloku hypofýzy [13].
Terapie metastatického postižení je multimodální a skládá se z chirurgie, radioterapie, chemoterapie a hormonální terapie. Chirurgická terapie zahrnuje transnazální transsfenoidální přístup (endoskopická nebo mikroskopická technika) nebo přístup z kraniotomie. Volba přístupu závisí na vyjádřených příznacích a uložení tumoru (supraselární šíření do kavernózního splavu, subfrontálně). Na našem pracovišti při transnazálním transsfenoidálním přístupu využíváme endoskopickou techniku. Chirurgická terapie se využívá samostatně nebo v kombinaci s radioterapií a umožňuje odebrání bioptického vzorku a dekompresi nervových struktur [146]. Většina studií potvrzuje po operačním výkonu zlepšení zraku a zmírnění bolesti hlavy [2,4,10,11,146]. Ostatní příznaky jako diplopie nebo panhypopituitarizmus zůstávají chirurgickou terapií neovlivněny. Zoli et al publikovali soubor 15 pacientů operovaných pro metastatické postižení hypofýzy. U 12 pacientů došlo ke zlepšení zraku, u pěti ustoupily bolesti hlavy, ale u žádného z operovaných nedošlo ke zlepšení hormonální funkce předního laloku hypofýzy [2]. Jak potvrzuje většina studií, chirurgická terapie sama nebo v kombinaci s radioterapií nevede k celkovému prodloužení přežití, ale zmírňuje příznaky a zlepšuje kvalitu života [2,4,7,147]. Lin et al dokonce ve své práci uvádějí, že u pacientů, kteří absolvovali lokální terapie, dochází k signifikantnímu prodloužení přežití [16]. Radioterapie nebo radiochirurgie – sama o sobě nebo v kombinaci s chemoterapií – bývá iniciální terapií zejména u pacientů s pokročilým metastatickým postižením [4]. Limitací radioterapie jsou zářením indukované nežádoucí účinky. Habu et al uvádějí frekvenci komplikací 6,7 %. Mezi nejčastější komplikace patří zvracení, hypopituitarizmus, diabetes insipidus a poškození zraku [9].
Prognóza i přes veškerou terapii zůstává špatná a závisí na typu onkologického onemocnění. K metastatickému postižení hypofýzy dochází většinou v pokročilých stadiích onemocnění [7]. Délka přežití se pohybuje v rozmezí 1–100 měsíců od stanovení metastatického postižení hypofýzy. Pacienti starší 70 let a s karcinomem plic mají významně kratší dobu přežití oproti pacientům mladším a s jiným typem nádoru [4,9]. Nejdelší publikovaná doba přežití je více než 8 let od diagnózy metastatického postižení hypofýzy [53].
Závěr
Metastatické postižení hypofýzy se v klinické praxi vyskytuje zřídka a tvoří pouze 1 % z operovaných nádorů hypofýzy. Charakteristickým prvotním příznakem je diabetes insipidus. Terapie metastatického postižení hypofýzy kombinuje chirurgii, radioterapii, chemoterapii a hormonální léčbu. Chirurgická terapie sama nebo v kombinaci s radioterapií nevede k celkovému prodloužení přežití, ale zmírňuje příznaky a zlepšuje kvalitu života. Celková prognóza závisí na typu nádoru a věku nemocného. I přes veškerou dostupnou terapii zůstává průměrné přežití kolem 12 měsíců od stanovení diagnózy metastatického postižení hypofýzy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Vlastimil Novák
Neurochirurgická klinika
LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
e-mail: vlastimil.novak@fnol.cz
Obdrženo: 13. 1. 2017
Přijato: 4. 4. 2017
Sources
1. Benjamin L. A cancer case. Virchows Arch Path Anat 1857; 12 : 566–569. doi: 10.1007/BF01950081.
2. Zoli M, Mazzatenta D, Faustini-Fustini M et al. Pituitary metastases: role of surgery. World Neurosurg 2013; 79 (2): 327–330. doi: 10.1016/j.wneu.2012.03.018.
3. McCormick PC, Post KD, Kandji AD et al. Metastatic carcinoma to the pituitary gland. Br J Neurosurg 1989; 3 (1): 71–79.
4. Komninos J, Vlassopoulou V, Protopapa D et al. Tumors metastatic to the pituitary gland: case report and literature review. J Clin Endocrinol Metab 2004; 89 (2): 574–580.
5. Committee of the Brain Tumor Registry of Japan. Report of Brain Tumor Registry of Japan (1984–2000). Neurol Med Chir (Tokyo) 2003; 43 : 1–111.
6. Max MB, Deck MD, Rottenberg DA. Pituitary metastasis: incidence in cancer patients and clinical differentiation from pituitary adenoma. Neurology 1981; 31 (8): 998–1002.
7. Fassett DR, Couldwell WT. Metastases to the pituitary gland. Neurosurg Focus 2004; 16 (4): E8.
8. Ntyonga-Pono MP, Thomopoulos P, Luton JP. Pituitary metastases. 3 cases. Presse Med 1999; 28 (29): 1567–1571.
9. Habu M, Tokimura H, Hirano H et al. Pituitary metastases: current practice in Japan. J Neurosurg 2015; 123 (4): 998–1007. doi: 10.3171/2014.12.JNS14870.
10. Morita A, Meyer FB, Laws ER Jr. Symptomatic pituitary metastases. J Neurosurg 1998; 89 (1): 69–73.
11. Ismail E, Issam L, Hamid M. Pituitary metastasis of rhabdomyosarcoma: a case report and review of the literature. J Med Case Rep 2014; 8 : 144. doi: 10.1186/1752-1947-8-144.
12. Sogani J, Yang W, Lavi E et al. Sellar collision tumor involving metastatic lung cancer and pituitary adenoma: radiologic-pathologic correlation and review of the literature. Clin Imaging 2014; 38 (3): 318–321. doi: 10.1016/j.clinimag.2013.12.010.
13. Jung JW, Noh GY, Lee TH et al. Polyuria and polydipsia in a patient with non-small-cell lung cancer. Clin Lung Cancer 2007; 8 (9): 565–567. doi: 10.3816/CLC.2007.n. 044.
14. Rajput R, Bhansali A, Dutta P et al. Pituitary metastasis masquerading as non-functioning pituitary adenoma in a woman with adenocarcinoma lung. Pituitary 2006; 9 (2): 155–157.
15. Feghaly J, Astras G. Diagnosis and management of isolated pituitary metastasis from adenocarcinoma of unknown origin presenting as loss of libido. BMJ Case Rep 2015; 2015: pii: bcr2014208735. doi: 10.1136/bcr-2014-208735.
16. Lin CY, Huang WK, Chung FT et al. Prognostic factors in cancer patients with symptomatic pituitary metastasis: a clinical case study. Anticancer Res 2015; 35 (2): 983–987.
17. Altay T, Krisht KM, Couldwell WT. Sellar and parasellar metastatic tumors. Int J Surg Oncol 2012; 2012 : 647256. doi: 10.1155/2012/647256.
18. Aung TH, Po YC, Wong WK. Hepatocellular carcinoma with metastasis to the skull base, pituitary gland, sphenoid sinus, and cavernous sinus. Hong Kong Med J 2002; 8 (1): 48–51.
19. Azambuja E, Piccart MJ, Awada A. Long-term survival in pituitary metastasis from breast cancer. Breast 2006; 15 (3): 446–447.
20. Barbaro D, Desogus N, Boni G. Pituitary metastasis of thyroid cancer. Endocrine 2013; 43 (3): 485–493. doi: 10.1007/s12020-012-9806-9.
21. Bell CD, Kovacs K, Horvath E et al. Papillary carcinoma of thyroid metastatic to the pituitary gland. Arch Pathol Lab Med 2001; 125 (7): 935–938.
22. Gurling KJ, Scott GB, Baron DN. Metastases in pituitary tissue removed at hypophysectomy in women with mammary carcinoma. Br J Cancer 1957; 11 (4): 519–522.
23. Hirsch D, Benbassat CA, Drozd T et al. Pituitary and bilateral adrenal enlargement: an unusual presentation of hepatocellular carcinoma. J Endocrinol Invest 2005; 28 (5): 454–458.
24. Burkhardt T, Henze M, Kluth LA et al. Surgical management of pituitary metastases. Pituitary 2016; 19 (1): 11–18. doi: 10.1007/s11102-015-0676-z.
25. Saeki N, Murai H, Kubota M et al. Oedema along the optic tracts due to pituitary metastasis. Br J Neurosurg 2001; 15 (6): 523–526.
26. Chrisoulidou A, Pazaitou-Panayiotou K, Flaris N et al. Pituitary metastasis of follicular thyroid carcinoma. Horm Res 2004; 61 (4): 190–192.
27. Granata A, Viola G, Privitera C et al. Smoking, polyuria and impaired vision. Clin Nephrol 2007; 67 (1): 49–52.
28. McCutcheon IE, Waguespack SG, Fuller GN et al. Metastatic melanoma to the pituitary gland. Can J Neurol Sci 2007; 34 (3): 322–327.
29. Santarpia L, Gagel RF, Sherman SI et al. Diabetes insipidus and panhypopituitarism due to intrasellar metastasis from medullary thyroid cancer. Head Neck 2009; 31 (3): 419–423. doi: 10.1002/hed.20911.
30. Simmons JD, Pinson TW, Donnellan KA et al. A rare case of a 1.5 mm papillary microcarcinoma of the thyroid presenting with pituitary metastasis. Am Surg 2010; 76 (3): 336–338.
31. Belfquih H, Akhaddar A, Elmoustarchid B et al. Pituitary metastasis revealed by a chiasma syndrome. Headache 2012; 52 (5): 820–821. doi: 10.1111/j.15264610.2010. 01805.x.
32. Senetta R, Castellano I, Garbossa D et al. Pituitary metastasis of an unknown neuroendocrine breast carcinoma mimicking a pituitary adenoma. Pathology 2013; 45 (4): 422–424. doi: 10.1097/PAT.0b013e328360dfd1.
33. Gormally JF, Izard MA, Robinson BG et al. Pituitary metastasis from breast cancer presenting as diabetes insipidus. BMJ Case Rep 2014; pii: bcr2014203683. doi: 10.1136/bcr-2014-203683.
34. Mao JF, Zhang JL, Nie M et al. Diabetes insipidus as the first symptom caused by lung cancer metastasis to the pituitary glands: clinical presentations, diagnosis, and management. J Postgrad Med 2011; 57 (4): 302–306. doi: 10.4103/0022-3859.90080.
35. Shah N, Cavanagh Y, Shaaban H et al. An unusual initial presentation of hepatocellular carcinoma as a sellar mass. J Nat Sci Biol Med 2015; 6 (2): 471–474. doi: 10.4103/0976-9668.160045.
36. Salpietro FM, Romano A, Alafaci C et al. Pituitary metastasis from uterine cervical carcinoma: a case presenting as diabetes insipidus. Br J Neurosurg 2000; 14 (2): 156–159.
37. Couldwell WT, Chandrasoma PT, Weiss MH. Pituitary gland metastasis from adenocarcinoma of the prostate. Case report. J Neurosurg 1989; 71 (1): 138–140.
38. Dutta P, Bhansali A, Shah VN et al. Pituitary metastasis as a presenting manifestation of silent systemic malignancy: a retrospective analysis of four cases. Indian J Endocrinol Metab 2011; 15 (Suppl 3): S242–S245. doi: 10.4103/2230-8210.84875.
39. Madronio EB, Lantion-Ang FL. The tale of two tumours: an undiagnosed case of papillary thyroid carcinoma. BMJ Case Rep 2011; 2011: pii: bcr0820114604. doi: 10.1136/bcr.08.2011.4604.
40. Ersoy R, Topaloglu O, Aydin C et al. Pituitary metastasis of breast cancer confirmed by fluorine-18 fluorodeoxyglucose positron emission tomography: a case report. J Endocrinol Invest 2007; 30 (6): 532–533.
41. Poursadegh Fard M, Borhani Haghighi A, Bagheri MH. Breast cancer metastasis to pituitary infandibulum. Iran J Med Sci 2011; 36 (2): 141–144.
42. Feletti A, Marton E, Rossi S et al. Pituitary metastasis of Merkel cell carcinoma. J Neurooncol 2010; 97 (2): 295–299. doi: 10.1007/s11060-009-0025-z.
43. Fridley J, Adams G, Rao V et al. Small cell lung cancer metastasis in the pituitary gland presenting with seizures and headache. J Clin Neurosci 2011; 18 (3): 420–422. doi: 10.1016/j.jocn.2010.05.006.
44. Furuta S, Hatakeyama T, Zenke K et al. Pituitary metastasis from carcinoma of the urinary bladder mimicking pituitary apoplexy – case report. Neurol Med Chir (Tokyo) 1999; 39 (2): 165–168.
45. Goglia U, Ferone D, Sidoti M et al. Treatment of a pituitary metastasis from a neuroendocrine tumour: case report and literature review. Pituitary 2008; 11 (1): 93–102.
46. Grossman R, Maimon S, Levite R et al. Multimodal treatment of hemorrhagic pituitary metastasis as first manifestation of renal cell carcinoma. World Neurosurg 2013; 79 (5–6): 798.E1–5. doi: 10.1016/j.wneu.2012.09.006.
47. Bhatoe HS, Badwal S, Dutta V et al. Pituitary metastasis from medullary carcinoma of thyroid: case report and review of literature. J Neurooncol 2008; 89 (1): 63–67. doi: 10.1007/s11060-008-9586-5.
48. He W, Chen F, Dalm B et al. Metastatic involvement of the pituitary gland: a systematic review with pooled individual patient data analysis. Pituitary 2015; 18 (1): 159–168. doi: 10.1007/s11102-014-0552-2.
49. Ito I, Ishida T, Hashimoto T et al. Hypopituitarism due to pituitary metastasis of lung cancer: case of a 21-year-old man. Intern Med 2001; 40 (5): 414–417.
50. Johnston PC, Black NR, McIlroy J et al. Hypopituitarism as the presenting feature of bronchogenic carcinoma with metastases to the pituitary gland. Indian J Endocrinol Metab 2013; 17 (1): 167–169. doi: 10.4103/2230-8210.107876.
51. Kam J, Kam J, Mann GB et al. Solitary pituitary metastasis from HER2-positive breast cancer. Asia Pac J Clin Oncol 2017; 13 (2): e181–e184. doi: 10.1111/ajco.12353.
52. Kanayama S, Matsuno A, Nagashima T et al. Symptomatic pituitary metastasis of malignant thymoma. J Clin Neurosci 2005; 12 (8): 953–956.
53. Kano H, Niranjan A, Kondziolka D et al. Stereotactic radiosurgery for pituitary metastases. Surg Neurol 2009; 72 (3): 248–255. doi: 10.1016/j.surneu.2008.06. 003.
54. Kim YH, Lee BJ, Lee KJ et al. A case of pituitary metastasis from breast cancer that presented as left visual disturbance. J Korean Neurosurg Soc 2012; 51 (2): 94–97. doi: 10.3340/jkns.2012.51.2.94.
55. Koshimoto Y, Maeda M, Naiki H et al. MR of pituitary metastasis in a patient with diabetes insipidus. AJNR Am J Neuroradiol 1995; 16 (Suppl 4): 971–974.
56. Kruljac I, Cerina V, Pećina HI et al. Pituitary metastasis presenting as ischemic pituitary apoplexy following heparin-induced thrombocytopenia. Endocr Pathol 2012; 23 (4): 264–267. doi: 10.1007/s12022-012-92 24-9.
57. Kurkjian C, Armor JF, Kamble R et al. Symptomatic metastases to the pituitary infundibulum resulting from primary breast cancer. Int J Clin Oncol 2005; 10 (3): 191–194.
58. Lau G, Tan SY, Chiang G et al. Bronchioloalveolar carcinoma with metastasis to the pituitary gland: a case report. J Clin Pathol 1998; 51 (12): 931–934.
59. Leung GK, Chow WS, Tan KC et al. Metastatic melanoma of the pituitary gland. Case report. J Neurosurg 2003; 99 (5): 913–915.
60. Luu ST, Billing K, Crompton JL et al. Clinicopathological correlation in pituitary gland metastasis presenting as anterior visual pathway compression. J Clin Neurosci 2010; 17 (6): 790–793. doi: 10.1016/j.jocn.2009.09.044.
61. Mansoor Q, Carey PE, Adams W. A rare ophthalmic presentation of pituitary metastases. BMJ Case Rep 2012; 2012: pii: bcr1120115145. doi: 10.1136/bcr.11.2011.5145.
62. Matsuda R, Chiba E, Kawana I et al. Central diabetes insipidus caused by pituitary metastasis of lung cancer. Intern Med 1995; 34 (9): 913–918.
63. Mathioudakis N, Quinones-Hinojosa A, Salvatori R et al. A lifelong smoker with hypopituitarism: rethinking the hypothesis of a tumor in the hypophysis. Case Rep Med 2012; 2012 : 853568. doi: 10.1155/2012/853568.
64. Peppa M, Papaxoinis G, Xiros N et al. Panhypopituitarism due to metastases to the hypothalamus and the pituitary resulting from primary breast cancer: a case report and review of the literature. Clin Breast Cancer 2009; 9 (4): E4–E7. doi: 10.3816/CBC.2009.n.047.
65. Moreno-Perez O, Peiró FM, López P et al. An isolated pituitary metastasis as presentation of a differentiated hepatocellular carcinoma mimicking a nonfunctioning macroadenoma. J Endocrinol Invest 2007; 30 (5): 428–433.
66. Mori Y, Kobayashi T, Shibamoto Y. Stereotactic radiosurgery for metastatic tumors in the pituitary gland and the cavernous sinus. J Neurosurg 2006; 105 (Suppl): 37–42.
67. Nasr C, Mason A, Mayberg M et al. Acromegaly and somatotroph hyperplasia with adenomatous transformation due to pituitary metastasis of a growth hormone-releasing hormone-secreting pulmonary endocrine carcinoma. Clin Endocrinol Metab 2006; 91 (12): 4776–4780.
68. Ochiai H, Nakano S, Goya T et al. Pituitary metastasis of thyroid follicular adenocarcinoma – case report. Neurol Med Chir (Tokyo) 1992; 32 (11): 851–853.
69. Pallud J, Nataf F, Roujeau T et al. Intraventricular haemorrhage from a renal cell carcinoma pituitary metastasis. Acta Neurochir (Wien) 2005; 147 (9): 1003–1004.
70. Ratti M, Passalacqua R, Poli R et al. Pituitary gland metastasis from rectal cancer: report of a case and literature review. Springerplus 2013; 2 : 467. doi: 10.1186/2193-1801-2-467.
71. Shimon I, Hadani M, Nass D et al. Malignant bronchial carcinoid tumor metastatic to the pituitary in a thyroid carcinoma patient: successful treatment with surgery, radiotherapy and somatostatin analog. Pituitary 2004; 7 (1): 51–57.
72. Spinelli GP, Lo Russo G, Miele E et al. Breast cancer metastatic to the pituitary gland: a case report. World J Surg Oncol 2012; 10 : 137. doi: 10.1186/1477-7819-10-137.
73. Stojanović M, Pekić S, Doknić M et al. What‘s in the Image? Pituitary Metastasis from Papillary Carcinoma of the Thyroid: A Case Report and a Comprehensive Review of the Literature. Eur Thyroid J 2013; 1 (4): 277–284. doi: 10.1159/000343910.
74. Takigawa T, Matsumaru Y, Hayakawa M et al. Transarterial embolization with use of lipiodol and gelatin sponge for active nasal bleeding from hepatocellular carcinoma metastasis in the pituitary gland. Neurol Med Chir (Tokyo) 2011; 51 (8): 592–595.
75. Teears RJ, Silverman EM. Clinicopathologic review of 88 cases of carcinoma metastatic to the putuitary gland. Cancer 1975; 36 (1): 216–220.
76. Thewjitcharoen Y, Shuangshoti S, Lerdlum S et al. Colorectal cancer manifesting with metastasis to prolactinoma: report of a case involving symptoms mimicking pituitary apoplexy. Intern Med 2014; 53 (17): 1965–1969.
77. Rozen WM, Mann GB. Angiosarcoma arising in an unirradiated breast with subsequent pituitary metastasis. Clin Breast Cancer 2007; 7 (10): 811–813.
78. Yang L, Yu SY, Hu GY. Pituitary metastasis from a renal cell carcinoma progressed after sorafenib treatment. Chin J Cancer 2013; 32 (6): 353–356. doi: 10.5732/cjc.012.10184.
79. Kawamura J, Tsukamoto K, Yamakawa K et al. Diabetes insipidus due to pituitary metastasis from bladder cancer. Urol Int 1991; 46 (2): 217–220.
80. Beckett DJ, Gama R, Wright J et al. Renal carcinoma presenting with adrenocortical insufficiency due to a pituitary metastasis. Ann Clin Biochem 1998; 35 (Pt 4): 542–544.
81. Sioutos P, Yen V, Arbit E. Pituitary gland metastases. Ann Surg Oncol 1996; 3 (1): 94–99.
82. Prodam F, Pagano L, Belcastro S et al. Pituitary metastases from follicular thyroid carcinoma. Thyroid 2010; 20 (7): 823–830. doi: 10.1089/thy.2009.0256.
83. Weil RJ. Pituitary metastasis. Arch Neurol 2002; 59 (12): 1962–1963.
84. Vianello F, Mazzarotto R, Taccaliti A et al. Follicular thyroid carcinoma with metastases to the pituitary causing pituitary insufficiency. Thyroid 2011; 21 (8): 921–925. doi: 10.1089/thy.2010.0335.
85. Cohen MM, Lessell S. Chiasmal syndrome due to metastasis. Arch Neurol 1979; 36 (9): 565–567. doi: 10.1001/ archneur.1979.00500450059010.
86. Lim W, Lim DS, Chng CL et al. Thyroid carcinoma with pituitary metastases: 2 case reports and literature review. Case Rep Endocrinol 2015; 2015 : 252157. doi: 10.1155/ 2015/252157.
87. Johnson PM, Atkins HL. Functioning metastasis of thyroid carcinoma in the sella turcica. J Clin Endocrinol Metab 1965; 25 : 1126–1130.
88. Sziklas JJ, Mathews J, Spencer RP et al. Thyroid carcinoma metastatic to pituitary. J Nucl Med 1985; 26 (9): 1097.
89. Masiukiewicz US, Nakchbandi IA, Stewart AF et al. Papillary thyroid carcinoma metastatic to the pituitary gland. Thyroid 1999; 9 (10): 1023–1027.
90. Simon N, Quyyumi SA, Rothman JG. Follicular thyroid cancer presenting as a sellar mass: case report and review of the literature. Endocr Pract 2004; 10 (1): 62–66.
91. Yilmazlar S, Kocaeli H, Cordan T. Sella turcica metastasis from follicular carcinoma of thyroid. Neurol Res 2004; 26 (1): 74–78.
92. Bobinski M, Greco CM, Schrot RJ. Giant intracranial medullary thyroid carcinoma metastasis presenting as apoplexy. Skull Base 2009; 19 (5): 359–362. doi: 10.1055/s-0029-1220202.
93. Conway A, Wiernik A, Rawal A et al. Occult primary medullary thyroid carcinoma presenting with pituitary and parotid metastases: case report and review of the literature. Endocr Pathol 2012; 23 (2): 115–122. doi: 10.1007/s12022-012-9200-4.
94. Huang MC, Lee LS, Ho DM et al. A metastatic pituitary carcinoid tumor successfully treated with gamma knife radiosurgery. Zhonghua Yi Xue Za Zhi (Taipei) 2001; 64 (7): 414–418.
95. Agarwal KK, Sharma P, Singla S et al. A rare case of non-small cell lung cancer metastasizing to the pituitary gland: detection with (18) F-FDG PET-CT. Clin Nucl Med 2014; 39 (5): e318–e319. doi: 10.1097/RLU. 0b013e31828da679.
96. McCutcheon IE, Kitagawa RH, Sherman SI et al. Adenocarcinoma of the salivary gland metastatic to the pituitary gland: case report. Neurosurgery 2001; 48 (5): 1161–1165.
97. Alacacioğlu A, Oztop I, Fidan F et al. Diabetes insipidus caused by pituitary gland metastasis accompanied by iris metastasis of small cell lung cancer: case presentation and review of the literature. Tumori 2008; 94 (5): 765–768.
98. Arai A, Morishita A, Hanada Y et al. Solitary metastatic tumor within the optic chiasm – case report. Neurol Med Chir (Tokyo) 2010; 50 (2): 158–161.
99. Gunn GB, Villa RD, Sedler RR et al. Nasopharyngeal carcinoma metastasis to the pituitary gland: a case report and literature review. J Neurooncol 2004; 68 (1): 87–90.
100. Bret P, Jouvet A, Madarassy G et al. Visceral cancer metastasis to pituitary adenoma: report of two cases. Surg Neurol 2001; 55 (5): 284–290.
101. Sturm I, Kirschke S, Krahl D et al. Panhypopituitarism in a patient with breast cancer. Onkologie 2004; 27 (5): 480–482.
102. Eksi MS, Hasanov T, Yilmaz B et al. Isolated metastasis of breast cancer to the pituitary gland. Neurol India 2014; 62 (1): 70–71. doi: 10.4103/0028-3886.128322.
103. Gilard V, Alexandru C, Proust F et al. Pituitary metastasis: is there still a place for neurosurgical treatment? J Neurooncol 2016; 126 (2): 219–224. doi: 10.1007/s11060-015-1967-y.
104. Gulsin GS, Jacobs ML, Gohil S et al. Competing interests in a lung cancer with metastasis to the pituitary gland: syndrome of inappropriate ADH secretion versus diabetes insipidus. Oxf Med Case Reports 2016; 2016 (6): 125–129. doi: 10.1093/omcr/omw044.
105. Gur C, Lalazar G, Salmon A et al. Metastatic pancreatic neuroendocrine tumor presenting as a pituitary space occupying lesion: a case report. Pituitary 2008; 11 (3): 293–297.
106. Huang YY, Lin SF, Dunn P et al. Primary pituitary lymphoma presenting as hypophysitis. Endocr J 2005; 52 (5): 543–549.
107. D Hughes J, Retzlaff A, Sims J et al. Adenoid Cystic Carcinoma Metastatic to the Pituitary: A Case Report and Discussion of Potential Diagnostic Value of Magnetic Resonance Elastography in Pituitary Tumors. World Neurosurg 2016; 91 : 669.e11-4. doi: 10.1016/j.wneu.2016.03. 044.
108. Chikani V, Lambie D, Russell A et al. Pituitary metastases from papillary carcinoma of thyroid: a case report and literature review. Endocrinol Diabetes Metab Case Rep 2013; 2013 : 130024. doi: 10.1530/EDM-13-0024.
109. Prpić M, Fröbe A, Zadravec D et al. Initial symptomatic pituitary metastasis in a patient with prostate foamy gland carcinoma: tailoring safe and effective therapy. Acta Clin Croat 2015; 54 (2): 243–248.
110. Karamouzis MV, Melachrinou M, Fratzoglou M et al. Hepatocellular carcinoma metastasis in the pituitary gland: case report and review of the literature. J Neurooncol 2003; 63 (2): 173–177.
111. Kawamata T, Harashima S, Kubo O et al. Intrasellar remote metastasis from adenoid cystic carcinoma of parotid gland: case report. Endocr J 2006; 53 (5): 659–663.
112. Lin EY, Hsieh CT, Lin CS et al. Keyhole surgery for isolated pituitary stalk metastatic tumors: a case report and review of the literature. Minim Invasive Neurosurg 2008; 51 (4): 222–224. doi: 10.1055/s-2008-1062742.
113. Kramer CK, Ferreira N, Silveiro SP et al. Pituitary gland metastasis from renal cell carcinoma presented as a non-functioning macroadenoma. Arq Bras Endocrinol Metabol 2010; 54 (5): 498–501.
114. Magalhães JF, Bacchin RP, Costa PS et al. Breast cancer metastasis to the pituitary gland. Arq Bras Endocrinol Metabol 2014; 58 (8): 869–872.
115. Marmouch H, Arfa S, Mohamed SC et al. An acute adrenal insufficiency revealing pituitary metastases of lung cancer in an elderly patient. Pan Afr Med J 2016; 23 : 34. doi: 10.11604/pamj.2016.23.34.8905.
116. Masui K, Yonezawa T, Shinji Y et al. Pituitary apoplexy caused by hemorrhage from pituitary metastatic melanoma: case report. Neurol Med Chir (Tokyo) 2013; 53 (10): 695–698.
117. Nassiri F, Cusimano M, Rotondo F et al. Neuroendocrine tumor of unknown origin metastasizing to a growth hormone-secreting pituitary adenoma. World Neurosurg 2012; 77 (1): 201.e9-201.e12. doi: 10.1016/j.wneu.2011.02.017.
118. Payandeh M, Sadeghi M, Sadeghi E et al. The Complete Response to Targeted Drugs Without Surgery or Radiotherapy: A Case of Pituitary Metastasis From Renal Cell Carcinoma. Acta Med Iran 2016; 54 (9): 617–619.
119. Piedra MP, Brown PD, Carpenter PC et al. Resolution of diabetes insipidus following gamma knife surgery for a solitary metastasis to the pituitary stalk. Case report. J Neurosurg 2004; 101 (6): 1053–1056.
120. Uzal MC, Kocak Z, Doganay L et al. Pituitary metastasis mimicking a macroadenoma from carcinoma of the larynx: a case report. Tumori 2001; 87 (6): 451–454.
121. Pozzessere D, Zafarana E, Buccoliero AM et al. Gastric cancer metastatic to the pituitary gland: a case report. Tumori 2007; 93 (2): 217–219.
122. Ravnik J, Smigoc T, Bunc G et al. Hypophyseal metastases: a report of three cases and literature review. Neurol Neurochir Pol 2016; 50 (6): 511–516. doi: 10.1016/j.pjnns.2016.08.007.
123. Siqueira PF, Mathez AL, Pedretti DB et al. Pituitary metastasis of lung neuroendocrine carcinoma: case report and literature review. Arch Endocrinol Metab 2015; 59 (6): 548–553. doi: 10.1590/2359-3997000000139.
124. Tamer G, Kartal I, Aral F et al. Pituitary infiltration by non-Hodgkin‘s lymphoma: a case report. J Med Case Rep 2009; 3 : 9293. doi: 10.1186/1752-1947-3-9293.
125. Tamura T, Kawamura Y, Ikeda K et al. Hepatocellular carcinoma metastasis to the brain mimicking primary pituitary tumor around the sella turcica. Clin J Gastroenterol 2013; 6 (4): 319–325. doi: 10.1007/s12328-013-0384-z.
126. Tanaka T, Hiramatsu K, Nosaka T et al. Pituitary metastasis of hepatocellular carcinoma presenting with panhypopituitarism: a case report. BMC Cancer 2015; 15 : 863. doi: 10.1186/s12885-015-1831-7. doi: 10.1186/s12885-015-1831-7.
127. Wang A, Carberry N, Solli E et al. Metastatic Mantle Cell Lymphoma to the Pituitary Gland: Case Report and Literature Review. Case Rep Oncol 2016; 9 (1): 25–32. doi: 10.1159/000443682.
128. Williams MD, Asa SL, Fuller GN. Medullary thyroid carcinoma metastatic to the pituitary gland: an unusual site of metastasis. Ann Diagn Pathol 2008; 12 (3): 199–203. doi: 10.1016/j.anndiagpath.2006.08.007.
129. Yılmaz H, Kaya M, Can M et al. Metastatic prostate adenocarcinoma presenting central diabetes insipidus. Case Rep Med 2012; 2012 : 452149. doi: 10.1155/2012/452149.
130. Yokoyama T, Yoshino A, Katayama Y et al. Metastatic pituitary tumor from renal cell carcinoma treated by fractionated stereotactic radiotherapy – case report. Neurol Med Chir (Tokyo) 2004; 44 (1): 47–52.
131. Abe T, Matsumoto K, Iida M et al. Malignant carcinoid tumor of the anterior mediastinum metastasis to a prolactin-secreting pituitary adenoma: a case report. Surg Neurol 1997; 48 (4): 389–394.
132. Sanguinetti CM, Marchesani F, Bichi-Secchi E et al. Neurogenic diabetes insipidus: an unusual clinical presentation of small cell lung cancer. Monaldi Arch Chest Dis 1993; 48 (2): 130–133.
133. Losa M, Grasso M, Giugni E et al. Metastatic prostatic adenocarcinoma presenting as a pituitary mass: shrinkage of the lesion and clinical improvement with medical treatment. Prostate 1997; 32 (4): 241–245.
134. Noseda A, Louis O, Mockel J et al. Diabetes insipidus from metastatic oat cell carcinoma: recovery after brain irradiation. Am J Med Sci 1985; 289 (1): 27–30.
135. Juneau P, Schoene WC, Black P. Malignant tumors in the pituitary gland. Arch Neurol 1992; 49 (5): 555–558.
136. James RL Jr, Arsenis G, Stoler M et al. Hypophyseal metastatic renal cell carcinoma and pituitary adenoma. Case report and review of the literature. Am J Med 1984; 76 (2): 337–340.
137. Takei H, Buckleair L, Goodman JC et al. Intraoperative cytologic diagnosis of symptomatic carcinoma (pulmonary small cell carcinoma) metastatic to the pituitary gland: a case report. Acta Cytol 2007; 51 (4): 637–641.
138. Eloy P, Evrard AS, Donckier J et al. Metastasis of a small cell carcinoma from undetected origin to the pituitary gland – the otolaryngologist‘s view. B-ENT 2005; 1 (3): 159–163.
139. Paulus P, Paridaens R, Mockel J et al. Argyrophilic breast carcinoma, single metastasis to the pituitary gland. Bull Cancer 1990; 77 (4): 377–384.
140. Rossi ML, Bevan JS, Fleming KA et al. Pituitary metastasis from malignant bronchial carcinoid. Tumori 1988; 74 (1): 101–105.
141. Eick JJ, Bell KA, Stephan MT et al. Metastatic renal cell carcinoma presenting as an intrasellar mass on computerized tomography. J Urol 1985; 134 (1): 128–130.
142. Makaryus AN, McFarlane SI. Diabetes insipidus: diag-nosis and treatment of a complex disease. Cleve Clin J Med 2006; 73 (1): 65–71.
143. Kimmel DW, O‘Neill BP. Systemic cancer presenting as diabetes insipidus. Clinical and radiographic features of 11 patients with a review of metastatic-induced diabetes insipidus. Cancer 1983; 52 (12): 2355–2358.
144. Leramo OB, Booth JD, Zinman B et al. Hyperprolactinemia, hypopituitarism, and chiasmal compression due to carcinoma metastatic to the pituitary. Neurosurgery 1981; 8 (4): 477–480.
145. Houck WA, Olson KB, Horton J. Clinical features of tumor metastasis to the pituitary. Cancer 1970; 26 (3): 656–659.
146. Branch CL Jr, Laws ER Jr. Metastatic tumors of the sella turcica masquerading as primary pituitary tumors. J Clin Endocrinol Metab 1987; 65 (3): 469–474.
147. Chiang MF, Brock M, Patt S. Pituitary metastases. Neurochirurgia (Stuttg) 1990; 33 (4): 127–131.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 4-
All articles in this issue
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

