-
Medical journals
- Career
Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
Authors: J. Kopecký; O. Kubeček
Authors‘ workplace: Klinika onkologie a radioterapie LF UK a FN Hradec Králové
Published in: Klin Onkol 2016; 29(2): 133-138
Category: Case Report
doi: https://doi.org/10.14735/amko2016133Metastazující maligní melanom se řadí mezi nádory s vysokou mortalitou. V posledních letech, díky poznání patogeneze maligního melanomu a vyvinutí léků cílených na tyto abnormality, jsme dosáhli významného posunu v léčbě našich pacientů. Hlavním přetrvávajícím nedostatkem těchto léků je vznik rezistence. Jedním ze způsobů, jak tuto rezistenci potlačit či alespoň oddálit, je použití kombinované terapie cílených léků.
Overview
Východiska:
Metastazující maligní melanom se řadí mezi nádory s vysokou mortalitou. V posledních letech, díky poznání patogeneze maligního melanomu a vyvinutí léků cílených na tyto abnormality, jsme dosáhli významného posunu v léčbě našich pacientů. Hlavním přetrvávajícím nedostatkem těchto léků je vznik rezistence. Jedním ze způsobů, jak tuto rezistenci potlačit či alespoň oddálit, je použití kombinované terapie cílených léků.Pozorování a závěr:
Tato kazuistika demonstruje účinnost kombinované cílené terapie BRAF a MEK inhibitoru a podtrhuje oprávnění zařazení této kombinace do terapeutického algoritmu u pacientů s maligním melanomem s mutací BRAF genu.Klíčová slova:
melanom – dabrafenib – trametinib – BRAF inhibitor – MEK inhibitorÚvod
Maligní melanom patří mezi nejzhoubnější nádory. Ačkoli v posledních letech dochází díky preventivním programům k nárůstu jeho incidence, zůstává mortalita maligního melanomu v čase víceméně konstantní [1].
Do roku 2011 byla v ČR k dispozici pro léčbu metastatického nebo inoperabilního onemocnění pouze chemoterapie, kdy zlatým standardem byla aplikace dakarbazinu. Díky novým „moderním“ lékům došlo v posledních letech k zlepšení prognózy těchto pacientů. Až v 50 % případů je za rozvoj maligního melanomu zodpovědná mutace vedoucí k aktivaci signální dráhy známé jako mitogenem aktivované protein kinázy (mitogen activated protein kinase – MAPK). MAPK signální dráha má důležitou regulační funkci buněčných dějů (proliferace, apoptóza, angiogeneze). Jde o kaskádu kináz přenášející signál z povrchového receptoru až do buněčného jádra pomocí fosforylace. Součástí této dráhy jsou proteiny ze skupiny Ras-Raf-MEK1, 2-ERK1, 2-ERK2 [2]. Mezi léky s cílenou aktivitou proti těmto mutačně aktivovaným proteinům patří dabrafenib a trametinib.
Dabrafenib je reverzibilní adenosin-trifosfát kompetitivní inhibitor BRAF kinázy nesoucí aktivační mutaci V600E nebo V600K.
Trametinib je reverzibilní, vysoce selektivní alosterický inhibitor mitogenem aktivované, mimobuněčným signálem regulované kinázy 1 a 2 (MEK1, MEK2), který svou aktivitou inhibuje růst buněčných linií melanomu s mutací genu BRAF.
Na základě výsledků současných klinických studií se ukazuje, že budoucnost léčby generalizovaného maligního melanomu s prokázanou mutací BRAF genu spočívá v kombinaci MEK inhibitoru s BRAF inhibitory [3,4].
Následující případ demonstruje účinnost kombinované léčby s dosažením kompletní léčebné odpovědi, avšak poukazuje rovněž na nutnost obezřetnosti pro možný rozvoj široké škály toxických projevů, na které je nutné včasně reagovat.
Kazuistika
Profesionální řidič (37 let) bez významnějších komorbidit byl operován v únoru 2014 pro uzlinový syndrom v pravém třísle. V peroperačně černě zbarveném paketu uzlin byla histologicky verifikována metastáza maligního melanomu s pozitivitou antigenu S100 v kompletně spotřebované uzlině. U pacienta byl proveden standardní vyšetřovací algoritmus ke stanovení rozsahu onemocnění a nalezení primárního nádorového ložiska. Pacient podstoupil dermatologické vyšetření, na základě kterého byla provedena excize suspektní pigmentové léze v oblasti podbřišku. Histologické vyšetření však neprokázalo přítomnost maligního melanomu. Jiná podezřelá kožní ložiska nebyla dermatologem identifikována. Pro vyloučení okulárního melanomu bylo provedeno oční vyšetření s negativním výsledkem. V rámci pátrání po možném primárním ložisku podstoupil pacient PET/ CT vyšetření, kde dominantním nálezem bylo uzlinové postižení pravého třísla (16 mm) (obr. 1), distální části krku vpravo (13 mm) i vlevo (12 mm), podkožní ložisko v oblasti pravé hýždě (11 mm) a především ložisková expanze (32 × 38 × 50 mm) v pánvi parailicky vpravo, která vedla k útlaku pravého ureteru (obr. 2). Onemocnění bylo klasifikováno jako metastatický maligní melanom neznámého primárního ložiska stadia M1c. Molekulárně patologické vyšetření identifikovalo u pacienta mutaci v genu BRAF V600E. Vzhledem k elevovaným hodnotám dusíkatých katabolitů (120 µmol/l) a městnání pravé ledviny byl po domluvě s urology zaveden do pravého ureteru stent.
#135459
#135460
Pacient byl zařazen do specifického léčebného programu pro terapii dabrafenibem v kombinaci s trametinibem (MEK 117341). Po celou dobu léčby byl pacient pravidelně monitorován jednou měsíčně v rámci klinického vyšetření vč. arteriálního tlaku s kontrolním krevním obrazem, biochemickým rozborem vnitřního prostředí, hladiny laktátdehydrogenázy (LDH), funkce štítné žlázy a jaterních enzymů. Jednou za tři měsíce bylo provedeno kontrolní vyšetření dermatologem, oftalmologem, ultrazvukové vyšetření srdce a EKG.
Léčba byla zahájena v květnu 2014 ve standardním dávkovacím schématu: dabrafenib 150 mg 2krát denně a trametinib 2 mg 1krát denně. Dominantním vedlejším účinkem od počátku léčby byla zvýšená únava pacienta hodnocená stupněm 2 dle CTCAE (pacient byl schopen vykonávat i nadále své zaměstnání profesionálního řidiče). V prvním měsíci léčby se objevovaly u pacienta hyperkeratotické výrůstky v oblasti obličeje, které však v průběhu dalších týdnů vymizely. Na základě dermatologického vyšetření byla v říjnu 2014 provedena excize suspektního ložiska z oblasti levé axily bez histologického průkazu malignity.
U pacienta se v listopadu 2014 objevily i přes zavedená režimová opatření (opalovací krémy UVA, UVB s vysokým faktorem, speciální fólie na čelní okno automobilu) první známky fototoxicity stupně 1 s dominantním postižením hřbetů rukou, které ustoupily po lokální aplikaci kalciové masti.
Začátkem ledna 2015 se však u pacienta rozvinula opětovná fototoxická dermatitida v oblasti horních končetin doprovázená otokem obličeje. Toxicita byla hodnocena jako stupeň 2 a byla zpočátku zvladatelná bez nutnosti přerušení či redukce léčby při systémové léčbě antihistaminiky (bilastin) a prednisonem v kombinaci s lokální aplikací betametazonové masti. V březnu 2015 bylo nutné pro rozvoj toxicity až stupně 3 v podobě fotosenzitivní dermatitidy (i při sebemenším styku s jakýmkoliv zdrojem světla) přerušit léčbu po dobu 14 dnů. Do dvou dnů od vysazení léčby došlo k promptní úpravě celkového stavu a vymizení lokálních fototoxických účinků. Pacient vyžadoval znovunasazení léčby. Ta mohla být vzhledem k ústupu toxicity opět zahájena, avšak s redukcí dávky dabrafenibu o 50 %. I přes tuto redukci se u pacienta do tří dnů objevila opět fototoxická reakce až stupně 3, která vedla k permanentnímu vysazení dabrafenibu a pokračování léčby v monoterapii trametinibem v dávce 2 mg denně od poloviny dubna 2015.
Léčba trametinibem byla provázena od počátečního užívání přítomností „akneiformní“ vyrážky v obličeji a horní polovině trupu, max. stupně 2. Naopak došlo k zlepšení pocitu únavy. Léčba trametinibem byla ukončena začátkem června 2015 pro rozvoj průjmů o frekvenci až 10krát denně (tedy stupně 3).
U pacienta bylo dosaženo regrese onemocnění již v průběhu prvních tří měsíců léčby a dle dalších kontrolních vyšetření (CT a PET/ CT) bylo dosaženo v květnu kompletní odpovědi, která přetrvává doposud (obr. 3, 4).
#135461
#135462
Diskuze
Zavedením „moderních“ léků jak ze skupiny imunologických, tak cílených, bylo dosaženo významného zlepšení prognózy pacientů s generalizovanou formou maligního melanomu. Výhodou cílených léků, jako např. dabrafenibu či vemurafenibu oproti chemoterapii či imunomodulační léčbě, je poměrně rychlý nástup účinku. Terapeutickým úskalím však zůstává fakt, že po relativně krátkém období kontroly onemocnění dochází k opětovné progresi na podkladě sekundární rezistence [5]. Rezistence k terapii BRAF inhibitory je spojena s reaktivací RAS-RAF-MEK-ERK signální dráhy. Byly proto zahájeny studie kombinující podání BRAF a MEK inhibitoru [3,4]. Touto kombinační terapií je dosahováno nejen zlepšení v klinických parametrech, jako je doba přežití bez progrese (progression-free survival – PFS) a celkové přežití (overall survival – OS), ale je dosahováno i kompletních léčebných odpovědí, a to až v 16 % (tab. 1) [4].
Table 1. Srovnání účinnosti jednotlivých léků v monoterapii a v kombinaci. 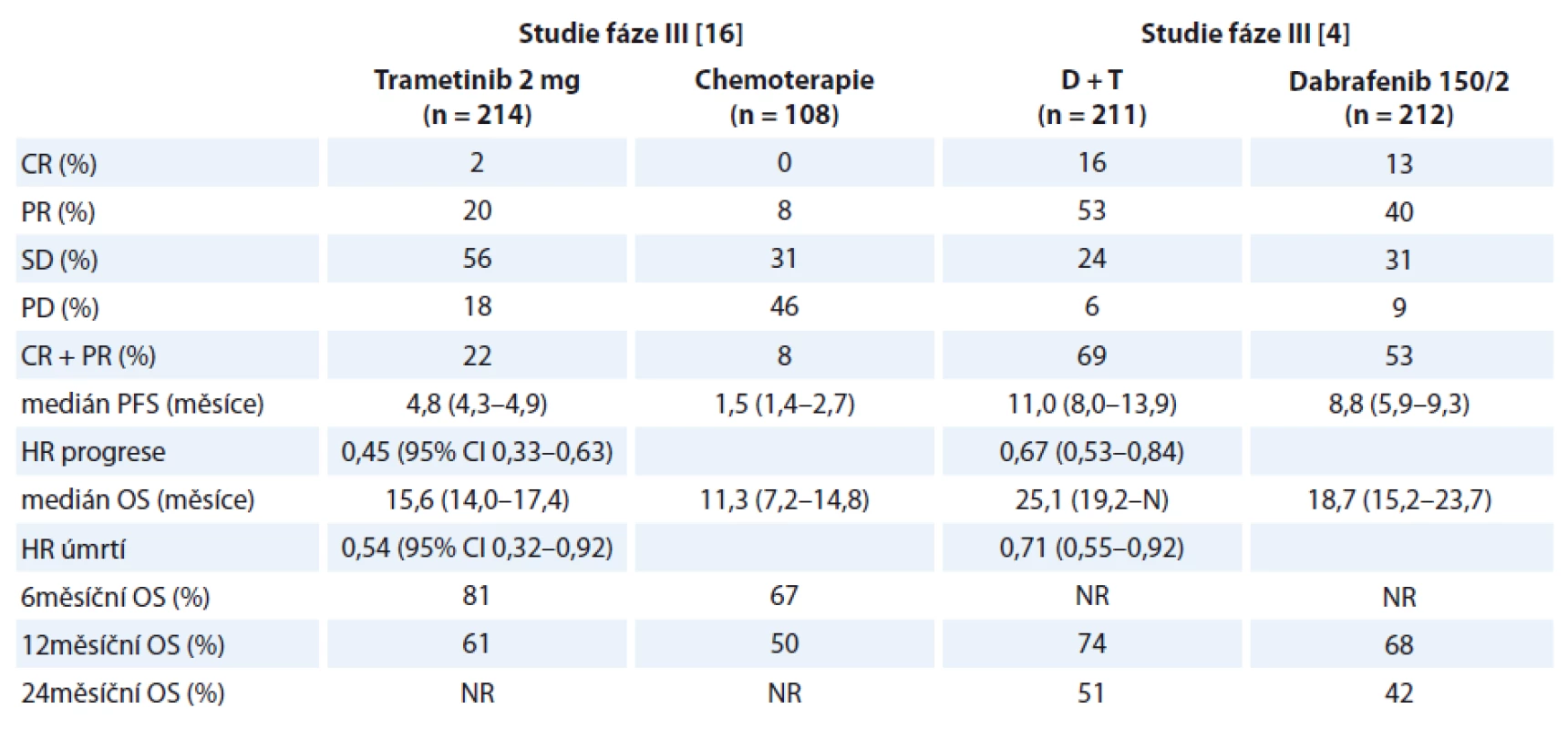
D + T – kombinace dabrafenib a trametinib, CR – kompletní odpověď, PR – částečná odpověď, SD – stabilizace onemocnění, PD – progrese onemocnění, PFS – doba bez progrese, HR – hazard ratio, OS – celkové přežití, NR – neuvedeno, N – nedosažen Ukazuje se, že kombinovaná terapie BRAF inhibitorem s MEK inhibitorem získává své nezastupitelné místo v algoritmu léčby generalizovaného maligního melanomu, kdy při jejich použití je dosahováno lepších léčebných výsledků než v případě léčby iplimumabem [6] anebo srovnatelných výsledků s novějšími léky ovlivňujícími imunitní reakci – nivolumabem, pembrolizumabem [7,8].
Stále nezodpovězenou otázkou v současné době zůstává správné načasování této kombinační terapie. Nezodpovězena je také otázka, za jakých podmínek je výhodnější u pacienta s mutovanou formou genu BRAF zahájit léčbu kombinací cílených léků, nebo se naopak přiklonit k léčbě imunomodulační. V reálném světě jsme často stavěni do situace, kde na jedné straně máme k dispozici výsledky klinických studií, na druhé straně je použití těchto preparátů regulováno plátci zdravotní péče. Dabrafenib a trametinib jsou registrovány v ČR pro pacienty s generalizovaným maligním melanomem, u kterých byla potvrzena mutace V600 genu BRAF. Úhradu ze zdravotního pojištění má v současné době na území ČR pouze monoterapie dabrafenibem v rámci tzv. 1. linie léčby u chemo - a imunonaivních pacientů. Trametinib je možno podávat pacientům v rámci klinických studií či specifického léčebného programu pro kombinaci s dabrafenibem.
Ve dvou retrospektivních klinických studiích byl pozorován lepší výsledek pro sekvenci ipilimumab, který byl následován cílenou léčbou BRAF inhibitorem v monoterapii [9,10]. Nutno podotknout, že tyto studie pozbyly v současnosti své významnosti. Důvodem je za prvé vyšší účinnost léků cílených proti PD-1 receptoru i co se týče dosažení redukce tumoru srovnatelné s monoterapií BRAF inhibitory [5,7,11,12] a za druhé kombinovaná terapie BRAF/ MEK inhibitory je v současné době považována za standard léčby [3,4].
Z biologického hlediska účinku současných léků používaných v léčbě generalizovaného maligního melanomu se zdá být výhodnější sekvence imunomodulační léčby s následnou terapií BRAF/ MEK inhibitory. BRAF/ MEK inhibitory je vhodné použít v 1. linii především u pacientů s rozsáhlým, život ohrožujícím onemocněním. V současné době probíhá nábor do klinické studie EA6134, která se snaží definovat optimální sekvenci, kdy je porovnávána v 1. linii kombinační terapie BRAF/ MEK inhibitory s kombinační imunomodulační terapií anti-CLTA-4/anti-PD-1 [13].
Kombinovaná terapie BRAF/ MEK inhibitory má odlišný toxický profil v porovnání s jednotlivými léky v monoterapii (tab. 2). Oproti monoterapii BRAF či MEK inhibitory byl u této kombinace léčiv zaznamenán nižší výskyt kožní toxicity (rash, hyperkeratóza, keratoakantomy, spinocelulární karcinomy kůže), hypertenze a průjmů. Naopak se mohou objevit nové vedlejší účinky, jako např. reverzibilní chorioretinopatie nebo pokles systolické funkce levé komory. Ukazuje se, že kombinovanou léčbou BRAF/ MEK inhibitory je, i přes toxicitu, současně dosahováno zlepšení kvality života oproti samotné léčbě dabrafenibem [14]. Není výjimkou, že pacient je ochoten, či dokonce vyžaduje pokračovat v léčbě i přes výskyt nežádoucích účinků nižšího stupně toxicity, kdy tyto nepovažuje s ohledem na vážnost svého onemocnění za faktor zhoršující jeho kvalitu života.
Table 2. Srovnání toxických profilů jednotlivých léků v monoterapie a v kombinaci. 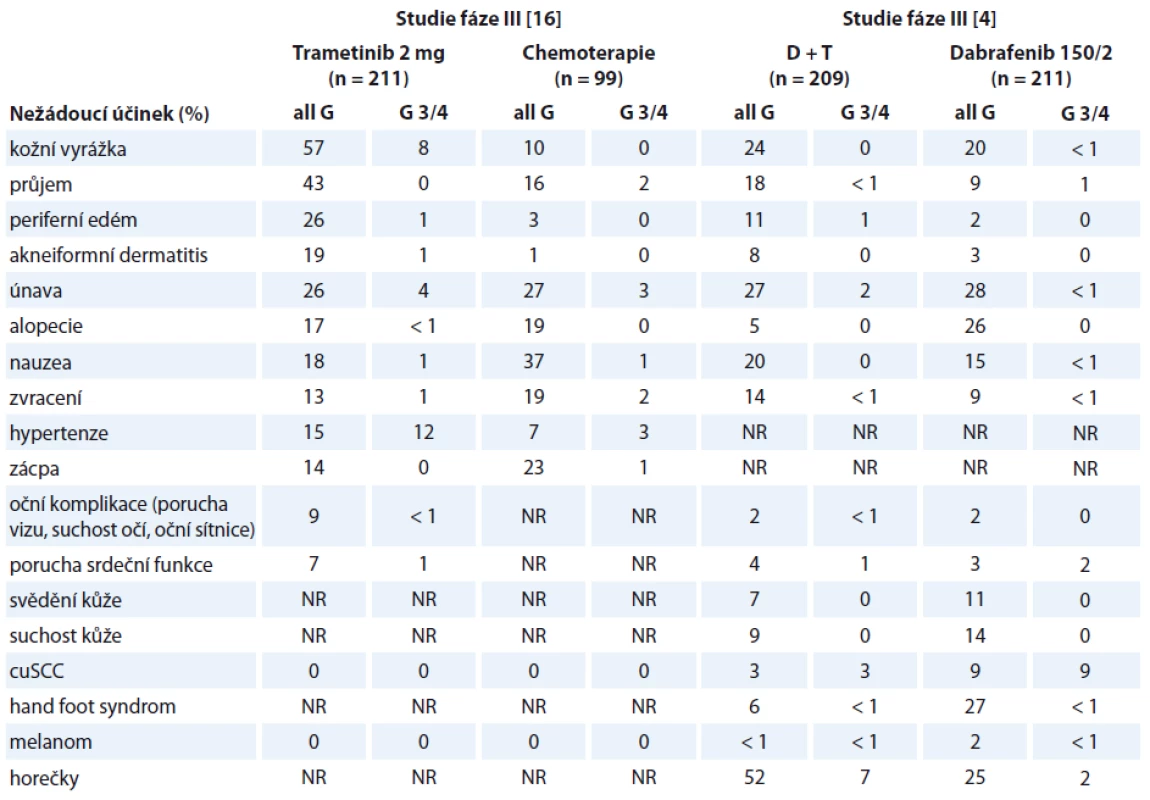
D + T – kombinace dabrafenib a trametinib, all G – nežádoucí účinky všech stupňů, G 3/4 – nežádoucí účinek 3. a 4. stupně, NR – neuvedeno, cuSCC – spinocelulární karcinom kůže Je však nezbytně nutné, aby tato léčba byla podávána lékařem, který je obeznámen s možnými i méně častými nežádoucími účinky. Samozřejmostí je nutnost informovat pacienta o potenciálních nežádoucích účincích před zahájením léčby, ale opakovaně i v jejím průběhu. Předpokladem zvládnutí nežádoucích účinků spojených s léčbou je jednak správně informovaný pacient a jednak pravidelná monitorace pacienta při léčbě [15].
Závěr
Kombinovaná terapie BRAF/ MEK inhibitory je v současnosti považována za standard léčby pro pacienty s maligním melanomem s mutovanou formou genu BRAF. U pacientů s touto léčbou je nutná pravidelná monitorace pro možný rozvoj i život ohrožujících nežádoucích účinků souvisejících s léčbou.
Stejně jako není jasná situace optimálního načasování léčby, není jasná ani situace, jak postupovat u pacientů, u kterých bylo dosaženo kompletní odpovědi. Není známa optimální doba podávání BRAF/ MEK inhibitorů ani jak postupovat při relapsu onemocnění v případě, že léčba byla přerušena.
Ačkoliv na základě dostupných klinických studií je patrná vyrovnanost jednotlivých režimů (BRAF/ MEK inhibice, anti-PD-1) v 1. linii, čekáme na výsledky v současnosti probíhající prospektivní studie srovnávající jednotlivé sekvence. Do doby schválení úhrady nivolumabu a pembrolizumabu do 1. linie léčby a po dobu platnosti současné úhradové vyhlášky týkající se indikace BRAF inhibitorů v monoterapii u chemo - a imunonaivních pacientů je správné pacienty s mutovaným BRAF genem v současnosti léčit v 1. linii BRAF inhibitory současně s MEK inhibitorem v rámci specifického léčebného programu probíhajícího na území ČR (nutno podotknout, že je nezbytné zažádat o schválení úhrady BRAF inhibitoru pojišťovnu pacienta) anebo zařazovat tyto pacienty do klinických studií.
Tato práce byla podpořena v rámci projektu Specifického vysokoškolského výzkumu SVV 2015-260286 a PRVOUK 37/06.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 10. 2. 2016
Přijato: 17. 2. 2016
MUDr. Jindřich Kopecký
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: kopecjin@fnhk.cz
Sources
1. Zvolský M. Vývoj incidence a mortality zhoubného melanomu v České republice v letech 1980 – 2011 [monografie na internetu]. ÚZIS ČR, Aktuální informace č. 11/ 2014. Dostupné z: http://www.uzis.cz/node/6600.
2. Cheng Y, Zhang G, Li G. Targeting MAPK pathway in melanoma therapy. Cancer Metastasis Rev 2013; 32(3 – 4): 567 – 584. doi: 10.1007/s10555-013-9433-9.
3. Flaherty KT, Infante JR, Daud A et al. Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med 2012; 367(18): 1694 – 1703. doi: 10.1056/NEJMoa1210093.
4. Long GV, Stroyakovskiy D, Gogas H et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3randomized controlled trial. Lancet 2015; 386(9992): 444 – 451. doi: 10.1016/S0140-6736(15)60898-4.
5. Sosman JA, Kim KB, Schuchter L et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 2012; 366(8): 707 – 714. doi: 10.1056/NEJMoa1112302.
6. Hodi FS, O’Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363(8): 711 – 723. doi: 10.1056/NEJMoa1003466.
7. Robert C, Long GV, Brady B et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372(4): 320 – 330. doi: 10.1056/NEJMoa1412082.
8. Robert C, Schachter J, Long GV et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015; 372(26): 2521 – 2532. doi: 10.1056/NEJMoa1503093.
9. Ackerman A, Klein O, McDermott DF et al. Outcomes of patients with metastatic melanoma treated with immunotherapy prior to or after BRAF inhibitors. Cancer 2014; 120(11): 1695 – 1701. doi: 10.1002/cncr.28620.
10. Ascierto PA, Simeone E, Sileni VC et al. Sequential treatment with ipilimumab and BRAF inhibitors in patients with metastatic melanoma: data from the Italian cohort of the ipilimumab expanded access program. Cancer Invest 2014; 32 : 144 – 149. doi: 10.3109/07357907.2014.885984.
11. Robert C, Ribas A, Wolchok JD et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomized dose-comparison cohort of a phase 1 trial. Lancet 2014; 384(9948): 1109 – 1117. doi: 10.1016/S0140-6736(14)60958-2.
12. Topalian SL, Sznol M, McDermott DF et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32(10): 1020 – 1030. doi: 10.1200/JCO.2013.53.0105.
13. ClinicalTrials.gov [homepage on the Internet]. A service of the U.S. National Institutes of Health [updated 2016 Feb 7; cited 2016 Feb 8]. Available from: https://clinicaltrials.gov/ct2/show/NCT02224781.
14. Schadendorf D, Amonkar MM, Stroyakovskiy D et al. Health-related quality of life impact in a randomized phase III study of the combination of dabrafenib and trametinib versus dabrafenib monotherapy in patients with BRAF V600 metastatic melanoma. Eur J Cancer 2015; 51(7): 833 – 840. doi: 10.1016/j.ejca.2015.03.004.
15. Kopecký J, Kubeček O, Trojanová P et al. Adverse effects of modern treatment of malignant melanoma and their treatment/ management. Klin Onkol 2014; 27(6): 393 – 400. doi: 10.14735/amko2014393.
16. Flaherty KT, Robert C, Hersey P et al. Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 2012; 367(2): 107 – 114. doi: 10.1056/NEJMoa1203421.
Labels
Dermatology & STDs Paediatric dermatology & STDs Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 2-
All articles in this issue
- Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Novinky v adjuvantní terapii neseminomů stadia I
- Comment – Active Surveillance vs. Adjuvant Therapy in Clinical Stage I Non-seminomatous Germ Cell Testicular Cancer
- Kvalita života měřená jako změna v čase u českých žen s karcinomem prsu
- Papilárny karcinóm štítnej žľazy u dvojročného dieťaťa
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

