-
Medical journals
- Career
Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
Authors: I. Richter 1,2; J. Dvořák 2; V. Hejzlarová 1; J. Chalupa 1; M. Sochor 1; I. Stankuš 1; L. Barsová 1; M. Holikova 1; J. Forster 3; J. Bartoš 1
Authors‘ workplace: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2; Onkologické oddělení, Oblastní nemocnice Jičín, a. s. 3
Published in: Klin Onkol 2016; 29(2): 127-132
Category: Original Articles
doi: https://doi.org/10.14735/amko2016127Overview
Cíl:
Enzalutamid a abirateron představují novou možnost terapie metastatického kastračně rezistentního karcinomu prostaty (metastatic castration-resistant prostate cancer – mCRPC). Cílem předkládané práce je retrospektivní analýza klinických zkušeností, léčebných výsledků a vzájemné porovnání obou preparátů u pacientů s mCRPC, kteří byli předléčeni chemoterapií v rámci našeho onkologického centra.Pacienti a metody:
Bylo hodnoceno celkem 32 pacientů s mCRPC. Všichni pacienti byli předléčení minimálně jednou linií chemoterapie. Enzalutamidem bylo léčeno 23 pacientů, devět pacientů bylo léčeno abirateronem. Hodnotili jsme celkové přežití i přežití bez známek progrese.Výsledky:
Při mediánu sledování 6,5 měsíce jsme u pacientů léčených enzalutamidem pozorovali celkem 10 progresí onemocnění (43,47 %). Celkem zemřelo osm pacientů k datu hodnocení (34,78 %). U pacientů léčených abirateronem jsme pozorovali celkem pět progresí onemocnění (55,56 %), jeden pacient zemřel (11,11 %). V rámci hodnocení celkového přežití nebyl prokázán statisticky významný rozdíl mezi skupinou pacientů léčených enzalutamidem a skupinou pacientů léčených abirateronem (HR 0,2362, 95% CI 0,0295 – 1,8942; p = 0,102). V rámci hodnocení přežití bez známek progrese nebyl prokázán statisticky významný rozdíl mezi skupinou pacientů léčených enzalutamidem a skupinou pacientů léčených abirateronem (HR 0,9853, 95% CI 0,2934 – 3,308; p = 0,939).Závěr:
Naše retrospektivní studie prokázala podobnou účinnost enzalutamidu a abirateronu u pacientů s mCRPC, kteří byli předléčení chemoterapií.Klíčová slova:
karcinom prostaty – enzalutamid – abirateron – celkové přežití – přežití bez známek progrese – toxicita – metastázyÚvod
Incidence karcinomu prostaty v posledních 20 letech výrazně stoupla. V roce 2013 byla incidence karcinomu prostaty 132,63 na 100 000 mužů, mortalita byla 28,52 na 100 000 mužů [1]. U části pacientů dochází ke vzniku kastračně rezistentního karcinomu (castration-resistant prostate cancer – CRPC), který progreduje i přes kastrační hodnoty testosteronu. Onemocnění přestává reagovat na androgenní deprivaci. V minulosti byla standardem léčby metastatického CRPC (mCRPC) chemoterapie mitoxantronem v kombinaci s prednisonem. Na podkladě klinických studií se stala od roku 2004 standardem léčby 1. linie chemoterapie docetaxelem s prednisonem [2,3]. U pacientů ale dříve nebo později dochází k další progresi onemocnění. Druhá a další linie léčby nebyly standardně definované. Používala se různá cytostatika, jako např. mitoxantron, vinorelbin a jiná. Až v posledních letech došlo k dalšímu vývoji léčebného algoritmu mCRPC. V roce 2010 byly publikovány výsledky klinické studie TROPIC, která prokázala delší celkové přežití (overall survival – OS) u pacientů léčených kabazitaxelem než u pacientů léčených mitoxantronem [4]. Další publikované práce potvrdily, že i přes kastrační hodnoty testosteronu má aktivace androgenního receptoru (AR) významný vliv na progresi onemocnění [5–8]. Enzalutamid a abirateron představují novou generaci hormonální léčby. Oba preparáty prokázaly prodloužení OS u pacientů s mCRPC předléčených chemoterapií v registračních klinických studiích AFFIRM a COO-AA-301 [9,10]. Na podkladě dat ze zmíněných klinických studií jsme také začali tyto preparáty používat v léčbě mCRPC na našem oddělení od září roku 2014. Cílem předkládané práce je retrospektivní analýza klinických zkušeností, léčebných výsledků a vzájemné porovnání obou preparátů u 32 pacientů s mCRPC, kteří byli předléčení chemoterapií.
Pacienti a metody
Celkem bylo hodnoceno 32 mužů s mCRPC. Hodnota testosteronu byla nižší než 1,7 nmol/ l. Všech 32 pacientů absolvovalo systémovou chemoterapii docetaxelem v 1. linii léčby. Medián počtu cyklů docetaxelu byl 6, rozmezí 1 – 10 cyklů. Všichni pacienti měli metastaticky postižen alespoň jeden orgánový systém. Nejčastěji se vyskytovaly kostní metastázy u 26 (81,25 %) pacientů, dále u šesti (18,75 %) pacientů bylo popsáno metastatické postižení lymfatických uzlin pánve nebo retroperitonea, jeden pacient měl metastaticky postižena játra a jeden pacient metastatické postižení plic. Medián věku všech pacientů byl 70 let, rozmezí 60 – 83 let. Enzalutamidem jsme celkem léčili 23 pacientů, abirateronem devět pacientů. Šest pacientů léčených enzalutamidem bylo kromě docetaxelu předléčeno i kabazitaxelem, u pacientů léčených abirateronem nebyl kabazitaxel po docetaxelu aplikován. Dva pacienti užívající abirateron byli součástí klinické studie, kde byli léčeni kombinací abirateron a olaparib/ placebo. Enzalutamid jsme podávali v dávce 160 mg denně, abirateron v dávce 1 000 mg denně společně s prednisonem 5 mg ve dvou denních dávkách. U pacientů léčených enzalutamidem byl medián vstupní koncentrace hemoglobinu 131 (91 – 146) g/l, medián vstupní koncentrace leukocytů byl 6,1 (3,7 – 18,0) × 109/l, medián vstupní koncentrace trombocytů 183 (67 – 449) × 109/l. Medián vstupní hodnoty PSA byl 116 ng/ ml (rozmezí 4,5 – 5 000 ng/ml). U pacientů léčených abirateronem byl medián vstupní koncentrace hemoglobinu 136 (106 – 147) g/l, medián vstupní koncentrace leukocytů byl 5,1 (3,4 – 12,8) × 109/l, medián vstupní koncentrace trombocytů 198 (62 – 259) × 109/l. Medián vstupní hodnoty PSA byl 216 ng/ ml (rozmezí 150,4 – 1 067 ng/ml). Pacienti byli v celkovém performance statusu 0 – 2. Demografická data jsou uvedena v tab. 1. V rámci statistického hodnocení jsme definovali dva ukazatele. Celková doba přežití (OS) = doba od zahájení terapie enzalutamidem nebo abirateronem po úmrtí nebo do dne poslední kontroly u přeživších. Přežití bez známek progrese (progression-free survival – PFS) = doba zahájení terapie enzalutamidem nebo abirateronem do progrese onemocnění nebo do poslední kontroly u pacientů bez progrese. Progrese onemocnění byla určena buď podle zobrazovacích vyšetření (CT vyšetření nebo scintigrafie skeletu), nebo podle 2krát prokázané elevace PSA v průběhu čtyř týdnů se současnou klinickou progresí onemocnění (zhoršení bolesti, přítomnost kostní události). Vzájemné porovnání OS a PFS u pacientů v obou skupinách bylo vypočteno pomocí Kaplan-Meierovy analýzy s použitím log-rank testu. Všechny statistické testy byly hodnoceny na hladině významnosti α = 0,05.
Table 1. Charakteristika souborů pacientů. 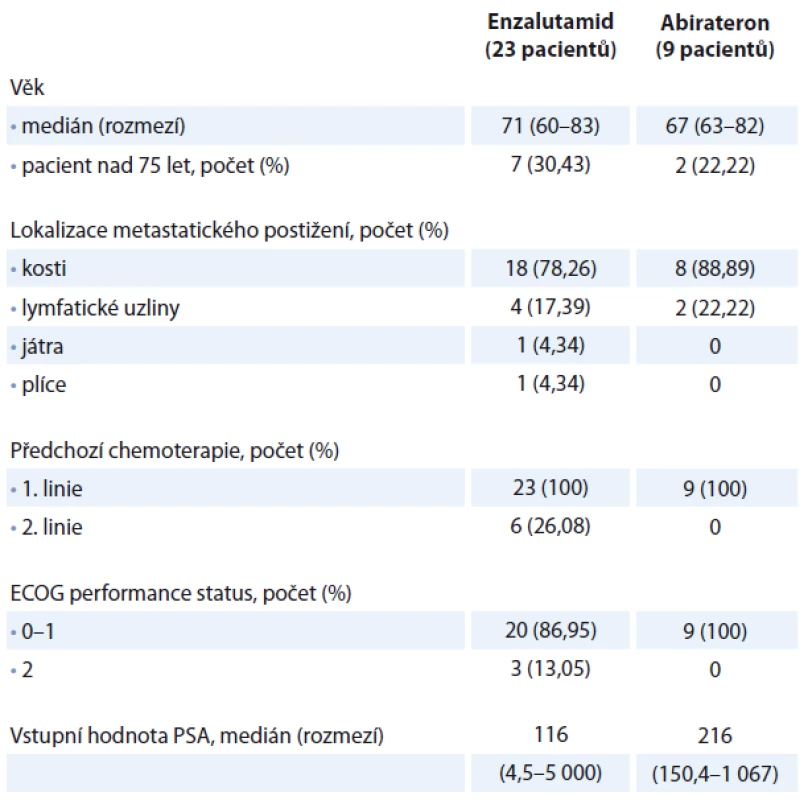
Výsledky
Medián sledování pacientů v době zhodnocení byl 6,5 měsíce. Medián délky trvání terapie enzalutamidem byl 5 cyklů (rozmezí 1 – 12 cyklů), medián délky trvání terapie abirateronem byl 6 cyklů (rozmezí 1 – 14 cyklů). U pacientů léčených enzalutamidem byl medián nadiru koncentrace hemoglobinu 121 (67 – 142) g/l, medián nadiru koncentrace leukocytů byl 5,3 (2,2 – 17,7) × 109/l, medián nadiru koncentrace trombocytů 159 (60 – 337) × 109/l. U pacientů léčených abirateronem byl medián nadiru koncentrace hemoglobinu 123 (90 – 142) g/l, medián nadiru koncentrace leukocytů byl 4,9 (2,2 – 12,8) × 109/l, medián nadiru koncentrace trombocytů 162 (47 – 259) × 109/l. Při hodnocení hematologické toxicity jsme srovnávali vstupní hodnoty krevního obrazu před zahájením terapie enzalutamidem či abirateronem a hodnoty nadiru v průběhu terapie. U části pacientů byly hodnoty krevního obrazu pod normou již ve vstupním vyšetření. V případě, že nedošlo k dalšímu poklesu hodnot v krevním obraze v průběhu terapie, nehodnotili jsme to jako toxicitu terapie u této skupiny pacientů. V rámci hematologické toxicity jsme pozorovali u pacientů léčených enzalutamidem výskyt anémie stupně II u tří pacientů (13 %), anémie stupně III taktéž u tří pacientů (13 %), leukopenie stupně I u dvou pacientů (8,7 %), leukopenie stupně II u jednoho pacienta (4,5 %). U pacientů léčených abirateronem jsme pozorovali anémii stupně II u jednoho pacienta (11,1 %), podobně i leukopenii stupně II a trombocytopenii stupně IV. V rámci nehematologické toxicity jsme pozorovali převážně toxicitu mírného stupně I – II. Jeden pacient na terapii enzalutamidem zemřel na hemoragickou mozkovou příhodu, jeden pacient na terapii abirateronem měl elevaci jaterních testů stupně III. Ostatní nálezy byly stupně I nebo II. Přehled toxicity je uveden v tab. 2. U pacientů léčených enzalutamidem jsme pozorovali celkem 10 progresí onemocnění (43,47 %). Celkem zemřelo osm pacientů k datu hodnocení (34,78 %). U pacientů léčených abirateronem jsme pozorovali celkem pět progresí onemocnění (55,56 %), jeden pacient zemřel (11,11 %). V rámci hodnocení OS nebyl prokázán statisticky významný rozdíl mezi skupinou pacientů léčených enzalutamidem a skupinou pacientů léčených abirateronem (HR 0,2362, 95% CI 0,0295 – 1,8942; p = 0,102) (graf 1). Medián OS u pacientů léčených abirateronem nebyl dosažen. V rámci hodnocení PSF podobně nebyl prokázán statisticky významný rozdíl mezi skupinou pacientů léčených enzalutamidem a skupinou pacientů léčených abirateronem (HR 0,9853, 95% CI 0,2934 – 3,308; p = 0,939). Medián PFS u pacientů léčených enzalutamidem byl 7,36 měsíce, medián PFS u pacientů léčených abirateronem byl 8,36 měsíce (graf 2). Medián nadiru PSA u pacientů léčených enzalutamidem byl 38,9 ng/ml (0 – 1 023). Medián nadiru PSA u pacientů léčených abirateronem byl 28,1 ng/ml (0,79 – 800).
Table 2. Nežádoucí účinky léčby – nehematologická toxicita. 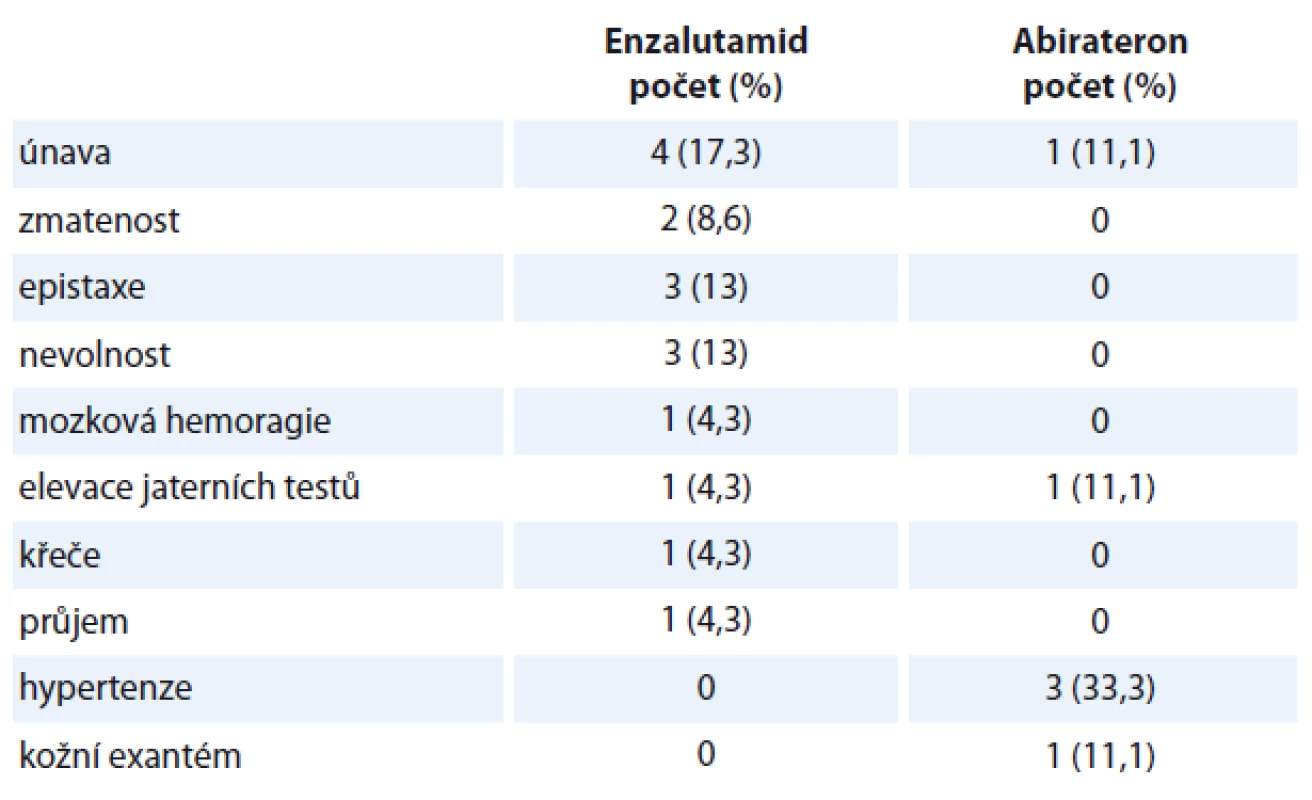
Graph 1. OS v měsících u pacientů léčených enzalutamidem (modrá) a abirateronem (šedá). 
Graph 2. PFS v měsících u pacientů léčených enzalutamidem (modrá) a abirateronem (šedá). 
Diskuze
Prezentovaná práce poukazuje na naše zkušenosti s hormonální terapií nové generace u pacientů s mCRPC. V rámci souboru jsme léčili více pacientů enzalutamidem (23 pacientů) než abirateronem (devět pacientů). Navíc dva pacienti léčení abirateronem byli součástí klinické studie. Důvodem vyššího počtu pacientů léčených enzalutamidem byl příznivější profil nežádoucích účinků v klinické studii AFFIRM než v klinické studii COU-AA-301 hodnotící abirateron [9,10]. Další výhodou aplikace enzalutamidu bylo jeho podání bez nutnosti podávání prednisonu. Prednison byl navíc užíván i v předchozí terapii v kombinaci s chemoterapií. Mnoho pacientů udávalo jeho negativní vliv hlavně na nárůst hmotnosti a retenci tekutin. V průběhu terapie abirateronem jsme postupně pozorovali dobrou toleranci preparátu s nižším počtem závažných nežádoucích účinků než v registrační klinické studii. Je ale potřeba vzít v úvahu fakt, že zatím nelze zobecňovat tuto empirickou zkušenost na vzorku devíti pacientů. V rámci terapie jsme pozorovali jedno úmrtí na hemoragickou mozkovou příhodu u pacienta léčeného enzalutamidem. Jednalo se o pacienta s anamnézou arteriální hypertenze a dalších kardiálních komorbidit. Je obtížné zhodnotit přímý vliv enzalutamidu na výskyt této komplikace. Naše retrospektivní pozorování neprokázalo statisticky odlišné léčebné výsledky u obou skupin pacientů (PFS, OS). Pacienti léčení abirateronem prokázali statisticky nevýznamně delší PFS o jeden měsíc. U této skupiny pacientů ale nutno přihlížet ke skutečnosti, že byli léčení v klinické studii v kombinaci s olaparibem/ placebem, kde případné podání olaparibu mohlo mít vliv na léčebné výsledky. Navíc se jednalo o menší skupinu pacientů. Je možně, že postupně s doplněním dalších pacientů a delší dobou sledování dojde ještě k dalšímu přiblížení hodnot PFS. Hodnoty PFS v našem souboru přibližně odpovídají výsledkům registračních klinických studií. Nyní na ESMO 2015 bylo publikováno posterové sdělení hodnotící retrospektivně účinnost abirateronu u 553 pacientů léčených předchozí chemoterapií. Většina vstupních charakteristik pacientů léčených v reálné klinické praxi byla podobná charakteristikám populace v registrační studii COU-AA-301. Medián OS byl 18,2 měsíce, což je o 2,4 měsíce delší doba než v registrační studii. Data z výše uvedené práce hodnotící reální klinickou praxi prokázala, že abirateron je efektivní léčebnou modalitou mCRPC [11]. Zatím nebyla publikována klinická studie, která by přímo hodnotila účinnost enzalutamidu a abirateronu u pacientů s mCRPC po předchozí aplikaci chemoterapie. V roce 2014 bylo publikováno nepřímé zhodnocení enzalutamidu a abirateronu na podkladě výsledků klinických studií AFFIRM a COO-AA-301 [12]. V rámci OS nebyl nalezen statisticky významný rozdíl mezi enzalutamidem a abirateronem (HR 0,85, 95% CI 0,68 – 1,07; p = 0,17). Enzalutamid ale prokázal delší čas elevace PSA (PSA progrese) (HR 0,4, 95% CI 0,3 – 0,47; p < 0,001), delší přežití bez radiologické progrese (HR 0,61, 95% CI 0,5 – 0,74; p < 0,001) a větší procento PSA odpovědí (HR 10,69, 95% CI 3,92 – 29,20; p < 0,001) než abirateron. V rámci hodnocení nežádoucích účinků nebyl prokázán statisticky významný rozdíl v únavě, průjmu, elevaci jaterních testů. Byl prokázán trend k vyššímu výskytu kardiálních nežádoucích účinků u pacientů léčených abirateronem. Specifické nežádoucí účinky abirateronu jako retence tekutin a hypokalemie byly významně častěji pozorovány u pacientů léčených abirateronem. Výskyt křečí byl častější u pacientů léčených enzalutamidem. Je otázka, čím mohla být způsobená vyšší účinnost enzalutamidu než abirateronu podle výše zmíněné publikace. Nutno ale dodat, že se jednalo o nepřímé retrospektivní srovnání na podkladě různých klinických studií. V roce 2012 byla publikovaná práce, která prokázala, že exogenní podání kortikoidů může aktivovat mutovaný androgenní receptor [13]. Bodová mutace androgenního receptoru je vzácná u nepředléčených pacientů, ale vyskytuje se u 15 – 45 % pacientů s CRCP. Mutace je spojena s vyšší afinitou ke steroidům s následnou aktivací AR [14,15]. Právě pacienti s abirateronem užívali i prednison. V klinické studii AFFIRM, která hodnotila enzalutamid, nebyla terapie prednisonem nutná. Sher et al na ESMO 2012 hodnotili i vliv kortikoidů na léčebné výsledky pacientů léčených enzalutamidem v postanalýze této klinické studie a prokázali, že pacienti užívající prednison měli trend ke kratší době OS a významný negativní vliv přežití bez progrese PSA či přežití bez radiologické progrese než pacienti bez kombinace s prednisonem. Na druhé straně pacienti léčení kombinací prednisonu a enzalutamidu byli v horším výkonnostním stavu než pacienti bez prednisonu, což také mohlo mít vliv na léčebné výsledky [16]. Obě registrační studie i naše pozorování prokázaly účinnost enzalutamidu i abirateronu. Oba preparáty lze nejspíše považovat za rovnocenné ve smyslu účinnosti, ale s různým profilem toxicity, což je nutno zvážit při výběru terapie. Aplikace enzalutamidu může být rizikovější u pacientů s anamnézou mozkového postižení, např. stavy po mozkových úrazech či přítomnost křečových stavů v anamnéze. Naopak podání abirateronu je nutno zvážit u pacientů s městnavým srdečním selháním, renálním selháním, u pacientů s minerálovou dysbalancí. Naše práce hodnotila jenom pacienty po předchozí terapii minimálně jedním cyklem chemoterapie. Vždy se jednalo o docetaxel jako standardní cytostatikum v 1. linii terapie mCRPC. Existuje ale skupina pacientů s asymptomatickým postižením nebo minimálně symptomatickým postižením, kde lze enzalutamid nebo abirateron podat s efektem i bez předchozí léčby docetaxelem, jak prokázaly další publikované klinické studie [17,18]. Je ale nutno zdůraznit, že oba preparáty byly v těchto studiích srovnávány s placebem. Od listopadu 2015 má abirateron také schválenou úhradu v indikaci před aplikací chemoterapie u pacientů s mCRPC. V roce 2016 bude zřejmě schválená úhrada i pro enzalutamid v podobné indikaci. Podle dat registračních klinických studií AFFIRM a COO-AA-301 je zřejmé, že ne každý pacient odpoví na terapii enzalutamidem či abirateronem. I z našich pozorování vyplývá, že u některých pacientů došlo k progresi onemocnění bez alespoň krátkodobé léčebné odpovědi či stabilizace nálezů. Hledají se proto možné faktory predikující účinnost abirateronu či enzalutamidu. V roce 2014 byla publikována studie, která prokázala, že detekce splice varianty 7 androgenního receptoru (AR-V7) v cirkulujících nádorových buňkách u pacientů s mCRPC je spojena s rezistencí vůči enzalutamidu či abirateronu. Celkem bylo hodnoceno 31 pacientů léčených enzalutamidem a 31 pacientů léčených abirateronem. Pacienti s detekcí AR-V7 prokázali v obou skupinách významně kratší OS, kratší přežití bez PSA či radiologické progrese než pacienti bez detekce AR-V7 [19].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 11. 11. 2015
Přijato: 11. 1. 2016
MUDr. Igor Richter, Ph.D.
Onkologické oddělení
Krajská nemocnice Liberec, a.s.
Husova 10
460 63 Liberec
e-mail: igor.richter@seznam.cz
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [citováno 13. červenec 2009]. Verze 7.0 [2007]. Dostupný z: http:/ / www.svod.cz.
2. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantron plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351(15): 1502 – 1512.
3. Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and estramustine compared with mitoxantrone plus prednisone for advanced refractory prostatae cancer. N Engl J Med 2004; 351(15): 1513 – 1520.
4. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostatae cancer progressing after docetaxel treatment: a randimized open-label trial. Lancet 2010; 376(9747): 1147 – 1154. doi: 10.1016/S0140-6736 (10)61389-X.
5. Sartor AO. Progression of metastatic castrate-resistant prostatae cancer: impact of therapeutic intervention in the post-docetaxel space. J Hematol Oncol 2011; 4 : 18. doi: 10.1186/1756-8722-4-18.
6. Chen CD, Welsbie DS, Tran C et al. Molecular determinants of resistance to antiandrogen therapy. Nat Med 2003; 10(1): 33 – 39.
7. Scher HI, Sawyers CL. Biology of progressive, castration-resistant prostate cancer directed therapies targeting the androgen-receptor signaling axil. J Clin Oncol 2005; 23(32): 8253 – 8261.
8. Ondruš D, Ondrušová M. Manažement pacientov s kastračne rezistentným metastatickým karcinómom prostaty. Klin Onkol 2015; 28(1): 24 – 29. doi: 10.14735/amko201524.
9. Scher HI, Fizazi K, Saad F et al. Increased survival with enzalutamide in prostatae cancer after chemotherapy. N Engj J Med 2012; 367(13): 1187 – 1197.
10. de Bono JS, Logothesis CJ, Molina A et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364(21): 1995 – 2005. doi: 10.1056/NEJMoa1014618.
11. Dearden L, Misingarimi P, Shalet N et al. Real-world treatment with abirateron acetate in metatsatic castration-resistance prostate cancer (mCRPC) patiens in post-chemotherapy petting in Europe. The 18th ECCO – 40th ESMO European Cancer Congress, Vienna, 25. – 29. 9. 2015: abstr. 2545.
12. Tan PS, Haaland B, Montero AJ et al. Hormonal therapeutics enzalutamide and abirateron acetate in the treatment of metastatic castration-resistant prostate cancer (mCRPC) post-docetaxel – an indirection comparison. Clin Med Insights Oncol 2014; 8 : 29 – 36. doi: 10.4137/CMO.S13671.
13. Richards J, Lim AC, Hay CW et al. Interaction of abiraterone, epelrenone and prednisolone with wild-type and mutant androgen receptor: a rationale for increasing abiraterone exposure or combining with MDV3100. Cancer Res 2012; 72(9): 2176 – 2182. doi: 10.1158/0008-5472.CAN-11-3980.
14. Luthy IA, Begin DJ, Labrie F. Androgenic acitivity of synthetic progestins and spironolactone in androgen-senzitive mouse mammary carcinoma (Shionogi) cells in culture. J Steroid Biochem 1988; 31(5): 845 – 852.
15. Taplin ME, Bubley GJ, Shuster TD et al. Mutation of the androgen receptor gene in metastatic androgen-receptor gene in metastatic androgen-independent prostatae cancer. N Engl J Med 1995; 332(21): 1393 – 1398.
16. Sher HI, Fizazi K, Saad F et al. Association of baseline corticosteroid with outcomes in multivariate analysis of the phase 3 affirm study of enzalutamide (ENZA), an androgen receptor signaling inhibitorr (ARSI). In ESMO 2012, Vienna; abstr. 2887.
17. Ryan CJ, Smith MR, de Bono JS et al. Abirateron in metastatic prostatae cancer without previous chemotherapy. N Engl J Med 2013; 368(2): 138 – 148. doi: 10.1056/NEJMoa1209096.
18. Beer TM, Amstrong AJ, Rathkof DE et al. Enzalutamide in metastatic prostatae cancer before chemotherapy. N Engl J Med 2014; 371(5): 424 – 433. doi: 10.1056/NEJMoa1405095.
19. Antonarakis ES, Lu C, Wang H et al. AR-V7 and resistance to enzalutamid and abirateron in prostate cancer. N Eng J Med 2014; 371(11): 1028 – 1038. doi: 10.1056/NEJMoa1315815.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 2-
All articles in this issue
- Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Novinky v adjuvantní terapii neseminomů stadia I
- Comment – Active Surveillance vs. Adjuvant Therapy in Clinical Stage I Non-seminomatous Germ Cell Testicular Cancer
- Kvalita života měřená jako změna v čase u českých žen s karcinomem prsu
- Papilárny karcinóm štítnej žľazy u dvojročného dieťaťa
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

