-
Medical journals
- Career
Protinádorový efekt rybího oleje – mýtus, nebo realita?
Authors: J. Neuwirthová; B. Gál; P. Smilek; P. Urbánková; R. Kostřica
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně
Published in: Klin Onkol 2016; 29(2): 100-106
Category: Review
doi: https://doi.org/10.14735/amko2016100Overview
Omega-3 mastné kyseliny z rybího oleje přinášejí mnohé zdravotní benefity využitelné i pro onkologické pacienty. Kromě jejich dobře známého protizánětlivého působení mají potenciál působit synergisticky s chemoterapií a zvyšovat radiosenzitivitu nádorů. Jejich protinádorový efekt je komplexní, a založen tak na více mechanizmech účinku. Byla u nich popsána zvýšená lipidová peroxidace během léčby, ovlivnění receptorových cest v nádorových buňkách, snížení tvorby prozánětlivých cytokinů podporujících buněčnou proliferaci, aktivace apoptózy v nádorové tkáni, imunomodulace a ovlivnění hormonálního metabolizmu. Výsledky jak epidemiologických, tak i experimentálních studií podporují existenci protinádorového účinku rybího oleje u zvířat i u lidí. Náš běžný západní styl stravy obsahuje nadbytek omega-6 mastných kyselin, které interferují se zdravotními přínosy omega-3 mastných kyselin, neboť soutěží o stejná vazebná místa a enzymové systémy. Z tohoto důvodu je pro projevení se protinádorového účinku omega-3 mastných kyselin potřeba i současně snížit konzumaci opačně působících omega-6 mastných kyselin. Některé epidemiologické studie mají vedle toho kontroverzní výsledky, které jsou však vysvětlitelné rozpory v jejich metodologii.
Klíčová slova:
omega-3 mastná kyselina – rybí olej – chemoprevence – protinádorová látka – apoptóza – lipoperoxidaceÚvod
Současná věda hledá stále nové možnosti, které by pomohly snížit výskyt nádorů, ale i toxicitu a následky onkologické léčby. Současně s tím se v posledních letech v medicíně rozvíjí i tzv. farmakonutrice, která umožňuje přirozeně se vyskytující složkou stravy v závislosti na dávce léčebně ovlivnit mnohé onemocnění [1]. Je jasné, že vývoj nových léků bude přinášet stále větší finanční zátěž, a v mnoha případech zůstává nepřekonaný problém toxicity. Proto je důležité věnovat pozornost podnětům, které ukazují na netoxickou a finančně nenáročnou možnost využití omega-3 mastných kyselin (MK) za účelem snížení výskytu nádorů i toxicity léčby. V současné době jsou omega-3 MK v onkologickém oboru využívány pouze s cílem zbrzdit kachexii pacientů a budoucnost ukáže, zdali vzniknou i další možnosti indikací.
Studie prokázaly, že přirozeně se vyskytující kyselina eikosapentaenová (EPA) a dokosahexaenová (DHA) z rybího oleje působí v organizmu různými mechanizmy od inkorporace do buněčných membrán se změnou jejich struktury a funkce přes vazbu na receptory a přímé ovlivnění genové exprese až po tvorbu specifických tkáňových mediátorů, tzv. resolvinů, protektinů a maresinů, které také ovlivňují mnohé buněčné procesy. Jejich efekt je, jak známo, protizánětlivý a proresorpční, ale i antikachektický, antitrombotický, hepatoprotektivní, nefroprotektivní, kardioprotektivní, neuroprotektivní aj. V posledních letech byly navíc popsány i některé zajímavé mechanizmy přímého protinádorového působení [2].
Toto review se proto zaměří na souhrn možných protinádorových účinků omega-3 MK. Vedle toho bychom chtěli pomoci osvětlit a zodpovědět některé kontroverzní otázky. Například jak je možné, že některé studie prokázaly, že vysoký příjem rybího oleje je spojen s nižším rizikem nádorů, a na straně druhé jiné studie prokazují vyšší výskyt v souvislosti s vysokotučnou stravou? Vedle toho některé studie, zejména stran karcinomů prostaty, mají kontroverzní výsledky. Jaké metodologické problémy a důvody tyhle rozpory mají a lze z nich udělat závěr? A pokud prokázal rybí olej opravdu protinádorový účinek, jaký je jeho molekulární mechanizmus?
Epidemiologické studie vlivu tuků na kancerogenezi a hledání odpovědi na kontroverzní otázky v této oblasti
Jak již bylo zmíněno, první kontroverzní otázka je ta, proč některé studie prokazují jednoznačnou spojitost mezi vyšší konzumací tuku a vznikem některých karcinomů, a na straně druhé jiné studie u těchto stejných nádorů dokladují nižší výskyt, pokud se sledují pouze v souvislosti s vyšším příjmem rybího tuku. Tato nejasnost má svoje vysvětlení, které spočívá ve faktu, že větší roli než celkové množství tuku má jeho složení. Většina živočišných tuků jsou zdroje, které pokud jsou konzumovány ve vysokém množství, podporují vznik některých druhů nádorů, zatímco rybí olej u stejných nádorů působí naopak, tedy preventivně. Zejména se to týká karcinomů prsu či prostaty, které mají velké rozdíly ve výskytu v jednotlivých populacích, a tyto rozdíly se zdají být kromě dalších faktorů podmíněny i odlišnostmi ve stravě. Jejich vysoké zastoupení v USA a Evropě ve srovnání s Asií je do značné míry závislé na stravovacích zvyklostech v těchto zemích, což bylo vysledováno na základě nárůstu jejich výskytu u asijské populace přistěhovalců vlivem změny jídelníčku v USA [3,4]. V Japonsku bylo zase popsáno v období mezi 60. a 90. léty 20. století zvýšení incidence karcinomu prsu v souvislosti s procentuálním nárůstem celkové konzumace tuku. Pokud se ale zaměříme pouze na vyšší konzumaci rybího tuku, výsledky jsou opačné, tedy preventivní. Pro Eskymáky je sice také charakteristická vysokotučná strava, ale hlavním zdrojem tuků je rybí olej a tato populace měla dlouhodobě naopak nižší výskyt zmíněných karcinomů prsu a prostaty. Souvislost mezi těmito faktory byla podpořena pozorováním, kdy u populace Eskymáků došlo snížením konzumace ryb přechodem na západní styl stravy k významnému nárůstu incidence sledovaných nádorů [1,5,6]. Také mnohé další epidemiologické studie upozornily na ochranný vliv rybího oleje na výskyt nádorů, a naopak na pronádorový vliv ostatních živočišných tuků, dle lokalit pak nejvíce na hormonálně závislé karcinomy a na karcinom tlustého střeva [7 – 10].
Pokud se ale zaměříme pouze na studie sledující vliv konzumace ryb na výskyt nádorů, tak i zde nalézáme kontroverzní výsledky. Ukazuje se, že pozitivní korelace vychází především ve studiích s dlouhodobým sledováním. Problémem možnosti věrohodného zhodnocení populačních studií je kromě časového faktoru i multifaktoriální vliv na výskyt nádorů a možnost zkreslení výsledků jejich koincidencí při změně životního stylu. Uvést to lze na příkladu karcinomů prsu, u kterých jsou časný věk pro menarche a první těhotenství a delší doba kojení faktory snižující riziko jejich výskytu podobně jako sledovaný rybí olej. Tyto faktory mají koincidenci, tedy jsou typické pro asijské oblasti s vyšší konzumací ryb ve srovnání např. s americkou nebo středoevropskou populací, a obojí se současně mění vlivem změny životního stylu. Vedle toho hraje roli to, že přechod na americký či středoevropský styl stravy s sebou nese nejen pokles konzumace omega-3 MK, ale i současné zvýšení konzumace opačně, tedy pronádorově působích nutričních složek dále ztěžující možnost věrohodné analýzy. Někteří autoři upozorňují i na možnost existence genetických variant v rámci metabolických cest, a tím účinků omega-3 MK. Problémem populačních studií je také samotný zdroj a kvalita ryb, které mohou obsahovat nejen málo omega-3 MK, ale i zdraví škodlivé látky, ať již primárně kontaminací z moře, anebo kancerogenů vznikajících po jejich tepelné úpravě nebo uzení. Pro metaanalýzy je také důležité srovnat, co si jednotliví autoři představují pod pojmem vyšší konzumace ryb, neboť ani tato definice není mezi studiemi jednoznačná. A rozdíly existují dokonce i ve vlastních sledovaných zdrojích mořských ryb, což některé studie již vůbec nerozlišují. Autoři samozřejmě správně odfiltrují sladkovodní ryby, které, jak známo, nejsou zdrojem omega-3 MK, ale již nerozlišují mezi jednotlivými druhy mořských ryb. Je potřeba si uvědomit, že relativně vysoká koncentrace omega-3 MK je nalézána pouze v tučných divokých rybách studených vod, jako je losos, makrela, sardinka, sleď apod., kdežto ryby teplých vod či farmářsky chované mají buďto málo tuku s nízkým obsahem omega-3 MK, anebo dokonce převažující opačně působící omega-6 MK. I v rámci mořských ryb se tedy jedná o významné rozdíly [2].
Přestože se nejedná o epidemiologickou studii, je potřeba zde na závěr osvětlit i kontroverzní výsledky studie SELECT, která před několika lety na rozdíl od ostatních upozornila na možnou souvislost mezi karcinomem prostaty a omega-3 MK, a vzbudila proto velkou pozornost odborníků i médií. Po bližším prozkoumání této studie však byl její závěr stran vlivu omega-3 MK dalšími autory zpochybněn. Jednak tato studie nebyla od začátku primárně cílena na sledování korelace mezi konzumací rybího oleje a karcinomů prostaty, tedy nebyla účastníkům doporučena konzumace ryb nebo rybího oleje, jednak vedle toho byly přítomny i další nedostatky, např. stran měření koncentrace MK pouze 1krát a pouze ve fosfolipidech plazmy namísto buněčných membrán erytrocytů. Je z jiných studií dobře známo, že v séru se omega-3 MK drží pouze několik dnů, hladiny v séru podléhají velké variabilitě, a pro detekci dlouhodobého stavu zásob omega-3 MK jsou proto mnohem vhodnější membrány krevních buněk [11]. Odhalené závažné metodologické chyby mohou být logickým vysvětlením, proč se její výsledky liší od řady jiných studií na lidech, které naopak ochranný vliv rybího oleje prokazují.
I přes mnohé překážky a někdy rozporuplné výsledky studií velké metaanalýzy podporují teorii ochranného vlivu rybího oleje na výskyt nádorů a daly významný podnět k dalším experimentálním a klinickým studiím v této oblasti [6].
Preklinické a klinické studie protinádorového účinku omega-3 MK a odhalení jeho molekulárních mechanizmů
Experimentální studie jsou stran protinádorového účinku omega-3 MK již mnohem průkaznější a jednoznačnější. Byly popsány mnohé molekulární mechanizmy, jakými jednotlivé tuky na samotný proces vzniku nádoru působí. Výzkum stran studií na lidech se však teprve rozvíjí a naráží podobně jako epidemiologické studie na mnohé metodologické překážky a někdy i protichůdné výsledky. Co se zdá být největšími problémy?
Na prvním místě je nutno poznamenat, že rostlinnou formu omega-3 MK, tedy kyselinu alfa-linolenovou (ALA), v tomto smyslu nelze brát jako efektivní zdroj, neboť její enzymatická konverze na vlastní živočišné, a tedy bioaktivní formy probíhá v lidském organizmu pouze v zanedbatelném procentu. Dalším problémem, který může být příčinou neúspěchu studií, je fakt, že současné standardní denní dávky 1 – 2 g EPA a DHA jsou pro mnoho indikací nízké a tím pádem neúčinné. Vedle rizika poddávkování má vliv i současný příjem opačně působících omega-6 MK. Jak již bylo zmíněno, v rámci výsledného efektu je více než celková dávka tuků důležité jejich složení. Zejména poměr omega-3 vůči omega-6 MK může hrát dokonce větší roli než jejich jednotlivá dávka. Je to dáno tím, že omega-3 a omega-6 MK soutěží o stejná vazebná místa, enzymové systémy a signální cesty. Jinými slovy tedy pro projevení se a zhodnocení vlastních příznivých účinků rybího oleje je nutno nejen zvážit optimální dávkování, ale současně i snížit příjem kompetitivně a opačně působících omega-6 MK, kterých je v našem jídelníčku zbytečný nadbytek v rámci jiných zdrojů tuků (obr. 1) [12].
Image 1. Nadmíra omega-6 MK ve stravě může kompetitivním způsobem vyrušit protizánětlivý a protinádorový efekt omega-3 MK. 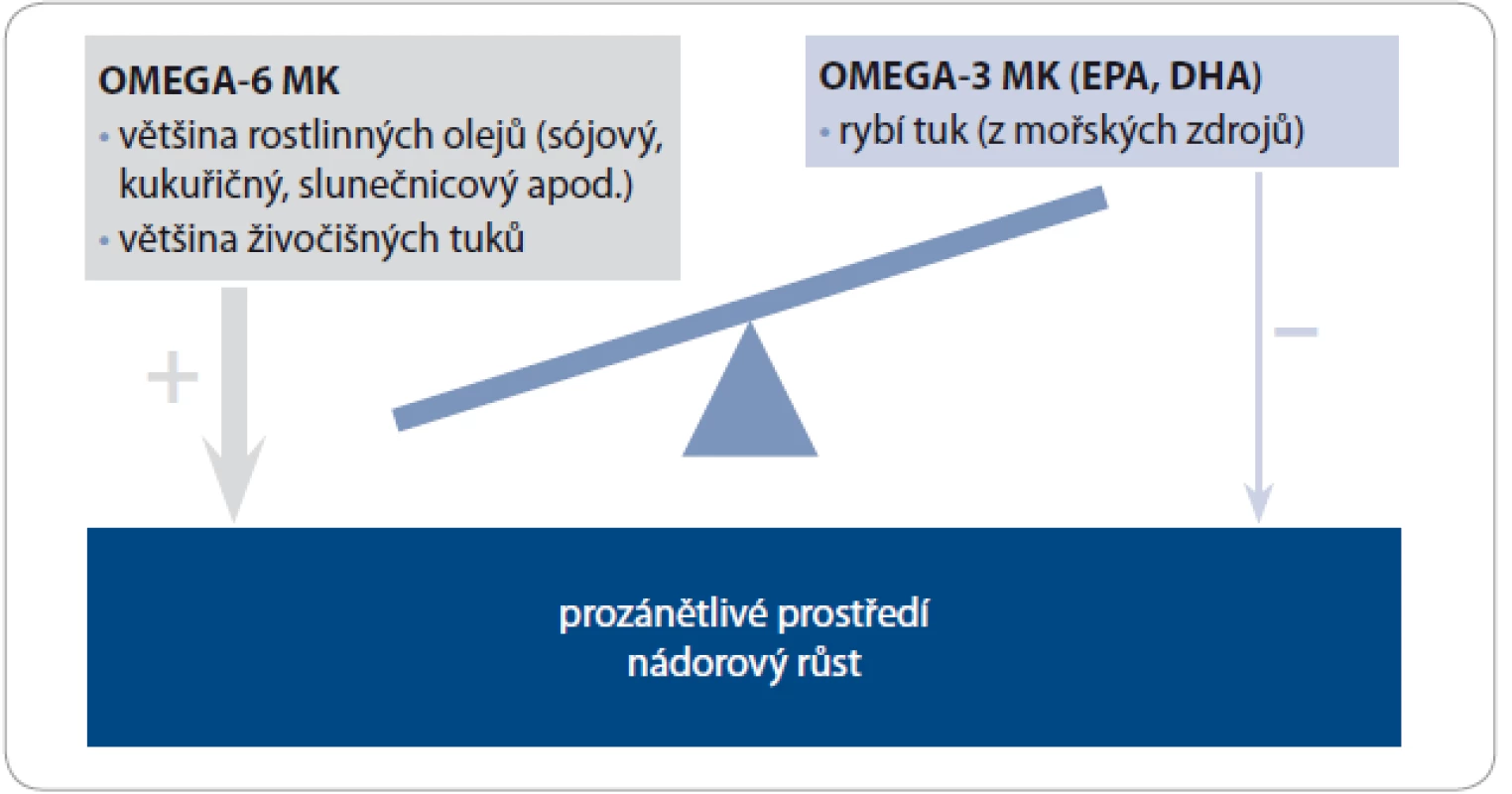
Z mnoha modelů karcinomů je známo, že zánětlivé prostředí přispívá ke kancerogenezi a urychluje ji a protizánětlivé látky mohou tento proces utlumit. U omega-3 MK byla však kromě známého protizánětlivého působení navíc identifikována i řada přímých protinádorových účinků a zaujaly proto pozornost onkologického výzkumu. Živočišné formy omega-3 MK, tedy EPA a DHA, působí v organizmu mnoha mechanizmy jak samy o sobě, tak i skrze tvorbu specifických tkáňových mediátorů. V experimentálních in vitro i in vivo studiích na modelech různých druhů karcinomů byla prokázána inhibice proliferace a aktivace apoptózy nádorových buněk, vliv na mezibuněčné spojení, inhibice angiogeneze, invazivity a metastazování, a v neposlední řadě příznivé imunomodulační působení. Důležité je, že protinádorový efekt omega-3 MK se ukazuje být selektivní na nádory, současně tedy nepoškozuje zdravé buňky organizmu [13].
Jaká je vlastní molekulární podstata protinádorových mechanizmů omega-3 MK? (tab. 1)
1. Změna struktury a funkce membrán, vliv na lipidové rafty a membránové receptory
Po inkorporaci omega-3 MK do membránových fosfolipidů se mění nejen permeabilita a flexibilita membrán, ale i aktivita membránových receptorů a tím mnoha klíčových signálních soustav, jako jsou receptory spřažené s G proteinem (G protein-coupled receptor – GPCR), toll-like receptory (TLR-4), tyrozinkinázové receptory (receptor pro epidermální růstový faktor (epidermal growth factor receptor – EGFR)), iontové kanály aj. [14 – 16]. Příkladem je vliv na EGFR, který je v onkologii sledován jako jedna z důležitých struktur pro růst nádoru i jako cíl některých protinádorových léků. Je známo, že omega-3 MK mění strukturu lipidových raftů buněčných membrán a snižují tak výskyt cholesterolu v nich. Snížení obsahu cholesterolu v lipidových raftech vyvolá mnohé další změny, mezi nimiž je i snížení množství EGFR receptorů na povrchu buněk. Bylo prokázáno, že snížení zastoupení EGFR v membránách nádorových buněk má působením omega-3 MK vliv na vyvolání apoptózy [17]. V důsledku působení omega-3 MK byla nalezena jak nižší aktivace EGFR [18], tak i nižší aktivace Ras proteinu, který je intracelulárním přenašečem a hraje úlohu v proliferaci i metastazování nádorových buněk [19]. Omega-3 MK jsou schopny nejen změnit exprimované množství membránových receptorů, ale na některé receptory jsou schopny i tvořit vazby jako ligandy. Mezi tyto receptory patří receptor aktivovaný peroxizomovými proliferátory (peroxisome proliferators-activated receptors – PPAR-γ). Jak známo, aktivátory PPAR-γ jsou potenciálními protinádorovými látkami díky svému vlivu na buněčnou proliferaci, diferenciaci a přežívání. Signální cesta PPAR-γ a její vliv na zpomalení růstu nádorových buněk a na indukci apoptózy již byla identifikována u různých druhů malignit [20]. Jedním z významných faktorů kancerogeneze je také ztráta funkce tzv. gap junctions tvořících membránový komunikační systém sousedících buněk. Jedná se o epigenetický faktor kancerogeneze, neboť buňka po přerušení těchto mezibuněčných spojení ztrácí kontrolu z okolí a může se tím projevit její onkogenní potenciál. Omega-3 MK prokázaly normalizaci funkce gap junctions skrze inhibici tyrozinkinázových receptorů, což má také význam pro chemoprevenci [21]. Omega-3 MK dále snižují adhezivitu nádorových buněk, zejména downregulací Rho-GTPázy, redukcí exprese intracelulárních adhezních molekul ICAM a vaskulárních adhezních molekul VCAM [22].
Table 1. Souhrn jednotlivých prokázaných protinádorových mechanizmů omega-3 MK. 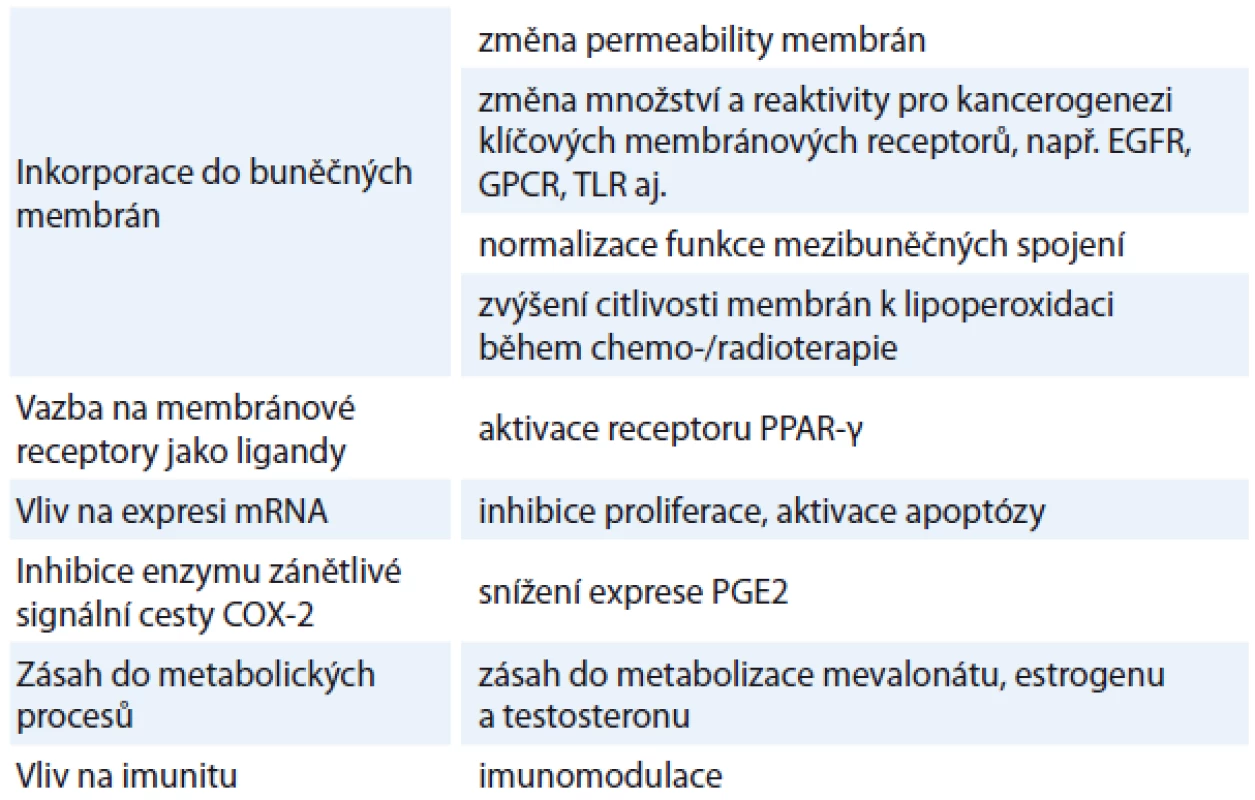
2. Inhibice iniciační fáze translace onkogenních proteinů z mRNA, zástava buněčného cyklu a tím růstu nádorových buněk
Translace je buněčný proces exprese proteinů z mRNA a má tři fáze – iniciaci, elongaci a terminaci. Zvýšená exprese proteinů regulující proces zahájení translace vede k neoplastické transformaci buněk skrze vyšší expresi onkogenních proteinů, jako je c-myc, cyklin D1 apod. Zvýšená exprese iniciačního faktoru translace byla zaznamenána např. u karcinomů hlavy a krku, kolorekta, prsu, močového měchýře a lymfomů. Experimentální studie ukazují, že omega-3 MK jsou schopny inhibovat zahájení procesu translace mRNA a snížit tak expresi onkogenních proteinů. Nádorové buňky jsou tímto mechanizmem blokovány v G1 fázi a vykazují vyšší stupeň apoptózy [3,23 – 28]. Další sledovanou strukturou je Wnt, která představuje intracelulární signální cestu zasahující do procesů buněčné diferenciace a migrace a její regulace probíhá skrze β-catenin. Zvýšená aktivace této signální cesty byla identifikována u mnoha druhů nádorů. In vitro i in vivo studie prokázaly, že omega-3 MK jsou schopny inhibice Wnt/ β-catenin signalizace a tím útlumu exprese c-myc a cyklinu D1 s inhibicí proliferace nádorových buněk [29,30]. Podpora degradace β-cateninu vlivem omega-3 MK byla popsána v souvislosti se snížením tvorby pronádorového prostaglandinu E2 (PGE2) [31].
3. Snížení produkce pronádorového PGE2 z omega-6 MK a zvýšení syntézy protinádorového PGE3 z omega-3 MK
Eikosanoidy jsou tkáňové působky, které zahrnují prostaglandiny, leukotrieny a tromboxany. Jejich účinky se liší v závislosti na tom, z jakých polynenasycených MK vznikají, tedy jestli z omega-3, nebo omega-6, které, jak známo, působí protichůdným způsobem. Ovlivňují mnoha mechanizmy buněčnou proliferaci, diferenciaci a apoptózu. Dále je dlouhodobě známo, že PGE2, který vzniká z omega-6 MK kyseliny arachidonové prostřednictvím enzymu cyklo-oxygenázy-2 (COX-2), podporuje zánět i kancerogenezi. Příjem omega-3 MK kompetitivním způsobem vytěsňuje kyselinu arachidonovou z buněčných membrán [32] a navíc i inhibuje enzym COX-2 [33,34]. Vytěsnění omega-6 MK z buněčných membrán a inhibice enzymů produkujících prozánětlivé pronádorové působky je jedním z důležitých mechanizmů protinádorového efektu omega-3 MK. Patologicky zvýšená exprese COX-2 byla zachycena v souvislosti s vývojem celé řady nádorů, např. karcinomů hlavy a krku, plic, prsu, žaludku, tlustého střeva, prostaty, pankreatu, mozku, gliomů, melanomů aj. Navíc je známo, že inhibitory COX-2 zabraňují progresi adenomů do adenokarcinomů u pacientů s familiární adenopolypózou střev a působí chemopreventivně v rámci prevence nádorů [35]. Bylo prokázáno, že COX-2 hraje skrze PGE2 roli ve všech fázích kancerogeneze od iniciace, promoce až po metastazování. Vlivem PGE2 dochází k aktivaci EGFR [36,37], Ras, MAPK a dalších pro kancerogenezi klíčových struktur [38,39]. Protinádorový vliv rybího oleje má vedle toho i tvorba opačně působících, tedy protizánětlivých a protinádorových eikosanoidů z omega-3 MK. Jedná se o prostaglandiny třídy 3 (PGE3), které ve studiích opakovaně prokázaly vliv na inhibici kancerogeneze [40]. Inhibice COX-2 skrze omega-3 MK má za následek nejen inhibici proliferace nádorových buněk, ale i inhibici angiogeneze skrze útlum exprese vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF), růstového faktoru odvozeného od krevních destiček (platelet derived growth factor – PDGF), matrixových metaloproteináz (MMP-2) aj. Je známo, že omega-6 MK působí na novotvorbu cév aktivačně, a sice již zmíněným kompetitivním způsobem. Studie proto upozorňují, že jak pro projevení se protizánětlivých, tak i protinádorových a antiangiogenních účinků omega-3 MK je potřeba současně snížit příjem opačně působících omega-6 MK [41,42].
4. Účinek na metabolizmus mevalonátu
Enzym 3-hydroxy-3-metylglutaryl koenzym A (HMG-CoA) reduktáza hraje roli v syntéze mevalonátu a má vliv na proliferaci buněk. Po podání rybího oleje byl popsán skrze supresi HMG-CoaA pokles syntézy mevalonátu ve žlázách savců, což představuje jeden z dalších možných protinádorových mechanizmů omega-3 MK [43].
5. Vliv na metabolizmus estrogenu a testosteronu
Estradiol je metabolizován dvěma cestami s tvorbou dvou různých metabolitů, tedy 16-hydroxyestronu a 2-hydroxyestronu. U karcinomu prsu je známo, že je riziková C16-hydroxylace estradiolu. Studie prokázaly, že rybí olej u žen redukuje C16-hydroxylaci [44,45]. Nižší produkce 16-hydroxyestronu s přesunem metabolických pochodů ke tvorbě 2-hydroxyestronu vlivem omega-3 MK tak může snížit riziko karcinomu prsu. Omega-3 MK navíc interferují s metabolizmem testosteronu. Inhibice enzymu 5α-reduktázy a tím nižší produkce dihydrotestosteronu [46] může být jedním z mechanizmů snižujících riziko karcinomu prostaty. Zásah do metabolizace hormonů je zajímavým chemopreventivním mechanizmem, který má potenciál uplatnit se nejen u typických hormonálně závislých nádorů. Souvislost kancerogeneze s hladinou sexuálních hormonů totiž byla díky přítomnosti hormonálních receptorů prokázána i u zdánlivě odlišných oblastí. Příkladem mohou být karcinomy horních dýchacích a polykacích cest aj. [47 – 52].
6. Imunomodulace a protiinfekční působení
Omega-3 MK mají vliv na reaktivitu imunitních buněk a zasahují tak mnoha mechanizmy do signálních cest zánětu s ovlivněním transkripčního faktoru NF-κB a tím produkce prozánětlivých cytokinů. Jejich účinek s potlačením zánětu není imunosupresivní, ale imunomodulační, neboť současně podporují rychlejší vstřebání zánětu a mají i určitý antimikrobiální efekt. Je známo, že imunomodulační účinek je součástí komplexního protinádorového mechanizmu omega-3 MK [53]. Příkladem je karcinom žaludku, u kterého byl prokázán chemopreventivní efekt rybího oleje, daný mj. i rychlejší eradikací infekce Helicobacter pylori, která, jak známo, hraje roli v kancerogenezi této oblasti [54 – 56].
7. Indukace oxidačního stresu v nádorových buňkách, zvýšená citlivost k lipidové peroxidaci při chemoterapii a radioterapii
Jak již bylo uvedeno, omega-3 MK se inkorporují do buněčných membrán, kde ovlivňují mnoho signálních soustav. Zároveň se ale zvýšením obsahu polynenasycených MK stávají buňky citlivější k chemoterapii a radioterapii, což představuje jeden z dalších protinádorových mechanizmů. Membrány jsou tak vulnerabilnější vůči oxidačnímu stresu a v takovémto prostředí byl zachycen vyšší stupeň apoptózy nádorových buněk [57,58]. Zvýšená citlivost k léčbě byla popsána jak u chemoterapie, tak i u radioterapie. Vlivem přidání omega-3 MK dochází k vyššímu stupni lipoperoxidace a apoptózy, což bylo prokázáno na různých druzích karcinomů [59 – 62]. Mutace proapoptotických genů, jako je např. p53, je jedním ze sledovaných markerů vyšší malignity u mnoha tumorů [63]. I při mutaci p53 prokázaly omega-3 MK pronádorový účinek skrze indukci mitochondriálního oxidačního stresu, a tím otevírají zajímavý terapeutický potenciál do budoucna [64]. Vedle toho studie prokázaly, že přidání antioxidantů tento prooxidační protinádorový mechanizmus rybího oleje může vyrušit [65].
Studie kombinací omega-3 MK se současnými protinádorovými léky a slibné možnosti do budoucna
Díky specifickému protizánětlivému a protinádorovému účinku, ale i díky možnosti zbrzdění rozvoje kachexie, omezení fibrotizace tkání a protekce vnitřních orgánů při léčbě se stávají omega-3 MK velmi zajímavé pro onkologické indikace jak v rámci prevence, tak i během léčby. Díky tomu, že působí přímým protinádorovým účinkem i skrze chemo - a radiosenzitizaci, se zkoušejí různé kombinace se současnými léky. Zlepšení efektu onkologické léčby při podání omega-3 MK bylo popsáno při radioterapii a na příkladu chemoterapeutik, jako je doxorubicin, epirubicin, 5-fluorouracil, oxaliplatina, cisplatina, tamoxifen, gemcitabin [66 – 74], ale i při cílené léčbě inhibitory EGFR [75].
Dalším příkladem je kombinace omega-3 MK s inhibitory COX-2. Kromě synergistického efektu v rámci chemoprevence karcinomů kolorekta se u této kombinace jeví jako slibná možnost i prevence kachexie onkologických pacientů [39].
Zjištěné antiproliferativní a proapoptotické působení bylo dokonce důvodem vývoje syntetických analog omega-3 MK, nabízejících tak pole výzkumu nového druhu protinádorových léků [76].
Význam chemoprevence stravou pro praxi
Nutriční podpora a tzv. imunonutrice prokázala velmi dobrý efekt na zlepšení výsledků léčby a přežití u onkologických pacientů [77], ale vliv úpravy stravy se významně uplatňuje i v rámci prevence nádorů u zdravé populace. Udává se, že pouze dietárními faktory je preventabilních až 40 % všech nádorů, přičemž míra preventability značně závisí na nádorové lokalizaci. Například nádory zažívacího traktu, jako jícnu, žaludku a kolorekta, jsou dietárními faktory preventabilní až ze 75 %. Velmi významný je i efekt stravy na řadu nádorů mimo gastrointestinální trakt, kdy nádory prsu a endometria jsou dietárními faktory preventabilní až z 50 %, nádory plic až ze 30 % [78] a podobně lze nalézt i některé jiné. Tato fakta jsou důvodem, proč je ve výzkumu tolik pozornosti věnováno popisu vlivu přirozených složek stravy na vlastní proces kancerogeneze. Pro onkologické indikace jsou vedle omega-3 MK předmětem studií i mnohé další přírodní látky v rámci tzv. chemoprevence [79], a teprve budoucnost ukáže, zdali se v širší míře dokážou uplatnit i v praxi.
Závěr
V současné době bylo odhaleno několik cest protinádorového účinku omega-3 MK. Byly popsány molekulární mechanizmy, kterými omega-3 MK aktivují apoptózu, inhibují proliferaci, invazivitu a metastazování nádorových buněk, potlačují angiogenezi a v neposlední řadě i mechanizmy imunomodulace. Klinický výzkum se teprve rozvíjí, ale již nyní se na základě dostupných preklinických dat zdají být omega-3 MK slibné jak v prevenci, tak i v kombinaci s onkologickou léčbou na základě jejich synergistického efektu s radioterapií, chemoterapií a cílenou léčbou. Některé epidemiologické studie cílené na sledování konzumace rybího oleje a výskytu nádorů přinesly vedle toho kontroverzní výsledky a vzbudily rozdílné názory. Tyto však byly po bližší analýze vysvětleny jejich metodologickými nedostatky. Je nutno rozlišovat ve zdrojích ryb, účinek je také závislý na vlastní dávce omega-3 MK, na poměru vůči opačně působícím omega-6 MK a na některých dalších faktorech. Dále pokud se sleduje hladina omega-3 MK v organizmu, je nutno ji detekovat z membrán krevních buněk, které mnohem lépe odrážejí stav dlouhodobých zásob ve srovnání s jejich hladinou v séru. I přes mnohé nejasnosti v tomto tématu velké metaanalýzy studií nakonec podpořily závěry ohledně ochranného vlivu rybího oleje. Stále však zůstala nedořešená otázka optimální dávky omega-3 MK, neboť současné standardní dávky se jeví v mnoha indikacích jako relativně nízké. Navíc se ukazuje, že samotné doplnění rybího oleje negativní efekt středoevropské a americké vysokotučné stravy bohaté na omega-6 MK nemá sílu vyrušit. Pro projevení se farmakonutričních účinků omega-3 MK je vhodné doporučit i další opatření ve smyslu současného snížení konzumace jiných tuků, neboť bylo prokázáno, že dokonce ještě více než samotná dávka má na výsledný efekt vliv vlastní poměr omega-3 vůči opačně kompetitivně působícím omega-6 MK.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 6. 11. 2015
Přijato: 9. 1. 2016
MUDr. Břetislav Gál, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF MU a FN u sv. Anny v Brně
Pekařská 664/53
656 91 Brno
e-mail: b.gal@fnusa.cz
Sources
1. Zadák Z, Tichá A, Hronek M et al. Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě. Vnitr Lek 2011; 57(11): 970 – 974.
2. Aktas BH, Chorev M, Halperin JA. Cancer and n-3 PUFAs: the translations initiation connection. In: Milner JA, Romagnolo DF (eds). Nutrition and health: bioactive compounds and cancer. Springer 2010 : 253 – 273.
3. Ziegler RG, Hoover RN, Pike MC et al. Migration patterns and breast cancer risk in Asian American women. J Natl Cancer Inst 1993; 85(22): 1819 – 1827.
4. Deapen D, Liu L, Perkins C et al. Rapidly rising breast cancer incidence rates among Asian-American women. Int J Cancer 2002; 99(5): 747 – 750.
5. Nielsen NH, Hansen JP. Breast cancer in Greenland-selected epidemiological, clinical, and histological features. J Cancer Res Clin Oncol 1980; 98(3): 287 – 299.
6. Terry PD, Rohan TE, Wolk A. Intakes of fish and marine fatty acids and the risks of cancers of the breast and prostate and of other hormone-related cancers: a review of the epidemiologic evidence. Am J Clin Nutr 2003; 77(3): 532 – 543.
7. Lanier AP, Kelly JJ, Smith B et al. Alaska Native cancer update: incidence rates 1989 – 1993. Cancer Epidemiol Biomarkers Prev 1996; 5(9): 749 – 751.
8. Tsuji K, Harashima E, Nakagawa Y et al. Time-lag effect of dietary fiber and fat intake ratio on Japanese colon cancer mortality. Biomed Environ Sci 1996; 9(2 – 3): 223 – 228.
9. You WC, Jin F, Devesa S et al. Rapid increase in colorectal cancer rates in urban Shanghai, 1972 – 97, in relation to dietary changes. J Cancer Epidemiol Prev 2002; 7(3): 143 – 146.
10. Thiebaut AC, Chajes V, Gerber M et al. Dietary intakes of omega-6 and omega-3 polyunsaturated fatty acids and the risk of breast cancer. Int J Cancer 2009; 124(4): 924 – 931. doi: 10.1002/ijc.23980.
11. Weylandt KH, Serini S, Chen YQ et al. Omega-3 polyunsaturated fatty acids: the way forward in times of mixed evidence. Biomed Res Int 2015; 2015 : 143109. doi: 10.1155/ 2015/143109.
12. Gerber M. Omega-3 fatty acids and cancers: a systematic update review of epidemiological studies. Br J Nutr 2012; 107 (Suppl 2): S228 – S239. doi: 10.1017/S0007114512001614.
13. Devi KP, Rajavel T, Russo GL et al. Molecular targets of omega-3 fatty acids for cancer therapy. Anticancer Agents Med Chem 2015; 15(7): 888 – 895.
14. Mitchell DC, Niu SL, Litman BJ. DHA-rich phospholipids optimize G-protein-coupled signaling. J Pediatr 2003; 143 (Suppl 4): S80 – S86.
15. Wong SW, Kwon MJ, Choi AM et al. Fatty acids modulate toll-like receptor 4 activation through regulation of receptor dimerization and recruitment into lipid rafts in a reactive oxygen species-dependent manner. J Biol Chem 2009; 284(40): 27384 – 27392. doi: 10.1074/jbc.M109.044065.
16. Xiao YF, Ke Q, Wang SY et al. Single point mutations affect fatty acid block of human myocardial sodium channel alpha subunit Na+ channels. Proc Natl Acad Sci U S A 2001; 98(6): 3606 – 3611.
17. Schley PD, Brindley DN, Field CJ. (n-3) PUFA alter raft lipid composition and decrease epidermal growth factor receptor levels in lipid rafts of human breast cancer cells. J Nutr 2007; 137(3): 548 – 553.
18. Corsetto PA, Montorfano G, Zava S et al. Effects of n-3 PUFAs on breast cancer cells through their incorporation in plasma membrane. Lipids Health Dis 2011; 10 : 73. doi: 10.1186/1476-511X-10-73.
19. Rogers KR, Kikawa KD, Mouradian M et al. Docosahexaenoic acid alters epidermal growth factor receptorrelated signaling by disrupting itslipid raft association. Carcinogenesis 2010; 31(9): 1523 – 1530. doi: 10.1093/carcin/bgq111.
20. Edwards IJ, O‘Flaherty JT. Omega-3 fatty acids and PPARgamma in cancer. PPAR Res 2008; 2008 : 358052. doi: 10.1155/2008/358052.
21. Zhang YW, Morita I, Yao XS et al. Pretreatment with eicosapentaenoic acid prevented hypoxia/ reoxygenation-induced abnormality in endothelial gap junctional intercellular communication through inhibiting the tyrosine kinase activity. Prostaglandins Leukot Essent Fatty Acids 1999; 61(1): 33 – 40.
22. Stephenson JA, Al-Taan O, Arshad A et al. The multifaceted effects of omega-3 polyunsaturated fatty acids on the hallmarks of cancer. J Lipids 2013; 2013 : 261247. doi: 10.1155/2013/261247.
23. Palakurthi SS, Flückiger R, Aktas H et al. Inhibition of translation initiation mediates the anticancer effect of the n-3 polyunsaturated fatty acid eicosapentaenoic acid. Cancer Res 2000; 60(11): 2919 – 2925.
24. Aktas H, Halperin JA. Translational regulation of gene expression by omega-3 fatty acids. J Nutr 2004; 134 (Suppl 9): 2487S – 2491S.
25. Mandal CC, Ghosh-Choudhury T, Dey N et al. miR-21 is targeted by omega-3 polyunsaturated fatty acid to regulate breast tumor CSF-1 expression. Carcinogenesis 2012; 33(10): 1897 – 1908. doi: 10.1093/carcin/bgs198.
26. Yao QH, Zhang XC, Fu T et al. ω-3 polyunsaturated fatty acids inhibit the proliferation of the lung adenocarcinoma cell line A549 in vitro. Mol Med Rep 2014; 9(2): 401 – 406. doi: 10.3892/mmr.2013.1829.
27. Lu Y, Nie D, Witt WT et al. Expression of the fat-1 gene diminishes prostate cancer growth in vivo through enhancing apoptosis and inhibiting GSK-3 beta phosphorylation. Mol Cancer Ther 2008; 7(10): 3203 – 3211. doi: 10.1158/1535-7163.MCT-08-0494.
28. Jakobsen CH, Størvold GL, Bremseth H et al. DHA induces ER stress and growth arrest in human colon cancer cells: associations with cholesterol and calcium homeostasis. J Lipid Res 2008; 49(10): 2089 – 2100. doi: 10.1194/jlr.M700389-JLR200.
29. Xue M, Wang Q, Zhao J et al. Docosahexaenoic acid inhibited the Wnt/ beta-catenin pathway and suppressed breast cancer cells in vitro and in vivo. J Nutr Biochem 2014; 25(2): 104 – 110. doi: 10.1016/j.jnutbio.2013.09.008.
30. Song KS, Jing K, Kim JS et al. Omega-3-polyunsaturated fatty acids suppress pancreatic cancer cell growth in vitro and in vivo via downregulation of Wnt/ Beta-catenin signaling. Pancreatology 2011; 11(6): 574 – 584. doi: 10.1159/000334468.
31. Lim K, Han C, Xu L et al. Cyclooxygenase-2-derived prostaglandin E2 activates beta-catenin in human cholangiocarcinoma cells: evidence for inhibition of these signaling pathways by omega 3 polyunsaturated fatty acids. Cancer Res 2008; 68(2): 553 – 560. doi: 10.1158/0008-5472.CAN-07-2295.
32. Rose DP, Rayburn J, Hatala MA et al. Effects of dietary fish oil on fatty acids and eicosanoids in metastasizing human breast cancer cells. Nutr Cancer 1994; 22(2): 131 – 141.
33. Rose DP, Connolly JM. Omega-3 fatty acids as cancer chemopreventive agents. Pharmacol Ther 1999; 83(3): 217 – 244.
34. Park JM, Kwon SH, Han YM et al. Omega-3 polyunsaturated fatty acids as potential chemopreventive agent for gastrointestinal cancer. J Cancer Prev 2013; 18(3): 201 – 208.
35. Evans JF, Kargman SL. Cancer and cyclooxygenase-2 (COX-2) inhibition. Curr Pharm Des 2004; 10(6): 627 – 634.
36. Donnini S, Finetti F, Solito R et al. EP2 prostanoid receptor promotes squamous cell carcinoma growth through epidermal growth factor receptor transactivation and iNOS and ERK1/2 pathways. FASEB J 2007; 21(10): 2418 – 2430.
37. Shao J, Evers BM, Sheng H. Prostaglandin E2 synergistically enhances receptor tyrosine kinase-dependent signaling system in colon cancer cells. J Biol Chem 2004; 279(14): 14287 – 14293.
38. Chun KS, Lao HC, Trempus CS et al. The prostaglandin receptor EP2 activates multiple signaling pathways and beta-arrestin1 complex formation during mouse skin papilloma development. Carcinogenesis 2009; 30(9): 1620 – 1627. doi: 10.1093/carcin/bgp168.
39. Vara-Messler M, Buccellati C, Pustina L et al. Potential role of PUFAs and COXIBs in cancer chemoprevention. Prostaglandins Other Lipid Media 2015; 120 : 97 – 102. doi: 10.1016/j.prostaglandins.2015.04.003.
40. Yang P, Jiang Y, Fischer SM. Prostaglandin E3 metabolism and cancer. Cancer Lett 2014; 348(1 – 2): 1 – 11. doi: 10.1016/j.canlet.2014.03.010.
41. Spencer L, Mann C, Metcalfe M et al. The effect of omega-3 FAs on tumour angiogenesis and their therapeutic potential. Eur J Cancer 2009; 45(12): 2077 – 2086. doi: 10.1016/j.ejca.2009.04.026.
42. Kang JX, Liu A. The role of the tissue omega-6/omega-3 fatty acid ratio in regulating tumor angiogenesis. Cancer Metastasis Rev 2013; 32(1 – 2): 201 – 210. doi: 10.1007/s10555-012-9401-9.
43. El-Sohemy A, Archer MC. Regulation of mevalonate synthesis in rat mammary glands by dietary n-3 and n-6 polyunsaturated fatty acids. Cancer Res 1997; 57(17): 3685 – 3687.
44. Duncan RE, El-Sohemy A, Archer MC. Dietary factors and the regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase: implications for breast cancer and development. Mol Nutr Food Res 2005; 49(2): 93 – 100.
45. Osborne CK. Effects of estrogens and antiestrogens on cell proliferation: Implications for the treatment of breast cancer. Cancer Treat Res 1988; 39 : 111 – 129.
46. Liang T, Liao S. Inhibition of steroid 5 alpha-reductase by specific aliphatic unsaturated fatty acids. Biochem J1992; 285(2): 557 – 562.
47. Ferguson BJ, Hudson WR, McCarty KS Jr. Sex steroid receptor distribution in the human larynx and laryngeal carcinoma. Arch Otolaryngol Head Neck Surg 1987; 113(12): 1311 – 1315.
48. Kleemann D, Kunkel S. Serum dihydrotestosterone versus total testosterone values of patients with laryngeal carcinomas and chronic laryngitis. Laryngorhinootologie 1996; 75(6): 351 – 355.
49. Remenár É, Számel I, Buda B et al. ‚ Why men?‘ Hormones and hormone receptors in male head and neck cancer patients. In: Klainsasser O, Glanz H, Olofsson J (eds). Advances in Laryngology in Europe. J Elsevier 1997 : 137 – 140.
50. Lukits J, Remenár E, Rásó E et al. Molecular identification, expression and prognostic role of estrogen - and progesterone receptors in head and neck cancer. Int J Oncol 2007; 30(1): 155 – 160.
51. Yoo HJ, Sepkovic DW, Bradlow HL et al. Estrogen metabolism as a risk factor for head and neck cancer. Otolaryngol Head Neck Surg 2011; 124(3): 241 – 247.
52. Shatalova EG, Klein-Szanto AJ, Devarajan K et al. Estrogen and cytochrome P450 1B1 contribute to both early - and late-stage head and neck carcinogenesis. Cancer Prev Res 2011; 4(1): 107 – 115. doi: 10.1158/1940-6207.CAPR-10-0133.
53. Kapoor S. Immunomodulatory properties of omega-3 fatty acids: a possible explanation for their systemic, anticarcinogenic effects. J Leukoc Biol 2009; 85(1): 2 – 3. doi: 10.1189/jlb.0708456.
54. Correia M, Michel V, Matos AA et al. Docosahexaenoic acid inhibits Helicobacter pylori growth in vitro and mice gastric mucosa colonization. PLoS One 2012; 7(4): e35072. doi: 10.1371/journal.pone.0035072.
55. Thompson L, Cockayne A, Spiller RC. Inhibitory effect of polyunsaturated fatty acids on the growth of Helicobacter pylori: a possible explanation of the effect of diet on peptic ulceration. Gut 1994; 35(11): 1557 – 1561.
56. Park SH, Kangwan N, Park JM et al. Non-microbial approach for Helicobacter pylori as faster track to prevent gastric cancer than simple eradication. World J Gastroenterol 2013; 19(47): 8986 – 8995. doi: 10.3748/wjg.v19.i47.8986.
57. Gonzalez MJ. Fish oil, lipid peroxidation and mammary tumor growth. J Am Coll Nutr 1995; 14(4): 325 – 335.
58. Hardman WE, Munoz J Jr, Cameron IL. Role of lipid peroxidation and antioxidant enzymes in omega 3 fatty acids induced suppression of breast cancer xenograft growth in mice. Cancer Cell Int 2002; 2(1): 10.
59. Cai F, Sorg O, Granci V et al. Interaction of ω-3 polyunsaturated fatty acids with radiation therapy in two different colorectal cancer cell lines. Clin Nutr 2014; 33(1): 164 – 170. doi: 10.1016/j.clnu.2013.04.005.
60. Kikawa KD, Herrick JS, Tateo RE et al. Induced oxidative stress and cell death in the A549 lung adenocarcinoma cell line by ionizing radiation is enhanced by supplementation with docosahexaenoic acid. Nutr Cancer 2010; 62(8): 1017 – 1024. doi: 10.1080/01635581.2010.492084.
61. Jeong S, Jing K, Kim N et al. Docosahexaenoic acid-induced apoptosis is mediated by activation of mitogen-activated protein kinases in human cancer cells. BMC Cancer 2014; 14 : 481. doi: 10.1186/1471-2407-14-481.
62. Fukui M, Kang KS, Okada K et al. EPA, an omega-3 fatty acid, induces apoptosis in human pancreatic cancer cells: role of ROS accumulation, caspase-8 activation, and autophagy induction. J Cell Biochem 2013; 114(1): 192 – 203. doi: 10.1002/jcb.24354.
63. Binkova H, Smardova J, Krpensky A et al. Prognoza nadoru hlavy a krku se zamerenim na nadorovy supresor p53. Otorinolaryng Foniat 2004; 4 : 189 – 195.
64. Shin S, Jing K, Jeong S et al. The omega-3 polyunsaturated fatty acid DHA induces simultaneous apoptosis and autophagy via mitochondrial ROS-mediated Akt-mTOR signaling in prostate cancer cells expressing mutant p53. Biomed Res Int 2013; 2013 : 568671. doi: 10.1155/ 2013/568671.
65. Gonzalez MJ, Schemmel RA, Dugan L Jr et al. Dietary fish oil inhibits human breast carcinoma growth: a function of increased lipid peroxidation. Lipids 1993; 28(9): 827 – 832.
66. Hardman WE. (n-3) fatty acids and cancer therapy. J Nutr 2004; 134 (Suppl 12): 3427S – 3430S.
67. Abulrob AN, Mason M, Bryce R et al. The effect of fatty acids and analogues upon intracellular levels of doxorubicin in cells displaying P-glycoprotein mediated multidrug resistance. J Drug Target 2000; 8(4): 247 – 256.
68. Abdia J, Garssena J, Faberb J et al. Omega-3 fatty acids, EPA and DHA induce apoptosis and enhance drug sensitivity in multiple myeloma cells but not in normal peripheral mononuclear cells. J Nutr Biochem 2014; 25(12): 1254 – 1262. doi: 10.1016/j.jnutbio.2014.06.013.
69. De Carlo F, Witte TR, Hardman WE et al. Omega-3 eicosapentaenoic acid decreases CD133 colon cancer stem-like cell marker expression while increasing sensitivity to chemotherapy. PLoS One 2013; 8(7): e69760. doi: 10.1371/journal.pone.0069760.
70. Vasudevan A, Yu Y, Banerjee S et al. Omega-3 fatty acid is a potential preventive agent for recurrent colon cancer. Cancer Prev Res (Phila) 2014; 7(11): 1138 – 1148. doi: 10.1158/1940-6207.CAPR-14-0177.
71. Manni A, El-Bayoumy K, Skibinski CG et al. Combination of atiestrogens and omega-3 fatty acids for breast cancer prevention. Biomed Res Int 2015; 2015 : 638645. doi: 10.1155/2015/638645.
72. Bougnoux P, Hajjaji N, Ferrasson MN et al. Improving outcome of chemotherapy of metastatic breast cancer by docosahexaenoic acid: a phase II trial. Br J Cancer 2009; 101(12): 1978 – 1985. doi: 10.1038/sj.bjc.6605441.
73. Yamagami T, Porada CD, Pardini RS et al. Docosahexaenoic acid induces dose dependent cell death in an early undifferentiated subtype of acute myeloid leukemia cell line. Cancer Biol Ther 2009; 8(4): 331 – 337.
74. Hering J, Garrean S, Dekoj TR et al. Inhibition of proliferation by omega-3 fatty acids in chemoresistant pancreatic cancer cells. Ann Surg Oncol 2007; 14(12): 3620 – 3628.
75. Rogers KR, Kikawa KD, Mouradian M et al. Docosahexaenoic acid alters epidermal growth factor receptorrelated signaling by disrupting its lipid raft association. Carcinogenesis 2010; 31(9): 1523 – 1530.
76. Dyari HR, Rawling T, Burget K et al. Synthetic omega-3 epoxyfatty acids as antiproliferative and pro-apoptotic agents in human breast cancer cells. J Med Chem 2014; 57(17): 7459 – 7464. doi: 10.1021/jm501083y.
77. Malá E, Vejražková E, Bielmeierová J et al. Dlouhodobé sledování nutričního, klinického stavu a kvality života u nemocných s rakovinou hlavy a krku. Klin Onkol 2015; 28(3): 200 – 214. doi: 10.14735/amko2015200.
78. Fiala J, Derflerová Brázdová Z. Výživa v prevenci nádorových onemocnění. Klin Onkol 2000; 13(speciál 2000): 8 – 16.
79. Klener P. Chemoprevence nádorových onemocnění. Klin Onkol 1999; 12(3): 78 – 81.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 2-
All articles in this issue
- Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Novinky v adjuvantní terapii neseminomů stadia I
- Comment – Active Surveillance vs. Adjuvant Therapy in Clinical Stage I Non-seminomatous Germ Cell Testicular Cancer
- Kvalita života měřená jako změna v čase u českých žen s karcinomem prsu
- Papilárny karcinóm štítnej žľazy u dvojročného dieťaťa
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

