-
Medical journals
- Career
Úspěšná terapie české pacientky s ROS1 translokací crizotinibem
Authors: M. Svaton; M. Pešek
Authors‘ workplace: Klinika pneumologie a ftizeologie LF UK a FN Plzeň
Published in: Klin Onkol 2016; 29(1): 63-65
Category: Case Report
doi: https://doi.org/10.14735/amko201663Overview
Cílená terapie plicního karcinomu přinesla významné zlepšení prognózy pro řadu nemocných s EGFR senzitivními mutacemi a ALK translokacemi. Další klinické studie prokázaly jako potenciálně možný cíl i ROS1 translokaci. Naše kazuistika přináší patrně prvně v české literatuře dokumentovaný případ úspěšného použití crizotinibu u pacientky s ROS1 translokací. Léčba byla dobře tolerována a nadále pokračuje, kdy na kontrolním PET/ CT vyšetření byla pozorována parciální regrese onemocnění. ROS1 translokace se tak stává dalším nadějným cílem pro naše nemocné, kdy by dle našeho názoru měla proběhnout diskuze o jeho zařazení mezi základní genetická vyšetření u nemocných s plicními adenokarcinomy.
Klíčová slova:
nemalobuněčný karcinom plic – ROS1 – crizotinibÚvod
Nemalobuněčný plicní karcinom (non-small cell lung cancer – NSCLC) představuje i nadále vedoucí příčinu nádorových úmrtí celosvětově [1], kdy pětiletá prognóza přežití je i v pokročilých stadiích stále nedobrá [2]. Možný zvrat přinesla pro pacienty se řídícími mutacemi tzv. cílená terapie [3]. Její první užití je spojené s EGFR senzitivními mutacemi [4], avšak brzy se začaly objevovat i další vhodné cíle. Mezi ně patří i translokace genu ROS1 [5]. Crizotinib byl zprvu určen pro pacienty s translokací genu ALK, nicméně byla známá i jeho citlivost vůči dalším potenciálním poruchám nádorového genomu [6]. Mezi ně patří i ROS1 translokace, kde crizotinib úspěšně obstál v klinické studii fáze I [7].
Kazuistika
Pacientka (53 let), nekuřačka, v osobní anamnéze vyjma vředové choroby žaludku bez vážnějších komorbidit, byla zprvu vyšetřována na lokálním interním oddělení pro nově vzniklý otok krku. Jeho příčinou byla pomocí ultrasonografického vyšetření (USG) určena trombóza vena jugularis interna. Neprodleně byla zahájena antikoagulační terapie a zároveň byl vyšetřován důvod nově vzniklé trombózy. Na základě genetického vyšetření byla prokázána Leidenské mutace v heterozygotní formě. Ta však tvořila nejspíše jen částečný podíl na tomto stavu. Jako hlavní příčina se jevil především nově objevený suspektní plicní tumor na RTG plic vpravo. Následně bylo doplněno CT plic a mediastina, kde bylo popsáno ložisko v periferii horního laloku pravé plíce (segment S1) velikosti max. 25 mm. Pomocí dalších standardních stagingových vyšetření (USG břicha a nadklíčků, bronchoskopie – BFSK, CT mozku) nebyla prokázána generalizace onemocnění. Cytologicky byl tumor verifikován jako adenokarcinom z aspirace při BFSK. Nemocná po předoperačním zavedení kaválního filtru pro přetrvávající trombotický uzávěr absolvovala pravou horní lobektomii s disekcí mediastinálních uzlin. Biopsie byla překvapením. Ukázalo se, že krom radikálně odstraněného tumoru jsou pozitivní i ipsilaterální mediastinální uzliny. Klinické předoperační stadium IA bylo tedy pooperačně přestážováno na stadium IIIA a po rekonvalescenci nemocné byla zahájena odpovídající adjuvantní chemoterapie platinovým dubletem (cisplatina + vinorelbin). Plánovaná sekvenční radioterapie musela být odložena pro zvracení po 2. cyklu chemoterapie. Do podpůrné medikace byl tedy přidáván aprepitant s dobrým efektem. Po 3. cyklu se však opět objevila nauzea a přechodné zvracení. Ve 4. cyklu byla proto místo cisplatiny užita carboplatina a uvažováno o sekvenční radioterapii po jeho dokončení. Po čtyřech cyklech chemoterapie však PET/CT prokázalo progresi mediastinální lymfadenopatie s nově aktivními uzlinami i v skalenické oblasti vpravo. Po předvedení případu na multidisplinárním týmu byla zahájena chemoterapie 2. linie s pemetrexedem (radioterapie nebyla doporučena pro rozsah postižení). Tato monoterapie přinesla dlouhé období kontroly tumoru (stabilní onemocnění), kdy bylo podáno celkem devět cyklů pemetrexedu. Následné PET/CT však prokázalo opět progresi onemocnění v mediastinálních lymfatických uzlinách (obr. 1) a navíc poukázalo na hilovou, oboustrannou krční a pravostrannou nadklíčkovou lymfadenopatii. Rovněž nebylo možné vyloučit drobné plicní a pleurální metastázy. V mezidobí byla u nemocné zjištěna translokace genu ROS1 a dle recentně publikované studie s crizotinibem připadala tato léčba silně v úvahu (při vědomí již omezených ostatních léčebných možností). Nejprve však bylo nutné schválení revizním lékařem zdravotní pojišťovny, neboť se zatím nejedná o léčbu se schválenou indikací ani úhradou. Zdravotní pojišťovna vyšla našemu požadavku vstříc a terapie byla zahájena v červenci 2015. Po prvotní stabilizaci onemocnění došlo v září k parciální regresi nálezu potvrzeného na PET/CT. Zde krom parciální regrese mediastinální lymfadenopatie (obr. 2) byla v parciální regresi i ostatní výše popsaná lymfadenopatie a rovněž i pleurální a plicní metastázy. Nemocná nyní (1/ 2016) nadále pokračuje v léčbě, kdy vyjma počátečních lehkých průjmů (které ustoupily po necelém měsíci terapie) nebyly zaznamenány žádné další nežádoucí účinky. Kvalita života pacientky je velmi dobrá, dle ECOG klasifikována jako PS1.
Image 1. PET/CT z 22. 6. 2015 před zahájením léčby crizotinibem. 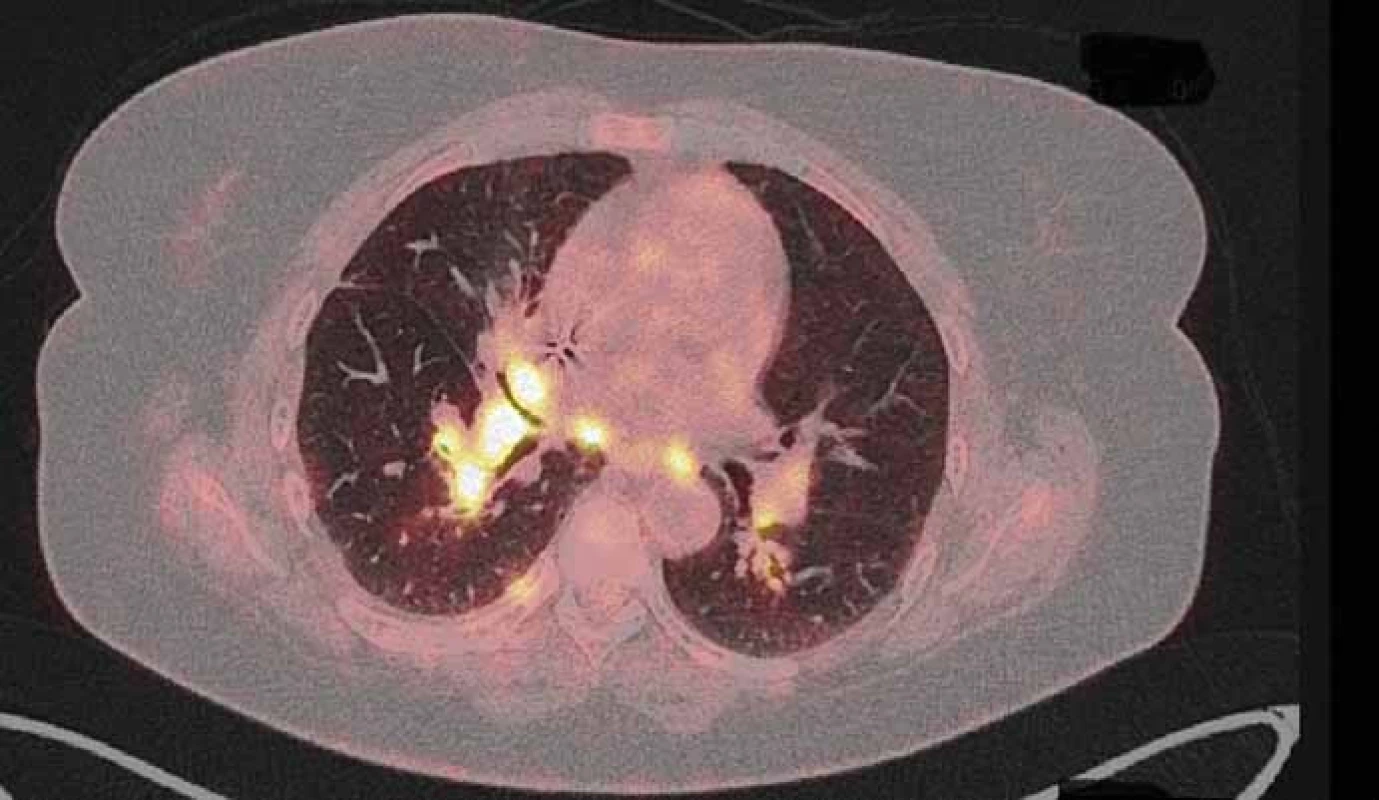
Image 2. PET/CT z 21. 9. 2015 po dvou měsících léčby crizotinibem. 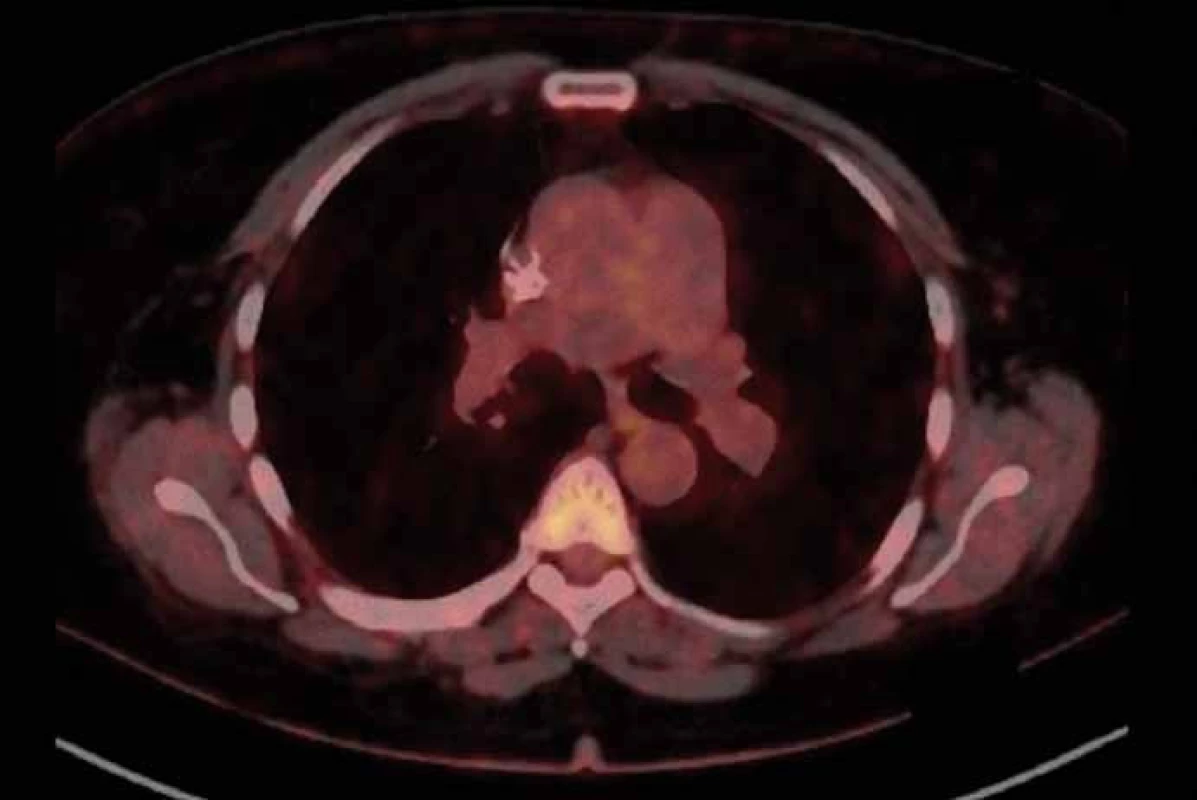
Diskuze
Gen ROS1 není normálně v plicní tkáni exprimován [8]. Jeho ligand není dosud znám, nicméně jeho nitrobuněčné dráhy (vedoucí k buněčné proliferaci, migraci a potlačení apoptózy) poukazují na onkogenní účinky nadměrné exprese tohoto genu [9,10]. Trvalá aktivita ROS1 pak může být navozena jeho translokací, které byly pozorovány i u pacientů s karcinomy plic [8]. V současné době je známo min. 6 fúzních partnerů genu ROS1 u NSCLC (CD74, EZR, LRIG3, SDC4, SLC34A2, TPM3), naopak kódovaný rozsah ROS1 domény je stále stejný [11].
Výskyt tohoto onkogenu je uváděn u plicních tumorů zhruba u 1 % populace, některé práce popisují i vyšší výskyt [5,12,13]. Vzhledem k značné podobnosti s genem ALK nepřekvapí vyšší zastoupení těchto translokací u pacientů s adenokarcinomem, nekuřáků/ lehkých kuřáků a žen [13]. Zlatým standardem diagnostiky je metoda FISH (fluorescenční in situ hybridizace), která na rozdíl od PCR (polymerázová řetězová reakce) dokáže spolehlivě detekovat různé fúzní partnery genu ROS1 [5,12 – 14]. Imunohistochemie je metoda vhodnější spíše pro prvotní screening. Je cenově přijatelnější ve srovnání s metodou FISH, avšak může vykazovat falešnou pozitivitu [5,12 – 14].
Crizotinib, použitý ve 3. linii léčby, představuje zástupce cílených léčiv ze skupiny tyrozinkinázových inhibitorů s účinností krom u translokací genu ROS1 především u nemocných s translokací genu ALK, což je dáno již zmíněnou značnou podobností těchto molekul [15 – 17]. U ALK translokací je obvykle podáván v dávce 250 mg dvakrát denně [18]. Ve studii fáze I u ROS1 translokací bylo užito stejné dávkování s velmi slibnou objektivní odpovědí dosahující 72 % [7]. Na základě těchto výsledků jsme se rozhodli pokusit se změnit negativní vývoj onemocnění i u naší pacientky, což se ukázalo jako dobrý krok. Dle kontrolního PET/ CT vyšetření bylo dosaženo parciální regrese onemocnění.
Crizotinib obecně (zkušenosti jsou zejména od nemocných s ALK translokacemi) vykazuje dobrý profil tolerability, kdy k nejčastějším nežádoucím účinkům (obvykle nižšího stupně) patří zejména poruchy vizu, gastrointestinální obtíže, elevace jaterních enzymů a periferní otoky [19]. Při terapii je třeba dávat pozor jednak na vznik potenciálně letální pneumonitis a prodloužení QTc intervalu a dále pak na případné interakce, neboť se jedná o látku metabolizovanou jaterním cytochromem CYP3A [19]. Naše pacientka měla pouze přechodně lehké průjmy, další typické nežádoucí účinky jsme dosud nepozorovali.
Rovněž jsme u naší nemocné pozorovali velmi dobrý efekt terapie pemetrexedem. Lze tudíž spekulovat, zda stejně jako u jeho použití u ALKomů není zvýšená citlivost k tomuto druhu chemoterapie [20]. Další studie srovnávající crizotinib s pemetrexedem a dalšími chemoterapeutiky u pacientů s ROS1 translokacemi by v tomto směru mohly napovědět více.
Závěr
Naše kazuistika přináší (dle našich znalostí) první český případ úspěšné terapie pacienta s ROS1 translokací crizotinibem. Tato terapie byla velmi dobře tolerovaná a přinesla významné zlepšení osudu naší nemocné.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Svatoň
Klinika pneumologie a ftizeologie
LF UK a FN Plzeň
Edvarda Beneše 1128/13
305 99 Plzeň
e-mail: svatonm@gmail.com
Obdrženo: 3. 11. 2015
Přijato: 7. 12. 2015
Sources
1. Zhao C, Li X, Li J et al. Detecting ALK, ROS1 and RET fusion genes in cell block samples. Transl Oncol 2014; 7(3): 363 – 367. doi: 10.1016/ j.tranon.2014.04.013.
2. Jakopovic M, Thomas A, Lopez-Chavez A. From platinum compounds to targeted therapies in advanced thoracic malignancies. Anticancer Res 2014; 34(1): 477 – 482.
3. Roberts PJ, Stinchcombe TE, Der CJ et al. Personalized medicine in non-small cell lung cancer: is KRAS a useful marker in selecting patients for epidermal growth factor receptor-targeted therapy? J Clin Oncol 2010; 28(31): 4769 – 4777. doi: 10.1200/ JCO.2009.27.4365.
4. Rosell R, Carcereny E, Gervais R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small cell lung cancer (EURTAC): a multicentre, open-label, randomized phase III trial. Lancet Oncol 2012; 13(3): 239 – 246. doi: 10.1016/ S1470-2045(11)70393-X.
5. Bergethon K, Shaw AT, Ou SH et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30(8): 863 – 870. doi: 10.1200/ JCO. 2011.35.6345.
6. Awad MM, Shaw AT. ALK inhibitors in non-small cell lung cancer: crizotinib and beyond. Clin Adv Hematol Oncol 2014; 12(7): 429 – 439.
7. Shaw AT, Ou SH, Bang YJ et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 2014; 371(21): 1963 – 1971. doi: 10.1056/ NEJMoa1406766.
8. Davies KD, Doebele RC. Molecular pathways: ROS1 fusion proteins in cancer. Clin Cancer Res 2013; 19(15): 4040 – 4045. doi: 10.1158/ 1078-0432.CCR-12-2851.
9. El-Deeb IM, Yoo KH, Lee SH. ROS receptor tyrosine kinase: a new potential target for anticancer drugs. Med Res Rev 2011; 31(5): 794 – 818. doi: 10.1002/ med.20206.
10. Acquaviva J, Wong R, Charest A. The multifaceted roles of the receptor tyrosine kinase ROS in development and cancer. Biochim Biophys Acta 2009; 1795(1): 37 – 52. doi: 10.1016/ j.bbcan.2008.07.006.
11. Chin LP, Soo RA, Soong R et al. Targeting ROS1 with anaplastic lymphoma kinase inhibitors: a promising therapeutic strategy for a newly defined molecular subset of non-small-cell lung cancer. J Thorac Oncol 2012; 7(11): 1625 – 1630. doi: 10.1097/ JTO.0b013e31826baf83.
12. Mescam-Mancini L, Lantuéjoul S, Moro-Sibilot D et al. On the relevance of a testing algorithm for the detection of ROS1-rearranged lung adenocarcinomas. Lung Cancer 2014; 83(2): 168 – 173. doi: 10.1016/ j.lungcan.2013.11.019.
13. Warth A, Muley T, Dienemann H et al. ROS1 expression and translocations in non-small-cell lung cancer: clinicopathological analysis of 1478 cases. Histopathology 2014; 65(2): 187 – 194. doi: 10.1111/ his.12379.
14. Choi CM. Overview of ALK and ROS1 rearranged lung cancer. Tuberc Respir Dis (Seoul) 2013; 75(6): 236 – 237. doi: 10.4046/ trd.2013.75.6.236.
15. Heigener DF, Reck M. Crizotinib. Recent Results Cancer Res 2014; 201 : 197 – 205. doi: 10.1007/ 978-3-642-54490-3_11.
16. Yasuda H, de Figueiredo-Pontes Ll, Kobayashi S et al. Preclinical rationale for use of the clinically available multitargeted tyrosine kinase inhibitor crizotinib in ROS1-translocated lung cancer. J Thorac Oncol 2012; 7(7): 1086 – 1090. doi: 10.1097/ JTO.0b013e3182570919.
17. Rothschild SI, Gautschi O. Crizotinib in the treatment of non-small-cell lung cancer. Clin Lung Cancer 2013; 14(5): 473 – 480. doi: 10.1016/ j.cllc.2013.04.006.
18. Gridelli C, Peters S, Sgambato A et al. ALK inhibitors in the treatment of advanced NSCLC. Cancer Treat Rev 2014; 40(2): 300 – 306. doi: 10.1016/ j.ctrv.2013.07.002.
19. Curran MP. Crizotinib: in locally advanced or metastatic non-small cell lung cancer. Drugs 2012; 72(1): 99 – 107. doi: 10.2165/ 11207680-000000000-00000.
20. Esfahani K, Agulnik JS, Cohen V. A systemic review of resistance mechanisms and ongoing clinical trials in ALK--rearranged non-small cell lung cancer. Front Oncol 2014; 4 : 174.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 1-
All articles in this issue
- Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Potenciál dlouhých nekódujících molekul RNA v diagnostice nádorových onemocnění
- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
- Úspěšná terapie české pacientky s ROS1 translokací crizotinibem
- Úloha bielkovín tepelného šoku v leukémii
- Predikce změny vitality u starších přeživších žen s karcinomem prsu po primární onkologické léčbě – přístup založený na použití změny hladin zánětlivého markeru C reaktivního proteinu v čase
- Úspěšná spojená resekce jater a podvaz portální žíly po neúspěšné dvojité TACE proceduře komplikované sepsí a pankreatitidou
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
- Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Úloha bielkovín tepelného šoku v leukémii
- Potenciál dlouhých nekódujících molekul RNA v diagnostice nádorových onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

