-
Medical journals
- Career
Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu
: L. Holubec 1,2; V. Liška 2,3; J. Fínek 1
: Onkologická a radioterapeutická klinika LF UK a FN Plzeň2 Biomedicínské centrum, LF UK v Plzni3 Chirurgická klinika LF UK a FN Plzeň 1
: Klin Onkol 2015; 28(2): 89-93
: Review
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko201589Východiska:
Účinnost protinádorové terapie se standardně hodnotí pomocí následujících ukazatelů – objektivní léčebnou odpovědí, dobou bezpříznakového přežití a dobou celkového přežití. Změna rozsahu nádorového postižení se posuzuje podle souhrnné změny velikosti cílových nádorových lézí pomocí zobrazovacích metod. Zde se nejčastěji uplatňují WHO či RECIST kritéria. Základním problémem těchto kritérií je, že vycházejí z různé definice vyhodnocení léčebných odpovědí. Obecně lze konstatovat, že existující výsledky těchto vyhodnocení nepotvrzují přímou korelaci mezi četností léčebných odpovědí a dobou přežití (dobou bezpříznakového přežití či dobou celkového přežití). Dalším problémem těchto metod je, že výsledky vyhodnocení nekorelují s biologickou aktivitou nádorového růstu, protože se jedná o statické vyhodnocení klinického stavu.Cíl:
V tomto přehledovém článku uvádíme souhrn dosud zveřejněných výsledků, které se týkají možnosti vyhodnocení účinnosti protinádorové terapie pomocí konceptu „hloubky léčebné odpovědi“ a konceptu „časné regrese nádoru“ u nemocných s metastazujícím kolorektálním karcinomem.Závěr:
Výsledky četných post‑hoc a explorativních analýz klinických studií konzistentně naznačují, že časné regrese nádoru a hloubky léčebné odpovědi jsou významné veličiny při hodnocení účinnosti systémové protinádorové léčby.Klíčová slova:
kolorektální karcinom – metastázy – RECIST – časná nádorová regrese – hloubka léčebné odpovědiÚvod
Hodnocení změny velikosti nádorového postižení je důležitou součástí klinického hodnocení protinádorových léčiv. Jak zmenšení rozsahu nádorového postižení, tak doba do progrese jsou významnými cílovými hodnoceními v klinických studiích u nádorových onemocnění. V současné době jsou v klinických studiích pro hodnocení objektivní odpovědi na léčbu (objective response rate – ORR), resp. progrese onemocnění standardně využívána kritéria RECIST, verze 1.1 [1]. Zde je vhodné připomenout, že částečná odpověď (partial response – PR) zůstává z hlediska velikosti změny nádorového postižení i v RECIST 1.1 široce definovanou kategorií, zahrnující potvrzené zmenšení nádorového postižení v rozmezí od – 30 % až do – 99,99 %. Využití vodopádových grafů umožnilo jednoduché znázornění individuálně dosažené změny rozsahu nádorového postižení a umožnilo formulování konceptu hloubky léčebné odpovědi (deepness of response – DoR). DoR je definována jako relativní změna sumární velikosti nádorového postižení ve srovnání se sumární velikostí před zahájením léčby. Velikost postižení a jeho změna se hodnotí radiograficky. Souhrnná velikost nádorového postižení odpovídá součtu nejdelších průměrů všech hodnocených metastatických lézí. Radiograficky neměřitelné nádorové postižení nelze pro hodnocení DoR použít. Při větším počtu metastáz se počet hodnocených lézí může omezit na rozhodující metastatická ložiska v jednotlivých postižených orgánech, cílové léze, jejichž celkový počet v souhrnném výpočtu obvykle nepřekračuje 10 vybraných měřitelných metastatických ložisek.
Přehled výsledků analýz týkajících se významu hodnocení časné regrese nádoru a hloubky léčebné odpovědi v rámci systémové léčby metastazujícího kolorektálního karcinomu
De Roock et al publikovali výsledky retrospektivního hodnocení u 102 irinotekan refrakterních pacientů, kteří se zúčastnili studií hodnotících účinnost cetuximabu v léčbě 2. linie metastazujícího kolorektálního karcinomu (metastatic colorectal cancer – mCRC). Z celkového počtu bylo 26,5 % pacientů léčeno monoterapií cetuximabem, 73,5 % kombinací cetuximab + irinotekan. Autoři provedli hodnocení účinnosti léčby ve vztahu ke stavu KRAS genu v nádorech pacientů a porovnání průměrné změny nádorového postižení po 24 týdnech léčby. Zatímco u pacientů s mutovanou formou KRAS byla zjištěna pozvolná progrese onemocnění, u pacientů s divokou formou KRAS byla průměrná regrese po šesti týdnech léčby 13,7 %, po 12 týdnech léčby 24,5 % a po 24 týdnech léčby 41,2 % při hodnocení podle RECIST kritérií. Tato zjištění podtrhují význam opakovaných kontrolních CT vyšetření v průběhu léčby. Při srovnání míry regrese podle RECIST a WHO kritérií, po 24. týdnech léčby autoři zjistili u pacientů s KRAS ‑ wt nádory zmenšení o 41,2 %, zatímco při hodnocení podle WHO kritérií bylo zmenšení pouze 14,3 %. To naznačuje, že při posuzování výsledků klinických studií je zapotřebí rozlišovat, jaká kritéria pro hodnocení ORR byla použita [2].
Arnold et al zveřejnili hodnocení variability změny nádorového postižení při systémové protinádorové léčbě mCRC v rámci dvou randomizovaných klinických studií (AIO 0104 a AIO 0604). Studie AIO 0104 srovnávala účinnost léčby cetuximab + XELIRI vs. cetuximab + XELOX. Studie AIO 06044 obdobně srovnávala účinnost bevacizumabu v kombinaci s režimem XELIRI nebo režimem XELOX. Jak bevacizumab, tak cetuximab vykazovaly obdobnou účinnost při použití s režimem XELIRI i XELOX. Z výsledků uvedených v tab. 1 je patrné, že zatímco jakéhokoli zmenšení dosáhla při léčbě většina pacientů, jen část z nich dosáhla zmenšení o > 50 % [3,4]. Následně Modest et al publikovali další výsledky analýzy ze studie AIO 0104, které ukázaly, že časná regrese o ≥ 20 % se ve srovnání s menší mírou časné regrese odrazí ve významně lepším přežití bez progrese (progression free survival – PFS) (mediány 8,9 vs. 4,7 měsíce; p < 0,001) i celkové době přežití (overall survival – OS) (mediány 31,6 vs. 15,8 měsíce; p = 0,005) [13].
1. Změny velikosti nádorového postižení ve studiích AIO 0104 a 0604. 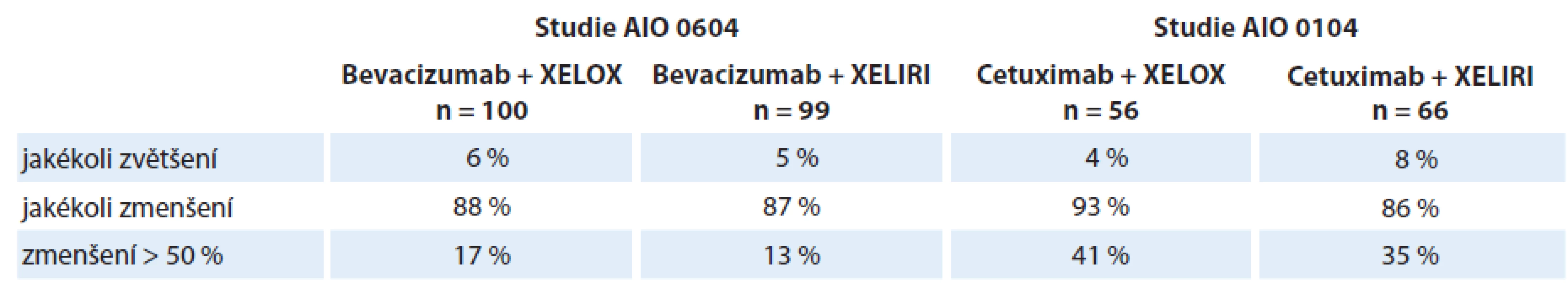
V roce 2011 publikovali Heun et al výsledky ze studie NCCTG N9741, ve které u pacientů s mCRC porovnávali účinnost tří režimů chemoterapie (IFL, FOLFOX a IROX) a hodnotili prediktivní význam změny velikosti nádorového postižení ve 12. a 24. týdnu od zahájení systémové léčby ve vztahu k OS. Hodnocení vztahu změny rozsahu nádorového postižení ve 12. týdnu léčby a celkové doby přežití naznačily, že regrese o ≥ 25 % koreluje s významně delší dobou přežití ve srovnání se změnou v rozpětí od – 25 % do +25 %. Jakékoli zvětšení o > 25 % znamenalo velmi špatnou prognózu, s velmi krátkou střední dobou přežití [4].
Ve studii Nordic VI proběhla u 506 pa-cientů s mCRC a systémovou chemoterapií kontrolní CT vyšetření hodnotící rozsah nádorového postižení, prováděná každých osm týdnů od zahájení léčby. Pacienti byli následně rozděleni do čtyř podskupin podle velikosti změny nádorového postižení při prvé kontrole: 1. nové metastatické léze, 2. jakékoli zvětšení existujících lézí až zmenšení < 10 %, 3. zmenšení o ≥ 10 % až < 50 %, 4. zmenšení o > 50 %. Mezi jednotlivými podskupinami byly zjištěny významné rozdíly v OS. Zatímco medián OS byl v této studii 19 měsíců, přežily delší dobu, než byla hodnota mediánu, 4 % pacientů v prvé skupině, 37 % pacientů ve 2. skupině, 60 % ve 3. skupině a 80 % ve 4. skupině. Zjištění regrese nádorového postižení o ≥ 50 % při druhém kontrolním vyšetření (v 16. týdnu od zahájení léčby) bylo jedinou významnou pozitivní proměnnou v Coxově regresním modelu hodnocení OS [5].
V klinické kontrolované studii fáze IIICRYSTAL, která hodnotila význam přidání cetuximabu k režimu FOLFIRI v léčbě 1. linie u pacientů s mCRC, byl kromě jiného hodnocen význam časné regrese nádoru a jejího rozsahu v 8. týdnu od zahájení léčby. Byly hodnoceny četnosti regrese o ≥ 20 %, o ≥ 30 % a o ≥ 50 %. Přidání cetuximabu k chemoterapii významně zvýšilo počty pacientů, u nichž bylo dosaženo časné regrese ve všech třech hodnocených kategoriích, především však v kategorii zmenšení o ≥ 50 % (tab. 2). Současně byla potvrzena pozitivní korelace mezi DoR a dobou přežití po progresi (post‑progression survival – PPS) (p < 0,001) [6,17].
2. Srovnání četností zmenšení o ≥ 20 %, 30 % a 50 % ve studii CRYSTAL. 
Ve studii CRYSTAL a v obdobně koncipované kontrolované klinické studii fáze IIOPUS, která porovnávala účinnost přidání cetuximabu k režimu FOLFOX, byla provedena následná analýza DoR a jejího vztahu k OS. Při kombinované léčbě cetuximab + chemoterapie bylo ve srovnání s chemoterapií samotnou dosaženo významně větší míry regrese nádoru (tab. 3), a to jak ve studii CRYSTAL, tak ve studii OPUS [7,8].
3. Mediány hloubky léčebné odpovědi (DoR) ve studiích CRYSTAL a OPUS. 
Studie PRIME byla randomizovaná, kontrolovaná studie fáze III, která hodnotila terapeutický přínos přidání panitumumabu ke standardnímu režimu chemoterapie FOLFOX v léčbě 1. linie u pacientů s mCRC. Douillard et al zveřejnili výsledky hodnocení časné regrese o ≥ 20 % a o ≥ 30 % ve vztahu k OS. Výsledky uvedené v tab. 4 svědčí o tom, že přidání panitumumabu k chemoterapii FOLFOX zvýšilo počty pacientů s časnou regresí nádoru o ≥ 20 % i ≥ 30 %, což se odrazilo v lepší hodnotě OS. Ta byla jak při kombinované léčbě panitumumab + FOLFOX, tak při chemoterapii samotné lepší u pacientů s časnou regresí ≥ 30 % [9].
4. Četnosti časných regresí nádoru a příslušné mediány OS ve studii PRIME. 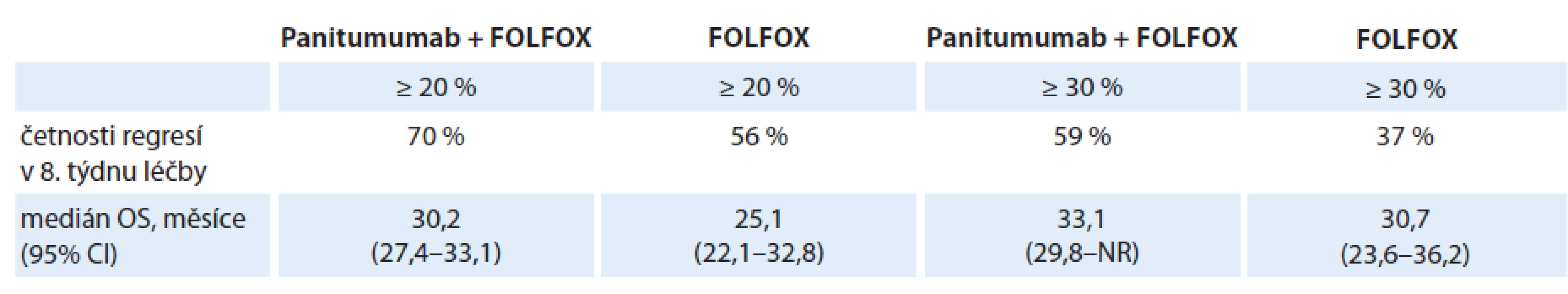
5. Vztah časné regrese (ETS) a hloubky odpovědi (DoR) k přežití ve studii TRIBE. 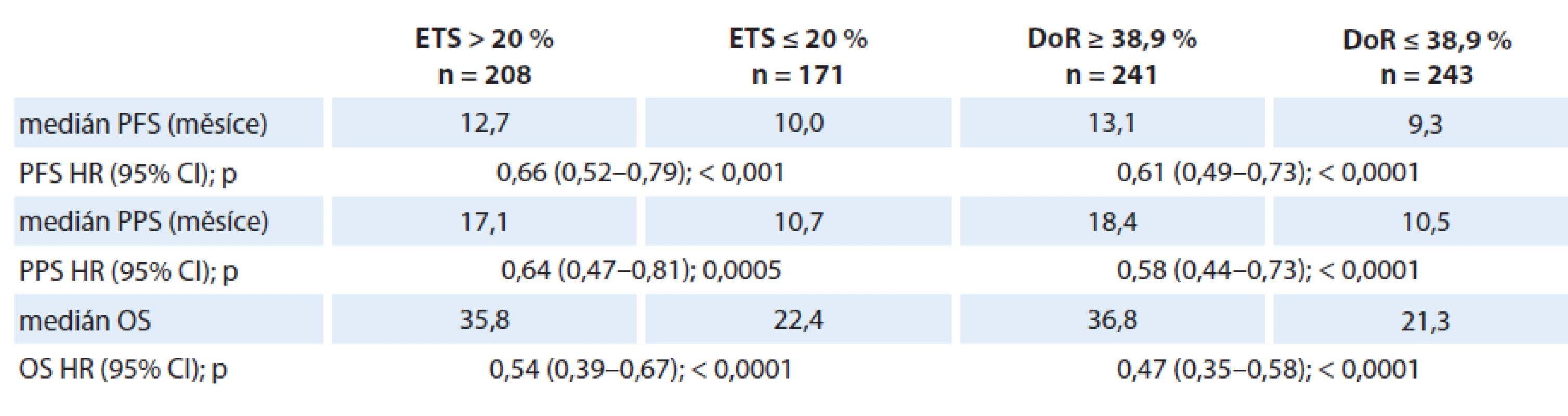
V roce 2013 Zhao et al zveřejnili výsledky analýzy u 468 pacientů s mCRC, kteří byli léčeni v rámci klinických studií fáze II a III a u kterých bylo možné zhodnotit časnou regresi nádoru (v rozmezí 3 – 9 týdnů od zahájení systémové léčby). Výsledky naznačily, že pokud není v rozmezí 3 – 9 týdnů od zahájení systémové léčby dosaženo alespoň 30% zmenšení původního rozsahu metastatického postižení, riziko úmrtí se významně zvyšuje – na dvojnásobek při zmenšení v rozsahu < 30 % až ≥ 10 % a na více než pětinásobek při změně v rozsahu od zmenšení o 10 % – zvětšení o 10 %. Při rychlé progresi (zvětšení o > 20 %) vzrostlo riziko úmrtí téměř 13násobně [10].
Prognostický význam časné regrese nádoru a DoR potvrdili Cremolini et al při analýze provedené ve studii TRIBE. Studie TRIBE byla randomizovaná studie fáze III porovnávající účinnost bevacizumabu v kombinaci s režimem FOLFIRI a s režimem FOLFOXIRI. Účinnost bevacizumabu byla vyšší v kombinaci s tripletem FOLFOXIRI než v kombinaci s dubletem FOLFIRI. V souhrnné analýze všech pacientů ve studii byla hodnocena též frekvence časné regrese a DoR. Medián největší dosažené regrese nádorového postižení (DoR) byl ve studii TRIBE 38,9 %. Přežití bez progrese (PFS), PPS i OS byly významně lepší u pacientů, u kterých dosažená DoR byla větší než medián DoR. Tabulka 5 uvádí souhrnný přehled zjištění [10,11,12,16].
V rámci konference WCGIC 2014 byly zveřejněny výsledky nezávislého hodnocení v randomizované studii fáze III, AIO KRK - 0306 (FIRE - 3), která hodnotila účinnost cetuximabu a bevacizumabu v kombinaci s chemoterapií FOLFIRI v léčbě 1. linie u pacientů s mCRC [13]. Hodnocení, které zahrnovalo četnosti dosažených objektivních odpovědí na léčbu (ORR), největší dosaženou DoR a časnou nádorovou regresi (early tumor shrinkage – ETS), bylo provedeno v celé populaci do studie zařazených pacientů, u kterých byly dostupné výchozí i kontrolní snímky CT umožňující zhodnocení ORR i podle kritérií RECIST. Výsledky ukazují na významnou korelaci největší dosažené regrese nádorového postižení (DoR) jak s dobou PFS, tak s OS v obou léčebných skupinách. DOR byla v populaci pacientů s RAS ‑ wt nádory výraznější při léčbě cetuximab + FOLFIRI. Přehled výsledků nezávislého hodnocení je uveden v tab. 6 [13,14].
6. Nezávislé hodnocení hloubky léčebné odpovědi (DoR) a její korelace s přežitím pacientů ve studii AIO KRK-0306. 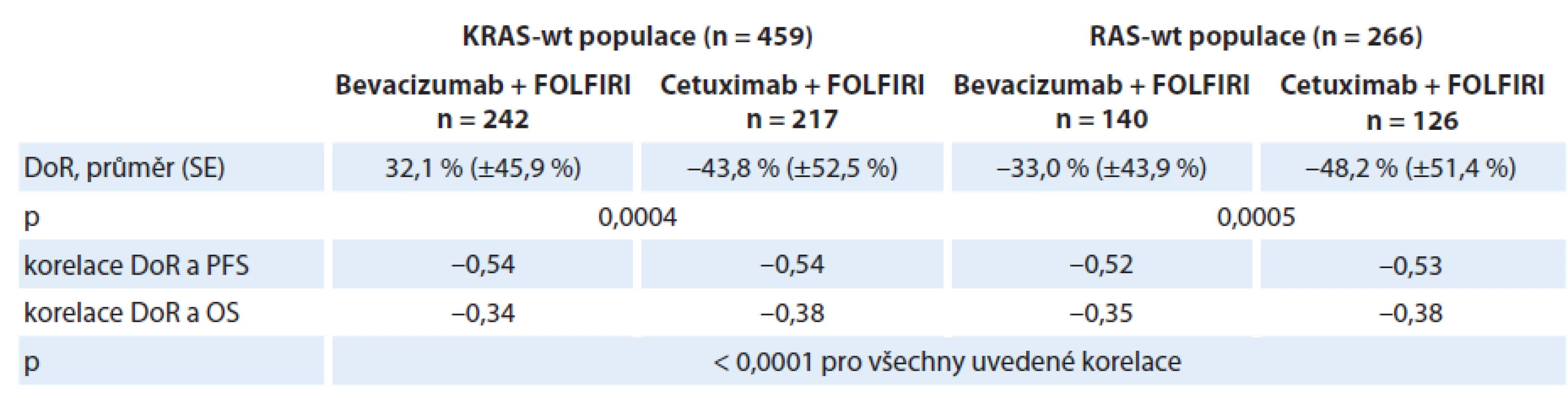
Studie PEAK byla randomizovaná klinická studie fáze II, která hodnotila účinnost panitumumabu a bevacizumabu přidaných k režimu FOLFOX v léčbě 1. linie pacientů s mCRC. Na konferenci WCGIC 2015 Rivera et al prezentovali výsledky explorativní analýzy z této studie, ve které hodnotili kromě četnosti ORR, DoR a ETS i délku trvání DoR [15]. DoR byla definována jako procentuální změna v období nadiru nebo progrese, ETS byla definována jako zmenšení o ≥ 30 % v 8. týdnu léčby a délka trvání léčebné odpovědi byla definována jako doba od prvé potvrzené odpovědi do progrese nebo úmrtí. Výsledky analýzy jsou uvedeny v tab. 7. Přestože četnost ORR byla v obou léčebných skupinách obdobná, délka trvání léčebné odpovědi, četnost pacientů s časnou regresí o ≥ 30 % a DoR byly významně větší ve skupině s léčbou panitumumab + FOLFOX. Tato zjištění jsou v souladu s lepšími hodnotami PFS i OS u pacientů, kteří dostávali s režimem FOLFOX panitumumab [15].
7. Hodnocení časné regrese, hloubky a trvání léčebné odpovědi u RAS-wt mCRC pacientů ve studii PEAK. 
Závěr
Výše uvedené výsledky naznačují, že DoR je významným faktorem ovlivňujícím výslednou dobu přežití pacientů s mCRC. DoR je při kombinované biochemoterapii významně větší než při chemoterapii samotné. Při časné regresi je z hlediska ovlivnění OS významné již zmenšení o ≥ 20 %. Při hodnocení změny velikosti nádorového postižení po více než 12 týdnech od zahájení léčby je z hlediska prodloužení OS významné pouze zmenšení o ≥ 50 %.
Jestliže se hodnocení DoR jeví jako užitečný doplňující ukazatel při hodnocení účinnosti léčby v rámci klinických studií, může mít tento ukazatel význam i v podmínkách běžné, každodenní praxe? Vyjdeme‑li z poznatků, že u pacientů s ORR je nadir odpovědi zjištěn obvykle mezi 15. a 16. týdnem léčby, tedy po aplikaci 5 – 8 cyklů systémové léčby, můžeme na základě vyhodnocení dosažené ORR u jednotlivých pacientů zvažovat, zda pokračování v dosavadní léčbě u pacientů, u nichž dosud nedošlo k progresi, se promítne do významného prodloužení OS či nikoliv.
Poděkování za konzultaci doc. MU Dr. Janu Bauerovi, CSc.
Práce byla podpořena projektem ED2.1.00//03.0076 Evropského fondu pro regionální rozvoj a dále grantem IGA MZČR 12025 a grantem IGA MZČR 14329.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 12. 8. 2014
Přijato: 30. 9. 2014
doc. MUDr. Luboš Holubec, Ph.D.
Onkologická a radioterapeutická klinika
LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: lubosholubec@seznam.cz
Sources
1. Eisenhauer EA, Therasse P, Bogaerts J et al. New response evaluation criteria in solid tumors: revised RECIST guideline (version1.1). Europ J Cancer 2009; 45(2): 228 – 247. doi: 10.1016/ j.ejca.2008.10.026.
2. De Roock W, Piessevaux H, De Schutter J et al. KRAS wild‑type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008; 19(3): 508 – 515.
3. Arnold D, Hinke A, Reinacher ‑ Schick AC et al. Waterfall plot analysis of XELOX or XELIRI with cetuximab or bevacizumab in patients with advanced colorectal cancer (ACRC): Combined analysis of two randomized first‑line phase II trials of the AIO CRC study group. J Clin Oncol 2008; 26 (15 Suppl): 4067.
4. Heun JM, Grothey A, Branda ME et al. Tumor status at 12 weeks predicts survival in advanced colorectal cancer: findings from NCCTG N9741. Oncologist 2011; 16(6): 859 – 867. doi: 10.1634/ theoncologist.2011 ‑ 0064.
5. Suzuki C, Blomqvist L, Sundin A et al. The initial change in tumor size predicts response and survival in patients with metastatic colorectal cancer treated with combination chemotherapy. Ann Oncol 2012; 23(4): 948 – 954. doi: 10.1093/ annonc/ mdr350.
6. Piessevaux H, Buyse M, Schlichting M et al. Use of early tumor shrinkage to predict long‑term outcome in metastatic colorectal cancer treated with cetuximab. J Clin Oncol 2013; 31(30): 3764 – 3775. doi: 10.1200/ JCO.2012.42.8532.
7. Mansman UR, Sartorius U, Laubender PR et al. Deepness of response: a quantitative analysis of its impact on post‑progression survival time after first‑line treatment in patients with mCRC. J Clin Oncol 2012; 30 (Suppl 34): abstr. 427.
8. Mansman UR, Laubender PR, Sartorius U et al. Improved early prediction of individual prognosis for patients with mCRC: joint modeling of tumor shrinkage with volume data for PFS and OS. J Clin Oncol 2012; 30 (Suppl): abstr. 3603.
9. Douillard JY, Salvatore S, Tabernero J et al. Overall survival (OS) and tumor shrinkage outcomes in partients with symptomatic/ asymptomatic mCRC: data from the PRIME study. Ann Oncol 2013; 24 (Suppl 4): iv32 – iv33.
10. Zhao B, Lee SM, Qi J et al. Minor response rate to predict patient survival. J Clin Oncol 2013; 31 (Suppl): abstr. 3635.
11. Cremolini C, Loupakis F, Antoniotti C et al. Assessing tumor response beyond RECIST criteria: early tumor shrinkage (ETS) and deepness of response (DoR) in phase III TRIBE trial by the GONO group. Eur J Cancer 2013; 49: S491.
12. Cremolini C, Loupakis F, Lonardi S et al. Early tumor shrinkage (ETS) and deepness of response (DoR) to predict progression‑free, postprogression, and overall survival: Results from the phase III TRIBE trial. J Clin Oncol 2014; 32 (Suppl 3): abstr. 521.
13. Modest DP, Laubender RP, Stintzing S et al. Early tumor shrinkage in patients with metastatic colorectal cancer receiving first‑line treatment with cetuximab combined with either CAPIRI or CAPOX: an analysis of the German AIO KRK 0104 trial. Acta Oncol 2013; 52(5): 956 – 962. doi: 10.3109/ 0284186X.2012.752580.
14. Heinemann V, Modest D, Fischer von Weikersthal L et al. Independent Radiological Evaluation of Objective Response Early Tumor Shrinkage, and Depth of Response in FIRE ‑ 3 (AIO KRK ‑ 0306). Ann Oncol 2014; 25 (Suppl 2): abstr. O ‑ 0030.
15. Rivera F. First‑line treatment with modified FOLFOX6 (mFOLFOX6) + panitumumab (pmab) or bevacizumab (bev) in wild‑type (WT) RAS metastatic colorectal carcinoma (mCRC): tumor response outcomes beyond RECIST. J Clin Oncol 2015; 33 (Suppl 3): abstr. 660.
16. Hradecká I, Ríhová B, Horová R et al. The cost study of first‑line treatment of metastatic colorectal carcinoma with bevacizumab ‑ containing regimen in the Czech Republic. Klin Onkol 2014; 27(4): 255 – 260. doi: 10.14735/ amko2014255.
17. Sevčíková K, Ušáková V, Bartošová Z et al. Surgical treatment of metastases and its impact on prognosis in patients with metastatic colorectal carcinoma. Klin Onkol 2014; 27(1): 38 – 44. doi: 10.14735/ amko201438.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue 2-
All articles in this issue
- Glomus Tumor of the Finger – Case Report
-
Domácí parenterální výživa v onkologii
Díl 2 – Kdy indikovat domácí paliativní parenterální výživu - FDA schválil první biosimilární přípravek v USA
- Rozmanitost 18F- FDG PET obrazů pacientů s maligním melanomem
- The Importance of Early Tumor Shrinkage and Deepness of Response in Assessing the Efficacy of Systemic Anticancer Treatment with Metastatic Colorectal Cancer
- Management of Chronic and Acute Pain in Patients with Cancer Diseases
- Vitamin D During Cancer Treatment
- Potential Clinical Benefit of Therapeutic Drug Monitoring of Imatinib in Oncology
- Value of Narrow Band Imaging Endoscopy in Detection of Early Laryngeal Squamous Cell Carcinoma
- Malignant Tumors of Thyroid Gland
- Controversies in the Management of Clinical Stage I Nonseminomatous Germ Cell Testicular Cancer
- Current Two EGFR Mutations in Lung Adenocarcinoma – Case Report
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Malignant Tumors of Thyroid Gland
- Vitamin D During Cancer Treatment
- Glomus Tumor of the Finger – Case Report
- The Importance of Early Tumor Shrinkage and Deepness of Response in Assessing the Efficacy of Systemic Anticancer Treatment with Metastatic Colorectal Cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

