-
Medical journals
- Career
Léčba polyneuropatické bolesti u nemocného s generalizovaným, kastračně rezistentním karcinomem prostaty – klinická kazuistika
Authors: L. Holubec 1,2; P. Mrázková 3; V. M. Matějka 2; O. Fiala 2; J. Fínek 2
Authors‘ workplace: Biomedicínské centrum LF v Plzni, UK v Praze, Plzeň 1; Onkologické a radioterapeutické oddělení, FN Plzeň 2; Klinika zobrazovacích metod LF UK a FN Plzeň 3
Published in: Klin Onkol 2013; 26(5): 354-357
Category: Case Report
Overview
Východiska:
Tapentadol je současně agonistou µ ‑ opioidních receptorů a zároveň inhibitorem zpětného vychytávání noradrenalinu. Tento farmakologický profil tapentadolu je vhodný pro léčbu bolesti s nociceptivní i neuropatickou složkou.Kazuistika:
Předmětem klinické kazuistiky je muž, 65 let, se špatně diferencovaným karcinomem prostaty – Gleason skóre 8 (4 + 4) a s metastatickým postižením skeletu. Kromě zahájení léčby bisfosfonáty byl tento muž léčen po dobu 18 měsíců kompletní androgenní blokádou (cyproteron acetát + leuprorelin acetát). Pro vzestup PSA byla tato léčba ukončena. Nemocný byl dále léčen paliativní chemoterapií docetaxel. Celkem bylo podáno osm cyklů této léčby s dobrým klinickým efektem. Tato léčba však musela být pro výraznou periferní neuropatii a bolesti horních a dolních končetin ukončena. Periferní neuropatie u nemocného progredovala, podpůrná léčba gabapentinem a amitryptilinem byla neúspěšná. Po čtyřech měsících, kdy byl nemocný léčen pouze monoterapií kyselinou zolendronovou, zahájil nemocný léčbu tapentadolem 2krát 50 mg, s následnou eskalací dávky na 2krát 100 mg (dosud byla léčba bolesti zajištěna transdermálním fentanylem 25 µg à tři dny). V průběhu tří týdnů od zahájení léčby tapentadolem došlo k výraznému ústupu neuropatických obtíží, včetně projevů bolesti, za tři měsíce od zahájení léčby došlo k normalizaci zdravotního stavu. Nemocný následně zahájil retreatment chemoterapie docetaxelem, kde při udržovací dávce tapentadolu 2krát 50 mg denně nedošlo ke klinickým projevům neuropatické bolesti.Závěr:
U nemocného byla pomocí tapentadolu zajištěna stabilní a dlouhodobá úleva od neuropatické bolesti, která je častým vedlejším příznakem v průběhu léčby kastračně rezistentního karcinomu prostaty pomocí taxanů.Klíčová slova:
kazuistika – tapentadol – neuropatická bolest – karcinom prostatyÚvod
Termínem nádorové bolesti označujeme různorodou skupinu bolestivých stavů, kterými mohou trpět nemocní s onkologickým onemocněním. Tyto bolestivé stavy mají rozdílnou intenzitu a délku trvání, jiný patogenetický mechanizmus vzniku a jiný vztah k nádorovému onemocnění [1]. Většina bolestivých stavů u onkologických nemocných (60 – 80 %) je z hlediska vztahu k základnímu onemocnění vyvolána přímým působením nádoru. V 15 – 20 % je příčinou bolesti protinádorová léčba a v 5 – 10 % bolest nesouvisí s nádorem ani s jeho léčbou [2]. Pacienti mohou trpět různými typy bolesti současně. K nejhůře ovlivnitelným typům nádorové bolesti patří kostní a neuropatické bolesti [3]. Na základě výsledků četných klinických studií je zřejmé, že 15 – 50 % bolestivých stavů v onkologii patří z patofyziologického hlediska do skupiny neuropatické bolesti. Tyto bolesti mohou být způsobeny vlastním nádorem či jeho léčbou [4]. Závažný klinický problém představují chemoterapií indukované periferní neuropatie, které vznikají po aplikaci některých chemoterapeutik, např. vinkristinu, cisplatiny, oxaliplatiny, paclitaxelu či docetaxelu [5]. V medikamentózní léčbě neuralgických bolestí onkologických nemocných se používá celá řada neopioidních i opioidních analgetik, stejně jako četná koanalgetika. Jejich účinek však nebývá vždy uspokojivý [6]. Jednou z nových možností léčby je tapentadol, který je současně agonistou µ ‑ opioidních receptorů a zároveň inhibitorem zpětného vychytávání noradrenalinu. Tento farmakologický profil tapentadolu je perspektivní v léčbě neuropatické nádorové bolesti [7].
Popis případu
Předmětem klinické kazuistiky je muž, kterému bylo v době stanovení nádorové diagnózy 65 let. V srpnu 2010 byl u nemocného diagnostikován špatně diferencovaný karcinom prostaty – T1cNXM1 s metastatickým postižením skeletu. Gleason skóre bylo 8 (4 + 4) a hodnota vstupního PSA 18,52 µg/ l. Dle provedené scintigrafie skeletu se jednalo o vícečetné metastatické postižení zejména v oblasti pánevního skeletu a v oblasti žeber. U nemocného byla v srpnu zahájena léčba kompletní androgenní blokádou (cyproteron acetát + leuprorelin acetát), která pokračovala do března 2012. V průběhu léčby došlo k poklesu PSA na 0,58 µg/ l, následně však došlo ke vzestupu PSA na 65,47 µg/ l a hormonální léčba byla ukončena. Dle PET/ CT vyšetření s natrium ‑ fluoridem, které bylo provedeno v březnu 2012, došlo k progresi vícečetných osteosklerotických metastáz s vysokou osteoblastickou aktivitou v oblasti pánve a žeber (obr. 1). Adenokarcinom prostaty byl označen jako kastračně rezistentní, hormonální léčba byla ukončena a nemocný zahájil paliativní chemoterapii docetaxelem v dávce 75 mg/ m2 v intervalu tří týdnů spolu s podáním prednisonu 5 mg 2krát denně per os. Nemocný podstoupil celkem osm cyklů této chemoterapie s dobrým klinickým efektem, kdy došlo v průběhu léčby k poklesu PSA na 15,86 µg/ l. Tato léčba však musela být pro výraznou periferní neuropatii a bolesti horních a dolních končetin ukončena. Nemocný postupně pociťoval mravenčení konečků prstů na rukou a plosek nohou. Postupně se parestezie rozšiřovaly až k loktům na horních končetinách a ke kolenům na dolních končetinách. Dále se objevilo pálení prstů, celková slabost končetin, velká citlivost končetin na teplotní výkyvy, která se projevovala nesnesitelnou bolestí. Nemocný byl zpočátku léčen neopioidními analgetiky, následně zahájil léčbu opioidy – transdermální fentanylovou náplastí v dávce 25 µg/ hod, měněnou každé tři dny. Byla rovněž zahájena léčba koanalgetiky. Nemocný zahájil léčbu gabapentinem: v počáteční dávce 3krát 300 mg denně, následně byla dávka eskalována na 3krát 600 mg denně. I přes eskalaci dávky gabapentinu nedošlo ke klinicky významnému zlepšení neuropatických potíží. Pro nežádoucí účinky (gastrointestinální potíže, akcelerace arteriální hypertenze) byla léčba snížena na počáteční dávku 3krát 300 mg. Při této dávce nemocný pak pociťoval mírné zlepšení potíží, přesto však klinické projevy neuropatie významně snižovaly kvalitu života nemocného. Současně byl proveden pokus ovlivnit neuropatické bolesti pomocí amitryptilinu. Nemocný začal užívat nejprve dávku 25 mg per os na noc, následně byla dávka eskalována na 75 mg. Opět nedošlo k významnému ovlivnění neuropatických bolestí a léčba musela být vzhledem k vedlejším účinkům (poruchy vizu, ataky ortostatické hypotenze) ukončena. Vzhledem k výše popisovaným klinickým potížím byl nemocný do března 2013 léčen pouze bisfosfonáty – kyselinou zoledronovou. Kromě neuralgických bolestí se u nemocného projevoval také depresivní syndrom. V březnu 2013 byla zahájena léčba tapentadolem 2krát 50 mg denně s následnou eskalací dávky na 2krát 100 mg denně. Tři týdny po zahájení léčby tapentadolem došlo k výraznému ústupu klinických potíží, nemocný pociťoval pouze mírné parestezie konečků prstů při změně teploty, posléze došlo v intervalu tří měsíců zcela k ústupu klinických potíží, včetně bolestí. Vzhledem k předchozí dobré reakci na docetaxel zahájil nemocný v dubnu 2013 retreatment docetaxelem. Hodnota PSA před zahájením léčby docetaxelem byla 226,70 µg/ l, po šesti cyklech chemoterapie klesla hodnota PSA na 14,31 µg/ l. U nemocného došlo k celkovému zlepšení zdravotního stavu a k výraznému zlepšení kvality života. Nemocný nadále pokračuje v retreatmentu pomocí docetaxelu za podpůrné léčby tapentadolem 2krát 100 mg denně. Nemocný je toho času bez bolestí, bez projevů toxicity protinádorové léčby, s velmi dobrou kvalitou života.
Image 1. PET/CT vyšetření skeletu natrium fluoridem, 3/2012. Vysoká osteoblastická aktivita v osteosklerotické metastáze v 5. žebru vlevo v čáře zadní axilární. Podezření na drobnou metastázu v 7. žebru vpravo. Vysoká osteoblastická aktivita v osteosklerotické metastáze v levé polovině sacra. Vícečetné osteosklerotické metastázy s vysokou osteoblastickou aktivitou v dorzální části spodiny acetabula vpravo, ve stydkých kostech oboustranně, v sedacím hrbolu vlevo a dále velmi drobné metastázy i v ilických kostech oboustranně. V levé polovině obratlového těla Th4 drobné osteolytické ložisko s mírně zvýšenou osteoblastickou aktivitou. Játra a slezina nezvětšeny, v nativním CT vyšetření bez ložisek. Žlučové cesty štíhlé. Patrně parapelvické cysty v levé ledvině, jiné změny na obou ledvinách nejsou patrné. Pankreas se známkami počínající tukové atrofie. Obě nadledviny a močový měchýř bez zřetelných patologických změn. Prostata nezvětšená. 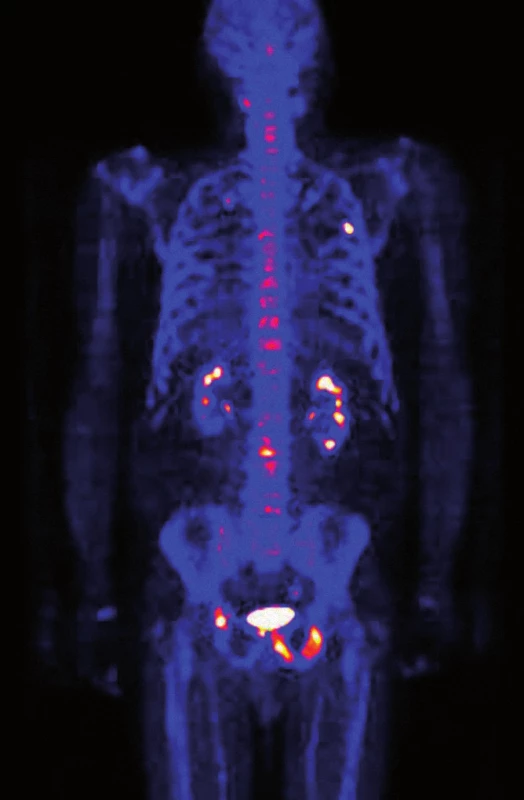
Table 1. Charakteristiky jednotlivých typů neuropatické bolesti [10]. ![Charakteristiky jednotlivých typů neuropatické bolesti [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8de1345c088950c47776379f8867e3a1.png)
Diskuze
Neuropatická bolest je bolestivý stav, který vzniká v souvislosti s poškozením struktury anebo funkce periferní či centrální nervové soustavy. Klinicky se projeví spontánní pálivou bolestí, intermitentní ostrou bolestí a bolestivou reakcí na nociceptivní (hyperalgezie) i non‑nociceptivní (alodynie) stimuly. Neuropatická bolest je nejčastěji lokalizovaná v dermatomu, který odpovídá nervu, nebo oblasti, která je inervována poškozeným nervovým kořenem či plexem [8]. Stute et al zjistili, že nejčastější příčinou neuropatických bolestí je komprese nervu (79 %), následuje poškození nervu (16 %), pouze 5 % je uváděno z jiných příčin [9]. Přehledná charakteristika jednotlivých typů neuropatické bolesti je uvedena v tab. 1 [10]. Periferní neuropatie zapříčiněná protinádorovou terapií – tzv. postchemoterapeutické neuropatie – se klinicky projevují jako senzitivní a motorické poruchy, častěji však jako smíšené senzomotorické neuropatie. Klinicky se projevují pocity mravenčení na končetinách, pálením prstů, pocity pálivé, píchavé až elektrizující bolesti, křečemi, ponožkovitým a rukavicovitým snížením citlivosti na akrálních částech končetin, poruchou jemné motoriky, slabostí končetin a zvýšenou citlivostí vůči teplotním výkyvům [10]. Postchemoterapeutické neuropatie vznikají především po podání vinkristinu, paclitaxelu, docetaxelu, cisplatiny, oxaliplatiny a thalidomidu. Výraznější postižení pozorujeme u nemocných s již existující diabetickou, ischemickou či alkoholickou neuropatií [11]. Bylo zjištěno, že dávková intenzita a vyšší kumulativní dávky chemoterapeutik jsou přímo úměrné incidenci a tíži průběhu senzomotorických poruch [12]. Léčba neuropatických bolestivých syndromů má být vzhledem k jejich častému výskytu integrální součástí léčby onkologických nemocných. Neléčená neuropatická bolest vyvolává úzkost, depresi, a negativně tak ovlivňuje kvalitu života nemocných [5]. V medikamentózní léčbě neuralgických bolestí onkologických pacientů se využívají léky užívané všeobecně k léčbě bolesti. Pokud nedosáhneme dostatečné úlevy od bolesti pomocí opioidních a neopioidních analgetik, přidáváme do léčebného schématu koanalgetika [9]. Nejčastěji užívanými koanalgetiky jsou karbamazepin, klonazepam, gabapentin, pregabalin a tricyklická antidepresiva [9,13]. Další klinické studie potvrdily účinnost selektivních inhibitorů zpětného vstřebávání serotoninu a noradrenalinu, jako jsou venlafaxin a duloxetin [14 – 16]. Novým opioidním analgetikem, které může být přínosem v léčbě postchemoterapeutických neuropatií, je tapentadol. Tapentadol je současně agonistou µ ‑ opioidních receptorů a zároveň je inhibitorem zpětného vychytávání noradrenalinu. Tento duální mechanizmus účinku rozšiřuje „terapeutické okno“ pro kauzální onkologickou léčbu neuropatií. Opioidní složka je dominantní v léčbě akutní bolesti, zatímco význam noradrenergní složky stoupá u chronické bolesti a bolesti neuropatické [17]. Klinické studie potvrdily, že tapentadol má analgetický účinek srovnatelný s oxycodonem při nižším výskytu nežádoucích účinků, zejména nežádoucích účinků typických pro opioidy, jako jsou nauzea, zácpa a zvracení [18]. Dobrý profil snášenlivosti potvrzuje také nízký výskyt lékových interakcí, protože tapentadol se málo váže na plazmatické bílkoviny a je nezávislý na metabolizmu cytochromů – především cytochromu P450, který je nezbytný pro metabolizmus mnoha chemoterapeutik (např. taxanů). Hladina tapentadolu tak není ovlivněna lékovými interakcemi. Tapentadol má také čistý farmakologický profil (není racemát či proléčivo) a jeho účinnost je nezávislá na metabolické aktivaci, a proto nehrozí riziko kumulace aktivních metabolitů [19].
Závěr
Na základě výše uvedené kazuistiky a získaných klinických zkušeností je možné konstatovat, že tapentadol poskytuje stabilní a dlouhodobou úlevu od postchemoterapeutické neuropatické bolesti. Tapentadol je díky svému metabolizmu bezpečný z hlediska lékových interakcí a díky svému duálnímu mechanizmu účinku rozšiřuje možnosti léčby neuropatické bolesti u onkologických pacientů.
Podporováno projektem ED2.1.00/03.0076 Evropského fondu pro regionální rozvoj.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Luboš Holubec, Ph.D.
Onkologické a radioterapeutické oddělení
LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: lubosholubec@seznam.cz
Obdrženo: 28. 8. 2013
Přijato: 14. 9. 2013
Sources
1. Mercadante S. Cancer pain. Curr Opin Support Palliat Care 2013; 7(2): 139 – 143.
2. Laird B, Colvin L, Fallon M. Management of cancer pain: basic principles and neuropathic cancer pain. Eur J Cancer 2008; 44(8): 1078 – 1082.
3. Laird BJ, Scott AC, Colvin LA et al. Pain, depression, and fatigue as a symptom cluster in advanced cancer. J Pain Symptom Manage 2011; 42(1): 1 – 11.
4. Urch CE, Dickenson AH. Neuropathic pain in cancer. Eur J Cancer 2008; 44(8): 1091 – 1096.
5. Fallon MT. Neuropathic pain in cancer. Br J Anaesth 2013; 111(1): 105 – 111.
6. Laufenberg ‑ Feldmann R, Schwab R, Rolke R et al. Cancer pain in palliative medicine. Anaesthesist 2012; 61(5): 457 – 467.
7. Afilalo M, Morlion B. Efficacy of tapentadol ER for managing moderate to severe chronic pain. Pain Physician 2013; 16(1): 27 – 40.
8. Clancy J. Cancer‑related neuropathic pain: pharmalogical options. Br J Nurs 2012; 21(17): S31.
9. Stute P, Soukup J, Menzel M et al. Analysis and treatment of different types of neuropathic cancer pain. J Pain Symptom Manage 2003; 26(6): 1123 – 1131.
10. Jakubíková H, Klímová E. Neuropatické bolesti onkologických pacientov. Paliat Med Liec Boles 2010; 3(3): 99 – 101.
11. Reyes ‑ Gibby CC, Morrow PK, Buzdar A et al. Chemotherapy‑induced peripheral neuropathy as a predictor of neuropathic pain in breast cancer patients previously treated with paclitaxel. J Pain 2009; 10(11): 1146 – 1150.
12. Jung BF, Herrmann D, Griggs J et al. Neuropathic pain associated with non‑surgical treatment of breast cancer. Pain 2005; 118(1 – 2): 10 – 14.
13. Dworkin RH, Backonja M, Rowbotham MC et al. Advances in neuropathic pain: diagnosis, mechanisms, and treatment recommendations. Arch Neurol 2003; 60(11): 1524 – 1534.
14. Goldstein DJ, Lu Y, Detke MJ et al. Duloxetine vs. placebo inpatients with painful diabetic neuropathy. Pain 2005; 116(1 – 2): 109 – 118.
15. Rowbotham MC, Goli V, Kunz NR et al. Venlafaxine extended release in the treatment of painful diabetic neuropathy: a double‑blind, placebo ‑ controlled study. Pain 2004; 110(3): 697 – 706.
16. Durand JP, Deplanque G, Montheil V et al. Efficacy of venlafaxine for the prevention and relief of oxaliplatin‑induced acute neurotoxicity: results of EFFOX, a randomized, double‑blind, placebo ‑ controlled phase III trial. Ann Oncol 2012; 23(1): 200 – 205.
17. Gaertner J, Schiessl C. Cancer pain management: what‘s new? Curr Pain Headache Rep 2013; 17(4): 328.
18. Taylor R, Pergolizzi JV, Raffa RB. Tapentadol extended release for chronic pain patients. Adv Ther 2013; 30(1): 14 – 27.
19. Riemsma R, Forbes C, Harker J et al. Systematic review of tapentadol in chronic severe pain. Curr Med Res Opin 2011; 27(10): 1907 – 1930.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 5-
All articles in this issue
- Cykliny D v regulaci a dysregulaci buněčného cyklu u mnohočetného myelomu
- Důvody změn ve stagingu karcinomu vulvy
- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Dosažení kompletní hematologické remise je zásadní pro prodloužení přežití nemocných s AL amyloidózou a srdečním postižením
- Klinické, histopatologické a zobrazovací charakteristiky non‑hodgkinských lymfomů u pacientů s postižením mozku
- Léčba polyneuropatické bolesti u nemocného s generalizovaným, kastračně rezistentním karcinomem prostaty – klinická kazuistika
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Pacientka s atypickým neurocytomem – kazuistika
- Onkogeny RAS – prediktivní molekulární marker u kolorektálního karcinomu
- Proliferačná aktivita v dospelom mozgu potkana po expozícii ionizujúcim žiarením
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Důvody změn ve stagingu karcinomu vulvy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

