-
Medical journals
- Career
Je ten istý tyrozín - kinázový inhibítor efektívny aj po vzniku mozgových metastáz? Kazuistika
Authors: J. Obertova; M. Mego; P. Palacka; J. Rajec; Martin Chovanec; J. Mardiak
Authors‘ workplace: II. onkologická klinika LF UK a Národný onkologický ústav, Bratislava
Published in: Klin Onkol 2013; 26(4): 286-290
Category: Case Report
Overview
Od uvedenia nových biologických cielených liekov (tyrozín - kinázových inhibítorov a mammalian target of rapamycin (mTOR) inhibítorov) do liečby renálneho karcinómu sme svedkami éry nových liečebných možností. U pacientov so vznikom mozgových metastáz pretrváva dilema ohľadne ďalšieho optimálneho liečebného postupu špeciálne u podskupiny pacientov bez progresie mimo centrálneho nervového systému. Cieľom prezentovanej kazuistiky je poukázať, že je možné pokračovať v tej istej liečbe cieleným liekom u pacienta po vzniku mozgových metastáz, ktorému bola aplikovaná lokálna rádioterapia na mozgové metastázy, s dosiahnutím zmysluplného celkového prežívania.
Kľúčové slová:
renálny karcinóm – mozgové metastázy – cielená liečba – sunitinibÚvod
Od roku 2006 po uvedení na trh prvých tyrozín-kinázových inhibítorov nastalo významné zlepšenie liečebných výsledkov u pacientov s lokálne pokročilým alebo metastatickým renálnym karcinómom. U pacienta liečeného tyrozín - kinázovým inhibítorom, u ktorého dôjde k vzniku mozgových metastáz bez progresie mimo centrálneho nervového systému, zostáva dilema ohľadne ďalšieho optimálneho liečebného postupu.
Kazuistika
Cieľom kazuistiky je prezentácia prípadu 70 - ročného muža s anamnézou dobre kontrolovanej arteriálnej hypertenzie na liečbe nitrendipinom, ktorému vo februári 2007 bol zistený bilaterálny nádor obličiek. Podľa vstupného CT vyšetrenia u pacienta boli prítomné rozsiahle tumory na obidvoch obličkách (veľkosti 80 a 120 mm) a mnohopočetné pľúcne metastázy (do 25 mm). Biopsia najväčšieho tumoru na ľavej obličke potvrdila diagnózu svetlobunkového renálneho karcinómu so stredným stupňom diferenciácie (stupeň 2). Pacient bol vo výbornom výkonnostnom stave a podľa Memorial Sloan - Kettering Cancer Center (MSKCC) prognostických kritérií patril do strednej prognostickej rizikovej skupiny [1]. U pacienta nebola realizovaná nefrektómia a v čase stanovenia diagnózy mal metastatické štádium ochorenia.
Od marca do mája 2007 bol u pacienta podávaný interferón α v klasickom dávkovaní 9 MIU s.c. 3 - krát týždenne, nakoľko v tom čase tyrozín - kinázový inhibítor na Slovensku nebol dostupný. Táto liečba nebola účinná a u pacienta došlo k progresii pľúcnych metastáz aj tumorov na obidvoch obličkách. V júli 2007 bola zahájená liečba sunitinibom v štandardnom dávkovacom režime 50 mg denne počas štyroch týždňov s 2 - týždňovou pauzou. Najlepšia dosiahnutá odpoveď bola parciálna remisia zaznamenaná po jednom roku liečby sunitinibom s výrazným zmenšením počtu a veľkosti pľúcnych metastáz a so zmenšením a zmenou vzhľadu na výrazne hypodenzný obličkových metastáz. Liečba bola dobre tolerovaná, dominujúcou toxicitou bolo zhoršenie hypertenzie na stupeň 3 podľa hodnotiacich kritérií nežiadúcich účinkov verzia 4.0 s potrebou pridania druhého antihypertenzíva (ramipril) a subklinická hypotyreóza bez nutnosti substitučnej liečby [2].
Začiatkom júna 2008 u pacienta vznikla expresívna afázia s miernou pravostrannou hemiparézou. CT vyšetrenie mozgu a následne vyšetrenie magnetickou rezonanciou (13. 6. 2008) potvrdilo nález mnohopočetných mozgových metastáz so známkami zakrvácania a rozsiahlym peritumorálnym edémom (obr. 1). U pacienta bola zahájená antiedematózna liečba dexametazónom, liečba sunitinibom bola prerušená a bola aplikovaná celomozgová externá rádioterapia v celkovej dávke 30 Gy počas 10 frakcií. U pacienta došlo ku kompletnej úprave expresívnej afázie a pravostrannej hemiparézy, avšak vzhľadom na pretrvávajúci peritumorálny edém okolo reziduálnych mozgových metastáz (kontrolná magnetická rezonancia mozgu 3. 9. 2008) (obr. 2) bola liečba dexametazónom podávaná až do konca októbra 2008 s veľmi pozvoľným znižovaním dávky.
Image 1. Magnetická rezonancia mozgu 13. 6. 2008. 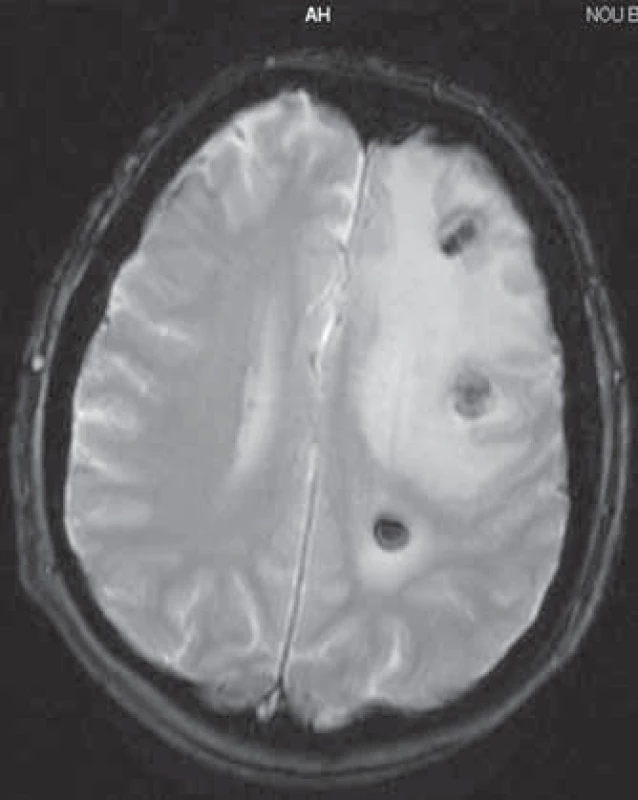
Image 2. Magnetická rezonancia mozgu 3. 9. 2008. 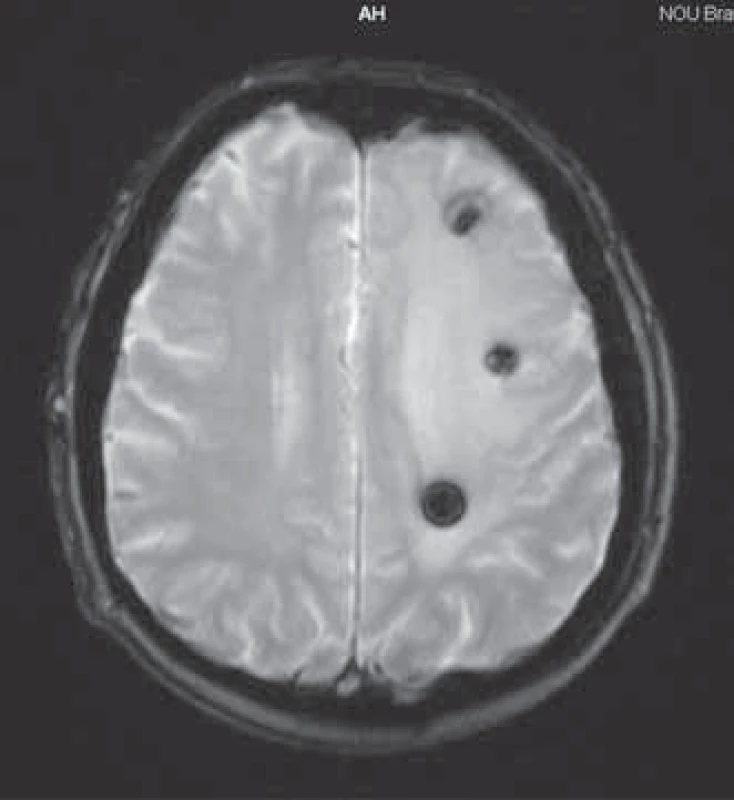
U pacienta vzhľadom na pretrvávanie dobrej kontroly ochorenia mimo centrálneho systému (trvanie parciálnej remisie v pľúcach a obličkách) sme sa rozhodli po aplikovaní lokálnej rádioterapie pokračovať v liečbe sunitinibom. Od novembra 2008 do júla 2009 nepotreboval žiadnu antiedémovú liečbu, bol vo výbornom výkonnostnom stave a bol schopný aktívne pracovať ako profesor na univerzite vrátane prednášok. Tolerancia liečby sunitinibom bola naďalej veľmi dobrá a nelíšila sa od obdobia pred vznikom mozgových metastáz. Opakované kontrolné CT vyšetrenia hrudníka a abdomenu potvrdilo pretrvávajúcu dobrú kontrolu ochorenia mimo centrálneho nervového systému (obr. 3, 4).
Image 3. CT vyšetrenie hrudníka a abdomenu 4. 2. 2009. 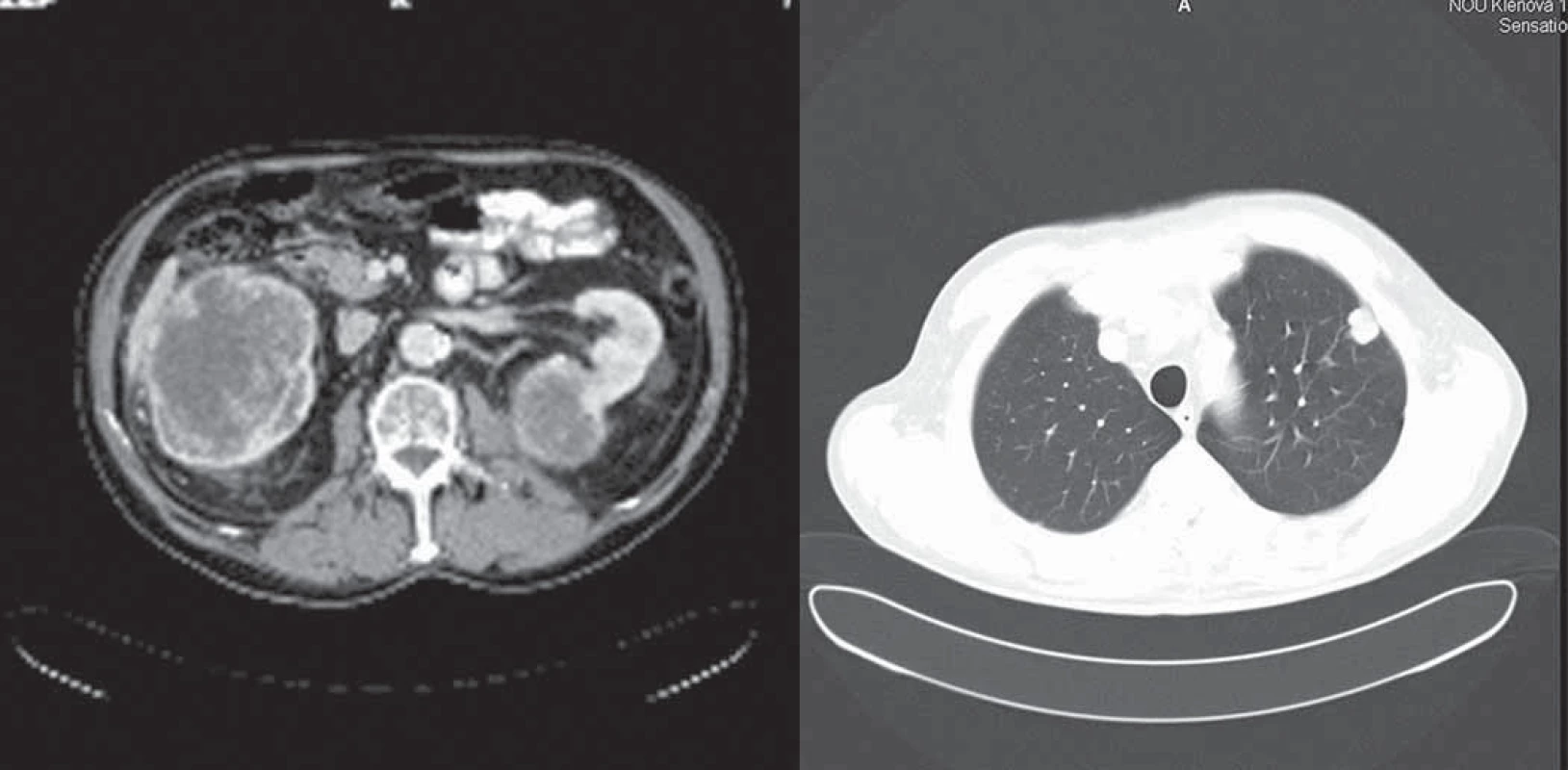
Image 4. CT vyšetrenie hrudníka a abdomenu 16. 4. 2009. 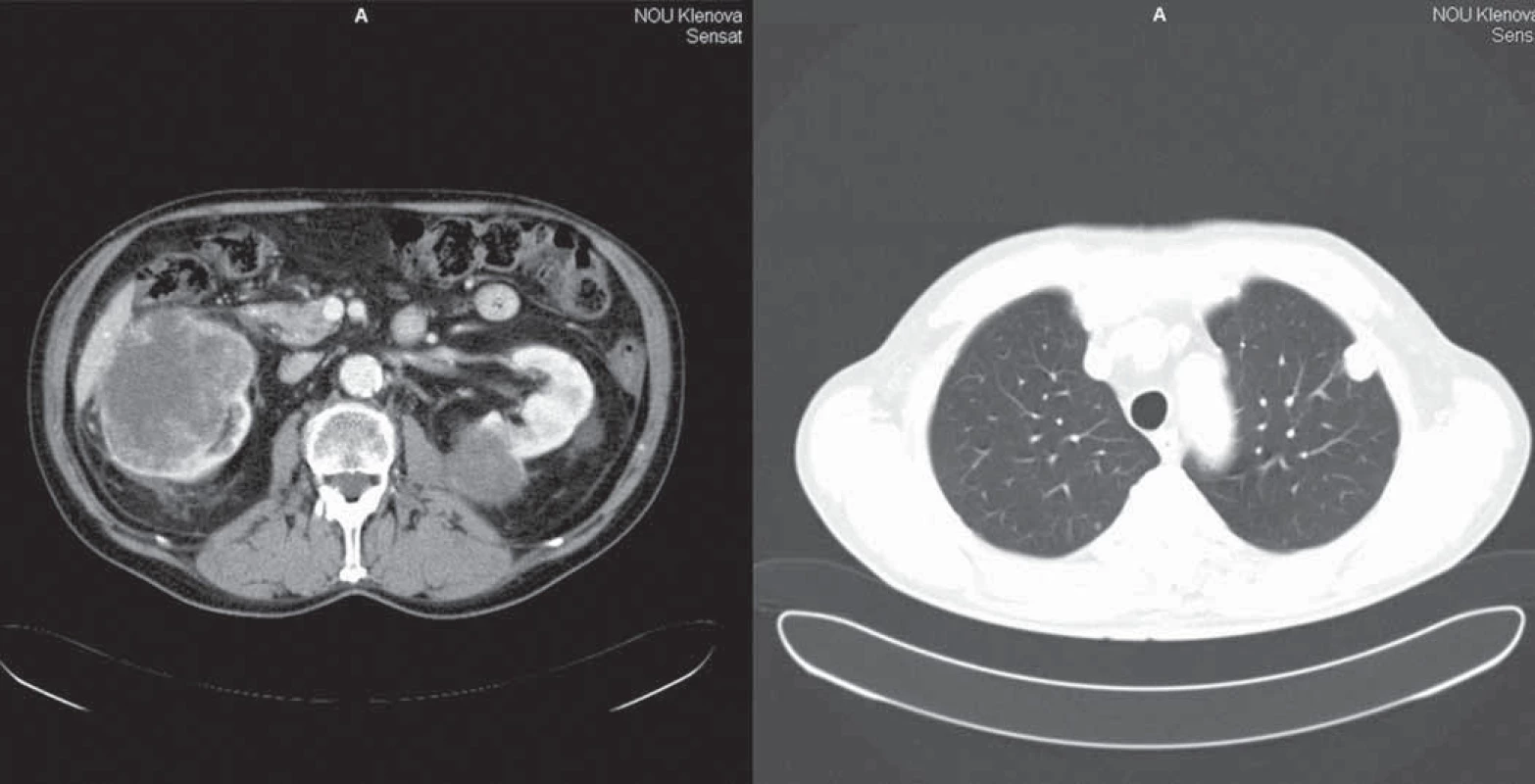
12. 7. 2009 u pacienta došlo k recidíve pôvodných neurologických ťažkostí: objavila sa expresívna afázia a mierna pravostranná hemiparéza. CT vyšetrenie mozgu preukázalo progresiu pôvodných reziduálnych mozgových metastáz so známkami zakrvácania a výrazným peritumorálnym edémom v kombinácii s postiradiačnými zmenami (obr. 5). Pacientovi bola započatá antiedematózna terapia s dexametazónom. Po troch dňoch došlo k úprave expresívnej afázie, ale u pacienta stále pretrvávala mierna pravostranná hemiparéza a celková slabosť. 20. 8. 2009 sa jeho zdravotný stav dramaticky zhoršil, bol hospitalizovaný s poruchou vedomia. Stav sa napriek symptomatickej liečbe a eskalovanej antiedematóznej liečbe už nepodarilo ovplyvniť a 27. 8. 2009 pacient zomrel za príznakov centrálneho zlyhania podmieneného kombináciou progresie mozgových metastáz a postiradiačnej leukoencefalopatie. Celkové prežívanie od stanovenia diagnózy dosiahlo 30,8 mesiaca, liečba sunitinibom trvala 25,8 mesiaca a pacient žil od zistenia mozgových metastáz 14,7 mesiaca. Až do smrti u pacienta pretrvávala parciálna remisia extrakraniálnej choroby na pľúcach a obličkách.
Image 5. CT vyšetrenie mozgu 12. 7. 2009. 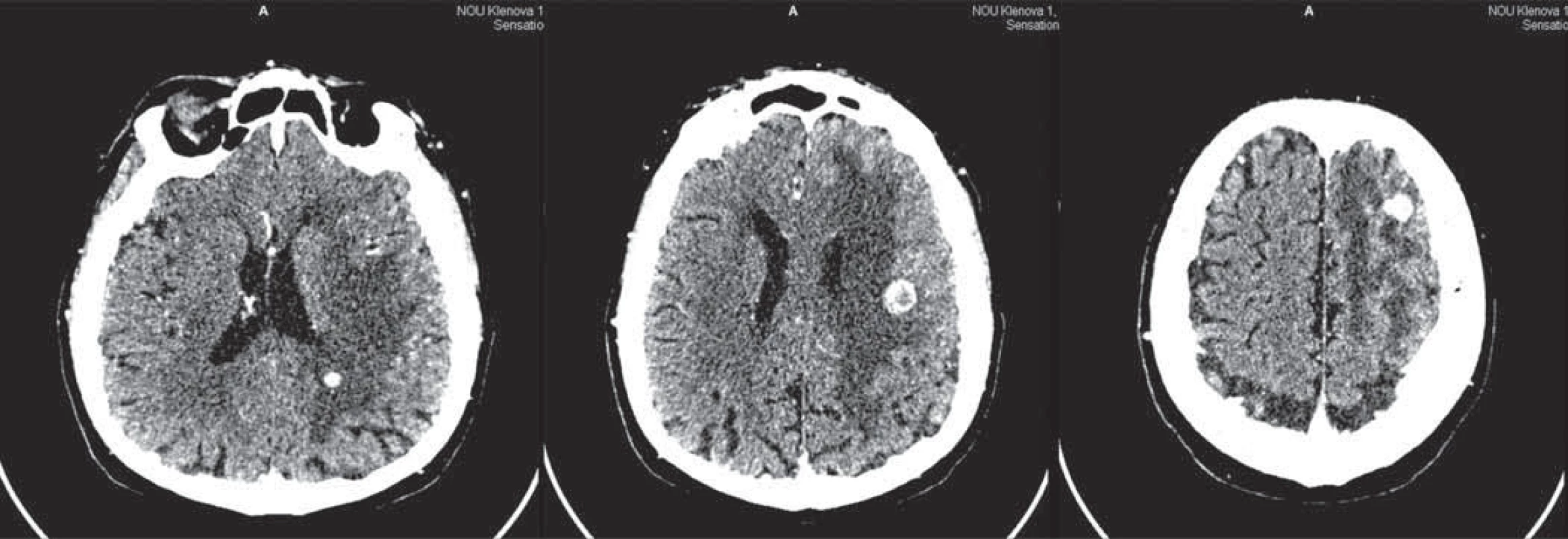
Diskusia
Renálny karcinóm patrí medzi nádory s častým výskytom mozgových metastáz [3,4]. Medián celkového prežívania dosahuje 3 – 6 mesiacov po vzniku mozgových metastáz [5], aj keď anekdoticky bol publikovaný aj dlhší medián celkového prežívania [6]. Kumulatívna incidencia mozgových metastáz počas liečby sunitinibom podľa údajov zo zväčša malých retrospektívnych súborov a kazuistík varíruje medzi 7 a 10 % [7,8].
Retrospektívna analýza všetkých hodnotiteľných pacientov liečených v ére biologickej cielenej liečby od novembra 2007 do novembra 2012 na II. onkologickej klinike LF UK a Národného onkologického ústavu v Bratislave preukázala 10,6% (20 pacientov z 189) kumulatívnu incidenciu počas liečby sunitinibom. Naše dáta v zhode s publikovanými dátami naznačujú, že sunitinib výraznejšie neznižuje incidenciu mozgových metastáz.
Je len málo dát o prenikaní sunitinibu a iných tyrozín - kinázových inhibítorov cez hemato - encefalickú bariéru do mozgu. Štúdie na zvieratách naznačujú, že sunitinib v určitom rozsahu preniká cez hemato - encefalickú bariéru [9]. Z publikovaných dát sa zdá, že sunitinib aj u ľudí dokáže udržať pod kontrolou mozgové metastázy. Publikované kazuistiky naznačujú, že solitárne alebo len v malom počte prítomné mozgové metastázy môžu dobre odpovedať na liečbu sunitinibom s dosiahnutím parciálnej až kompletnej remisie bez predchádzajúcej aplikácie lokálnej liečby na mozgové metastázy (rádioterapie alebo operácie) [10,11]. Dosiaľ najväčší publikovaný súbor pacientov s mozgovými metastázami liečených sunitinibom pochádza z rozšíreného prístupového programu [12]. Do štúdie bolo zaradených 4 371 pacientov, z ktorých 321 pacientov (7,3 %) malo mozgové metastázy. U 213 pacientov s mozgovými metastázami sa dala hodnotiť efektivita liečby. Pri liečbe sunitinibom 12 % pacientov s mozgovými metastázami dosiahlo objektívnu odpoveď a 52 % stabilizáciu v trvaní viac ako tri mesiace. Medián prežívania bez progresie u tejto podskupiny pacientov bol 5,6 mesiaca a celkové prežívanie bolo 9,2 mesiaca. Na porovnanie, hodnotiteľných 3 251 pacientov bez mozgových metastáz malo 19 % odpovedí, 59 % stabilizácií, medián prežívania bez progresie 11,1 mesiaca a medián celkového prežívania 19,1 mesiaca. Z publikovanej štúdie nie je jasné, či pacienti s mozgovými metastázami pred zahájením sunitinibovej liečby mali aplikovaný nejaký typ lokálnej liečby.
Dáta z jednej malej retrospektívnej štúdie naznačujú, že sunitinib môže mať antiedematózny účinok [13], a tak maskovať preexistujúce mozgové metastázy. Tento fenomén bol tiež pozorovaný aj v práci Helgasona et al [7]. U väčšiny pacientov so vznikom mozgových metastáz počas liečby sunitinibom sa neurologické príznaky prejavili a boli diagnostikované počas dvojtýždňovej pauzy v sunitinibovej liečbe. U nášho pacienta sme pozorovali podobný úkaz, rozvoj neurologických ťažkostí nastal v druhom týždni pauzy v sunitinibovej liečbe.
Naša skúsenosť naznačuje, že je bezpečné pokračovať v liečbe sunitinibom u pacienta so vznikom mozgových metastáz v prípade dobrej kontroly extrakraniálnej systémovej choroby a sunitinib si môže zachovať efektivitu aj po vzniku mozgových metastáz. Náš pacient žil od diagnostikovania mozgových metastáz 14,7 mesiaca so zachovanou stabilizáciou choroby, čo môže naznačovať aktivitu sunitinibu v centrálnom nervovom systéme. Liečba suntinibom trvala 25,8 mesiaca a celkové prežívanie dosiahlo 30,8 mesiaca.
Dosiaľ publikované dáta naznačujú, že je bezpečnejšie liečbu sunitinibom počas externej rádioterapie mozgu pozastaviť a v liečbe pokračovať až po ukončení lokálnej liečby. Fenomén pseudoprogresie ako následku toxicity z kombinovanej liečby sunitinibom alebo sorafenibom spolu s rádioterapiou mozgu je charakterizovaný intrakraniálnou symptomatológiou, peritumorálnym edémom s reverzibilným nárastom kontrastného sýtenia pri vyšetrení magnetickou rezonanciou [14],čím imituje progresiu. U nášho pacienta sme liečbu sunitinibom počas externej rádioterapie mozgu prerušili a v liečbe sme znovu pokračovali až po ukončení lokálnej liečby a fenomén pseudoprogresie sme nepozorovali.
Záver
Mozgové metastázy patria k obzvlášť devastujúcim vzdialeným metastázam s výrazne negatívnym vplyvom na celkové prežívanie. Výber liečby po vzniku mozgových metastáz predstavuje liečebnú dilemu ohľadne ďalšieho optimálneho liečebného postupu. Naša kazuistika podporuje liečebnú možnosť pokračovať v terapii tým istým cieleným liekom, ak nie sú známky extrakraniálnej progresie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Jana Obertová
II. onkologická klinika LF UK
Národný onkologický ústav
Klenová 1
833 10 Bratislava
Slovenská republika
e-mail: jobert878@gmail.com
Obdrženo: 3. 4. 2013
Přijato: 23. 4. 2013
Sources
1. Motzer RJ, Bacik J, Murphy BA et al. Interferon‑alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289 – 296.
2. Cancer.gov [homepage on the Internet]. National Cancer Institute Common Terminology Criteria for adverse events, version 4.0. U.S. Department of health and human services. Published: May 28, 2009. Available from: http:/ / ctep.cancer.gov/ protocolDevelopment/ electronic_applications/ ctc.htm#ctc_40.
3. Schouten LJ, Rutten J, Huveneers HA et al. Incidence of brain metastasis in a cohort of patients with carcinoma of the breast, colon, kidney, and lung and melanoma. Cancer 2002; 94(10): 2698 – 2705.
4. Remon J, Lianes P, Martínez S. Brain metastases from renal cell carcinoma. Should we change the current standard? Cancer Treat Rev 2012; 38(4): 249 – 257.
5. Wrónsky M, Maor MH, Davis BJ et al. External radiation of brain metastases from renal carcinoma: A retropective study of 119 patients from the M. D. Anderson Cancer Center. Int J Radiat Oncol Biol Phys 1997; 37(4): 753 – 759.
6. Sheehan JP, Sun MH, Kondziolka D et al. Radiosurgery in patients with renal cell carcinoma metastasis to the brain: Long‑term outcomes and prognostic factors influencing survival and local tumor control. J Neurosurg 2003; 98(2): 342 – 349.
7. Helgason HH, Mallo HA, Droogendijk H et al. Brain metastases in patients with renal cell cancer receiving new targeted treatment. J Clin Oncol 2008; 26(1): 152 – 154.
8. Larkin JM, Hess V, Pickering LM et al. Symptomatic brain metastases from renal cell carcinoma during treatment with sunitinib or sorafenib. J Clin Oncol 2010; 28 (Suppl 15):abstr. e15023.
9. Patyna S, Peng G. Distribution of sunitinib and its active metabolite in brain and spinal cord tissue following oral or intravenous administration in rodents and monkeys. Eur J Cancer 2006; 4 : 21 – 22.
10. Koutras AK, Krikelis D, Alexandrou N et al. Brain metastasis in renal cell cancer responding to sunitinib. Anticancer Res 2007; 27(6C): 4255 – 4257.
11. Zeng H, Li X, Yao J et al. Multifocal brain metastases in clear cell renal cell carcinoma with complete response to sunitinib. Urol Int 2009; 83(4): 482 – 485.
12. Gore ME, Hariharan S, Porta C et al. Sunitinib in metastatic renal cell carcinoma patients with brain metastases. Cancer 2011; 117(3): 501 – 509.
13. Batchelor TT, Sorensen AG, di Tomaso E et al. AZD2171, a pan - VEGF receptor tyrosine kinase inhibitor, normalizes tumor vasculature and alleviates edema in glioblastoma patients. Cancer Cell 2007; 11(1): 83 – 95.
14. Kelly PJ, Weiss SE, Sher DJ et al. Sunitinib - Induced pseudoprogression after whole - brain radiotherapy for metastatic renal cell carcinoma. J Clin Oncol 2010; 28(25): e433 – e435.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 4-
All articles in this issue
- Moderní zobrazovací techniky pro antracyklinová cytostatika – literární přehled
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Karcinom pankreatu a faktory životního stylu
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Je ten istý tyrozín- kinázový inhibítor efektívny aj po vzniku mozgových metastáz? Kazuistika
- Týdenní vs dvoutýdenní aplikace cetuximabu v léčbě metastatického kolorektálního karcinomu – aktuální klinická data
- Dimenze onkochirurgie
- Synchronní bilaterální testikulární tumor ze zárodečných buněk: kazuistika a přehled literatury
-
Onkologie v obrazech
Giant Metastatic Testicular Tumor
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

