-
Medical journals
- Career
Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory
Authors: T. Büchler 1; K. Šimonová 2; P. Fencl 2; J. Abrahámová 1
Authors‘ workplace: Onkologické oddělení, Fakultní Thomayerova nemocnice a 1. LF UK, Praha 1; Oddělení nukleární medicíny a PET centrum, Nemocnice Na Homolce, Praha 2
Published in: Klin Onkol 2011; 24(6): 413-417
Category: Reviews
Overview
Pozitronová emisní tomografie s využitím 18-fluorodeoxyglukózy (FDG-PET) nemá v diagnostice a sledování neseminomových germinálních nádorů jednoznačné postavení. Klinické studie prokázaly poměrně nízkou specificitu a senzitivitu metody při hodnocení vstupního rozsahu nemoci a viability reziduálních ložisek po chemoterapii. Na druhou stranu FDG-PET může přinést klinicky důležité informace u pacientů se stoupajícími nádorovými markery a u nemocných s mnohočetnými, obtížně resekovatelnými reziduálními lézemi po chemoterapii. Umožňuje také časné hodnocení chemosenzitivity nádorů a detekci zánětlivých komplikací léčby.
Klíčová slova:
pozitronová emisní tomografie – germinom – diagnostika – terapieGerminální nádory varlat jsou nejčastější malignitou mužů ve věku 15–35 let. Vznikají z mužských zárodečných buněk. Z klinického hlediska má význam rozdělení germinálních nádorů varlat dospělých na seminomy (55 %) a skupinu neseminomových nádorů (45 %), jejichž hlavními zástupci jsou embryonální karcinom, teratokarcinom, choriokarcinom a nádor ze žloutkového váčku. Neseminomové nádory často současně obsahují okrsky různých výše uvedených histologických typů. Nádory stejné histologie občas vzniknou i mimo varle, nejčastěji v retroperitoneu, mediastinu nebo v pineální žláze.
V České republice je patrný vzestup výskytu testikulárních nádorů jak v číslech absolutních, tak relativních. Za rok 2007 byla incidence 9,5/100 tisíc mužů (482 osob) a mortalita 0,7/100 tisíc mužů (35 osob) [1]. Toto onemocnění postihuje především mladé muže ve věku 20–40 let – v období 2001–2006 byl u nás střední věk pacientů se seminomy 38 let a pacientů s neseminomovými nádory 29 let [2].
U všech nemocných s nově diagnostikovaným testikulárním germinálním nádorem jakéhokoliv stadia je cílem léčby dosáhnout dlouhodobé kompletní remise. Vyléčí se téměř 100 % pacientů s nepokročilým nádorem a 90 % pacientů s metastatickým testikulárním nádorem ve skupině s dobrou prognózou. Avšak z pacientů v nepříznivé prognostické skupině přežívá pět let méně než 50 % a z pacientů s relapsem po léčbě kombinovanou chemoterapií na bázi platiny méně než 20 % [3].
Pozitronová emisní tomografie (PET) je diagnostická zobrazovací metoda umožňující na tomografických řezech sledovat rozložení radiofarmaka v těle pacienta. Nejčastěji využívaným radiofarmakem je 18-fluorodeoxyglukóza (FDG). Buňky většiny maligních nádorů vykazují zvýšenou konzumpci glukózy a maligní nádory jsou pak při FDG-PET zobrazeny jako ložiska patologicky zvýšené konzumpce FDG. V současné době již převažují hybridní PET/CT kamery, které v rámci jednoho vyšetření umožňují získat kromě metabolické i morfologickou informaci o patologickém ložisku.
Staging
Standardní staging pacientů s TGN se kromě histopatologického vyšetření primárního nádoru opírá o klinické vyšetření, vyšetření břicha, malé pánve a hrudníku pomocí CT a stanovení hladin nádorových markerů po orchiektomii.
Ve studii publikované Albersem a spolupracovníky byl staging pomocí CT srovnán se stagingem pomocí FDG-PET u 37 pacientů se seminomovými a neseminomovými nádory stadií I a II. V této studii se prokázala vyšší senzitivita (70 % vs 40 %) i specificita (100 % vs 78 %) vyšetření FDG-PET ve srovnání s CT [4]. I v další podobné studii byla opět prokázána 100% specificita a pozitivní prediktivní hodnota FDG-PET [5].
Lassen et al zkoumali, zda je FDG-PET dostatečně citlivou metodou pro predikci relapsů z retroperitoneálních ložisek nezachytitelných na CT [6]. Pozitivní výsledek FDG-PET mělo 7 z 10 pacientů, kteří relabovali v retroperitoneu po 1–8 měsících od vyšetření. I tato výzkumná skupina tedy konstatovala, že FDG-PET má přidanou hodnotu ve srovnání se standardním stagingem pacientů s neseminomovými nádory [6].
Uvedené výsledky vedly k britské randomizované studii TE22, která zkoumala, zda FDG-PET vyšetření může pomoci identifikovat pacienty vhodné ke sledování. Do studie bylo zařazeno 116 pacientů s neseminomovými nádory stadia I s vysokým rizikem relapsu (s lymfovaskulární invazí). Po mediánu sledování 1 rok ovšem došlo k relapsu u 47 % pacientů s negativním vstupním FDG-PETa studie byla pro toto vysoké procento relapsů předčasně ukončena [7].
Příčinou negativity FDG-PET u retroperitoneálních metastáz není jen jejich malá velikost. De Wit et al prokázali, že někdy FDG-PET dokáže detekovat metastatické ložisko velké jen 0,2 cm [8]. Na druhou stranu i u jejich pacientů mělo vyšetření FDG-PET někdy falešně negativní výsledek u postižených uzlin zvětšených až na 2 cm. Příčinou jsou biologické odlišnosti neseminomových nádorů, které vykazují nejednotnou a nehomogenní konzumpci glukózy.
I když je negativní prediktivní hodnota FDG-PET ve srovnání s CT vyšší (78 % vs 67 %, P = 0,05), právě z důvodů občasné falešné negativity není FDG-PET vhodným nástrojem k rozhodnutí o observaci pacientů s nepokročilým neseminomem. Pacienti s vysokým rizikem mikrometastáz, tj. ti nemocní, u nichž histologie potvrdí přítomnost vaskulární invaze v primárním nádoru [9], by měli být léčeni adjuvantní chemoterapií i při negativním výsledku FDG-PET. FDG-PET v rámci stagingu neseminomů stadia I tedy zásadně nezmění léčebnou strategii ve srovnání s konvenčním stagingem pomocí CT a nádorových markerů.
Hodnocení léčebné odpovědi a nádorového rezidua
FDG-PET je osvědčeným vyšetřením v diagnostice viability reziduálních seminomových nádorů. Ve studii publikované De Santis a jejími spolupracovníky byla senzitivita FDG-PET 80 % a jeho specificita 100 % pro nádory velikosti 3 cm a více. FDG-PET v těchto parametrech a indikaci jasně překonává CT [10,11].
Podle nejnovějších evropských doporučení pro diagnostiku a léčbu TGN se FDG-PET doporučuje u reziduálních ložisek po chemoterapii pro seminom, zejména pokud je reziduum větší než 3 cm [12].
U seminomových i neseminomových nádorů mohou být falešně negativní výsledky způsobené potlačením metabolické aktivity viabilního nádoru po chemoterapii, obvykle do dvou týdnů po ukončení léčby, a falešně pozitivní výsledky zvýšenou aktivitou makrofágů v oblasti nekrózy nádoru po chemoterapii (tzv. úklidová reakce), viz obr. 1. Časový limit výskytu této úklidové reakce není přesně znám. Odstup od podané chemoterapie by měl být u většiny indikací minimálně 3 týdny, ale občas je úklidová reakce na FDG-PET viditelná i po této době [13].
Image 1. Obraz infiltrace nádorového rezidua v retroperitoneu makrofágy po chemoterapii – pravděpodobně se jedná o tzv. úklidovou reakci, přetrvávající viabilní neoplazii ovšem nebylo možné vyloučit (A). Na snímku provedeném v odstupu 3 měsíců již fotopenická masa charakteru nekrózy (B). 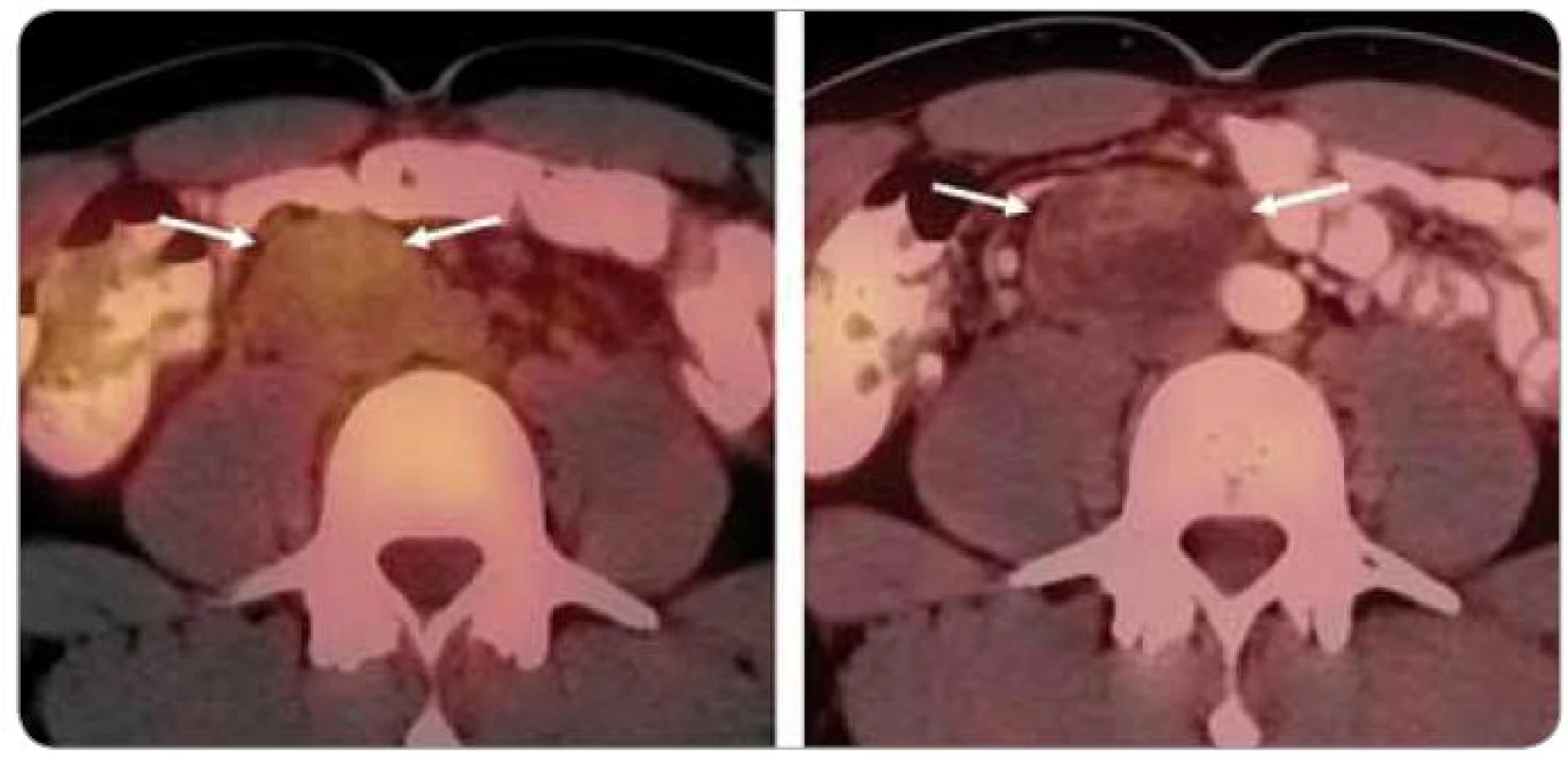
U pacientů s neseminomovými nádory dochází v některých případech spontánně nebo vlivem chemoterapie k diferenciaci nádorové tkáně do zralého teratomu, což je pomalu rostoucí, biologicky nestabilní ložisko, z něhož mohou po měsících i letech opět vznikat vysoce maligní struktury. Zralé teratomy jsou chemo - i radiorezistentní a jedinou možností jejich léčby je kompletní resekce. Známou nevýhodou CT a dalších zobrazovacích metod u pacientů s neseminomovými nádory po chemoterapii je nemožnost odlišit reziduální maligní (tzv. viabilní) nádor od zralého teratomu a jiných tkání, například jizevnaté nebo nekrotické tkáně (obr. 2). Viabilní nádor nebo zralý teratom se přitom v postchemoterapeutických reziduích vyskytuje až v 35 % případů [14].
Image 2. Retroperitoneální ametabolické nádorové reziduum u pacienta po vysokodávkované chemoterapii – nález je typický pro zralý teratom. 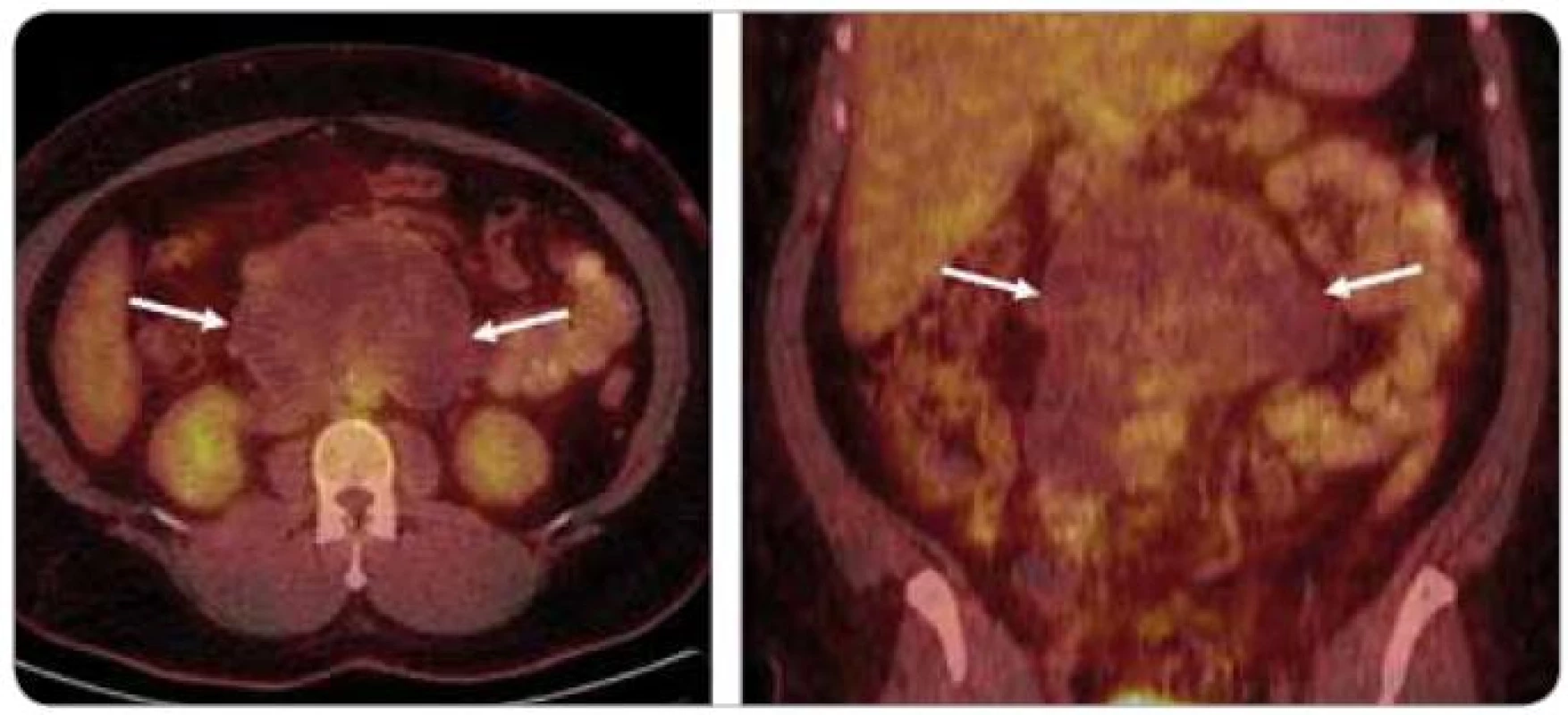
Využití FDG-PET pro diagnostiku perzistence nemoci po chemoterapii bylo zkoumáno v řadě retrospektivních a prospektivních studií s kontrolou histologie postchemoterapeutických reziduálních ložisek a/nebo dlouhodobým hodnocením klinického průběhu.
V prospektivní studii publikované v roce 2002 německou multicentrickou skupinou byly výsledky vyšetření FDG-PET, CT a nádorových markerů validovány buď histologickým vyšetřením, nebo minimálně šestiměsíčním sledováním pacientů s reziduálními nádory po chemoterapii. Senzitivita a specificita vyšetření pro odhad viability nádorového rezidua byly následující (senzitivita/specificita): FDG-PET 59/92 %, CT 55/86 %, nádorové markery 42/100 %. Silným prediktorem přítomnosti viabilního nádoru bylo zvýšení konzumpce glukózy ve více reziduálních lézích [15].
Významnou studii, která rozhodujícím způsobem ovlivnila pohled odborné veřejnosti na schopnost FDG-PET hodnotit reziduální léze po chemoterapii, publikovala v roce 2008 opět německá kooperativní skupina [13]. Autoři řešili otázku, zda pomocí vyšetření FDG-PET dovedeme identifikovat ty pacienty, kteří mají reziduální lézi, ale není nutné její chirurgické odstranění. Pokud bychom měli k dispozici spolehlivou metodu, která by dokázala odlišit nekrotické a jizevnaté léze od viabilního nádoru a zralého teratomu, mohli bychom některé pacienty s reziduem po chemoterapii dále jen sledovat. V této prospektivní studii s hodnocením histologie u všech reziduálních tumorů u 121 pacientů s neseminomovými nádory stadií IIC a III predikovalo vyšetření FDG-PET přítomnost viabilního nádoru nebo zralého teratomu správně jen v 56 % případů a nebylo lepší než CT nebo nádorové markery. Senzitivita FDG-PET byla 70 % a specificita 48 % [13]. Pacientů s viabilním nádorem nebo zralým teratomem v reziduu bylo v této studii 55 %, což je poněkud vyšší procento než v jiných sériích [14]. Pozitivní prediktivní hodnota FDG-PET u pacientů s reziduálním nádorem byla vysoká (96 %) (obr. 3), ale podobně vysoká byla i pozitivní prediktivní hodnota markerů (94 %) [13].
Image 3. FDG -PET/CT u pacienta s metastatickým choriokarcinomem prokazuje perzistenci viabilní neoplazie v plicích, játrech a retroperitoneu po 4 cyklech chemoterapie BEP. 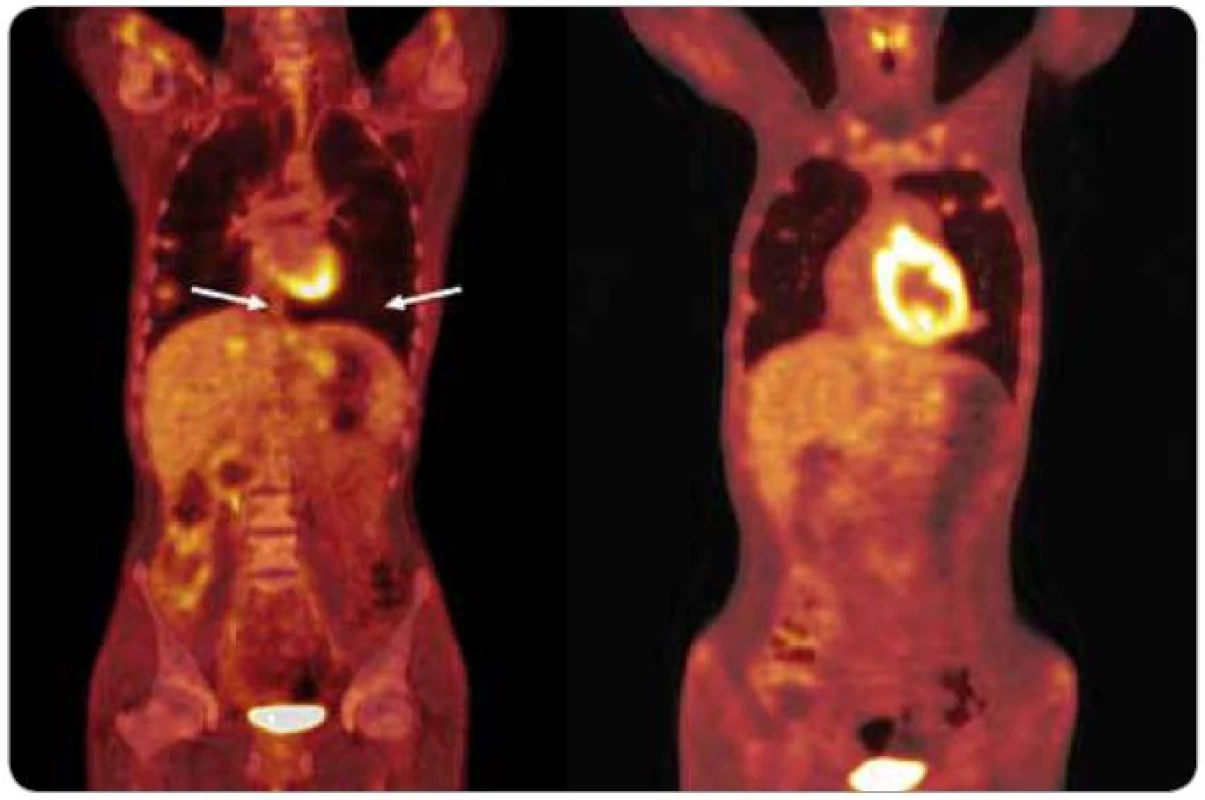
Hlavním problémem FDG-PET u nemocných s neseminomovými nádory je tedy nízká senzitivita. Falešná pozitivita vyšetření je pozorována u přibližně 5–10 % pacientů. Karapetis et al zjistili falešně pozitivní nález na FDG-PET u 3/26 vyšetření a u dalších čtyř vyšetření nebyl nález jednoznačný [16]. Ve všech publikovaných souborech pacientů se přitom dodržoval požadovaný, přibližně třítýdenní odstup od podané chemoterapie.
Z uvedených výsledků vyplývá, že FDG-PET nemá dostatečně vysokou senzitivitu pro detekci perzistujícího neseminomového nádoru. Stejně lze ovšem hodnotit i přínos dalších vyšetřovacích metod (CT, markery), a proto je základem včasné detekce relapsu časté a důkladné sledování dispenzarizovaných pacientů s vyšetřeními prováděnými sériově. Jednou z mála akceptovaných indikací FDG-PET u nemocných po léčbě je lokalizace místa relapsu u pacientů s elevací nádorových markerů a výběr vhodného místa biopsie v situacích, kdy je reziduí několik a jejich kompletní resekce by byla obtížná. V situaci, kdy jsou markery zvýšené, je však negativní prediktivní hodnota FDG-PET jen 50 % [13,17,18].
Časné sledování odpovědi na systémovou terapii
Metoda FDG-PET umožňuje kvantifikovat hladinu glukózové metabolické aktivity zobrazených tkání (standard uptake value – SUV). Na přínos kvantifikace SUV pro hodnocení nálezu jsou rozdílné názory. Protože je rozptyl při stanovení SUV velký, v současnosti jej má význam stanovovat jen v rámci klinických studií, které agregují velký počet dat získaných za totožných podmínek. Pro jednotlivého nemocného je hodnocení SUV méně spolehlivé než vizuální hodnocení.
Při systémové onkologické terapii pokles metabolické aktivity v nádoru obvykle předchází jeho morfologické regresi. Proto by vyšetření FDG-PET indikované časně po zahájení léčby teoreticky mohlo odlišit ty pacienty, u nichž je chemoterapie či biologická léčba účinná, od pacientů, kde je vhodné ji ukončit a nahradit další linií terapie.
Časné hodnocení odpovědi nádoru na systémovou terapii pomocí FDG-PET je zatím experimentální. Ve studii na xenograftech se prokázalo, že terapie cisplatinou vede k bifázické křivce akumulace FDG se zvýšením 2. dne a poklesem 7. dne po chemoterapii. V tomto časovém období ještě nedochází ke změně objemu nádorových ložisek [19]. Klinické studie s velmi časně provedeným vyšetřením FDG-PET zatím nejsou k dispozici.
Chemosenzitivita germinálních nádorů byla ovšem pomocí FDG-PET zkoumána u pacientů plánovaných k vysokodávkované chemoterapii. Chemosenzitivita TGN je totiž jedním z hlavních předpokladů úspěšné vysokodávkované chemoterapie s transplantací krvetvorných buněk [20].
V sérii pacientů léčených na německých pracovištích bylo vyšetření FDG-PET prováděno po 2–3 cyklech indukční chemoterapie před chemoterapií vysokodávkovanou. Léčebná odpověď hodnocená pomocí FDG-PET predikovala úspěch vysokodávkované chemoterapie lépe než jiné klinické parametry běžně užívané k hodnocení průběhu terapie u germinálních nádorů (CT a nádorové markery). Výsledek vysokodávkované chemoterapie predikovalo vyšetření FDG-PET v 91 % případů, CT v 59 % případů a markery jen ve 48 % případů [15,21]. Podobný výsledek jsme zaznamenali v naší studii u nemocných s extragonadálními germinálními nádory, kde výsledek vyšetření FDG-PET provedeného po první linii chemoterapie vysoce koreloval s celkovým přežitím pacientů [22].
Sledování toxicity léčby
Z krátkodobých a dlouhodobých následků léčby lze vyšetření FDG-PET využít v diagnostice druhé malignity a zánětlivých komplikací.
Zjištění druhé malignity metodou FDG-PET, i když teoreticky možné, nebývá u pacientů s germinálními nádory časté vzhledem k jejich mladému věku a faktu, že se FDG-PET zpravidla nepoužívá k dlouhodobému sledování po léčbě. V našem souboru druhých malignit u 1 057 pacientů sledovaných pro TGN jsme takový případ nezaznamenali, i když FDG-PET bylo užitečným vyšetřením v rámci ověřování a stagingu druhých malignit [23].
Diferenciální diagnostika suspektních okultních infekcí je jednou z hlavních indikací FDG-PET. U pacientů s nádory vyšetření FDG-PET občas prokáže infekční ložisko, a to jak v rámci stagingu, tak v rámci dlouhodobého sledování po léčbě [24–26].
Významnou, i když nepříliš častou komplikací chemoterapie bleomycinem je pneumonitida. FDG-PET ve spojení s CT a pneumologickým vyšetřením (funkční vyšetření plic a optimálně také bronchoalveolární laváž) umožňuje jednak včasnou diagnostiku pneumonitidy indukované bleomycinem, jednak monitorování jejího průběhu [27–30]. Pro akutní pneumonitidu indukovanou bleomycinem je charakteristický CT obraz bilaterálního intersticiálního plicního zánětu s retikulární kresbou hlavně v subpleurální lokalizaci (obr. 4). Spontánně nebo při protizánětlivé terapii se konzumpce glukózy normalizuje, s čímž koreluje zlepšení symptomů a difuzní plicní kapacity [30]. Fibrotické změny plicního parenchymu zpravidla přetrvávají dlouhodobě nebo i trvale.
Image 4. FDG-PET/CT u pacienta s dušností a kašlem po chemoterapii BEP, klinický průběh odpovídal pneumonitidě indukované bleomycinem. 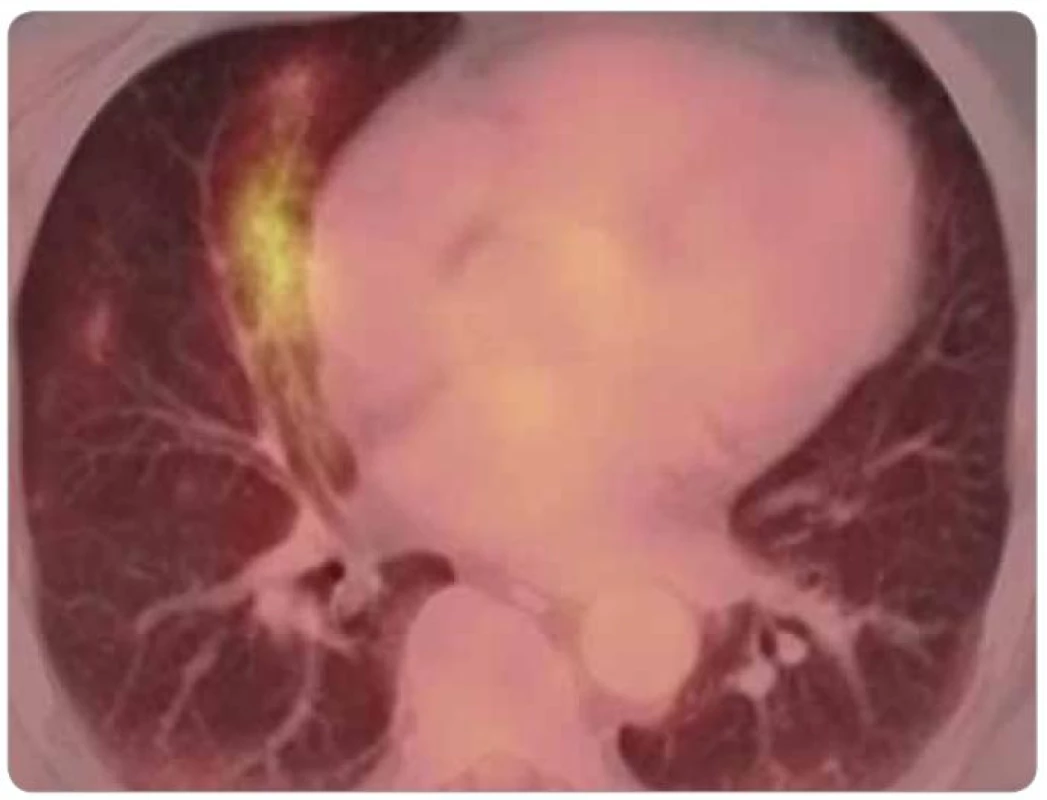
Rizika FDG-PET/CT
Každé vyšetření, které využívá k zobrazení lidského těla ionizující záření, zvyšuje úhrnnou absorbovanou dávku záření. Tu je možné vyjádřit v milisievertech (mSv). Přehledný rentgenový snímek plic je spojen s absorbovanou dávkou záření přibližně 0,1 mSv, naproti tomu CT plic exponuje tělo dávkou 10–100krát vyšší v závislosti na rozsahu vyšetření, zvolených parametrech a typu přístroje. Moderní přístroje poskytují kvalitní informaci již při dávkách kolem 3-8 mSv. Podaná 18-fluordeoxyglukóza se pak na úhrnné dávce podílí dalšími 3–4 mSv. Negativní účinek záření je možné pozorovat při dávce vyšší než 100 mSv, riziko je vyšší u mladší populace [31]. Protože i standardní sledování pomocí CT vystavuje pacienta jisté nezanedbatelné radiační zátěži, v rámci vyšetřování a zejména dlouhodobého poléčebného sledování pacientů s TGN se v budoucnu zřejmě více uplatní metody, jako je ultrazvuk s vysokou rozlišovací schopností a magnetická rezonance.
Závěr
Využití FDG-PET je u germinálních neseminomových nádorů omezené relativně nízkou specificitou a senzitivitou, jakož i značnou radiační zátěží pacienta a vysokou cenou vyšetření. Proto FDG-PET není rutinně indikováno k stagingu ani ke dlouhodobému sledování pacientů. Nejlepší indikací se podle dostupných prací jeví vyšetření pacientů, u nichž je vysoký stupeň podezření na relaps. Zajímavým využitím metody je diagnostika pacientů s podezřením na bleomycinovou pneumonitidu a sledování jejího vývoje. Výsledek FDG-PET po první linii terapie je silným prediktorem celkového úspěchu systémové léčby diseminovaných neseminomových nádorů.
S podporou grantu IGA NS 10420-3/2009 Ministerstva zdravotnictví České republiky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Tomáš Büchler, Ph.D.
Onkologické oddělení
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Obdrženo: 2. 6. 2011
Přijato: 18. 8. 2011
Sources
1. Dušek L, Mužík J, Gelnarová E et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311–324.
2. Abrahámová J, Dušek L, Mužík J. Epidemiologie nádorů varlat. In: Vybrané otázky onkologie XIII. 17. onkologicko-urologické sympozium a 13. mammologické sympozium, Praha 26.–28. 11. 2009 : 12–14.
3. International Germ Cell Cancer Collaborative Group. International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997; 15(2): 594–593.
4. Albers P, Bender H, Yilmaz H et al. Positron emission tomography in the clinical staging of patients with Stage I and II testicular germ cell tumors. Urology 1999; 53(4): 808–811.
5. Hain SF, O’Doherty MJ, Timothy AR et al. Fluorodeoxyglucose PET in the initial staging of germ cell tumours. Eur J Nucl Med 2000; 27(5): 590–594.
6. Lassen U, Daugaard G, Eigtved A et al. Whole-body FDG-PET in patients with stage I non-seminomatous germ cell tumours. Eur J Nucl Med Mol Imaging 2003; 30(3): 396–402.
7. Huddart RA, O’Doherty MJ, Padhani A et al. 18fluorodeoxyglucose positron emission tomography in the prediction of relapse in patients with high-risk, clinical stage I nonseminomatous germ cell tumors: preliminary report of MRC Trial TE22--the NCRI Testis Tumour Clinical Study Group. J Clin Oncol 2007; 25(21): 3090–3095.
8. de Wit M, Brenner W, Hartmann M et al. [18F]-FDG-PET in clinical stage I/II non-seminomatous germ cell tumours: results of the German multicentre trial. Ann Oncol 2008; 19(9): 1619–1623.
9. Albers P, Siener R, Kliesch S et al. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003; 21(8): 1505–1512.
10. De Santis M, Becherer A, Bokemeyer C et al. 2-18fluoro-deoxy-D-glucose positron emission tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. J Clin Oncol 2004; 22(6): 1034–1039.
11. Becherer A, De Santis M, Karanikas G et al. FDG PET is superior to CT in the prediction of viable tumour in post-chemotherapy seminoma residuals. Eur J Radiol 2005; 54(2): 284–288.
12. Schmoll HJ, Jordan K, Huddart R et al. Testicular seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21 (Suppl 5): v140–v146.
13. Oechsle K, Hartmann M, Brenner W et al. [18F]Fluoroeoxyglucose positron emission tomography in nonseminomatous germ cell tumors after chemotherapy: the German multicenter positron emission tomography study group. J Clin Oncol 2008; 26(36): 5930–5935.
14. Fosså SD, Qvist H, Stenwig AE et al. Is postchemotherapy retroperitoneal surgery necessary in patients with nonseminomatous testicular cancer and minimal residual tumor masses? J Clin Oncol 1992; 10(4): 569–573.
15. Kollmannsberger C, Oechsle K, Dohmen BM et al. Prospective comparison of [18F]fluorodeoxyglucose positron emission tomography with conventional assessment by computed tomography scans and serum tumor markers for the evaluation of residual masses in patients with nonseminomatous germ cell carcinoma. Cancer 2002; 94(9): 2353–2362.
16. Karapetis CS, Strickland AH, Yip D et al. Use of fluorodeoxyglucose positron emission tomography scans in patients with advanced germ cell tumour following chemotherapy: single-centre experience with long-term follow up. Intern Med J 2003; 33(9–10): 427–435.
17. Hain SF, O’Doherty MJ, Timothy AR et al. Fluorodeoxyglucose positron emission tomography in the evaluation of germ cell tumours at relapse. Br J Cancer 2000; 83(7): 863–869.
18. Sanchez D, Zudaire JJ, Fernandez JM et al. 18F-fluoro-2-deoxyglucose-positron emission tomography in the evaluation of nonseminomatous germ cell tumours at relapse. BJU Int 2002; 89(9): 912–916.
19. Aide N, Poulain L, Briand M et al. Early evaluation of the effects of chemotherapy with longitudinal FDG small-animal PET in human testicular cancer xenografts: early flare response does not reflect refractory disease. Eur J Nucl Med Mol Imaging 2009; 36(3): 396–405.
20. Beyer J, Kingreen D, Krause M et al. Long-term survival of patients with recurrent or refractory germ cell tumors after high dose chemotherapy. Cancer 1997; 79(1): 161–168.
21. Pfannenberg AC, Oechsle K, Kollmannsberger C et al. Early prediction of treatment response to high-dose chemotherapy in patients with relapsed germ cell tumors using [18F]FDG-PET, CT or MRI, and tumor marker. Rofo 2004; 176(1): 76–84.
22. Büchler T, Foldyna M, Nepomucká J et al. Extragonadal germ cell tumours - results from a single centre. EJC Supplements 2009; 7 : 447.
23. Büchler T, Kubánková P, Boublíkova L et al. Detection of second malignancies during long-term follow-up of testicular cancer survivors. Cancer 2011; 117(18): 4212–4218.
24. Wong PS, Lau WE, Worth LJ et al. Clinically important detection of infection as an ‘incidental’ finding during cancer staging using FDG-PET/CT. Intern Med J 2011. Epub ahead of print.
25. Mahfouz T, Miceli MH, Saghafifar F et al. 18F-fluorodeoxyglucose positron emission tomography contributes to the diagnosis and management of infections in patients with multiple myeloma: a study of 165 infectious episodes. J Clin Oncol 2005; 23(31): 7857–7863.
26. Sonet A, Graux C, Nollevaux MC et al. Unsuspected FDG-PET findings in the follow-up of patients with lymphoma. Ann Hematol 2007; 86(1): 9–15.
27. Hain SF, Beggs AD. Bleomycin-induced alveolitis detected by FDG positron emission tomography. Clin Nucl Med 2002; 27(7): 522–523.
28. Kirsch J, Arrossi AV, Yoon JK et al. FDG positron emission tomography/computerized tomography features of bleomycin-induced pneumonitis. J Thorac Imaging 2006; 21(3): 228–230.
29. von Rohr L, Klaeser B, Joerger M et al. Increased pulmonary FDG uptake in bleomycin-associated pneumonitis. Onkologie 2007; 30(6): 320–323.
30. Büchler T, Bomanji J, Lee SM. FDG-PET in bleomycin-induced pneumonitis following ABVD chemotherapy for Hodgkin’s disease--a useful tool for monitoring pulmonary toxicity and disease activity. Haematologica 2007; 92(11): e120–e121.
31. Bosl GJ, Motzer RJ. Weighing risks and benefits of postchemotherapy retroperitoneal lymph node dissection: not so easy. J Clin Oncol 2010; 28(4): 519–521.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 6-
All articles in this issue
- Plazminogen aktivátor systém a jeho klinický význam u pacientů s nádorovým onemocněním
- Castlemanova choroba
- Naše päťročné výsledky in vitro testovania chemorezistencie u onkologických pacientov
- Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek
- Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi
- Lékový registr – trabectedin
- Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
- Aktuálne charakteristiky deskriptívnej epidemiológie nádorov žalúdka v Slovenskej republike v kontexte medzinárodného porovnania
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- HER2 pozitivní T1N0M0 tumor: Čas pro změnu?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Castlemanova choroba
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- Lékový registr – trabectedin
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

