-
Medical journals
- Career
Naše päťročné výsledky in vitro testovania chemorezistencie u onkologických pacientov
Authors: J. Hatok 1; T. Matáková 1; J. Jurečeková 1; J. Chudej 2; P. Chudý 2; E. Huľo 3; Anton Dzian 3; Ľ. Strelka 3; D. Dobrota 1; P. Račay 1
Authors‘ workplace: Ústav lekárskej biochémie, JLF UK Martin, Slovenská republika 1; Klinika hematológie a transfuziológie, JLF UK a UNM Martin, Slovenská republika 2; Chirurgická klinika, JLF UK a UNM Martin, Slovenská republika 3
Published in: Klin Onkol 2011; 24(6): 443-446
Category: Original Articles
Overview
Východiská:
Translačná medicína predstavuje medicínsky odbor, ktorý zahŕňa základný výskum a vývoj nových diagnostických a terapeutických stratégií pre klinickú prax. Tento vedecký príspevok je zameraný na naše doterajšie skúsenosti v oblasti testovania chemorezistencie onkologických pacientov.Materiál a metódy:
Od roku 2005 sme odobrali vzorky 71 pacientov s leukemickým ochorením (AML, ALL a CML) a 92 pacientov so solídnymi tumormi (bronchogénne karcinómy a karcinómy GITu). Testovanie in vitro rezistencie malígnych buniek na liečivá sme vykonávali pomocou cytotoxického metyl-tiazol tetrazoliového (MTT) testu.Výsledky:
Na základe stanovenia LC50 (letálna koncentrácia liečiva, ktorá usmrcuje 50 % bunkovej populácie) sme zistili, že pacienti s akútnou myeloblastickou leukémiou vykazujú väčší stupeň rezistencie oproti pacientom s akútnou lymfoblastickou leukémiou. U pacientov s bronchogénnymi karcinómami sa primárna rezistencia prejavila pri cisplatine v 28 percentách, paklitaxelu (36 %), vinkristíne (50 %), etopozide (56 %), vinorelbíne (57 %), topotekane (62 %), gemcitabíne (77 %) a dakarabazíne v 86 % prípadov testovaných vzoriek.Záver:
Z výsledkov MTT testu karcinómov GITu (karcinóm hrubého čreva, rektosigmoidálneho spojenia a konečníka) vyplýva predovšetkým relatívna úspešnosť cisplatiny (okrem karcinómu žalúdka), ktorá je porovnateľná so základným cytostatikom 5-fluorouracilom. Samotný MTT test sa aj napriek niektorým limitujúcim faktorom (nedostatočný počet vitálnych buniek, možná kontaminácia nenádorovými bunkami a pod.) ukazuje za spoľahlivú in vitro metódu stanovenia rezistencie nádorových buniek na klinicky používané liečiva.Kľúčové slová:
translačná medicína – chemorezistencia – in vitro testovanie – malignityÚvod
Jedným z perspektívnych trendov modernej medicíny je translačná medicína (TM) predstavujúca nový medicínsky odbor, ktorý zahŕňa základný výskum a vývoj nových diagnostických a terapeutických stratégií pre klinickú prax. TM sa zaoberá prenosom a aplikáciou najnovších poznatkov základného výskumu v oblasti genetiky, molekulárnej biológie, biochémie a biotechnológií do klinickej praxe. V tomto článku uvádzame výsledky v oblasti testovania chemorezistencie leukemických buniek a buniek získaných od pacientov so solídnymi tumormi.
Rezistencia malígnych ochorení predstavuje v súčasnosti hlavnú príčinu, ktorá obmedzuje efektivitu chemoterapie. Malignity môžu byť primárne rezistentné na cytostatiká (geneticky podmienená rezistencia) alebo k vývoju rezistencie dochádza počas liečby (získaná rezistencia). Predpokladá sa, že rezistencia na cytostatiká, či už geneticky podmienená, alebo získaná, je zodpovedná za zlyhanie liečby u viac ako 90 % pacientov s metastázami a rezistentné mikrometastatické tumory môžu tiež znižovať efektivitu chemoterapie v adjuvantnej liečbe [1].
Testovaním chemorezistencie pomocou rôznych metód je teoreticky možné vybrať optimálne zloženie chemoterapie z viacerých možností štandardnej liečby [2]. Na základe prediktívneho in vitro testu (MTT) sme prispeli k určeniu najúčinnejších cytostatík pre individualizovanú terapiu, a tým sme sa priradili k špecializovaným pracoviskám nielen na Slovensku.
Materiál a metódy
Biologický materiál
Od leukemických pacientov (n = 71, vek: 19–84 rokov) sme získavali heparizovanú periférnu krv (PK) alebo kostnú dreň (KD). Jednotlivé zastúpenia diagnóz boli v tomto počte: AML (45), ALL (18) a CML (8). Izoláciu leukocytov sme realizovali pomocou hustotného gradientu (Lymphocyte Separatium Medium 1077, PAA – Austria), po ktorej boli bunky kultivované v kultivačnom médiu (RPMI 1640, 15 % FBS, 2 mM L-glutamín, 1 % ATB a 0,005 % ITS) pri 37 °C a 5 % CO2.
Od pacientov so solídnymi tumormi (n = 92, vek 25–82 rokov) sme odobrali vzorky tkaniva s explantačnou účinnosťou 75 %. V skupine boli pacienti s bronchogénnymi karcinómami (15) a karcinómami gastrointestinálného traktu (GITu – 77). Separáciu nádorových buniek daného biologického materiálu sme vykonali pomocou mechanickej a enzymatickej fragmentácie (0,05% kolagenáza) s následnou purifikáciou nádorových buniek technikou centrifugácie v hustotnom gradiente. Takto získané bunky sme ďalej kultivovali obdobne ako leukocyty, len sme zvýšili obsah ATB na 2 %.
Testovanie chemorezistencie
Na in vitro testovanie chemorezistencie sme použili päťdňový metyl-tiazol tetrazoliový (MTT) test [3]. Princíp testu je založený na schopnosti živých buniek redukovať žltú rozpustnú tetrazoliovú soľ mitochondriálnym enzýmom sukcinátdehydrogenázou na nerozpustný modrý formazán. Suspenziu vitálnych buniek v koncentračnom rozpätí 1–1,5 × 106/ml sme kultivovali 72 hodín ako bez cytostatík (kontrola), tak spolu so študovanými cytostatikami v zostupných koncentráciách na 96-jamkovej platni. Na záver kultivácie sme do každej jamky pridali MTT soľ (5 mg/ml) a nechali 4–6 hodín pôsobiť. Vzniknuté formazánové kryštály sme rozpustili pomocou roztoku laurylsulfátu sodného (pH = 5,5). Na druhý deň sme na čítači platní (Microplate reader, Bio-Rad – Germany) merali optickú denzitu (OD) pri 540 nm. Na základe získaných hodnôt sme určili koncentráciu LC50 (letálna koncentrácia liečiva, ktorá usmrcuje 50 % bunkovej populácie – najúčinnejšia). Nakoniec sme definovali výsledky testovania chemorezistencie, resp. citlivosti do troch skupín podľa hodnôt LC50 a percenta prežívajúcich buniek pri maximálnej koncentrácii cytostatík:
- citlivá skupina predstavovala prežívanie buniek pri maximálnej koncentrácii od 0 do 25 % a hodnota LC50 sa pohybovala okolo strednej koncentrácie testovanej škály cytostatika, po prípade bola nižšia;
- vnímavá skupina bola charakterizovaná prežívaním buniek pri maximálnej koncentrácii od 25 do 50 % a hodnota LC50 bola stanovená pri vyšších koncentráciách;
- rezistentná skupina predstavovala prežívanie buniek pri maximálnej koncentrácii nad 50 % a hodnota LC50 vo väčšine prípadov nebola stanovená.
Výsledky a diskusia
Leukemickí pacienti
Celkovo sme v tejto skupine pacientov mali 31 mužov a 40 žien. Pri porovnávaní získaných hodnôt LC50 v závislosti od typu materiálu (PK vs KD) sme nezistili žiadny rozdiel. Ak sme porovnávali hodnoty LC50 (n = 42) od štyroch párov leukemických pacientov, t.j. spolu 8 vzoriek periférnej krvi a kostnej drene, zistili sme lineárnou regresiou pozitívnu koreláciu (R = 0,9844; p < 0,0001). Stanovenie výsledkov chemorezistencie leukemických buniek z kostnej drene a periférnej krvi sa ukazuje za výhodný praktický význam, keďže môžeme vychádzať z rôzneho materiálu a pritom zachovať takmer identický výstup. Podobné zistenia namerali aj Kaspers et al ešte v roku 1991, kde testovali 14 liečiv na vzorkách PK a KD od 12 leukemických pacientov [4].
Na základe priebehu krivky a hodnôt LC50 sme mohli posúdiť vplyv cytostatík na populáciu leukemických buniek, kde sme výsledok rozdelili do troch skupín, viď. časť Materiál a metódy. Reprezentatívnu ukážku výstupu testovania chemorezistencie môžeme vidieť na obr. 1. Bunky od pacienta s akútnou myeloblastickou leukémiou (denovo, M0-1) sú citlivé na mitoxantrón (MIX) a daunorubicín (DAU), vnímavé na cytarabín (Ara-C) a rezistentné na vinkristín (VNC), kedy bunky prežívajú aj pri maximálnej koncentrácii.
Image 1. Grafické znázornenie závislosti prežívania buniek od rastúcej koncentrácie používaných cytostatík. 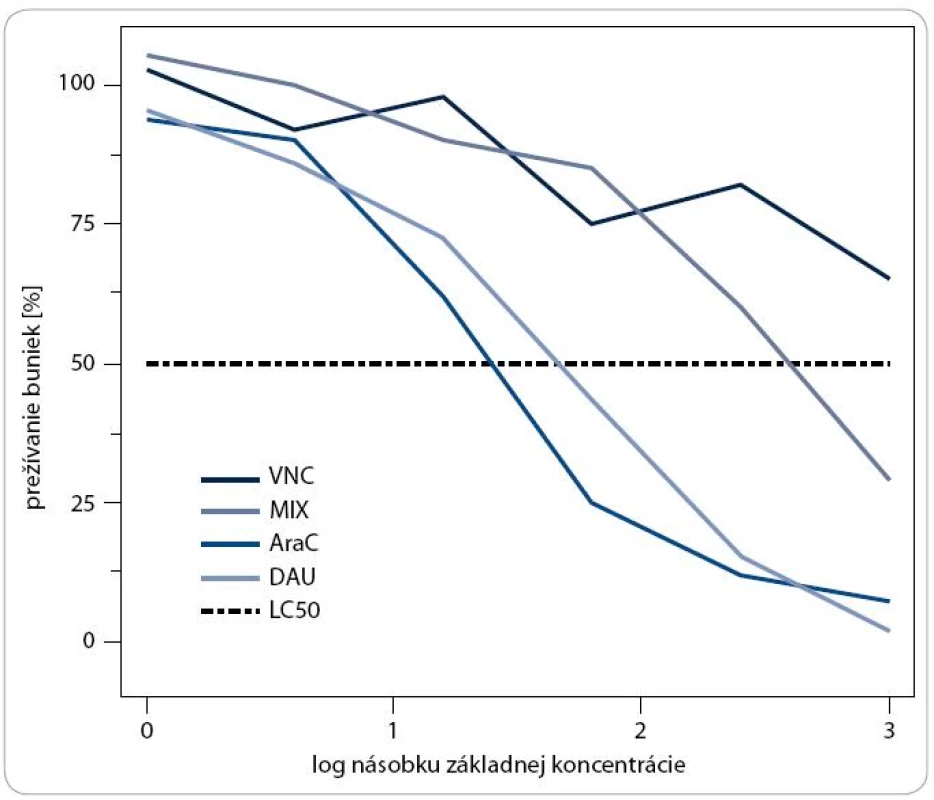
Pri porovnaní výsledkov testovania chemorezistencie medzi akútnymi leukémiami sme zistili štatistický významné rozdiely pri niektorých testovaných cytostatikách. V skupine AML vzoriek (n = 45) sme určili vyššie hodnoty LC50 pre etopozid, metylprednizolón, mitoxantrón, prednizón a vinkristín oproti skupine ALL vzoriek (n = 18). Naopak, ALL vzorky boli rezistentnejšie na cytarabín, daunorubicín a doxorubicín (tab. 1). Lymfoblasty získané od CML pacientov nepreukazovali žiadne štatistický významné rozdiely v porovnaní s bunkami od pacientov s akútnymi leukémiami aj z dôvodu, že ich počet v súbore nebol postačujúci.
Table 1. Prehľad výsledkov testovania chemorezistencie hematologických malignít. 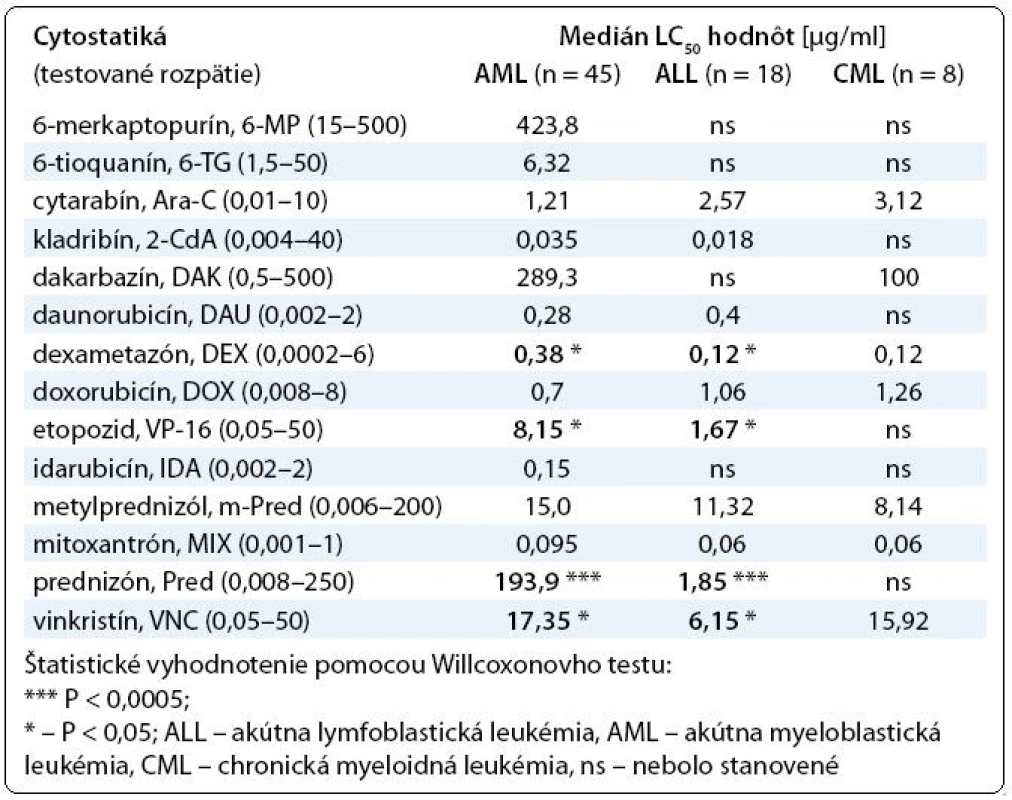
Zlyhávanie terapie leukémií je pravdepodobne spôsobené tým, že leukemický klon nie je možné dostatočne odstrániť. Veľký význam k pochopeniu zlyhania terapie sa preto nakláňa k porozumeniu mechanizmom liekovej rezistencie pred zasiahnutím cieľa liečivom (farmakologická rezistencia) a po liekovej interakcii s miestom ataku (bunková rezistencia) [5].
Výsledky našej in vitro štúdie prezentujú, že dospelí pacienti s AML dosiahli vyššiu rezistenciu na niektoré testované liečivá (dexametazón, etopozid, prednizón a vinkristín) v porovnaní s ALL pacientmi. Odlišné in vitro výsledky medzi študovanými diagnózami (tab. 1) vysvetľujú rozdielne biologické aspekty jednotlivých typov leukemických ochorení, ktorými si môžeme vysvetľovať aj ich rozdielne prognózy. Medzi vzorkami od novo diagnostikovaných a pacientov v relapse sme nezistili štatistický významné rozdiely, ale vysoká variabilita hodnôt LC50 indikuje k individuálnemu prístupu in vivo chemoterapie.
Pacienti so solídnymi tumormi
Výsledky v tejto časte sme rozdelili podľa diagnóz do dvoch oblastí: bronchogénne karcinómy a karcinómy gastrointersticiálného traktu (GITu).
Chemoterapia pokročilých bronchogénnych karcinómov je relatívne málo úspešná už niekoľko rokov. Najlepšie výsledky pri hodnotení percenta pacientov prežívajúcich jeden rok po liečbe sú dosahované cisplatinovou monoterapiou (24 %), alebo kombináciou s etopozidom (35 %), vinorelbínom (36 %), paklitaxelom (36 %) a gemcitabínom (39 %). Minimálne 2/3 karcinómov sú však k chemoterapii rezistentné a liečba je v týchto prípadoch záťažou pre pacienta, ako aj zdravotný systém [6]. Otestovali sme celkovo 15 vzoriek získaných z nádorového tkaniva. Primárna rezistencia explantovaných buniek bronchogénnych karcinómov sa prejavila v 28,5 % pri cisplatine, 62,5 % (topotekan), 57,1 % (vinorelbín), 50 % (vinkristín), 35,7 % (paklitaxel), 77,7 % (gemcitabín), 55,5 % (etopozid) a v 85,7 % pri dakarbazíne. Najvyššiu rezistenciu sme zaznamenali v prípade antimetabolitu gemcitabínu a dakarbazínu. Relatívne najlepšiu citlivosť nádorových buniek sme zistili na cisplatinu a paklitaxel. Úplnú polychemorezistenciu sme zaznamenali v jednom prípade.
Kolorektálny karcinóm v ostatných 30 rokoch obsadzuje prvé miesto v rebríčku zhubných ochorení. Na Slovensku je kolorektálny karcinóm druhým najčastejšie sa vyskytujúcim zhubným nádorom – u mužov za karcinómom pľúc a u žien za karcinómom prsníka. Incidencia kolorektálneho karcinómu na Slovensku má už niekoľko rokov stúpajúci trend, každoročne sa zaznamenáva 4-násobný nárast [7]. Účinnosť štandardnej chemoterapie v spomínanej skupine karcinómov je 20–30 % [8]. V období od roku 2005 sme otestovali 77 vzoriek nádorov získaných z karcinómov GITu rôznej etiológie. Vzorky od pacientov s karcinómom žalúdka (n = 3) boli vnímavé na 5-fluorouracil (5-FU), etopozid a paklitaxel. Naopak rezistenciu na cisplatinu sme zistili u všetkých vzoriek. Nádorové bunky pochádzajúce z hrubého čreva boli v in vitro podmienkach citlivé na 5-FU, cis-Pt, VP-16 a rezistentné na DAK. Zo 40 vzoriek tkaniva karcinómu rektosigmoidálneho spojenia v 12 z nich sme nezískali potrebné množstvo buniek na analýzu alebo počas kultivácie došlo ku kontaminácii. Na základe porovnania výsledkov MTT testu sa javia subpopulácie nádorových buniek karcinómu rektosigmoidálneho spojenia najmenej citlivé na testované cytostatiká. Z výsledkov vyplýva relatívna úspešnosť cisplatiny, ktorá nie je v prípade kolorektálneho karcinómu v terapii na prvom mieste voľby. Citlivosť voči základnému 5-FU je porovnateľná s cis-Pt, ako aj s TAX. Môžeme však uvažovať, že ďalšie liečivá patriace do skupiny antimetabolitov nie sú schopné v krátkodobej kultúre rozvinúť proliferačnú aktivitu v porovnaní s cis-Pt zo skupiny alkylačných látok. Pri vzorkách kolorektálnych karcinómov sme za najúčinnejšie cytostatikum označili topotekan. Do skupiny GITu sme zaradili ešte aj karcinómy rekta, kde sme jednoznačne účinné, resp. rezistentné cytostatikum na jednotlivé bunkové populácie (n = 11) nezistili (tab. 2).
Table 2. Prehľad výsledkov testovania chemorezistencie najpočetnejších skupín pacientov so solídnymi tumormi. 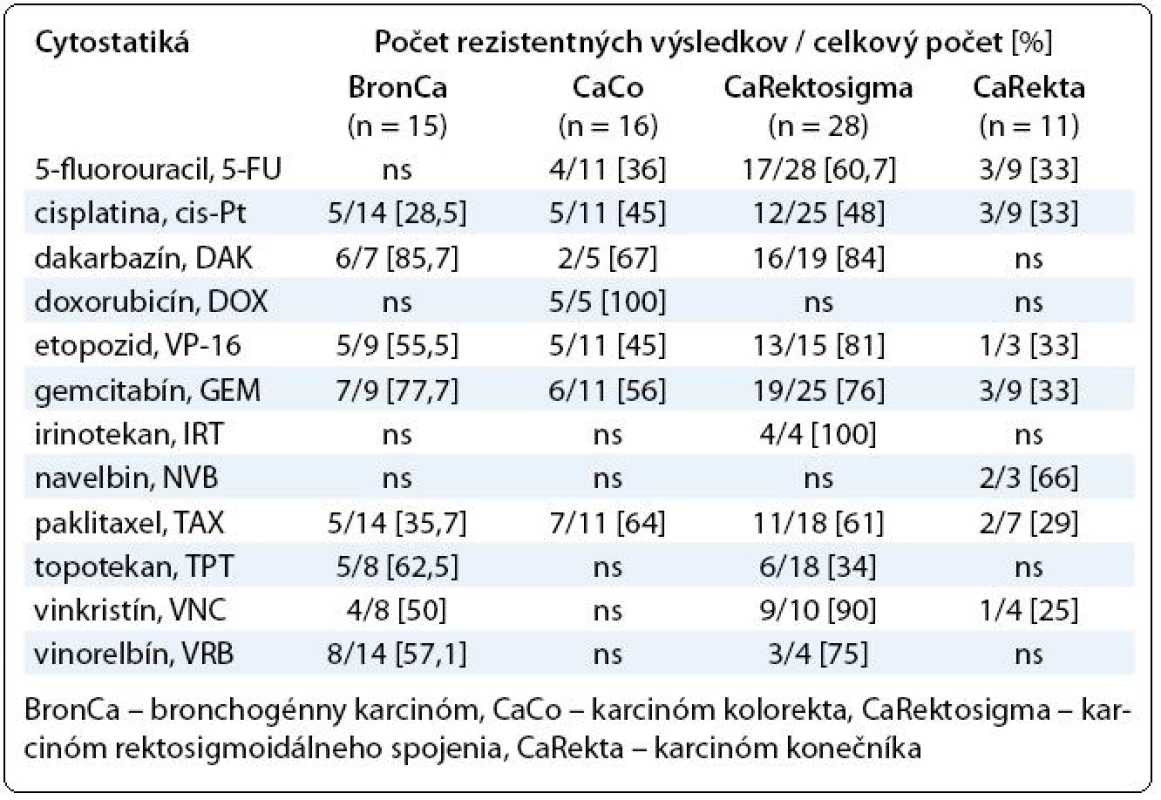
Záver
Metyl-tiazol tetrazoliový test poskytuje rýchle určenie liekovej rezistencie pre skúmanú populáciu malígnych buniek s rôznym morfologickým, cytogenetickým a proliferačným potenciálom. V princípe sa jedná o krátkodobú in vitro metódu testovania chemorezistencie, kedy už na 5. deň, od začiatku pokusu, vieme vyhodnotiť výsledok. Vo všeobecnosti sa účinnosť modernej chemoterapie pohybuje medzi 30 a 60 percentami. Tieto in vitro prediktívne testy by preto mali byť dostupné na špecializovaných pracoviskách, kde môžu onkológom poskytnúť možnosť výberu najúčinnejších liečiv pre individualizovanú chemoterapiu. Samotné ich uplatnenie sa v klinickej praxi využíva najmä v prípadoch, kedy neexistujú štandardné chemoterapeutické režimy, definované na základe výsledkov klinických štúdií, a kde ide o recidivujúce a polyrezistentné malignity po predchádzajúcej liečbe. Rovnako tak môžeme testovanie in vitro chemorezistenci uskutočniť pri malignitách, kde síce existuje možnosť výberu z viacerých štandardných režimov, avšak ich účinnosť je značne obmedzená.
Aj keď zatiaľ nie sú prediktívne testy chemorezistencie optimálne, ich použitie je v zahraničí realitou súčasnosti. Je potrebné ich naďalej zdokonaľovať, to však nie je možné uskutočniť bez aktívneho prispenia všetkých odborníkov zaoberajúcich sa onkologickými ochoreniami. Rovnako je tak dôležité navodenie intenzívnejšej klinickej diskusie k interpretáciám prediktorov chemorezistencie.
Poďakovanie
Za laboratórnu výpomoc pri spracovaní jednotlivých malígnych buniek by sme sa chceli poďakovať pani Jolane Benčatovej.
Táto práca bola podporená projektom Centrum translačnej medicíny, spolufinancovaným zo zdrojov ES a Európskeho fondu regionálneho rozvoja.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
RNDr. Jozef Hatok, PhD.
Univerzita Komenského v Bratislave
Jesseniova lekárska fakulta v Martine
Ústav lekárskej biochémie
Malá Hora 4
036 01 Martin
Slovenská republika
e-mail: hatok@jfmed.uniba.sk
Obdrženo: 17. 1. 2011
Přijato: 21. 11. 2011
Sources
1. Redmond KM, Wilson TR, Johnston PG et al. Resistance mechanisms to cancer chemotherapy. Front Biosci 2008; 13 : 5138–5154.
2. Hatok J, Babusikova E, Matakova T et al. In vitro assays for the evaluation of drug resistance in tumor cells. Clin Exp Med 2009; 9(1): 1–7.
3. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65(1–2): 55–63.
4. Kaspers GJ, Pieters R, Van Zantwijk CH et al. In vitro drug sensitivity of normal peripheral blood lymphocytes and childhood leukaemic cells from bone marrow and peripheral blood. Br J Cancer 1991; 64(3): 469–474.
5. Stone RM, O’Donnell MR, Sekeres MA. Acute myeloid leukemia. Hematology Am Soc Hematol Educ Program 2004; 98–117.
6. Hajdúch M, Mihál V, Minarík J et al. Decreased in vitro chemosensitivity of tumour cells in patients suffering from malignant diseases with poor prognosis. Cytotechnology 1996; 19(3): 243–245.
7. Matáková T, Hatok J, Sivoňová M et al. Testovanie chemorezistencie nádorových buniek MTT testom u onkochirurgických pacientov s bronchogénnym karcinómom a nádormi gastrointestinálneho traktu. Medicina Militaris Slovaca 2008; 10(1): 15–19.
8. Benson AB. Gastrointestinal oncology. Kluwer Academic publisher 1999; 25–36.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 6-
All articles in this issue
- Plazminogen aktivátor systém a jeho klinický význam u pacientů s nádorovým onemocněním
- Castlemanova choroba
- Naše päťročné výsledky in vitro testovania chemorezistencie u onkologických pacientov
- Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek
- Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi
- Lékový registr – trabectedin
- Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
- Aktuálne charakteristiky deskriptívnej epidemiológie nádorov žalúdka v Slovenskej republike v kontexte medzinárodného porovnania
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- HER2 pozitivní T1N0M0 tumor: Čas pro změnu?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Castlemanova choroba
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- Lékový registr – trabectedin
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

