-
Medical journals
- Career
Adaptivní IG-IMRT karcinomu prostaty
Authors: J. Vaňásek 1; K. Odrážka 1,2,3; M. Doležel 1,3; I. Kolářová 1
Authors‘ workplace: Oddělení klinické a radiační onkologie, Multiscan s. r. o., Pardubická krajská nemocnice a. s., Pardubice 1; 1. a 3. lékařská fakulta, Univerzita Karlova v Praze 2; Katedra radiační onkologie IPVZ, Praha 3
Published in: Klin Onkol 2011; 24(5): 361-366
Category: Original Articles
Overview
Východiska:
Adaptivní obrazem navigovaná radioterapie s modulovanou intenzitou (IG-IMRT) je perspektivní metoda léčby lokalizovaného karcinomu prostaty. Je třeba vytvořit a validovat optimální protokoly pro IG-IMRT s využitím kilovoltážního CT kónickým svazkem (CBCT).Soubor pacientů a metody:
Adaptivní IG-IMRT bylo léčeno 76 pacientů s karcinomem prostaty. Na základě CBCT prováděného během prvních 10 frakcí radioterapie byla stanovena průměrná pozice prostaty vůči skeletu pánve ve třech osách: anteroposteriorní AP, kraniokaudální SI, laterolaterální RL. Adaptovaný ozařovací plán pro druhu fázi radioterapie zahrnoval posun izocentra do jeho průměrné pozice (korekce systematické chyby Σ). Podle velikosti náhodné chyby σ byl upraven lem mezi klinickým a plánovacím cílovým objemem (CTV-PTV). Ve druhé fázi radioterapie byli pacienti denně nastavováni na skelet pánve kilovoltážním skiagrafickým zobrazením ve dvou projekcích (kV-kV). Kontrolní CBCT bylo provedeno 1× týdně.Výsledky:
Průměrná pozice izocentra byla u 63 pacientů (83 %) alespoň v jedné ose odlišná od pozice izocentra na referenčním plánovacím CT. Největší změny byly zaznamenány v AP ose – posun ≥ 2 mm u 33 pacientů (43 %), posun ≥ 5 mm u 7 pacientů (9 %). PTV pro druhou fázi radioterapie byl v rozmezí 6–10 mm v AP ose, 6–8 mm v SI ose, respektive 6 mm v RL ose. Průměrná hodnota σ byla v AP ose menší u pacientů s dietním režimem oproti pacientům bez diety (2,2 vs 2,7 mm, p = 0,05). Vyhodnotili jsme 446 kontrolních CBCT obrazů z druhé fáze radioterapie (66 pacientů mělo 6 CBCT, 10 pacientů mělo 5 CBCT). Chyba nastavení přesahující lem CTV-PTV se objevila ve 4 případech, vždy maximálně jedenkrát u jednoho pacienta. Bezpečnostní lem byl dostatečný u 72/76 pacientů (95 %).Závěr:
Protokol IG-IMRT kombinující CBCT a kV-kV zobrazení zajišťuje adekvátní pokrytí cílového objemu a vyhovuje po stránce organizace provozu. Redukce lemu kolem CTV je předpokladem pro eskalaci dávky na intraprostatickou lézi.Klíčová slova:
karcinom prostaty – radioterapie – adaptivní – řízení obrazem – IMRTÚvod
Protinádorový účinek zevní radioterapie u lokalizovaného karcinomu prostaty závisí na výši aplikované dávky záření. Randomizované a retrospektivní studie prokázaly, že eskalace dávky pomocí 3D-CRT (trojrozměrná konformní radioterapie) a IMRT (radioterapie s modulovanou intenzitou) přináší vyšší kontrolu nádoru a přijatelnou toxicitu [1–3]. Přesné provedení frakcionované radioterapie je nezbytnou podmínkou efektu léčby. Opakovaná verifikace pozice pacienta před ozářením, kvantifikace chyby nastavení a korekce dle přijatého protokolu jsou základními prvky IGRT (radioterapie řízená obrazem) [4]. IGRT se v klinické praxi rozšířila především v posledních 5 letech, kdy jsou komerčně dostupné různé systémy verifikace nastavení. Při radioterapii karcinomu prostaty jsou nejčastěji využívány dvě metody – kilovoltážní skiagrafické zobrazení ve dvou projekcích (kV-kV) a kilovoltážní CT kónickým svazkem (CBCT). Nespornou výhodou CBCT je zobrazení měkkých tkání – prostaty, rekta a močového měchýře [5].
Adaptivní radioterapie je proces, při němž je ozařovací plán modifikován na základě zpětných informací – systematické monitorování variací v časné fázi léčby umožňuje optimalizovat ozařovací plán pro další fázi radioterapie [6]. Yan et al prokázali, že na základě portálového zobrazení v prvních dnech radioterapie lze predikovat chybu nastavení a vytvořit pro pacienta individuální PTV (plánovací cílový objem) a následně nový ozařovací plán [7,8]. Touto metodou bylo možné redukovat objem PTV v průměru o 24 %. Výzkum v Netherlands Cancer Institute ukázal, že s využitím adaptivní radioterapie lze omezit lem mezi CTV (klinický cílový objem) a PTV z 10 mm na 7 mm [9]. Při prvních 6 ozářeních bylo vždy zhotoveno CBCT a na základě těchto zobrazení byl vytvořen průměrný CTV a průměrný objem rekta. Následný plán tak částečně zohlednil systematickou chybu nastavení a umožnil redukci bezpečnostního lemu.
Naším cílem bylo vytvořit a validovat protokol pro adaptivní obrazem navigovanou radioterapii s modulovanou intenzitou (IG-IMRT). S ohledem na nádorovou lokalitu, vybavení pracoviště a organizaci provozu jsme zvolili kombinaci CBCT a kV-kV.
Soubor pacientů a metody
Charakteristika souboru
V období od listopadu 2008 do ledna 2010 bylo na Oddělení klinické a radiační onkologie, Multiscan a Pardubická krajská nemocnice, léčeno adaptivní IG-IMRT celkem 76 pacientů s karcinomem prostaty. Jednalo se o pacienty s lokalizovaným onemocněním, bez klinických či chirurgických známek postižení uzlin, bez klinických známek distančních metastáz – stadium T1-3 N0 (pN0) M0. Hormonální léčba byla podávána v souladu s doporučením National Cancer Institute a National Comprehensive Cancer Network. Všichni pacienti podepsali před léčbou informovaný souhlas.
Plánování radioterapie – IMRT
Pacienti byli plánováni a léčeni v poloze na zádech s vakuovou podložkou nebo podložkou pod kolena a nohy (Vac-Lok/Dual Leg Positioner Cushion, Civco) k imobilizaci dolních končetin a pánve. Všechny ozařovací plány byly vyhotoveny v 3D plánovacím systému s inverzním plánováním (Eclipse 8.0, Varian). Klinický cílový objem zahrnoval prostatu a bázi semenných váčků / celé semenné váčky při jejich postižení. Plánovací cílový objem (PTV) je specifikován v textu o adaptivní radioterapii. Rektum bylo konturováno v úrovni PTV plus 10 mm kraniálně i kaudálně; močový měchýř byl konturován celý. Používali jsme techniku pěti koplanárních polí (45°, 105°, 180°, 255°, 315°). Předepsaná dávka v izocentru byla 78 Gy během 8 týdnů, dávka na frakci 2 Gy, jedna frakce denně. Při kalkulaci a optimalizaci ozařovacího plánu jsme respektovali řadu dávkově-objemových parametrů pro PTV a rizikové orgány. Mezi parametry s nejvyšší prioritou patřily následující limity: PTV – minimálně 95 % objemu obdrží 95 % předepsané dávky; rektum – maximálně 25 % objemu obdrží dávku 70 Gy; močový měchýř – maximálně 30 % objemu obdrží dávku 70 Gy. Modulace fotonového svazku byla prováděna pomocí mnoholistového dynamického kolimátoru metodou sliding window. Ozařování probíhalo na lineárním urychlovači (Clinac 2100 C/D, Varian) při energii fotonů 18 MV.
Od června 2009 byli pacienti před léčbou instruováni, aby respektovali specifický dietní režim. Jeho cílem bylo omezení plynatosti střev, evakuace rekta před ozařováním a zajištění konstantní náplně močového měchýře. Dietní opatření začali pacienti dodržovat jeden týden před plánovacím CT a pokračovali kontinuálně v celém průběhu radioterapie.
Verifikace nastavení – IGRT
Ověření pozice pacienta a její korekce byly prováděny před každým ozářením (OBI 1.3, Varian). Kombinovali jsme dvě metody IGRT – kilovoltážní CT kónickým svazkem (CBCT) a kilovoltážní skiagrafické zobrazení ve dvou projekcích (kV-kV). CBCT bylo získáno při rotaci gantry o 360° nebo 180° a porovnáváno s referenčním plánovacím CT. Nejprve jsme provedli registraci skeletu pánve a zaznamenali chybu nastavení ve třech osách (anteroposteriorní AP, kraniokaudální SI, laterolaterální RL) – viz obr. 1a. Potom jsme dosáhli shody pozice prostaty a opět jsme zaznamenali chybu nastavení, která současně reprezentovala korekci polohy stolu před ozářením (obr. 1b). Ortogonální kV-kV obrazy byly snímány při pozici rentgenky 0° a 90°. V obou projekcích jsme provedli manuální registraci skeletu pánve s referenčními digitálně rekonstruovanými snímky z plánovacího CT. Chyba nastavení odpovídala následné korekci pozice stolu před ozářením.
Image 1. CBCT – registrace pozice skeletu pánve (a), registrace pozice prostaty (b). (a) vlevo aktuální CBCT, vpravo refrenční plánovací CT (b) vlevo aktuální CBCT, vpravo refrenční plánovací CT CBCT – kilovoltážní CT kónickým svazkem 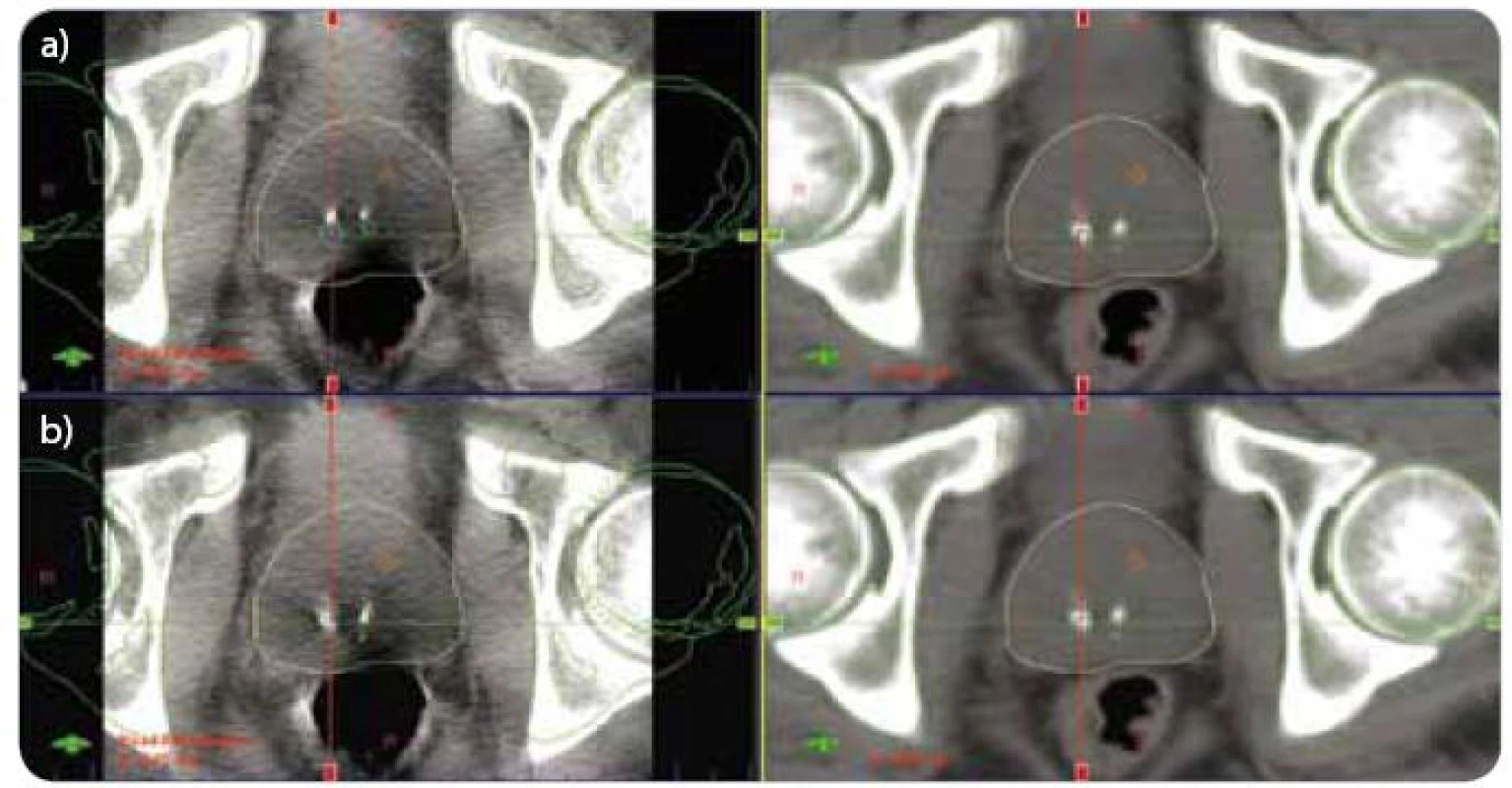
Adaptivní radioterapie
Každý pacient měl v rámci IG-IMRT dva ozařovací plány – zatímco plán pro první fázi léčby byl standardní, plán pro druhou fázi radioterapie byl individuálně upraven na základě dat získaných během prvních dvou týdnů léčby (obr. 2). Lem mezi CTV a PTV byl v první fázi terapie 8 mm, 6 mm a 6 mm v AP, SI, respektive RL ose. Jeho velikost byla stanovena na základě předchozí pilotní analýzy nepřesnosti nastavení na pracovišti (vyhodnotili jsme změny pozice prostaty vůči skeletu pánve na základě 225 CBCT u 20 pacientů; stanovili jsme průměrný posun izocentra/prostaty, systematickou a náhodnou komponentu chyby nastavení (tab. 1), vypočítali jsme teoretický lem potřebný k pokrytí CTV izodózou 95 % u minimálně 90 % nastavení [10]; vypočítaný lem jsme modifikovali s ohledem na další možné zdroje chyb nastavení a použitý způsob verifikace nastavení. Po dvou týdnech léčby jsme vyhodnotili 10 CBCT procedur, stanovili jsme průměrnou pozici izocentra vůči skeletu pánve (systematická chyba Σ) a distribuci měření kolem průměrné pozice (náhodná chyba σ).
Image 2. Algoritmus adaptivní IG-IMRT karcinomu prostaty. CBCT – kilovoltážní CT kónickým svazkem; kV-kV – kilovoltážní skiagrafické zobrazení ve dvou projekcích; W – týden; CTV – klinický cílový objem; PTV – plánovací cílový objem 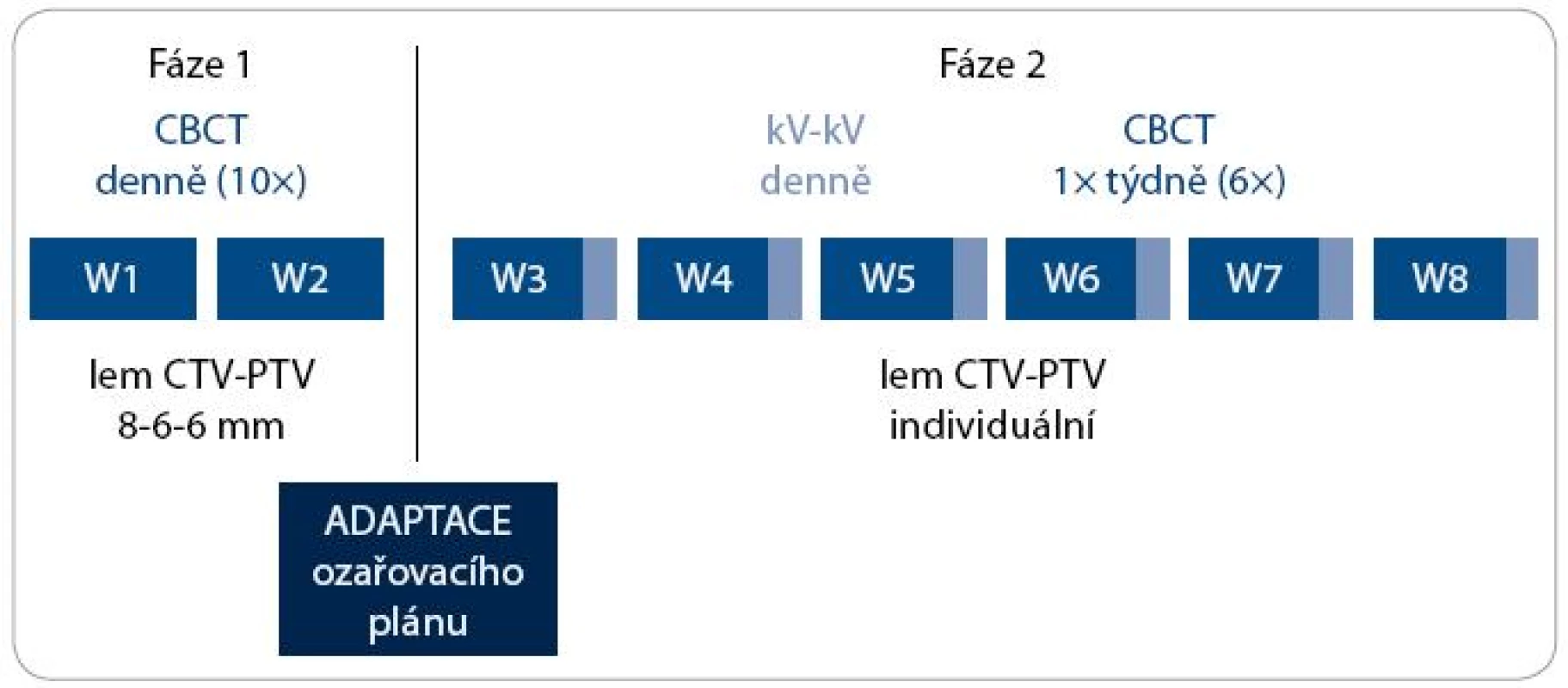
Table 1. Chyba nastavení prostata – skelet pánve. 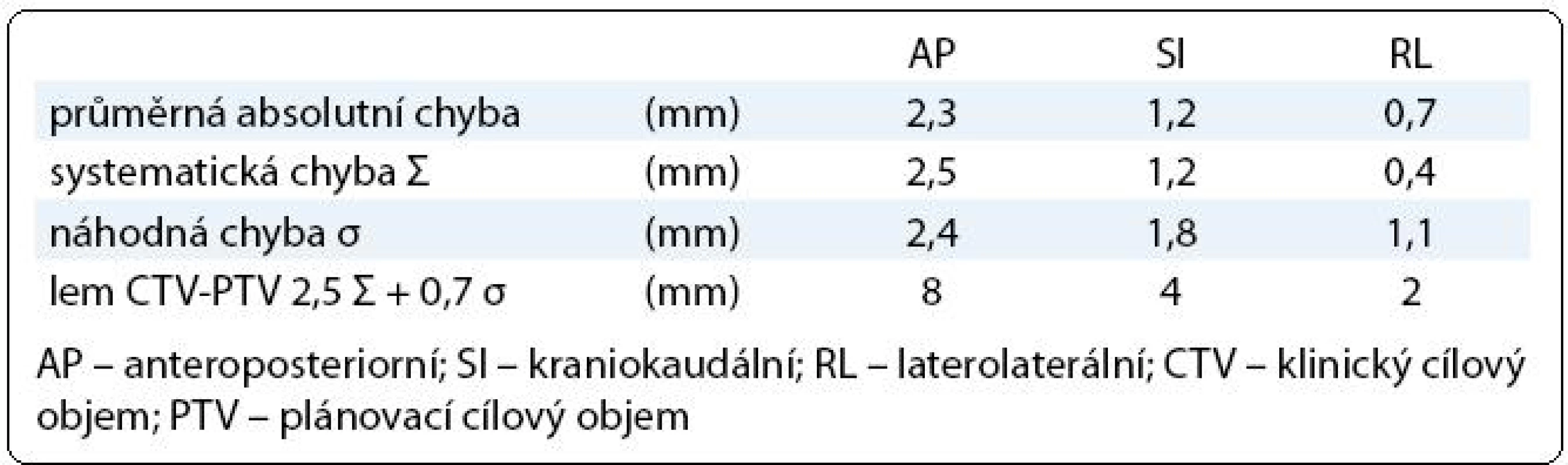
Úpravu ozařovacího plánu pro druhou fázi radioterapie jsme provedli ve dvou krocích:
- posun izocentra do jeho průměrné pozice – tak jsme z větší části eliminovali systematickou chybu,
- volba lemu CTV-PTV podle velikosti náhodné chyby (izotropní lem 6 mm při σ ≤ 2,5 mm; lem 8 mm v té ose, kde bylo σ > 2,5 mm, ale maximálně 5 mm; lem 10 mm v té ose, kde bylo σ > 5 mm).
Verifikace nastavení byla ve druhé fázi léčby prováděna denně kV-kV metodou – registrace skeletu pánve. Jednou týdně bylo zhotoveno kontrolní CBCT, tj. celkem 6 procedur mezi 3. a 8. týdnem ozařovací série.
Hodnocení nepřesnosti nastavení
Ve druhé fázi radioterapie jsme u všech 6 CBCT sledovali chyby nastavení. Zaznamenali jsme posun izocentra vůči skeletu pánve v AP, SI, respektive RL ose. Ověřovali jsme, zda naměřené hodnoty nepřekračují velikost individuálního lemu CTV-PTV v libovolné ose. Pokud by chyba nastavení byla větší než příslušný lem CTV-PTV minimálně při dvou kontrolních CBCT, následovala by intervence (revize velikosti lemu, změna metody verifikace nastavení).
Statistika
Interfrakční náhodná chyba nastavení (σ) ve dvou skupinách pacientů (pacienti s dietou versus pacienti bez diety) byla porovnávána v AP, SI, respektive RL ose dvouvýběrovým t-testem. Jestliže výběry nepocházely z normálního rozdělení hodnot, byl použit Mann-Whitneyův test.
Výsledky
V první fázi radioterapie jsme v celém souboru 76 pacientů vyhodnotili celkem 760 CBCT obrazů (10 zobrazení u každého pacienta). Průměrná pozice izocentra vypočítaná na základě 10 CBCT měření byla u 63 pacientů (83 %) alespoň v jedné ose odlišná od pozice izocentra na referenčním plánovacím CT (tab. 2). Nejčastěji byla jiná pozice prostaty zjištěna v AP ose – 51 pacientů (67 %), přičemž posun ≥ 2 mm, respektive ≥ 5 mm, byl prokázán u 33 (43 %), respektive 7 (9 %) pacientů. Změna pozice prostaty v SI ose ≥ 2 mm byla detekována u 9 pacientů (12 %) a změna ≥ 5 mm u jednoho pacienta (1 %). Lem CTV-PTV pro druhou fázi radioterapie vycházející z hodnot σ byl v rozmezí 6–10 mm v AP ose, 6–8 mm v SI ose, respektive 6 mm v RL ose (obr. 3). Průměrná hodnota σ z 10 CBCT měření byla ve všech třech osách menší u pacientů s dietním režimem oproti pacientům bez diety (tab. 3). Rozdíl dosáhl v AP ose hranice statistické významnosti.
Table 2. Posun izocentra vůči skeletu pánve. 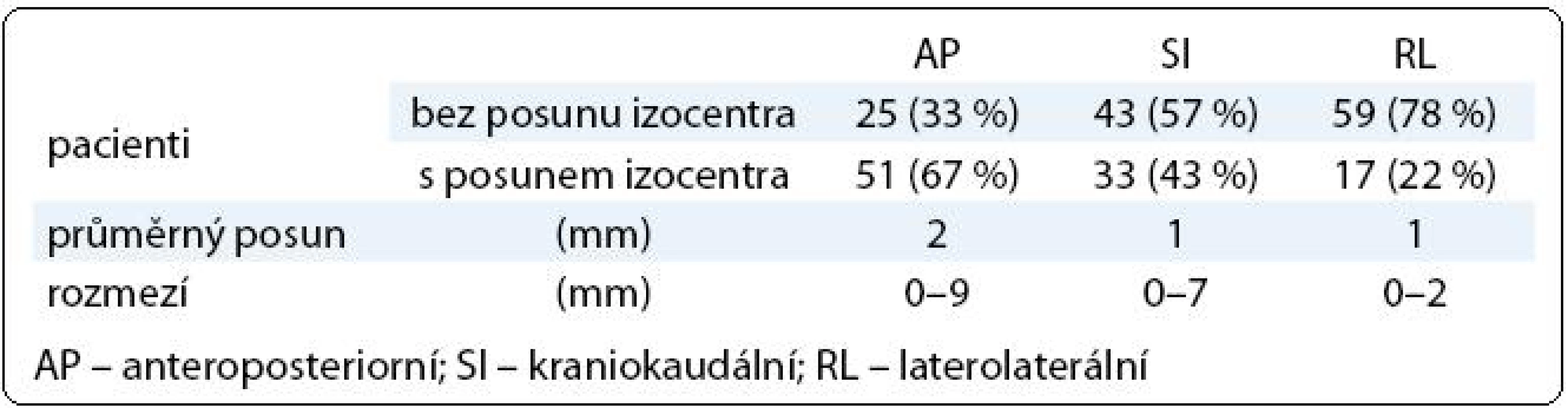
Image 3. Distribuce pacientů podle velikosti lemu CTV -PTV. CTV – klinický cílový objem; PTV – plánovací cílový objem; AP – anteroposteriorní; SI – kraniokaudální; RL – laterolaterální 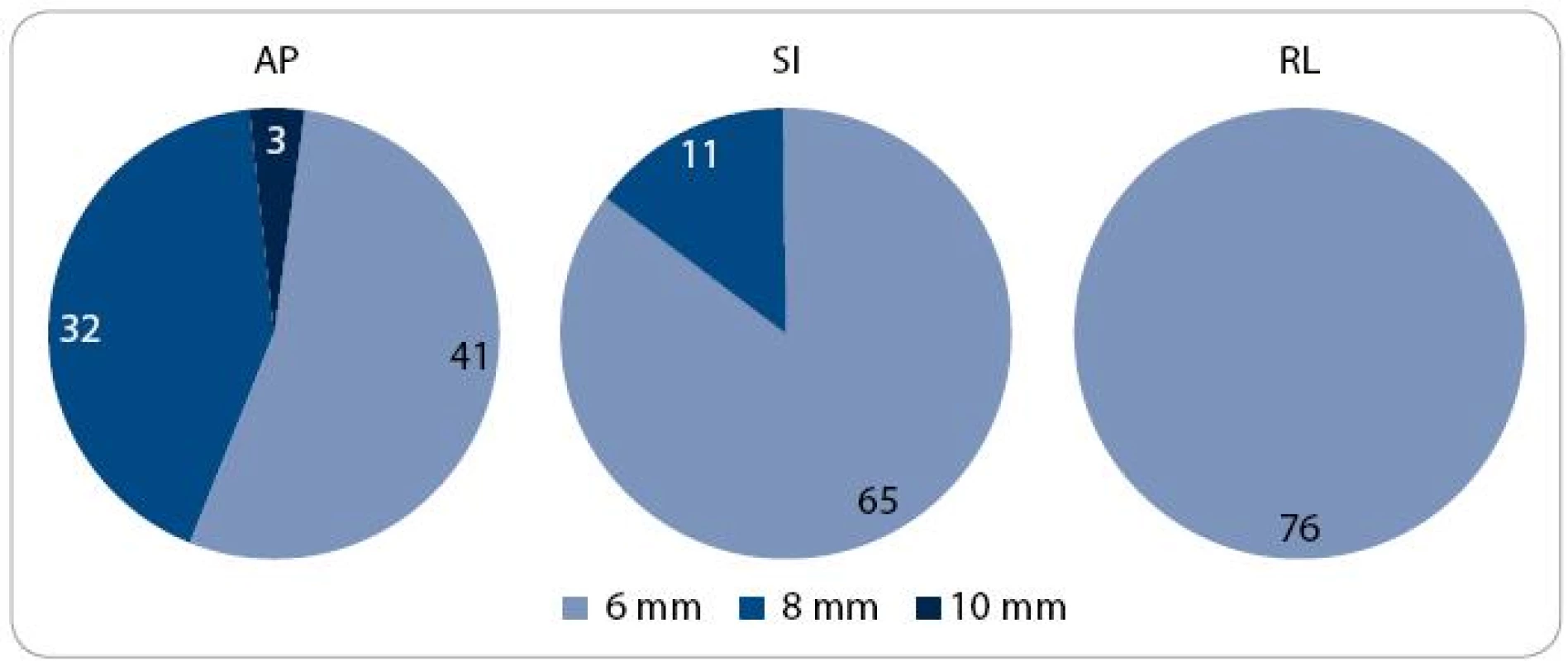
Table 3. Vliv diety na náhodnou chybu nastavení. 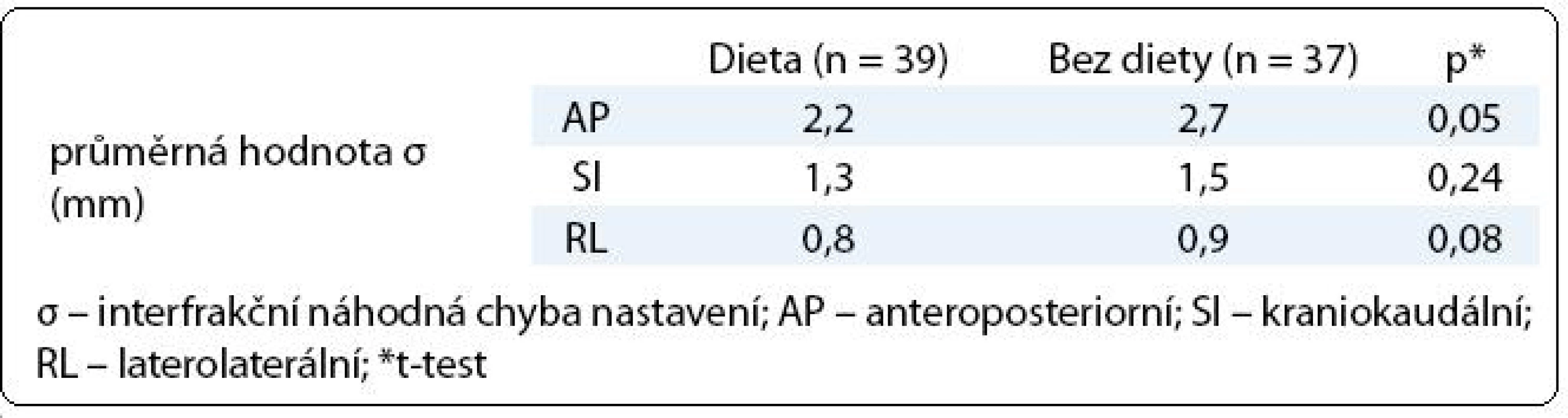
Ve druhé fázi radioterapie jsme v souboru 76 pacientů vyhodnotili celkem 446 kontrolních CBCT obrazů (66 pacientů mělo 6 CBCT, 10 pacientů mělo 5 CBCT). Chyba nastavení přesahující lem CTV-PTV se objevila celkem čtyřikrát, vždy maximálně jedenkrát u jednoho pacienta (tab. 4). Lem CTV-PTV byl dostatečný u 72/76 pacientů (95 %).
Table 4. Chyba nastavení ve vztahu k lemu CTV -PTV. 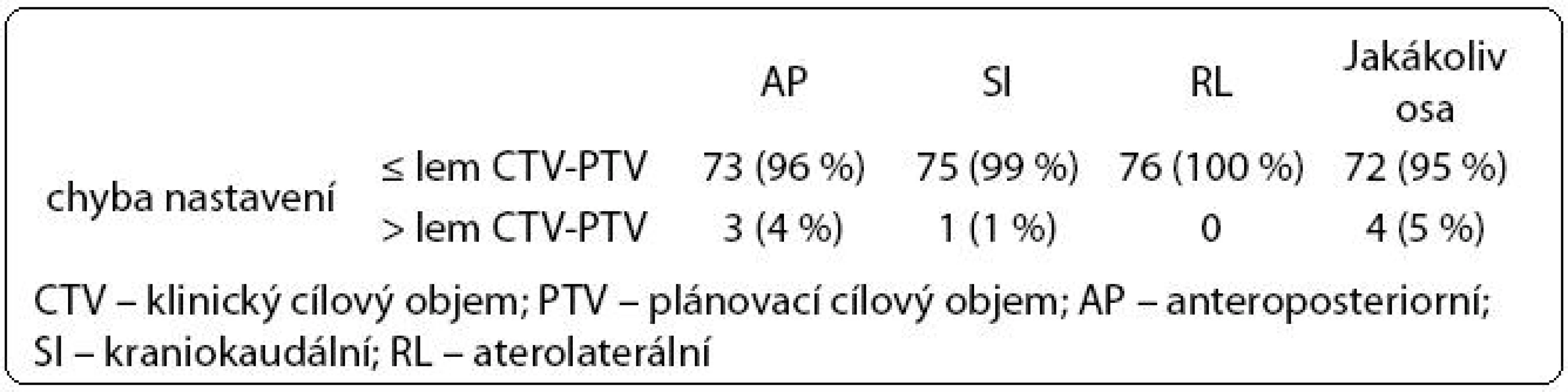
Diskuze
Verifikace pozice pacienta před ozářením pomocí zobrazení tělesných struktur má svoje počátky v 50. letech 20. století (mobilní či integrovaný rentgenový přístroj pro skiagrafii). Moderní IGRT přichází v 90. letech minulého století a je spojena s periodickým zobrazováním pomocí elektronického portálového zařízení EPID (electronic portal imaging device), vyhodnocením chyby nastavení a činností směřující ke korekci chyb [4,11]. V posledním desetiletí je v klinické praxi dostupná řada IGRT systémů – pro verifikaci pozice prostaty se nejčastěji používají EPID, ortogonální kV zobrazení, CBCT a lokalizace ultrazvukem. EPID a kV-kV zobrazí skelet a intraprostatické markery, nikoliv měkké tkáně. Naproti tomu CBCT a UZ poskytují obraz prostaty a rizikových orgánů.
Chyba nastavení mezi prostatou a kožními značkami může vyžadovat bezpečnostní lem přesahující 10 mm. Tanyi et al sledovali denně a během ozáření kontinuálně pozici prostaty pomocí mikročipů [12]. Lem potřebný k pokrytí chyby nastavení při použití kožních značek byl v AP, SI a RL ose 16,3 mm, 11,4 mm, respektive 7,5 mm; při registraci na skelet pánve klesly hodnoty na 10,5 mm (AP), 9,4 mm (SI), respektive 2,1 mm (RL). Lem potřebný k pokrytí chyby nastavení prostaty při registraci na skelet byl zkoumán rovněž na Mayo Clinic u 20 pacientů pomocí EPID a intraprostatických markerů [13]. Autoři uvádějí následující hodnoty: 7,3 mm v AP ose, 5,1 mm v SI ose a 5,0 mm v RL ose. Sami jsme analýzou 225 CBCT u 20 pacientů zjistili, že lem mezi CTV a PTV při registraci na kožní značky musí být 12 mm (AP), 9 mm (SI) a 12 mm (RL), aby izodóza 95 % pokryla minimálně 90 % nastavení. Při nastavení na skelet pánve jsme dospěli k hodnotám lemu CTV-PTV v AP, SI a RL ose 8 mm, 4 mm, respektive 2 mm (nepublikované údaje). Nastavení na skelet pánve je přesnější než nastavení na kůži, přesto je pohyb prostaty vůči skeletu významný. Podílí se na něm měnící se náplň rekta a močového měchýře, tonus svalstva pánve a dýchání. Pohyb prostaty nejvíce ovlivňuje objem rekta – naplněné rektum vytlačuje prostatu ventrálně a kraniálně. Posun prostaty je nejmenší v oblasti apexu a zvětšuje se směrem k bázi a semenným váčkům.
Měření systematické a náhodné chyby nastavení a výpočet lemu CTV-PTV v populaci pacientů má spolehlivé výstupy [10]. Určení optimálního individuálního lemu pro konkrétního pacienta je problematické. V souboru našich pacientů jsme posunem izocentra do jeho průměrné pozice z 10 CBCT měření částečně eliminovali systematickou chybu. Podobný postup použili Nijkamp et al v Amsterodamu, kteří místo posunu izocentra vytvořili na základě 6 CBCT průměrné kontury CTV a rekta [9]. Reziduální systematická chyba závisí na počtu CBCT měření, celkovém počtu frakcí a náhodné chybě; v podmínkách našeho protokolu je její velikost přibližně ≤ 1 mm [14]. Při stanovení lemu pro druhou fázi léčby jsme vycházeli z hodnoty 1,5–2× náhodná chyba σ a zohlednili jsme reziduální systematickou chybu a nepřesnost registrace prostaty při CBCT [15,16]. Jako minimální lem CTV-PTV jsme zvolili hodnotu 6 mm. Taková velikost lemu odpovídá výsledkům výzkumu, který provedli Polat et al ve Würzburgu [17]. Ve skupině 21 pacientů bylo CBCT provedeno před ozářením a bezprostředně po jeho skončení. Intrafrakční posun prostaty přesahující 5 mm byl zjištěn u 12 % frakcí, přičemž pohyb prostaty byl nezávislý na pohybu skeletu. Autoři vypočítali, že ke kompenzaci intrafrakční chyby je potřebný lem 6 mm.
Vzhledem k nejistotě při určení správného lemu CTV-PTV má zásadní význam ověření vlastních dat. Validace našeho protokolu (446 kontrolních CBCT u 76 pacientů) prokázala, že aktuální posun prostaty nepřesahoval lem v adaptovaném plánu u 442/446 měření (99 %). Adekvátního pokrytí CTV jsme dosáhli u 72/76 pacientů (95 %). Nijkamp et al v protokolu adaptivní radioterapie zaznamenali, že při 137/143 (96 %) kontrolních CBCT byl CTV vzat do PTV. Tomu odpovídalo adekvátní pokrytí cílového objemu u 15/20 pacientů (75 %) [9].
Analýza ozařovacích plánů u 127 pacientů léčených 3D-CRT v M. D. Anderson Cancer Center ukázala, že distenze rekta na plánovacím CT zvyšuje riziko biochemického relapsu [18]. Ke shodnému závěru dospěli rovněž onkologové v Bruselu [19]. Je evidentní, že distenze rekta je tak spojena s vyšším rizikem poddávkování cílového objemu. Zavedení dietního protokolu u našich pacientů mělo pozitivní vliv na náhodnou chybu nastavení především v AP ose (dieta σ 2,2 mm vs bez diety σ 2,7 mm, p = 0,05). Podobné rozdíly zaznamenali Smitsmans et al při analýze CBCT u 49 pacientů s karcinomem prostaty [20]. Náhodná chyba v AP ose 4,0 mm (pacienti bez diety) se snížila na 2,6 mm (pacienti s dietou).
Závěr
IG-IMRT protokol využívající CBCT a kV-kV zobrazení zajišťuje adekvátní pokrytí cílového objemu a vyhovuje po stránce organizace provozu. Redukce bezpečnostního lemu nám umožňuje respektovat striktní kritéria pro dávku v rizikových orgánech a eskalovat dávku záření na prostatu, případně na intraprostatickou lézi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
doc. MUDr. Jaroslav Vaňásek, CSc.
Oddělení radiační a klinické onkologie
Multiscan & Pardubická krajská nemocnice
Kyjevská 44
532 03 Pardubice
e-mail: vanasek@multiscan.cz
Obdrženo: 16. 2. 2011
Přijato: 15. 3. 2011
Sources
1. Dearnaley DP, Sydes MR, Graham JD et al. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8(6): 475–487.
2. Kuban DA, Tucker SL, Dong L et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(1): 67–74.
3. Dolezel M, Odrazka K, Vaculikova M et al. Dose escalation in prostate radiotherapy up to 82 Gy using simultaneous integrated boost: direct comparison of acute and late toxicity with 3D-CRT 74 Gy and IMRT 78 Gy. Strahlenther Onkol 2010; 186(4): 197–202.
4. Verellen D, De Ridder M, Storme G. A (short) history of image-guided radiotherapy. Radiother Oncol 2008; 86(1): 4–13.
5. Xing L, Thorndyke B, Schreibmann E et al. Overview of image-guided radiation therapy. Med Dosim 2006; 31(2): 91–112.
6. Ghilezan M, Yan D, Martinez A. Adaptive radiation therapy for prostate cancer. Semin Radiat Oncol 2010; 20(2): 130–137.
7. Yan D, Vicini F, Wong J et al. Adaptive radiation therapy. Phys Med Biol 1997; 42(1): 123–132.
8. Martinez A, Yan D, Lockman D et al. Improvement in dose escalation using the process of adaptive radiotherapy combined with three-dimensional conformal or intensity-modulated beams for prostate cancer. Int J Radiat Oncol Biol Phys 2001; 50(5): 1226–1234.
9. Nijkamp J, Pos FJ, Nuver TT et al. Adaptive radiotherapy for prostate cancer using kilovoltage cone-beam computed tomography: first clinical results. Int J Radiat Oncol Biol Phys 2008; 70(1): 75–82.
10. Van Herk M, Remeijer P, Rasch C et al. The probability of correct target dosage: dose-population histograms for deriving treatment margins in radiotherapy. Int J Radiat Oncol Biol Phys 2000; 47(4): 1121–1135.
11. Odrážka K, Vaculíková M, Petera J et al. Nepřesnost nastavení během konformní radioterapie karcinomu prostaty. Radiační onkologie 2011; 1 : 11–19.
12. Tanyi JA, He T, Summers PA et al. Assessment of planning target volume margins for intensity-modulated radiotherapy of the prostate gland: role of daily inter - and intrafraction motion. Int J Radiat Oncol Biol Phys 2010; 78(5): 1579–1585.
13. Schallenkamp JM, Herman MG, Kruse JJ et al. Prostate position relative to pelvic bony anatomy based on intraprostatic gold markers and electronic portal imaging. Int J Radiat Oncol Biol Phys 2005; 63(3): 800–811.
14. Bortfeld T, van Herk M, Jiang SB. When should systematic patient positioning errors in radiotherapy be corrected. Phys Med Biol 2002; 47(23): N297–N302.
15. Litzenberg DW, Balter JM, Lam KL et al. Retrospective analysis of prostate cancer patients with implanted gold markers using off-line and adaptive therapy protocols. Int J Radiat Oncol Biol Phys 2005; 63(1): 123–133.
16. White EA, Brock KK, Jaffray DA et al. Inter-observer variability of prostate delineation on cone beam computerized tomography images. Clin Oncol 2009; 21(1): 32–38.
17. Polat B, Guenther I, Wilbert J et al. Intra-fractional uncertainties in image-guided intensity-modulated radiotherapy (IMRT) of prostate cancer. Strahlenther Onkol 2008; 184 : 668–673.
18. de Crevoisier R, Tucker SL, Dong L et al. Increased risk of biochemical and local failure in patients with distended rectum on the planning CT for prostate cancer radiotherapy. Int J Radiat Oncol Biol Phys 2005; 62(4): 965–973.
19. Engels B, Soete G, Verellen D et al. Conformal arc radiotherapy for prostate cancer: increased biochemical failure in patients with distended rectum on the planning computed tomogram despite image guidance by implanted markers. Int J Radiat Oncol Biol Phys 2008; 74(2): 388–391.
20. Smitsmans MH, Pos FJ, de Bois J et al. The influence of a dietary protocol on cone beam CT-guided radiotherapy for prostate cancer patients. Int J Radiat Oncol Biol Phys 2008; 71(4): 1279–1286.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 5-
All articles in this issue
- Hsp90 – cíl protinádorové terapie
- Předoperační chemoradioterapie v kombinaci s bevacizumabem u karcinomu konečníku
- Co pacientky potřebují vědět před operací mamárního karcinomu
- Neuroendoskopická biopsie tumoru mozku
- Adaptivní IG-IMRT karcinomu prostaty
- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Výsledky terapie metastatického renálního karcinomu lékem everolimus – analýza údajů z klinického registru RENIS
- Cetuximab zvyšuje antiproliferativní účinek trastuzumabu u buněk karcinomu prsu s nadměrnou expresí ERBB2 – předběžná studie
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Neuroendoskopická biopsie tumoru mozku
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Co pacientky potřebují vědět před operací mamárního karcinomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

