-
Medical journals
- Career
Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
: A. Molnárová; L. Bezák
: Odd. brachyterapie, Klinika radiačnej onkológie, Onkologický ústav sv. Alžbety, s. r. o., Bratislava, Slovenská republika
: Klin Onkol 2010; 23(6): 433-438
: Original Articles
Východiska:
Pooperačná akcelerovaná parciálna intersticiálna brachyterapia ako monoterapia včasného štádia karcinómu prsníka je limitovaná pre pacientky s nízkym rizikom lokálnej recidívy.Materiál a metódy:
V rokoch 2004 – 2008 bolo v našom ústave týmto spôsobom liečených 53 pacientok. Akceptované boli pacientky po kvadrantektómii/ extirpácii tumoru veľkosti T1 N0 M0, histologicky nonlobulárny karcinóm, negatívne histologické okraje, G1 – 2. Všetky pacientky absolvovali HDR 192Ir multikatétrovú intersticiálnu brachyterapiu. PTV bol definovaný ako pooperačná kavita + 2cm okraj. Dávka na frakciu bola 4 Gy dvakrát denne v 6 - hodinovom intervale, 4 – 5 dní do celkovej dávky 32 Gy. Doba sledovania bola 2 – 50 mesiacov. Lokálna kontrola v sledovanom období bola 100 %.Výsledky:
Nevyskytla sa ani jedna lokálna recidíva. Celkové prežívanie bolo 96 %. Jedna pacientka zomrela na generalizáciu malígneho melanómu a jedna na generalizáciu základného ochorenia. Kozmetický efekt bol dobrý až výborný u všetkých pacientok.Záver:
Krátka doba sledovania našich pacientok nám ešte nedovoľuje dlhodobé vyhodnotenie lokálnych recidív a celkového prežívania. Avšak výborný kozmetický efekt a nízka perioperačná morbidita ako aj minimálne akútne a neskoré sprievodné reakcie poukazujú na nové smerovanie pooperačnej rádioterapie u selektovaných pacientok.Klúčové slová:
karcinóm prsníka – brachyterapia – rádioterapiaPrsník zachovávajúca liečba u včasných štádií karcinómu prsníka – kvadrantektómia s následnou externou rádioterapiou na celý prsník – je preverená časom a s malými zmenami sa používa viac ako 40 rokov s dobrými výsledkami. Rovnaké prežívanie u mastektomovaných pacientok a pacientok po prsník zachovávajúcej operácii s adjuvantnou rádioterapiou s systémovou terapiou alebo bez nej umožnilo štandardné zaradenie menej agresívnej liečby u včasných štádií karcinómu prsníka [1,2].
Štandardným terapeutickým postupom u I. a II. klinického štádia ochorenia je limitovaný chirurgický zákrok a následne rádioterapia na celý prsník, s systémovou liečbou alebo bez nej.
Rádioterapia spočíva v ožiarení celého prsníka externou rádioterapiou tumoróznou dávkou 46 – 50 Gy v 25 frakciách, čo predstavuje ožarovanie každý pracovný deň po dobu 5 týždňov s následnou dosycovacou dávkou – boostom – formou jedného priameho poľa alebo formou intersticiálnej brachyterapie. Celková doba liečby je 6 – 9 týždňov.
Rozvoj nových technológií umožňuje stanoviť cieľový objem rádioterapie s vysokou presnosťou, čím klesá radiačná toxicita.
Novou koncepciou liečby včasných štádií karcinómu prsníka je u selektovaných pacientok pooperačná akcelerovaná parciálna brachyterapia ako sólo terapeutický postup [3].
Význam rádioterapie spočíva v eliminácii subklinických tumorov v zachovanom prsníku po konzervatívnom chirurgickom výkone. 81 – 100 % lokálnych recidív vzniká v oblasti lôžka po operácii tumoru. To znamená, že ožiarenie celého prsníka vplýva na relaps ochorenia len obmedzene [4].
Pre pacientky s predpokladaným nízkym rizikom lokálnej recidívy sa otvára možnosť ožiarenia len lôžka po operácii tumoru s bezpečnostným lemom [5].
Je tu niekoľko technických možností. Využitie externej rádioterapie 3D CRT, IMRT techník alebo intraoperačnej rádioterapie urýchlenými elektrónami alebo intersticiálnej brachyterapie [6,7].
Výhody akcelerovanej intersticiálnej brachyterapie spočívajú vo významnom skrátení celkového času ožarovania zo 6 – 9 týždňov na jeden týždeň, pri nízkej perioperačnej morbidite, 5 - ročnej lokálnej kontrole porovnateľnej s externou rádioterapiou + boost dávkou a výborným kozmetickým efektom [8 – 10].
V tab. 1 je porovnanie incidencie relapsu ochorenia v niektorých štúdiách bez adjuvantnej rádioterapie, pri externej pooperačnej rádioterapii a pooperačnej akcelerovanej parciálnej intersticiálnej brachyterapii. Rozsah relapsov pre jednotlivé modality je 1,5 – 3,6 %, 0 – 3,8 % a 0 – 2,4 %, čo sú prakticky rovnaké hodnoty.
1. Incidencia relapsu po RT. 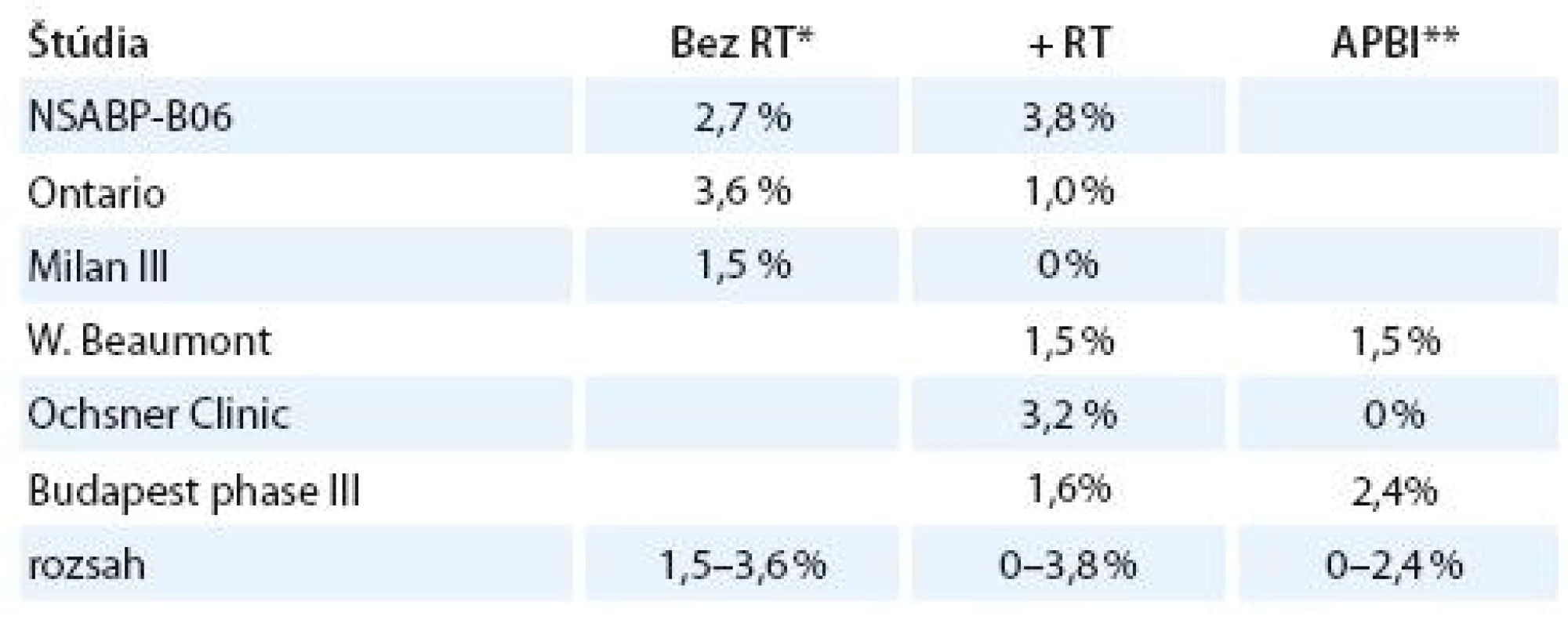
*RT – externá rádioterapia; **APBI (accelerated partial breast irradiation) – akcelerovaná parciálna intersticiálna brachyterapia Štúdia Patela et al z roku 2008, ktorá porovnávala 5 - ročnú lokálnu kontrolu, procentá lokálnych recidív a celkové 5-ročné prežívanie medzi vysokorizikovou skupinou a skupinou pacientok s nízkym rizikom recidívy, nepreukázala signifikantný rozdiel v uvedených parametroch (tab. 2) [11].
2. Porovnanie parciálnej akcelerovanej intersticiálnej brachyterapie u pacientok s vysokým a nízkym rizikom recidívy základného ochorenia [11]. ![Porovnanie parciálnej akcelerovanej intersticiálnej brachyterapie u pacientok s vysokým a nízkym rizikom recidívy základného ochorenia [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/373a084de4f7cb79d08c3388407d53da.jpeg)
medzi oboma skupinami nie je signifi kantný rozdiel V štúdii Polgára et al z roka 2004 (tab. 3) sú porovnané sedemročné výsledky lokálneho relapsu, bezrelapsového prežívania, kozmetického efektu a prítomnosť asymptomatickej tukovej nekrózy medzi terapeutickými modalitami – sólo brachyterapia, sólo externá rádioterapia a externá rádioterapia + boost. U týchto liečebných metód nie je v jednotlivých sledovaných parametroch signifikantný rozdiel [12].
3. Porovnanie liečebných modalít: parciálna akcelerovaná intersiciálna brachyterapia vs externá rádioterapia vs externá rádioterapia + dosycovacia dávka (boost) [12]. ![Porovnanie liečebných modalít: parciálna akcelerovaná intersiciálna brachyterapia vs externá rádioterapia vs externá rádioterapia + dosycovacia dávka (boost) [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a38cc79a3b21e7419868b754db126d4f.jpeg)
Parciálna akcelerovaná intersticiálna brachyterapia môže byť realizovaná v čase operácie, keď sa v priebehu operačného výkonu zavádzajú aplikátory. Výhodou je presná vizuálna lokalizácia cieľového objemu ako aj to, že pacientka absolvuje len jednu anestézu. Nevýhodou je, že nie je známa definitívna histológia aj s prognostickými faktormi. V prípade, že sa následne ukáže, že pacientka nie je vhodná na tento typ terapie, absolvuje dosycovaciu dávku (boost) a pokračuje externou rádioterapiou [13,14].
Pooperačná parciálna akcelerovaná intersticiálna brachyterapia sa zahajuje po zhojení operačnej jazvy, maximálne do dvanástich týždňov po operácii a jej výhodou je známa definitívna histológia aj s prognostickými faktormi.
Nevýhodou je potreba krátkodobej celkovej anestézy. Veľmi starostlivo musí byť lokalizovaný cieľový objem. Na tento účel sa využívajú všetky dostupné informácie o rozsahu a lokalizácii tumoru – predoperačná mamografia, MR, ak bola robená, operačný nález, pooperačná sonografia alebo/ a CT a zlatým štandardom sú chirurgické klipy umiestnené v pooperačnom lôžku [15,16].
Podľa štúdie Johanssona et al z roku 2003 na Aldersonovom fantóme je významne rozdielne radiačné zaťaženie vzdialených ako aj priľahlých orgánov v ožarovanom objeme. Pri ožarovaní ľavého prsníka parciálnou akcelerovanou intersticiálnou brachyterapiou aj externou rádioterapiou sú kostná dreň aj vzdialené orgány zaťažené 1,0 – 1,4 % predpísanej dávky. Avšak vo vzdialenosti 50 mm od cieľového objemu (ľavé pľúca, srdce) pri ožarovaní brachyterapiou dochádza až k 90% redukcii dávky oproti ožiareniu externou rádioterapiou [17].
Plánovaný ožarovaný objem (PTV) je tvorený pooperačnou kavitou + 2–3cm lemom [18].
Stanovujeme ho z predoperačnej MMG, USG, operačného nálezu, jazvy a chirurgických klipov, pooperačnej sonografie, prípadne pooperačného CT.
Indikácia parciálnej akcelerovanej intersticiálnej brachyterapie
NSABP B 39/ RTOG 0413
- tumor T1, T2 do veľkosti 30 mm
- histológia nie lobulárny karcinóm
- N0 (max. 3 pozit. LU bez známok perikapsulárneho šírenia)
- jedno ložisko
- negatívne resekčné kraje
- neprítomnosť EIC
- pozit. Er, Pr
- grading 1, 2
- vek nad 40 rokov [19 – 21]
Kontraindikácie parciálnej akcelerovanej intersticiálnej brachyterapie
NSABP B 39/ RTOG 0413
- invazívny lobulárny karcinóm
- EIC +
- G3
- bilaterálny karcinóm
- štádium III a IV
- pozitívne histologické okraje
- gravidita a kojenie
- psychiatrické ochorenie
- technicky nemožná aplikácia
- karcinóm prsníka v anamnéze
- iná malignita v anamnéze
Technicky je možné použiť aplikátor MammoSite alebo multikatétrovú intersticiálnu aplikáciu.
MammoSite
Implantácia balónikového aplikátora sa robí v priebehu operačného výkonu, alebo po zhojení operačnej jazvy v krátkodobej celkovej anestéze. Kavita, ktorá ostala po operácii, musí mať väčší priemer ako 30 mm. Vzdialenosť povrchu balónika od kože musí byť rovná alebo väčšia ako 7 mm. Dávka sa počíta na vzdialenosť 10 mm od povrchu balónika. Celková dávka je 34 Gy, jednotlivá dávka 3,4 Gy/ frakciu 2krát denne v 6 - hodinovom intervale [22]. Výskyt akútnych, aj neskorých postradiačných reakcií je vyšší ako pri multikatétrovej intersticiálnej brachyterapii, čo znázorňuje tab. 4 [23–25].
4. Akútne a neskoré sprievodné reakcie pri ožarovaní aplikátorom MammoSite [23–25]. ![Akútne a neskoré sprievodné reakcie pri ožarovaní aplikátorom MammoSite [23–25].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fcd910bad9ee52091b0b5d7cd7ea9e55.jpeg)
Multikatétrová intersticiálna brachyterapia
Multikatétrová intersticiálna brachyterapia sa najčastejšie realizuje po zhojení operačnej jazvy. Interval medzi operáciou a rádioterapiou by nemal byť dlhší než 12 týždňov. Optimálny interval doteraz nebol definovaný [4].
Aplikátory sa zavádzajú v krátkodobej celkovej anestéze pomocou štandardizovaných šablón (templates). Možno použiť ak kovové ihly, tak aj plastikové katétre formou dvoj až trojrovinnej aplikácie, najčastejšie v počte 7 – 15 aplikátorov.
Jednotlivá dávka na frakciu je 4 Gy/ 2 frakcie denne a 6 hod/ 4 – 5 dní v týždni. Tumoróznu dávku možno počítať geometricky na 85% izodózu alebo pri výpočte dávky prostredníctvom CT na 95 – 100% izodózu zakresleného PTV (anatomický objem) [18,26].
Akútne sprievodné reakcie sú znázornené v tab. 5.
5. Akútne a neskoré sprievodné reakcie po multikatétrovej intersticiálnej brachyterapii [15,27-29]. ![Akútne a neskoré sprievodné reakcie po multikatétrovej intersticiálnej brachyterapii [15,27-29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8e035f6902e14b35862e7687c07554a6.jpeg)
V rokoch 2004 – 2008 sme parciálnou akcelerovanou multikatétrovou intersticiálnou brachyterapiou ožiarili 53 selektovaných pacientok. Priemerný vek bol 61 rokov (38 – 76 rokov).
Histológia: adenokarcinóm G1, G2 a 1krát lobulárny karcinóm. Priemerná veľkosť tumoru 8 mm (1 – 22 mm). Ani jedna pacientka nemala pozitívne lymfatické uzliny, ani jedna pacientka nemala pozitívny histologický okraj resekátu.
Sledované prognostické faktory: hormonálne receptory Er, Pr, C erbB 2, p53, E cadherin, Ki67, HER 2. U všetkých pacientok vyzneli ako priaznivý prognostický znak s nízkym metastatickým potenciálom.
Tumor bol najčastejšie lokalizovaný v pravom prsníku (30 pacientok) a hornom laterálnom kvadrante (32 pacientok). Hormonálnu terapiu podstúpilo 32 pacientok a chemoterapiu 6 pacientok.
Neštandardnou indikáciou bol u dvoch pacientok veľký prsník a u troch pacientok druhý prsník, keď prvý bol v minulosti ožiarený externou rádioterapiou (z dôvodu kríženia ožarovaných polí).
Technika
Po starostlivom stanovení cieľového objemu (predoperačná MMG, USG, operačný nález, pooperačné CT s lokalizáciou klipov) – operačná kavita + jazva + 2cm lem sme v krátkodobej celkovej anestéze pomocou šablón zaviedli kovové ihly (7 – 15) v dvoch, častejšie troch rovinách (obr. 1). Výpočet dávky do roka 2008 sme robili podľa Parížskeho dozimetrického systému na plánovacom systému PLATO, keď dávkové body boli v strede rovnostranných trojuholníkov a tumorózna dávka sa počítala na 85% izodózu (obr. 2). Od začiatku roka 2008 sme prešli na výpočet z CT (objem podľa anatómie) (obr. 3).
1. Trojrovinná intersticiálna brachyterapia pätnástimi kovovými ihlami. 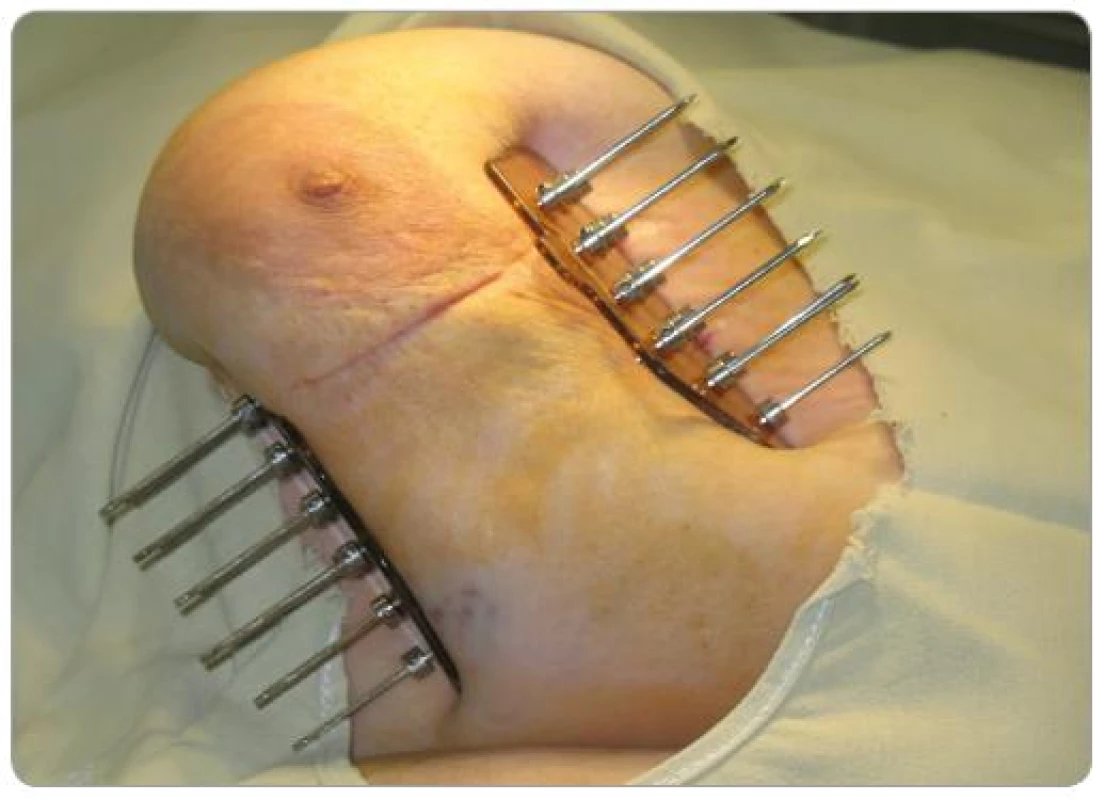
2. Priestorové znázornenie ožarovaného objemu. 
3. Izodózový plán pri plánovaní z CT. 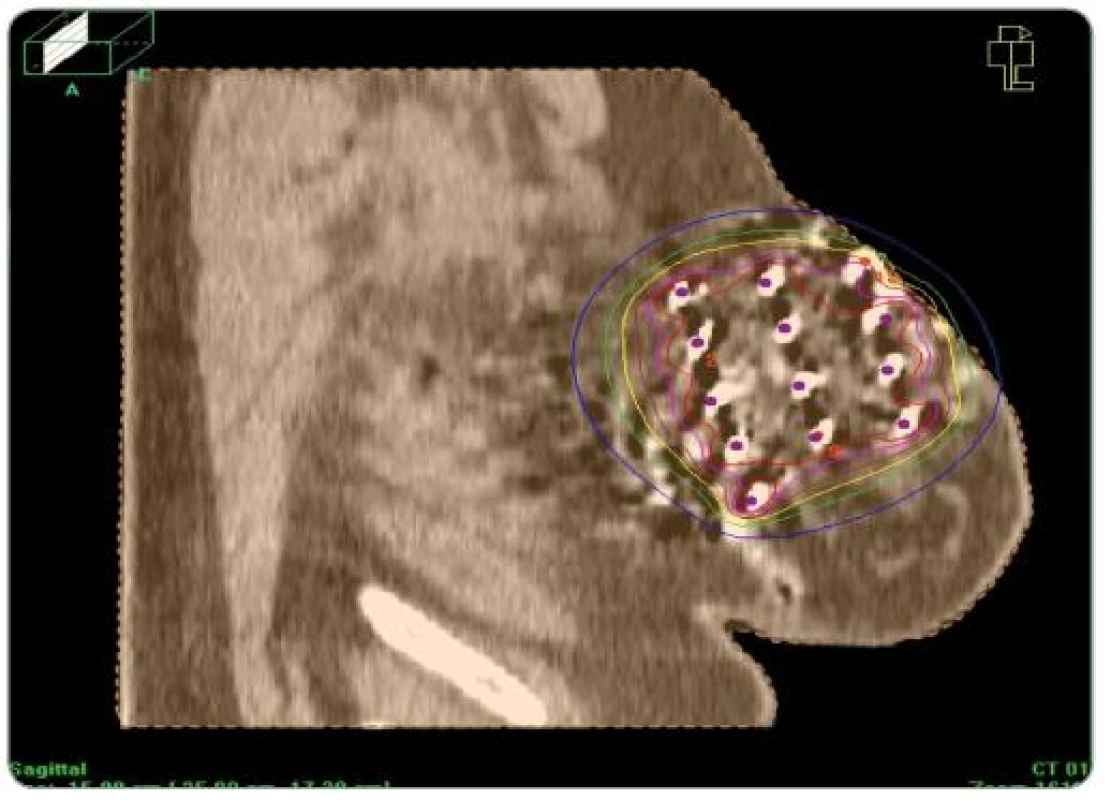
Zdroj žiarenia: 192Ir, microSelectron (Nucletron). Jednotlivá dávka 4,0 Gy 2krát denne s 6 - hodinovým intervalom, do celkovej dávky 32 Gy.
Sprievodné reakcie
akútne:
- hematóm 43 pacientok
- infekcia 3 pacientky
neskoré:
- bolesť v prsníku 2 pacientky
- tuková nekróza 1 pacientka
- olejová cysta 1 pacientka
Podobne ako je udávané v literatúre, najčastejšou akútnou sprievodnou reakciou bol rôzne vyznačený hematóm. Ostatné sprievodné reakcie sa vyskytli len zriedkavo.
U piatich pacientok sa v sledovanom období vyskytlo druhé malígne ochorenie:
- melanoma malignum v capilitiu 1 pacientka
- carcinoma corporis uteri 2 pacientky
- carcinoma vaginae in situ 1 pacientka
- struma maligna 1 pacientka
Za sledované obdobie (2 – 50 mesiacov) sme u všetkých pacientok hodnotili kozmetický efekt ako dobrý až výborný, pričom vo výraznej miere závisel predovšetkým od chirurgického zákroku.
Ani u jednej pacientky nebola diagnostikovaná lokálna recidíva, avšak u dvoch pacientok po 24 mesiacoch vznikol karcinóm v kontralaterálnom prsníku.
Celkové prežívanie bolo 96 %. Jedna pacientka zomrela na generalizáciu základného ochorenia a jedna pacientka zomrela na generalizáciu malígneho melanómu.
Záver
Rádioterapia je lokálna liečba, ktorej úlohou je znížiť percento lokálnych recidív. V liečbe lokalizovaného karcinómu prsníka má štandardné postavenie.
Klasická schéma pooperačnej rádioterapie je externá rádioterapia na celý prsník v TD 46–50 Gy konvenčnou frakcionáciou (5 týždňov) + dosycovacia dávka (boost) 10 – 16 Gy, čo predlžuje čas liečby o ďalšie dva až tri týždne.
Úlohou parciálnej akcelerovanej rádioterapie, ožiarenia v krátkom čase (4 – 5dní), je znížiť riziko recidívy v oblasti lôžka po operácii tumoru. Počet lokálnych recidív u selektovaných pacientok je 0 – 4 %, čo je porovnateľné s konvenčnou externou rádioterapiou, pričom pozitivom sú zlepšená kvalita života počas liečby a znížené náklady na liečbu [11,31,32]. Špecifické, aj 5 - ročné prežitie je rovnaké ako pri adjuvantnej externej rádioterapii + dosycovacej dávke [3,7,33].
Výhodou akcelerovanej parciálnej brachyterapie je okrem výrazného skrátenia doby terapie aj minimálna toxicita a výborný kozmetický efekt.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Alžbeta Molnárová
Odd. brachyterapie, Klinika radiačnej onkológie
Onkologický ústav sv. Alžbety, s.r.o.
Heydukova 10
812 50 Bratislava
Slovenská republika
e-mail: almolnar@ousa.sk
Sources
1. Jacobson JA et al. Ten-year results of a comparison of conservation with mastectomy in the teratment of stage I and II breast cancer. N Engl J Med 1995; 332 : 907 – 911.
2. Fischer B et al. Reanalysis and results after 12 years of follow‑up a randomized clinical trial comparing total mastectomy with lumpectomywith or without irradiation in the teratment of breast cancer. N Engl J Med 1995; 333(22): 1456 – 1461.
3. Van Linbergen E, Weltens C. New trends in radiotherapy for breast cancer. Curr Opin Oncol 2006; 18(6): 555 – 562.
4. Smith BD, Arthur DW, Bucholz TA et al. The concept of APBI – Scientific rationale – Clinical basis. Int J Radiat Oncol Biol Phys 2000; 48(5): 1281 – 1289.
5. Heimann R, Powers C, Halpem HJ et al. Breast preservation in stage I and II carcinoma of the breast. Cancer 1996; 78(8): 1722 – 1730.
6. Sauer G et al. Partial breast irradiation after breast ‑ conserving surgery. Strahender Onkol 2005; 181(1): 1 – 8.
7. Kaufman SA, DiPetrillo TA, Price LL et al. Long‑term outcome and toxicity in a Phase III trial using HDR multicateter interstitial brachytherapy for T1/ T2 breast cancer. Brachytherapy 2007; 6(4): 286 – 292.
8. Kuske RR et al. A phase I/ II trial of brachythetrapy alone following lumpectomy select breast cancer: toxicity analysis of Radiation Therapy Oncology Group 9517. Int J Radiat Oncol Biol Phys 2002; 54 (2 Suppl 1): A – 151.
9. Kuske RR et al. A phase II trial of brachythetrapy alone following lumpectomy for stage I or II breast cancer: initial outcomes of Radiation Therapy Oncology Group 9517. J Clin Oncol 2004; 22 (Suppl 14): A – 565.
10. Das RK, Patel R, Shah H et al. 3D CT‑based HDR breas brachytherapy implants: Treatment planning and quality assurance. Int J Radiat Oncol Biol Phys 2004; 59(4): 1224 – 1228.
11. Patel RR, Christensen ME, Hodge CW et al. Clinical outcome analysis in“high‑risk“versus“low ‑ risk patients eligible for national surgical adjuvant brest RTOG 0413trial: five‑year results. Int J Radiat Oncol Biol Phys 2008; 70(4): 970 – 973.
12. Polgar C, Major T, Fodor J et al. HDR brachytherapy alone vs whole breast radiotherapy with or without tumor bed boost after breast ‑ conserving surgery:seven‑year results of a comparative study. Int J Radiat Oncol Biol Phys 2004; 60(4): 1173 – 1181.
13. Heeres PH, Mak AC, te Loo HJ et al. Breast preserving therapy: shorter treatment duration by the peroperative introduction of irridium guide needles. Ned Tijdschr Geneeskd 1991; 135(24): 1084 – 1088.
14. Cuttino LW, Todor D, Arthur DW et al. CT ‑ guided multi-catheter insertion technique for partial breast brachytherapy: reliable target coverage and dose homogenity. Brachytherapy 2005; 4(1): 7 – 10.
15. Perera F, Chisela F, Stitt L et al. TLD skin dose measurements and acute and late effects after lumpectomy and HDR brachytherapy only for early breast cancer. Int J Radiat Oncol Biol Phys 2005; 62(5): 1283 – 1290.
16. Soumarová et al. Principles of pot-resection brachytherapy of solid tumors using HDR afterloading. Rozhl Vhir 2003; 82(6): 301 – 306.
17. Johansson B et al. Phantom study of radiation doses outside the target volume brachytherapy verus external radiotherapy of early breast cancer. Radiother Oncol 2003; 69 (1): 107 – 12; 27.
18. Nag S. HDR brachytherapy: its clinical applications and treatment gudelines. Technol Cancer Res Treat 2004; 3(3): 269 – 287.
19. Blamey R. British Assotiationof Surgical Oncology (BASO)II trial: Comparing wide local excision alone with wide local excision plus radiotherapy in small well differentiated breast cancers. Europ J Canc 2000; 36 (Suppl. 5).
20. Soumarová R et al. Faktory ovlivňující vznik lokálnírecidivy a vzdálené diseminace u pacientek s prs zachovávajícím chirurugickýn výkonem a pooperační radioterapií. Onkologie v gynekologii a mammologii 2001; 88 – 91.
21. Růžičková J et al. Samostatná peroperační intersticiální HDR Brachyradioterapie u časných stadií karcinomu prsu ‑ první výsledky klinické studie. Klin Onkol 2005; 18(1): 15 – 18, 22.
22. Major T et al. Dosimetric comparisons between HDR interstitial and MammoSite baloon brachytherapy for breast cancer. Radiother Oncol 2006; 79(3): 321 – 328.
23. Vicini FA, Antonoucci JV, Wallace M et al. Long‑term fficacy and patterns of faikure after accelerated partial breast irradiationa molecular assay‑based clonality avluation. Int J Radiat Oncol Biol Phys 2007; 68(2): 341 – 346.
24. Bickell NA, Wang JJ, Oluwole S et al. Missed opportunities:radica disparirie in adjuvant breast cancer treatment. J Clin Oncol 2006; 24(9): 1357 – 1362.
25. Albrand G, Terret C D. Early breast cancer in the elderly: assessment and management considerations. Drugs Aging 2008; 25(1): 35 – 45.
26. Bovi J, Qi XS, White J et al. Comparison of three accelerated partial breast irradiation techniques: treatment affectivenes based upon biological models. Radiother Oncol 2007; 84(3): 226–227.
27. Wazer DE, Lowther D, Boyle T et al. Clinically evident fat necrosis treated with HDR brachytherapy alone or early‑stage breast cancer. Int J Radiat Oncol Biol Phys 2001; 50(1): 107 – 111.
28. Benitez PR, Chen PY, Vicini PA et al. Partial breast irradiation in breast consrving, therapy by way of interstitial brachytherapy. AM J Surg 2004; 188(4): 355 – 364.
29. Wazer DE, Berle L, Graham R et al. Preliminary results of a phase I/ II study of HDR brachytherapy alone for T1/ T2 breast cancer. Int J Radiat Oncol Biol Phys 2002; 53(4): 889 – 897.
30. Nose T, Komoike Y, Yoshida K et al. A pilot studa of wider use of accelerated partial breast irradiation: intraoperative margin‑directed re‑excision combined with sole HDR interstitial brachytherapy. Breast Cancer 2006; 13(3): 289 – 299; 25.
31. Hannoun ‑ Lévi JM, Marsiglia H, Garbay JR. Preview Irradiation partielle du sein: pourquoi, comment? (fre; includes abstract) Cancer Radiothérapie: Journal De La Société Française De Radiothérapie Oncologique 2003; 7(3): 200 – 209.
32. Stevens MJ, Cooper SG, Cross P et al. Accelerated paertial breast irradiation using interstitial high dose rate iridium brachytherapy: Early Autralian experience and review of the literature. Australas Radiol 2006; 50(2): 143.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2010 Issue 6-
All articles in this issue
- New Therapeutic Options in Therapy of Glioblastoma Multiforme
- Acute Myeloblastic Leukaemia with Alternationsof MLL Proto-Oncogene Protein (11q23/ MLL+ AML)
- Actual Problems in Structure and Orientation of Concise National Cancer Control Programs
- The Problematic of Original and Generic Drugs and Biosimilars – Switching of Drugs Today and Tomorrow with the Main Targeting on Biotechnologies- Associated Risks
- Evaluation of Neoadjuvant Chemo- Radiotherapy with Locally Advanced Rectal Cancer by Comparing Tumour Volume before and after Treatment
- Hormonal Contraceptives and Their Relationship to Breast Cancer
- Postoperative Accelerated Partial Radiotherapy for Breast Cancer
- Economic Evaluation of Targeted Biologic Therapy in Metastatic Renal Cell Carcinoma
- Malignant Subtype of Cystosarcoma Phyllodes with Brain Metastases
- The Variance of Melphalan Doses Related to Kilogram of Body Weight and the Consequences
- Genetic Testing and Prevention of Hereditary Cancer at the MMCI – Over 10 Years of Experience
- Inflammatory Skin Metastasis as a First Sign of Progression of Lung Cancer – a Case Report
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- New Therapeutic Options in Therapy of Glioblastoma Multiforme
- Hormonal Contraceptives and Their Relationship to Breast Cancer
- Acute Myeloblastic Leukaemia with Alternationsof MLL Proto-Oncogene Protein (11q23/ MLL+ AML)
- Postoperative Accelerated Partial Radiotherapy for Breast Cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

