-
Medical journals
- Career
Cílená léčba bronchioloalveolárního karcinomu inhibitory tyrozinkinázové aktivity EGFR: přehled literatury a kazuistika klinicky promptní a výrazné odpovědi na léčbu erlotinibem
: M. Svoboda 1,2; P. Fabian 3; O. Slabý 1,2; M. Staňková 4; R. Lakomý 1,2; R. Němeček 1; R. Vyzula 1,2
: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Lékařská fakulta Masarykovy Univerzity, Brno 2; Oddělení patologie, Masarykův onkologický ústav, Brno 3; Institute of Applied Biotechnologies, a. s., Praha 4
: Klin Onkol 2010; 23(4): 224-230
: Reviews
Úvod:
Bronchioloalveolární karcinom (BAC) patří ve skupině nemalobuněčných plicních karcinomů (NSCLC) mezi adenokarcinomy a kromě morfologie a endobronchiálního šíření vykazuje i určitá klinická specifika: častější výskyt u žen, nekuřáků a mladších pacientů, přítomnost maligní bronchorrhey a nižší citlivost ke konvenční cytostatické léčbě ve srovnání s ostatními podtypy NSCLC. Naopak nemucinózní typ BAC může dosahovat lepších léčebných výsledků při použití cílené terapie inhibitory tyrozinkinázové aktivity (TKI) receptoru pro epidermální růstový faktor (EGFR) erlotinibem nebo gefitinibem, neboť je až 5krát častěji nositelem mutací v genu pro EGFR oproti konvenčnímu plicnímu adenokarcinomu.Popis případu:
Popisujeme případ 41letého muže, 5 let stopkuřáka, u kterého byla diagnostikována pneumonická forma nemucinózního bronchioloalveolárního karcinomu. Již iniciálně byly přítomny metastázy do regionálních i vzdálených lymfatických uzlin a masivní postižení skeletu s infiltrací kostní dřeně. V průběhu I. linie paliativní chemoterapie v režimu karboplatina/ paklitaxel dochází k výrazné progresi nemoci a zhoršení stavu pacienta (performance status – (PS) 3, těžká klidová dušnost, maligní bronchorrhea). Na základě několika kazuistik popisujících dobrou odpověď BAC na léčbu TKI EGFR bylo zahájeno podávání erlotinibu. Již po 4 dnech aplikace nastává evidentní zlepšení stavu pacienta a regrese periferní lymfadenopatie, po 30 dnech dochází k téměř úplnému vymizení plicních infiltrátů, pacient se stává asymptomatický, PS 0. Molekulárně genetické metody potvrdily fenotyp tumoru zvýšeně citlivý k cílené terapii TKI EGFR. V tumoru byla zjištěna mutace genu EGFR v exonu 19 (in‑frame delece L747 ‑ 753insS) a nemutovaný gen K ‑ ras. Progrese onemocnění byla potvrzena po 6 měsících léčby, kdy došlo k relapsu onemocnění v játrech. Další léčba již nebyla efektivní, byť následné podávání pemetrexedu a gefitinibu vždy na krátkou dobu stabilizovalo progresi jaterních enzymů. Pacient zemřel za 12 měsíců od diagnózy nemoci.Závěr:
Náš případ potvrzuje význam cílené terapie v případě její aplikace u nádorů s odpovídajícím fenotypem. Takto indikovaná léčba může mít promptní a silný účinek, jenž může zvrátit vývoj nemoci i u pacientů ve špatném celkovém stavu.Klíčová slova:
karcinom plic – bronchioloalveolární karcinom – gen EGFR – gen K ‑ ras – erlotinib – gefitinib – cílená léčba – predikceÚvod
Zhoubné novotvary plic patří k nejčastějším malignitám u mužů i u žen, obecně mají nepříznivou prognózu a vysokou mortalitu. Bronchioloalveolární karcinom (BAC) patří ve skupině nemalobuněčných plicních karcinomů (non small cell lung cancer – NSCLC) mezi adenokarcinomy a kromě morfologie a endobronchiálního šíření vykazuje i určitá klinická specifika: častější výskyt u žen, nekuřáků a mladších pacientů, eventuální přítomnost maligní bronchorrhey a nižší citlivost ke konvenční cytostatické léčbě ve srovnání s ostatními podtypy NSCLC [1–3]. Naopak nemucinózní typ BAC může dosahovat lepších léčebných výsledků při použití cílené terapie inhibitory tyrozinkinázové aktivity (tyrosine kinase inhibitors – TKI) receptoru pro epidermální růstový faktor (epidermal growth factor receptor –EGFR) erlotinibem nebo gefitinibem [4–6], neboť je až 5krát častěji nositelem mutací v genu pro EGFR oproti konvenčnímu plicnímu adenokarcinomu [6,7].
Etiopatogeneze
Bronchioloalveolární karcinom se může vyskytovat samostatně (do 5% NSCLC), častěji se však jedná o smíšený adenokarcinom s menším či větším zastoupením složky BAC (20–40% adenokarcinomů). „Čistá“ forma BAC se vyznačuje neinvazivním růstem v plicních sklípcích podél alveolárních sept. K šíření dochází uvnitř dýchacích cest a lymfatiky. Makroskopicky pak může tumor růst ve formě uzlů nebo difuzně postihovat část či celou plíci [1,5,8].
Rozlišují se tři podtypy BAC: mucinózní, nemucinózní a smíšený. Toto dělení odráží nejenom rozdíly na úrovni molekulární a morfologické, nýbrž má i významný dopad na léčbu a prognózu pacienta. Mucinózní BAC tvoří přibližně 30–40% případů BAC a vychází nejspíše z pohárkových buněk přítomných v epitelu dýchacích cest až do úrovně bronchiolů. Zbylou část případů představuje zejména nemucinózní BAC, který vzniká z Clarových buněk (na úrovni bronchiolů) nebo pneumocytů II typu (na úrovni alveolů). Smíšená forma mucinózního a nemucinózního BAC je vzácná [1,5,8,9]. Nemucinózní typ BAC je až 5krát častěji nositelem mutací EGFR oproti konvenčnímu adenokarcinomu [6,7]. Více než 90% mutací v genu pro EGFR nastává v exonu 19 a 21 [6,7,10]. V důsledku těchto mutací dochází nejčastěji k permanentní aktivaci tyrozinkinázové domény EGFR, bez závislosti na ligandu receptoru, což vede k fosforylaci dalších proteinů EGFR signální dráhy. Výsledkem je agresivní fenotyp tumoru [6,10].
Marchetti et al publikovali výsledky analýzy mutačního stavu EGFR genu v exonech 18, 19 a 21 u 860 pacientů s NSCLC [6]. Zatímco u 454 pacientů s dlaždicobuněčným karcinomem nebyla nalezena žádná mutace v EGFR genu, u adenokarcinomů byly mutace detekovány v 39 případech z 375 pacientů (10%), z toho 22 mutací připadlo na 69 pacientů s nemucinózním typem BAC (32%). Ani jeden z mucinózních BAC nebyl nositelem mutace v EGFR genu [6]. Obecně u adenokarcinomů plic platí, že mutace v EGFR genu jsou častější u Asijců (40–60%) ve srovnání s Američany (14%) nebo Italy (10%) či Australany (7%); u žen (20–62%) oproti mužům (7–22%); u celoživotních nekuřáků (27–56%) ve srovnání s kuřáky (7–14%) [6,7,10,11]. Ke kouření je nutné uvést, že i v případě vzniku BAC hraje kouření významnou roli, nicméně jedna třetina případů BAC vzniká u nekuřáků a stejná proporce připadá na pacienty, kteří jsou víceletí stopkuřáci nebo kouřili periodicky [12].
Diagnostika
Příznaky onemocnění závisí na jeho rozsahu. V případě uzlovité formy růstu může být BAC diagnostikován i u zcela asymptomatických pacientů. U pokročilých případů nebo difuzní formy růstu jsou nejčastějšími projevy nemoci kašel, dušnost, hemoptýza, ztráta hmotnosti a teploty. Specifickým symptomem BAC je maligní bronchorrhea, kdy v nadměrném množství (> 100ml/den) vykašlávaného spůta lze prokázat buňky BAC. Na základě způsobu růstu tumoru lze při rentgenovém vyšetření plic (RTG nebo CT) detekovat buď jednotlivé nebo vícečetné uzly nebo mnohočetné periferně lokalizované malé noduly, anebo plicní infiltráty jako u bakteriální pneumonie, avšak s nápadným vzdušným bronchogramem (obr. 1A, 1B, 2). Posledně uvedená forma je označována jako tzv. „pneumonická forma“ a tito pacienti mají nejhorší prognózu (obr. 2) [1,5,13]. Při stagingu onemocnění se řídíme sedmým vydáním TNM klasifikace, ve kterém je mnohočetné ložiskové postižení v rámci jednoho plicního laloku klasifikováno jako T3, a nikoliv T4, jak by tomu bylo při stagingu NSCLC v šestém vydání. Podobně je tomu i v případě nálezu ložisek v dalším laloku/lalocích stejné plíce, které je klasifikováno jako T4, nikoliv M1 [14]. K nejčastějším místům metastatického rozsevu patří druhostranná plíce, skelet, nadledviny, mozek [13]. Diagnózu lze stanovit jak z cytologického vyšetření aspirátu tenkojehlové biopsie či brochoalveolární laváže (obr. 3F), tak z histologie resekovaného tumoru nebo postižených lymfatických uzlin (obr. 3A–E).
1. A) CT vyšetření plic a mediastina v době před stanovením diagnózy bronchioloalveolárního karcinomu. V popisu CT a předchozího HRCT zhodnoceno jako: „Oboustranný intersticiální plicní proces charakteru fi brotizující alveolitidy s mikro- až makronodulací.“ (Vyšetření provedeno mimo MOÚ). B) HRCT vyšetření plic provedené v době progrese onemocnění po 2. sérii iniciální chemoterapie v režimu karboplatina/paklitaxel: „V plicním parenchymu oboustranně poměrně symetrická, výrazná alveolární infiltrace s max. perihilózně, spíše vynechávající periferní peripleurální partie plic, s patrným air-bronchogramem bilat. Ve srovnání s dokumentací z 24/4/08 nález ve výrazné progresi.“ V této době je pacient v celkově velmi špatném stavu (PS 3), manifestovaném zejména klidovou dušností (saturace SpO<sub>2</sub> 74 %, měřeno puzlním oxymetrem, bez oxygenoterapie) a intermitentním dávivým kašlem s bronchorrheou. C) CT vyšetření plic a mediastina provedené 1 měsíc od zahájení cílené léčby inhibitorem tyrozinkinázové aktivity EGFR – erlotinibem: „Prokázána výrazná regrese velikosti i rozsahu měkkých převážně alveolarních infi ltratů v obou plicních křídlech a regrese pleurálních výpotků.“ D) CT vyšetření plic a mediastina provedené 3 měsíce od zahájení léčby erlotinibem: „Další regrese nízce denzních infiltrátů v plicním parenchymu bilat. Fluidothorax vpravo lehce výraznější, vlevo regrese ad integrum. Uzliny v mediastinu již stacionární. Karcinomatóza skeletu stacionární.“ Vyšetření provedli: MUDr. Petr Opletal, MUDr. Renata Belánová, MUDr. Michal Standara. 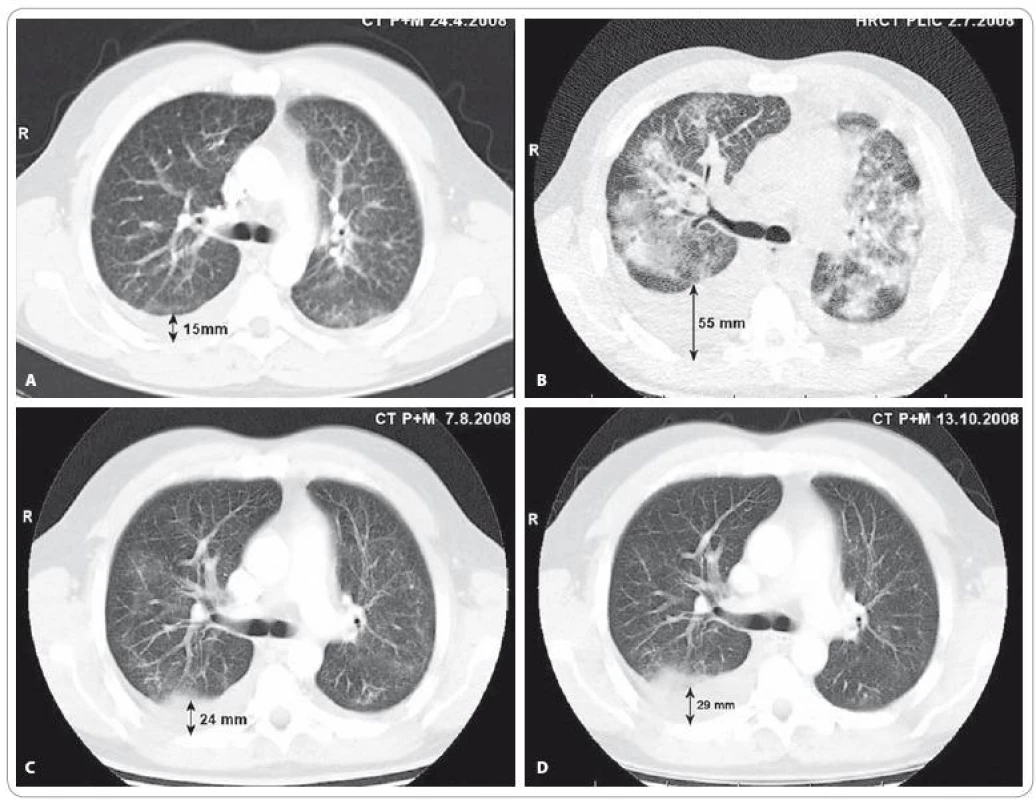
Léčba
Léčba BAC se řídí pravidly platnými pro NSCLC. Iniciální chirurgická léčba je preferována v případě I. a II. klinického stadia nemoci, v úvahu připadá i u jednotlivých resekovatelných uzlů. Radioterapie je u BAC stejně efektivní jako u ostatních typů NSCLC a je indikována zejména u III. klinického stadia nebo u pacientů, kteří nemohou podstoupit chirurgický výkon. Často je součástí multimodální léčby. Mezi ostatními typy NSCLC je BAC je považován za relativně chemorezistentní onemocnění, byť některá cytostatika mohou vykazovat srovnatelný efekt, např. taxany [1–3,5,11]. Naopak nemucinózní typ BAC může dosahovat lepších léčebných výsledků při použití cílené terapie inhibitory tyrozinkinázové aktivity (TKI) receptoru pro epidermální růstový faktor (EGFR) erlotinibem (Tarceva®) nebo gefitinibem (Iressa®), neboť je až 5krát častěji nositelem mutací v genu pro EGFR oproti konvenčnímu plicnímu adenokarcinomu [4–7]. V klinických studiích s TKI EGFR v paliativní léčbě NSCLC dosahovala objektivní odpověď 10–30 % u neselektované populace pacientů, 60–75 % u pacientů s tumory s mutovaným genem EGFR a do 2 % u pacientů s normálním genem EGFR a nebo s mutací v genu K-ras[6,10,11].
2. RTG snímek plic – zadopřední projekce. Snímek proveden v době progrese onemocnění po 2. sérii iniciální chemoterapie, před zahájením cílené protinádorové léčby. Na snímku je patrná rozsáhlá převážně intersticiální infiltrace obou plicních křídel - nehomogenní cárovité splývající infiltráty, nejvýraznější a nejsytější vlevo ve středním plicním poli. Fluidothorax vpravo, nově nepatrně i vlevo. Metastatické postižení skeletu. (Vyšetření provedla: MUDr. Monika Procházková). 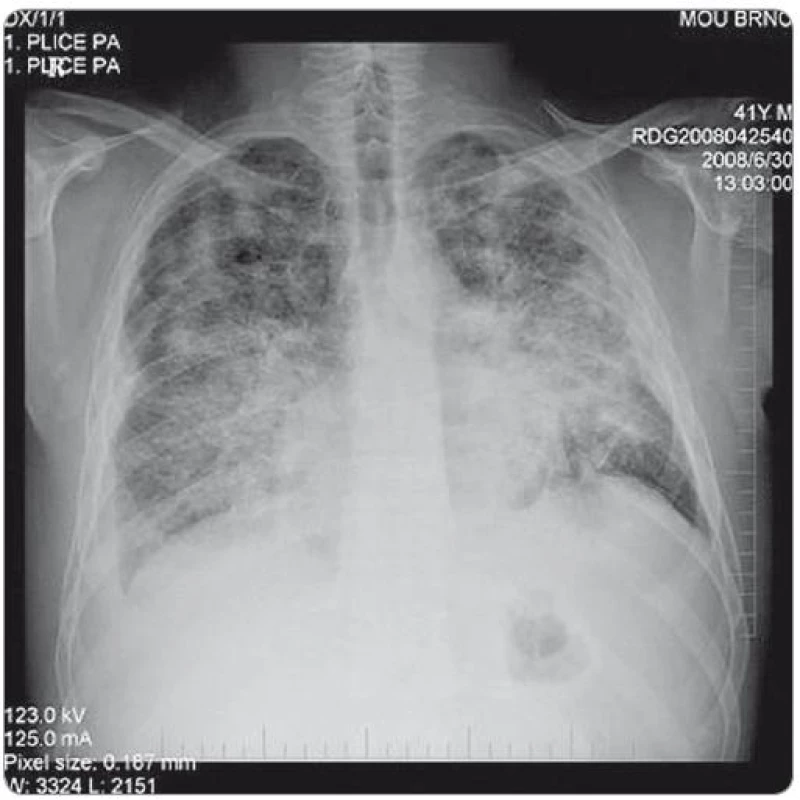
Popis kazuistiky
Pacient – muž, rok narození 1967. Rodinná a osobní anamnéza nevýznamná. Stopkuřák 5 let, kouřil 15 let, cca 10 cigaret denně.
Průběh onemocnění: od 22. 4. 2008, po 14. dnech postupně progredujícího suchého kašle a selhání antibiotické terapie byl pacient hospitalizován na plicním oddělení okresní nemocnice pro rozsáhlou levostrannou pneumonii. Zde provedeno CT a HRCT vyšetření plic s nálezem oboustranného intersticiálního plicního procesu charakteru fibrotizující alveolitidy s mikro - až makronodulací, fluidothorax vlevo, zmnožené a zvětšené lymfatické uzliny v horním mediastinu do 10mm (obr. 1A). V séru pacienta nalezeny zvýšené hladiny protilátek proti ENA a kardiolipinu a na základě těchto zjištění bylo vysloveno podezření na systémové onemocnění. Následovala terapie kortikoidy s krátkodobě dobrým efektem. Další zhoršení stavu pacienta vedlo k novým vyšetřením, která odhalila osteolytické postižení skeletu, lymfadenopatii v dutině břišní a retroperitoneu, což vzbudilo podezření na nádorové onemocnění. Maligní buňky nebyly zachyceny v žádném z vyšetřovaných materiálů: pleurální výpotek, aspirát bronchoalveolární laváže, cílená transtorakální biopsie. Pacient byl dne 15. 5. 2008 přeložen do MOÚ k došetření. Při přijetí byla nově zjištěna patologická uzlina v levé axile, která byla dne 21. 5. 2008 extirpována. Histologické a imuno histochemické vyšetření prokázalo kompletní infiltraci uzliny metastázou adenokarcinomu plicního origa odpovídající nemucinóznímu bronchio-loalveolárnímu karcinomu (exprese TTF 1 difuzně pozitivní, EGFR silně pozitivní) (obr. 3B, 3C). Celotělová pozitronová emisní tomografie potvrdila rozsáhlou disseminaci malignity do plic, lymfatických uzlin a skeletu. V kostní dřeni byly prokázány maligní buňky, v séru zjišěna elevace nádorových markerů CEA, CA 15 3, CYFRA 21 1, NSE, CA 125 (graf 1). Stav pacienta se dále zhoršoval a komplikoval, došlo ke vzniku hluboké žilní trombózy v dolní končetině. Vzhledem ke klinicky rychlé progresi choroby byla dne 29. 5. 2008 zahájena 1. série I. linie paliativní chemoterapie v režimu karboplatina/paklitaxel. Dne 19. 6. 2008 byla aplikována její 2. série a postupně snižována dávka kortikoidů. Již za sedm dní (25. 6. 2008) je pacient akutně přijat k hospitalizaci pro celkové zhoršení stavu (PS 3) manifestované zejména klidovou dušností (saturace SpO2 74 %, měřeno pulzním oxymetrem, bez oxygenoterapie) a intermitentním dávivým kašlem s expektorací hlenů rezavé barvy. Provedeno HRCT plic a bronchoskopie s bronchoalveolární laváží. HRCT plic prokázalo výraznou alveolární infiltraci obou plicních křídel a oboustranný fluidothorax (obr. 1B, HRCT z 2. 7. 2008). To, že se jedná o obraz progrese nádorového onemocnění potvrdilo cytologické vyšetření aspirátu broncholoalveolární tekutiny, ve které byly masivně přítomny nádorové buňky s morfologií BAC (obr. 3F). Stav pacienta uzavřen jako výrazná progrese základní choroby v průběhu I. linie paliativní chemoterapie a po vyloučení souběžné infekční příčiny byly navýšeny kortikoidy s efektem ústupu klidové dušnosti (SpO2 90 %, měřeno pulzním oxymetrem, bez oxygenoterapie).
3. A) Infiltrace lymfatické uzliny metastázou adenokarcinomu plicního origa odpovídající nemucinóznímu bronchioloalveolárnímu karcinomu (dle podrobného imunoprofilu – viz text). Barvení hematoxylin – eozin. Zvětšeno 100×. B) Imunohistochemické vyšetření exprese TTF-1 (thyroid transcription factor-1, specifi cký marker pro adenokarcinomy plicního origa): pozitivní průkaz. Zvětšeno 200×. C) Imunohistochemické vyšetření exprese EGFR: pozitivní průkaz silné membránové exprese. Zvětšeno 200×. D) Imunohistochemické vyšetření exprese antigenu CA 15-3: pozitivní průkaz. Zvětšeno 200×. U pacienta byl antigen CA 15-3 ve zvýšené koncentraci detekován rovněž v séru. E) Imunohistochemické vyšetření exprese antigenu CA 125: negativní průkaz. U pacienta byl antigen CA 125 ve zvýšené koncentraci detekován v séru. Nejspíše však pocházel z buněk mezotelu pleury, neboť nádorové buňky tento antigen neexprimovaly. F) Trs nádorových buněk získaných z cytospinu aspirátu bronchoalveolární laváže provedené v době progrese nemoci. Vyšetřením byla prokázána maligní bronchorrhea. Barvení MGG, zvětšeno 630×. (Fotografie a vyšetření provedli: MUDr. Pavel Fabian, Ph.D., MUDr. Eva Krejčí). 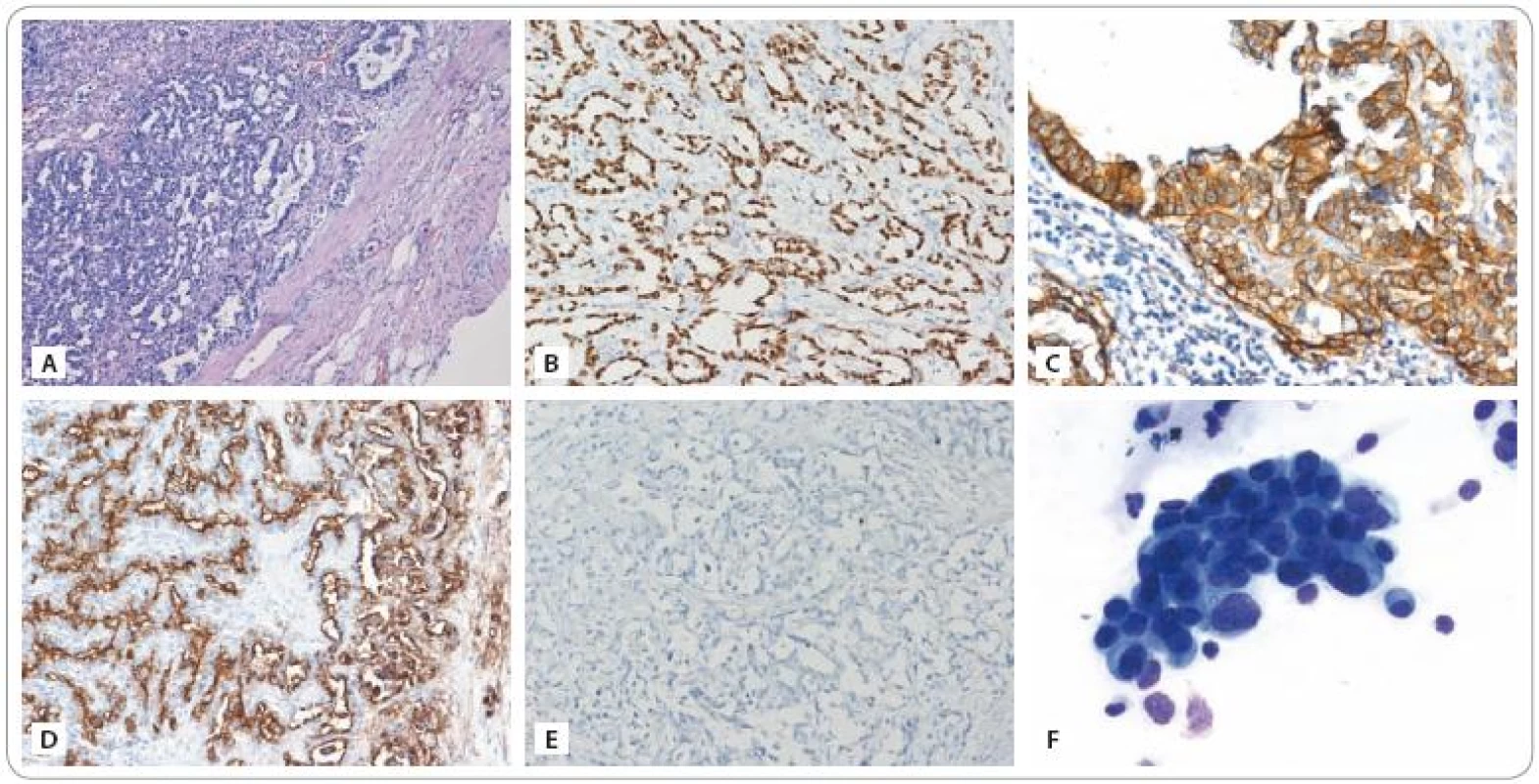
Na základě do té doby ojedinělých kazuistik popisujících enormní odpovědi až do obrazu kompletních remisí u pacientů s BAC léčených TKI EGFR erlotinibem nebo gefitinibem, jsme dne 9. 7. 2008 zahájili II. linii paliativní protinádorové léčby erlotinibem v pravidelné denní dávce 150mg. Pacient byl bezprostředně propuštěn do domácí péče, při propuštění PS 2. První klinická kontrola pacienta provedena po 14 dnech léčby erlotinibem. Pacient přichází ve velmi dobrém stavu (PS 1), neguje potíže, včetně kašle nebo námahové dušnosti, udává, že zlepšení stavu začal pociťovat již po 4 dnech léčby erlotinibem. Lékař dále zaznamenává, že došlo k regresi periferní lymfadenopatie. Po 1. měsíci léčby, dne 7. 8. 2008, je provedeno kontrolní CT plic a mediastina (obr. 1C, CT ze 7. 8. 2008), které prokázalo výraznou oboustrannou regresi alveolárních infiltrátů i pleurálních výpotků. Pacient je bez potíží (PS 0). Na dalším CT vyšetření, které bylo provedeno po 3 měsících léčby dne 13. 10. 2008, je patrná další regrese již pouze nízce denzních nepravidelných infiltrátů v plicním parenchymu (obr. 1D, CT ze 13. 10. 2008). Pacient se cítí velmi dobře (PS 0), neudává žádné omezení ve svých pracovních aktivitách, bez potíží zvládá vycházky s dětmi a jízdu na kole. Z nežádoucích účinků erlotinibu je patrný generalizovaný exantém s maximem v obličejové části, kde je klasifikovatelný stupněm G2 (dle CTCAE). Mimo erlotinib je aplikována podpůrná terapie bisfosfonáty pro současné metastatické kostní postižení. Uvedený stav přetrvává celkem 6 měsíců. V prosinci 2009 zjištěna progrese nádorového markeru CA 15 3 (graf 1) a jaterních enzymů, pacient nadále asymptomatický. Dne 6. 1. 2009 při pravidelném kontrolním CT vyšetření zjištěno nově mnohočetné metastatické postižení jater a mírná progrese fluidothoraxu. Pacient nadále asymptomatický. Od února 2009 zahájena III. linie paliativní protinádorové léčby pemetrexedem (Alimta®). Po 1. sérii dochází ke stabilizaci jaterních enzymů, nicméně již od 2. série nastává jejich rychlá a výrazná progrese, pacient je ikterický, narůstá plicní výpotek, pacient kachektizuje a celkově se zhoršuje. Po potvrzení progrese jaterního postižení zobrazovacími metodami je v dubnu 2009 léčba pemetrexedem po 2. sérii ukončena a po kolektivní rozvaze je indikována symptomatická a ošetřovatelská péče. V této situaci si pacient obstarává v Rusku gefitinib, který si na vlastní riziko aplikuje v denní dávce 250mg od 26. 4. 2009 do 22. 5. 2009. Přestože nedošlo při užívání gefitinibu k žádnému zjevnému zlepšení stavu pacienta, nebyla pozorována ani toxicita léku, místo toho došlo k poklesu GMT z 54,3 mkat/l na 23,82 mkat/l a ALT z 8,78 mkat/l na 2,48 mkat/l a ke stabilizaci AST na hladině 2,6–2,9 mkat/l. Všechny jaterní enzymy do týdne po vysazení gefitinibu opět vzrostly, a to na 49,18 mkat/l u GMT a 3,48 mkat/l u ALT a 4,78 mkat/l v případě AST.
1. Hodnoty sérové koncentrace vybraných nádorových markerů v průběhu choroby. Zatímco u nádorových markerů CEA a CA 15-3 byla prokázána jejich exprese nádorovými buňkami, v případě CA 125 nikoliv. Zvýšená sérová koncentrace CA 125 tak nejspíše pocházela z aktivovaných mezotelií pleury. Poznámka: Normy jednotlivých markerů: CEA do 4,6 mg/l, CA 15-3 do 30 kU/l, CA 125 do 35 kU/l. 
Stav pacienta se opět zhoršuje, je akutně hospitalizován a dne 30. 5. 2010 umírá v důsledku progrese nádorového onemocnění a jaterního selhání.
Diskuze
Zpětný pohled na průběh diagnostického a léčebného procesu u tohoto případu ukázal na několik zajímavých míst a skutečností vhodných k diskuzi.
Příznaky a výsledky prvních vyšetření na počátku nemoci a v průběhu prvních 6 týdnů od jejich vzniku vedly nejprve k diagnóze infektu horních cest dýchacích, následně ke zjištění levostranné pneumonie a poté k vyslovení podezření na systémové onemocnění. A právě všemi těmito klinickými obrazy se může bronchioloalveolární karcinom manifestovat. Ani cílená biopsie, ani vyšetření aspirátů z bronchoalveolární laváže či fluidothoraxu nevedly ke stanovení diagnózy. Až histologické a imunohistochemické vyšetření zvětšující se lymfatické uzliny potvrdilo diagnózu plicního adenokarcinomu (pozitivní exprese: cytokeratinu (CK) 7, antigenu TTF 1 difuzně, CEA v části tumoru, EGFR silně membránově, CK19 slabě; naopak žádná exprese: CK20, CK5/6, CD30, tyreoglobulinu, PSA, estrogenových a progesteronových receptorů). Nádorové buňky byly v aspirátu z bronchoalveolární laváže přítomny až v době, kdy pacient trpěl bronchorrheou. Přechodné zlepšení stavu při terapii kortikoidy bylo způsobeno útlumem paraneoplastických symptomů. Ostatně kortikoidy jsou u BAC obecně doporučovány k tlumení bronchorrhey [15].
Za problematické místo našeho případu považujeme období, kdy po 2. sérii iniciální chemoterapie karboplatina/paklitaxel, považované za jednu z nejefektivnějších v léčbě NSCLC, byla zjištěna rychlá progrese onemocnění, která bezprostředně ohrožovala život pacienta (celkový stav pacienta PS 3, těžká klidová dušnost, saturace O2 měřená periferním oxymetrem 74 %, bronchorrhea). Za daných okolností jsme se těžce rozhodovali o dalším postupu léčby. S ohledem na skutečnost, že pacient byl muž a kuřák a že nebylo možné čekat na případný výsledek vyšetření známých molekulárních prediktorů, mutačního stavu genů EGFR a K ras, se část lékařů přikláněla k pokračování protinádorové léčby na bázi jiných cytostatik raději než perorálně aplikovaného TKI EGFR. Určitou roli zde hrála i nedůvěra k možnému časnému nástupu protinádorového účinku inhibitoru při současné rychlé progresi choroby. Již v té době (06/2008) však bylo k dispozici několik prací popisujících větší pravděpodobnost efektivity TKI EGFR u BAC, a proto jsme do II. linie paliativní protinádorové léčby zvolili jediný dostupný přípravek této lékové skupiny v ČR – erlotinib. Volba se ukázala jako správná. Již po 4 dnech užívání došlo ke zlepšení stavu pacienta a nastala regrese periferní lymfadenopatie. Do 1 měsíce byl pacient zcela asymptomatický a nález na CT plic minimální ve srovnání se vstupním vyšetřením. Molekulárně genetická vyšetření prokázala v nádoru pacienta mutaci v genu EGFR v exonu 19 (in frame delece L747-753insS), která způsobuje permanentní aktivitu tyrozinkinázové domény EGFR, a nemutovaný gen K ras. Právě výše uvedená mutace EGFR genu patří k mutacím predikujících velmi dobrou odpověď k oběma tyrozinkinázovým inhibitorům – gefitinibu (IC50 7 nmol/l) i erlotinibu (IC50 5 nmol/l) [10,16]. V klinických studiích s TKI EGFR v paliativní léčbě NSCLC dosahovala objektivní odpověď 10–30% u neselektované populace pacientů, 60–75% u pacientů s tumory s mutovaným genem EGFR a do 2% u pacientů s normálním genem EGFR anebo s mutací v genu K ras [6,10,11]. O příčině selhání cílené terapie u daného pacienta můžeme pouze spekulovat. Vezmeme li v úvahu následný klinický vývoj (celkově pomalejší progrese, která se odehrávala zejména v játrech, a větší elevace nádorového markeru CEA než CA 15 3), jeví se nám jako nejpravděpodobnější příčina progrese konvenční složky adenokarcinomu, která na rozdíl od BAC nemusela mít mutaci v EGFR genu. Druhou možnou příčinou mohl být vznik sekundární mutace v EGFR genu, která způsobila rezistenci proti podávaným TKI EGFR. Existence a význam těchto mutací již byl publikován [10,17].
V neposlední řadě chceme v diskuzi uvést i několik skutečností, které doprovázely podávání gefitinibu, včetně lidského aspektu, který zde sehrál významnou roli. Po selhání pemetrexedu, jako již druhé řady cytostatické léčby, pacient a jeho rodina zaměřili svoji aktivitu na získání gefitinibu jako léčiva podobného erlotinibu, při kterém nastalo výrazné zlepšení stavu pacienta. Byť jsme jim v tomto snažení nedávali velké naděje ani pro získání léčiva, které nebylo v Evropské unii dostupné, ani pro jeho efekt, a naopak jsme je varovali před možnou toxicitou léku užívaného pacientem s těžkou hepatopatií, podařilo se jim získat jedno balení gefitinibu v Rusku. V průběhu aplikace gefitinibu došlo k poklesu některých jaterních enzymů, nicméně bez vlivu na zhoršující se stav pacienta. Na druhou stranu nebyla pozorována žádná toxicita léku, a to přesto, že byl podáván při těžké hepatopatii (GMT 54,3 mkat/l).
Závěr
Naše kazuistika potvrzuje jisté výlučné postavení bronchioloalveolárního karcinomu ve skupině nemalobuněčných plicních karcinomů, a to v případě patogeneze, diagnostiky i léčby. Tento případ rovněž dokládá, že je li cílená léčba podána správnému pacientovi, lze očekávat její efekt. Naše rozhodnutí, byť bylo správné, vycházelo pouze z empirických dat. Správného pacienta, tj. pacienta s tumorem primárně senzitivním k cílené terapii, však mohou identifikovat pouze molekulárněgenetické metody. Ty mohou navíc určit i příčinu selhání cílené léčby a případně pomoci k výběru léčby následné. Úspěšným příkladem takového použití může být cílená léčba chronické myeloidní leukemie (CML), kolorektálního karcinomu nebo gastrointestinálního stromálního tumoru (GIST). Zajištění dostupnosti molekulárně genetických vyšetřovacích metod musí být proto v zájmu jak lékařů, tak zdravotních pojišťoven.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
This work was supported by the Czech Ministry of Health under contract No. FUNDIN - MZ0MOU2005.Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Sources
1. Gandara DR, West H, Chansky K et al. Bronchioloalveolar carcinoma: a model for investigating the biology of epidermal growth factor receptor inhibition. Clin Cancer Res 2004; 10(12 Pt 2): 4205s – 4209s.
2. Yano S, Kanematsu T, Miki T et al. A report of two bronchioloalveolar carcinoma cases which were rapidly improved by treatment with the epidermal growth factor receptor tyrosine kinase inhibitor ZD1839 („Iressa“). Cancer Sci 2003; 94(5): 453 – 458.
3. Fong T, Morgensztern D, Govindan R. EGFR inhibitors as first‑line therapy in advanced non‑small cell lung cancer. J Thorac Oncol 2008; 3(3): 303 – 310.
4. Kijima T, Suzuki M, Ueda K et al. Short‑term gefitinib treatment brought about a long‑term regression of bronchioloalveolar carcinoma without EGFR gene alterations: a case report. Oncol Res 2007; 16(10): 489 – 495.
5. Miller VA, Riely GJ, Zakowski MF et al. Molecular characteristics of bronchioloalveolar carcinoma and adenocarcinoma, bronchioloalveolar carcinoma subtype, predict response to erlotinib. J Clin Oncol 2008; 26(9): 1472 – 1478.
6. Marchetti A, Martella C, Felicioni L et al. EGFR mutations in non‑small‑cell lung cancer: analysis of a large series of cases and development of a rapid and sensitive method for diagnostic screening with potential implications on pharmacologic treatment. J Clin Oncol 2005; 23(4): 857 – 865.
7. Shigematsu H, Lin L, Takahashi T et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005; 97(5): 339 – 346.
8. Travis WD. World Health Organization, International Agency for Research on Cancer, International Association for the Study of Lung Cancer, International Academy of Pathology. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. Lyon, Oxford: IARC Press, Oxford University Press 2004.
9. Henrikson RC, Kaye GI, Mazurkiewicz JE. Respiratory system. In: NMS Histology. 1st ed. Baltimore: Williams and Wilkins 1997 : 311 – 321.
10. Gazdar AF. Activating and resistance mutations of EGFR in non‑small‑cell lung cancer: role in clinical response to EGFR tyrosine kinase inhibitors. Oncogene 2009; 28 (Suppl 1): S24 – S31.
11. Mok T, Wu YL, Thongprasert S et al. Phase III, randomised, open ‑ label, first‑line study of gefitinib vs carboplatin/ paclitaxel in clinically selected patients with advanced non‑small‑cell lung cancer – IPASS. Ann Oncol 2008; 19 (Suppl 8): viii3.
12. Rolen KA, Fulton JP, Tamura DJ et al. Bronchioloalveolar carcinoma (BAC) of the lung is related to cigarette smoking: A case ‑ control study from Rhode Island (RI). Proc Am Soc Clin Oncol 2003; 22 : 674.
13. Ebright MI, Zakowski MF, Martin J et al. Clinical pattern and pathologic stage but not histologic features predict outcome for bronchioloalveolar carcinoma. Ann Thorac Surg 2002; 74(5): 1640 – 1646.
14. Edge SB, Byrd DR, Compton CC. AJCC Cancer Staging Manual. 7th ed. New York: Springer ‑ Verlag 2010.
15. Nakajima T, Terashima T, Nishida J et al. Treatment of bronchorrhea by corticosteroids in a case of bronchioloalveolar carcinoma producing CA19 – 9. Intern Med 2002; 41(3): 225 – 228.
16. Kancha RK, von Bubnoff N, Peschel C et al. Functional analysis of epidermal growth factor receptor (EGFR) mutations and potential implications for EGFR targeted therapy. Clin Cancer Res 2009; 15(2): 460 – 467.
17. Kobayashi S, Boggon TJ, Dayaram T et al. EGFR mutation and resistance of non‑small‑cell lung cancer to gefitinib. N Engl J Med 2005; 352(8): 786 – 792.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2010 Issue 4-
All articles in this issue
- ABL1, SRC and Other Non‑ Receptor Protein Tyrosine Kinases as New Targets for Specific Anticancer Therapy
- Merkel Cell Skin Carcinoma
- Molecular Predictors in Head and Neck Tumours
- Targeted Therapy with an EGFR Tyrosine Kinase Inhibitor in Bronchioloalveolar Carcinoma of the Lung: A Literature Review and a Case Study of Clinically Prompt and Intensive Response to Erlotinib.
- Bortezomib in Multiple Myeloma Patients after Allogeneic Stem Cell Transplantation
- Late Effect of Treatment of Nephroblastoma in Patients Treated in 1980– 2001 in a Single Centre
- Changes in Target Volumes Definition by Using MRI for Prostate Bed Radiotherapy Planning – Preliminary Results
- Metastatic Breast Cancer in 28 Years Old Man
- Bile Duct Malignancies
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Merkel Cell Skin Carcinoma
- Metastatic Breast Cancer in 28 Years Old Man
- Bile Duct Malignancies
- Targeted Therapy with an EGFR Tyrosine Kinase Inhibitor in Bronchioloalveolar Carcinoma of the Lung: A Literature Review and a Case Study of Clinically Prompt and Intensive Response to Erlotinib.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

