-
Medical journals
- Career
Clostridium difficile Associated Diarrhoea – problém onkologického pacienta?
: A. Ligová 1; M. Matuška 1; P. Mrázková 1; D. Feltl 1; J. Mayer 2
: Klinika onkologická, Fakultní nemocnice Ostrava 2Interní hematoonkologická klinika, Fakultní nemocnice Brno Bohunice 1
: Klin Onkol 2009; 22(3): 108-116
: Case Reports
Východiska:
Clostridium difficile Associated Diarrhoea/Disease je zánětlivé onemocnění střeva postihující pacienty po předchozí expozici širokospektrými antibiotiky, dlouhodobě hospitalizované a imunosuprimované. Ve své nejtěžší formě se toto onemocnění manifestuje jako pseudomembranózní kolitida, v závažných případech probíhající fulminantně. V posledních letech byl celosvětově pozorován nárůst incidence tohoto onemocnění, bylo zachyceno několik závažných epidemií způsobených virulentními kmeny Clostridium difficile v zemích západní Evropy, Severní Ameriky i Asie.Soubor pacientů:
Na našem pracovišti jsme v letech 2004–2007 zachytili zvýšený výskyt tohoto onemocnění. V článku je analyzována skupina 36 pacientů s CDAD. Ve skupině byli pacienti s různě závažným průběhem – od mírně probíhajícího postantibiotického průjmu až po závažnou pankolitidu s projevy sepse a MODS (Multiple Organ Dysfunction Syndrom).Materiál a metody:
Jedná se o retrospektivní analýzu skupiny pacientů s CDAD.Výsledky a závěr:
Postantibiotický clostridiový průjem probíhá podle našich zkušeností u onkologického pacienta často komplikovaně a protrahovaně, postihuje i relativně mladší pacienty a při jeho vzniku se významně uplatňuje proteinová malnutrice a febrilní neutropenie. Vyšší riziko onemocnění je u pacientů s maligními lymfomy a kolorektální malignitou, 20% našich pacientů nemělo předchozí ATB expozici, což nás vede k vyslovení teorie o onkologické terapii jako predispozičním faktoru CDAD. U onkologického pacienta se závažnost CDAD nedá hodnotit podle leukocytózy (výrazný podíl febrilní neutropenie v průběhu onemocnění v našem souboru). Onemocnění může vyžadovat kombinovanou kauzální terapii a intenzivní podpůrnou péči. Ve skupině onkologických pacientů je rovněž vyšší riziko těžkého průběhu onemocnění s MODS. V článku je uvedena i kazuistika jednoho z komplikovaných případů.Klíčová slova:
kolitida – Clostridium difficile – pseudomembranózní enterokolitida – lékařská onkologie – průjemÚvod
Otázka infekčních komplikací u onkologických pacientů zaujímá v současnosti důležitou část podpůrné péče o tuto skupinu pacientů. Onkologický pacient je vystaven infekcím hlavně v důsledku imunosupresivní terapie – chemoterapie, radioterapie, biologická léčba. Vysoké riziko život ohrožujících infekcí je spojeno i s výskytem pancytopenie způsobené onkologickou terapií nebo samotným nádorem. Tyto infekce často vyžadují intenzivní přístup k léčbě, aplikaci různých kombinací antimikrobiálních látek a rozsáhlou podpůrnou terapii. Jedním z problémů, o němž se v posledních letech hodně diskutuje, je postantibiotický clostridiový průjem. Jako exogenní nozokomiální infekce nabývá tento problém stále větších rozměrů. Vzhledem k sporogenní formě je riziko šíření této infekce v nemocnicích hodně vysoké – spory přežívají na různých materiálech až 6 měsíců. Výskyt postantibiotického průjmu u hospitalizovaných pacientů se uvádí v rozmezí 10–35%.
Původce onemocnění
Clostridium difficile je grampozitivní sporulující bacil, který je považován za nejčastější příčinu nozokomiálních průjmů u dospělých pacientů. Jedná se o relativně velký mikroorganizmus (o délce 2–17 μm), který dobře roste na kulturách obsahujících cykloserin, cefoxitin a fruktózu v žloutkovém agaru [1]. Poprvé bylo Clostridium Difficile (CD) popsáno v roce 1935 jako součást normální střevní flóry novorozenců [1,2]. První zmínka o pseudomembranózní kolitidě je z roku 1899 (tedy ještě z preantibiotické éry), kdy byla popsána jako „difterická“ kolitida u mladé ženy po gastrointestinálním chirurgickém výkonu. V 70. letech 20. století se infekce CD začala spojovat s používáním širokospektrálních antibiotik a s pseudomembranózní kolitidou [3]. V roce 1974 v prospektivní studii s 200 pacienty užívajícími clindamycin byl popsán průjem u 21% a pseudomembranózní kolitida u 10% těchto pacientů [1,4].
Eradikace infekce je problematická, protože spory přežívají na různých materiálech 5–6 měsíců a jsou rezistentní vůči běžným alkoholovým dezinfekčním prostředkům. Obecně je CD neinvazivním mikroorganizmem. Ke vzniku CDAD je nutná kombinace infekce toxigenními kmeny CD a ztráty normální střevní ochranné bariéry – narušení anaerobní flóry. Normální střevní flóra (tab. 1) je vůči kolonizaci CD odolná, riziko kolonizace a infekce narůstá s její alterací.
1. Normální střevní flóra [5]. ![Normální střevní flóra [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/15efb80f0c475e34dd1b287d9dcf4d62.png)
Schopnost CD vytvářet spory je důvodem perzistence CD infekcí u pacientů, jakož i dlouhé perzistence na zdravotnických nástrojích a plochách. Přenos infekce je fekálně orální. Většina vegetativních buněk CD je zničena v žaludku (antacida a inhibitory protonové pumpy tuto bariéru oslabují), pouze 1% vegetativních buněk přechází do tenkého střeva. Spory CD jsou však acidorezistentní a po přechodu do tenkého střeva zde dozrávají do vegetativních forem. Nejdůležitějšími faktory virulence CD jsou exotoxiny – enterotoxin A a cytotoxin B [6]. Oba zvyšují vaskulární permeabilitu, interferují s proteosyntézou, působí chemotakticky na granulocyty, indukují produkci TNF alfa a zánětlivých interleukinů, což vede k zánětlivé odpovědi a následně ke vzniku pseudomembrán – nažloutlých adherujících plaků, histologicky složených z neutrofilů, fibrinu, hlenu a buněčných reziduí. Toxin A (molekulární váha: 308 kDa) se váže na receptory enterocytů a poškozením cytoplazmatických mikrofilament vede k extenzivnímu poškození tkání, spojenému s uvolněním velkého množství tekutin. Toxin B (molekulární váha: 269 kDa) má cytotoxický efekt na buňky poškozené toxinem A. Na střevní sliznici pak vznikají rozsáhlé ulcerace – nekrotické útvary, pseudomembrány – konglomeráty zničených buněk střevního epitelu, uhynulých polymorfonukleárů, fibrinu a mucinu ve tvaru květákovitě zduřelých, žlutě zbarvených krust, které lze poměrně snadno endoskopicky detekovat. Toto poškození může vyústit v dilataci až perforaci střeva [6,7]. Výskyt pseudomembrán se odhaduje u 10% pacientů s CDAD [7], podle korejské studie se 150 pacienty s postantibiotickým průjmem se pseudomembranózní kolitida (endoskopicky a histologicky potvrzena) zjistila až v 53% případů. V sledovaném souboru bylo 20 pacientů s malignitou a v této skupině byly histologicky zjištěny pseudomembrány až u 70% [8].
Dalším toxinem produkovaným některými kmeny CD je tzv. binární toxin, popsaný v roce 1988, jeho úloha se ale nepovažovala za zásadní. Poslední roky byly objeveny kmeny CD, které produkují pouze tento binární toxin (jsou toxin A a toxin B negativní), a byla vyslovena teorie o korelaci mezi binárním toxinem a závažností CDAD (pokusy na zvířatech ovšem zatím tuto teorii nepotvrdily). Byl kompletně přečten genom této bakterie, k typizaci kmenů CD se nyní používají PCR ribotypizace a pulzní gelová elektroforéza (PFGE). V letech 2003–2007 byly popsány kmeny CD produkující velké množství toxinu A a toxinu B (až 15–20násobně vyšší) a pojmenovány jako toxinotype III. Zjistilo se, že produkce toxinů v CD je na úrovni chromozomu regulována tzv. PaLoc (Pathogenicity Locus), který je tvořen geny tcdA, tcdB, tcdC (down-regulator), tcdR a tcdE, přičemž u hypervirulentních kmenů typu PCR ribotype 027/NAP1 dochází k deleci tcdC s poruchou down-regulace (netoxigenní kmeny CD PaLoc nemají) [9,10,11].
Epidemiologie
Asymptomatické nosičství CD u zdravé (ambulantní) populace se pohybuje mezi 1–3%, u hospitalizovaných pacientů mezi 7–11% [6,7]. Toto nosičství paradoxně nevede k závažným klinickým manifestacím a je připisováno tvorbě IgG protilátek proti CD toxinu A. Primárním zdrojem infekce v nemocnicích jsou pacienti nosiči nebo pacienti s aktivní infekcí, používané zdravotnické nástroje a ruce personálu, přičemž riziko přenosu infekce z pacienta na pacienta stoupá od 1% u pacientů hospitalizovaných týden po 50% riziko přenosu u pacientů hospitalizovaných více než 4 týdny. Je popisován přirozeně vyšší výskyt toxigenních kmenů CD u novorozenců, kojenců a malých dětí (až 30% zdravých malých dětí, podle některých zdrojů i více). Poměr těchto toxigenních druhů CD u dětí s přibývajícím věkem klesá, absence symptomů je připisována nezralosti enterocytů postrádajících receptory pro CD toxin A. Tento fakt je důležitý pro onkologického pacienta spíše z hlediska epidemiologie [6].
Výskyt postantibiotického průjmu u hospitalizovaných pacientů se pohybuje mezi 10–35%, u pacientů s febrilní neutropenií se popisuje incidence 29%, u pacientů po transplantaci kolem 20% [1,3,7,12]. Od roku 2003 incidence stoupá, současně se zvyšuje i závažnost a mortalita onemocnění. Podle studie kanadských lékařů vzrostla incidence CDAD z 35,6/100 000 obyvatel v roce 1991 na 156,3/100 000 obyvatel v roce 2003, tedy skoro pětinásobně. Nejvýrazněji byl tento vzestup pozorován u pacientů nad 65 let věku – ze 102,0 na 866,5 na 100 000 obyvatel. 30denní mortalita stoupla z 4,7% na 13,8% [13]. Byly zaznamenány epidemie CDAD v USA, Kanadě, státech západní Evropy (Velká Británie, Nizozemsko, Belgie, Francie, Německo, jeden případ byl popsán i v Rakousku – jednalo se ale o britskou turistku, bez dalšího epidemiologického šíření), dále byl hlášen trojnásobný vzestup incidence v Singapuru a v dalších vyspělých asijských státech [1,11,14,15]. Onemocnění, které jsme dříve považovali za typickou nozokomiální nákazu, nově, podle amerických a evropských studií až ve třetině případů, vzniká v komunitě. Za příčinu těchto epidemií jsou označovány hypervirulentní kmeny CD – zejména ribotypy 027, 001, 014, 046 a 106 (ribotyp 106 převažuje mezi komunitně získanými CDAD). Podle amerických a kanadských studií se jeví jako nejvýznamnější kmen – ribotyp 027 (nazvaný podle PCR ribotypizace), označovaný i zkratkou NAP1 (North American Pulsovar 1) podle diagnostiky založené na pulzní gelové elektroforéze (PFGE), kde vytváří specifický sled linií. Další způsobem identifikace je typizace PCR-REA (restriction endonuclease analysis), podle které je tento kmen 027/NAP1 řazen do toxinotypu III [11,16,17,18]. Podle kanadských autorů je popisována až 23% mortalita do 30 dnů od diagnózy CDAD u pacientů s infekcí způsobenou ribotypem 027, ve srovnání se 7% mortalitou v kontrolní skupině [18].
Vzhledem k výše uvedenému byla při Evropské společnosti pro klinickou mikrobiologii a infekční lékařství (ESCMID) zřízena speciální pracovní skupina nazvaná ESGCD (ESCMID Study Group on Clostridium Difficile). V ČR zatím Clostridium difficile nepodléhá epidemiologickému hlášení. V Praze ve FN Motol pod primářem MUDr. Otakarem Nyčem vznikla Pracovní skupina pro diagnostiku Clostridium difficile – zatím mikrobiologického zaměření, tento problém bude ale zcela jistě i u nás vyžadovat multidisciplinární přístup.
Rizikové faktory
K propuknutí CDAD je nutná kombinace infekce toxigenními kmeny CD a ztráty normální střevní ochranné bariéry. Za hlavní predisponující faktor je považována ATB expozice 1–8 týdnů před onemocněním. Přes 90% CDAD se vyskytuje po širokospektrálních ATB – aminopeniciliny, cefalosporiny (především 3. generace cefalosporinů), linkosamidy [2,19] – a podle nových poznatků i po fluorochinolonech III. generace (gatifloxacin, levofloxacin, moxifloxacin, ale i ciprofloxacin). Fluorochinolony byly dříve z hlediska postantibiotického průjmu považovány za bezpečný typ ATB, podle posledních údajů ale právě rezistence CD vůči chinolonům je jedním z důvodů vzestupu hypervirulentních kmenů CD. Za nejrizikovější z chinolonů jsou považovány gatifloxacin a levofloxacin, a to hlavně z hlediska infekce hypervirulentními kmeny. Podle nizozemské analýzy 50 zdravotnických zařízení, ve kterých se vyskytla CDAD, až 24% pacientů s infekcí CD ribotyp 027 užívalo fluorochinolony (vs 15,4% infikovaných jiným ribotypem CD). Podle amerických studií jsou fluorochinolony jako rizikový faktor infekce hypervirulentními kmeny hodnoceny dokonce hůře než clindamycin [13]. V nizozemské analýze byly ribotypy 001 a 014 obecně rezistentní vůči ciprofloxacinu, ribotyp 001 i vůči moxifloxacinu. Již na konci 80. let 20. století ale byla vyslovena teorie o chinolonech jako predisponujícím faktoru CDAD z důvodu velmi nízké in vitro senzitivity Clostridium difficile. Je tedy namístě otázka, zdali narůstající asociace mezi užíváním fluorochinolonů a CDAD jen nekoreluje s jejich narůstajícím použitím v posledních 30 letech – zejména v zemích Severní Ameriky a západní Evropy [19].
Z hlediska onkologického pacienta bychom rádi uvedli ještě studii německých autorů, kteří analyzovali skupinu hematoonkologických pacientů užívajících v období neutropenie ATB profylaxi – moxifloxacin versus levofloxacin. Jedním z výsledků této studie byl vysoký výskyt incidence CDAD – až 33% ve skupině užívající moxifloxacin vs 6% ve skupině užívající levofloxacin [17].
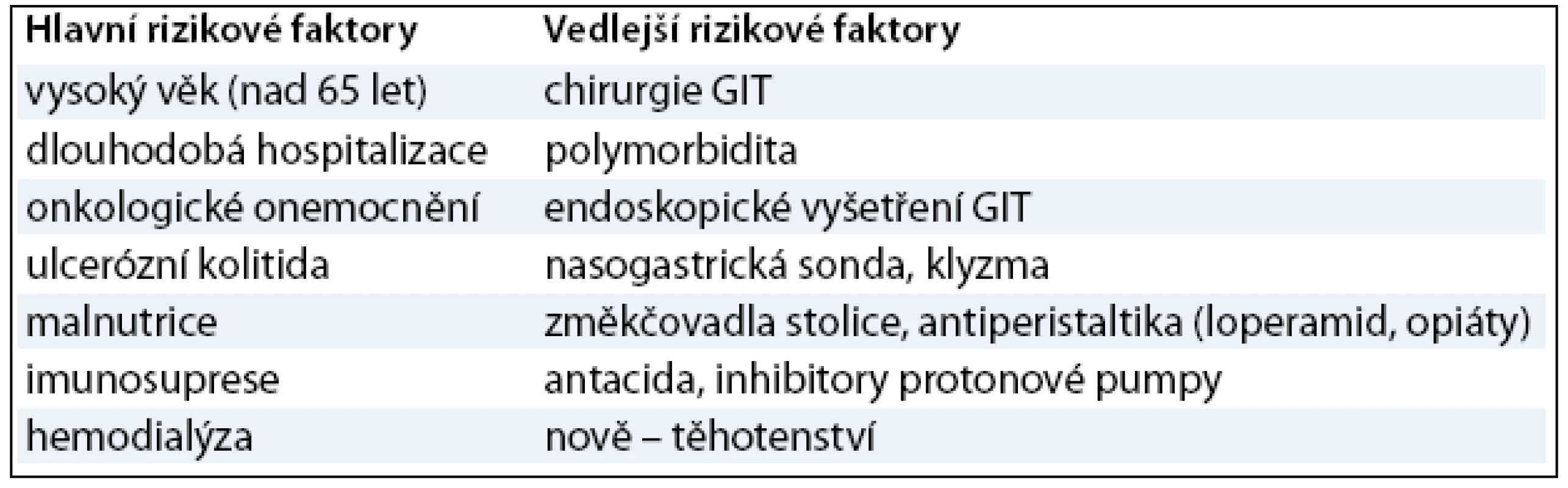
Obecně byly přehodnoceny i další rizikové faktory CDAD. Za nejdůležitější jsou nadále považovány dlouhá hospitalizace, vyšší věk (nad 65 let), imunosuprese a nově i onkologické onemocnění, malnutrice a ostatní uvedené v tab. 2. Méně důležitými jsou chirurgie GIT, polymorbidita, endoskopie GITu, tzv. změkčovadla stolice, antiperistaltika včetně oblíbeného loperamidu, opiáty, antacida, inhibitory protonové pumpy. Nově se ve skupině rizikových faktorů vyskytla gravidita, což je připisováno snížení střevní motility. V Atlantě v USA bylo popsáno 10 závažných případů CDAD u těhotných žen, z nichž tři zemřely (podle PubMed) [3,6,11,20,21].
Klinické projevy
Klinický obraz se rozvíjí od 4 dnů až do 6 týdnů od začátku expozice ATB, nejčastěji po 1–2 týdnech. Bývá různý, od mírného průjmu až po těžké stavy s pseudomembranozní kolitidou, s rozvojem toxického megakolon, MODS, event. i s fatálním koncem [3,6]. Podle učebnic se typicky jedná o onemocnění staršího, dlouho hospitalizovaného pacienta, léčeného širokospektrými antibiotiky, projevující se čtveřicí příznaků: průjmy, horečka, bolest břicha a leukocytoza.
Realita je ale často jiná, řada případů probíhá atypicky – v klinickém obraze mohou být jen řidší (kašovité) stolice (často hodnoceny u starších ležících pacientů jen jako inkontinentní stolice), meteorizmus, různá intenzita bolestí břicha, dyspepsie, hraniční subileózní stavy, event. i enteroragie. Horečky, subfebrilie a komplexní zánětlivá odpověď organizmu korelují se stavem imunitního systému, u imunosuprimovaných pacientů nemusí být komplexní zánětlivá odpověď vyjádřena. Podle nových poznatků až 10–20% pacientů nemá v anamnéze užívání antibiotik.
Fulminantní průběh onemocnění se vyskytuje v přibližně 3% případů. Projevuje se jako ileus, toxické megakolon nebo perforace střeva; jeho mortalita je 40–50%. Postihuje převážně starší pacienty, imunosuprimované, se sepsí v anamnéze a je spojen s leukocytózou (nad 50 000) a hyperlaktatemií (nad 5,0 mmol/l) [1,11,22,4]. Mortalita CDAD všeobecně je 2–5%, ve skupině oslabených pacientů ale až 10–20% [7].
Toto onemocnění se dále vyznačuje vysokým výskytem relapsů – 20%, přičemž relaps je definován jako návrat symptomů a průkaz infekce v průběhu dvou měsíců od úspěšné standardní terapie. Patogeneticky je relaps CDAD připisován následnému dozrávání spor perzistujících ve střevě pacienta i po úspěšném přeléčení CDAD [2]. Po přeléčení prvního relapsu je riziko dalších relapsů až 65% [7]. Vyšší riziko relapsu mají ženy – 60% [3], dalšími rizikovými faktory relapsu jsou věk nad 65 let, opakovaná expozice ATB, hypoalbuminemie pod 2,5g/dL a hospitalizace delší než 16 dnů [1]. Jako další komplikace CDAD jsou uváděny chronický průjem a perzistující hypoalbuminemie s následnými otoky [1].
Diagnóza a diferenciální diagnóza
Diagnóza CDAD je založená na klinickém obrazu a detekci CD toxinů A a B. Spolehlivou metodou je průkaz toxinu ve stolici nebo v tekuté střevní kultuře. Zlatým standardem býval test cytotoxicity na toxin B – s vysokou specificitou 99–100%, senzitivitou 80–90%. Nevýhodou je dostupnost výsledku až po 48 hodinách a detekce pouze toxinu B. Navíc tato zkouška vyžaduje práci s tkáňovými kulturami. Nejvíce používaný EIA (Enzyme Immuno Assay) průkaz toxinu A nebo obou toxinů A i B má specificitu 65–100%, senzitivitu jen 65–96%, výsledek je dostupný již za 4 hodiny a opakovaným prováděním tohoto testu se senzitivita významně zvyšuje. Izolace CD se stanovením cytotoxinů má specificitu přes 98% a senzitivitu 90%, dostupnost výsledků je ale až za 72–96 hod. PCR metoda detekce CD toxinu A a B má specificitu 100% senzitivitu 92–97%. Další hodnocení specificity a senzitivity vyšetření je uvedeno v tab. 3 [1,6]. Nově se celosvětově začaly v diagnostice používat molekulárně biologické metody – PCR ribotypizace, pulzní gelová elektroforéze (PFGE) a typizace PCR-REA (Restriction Endonuclease Analysis), standardně se ale zatím v ČR neprovádějí [11,23].
3. Diagnostické testy pro Clostridium difficile [1]. ![Diagnostické testy pro Clostridium difficile [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0786349f63e78fc766de2f57fc1e17f0.png)
Z dalších diagnostických metod, které mají význam pro diagnostiku, je třeba uvést endoskopické vyšetření střeva s bioptickým odběrem vzorku (v případě těžkého průběhu je ale riziko perforace, nevhodné je endoskopické vyšetření i u onkologických pacientů s pancytopenií). Endoskopicky bývá popisován typický obraz – nažloutlé ostrůvky pablán na sliznici. Při tomto jasném makroskopickém obrazu není nutná biopsie a toto vyšetření je považováno za alternativní průkaz onemocnění [1,11].
Ze zobrazovacích metod je doporučováno CT vyšetření, event. ultrazvuk, který je ale méně senzitivní. Nezastupitelnou úlohu v diagnostice komplikací má nativní RTG snímek břicha [11]. Včasnost diagnostiky má u fulminantní formy CDAD zásadní význam pro prognózu pacienta.
Diferenciálně diagnosticky je nutno myslet na stafylokokovou či jinou infekční enterokolitidu (Campylobacter, Shigella, Salmonella, E. coli, Listeria), neutropenickou enterokolitidu, poradiační kolitidu, chemickou kolitidu po chemoterapii, ischemickou kolitidu, Crohnovu nemoc a ulcerózní kolitidu [7].
Epidemiologická opatření a terapie
Pacienta s prokázanou CDAD je vhodné izolovat, a tak zabránit dalšímu šíření infekce – manipulace s pacientem v ochranném obleku, důsledná dezinfekce všech používaných nástrojů, rukou personálu, použití rukavic. Dalším krokem je vysazení užívaných antibiotik a léků spojených s rizikem alterace střevní flóry nebo alespoň jejich omezení [24].
V terapii se jako lék první volby doporučuje (podle Centers for Disease Control) metronidazol v dávkování 4 × 250mg nebo 2 × 500mg perorálně po dobu 10–14 dnů, event. (v indikovaných případech – paralytický ileus, zvracení, fulminantní průběh) je možné podávat metronidazol intravenózně 3 × 500mg.
Jako alternativa se používá vankomycin perorálně 4 × 125mg/den, který se ze střeva vstřebává minimálně (dosahuje ve stolici koncentrací přes 3 100 μg/g). Účinnost obou antibiotik je kolem 94% [3,6,7,24]. Podání vankomycinu se doporučuje u pacientů v kritickém stavu (event. v kombinaci s parenterálním metronidazolem) nebo v případech, kdy je metronidazol kontraindikován (alergie, intolerance, gravidita) či u CD rezistentních na metronidazol (nedávno byla popsána in vitro rezistence některých hypervirulentních kmenů). Jedná se o léčbu dražší a riskantní z hlediska výskytu vankomycin rezistentních enterokoků. Parenterální podání vankomycinu se nedoporučuje, při těžkém ileozním stavu je doporučeno podávat vankomycin klyzmatem v dávkování 4 × 500mg [1,7,11].
V první linii jsou v evropských datech jako stejně účinné uváděny teikoplanin (v dávce 2 × 200mg perorálně, ve srovnání s vankomycinem má delší poločas) s účinností 96%, kyselina fusidová (v ČR není registrována perorální forma, dostupná jen jako dermatologicum a oční kapky) s účinností 93% [1,24,25]. Dále jsou v dostupné literatuře jako účinné uváděny nitazoxamid, rifaximin, ramoplanin [1,11,26].
Z non antimikrobiálních léků se pacientům s CDAD podávají imunoglobuliny (v dávce 200–500mg/kg), probiotika a střevní adsorbencia [1,11,27]. Léčebný efekt parenterálních imunoglobulinů dosud nebyl ověřen žádnou dostatečně velkou studií. Dříve doporučovaná střevní adsorbencia colestipol a cholestyramin (vážou na sebe CD toxiny, ale vážou i vankomycin) jsou již nyní považována za nevhodná [1,2,11,24,28]. Nově je zkoušen polymer nazvaný tolevamer – vysokomolekulární polyanionní silice, která váže CD toxiny.
Z probiotik se za nejúčinnější považuje Saccharomyces boulardii (2 × 500mg po dobu čtyř týdnů), nepatogenní kvasinka, která produkuje protein interferující s toxinem A ve vazbě na jeho receptor [1], snižuje riziko relapsů o 50% (McFarland, 1994). Dále je doporučováno podávání Lactobacillus rhamnosus GG (20 × 109 U denně). Probiotika nejsou vhodná u oslabených a neutropenických pacientů (riziko iatrogenně navozené fungemie), mají ale nezastupitelnou úlohu v prevenci relapsů a v období rekonvalescence [11,29,30,31]. Navíc byl prokázán efekt v prevenci CDAD – hlavně již zmíněné Saccharomyces boulardii a Lactobacillus GG [32,33].
Nutná jsou dietní opatření, v těžkých případech je nezbytná rozsáhlá podpůrná terapie, intenzivní rehydratace, suplementace iontů, v indikovaných případech i plná parenterální výživa. V případě toxického megakolon nebo perforace střeva je indikována chirurgická léčba. Kolektomie byla hodnocena jako přínosná zejména u starších pacientů s leukocytózou 20,000–50,000/ml a s laktatémií pod 5 mmol/l. U pacientů s leukocytózou nad 50,000/ml a hyperlaktatémií nad 5 mmol/l nevedla ke snížení mortality. Vyšší úmrtnost byla spojena i s předoperačním MODS s nutností aplikace vazopresorů [11,34].
Patogeneze relapsu je dána přežíváním spor a jejich dozráváním na vegetativní formy CD. Nejedná se tedy o rezistenci na antibiotika. Proto se v terapii relapsu doporučuje opakování úvodní terapie metronidazolem či vankomycinem po dobu 10–14 dnů. Účinnost takové léčby je 92% [2,6,7,24,28]. V případě léčby vankomycinem možno terapii ponechat 4–6 týdnů, vankomycin se pak podává v postupné redukci dávky [6,7,24]. Podle dalšího ze schémat terapie relapsu se doporučuje současné podávaní vankomycinu 4 × 125mg a probiotika Saccharomyces boulardii 2 × 500mg po dobu 7 dnů, následováno samotným podáváním probiotik [2,6,7,24,28,35]. Spory CD přežívají na povrchu nástrojů a ploch až 5–6 měsíců [7], proto je prevence šíření infekce založena na důkladné dezinfekci všech povrchů, mytí rukou mýdlem, izolaci nakažených pacientů zahrnující použití rukavic v kontaktu s pacientem, dále racionalizace a redukce používání širokospektrálních antibiotik.
Pro zajímavost: U 18 pacientů s refrakterním průběhem byl provedeny pokusy o obnovu normální střevní flóry podáváním tzv. stool infusions od zdravých dárců – podle autorů s efektem [36].
Soubor našich pacientů
V letech 2004–2008 jsme i na naší klinice pozorovali zvýšený výskyt CDAD, což epidemiologicky mohlo souviset s nárůstem počtu onemocnění v Evropě (bohužel bez potvrzení molekulárně biologickými diagnostickými metodami). Celkem jsme do hodnoceného souboru zařadili 36 pacientů s primární onkologickou diagnózou, 16 žen a 20 mužů. Věkový průměr byl 55,33 let (v rozmezí 24–87), pouze 6 pacientů v souboru (16%) bylo ve věku nad 65 let.
Diagnóza CDAD byla stanovena na základě klinického obrazu a opakované pozitivity CD toxinů ve stolici metodou EIA (min. dvě pozitivní stolice). Podle základní diagnózy převažovali pacienti s hematologickými a kolorektálními malignitami (52%). Rozvrstvení základních onkologických diagnóz v souboru je uvedeno v tab. 4.
4. Základní onkologická diagnóza u pacientů s CDAD . 
Všichni tito pacienti byli na naší klinice primárně léčeni onkologickou léčbou, nejvíc pacientů (28) bylo léčeno chemoterapií (z toho u 9 pacientů došlo ke vzniku CDAD již po prvním cyklu chemoterapie), 6 pacientů bylo léčeno radioterapií pánve (z toho 4 měli kombinovanou léčbu – chemoradioterapií) a 2 pacienti byli léčeni jinou radioterapií (1× orofaryngeální oblast, 1× mediastinum). Dva pacienti ve skupině byli v průběhu CDAD vedeni a léčeni ambulantně, ostatní (94,5%) byli hospitalizováni. Ve skupině hospitalizovaných byl průjem již při přijetí u 16 pacientů (44%), u 18 pacientů průjem vznikl za hospitalizace (50%).
Z hlediska rizikových faktorů 7 pacientů (20%) nemělo v období předchozích osmi týdnů ATB expozici (graf 1), u ostatních 29 pacientů převažovala expozice cefalosporinům a fluorochinolónům, 14 pacientů užívalo ATB perorálně, 15 pacientů parenterální formou.
1. ATB expozice v sledovaném souboru. 
15 pacientů (41,67%) mělo v anamnéze kolorektální malignitu a/nebo resekční operace gastrointestinálního traktu. U 27 pacientů (75%) byla zjištěna hypoalbuminemie (u 2 pacientů neměřeno), 22 pacientů (61%) mělo prokázanou malnutrici (nízké hladiny prealbuminu), prealbumin jsme ale nehodnotili u všech pacientů. Z dalších imunosupresivních vlivů převažoval diabetes mellitus (7 pacientů), hepatopatie (5 pacientů), nefropatie (3 pacienti). Komorbidně se nejčastěji vyskytovala ischemická choroba srdce a arteriová hypertenze.
Leukocytózu (graf 2) jsme zaznamenali pouze u 19 (52%) pacientů, z toho jen 22% přesahovalo hodnoty nad 20 000/ml leukocytů. U 20 pacientů 55,5% byl průběh CDAD spojen s febrilní neutropenií.
2. Leukocytóza ve sledovaném souboru. 
Hodnoty CRP (c reaktivní protein) naproti tomu korelovaly s klinickým obrazem – jen čtyři pacienti měli CRP v normě (u všech probíhala nemoc lehkou formou), 15 pacientů (42%) mělo hodnoty CRP přes 200mg/l (obr. 1).
1. Hladina CRP v průběhu CDAD ve sledovaném souboru. 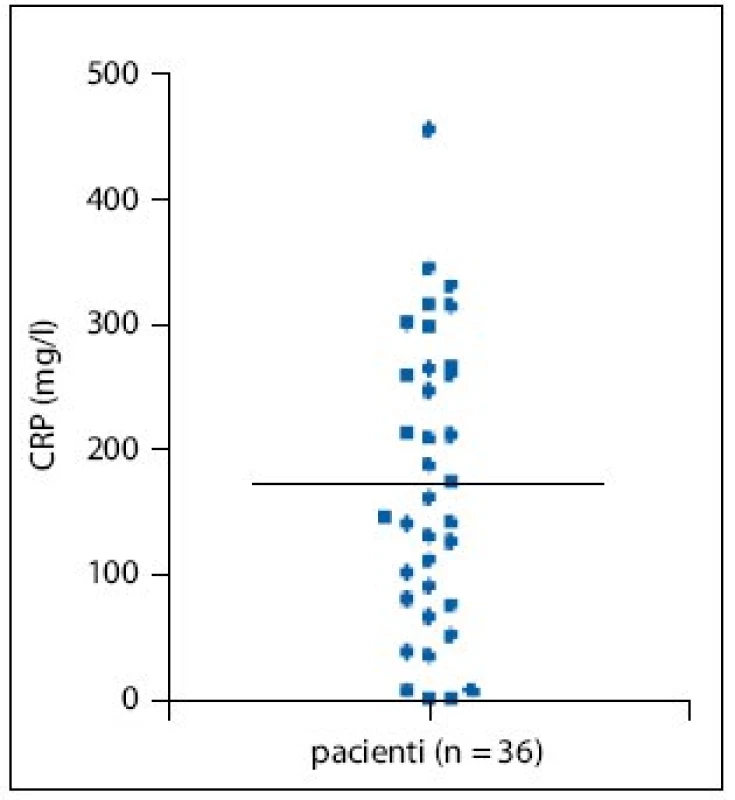
V rámci zobrazovacích diagnostických metod jsme u pacientů nejčastěji vyšetřovali RTG nativní snímek břicha – u 27 pacientů, z toho u 15 pacientů (41,6%) byly na snímku popisovány hladiny stagnujícího střevního obsahu, nejčastěji označováno jako několik drobných hladin v oblasti tenkých střevních kliček, což jsme hodnotili jako subileózní stav. CT vyšetření s průkazem zánětlivého prosáknutí a infiltrace stěny střeva bylo provedeno u 6 pacientů. U 2 pacientů byl střevní zánět popsán ultrazvukovým vyšetřením břicha.
U všech pacientů bylo nejméně ve dvou vzorcích stolice pozitivní vyšetření EIA CD toxinů, u 11 pacientů (30%) byla pozitivní anaerobní kultivace Clostridium difficile. U 20 pacientů byla diagnostikována koinfekce ve stolici, ve 12 případech se jednalo o 1 patogen, v 8 případech o kombinaci 2–3 patogenů. U 14 pacientů jsme diagnostikovali kandidovou koinfekci ve stolici (převážně Candida albicans, 2× v kombinaci s Candida tropicalis, 1× samotná Candida glabrata, 1× samotná Candida krusei), u 6 pacientů Staphylococcus aureus, u dvou pacientů Pseudomonas aeruginosa, po jednom Morganella morganii, Proteus mirabilis, Acinetobacter lwofii. U všech pacientů s kandidovou koinfekcí jsme zjistili kvasinkovou kolonizaci i z jiných kultivačních odběrů. 7 pacientů v souboru mělo pozitivní hemokulturu, převážně se jednalo o gramnegativní patogeny (E. coli, E. coli haemolytica, Serratia marcescens), v jednom případě šlo o stafylokoky koagulaza negativní. U jedné pacientky byla zjištěna současná cytomegalovirová infekce.
Klinický průběh CDAD u našich pacientů se pohyboval od mírných forem až po těžké případy s MODS. Celkově jsme pozorovali velmi těžký průběh s MODS u 7 pacientů (20%). U 20 pacientů byl stav komplikován febrilní neutropenií (55,5%). 41,6% pacientů mělo poruchu pasáže gastrointestinálním traktem, co bylo řešeno převážně konzervativně – pouze v jednom případě byl proveden resekční výkon (colon sigmoideum) s histologickým průkazem pseudomembranózní kolitidy. U 8 pacientů (22,2%) jsme prokázali relaps onemocnění – 4 muži, 4 ženy, u 6 pacientů v souboru nezjištěno. 2 pacienti v souboru zemřeli v průběhu CDAD (5,6%), u obou se ale jednalo o generalizované základní onemocnění. (1. pacient – MODS, hemoragický šok – krvácení do GIT – TU infiltrace duodena, generalizace základního onemocnění, 2. pacient – MODS, generalizace základního onemocnění, relaps CDAD). Do čtyř měsíců po odeznění CDAD zemřeli další 2 pacienti – oba na generalizaci základního onemocnění.
V terapii jsme častěji použili metronidazol v monoterapii – 19 pacientů (52%), event. v kombinaci s perorálním vankomycinem – 17 pacientů (48%). U 5 pacientů byla léčba kombinována s rifaximinem, u 30 pacientů jsme přidávali probiotika – Saccharomyces boulardii (2 × 500mg/den). Délka podávání metronidazolu byla nejčastěji 10–14 dnů (28 pacientů), vankomycin byl podáván nejčastěji rovněž 10–14 dnů (13 pacientů). U 7 pacientů jsme museli podávat metronidazol přes 3 týdny, maximálně 9 týdnů (pro těžký protrahovaný průběh nebo z důvodu relapsů), vankomycin byl nejdéle podáván 2 × 21 dnů (1 pacient), 5 týdnů u dvou pacientů a 3 týdny u jednoho. Průběh byl nejčastěji komplikován malnutricí, mukozitidou a subileozním stavem. U 14 pacientů (39%) jsme podpůrně podávali parenterální výživu, v 6 případech byly podávány vazopresory.
Kazuistika
Pro kompletní obraz o možném průběhu CDAD u onkologického pacienta zde uvádíme jednu z kazuistik. Jednalo se o ženu, ve věku 31 let, se základní diagnózou Hodgkinova lymfomu, typu nodulární skleróza, stadium IIB, s bulky postižením mediastina. Léčena na naší klinice chemoterapií v režimu BEACOPP. U pacientky byla v průběhu léčby navíc diagnostikována osteoporóza v.s. po kortikoidech, s kompresivní frakturou L1-2 (podle magnetické rezonance), s korzetem a s omezenou hybností (osteoporóza potvrzena denzitometrií). 12. 10. 2006 byla pacientka přijata pro febrilní neutropenii IV. stupně podle WHO a pancytopenii po chemoterapii (CHT). Klinicky v úvodu udávala 1× zvracení, tři stolice denně – kašovité konzistence, bez jednoznačného průjmu, bolesti páteře, soor v dutině ústní, horečka, v laboratorních parametrech hluboká neutropenie, CRP: 203mg/l, přijata na JIP naší onkologické kliniky, empiricky zahájena ATB terapie ve složení ceftazidim, ciprofloxacin, pro soor v DÚ – empiricky flukonazol (kultivačně později potvrzena z úst Candida albicans), podány G CSF (granulocyty stimulující faktor). Stav se zlepšoval, 16. 10. 2006 vybavena z neutropenie, CRP kleslo na 57mg/l, klinicky ale pokračují kašovité stolice s frekvencí maximálně tři stolice denně. 19. 10. 2006 došlo ke zhoršení stavu, CRP: 115mg/l, stolice řídká, nauzea, bolesti břicha (po celou dobu přetrvávala trombocytopenie III.–IV. stupně podle WHO). Empiricky nasazen metronidazol 4 × 250mg perorálně, antidiarrhoika, ve stolici následně opakovaně zjištěny pozitivní CD toxiny. Provedena komplexní opatření, izolace pacientky, úprava diety, 24. 10. 2006 dochází k dalšímu zhoršení stavu – vzestup CRP na 198mg/l, nové febrilie, nauzea, zvracení, zjištěna těžká malnutrice – prealbumin: 0,04g/l, albuminemie 21g/l. Vzhledem ke zhoršování stavu zastavena enterální výživa, zahájena plná parenterální výživa. Doplněn RTG nativní snímek břicha, kde byla popsána pneumatóza střeva, bez hladin. Pacientka již byla na perorálním metronidazolu, proto vzhledem ke zhoršení stavu do terapie přidán perorální vankomycin. Den poté 25. 10. 2006 dochází k rozvoji šokového stavu s těžkou hypotenzí, další vzestup CRP na 269mg/l, do terapie přidány vazopresory, konzultován chirurg – indikována konzervativní terapie, laboratorně přítomny známky mírné hepatopatie, trvá trombocytopenie (bez krvácivých projevů). Stav následně opětovně zlepšen, 27. 10. 2006 CRP klesá na 74mg/l, klinicky ale nadále tři řídké stolice denně. Zahájena postupná perorální realimentace, tekutiny, postupně zátěž stravou. 31. 10. 2006 již CRP v normě, pokračuje zátěž stravou, stolice nadále kašovitá 2–3 za den. 1. 11. 2006 další zhoršení stavu, febrilie, další vzestup zánětlivých parametrů, z hemokultury hlášeny gram pozitivní koky, proto následně přidán empiricky parenterální piperacilin/tazobactam a pro uroinfekt (Klebsiella pneumoniae v moči – rezistentní na cefalosporiny a aminopeniciliny) od 3. 11. 2006 i parenterální gentamicin. Hemokultury z 1. 11. 2006 později určeny jako Staphylococcus haemolyticus. Piperacilin/tazobactam v kombinaci s gentamicinem ponechány, současně pokračovala terapie perorálním vankomycinem (metronidazol ukončen 15. den podávání). Stav následně zlepšen, bez febrilií, CRP klesá. 8. 11. 2006 zjištěna enteroragie – stolice nadále kašovitá, nově ale s příměsí čerstvé krve, ukončena parenterální ATB terapie, podány transfuze trombocytů, hemostyptika. Doplněno CT břicha, kde popsáno výrazné prosáknutí a rozšíření stěny tračníku v celém rozsahu, s lemy tekutiny v okolí colon ascendens, postižení zasahuje až k oblasti rekta, kde se stěna jeví v aborálním úseku již štíhlá. Pacientka dodatečně udávala v rodinné anamnéze Crohnovu nemoc u bratra, proto konzultován gastroenterolog, endoskopie z hlediska trombocytopenie a CT nálezu považována za rizikovou, k perorálnímu vankomycinu přidána kyselina 5-aminosalicylová perorálně a metylprednizolon 40mg/den parenterálně, později podáváno obden. Léčba s efektem, stav zlepšen, stolice bez příměsí krve, CRP normalizováno, vankomycin podáván celkem 25 dnů. Doplněno kontrolní CT mediastina, kde nadále nález bulky postižení mediastina jen v parciální regresi, proto podána radioterapie na oblast mediastinálního tumoru a v dalším průběhu pacientka přeložena na neurochirurgickou kliniku ke stabilizační operaci páteře (při překladu v terapii kys. 5-aminosalicylová, Saccharomyces boulardii 2 × 500mg). Na neurochirurgii hospitalizována do 6. 12. 2006. 30. 11. 2006 zde došlo k opětovnému zhoršení stavu – bolesti břicha, zvracení, řídká stolice, doplněno chirurgické konzilium – podávána spasmolytika, antiemetika, bez efektu. 6. 12. 2006 byla pacientka přeložena zpět na naši JIP v hypovolemickém šoku, s projevy MODS, dehydratovaná (laboratorně projevy renální a hepatální insuficience, CRP: 219mg/l, albumin: 18g/l), opětovně pancytopenická, s neutropenií IV. stupně podle WHO. Nasazen zpátky perorální vankomycin s metronidazolem a vzhledem k celkově špatnému stavu i empiricky meropenem s flukonazolem parenterálně. Po intenzivní rehydrataci (včetně aplikace koloidů), opakovaně podány transfuze trombocytů i erytrocytů, aplikovány G CSF, plná parenterální výživa, vazopresory, albumin, dochází k zlepšení stavu. Stolice opakovaně pozitivní na CD toxiny, proto metronidazol s vankomycinem podávány dalších 20 dnů, s efektem a zlepšením stavu, dimitována 27. 12. 2006 v dobrém stavu. Následně provedeno PET/CT vyšetření 4. 1. 2007, podle kterého pacientka bez vitální nádorové masy. Dosud je dispenzarizována s kompletní remisí základního onemocnění.
Závěr
CDAD je pro onkologického pacienta komplikací, která může významně ovlivnit kvalitu života, průběh onkologické léčby i prognózu základního onemocnění. V této skupině pacientů onemocnění postihuje i relativně mladší pacienty, event. možno říct, že postihuje všechny věkové kategorie. Podle naší malé studie je vyšší riziko onemocnění u pacientů s lymfomy a kolorektální malignitou, dále u pacientů s anamnézou chirurgického výkonu na gastrointestinálním traktu. 20% našich pacientů nemělo předchozí ATB expozici, což nás vede k vyslovení teorie o onkologické terapii jako predispozičním faktoru CDAD. Vyvstává i otázka, jakou důležitost v rámci rizikových faktorů má radioterapie břicha nebo pánve. U onkologického pacienta se závažnost onemocnění nedá hodnotit podle leukocytózy, k leukocytóze došlo jen u poloviny pacientů (výrazný podíl febrilní neutropenie v průběhu onemocnění v našem souboru). U imunosuprimovaných pacientů může mít toto onemocnění i vleklý a subklinický průběh vyžadující kombinovanou terapii a intenzivní podpůrnou péči. Ve skupině onkologických pacientů je rovněž vyšší riziko fulminantního průběhu onemocnění s MODS, event. i zpočátku s chudou klinickou symptomatologií, ale se závažným průběhem a častými relapsy. To všechno znamená pro onkologického pacienta přinejmenším odklad, v horších případech zastavení probíhající onkologické terapie. Proto by se měl klást velký důraz na prevenci této infekce u onkologicky nemocných a na racionalizaci použití rizikových skupin antibiotik.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Alexandra Ligová
Klinika onkologická
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: sligova@yahoo.com
Sources
1. Aslam S, Musher DM. An Update on Diagnosis, Treatment and Prevention of Clostridium difficile-Associated Disease. Gastroenterol Clin N Am 2006; 35 : 315–335.
2. Joyce AM, Burns DL. Reccurent Clostridium difficile colitis Tackling a tenacious nosocomial infection. Postgraduate Medicine. Minneapolis 2002; 112(5): 53.
3. Surawicz CM. Antibiotic – Associated Diarrhea an Pseudomembranous Colitis: Are They Less Common with Poorly Absorbed Antimicrobials? Chemotherapy 2005; 51 (Suppl 1): 81–89.
4. Kelly CP, LaMont JT. Clostridium difficile infection. Ann Rev Med 1998; 49 : 375–388.
5. Jedličková A. Antimikrobiální terapie. 1. vyd. Praha: Jesenius Maxdorf 2004.
6. Poutanen SM, Simor AE. Clostridium difficile associated diarrhea in adults. Can Med Assoc J 2004; 171(6): 51–56.
7. Yasin SF, Young-Fadok TM, Zein NN et al. Clostridium difficile-Associated Diarrhea and Colitis. Mayo Clin Proc 2001; 76(7): 725–730.
8. Lee KS, Shin WG, Jang MK et al. Who are Susceptible to Pseudomembranous Colitis Among Patients with Presumed Antibiotic-Associated Diarrhea? Dis Colon Rectum 2006; 49(10): 1552–1558.
9. Riley TV. Epidemic Clostridium difficile. Med J Aust 2006; 185(3): 133–134.
10. Barlett JG. Narrative Review: The New Epidemic of Clostridium difficile – Associated Enteric Disease. Ann Int Med 2006; 145(10): 758–764.
11. Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin Mikrobiol Inf Lék 2006; 12(6):247–251.
12. Dettenkofer M, Ebner W, Bertz H et al. Infections Post Transplant. Surveillance of nosocomial infections in adults recipients of allogeneic and autologous bone marrow and perpheral blood sterm-cell transplantation. Bone Marrow Transplant 2003; 31 : 795–801.
13. Norén T. Outbreak from a high toxin intruder: Clostridium difficile. Lancet 2005; 366(9491): 1053–1054.
14. Louie TJ. How should we respond to the highly toxogenic NAP1/ribotype 0,27 strain of Clostridium Difficile? Can Med Assoc J 2005; 173(9): 1049–1050.
15. Warny M, Pepin J, Fang A et al. Toxin Production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366(9491): 1079–1084.
16. Deshpande A, Pant C, Jain A et al. Do fluoroquinolones predispose patients to Clostridium difficile associated disease? A review of the evidence. Curr Med Res Opin 2008; 24(2): 329–333.
17. von Baum H, Sigge A, Bommer M et al. Moxifloxacin prophylaxis in neutropenic patients. J Antimicrob Chemotherapy 2006; 58 : 891–894.
18. Pépin J, Valiquette L, Cossette B. Mortality attributable to nosocomial Clostridium difficile associated disease during an epidemic caused by a hypervirulent strain in Quebec. Can Med Assoc J 2005; 173(9): 1037–1041.
19. Thomas C, Stevenson M, Riley TV. Antibiotics and hospital-acquired Clostridium difficile associated diarrhoea: a systematic review. J Antimicrob Chemotherapy 2003; 51(6): 1339–1350.
20. Louie TJ, Meddings J. Clostridium difficile infection in hospital: risk factors and responses. Can Med Assoc J 2004; 171(1): 45–46.
21. Dial S, Alrasadi K, Manoukian C et al. Risk of Clostridium difficile diarrhea among hospital inpatients prescribed proton pump inhibitors: cohort and case-control studies. Can Med Assoc J 2004; 171(1): 33–38.
22. Grover S, Hamilton MJ. Refractory Clostridium difficile associated Diarrhea. Med Gen Med 2007; 9(2): 46.
23. van den Berg RJ, Vaessen N, Endtz HP et al. Evaluation of real-time PCR and conventional diagnostic methods for the detection of Clostridium difficile associated diarrhoea in prospective multicentre study. J Med Microbiol 2007; 56 : 36–42.
24. Mylonakis E, Ryan ET, Calderwood SB. Clostridium difficile – associated diarrhea: A review. Arch Int Med Chicago 2001; 161(4): 525–533.
25. Wullt M, Odenholt I. A double-blind randomized controlled trial of fusidic acid and metronidazole for treatment of an initial episode of Clostridium difficile associated diarrhoea. J Antimicrob Chemotherapy 2004; 54(1): 211–215.
26. Musher DM, Logan N, Hamill R et al. Nitazoxanide for the Treatment of Clostridium difficile Colitis. Clin Infect Dis 2006; 43 : 421–427.
27. Murphy C, Vernon M, Cullen M. Intravenous immunoglobulin for resistant Clostridium difficile infection. Age Ageing 2006; 35 : 85–86.
28. Kyne L, Kelly CP. Recurrent Clostridium difficile diarrhoea. Gut 2001; 49(1): 152–153.
29. McFarland L. Meta Analysis of probiotics for the prevention of antibiotic Associated Diarrhea and the Treatment of Clostridium difficile Disease. Am J Gastroenterol 2006; 101 : 812–822.
30. Dendukuri N, Costa V, McGregor M et al. Probiotic therapy for the prevention and treatment of clostridium difficile associated diarrhea: a systematic review. Can Med Assoc J 2005; 173(2): 167–170.
31. Herbrecht R, Nivoix J. Saccharomyces cerevisiae Fungemia: An Adverse Effect of Saccharomyces boulardii Probiotic Administration. Clin Infect Dis 2005; 40(11): 1635–1637.
32. D’Souza AL, Rajkumar C, Cooke J et al. Probiotics in prevention of antibiotic associated diarrhoea: meta analysis. Br Med J 2002; 324(7350): 1361–1364.
33. Greenberger NJ, Sharma P. Update in Gastroenterology and Hepatology. Ann Int Med 2004; 141(5): 374.
34. Ali SO, Welch JP, Dring RJ. Early sugrical Intervention for Fulminant Pseudomembranous Colitis. Am Surg 2008; 74(1): 20–26.
35. Pham M, Lemberg DA, Day AS. Probiotics: sorting the evidence from the myths. Med J Aust 2008; 188(5): 304–308.
36. Aas J, Gessert CE, Bakken JS. Recurrent Clostridium difficile colitis: case series involving 18 patients treated with donor stool administered via nasogastric tube. Clin Infect Dis 2003; 36(5): 580–585.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue 3-
All articles in this issue
- New Radiopharmaceuticals and Positron-emission Tomography Applications at the Masaryk Memorial Cancer Institute in Brno
- Use of PET/CT Examination in Head and Neck Cancer Radiotherapy Planning
- Long term Results of Surgical Treatment of Pulmonary Metastases in Germ Cell Testicular Cancer Patients
- Clostridium Difficile Associated Diarrhoea –Problem of Oncological Patient?
- Lenalidomide in the Treatment of Multiple Myeloma
- Comments on the 4th WHO Classification of Lymphomas
- Evaluation of Aromatase Inhibitors’ Side Effects in Clinical and Experimental Studies
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Evaluation of Aromatase Inhibitors’ Side Effects in Clinical and Experimental Studies
- Use of PET/CT Examination in Head and Neck Cancer Radiotherapy Planning
- Clostridium Difficile Associated Diarrhoea –Problem of Oncological Patient?
- New Radiopharmaceuticals and Positron-emission Tomography Applications at the Masaryk Memorial Cancer Institute in Brno
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career