-
Medical journals
- Career
Galektin-3: patofyziologie, analytické charakteristiky, interpretační meze a biologická variabilita
Authors: J. Franeková 1,2; A. Jabor 1,2
Authors‘ workplace: Oddělení klinické biochemie, Pracoviště laboratorních metod, Institut klinické a experimentální medicíny, Praha 1; Ústav imunologie a klinické biochemie, 3. lékařská fakulta Univerzity Karlovy, Praha 2
Published in: Klin. Biochem. Metab., 30, 2022, No. 3, p. 68-72
Overview
Galektin-3, člen rodiny solubilních neglykosylovaných lektinů, patří mezi novější biomarkery s prognostickou rolí u onemocnění srdce, ale také plic, ledvin, jater a dalších orgánů. Má prozánětlivé a profibrotické účinky, podílí se na patofyziologii rozvoje srdečního selhání. Existuje automatizovaná analytická metoda stanovení galektinu-3 s robustními analytickými znaky. Jsou známá referenční rozmezí i rozhodovací limity; v kardiologické literatuře panuje shoda o zvýšeném riziku horší prognózy podmíněné fibrózou a zánětem při koncentracích galektinu-3 nad 18 μg/L. Je známá biologická variabilita u zdravých osob i u pacientů, hodnoty koncentrací galektinu-3 jsou v čase stabilní. Nejvíce dat o galektinu-3 se týká kardiologické diagnostiky, patří mezi biomarkery s možným využitím u srdečního selhání, infarktu myokardu, transplantace srdce a dalších kardiologických jednotek, má také roli u dalších onemocnění. Vzhledem k připravované úhradě podle Seznamu výkonů a jeho diagnostickému a prognostickému potenciálu jde o biomarker vhodný pro použití v běžné klinické praxi.
Klíčová slova:
referenční interval – Galektin-3 – analytické znaky – rozhodovací meze – biologická variabilita
Přehled galektinů
Galektiny tvoří rodinu solubilních neglykosylovaných lektinů s malou molekulovou hmotností (14-39 kDa). Vykazují afinitu k beta-galaktosidovým strukturám lokalizovaným v karbohydrátové rozpoznávací doméně (CRD); rozlišuje se zatím 17 galektinů, u savců je dobře popsaných 15 různých typů (Tabulka 1).
Table 1. Basic description of galectin family members. Adapted from The UniProt Consortium. UniProt: the universal protein knowledgebase in 2021. OMIM® - Online Mendelian Inheritance in Man®. 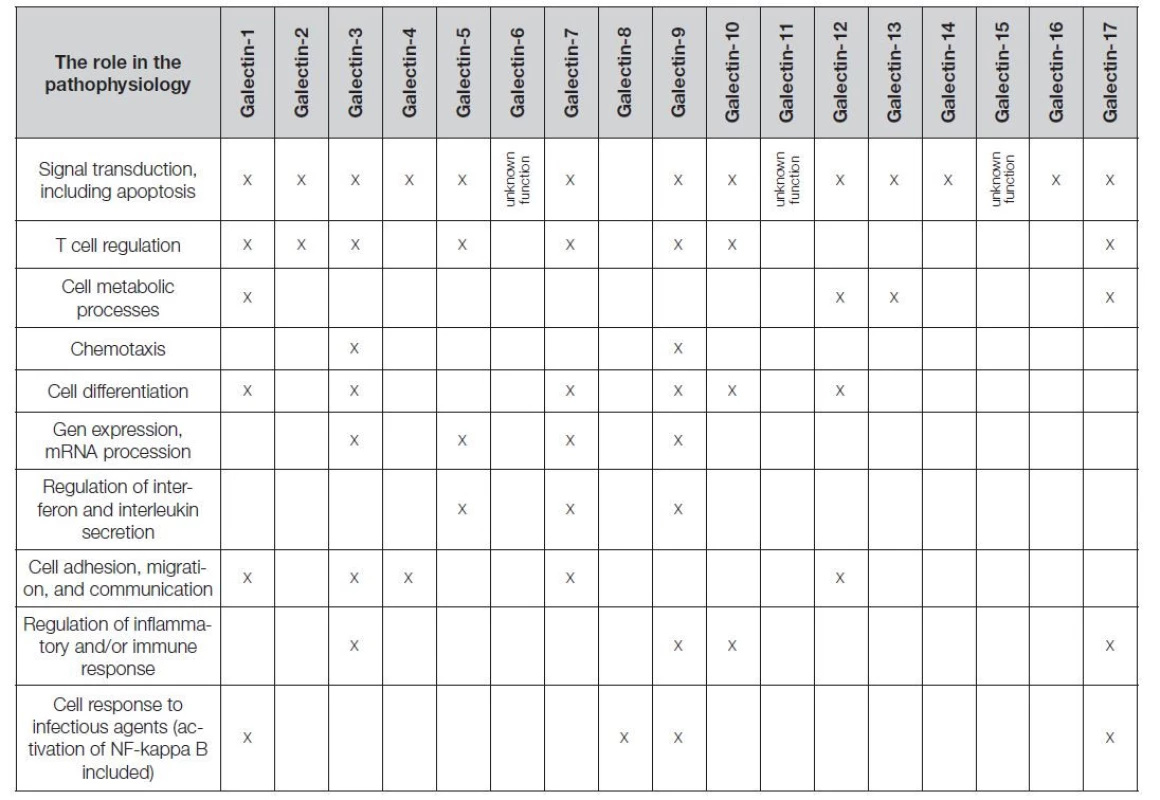
Syntéza a struktura
Galektiny jsou syntetizovány na volných ribozómech v cytosolu buněk, nemají signální sekvence a pronikají membránami tzv. „non-classical secretion“ mechanismem (exosomální sekrecí). Tímto mechanismem se dostávají do intracelulárních a extracelulárních vesikul. Na povrchu buněk vytvářejí s glykosylovanými ligandy příčné vazby, které tvoří dynamickou mřížku, která reguluje různé děje, jako je difuze, endocytóza membránových glykoproteinů, glykolipidů a další. Mezi hlavní funkce galektinů patří „cell-to-cell“ interakce, „cell-to - -matrix“ interakce, ovlivnění růstu a diferenciace buněk, regenerace buněk, aktivace a regulace imunitních buněk, ovlivnění fibroblastů a vytvoření profibrotického prostředí v různých tkáních.
Vzhledem k tomu, že galektiny jsou syntetizovány v cytoplazmě, je známá také jejich bohatá interakce s jádrem buněk a jinými intracelulárními kompartmenty [1,2]. Právě exprese a intracelulární lokalizace galektinů a také jejich průchod do extracelulárních vesikul může poskytovat prognostickou a diagnostickou informaci u různých závažných stavů. I když je patofyziologie galektinů hodně zkoumaná, jednoznačný přenos poznatků do klinické praxe zatím chybí, s výjimkou použití galektinu-3 u srdečního selhání.
Galektiny se podle struktury dělí na tři skupiny [3]:
1. Prototypové galektiny (Prototype), které obsahují samostatnou CRD doménu, s možností tvořit nekovalentní homodiméry
2. V tandemu se opakující typ (Tandem-repeat type), v tomto případě jsou dvě CRD domény spojeny peptidovým můstkem
3. Chimerický typ (Chimera-type), který je tvořen jednou CRD doménou a polypeptidovým aminoterminálním řetězcem.
Galektin-3 je zástupcem třetí uvedené skupiny (obr. 1).
Fig. 1: Classification of galectin based on structural characteristics (according to [3]). Prototype galectins comprise Gal-1, -2, -5, -7, -10, -11, -13, -14, -15; tandem-repeat type galectins comprise Gal-4, -6, -8, -9, -12; the only chimera-type is Gal-3. ![Fig. 1: Classification of galectin based on structural characteristics
(according to [3]). Prototype galectins comprise Gal-1,
-2, -5, -7, -10, -11, -13, -14, -15; tandem-repeat type galectins
comprise Gal-4, -6, -8, -9, -12; the only chimera-type is Gal-3.](https://pl-master.mdcdn.cz/media/image_pdf/9842bb6675194367273b7652a17ecd53.jpg?version=1663258370)
Patofyziologie
Nejvíce popsané galektinové molekuly jsou galektin - 3 a galektin-9. Galektin-3 (Carbohydrate-binding protein 35, CBP 35; macrophage galactose-specific lectin 3; Mac-2 antigen, MAC2; galactoside-binding protein, GALBP; GAL3; IgE-binding protein; Laminin - -binding protein; Lectin L-29) byl poprvé popsán Hoem a Springerem jako Macrophage sub-population specific marker [4, 5]. Je členem lektinové rodiny, kódován genem LGALS3, lokus 14q22.3, molekulová hmotnost 35 kDa (odtud také název CBP 35). Podobně jako ostatní galektiny je také galektin-3 syntetizován v cytoplazmě buněk, s výskytem v jádře, mitochondriích, na povrchu buněk a v extracelulární matrix.
Jde o evolučně konzervativní chimerický protein, jeho C-terminální karbohydrátová doména (CRD) je propojená prolinem, glycinem a tyrosinem s N-terminální doménou. Prostřednictvím CRD domény se galektin-3 váže na povrchové glykoproteiny, dochází k oligomerizaci a vytváření galektinových sítí.
Galektin-3 má bohatou intra - i extracelulární komunikaci s jádrem, povrchem buněk a extracelulární matrix. Může ovlivňovat prezentování receptorů na povrchu buněčné membrány a modifikovat laterální pohyb receptorů v membráně a tím přispívat ke změnám jejich funkčnosti. Uplatňuje se také v intracelulárních interakcích mezi jádrem, mitochondriemi a molekulárními cytoplasmatickými strukturami. Reguluje tak základní buněčné funkce včetně regulace genové transkripce v jádře, buněčného růstu a diferenciace, komunikace mezi buňkami (aktivace buněk a chemoatrakce), mezi buňkami a extracelulární matrix. Dochází k ovlivnění růstu, proliferace a diferenciace buněk, modifikaci prozánětlivých a profibrotických procesů a řízení apoptózy. Galektin-3 je z uvedených důvodů zapojen do patofyziologie mnoha onemocnění od fibrózy, přes zánět až k nádorovým onemocněním různých tkání.
Galektin-3 se vyskytuje v makrofázích, epiteliálních i endoteliálních buňkách, dendritických buňkách, ale i v dalších buňkách různých tkání, které mohou být ovlivňovány a modulovány extracelulárním galektinem-3. Za fyziologických podmínek je nejvyšší exprese galektinu-3 v plicích, slezině, žaludku, střevu, ovariu a uteru. Střední exprese v játrech, ledvinách a nadledvinách, nízká exprese v srdci a pankreatu [6]. Galektin-3 je jedním z faktorů s významnou rolí v počátku reparace tkáně. Jeho syntéza je v jednotlivých tkáních indukovatelná; například v intaktním myokardu je exprese velice nízká, ale při poškození nastává rapidní vzestup. Galektin - 3 je tedy multifunkční protein, vyskytující se v různých tkáních, ve kterých modifikuje jejich funkce a má vliv na rozvoj a průběh řady patofyziologických stavů.
Galektin-3 má multifunkční roli v patogenezi zánětu. Je exprimován buňkami innátní imunity a uplatňuje se při akutním zánětu jako ligand pro Toll like receptory, pravděpodobně působí také jako DAMP (Damage/ Danger-Associated Molecular Pattern), aktivuje neutrofily a inhibuje apoptózu neutrofilů. Extracelulárně naopak inhibuje cytotoxické T-lymfocyty a indukuje jejích apoptózu (prostřednictvím extracelulárních interakcí T-lymfocytů a galektinové sítě, lattice). Se zánětem úzce souvisí profibrotické působení galektinu-3: reguluje funkci makrofágů včetně fagocytózy, přispívá k vytvoření profibrotického makrofágového fenotypu. Aktivuje geny podílející se na vytvoření profibrotického prostředí, stimuluje produkci fibronektinu a dalších matrixových proteinů. Klíčovou roli hraje také aktivace fibroblastů a myofibroblastů galektinem-3 secerovaným aktivovanými makrofágy [1,2,7,8]. Je však nutné poznamenat, že role galektinu-3 v patogenezi není plně objasněna a spíše se považuje za důležitější extracelulární aktivita než intracelulární (protein-protein interakce).
Analytické znaky stanovení
První diagnostickou soupravu na stanovení galektinu-3 v séru uvedla firma BG Medicine (dále BGM) na principu ELISA, souprava má schválení FDA pro klinické použití. Patent BGM následně získala například firma Abbott, která vyvinula v roce 2012 automatizovanou chemiluminiscenční imunoanalýzu na mikročásticích (CMIA) pro analyzátor Abbott Architect. Naše pracoviště se podílelo na mezinárodní studii, která soupravu hodnotila jak analyticky, tak z hlediska podkladů pro interpretaci [10]. Na celkem osmi pracovištích (Velká Británie, Německo, Francie, Česko, Španělsko a Itálie) byla prokázána uspokojivá preciznost (podle protokolu EP5-A2) s rozsahem hodnot CV 3,8-7,4 % (kontrolní materiál 9,1 μg/L), 2,0-4,3 % (20,5 μg/L) a 1,7-3,5 % (74,1 μg/L). Hodnoty LoB, LoD a LoQ pro verzi STAT (Architect ci16200) byly 0,0-1,2 μg/L, 0,5 - 1,7 μg/L a 2,1-4,0 μg/L. Hodnoty LoB, LoD a LoQ byly srovnatelné pro verzi soupravy „routine“, se kterou jsme ale na našem pracovišti nepracovali. Rozsah měření metody CMIA 5,5-103,1 μg/L (tedy podobný rozsah jako u soupravy ELISA s rozsahem 1,32-96,6 μg/L). Porovnání mezi metodou BGM a Abbott bylo provedeno na 807 vzorcích, pomocí Passingovy-Bablokovy regrese byl konstatován uspokojivý vztah mezi metodou CMIA a ELISA (Abbott=1,04. BGM - 0,07). Vyšší hodnoty poskytovala plazma než sérum (bias 10,2 %, Bland - -Altman), nebyl podstatný vliv mezi vzorky vyšetřenými bez skladování a po zamražení. Podobnou evaluaci a porovnání s dalšími diagnostickými soupravami provedl Meijers [9].
Zatím nám není známo, že by bylo k dispozici externí hodnocení kvality. V úvahu přichází dohoda mezi pracovišti, která by toto vyšetření poskytovala. Pro výběr vhodného biologického materiálu bude potřebná spolupráce s diagnostickou firmou, organizaci počátečních externích porovnávání můžeme zajistit.
Referenční intervaly, rozhodovací limity
Ve zmíněné publikaci [10] byl určen 95. a 97,5. percentil na úrovni 25,2, resp. 28,4 μg/L. V publikaci Christensona pro BGM ELISA byly podobně hodnoty 90., 95. a 97,5. percentilu na úrovních 17,6; 20, 3 a 22,1 μg/L [11]. Firma Abbott později doporučila v souladu s pracemi McCullougha [12,13] rozhodovací limit 17,8 μg/L, který odděluje „low-risk“ populaci od „moderate-risk“ populace pacientů se srdečním selháním a pozitivitou natriuretických peptidů. Překročení horní hranice „moderate-risk“ na úrovni 25,9 μg/L vymezuje populaci s vysokým rizikem rehospitalizace a úmrtí na srdeční selhání. Zajímavou práci zabývající se hodnotami u zdravé populace přinesl Krintus [14]. Pro metodu CMIA pro Abbott Architect navrhl u dobře vybrané referenční populace interval 5,9-18,1 μg/L (2,5. - 97,5. percentil) s možností použít tyto hodnoty jako referenční interval pro obě pohlaví a dospělý věk. Zdá se tedy, že hodnota 18,0 μg/L může sloužit jako univerzální cut-off limit pro identifikování rizikových jedinců v populaci s uvažovaným srdečním selháním, zejména typu HFpEF (se zachovanou ejekční frakcí levé komory). Podobné rozhodovací limity mezi 16 a 20 μg/L byly použity v řadě klinických studií (COACH, CORONA, DEAL, PRIDE, UMDH23258, Val-HeFT, VitD-CHF a další).
Biologická variabilita
Wu [15] sledoval jako první biologickou variabilitu galektinu-3 a sST2 v kohortě 17 zdravých subjektů (muži i ženy); sledování probíhalo osm týdnů, odběry jednou za dva týdny (dlouhodobá biologická variabilita). Dále sledoval 12 subjektů po čtyřech hodinách (krátkodobá variabilita). Další informace o biologické variabilitě u zdravých osob přinesly práce Gazeho, Meijerse a Schindlerové [10,16,17], někteří autoři sledovali také populace nemocných [16 - 18]. Výsledky ukazuje Tabulka 2. Velmi podstatnou informaci poskytla Schindlerová [17]: pro odhad homeostatického bodu koncentrace galektinu-3 v intervalu 10 % (s 95% konfidenčním intervalem) je potřebný pouze jeden odběr u zdravých osob a dva odběry u pacientů se stabilním srdečním selháním. Jde o podstatně nižší hodnoty než u BNP (33-47 odběrů u zdravých a 20-30 odběrů u srdečního selhání) nebo hs-cTnI (9 odběrů u zdravých a čtyři odběry u srdečního selhání). V případě BNP je pochopitelně kritérium 10% intervalu odhadu homeostatického bodu příliš přísné, vzhledem k vysoké dynamice hodnot koncentrací tohoto biomarkeru v patologii nebo při odpovědi na terapii srdečního selhání.
Table 2. Data on biological variation in healthy subjects and patients 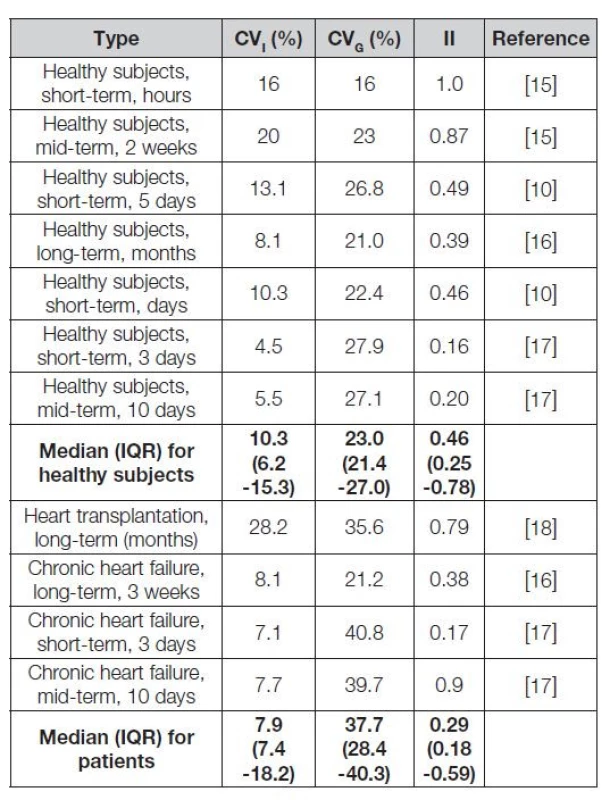
Při analýze dat popisujících biologickou variabilitu je patrné, že není jednoznačná závislost mezi délkou intervalu mezi odběry a hodnotou CVI nebo CVG. Větší rozptyl mezi experimentálními daty CVI a CVG je u nemocných. Index individuality u některých studií podporuje potřebu monitorování (nízká hodnota CVI), u jiných podporuje možnost použití populačních referenčních intervalů a rozhodovacích mezí (vyšší index individuality). Lze předpokládat, že rozdíly mezi odhady biologické variability závisejí na použité metodice sledování.
Biologickou variabilitu dalších biomarkerů onemocnění srdce a kardiovaskulárního aparátu uvádí v přehledné práci Meijers [19].
Rutinní možnost stanovení
V současné době je ideální platformou dosažitelnou v ČR imunoanalýza firmy Abbott (Architect a Allinity). Analytické charakteristiky a rozhodovací limity byly popsány výše a umožňují automatizované stanovení a správnou interpretaci. Předložili jsme kalkulační list pro stanovení galektinu-3 v séru, který schválil výbor České společnosti klinické biochemie a podpořil výbor České kardiologické společnosti. Dne 2. 12. 2021 proběhlo zasedání pracovní skupiny č. 2, která rozhodla o možnosti zařazení této položky do Seznamu výkonů s bodovými hodnotami. Příští revize Seznamu výkonů by tedy již mohla tento výkon obsahovat.
Závěry
Galektin-3 je perspektivní biomarker s omezenou diagnostickou, ale významnou prognostickou rolí u řady onemocnění (uplatnění především v kardiologii, pneumologii, nefrologii, onkologii). V patofyziologických procesech se uplatňuje především jako faktor s prozánětlivými a profibrotickými účinky. Existuje robustní analytická metoda stanovení galektinu-3 prověřená v multicentrické mezinárodní studii i dílčích experimentech, souvisejících například s určením biologické variability. Jsou známé rozhodovací limity, lze doporučit „univerzální“ limit 18 μg/L pro identifikaci osob ve vyšším riziku komplikací spojených s fibrózou a zánětem. Je známá biologická variabilita u zdravých osob i u pacientů. Nejvíce dat o galektinu-3 se týká kardiologické diagnostiky, patří mezi biomarkery s možným využitím u srdečního selhání, infarktu myokardu, transplantace srdce a dalších kardiologických jednotek. U všech zmíněných dominuje především jeho prognostický význam. Má také roli u dalších onemocnění. Testuje se terapeutické použití inhibitorů galektinu-3. Vzhledem k připravované úhradě podle Seznamu výkonů a jeho diagnostickému a prognostickému potenciálu jde o biomarker vhodný pro použití v běžné klinické praxi.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 22. 4. 2022
Adresa pro korespondenci
doc. MUDr. Janka Franeková, Ph.D.
Oddělení klinické biochemie
Pracoviště laboratorních metod
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
e-mail: jafa@ikem.cz
Sources
1. Liu, Y., Meng, H., Xu, S., Qi, X. Galectins for diagnosis and prognostic assessment of human diseases: an overview of meta-analyses. Med. Sci. Monit., 2020, 26, e923901.
2. Sciacchitano, S., Lavra, L., Morgante, A., et al. Galectin-3: One molecule for an alphabet of diseases, from A to Z. Int. J. Mol. Sci., 2018, 19(2), 379.
3. Hara, A., Niwa, M., Kanayama, T., et al. Galectin-3: A potential prognostic and diagnostic marker for heart disease and detection of early stage pathology. Biomolecules, 2020, 10(9), 1277.
4. Ho, M. K., Springer, T. A. Mac-2, a novel 32,000 Mr mouse macrophage subpopulation-specific antigen defined by monoclonal antibodies. J. Immunol., 1982, 128(3), 1221-1228.
5. Ho, M. K., Springer, T. A. Tissue distribution, structural characterization, and biosynthesis of Mac-3, a macrophage surface glycoprotein exhibiting molecular weight heterogeneity. J Biol. Chem., 1983, 258(1), 636 - 642.
6. Dumic, J., Dabelic, S., Flögel, M. Galectin-3: an openended story. Biochim. Biophys, Acta, 2006, 1760(4), 616-635.
7. Suthahar, N., Meijers, W. C., Sillje, H. H. W., Ho, J. E., Liu, F. T., de Boer, R. A. Galectin-3 Activation and inhibition in heart failure and cardiovascular disease: An update. Theranostics, 2018, 8(3), 593 - 609.
8. Slack, R. J., Mills, R., Mackinnon, A. C. The therapeutic potential of galectin-3 inhibition in fibrotic disease. Int. J Biochem. Cell. Biol., 2021, 130, 105881.
9. Meijers, W. C., van der Velde, A. R., de Boer, R. A. The ARCHITECT galectin-3 assay: comparison with other automated and manual assays for the measurement of circulating galectin-3 levels in heart failure. Expert Rev. Mol. Diagn., 2014, 14, 257-266.
10. Gaze, D. C., Prante, C., Dreier, J., et al. Analytical evaluation of the automated galectin-3 assay on the Abbott ARCHITECT immunoassay instruments. Clin. Chem. Lab. Med., 2014, 52(6), 919-926.
11. Christenson, R. H., Duh, S. H., Wu, A. H., et al. Multicenter determination of galectin-3 assay performance characteristics: Anatomy of a novel assay for use in heart failure. Clin. Biochem., 2010, 43(7-8), 683-690.
12. McCullough, P. A., Olobatoke, A., Vanhecke, T. E. Galectin-3: a novel blood test for the evaluation and management of patients with heart failure. Rev Cardiovasc Med, 2011, 12(4), 200-210. Erratum in: Rev. Cardiovasc. Med., 2012, 13(1), e52.
13. McCullough, P. A. Practical experience using galectin-3 in heart failure. Clin. Chem. Lab. Med., 2014, 52(10), 1425-1431.
14. Krintus, M., Kozinski, M., Fabiszak, T., Kubica, J., Panteghini, M., Sypniewska, G. Establishing reference intervals for galectin-3 concentrations in serum requires careful consideration of its biological determinants. Clin. Biochem., 2017, 50(10-11), 599-604.
15. Wu, A. H., Wians, F., Jaffe, A. Biological variation of galectin-3 and soluble ST2 for chronic heart failure: implication on interpretation of test results. Am. Heart. J., 2013, 165(6), 995-999.
16. Meijers, W. C., van der Velde, A. R., Muller Kobold, A. C., et al. Variability of biomarkers in patients with chronic heart failure and healthy controls. Eur. J Heart. Fail., 2017, 19(3), 357-365.
17. Schindler, E. I., Szymanski, J. J., Hock, K. G., Geltman, E. M., Scott, M. G. Short - and long-term biologic variability of galectin-3 and other cardiac biomarkers in patients with stable heart failure and healthy adults. Clin. Chem., 2016, 62(2), 360-366.
18. Franeková, J., Kubíček, Z., Hošková, L., et al. Long-term biological variability of galectin-3 after heart transplantation. Clin. Chem. Lab. Med., 2015, 53(1), 119-123.
19. Meijers, W. C., Bayes-Genis, A., Mebazaa, A., et al. Circulating heart failure biomarkers beyond natriuretic peptides: review from the Biomarker Study Group of the Heart Failure Association (HFA), European Society of Cardiology (ESC). Eur. J Heart. Fail., 2021, 23(10), 1610 - 1632.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2022 Issue 3-
All articles in this issue
- Editorial
- Galectin-3: an overview, pathophysiology, analytics, limits of interpretation and biological variation.
- MxA protein and its application in early diagnosis of viral infections including SARS-CoV-2
- Antioxidant effects of sulfane sulfur
- How we can put patients´ lives at risk together
- Biological variability. Concepts and literature recommended to education
- Big data, machine learning and artificial intelligence in clinical laboratory. Concepts and literature for education
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- MxA protein and its application in early diagnosis of viral infections including SARS-CoV-2
- How we can put patients´ lives at risk together
- Galectin-3: an overview, pathophysiology, analytics, limits of interpretation and biological variation.
- Biological variability. Concepts and literature recommended to education
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

