-
Medical journals
- Career
Doporučení České společnosti klinické biochemie ČLS JEP k využití nádorových markerů v klinické praxi
Authors: D. Springer 2; D. Valík 1; R. Kučera 3; L. Zdražilová Dubská 1; M. Karlíková 3; O. Topolčan 3; T. Zima 2
Authors‘ workplace: Masarykův onkologický ústav Brno, BBMRI-CZ 1; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN Praha, BBMRI-CZ 2; Oddělení imunochemické diagnostiky FN Plzeň, BBMRI-CZ 3
Published in: Klin. Biochem. Metab., 29, 2021, No. 1, p. 41-55
Účelem tohoto doporučení je pomoci lékařům a pracovníkům klinických laboratoří orientovat se v racionálním používání nádorových markerů v klinické praxi. Doporučení rámcově vychází ze světových doporučení a dokumentů publikovaných k diagnostice a léčbě nádorových onemocnění a dále zohledňuje dlouhodobé zkušenosti autorů s používáním nádorových markerů v péči o onkologického pacienta. Doporučení nepojednává o cirkulujících buněčných elementech, cirkulujících nukleových kyselinách nebo jejich částech analyzovaných pomocí technik molekulární biologie, jelikož v této oblasti vědního rozvoje zatím nebylo dosaženo potřebného odborného konsensu, jenž by podpořil aplikace těchto postupů v klinické praxi.
Doporučení není také myšleno jako náhrada klinického úsudku ošetřujícího lékaře, stejně tak nemůže postihnout všechny možné situace, jež mohou nastat v klinické praxi.
Úvod
Nádorovým markerem rozumíme substanci přítomnou v nádoru nebo produkovanou nádorem nebo hostitelem jako odpověď na přítomnost tumoru. Tuto substanci lze využít k diferenciaci nádoru od normální tkáně, nebo uvažovat o přítomnosti tumoru na základě analýzy tělesných tekutin. Substanci lze měřit kvalitativně nebo kvantitativně metodami chemickými, imunologickými nebo metodami molekulární biologie.
Vzhledem k širokému biologickému spektru nádorových onemocnění neexistuje univerzální nádorový marker. Obdobně senzitivita (správný záchyt nemocných) při dostatečné specificitě (správná negativita u lidí bez nádorového onemocnění) nedosahuje ideálních 100 %. Nezvýšená koncentrace nádorového markeru není tedy ještě důkazem nepřítomnosti maligního onemocnění, naopak pozitivní výsledek nemusí nutně znamenat přítomnost zhoubného nádoru.
Limitace využití nádorových markerů
Je třeba vnímat skutečnost, že s rozvojem diagnostických zobrazovacích technik v onkologii, došlo k posunu ve využití solubilních cirkulujících nádorových markerů. Vyšetření PET/CT a PET/MRI jsou ze své podstaty dynamickými vyšetřeními biochemických procesů spojenými s nádory fúzovanými s morfologickým kontextem nádorových lézí. Solubilní cirkulující nádorové markery umožňují indikovat u asymptomatických pacientů zobrazovací techniky a pomáhají i v interpretaci výsledků zobrazovacích technik.
Screening a primární diagnostika
Vzhledem k poměrně nízké diagnostické senzitivitě a specificitě není většina nádorových markerů vhodná k tomuto účelu u asymptomatických vyšetřovaných. U symptomatických nemocných nebo u skupin pacientů s vysokým rizikem vývoje nádorového onemocnění lze použít vyšetření některých nádorových markerů k časné diagnostice choroby (nádory testes, prostata).
Agresivita onemocnění
Vysoká hodnota nádorového markeru v séru může u některých diagnóz upozornit na nesprávně určené nižší stadium choroby.
Prognóza
Určení prognózy onemocnění nebylo podstatnou rolí solubilních nádorových markerů. Značný význam má však AFP a hCG u germinativních tumorů, určitý význam má hodnota CEA u kolorektálních karcinomů, PHI u nádorů prostaty, případně β2-mikroglobulin u myelomů.
Sledování průběhu choroby je hlavní indikací těchto vyšetření
Vzestup hladin nádorových markerů představuje včasné upozornění, které předchází klinickou diagnózu návratu choroby.
Účinek terapie
Sledování účinku terapie pomocí nádorových markerů je významnou indikací vyšetření solubilních nádorových markerů (Tabulka 1). Vzhledem k různým biologickým poločasům jednotlivých markerů je nutno správně volit intervaly odběrů krve k vyšetření tak, aby se skutečně postihl efekt terapie, nikoli pouze tzv. „lysis fenomén“, tj. prudké zvýšení koncentrace markeru jako důsledek cytolýzy po bezprostředním působení protinádorové terapie.
Table 1. Solubilní nádorové markery vhodné pro monitorování průběhu choroby a účinnosti terapie 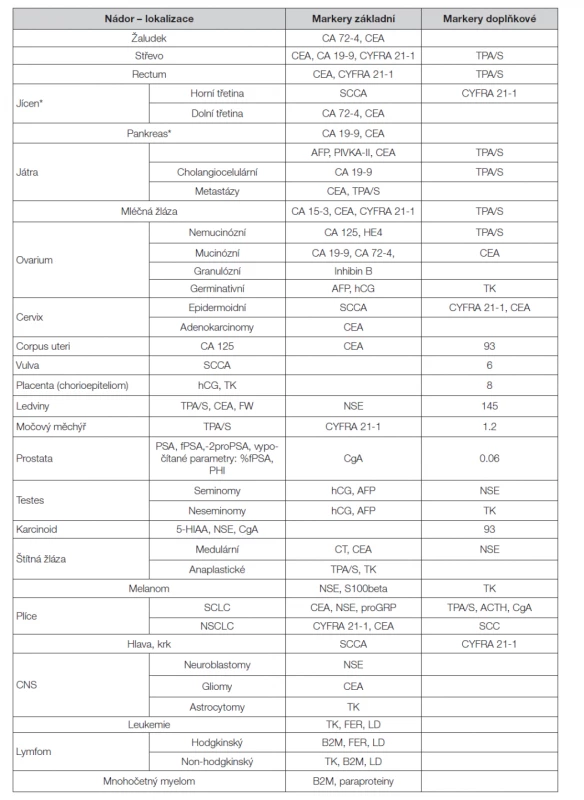
* Vzhledem k nepříznivé prognóze většina autorů sledování TM vůbec nedoporučuje, jejich přínos je sporný. Frekvence vyšetření
Pro frekvenci vyšetřování platí kritéria doporučená WHO a podle zkušeností kliniků i statistiků hodnotících dynamiku změn nádorových markerů ve vztahu ke klinickému průběhu choroby je vhodné dodržovat doporučenou frekvenci vyšetření (Tabulka 2).
Table 2. Frekvence vyšetřování TM 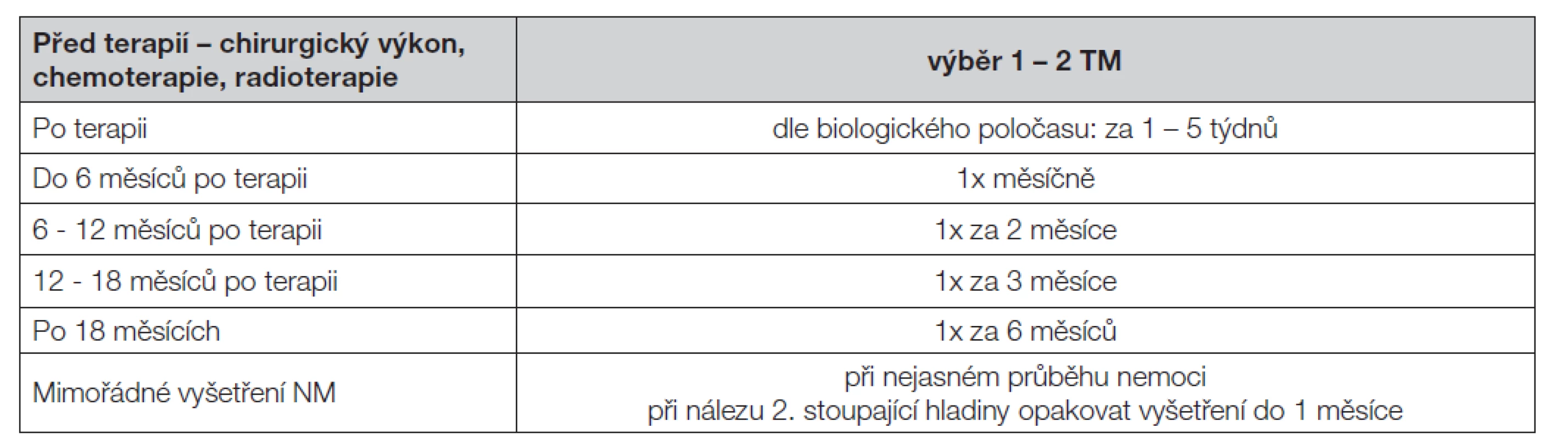
Při hodnocení vyšetření je třeba zvážit další faktory, které by mohly přispět k falešné pozitivitě výsledku (Tabulka 3 a Tabulka 4). Jsou to především zvýšené hladiny nádorových markerů v důsledku jejich produkce u nemaligních onemocnění, nebo při poruchách jejich vylučování (zejména při zhoršené funkci jater nebo ledvin). Pro většinu nádorových markerů je znám aproximativní biologický poločas v séru, který je velmi rozdílný (Tabulka 5); proto je třeba jej při hodnocení změn časového průběhu hladin zvažovat.
Table 3. Zvýšené hladiny nádorových markerů u nemaligních onemocnění 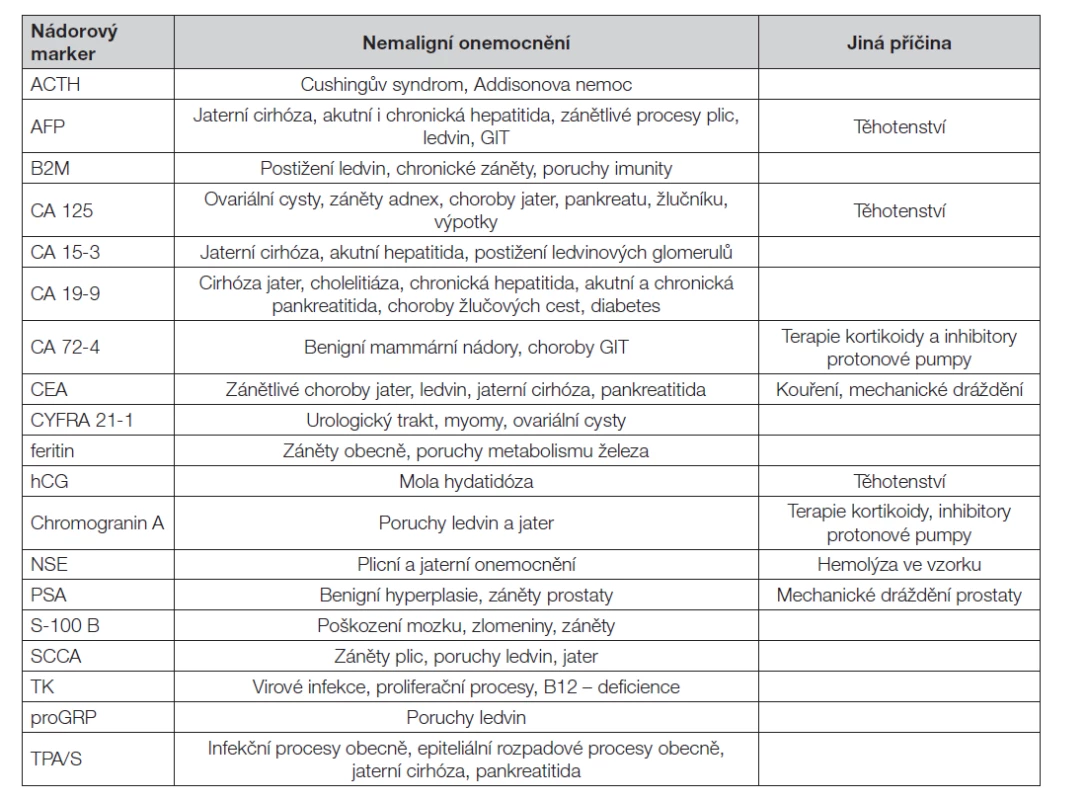
Table 4. Pozitivita nádorových markerů u benigních onemocnění – změna hladiny TM 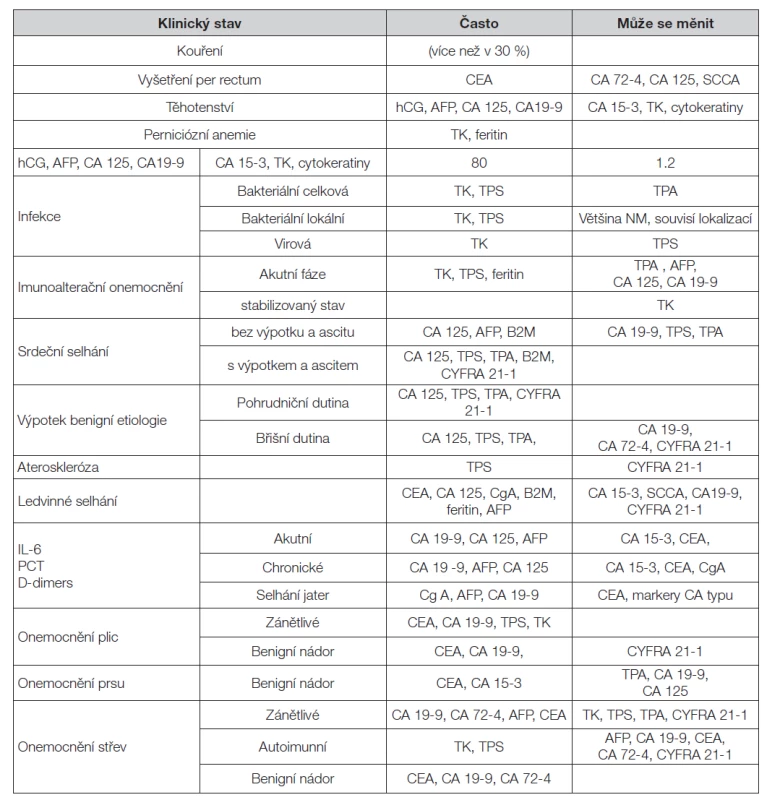
Table 5. Aproximativní biologické poločasy nádorových markerů v cirkulaci 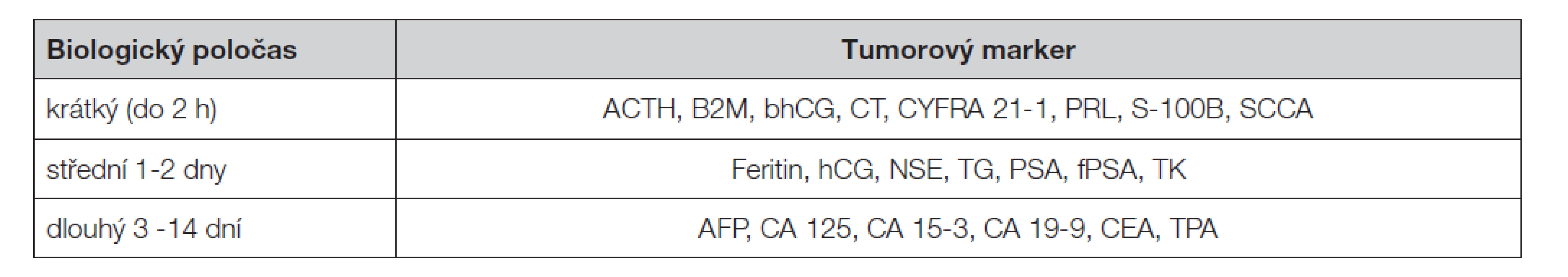
Jako signifikantní bývají posuzovány tyto změny hladin nádorových markerů:
a) bez terapie (v klinické remisi): stoupající trend koncentrace ve třech následných odběrech i v hladinách do cut-off může značit recidivu, resp. progresi, při vyloučení biologických i analytických interferencí;
b) během terapie: nárůst o více než 25 % značí progresi onemocnění, pokles více než 50 % parciální remisi (kompletní remise však nemůže být hodnocena pouze pomocí změn v hladinách markerů).
1. Biologická povaha nádorových markerů
Nádorovým markerem rozumíme substanci přítomnou v nádoru nebo produkovanou nádorem nebo hostitelem jako odpověď na přítomnost tumoru. Mezi markery produkované tumorem patří enzymy (např. LD, NSE, PSA, thymidinkináza - TK), imunoglobuliny nebo jejich fragmenty či podjednotky (monoklonální imunoglobuliny, tzv. „paraproteiny“), hormony (např. hCG, PTH, ACTH, kalcitonin, gastrin, prolaktin, norepinefrin, epinefrin), fragmenty komplexních glykoproteinů, (např. CA19-9, CA15-3, CA125), fragmenty cytokeratinů (TPA, TPS, CYFRA21-1), onkofetální antigeny (AFP, CEA), molekuly receptorové povahy (estrogenový a progesteronový receptor, receptor pro interleukin 2, HER2/neu a EGF, cirkulující buněčné elementy (cirkulující nádorové buňky, cirkulující endotelové buňky a cirkulující endotelové prekursory) a cirkulující fragmenty nukleových kyselin (zejména DNA a miRNA). Mezi přirozené funkční proteiny reagující zvýšením koncentrace v některém tělesném biologickém materiálu patří v séru/plazmě feritin, nebo C-reaktivní protein (vzdáleně do této kategorie patří i jev sedimentace erytrocytů) a hemoglobin ve stolici. Mimo obvyklé aplikace klasických (solubilních) nádorových markerů se zdají být jako nádorové markery klinicky užitečné i některé genetické abnormality, a to především pro specifikaci abnormality nádorových buněk určující způsob léčby.
Tento dokument se bude věnovat pouze solubilním nádorovým markerům, které jsou v běžné nabídce vyšetření prováděných v biochemických laboratořích.
2. Preanalytické aspekty
V současnosti se většina používaných solubilních nádorových markerů stanovuje v séru. Jde obvykle o štěpy velkých molekulárních komplexů, a proto nevykazují nádorové markery příliš velkou preanalytickou variabilitu. Pro správnou interpretaci změn v hladinách markerů, zejména při dlouhodobém sledování nemocných s nádorovými chorobami, je třeba vyloučit možné rušivé faktory, které by mohly stanovení ovlivnit už ve fázi preanalytické. V určitých případech mohou být výsledky analýzy ovlivněny některými postupy klinického vyšetřování; např. pro stanovení prostatického specifického antigenu (PSA) má být krev odebrána nejdříve 48 hod po rektálním vyšetření prostaty. Jeho hladinu může ovlivnit i jakákoliv manipulace s prostatou včetně jízdy na kole nebo sexuální aktivity. Kontaminace vzorku slinami nebo potem může znehodnotit stanovení antigenu skvamózních buněk (SCCA) nebo CA 19-9. Neuron-specifická enoláza (NSE) a laktátdehydrogenáza (LD) je při hemolýze významně uvolňována z erytrocytů, oddělení séra od krevních elementů je třeba provést nejpozději do 1 hod po odběru. Hemolýza nad 300 mg/L volného hemoglobinu vede ke zvýšení koncentrace NSE nad hodnotu cut-off.
3. Vlastní laboratorní analýza
Měření hladiny nádorového markeru je třeba provádět pomocí technologie určené k in vitro diagnostice. Pracoviště by mělo plnit požadavky normy ISO15189, tj. minimálně disponovat příslušně kvalifikovaným personálem znalým problematiky a pravidelně se účastnit procesu externího hodnocení kvality. K vyšetření koncentrace nádorových markerů jsou obvykle používány metody imunoanalýzy, případně se měří enzymové aktivity (LD, TK).
Potřeba dlouhodobého sledování pacienta se zhoubným onemocněním vyžaduje, aby se technologie stanovení pro daný marker dlouhodobě neměnila. Pokud je změnu technologie měření nutné v praxi realizovat, je třeba nejprve provést srovnávací sérii měření na dostatečném množství konkrétních pacientských vzorků pomocí obou souprav, aby laboratoř získala data o chování nové soupravy v konkrétních podmínkách. Vede-li změna analytické metody ke změně hodnoty cut-off, pak je třeba ji s účinností od konkrétního data implementovat do praxe a informovat indikující lékaře.
4. Zdroje interference
Níže popsané analytické interference mohou způsobit jak falešné snížení, tak falešné zvýšení stanovené koncentrace cirkulujícího nádorového markeru.
K obvyklým typům analytických interferencí patří:
a) zkřížená reaktivita strukturálně podobných molekul
Imunologické metody nemohou docílit naprosté specifity protilátky vzhledem k vazebnému epitopu analyzované molekuly. Používáním monoklonálních protilátek je toto riziko výrazně sníženo. Výrobce IVD informuje uživatele o zdrojích možné interference v příbalovém letáku soupravy. Uživatelé se s možností zkřížené reaktivity u konkrétní diagnostické soupravy musí seznámit.
b) „hook efekt“ způsobený vysokou koncentrací markeru (high-dose hook effect),
Jde o stav, kdy velmi vysoká koncentrace analytu překročí vazebnou schopnost jedné protilátky a zabrání navázání protilátky druhé. Výrobce soupravy by měl s tímto typem interference počítat a jasně definovat lineární dynamický rozsah měření. Tento problém se vyskytuje pouze u jednokrokových metod, u dvoukrokových metod je tento problém řešen vloženým promytím. Laboratoře by měly mít k dispozici protokol, jenž řeší možnost výskytu tohoto jevu.
c) interference heterofilních protilátek a lidských anti-myších protilátek (HAMA).
Lidské heterofilní protilátky jsou endogenní imunoglobuliny, jež reagují s druhově odlišnými imunoglobuliny (myšími nebo králičími) jak in vivo, tak in vitro. Většinou se objevují u patologických stavů spojených s polyklonální aktivací imunitního systému, typicky primoinfekce EB virem, nebo u procesů spojených s autoimunitou, kde typickým příkladem je revmatoidní faktor. Lidské anti-myší protilátky jsou imunoglobuliny, které specificky reagují s epitopy myších imunoglobulinů a mohou se v tělních tekutinách objevit zejména jako důsledek reakce organismu na myší bílkoviny, podané např. za účelem diagnostiky nebo terapie (humanizované protilátky např. bevacizumab, trastuzumab) nebo předchozí imunizace pacienta stykem s hlodavci. Nejjednodušším postupem ověření klinickému stavu neodpovídající naměřené hodnoty je stanovení téhož analytu, nejlépe z téhož vzorku (zkumavky, alikvotu) jinou imunoanalytickou technologií, jelikož pravděpodobnost výskytu téhož interferujícího jevu s rozdílnými protilátkami použitými jiným výrobcem je velmi malá. Pokud laboratoř nemá takovou možnost k dispozici, lze provést ředění vzorku v sérii alespoň čtyři měření – není-li výsledek měření lineární, jde pravděpodobně o interferenci.
5. Interpretace
Vzhledem k širokému spektru nádorových onemocnění neexistuje univerzální nádorový marker. Obdobně senzitivita (správný záchyt nemocných) při dostatečné specificitě (správná negativita u lidí bez nádorového onemocnění) nedosahuje ideálních 100 %. Nezvýšená koncentrace nádorového markeru není tedy ještě průkazem nepřítomnosti maligního onemocnění, naopak pozitivní výsledek nemusí nutně znamenat přítomnost zhoubného nádoru. Vztah senzitivity a specificity markerů vyjadřuje ROC křivka (Receiver Operating Characteristics). Senzitivita se nejčastěji udává jako hodnota při 95% specificitě.
Při interpretaci vyšetření solubilních nádorových markerů v klinické praxi se řídíme následujícími pravidly:
Screening
Vzhledem k poměrně nízké diagnostické senzitivitě a specificitě není většina nádorových markerů vhodná k tomuto účelu u asymptomatických vyšetřovaných. Zavedení screeningu karcinomu prostaty u mužů nad 50 let zatím není doporučeno. Screening kolorektálního karcinomu pomocí vyšetření okultního krvácení, tj. pomocí volného hemoglobinu přítomného ve stolici, se v současnosti doporučuje pouze za použití imunoanalytických postupů, nikoli pouze chemické detekce pseudoperoxidázové aktivity hemoglobinu. Mamografický screening karcinomu prsu a cytologický screening karcinomu čípku děložního patří mezi významné nástroje záchytu onemocnění v časném stádiu, ale jeho provádění nesouvisí s vyšetřováním solubilních biologických markerů a není tedy součástí tohoto doporučení. U symptomatických nemocných nebo u skupin jedinců s vysokým rizikem vývoje nádorového onemocnění lze použít vyšetření některých nádorových markerů ke screeningu choroby. Například screeningové vyšetřování kalcitoninu v rodinách s výskytem medulárního karcinomu štítné žlázy, nebo vyšetření CA 15-3 spolu se zobrazovacími metodami v rodinách s mutacemi v genech BRCA1 a BRCA2.
Primární diagnostika
Podobně jako pro screening onemocnění nejsou existující nádorové markery často vhodné ani pro primární diagnostiku z důvodů analogických. Výjimkami jsou podezření na germinální nádory (hCG), chorio-epiteliom, nádory testes nebo diferenciální diagnostika jaterních lézí, vč. lézí ložiskových (AFP).
Diferenciální diagnostika
Využití kombinace CEA, NSE, pro-GRP a cytokeratinů pro diferenciální diagnostiku karcinomů plic a u neuroendokrinních nádorů využití chromograninu A.
Staging
Posouzení anatomického rozsahu onemocnění. U některých markerů např. CA 125, CA 19-9 korelace mezi závažností onemocnění a jeho výší neexistuje. Naopak vysoká hodnota nádorového markeru v séru může někdy upozornit na nesprávně určené nižší stadium choroby (např. susp. generalizace u hodnot PSA >100 mg/L).
Prognóza
určení prognózy onemocnění není podstatnou rolí solubilních nádorových markerů. Značný význam má AFP a hCG u germinálních tumorů, určitý význam má hodnota CEA u kolorektálních karcinomů, případně b2-mikroglobulin u myelomu.
Sledování průběhu choroby a účinku terapie
Jde o hlavní indikace těchto vyšetření. Vzestup hladin nádorových markerů představuje včasné upozornění, které předchází klinickou diagnózu návratu (rekurence) choroby. Sledování účinku terapie pomocí nádorových markerů je významnou indikací vyšetření solubilních nádorových markerů (Tabulka 1). Vzhledem k různým biologickým poločasům jednotlivých markerů je nutno správně volit intervaly odběrů krve k vyšetření tak, aby se skutečně postihl efekt terapie, nikoli pouze tzv. „lysis fenomén“, tj. prudké zvýšení koncentrace markeru jako důsledek cytolýzy po bezprostředním působení protinádorové terapie.
Frekvence vyšetření
Pro frekvenci vyšetřování platí kritéria doporučená WHO a podle zkušeností kliniků i statistiků hodnotících dynamiku změn koncentrací nádorových markerů ve vztahu ke klinickému průběhu choroby je třeba dodržovat doporučenou frekvenci vyšetření. Je vhodné vyšetřit hladinu tumorových markerů před chirurgickým výkonem, aby bylo možné posoudit radikalitu výkonu při měření hladin markeru po výkonu. V průběhu primární terapie může onkolog zvolit monitoring odpovědi na léčbu pomocí vhodného solubilního nádorového markeru v intervalu kratším než jeden měsíc. Koncentrace nádorového markeru má být dále vyšetřena: před nasazením terapie, po ukončení terapie (podle poločasu markeru, obvykle 3.-4. týden), při změně terapie, dále i při nejasném průběhu nemoci. Při nálezu zvýšené hodnoty se doporučuje v co nejkratší době provést opakování odběru kvůli potvrzení nálezu. Po potvrzení je vhodné zkrátit intervaly vyšetřování, aby se zjistil případný stoupající trend. Frekvence vyšetřování solubilních nádorových markerů je shrnuta v Tabulce 2.
Pro sledování průběhu léčby a monitorování terapie se doporučuje využívat těch nádorových markerů, které daný typ nádoru produkuje (např. případ karcinomu prsu, který byl před zahájením léčby bez elevace CA15-3, ale se zvýšenými hladinami CEA, je vhodné sledovat pomocí tohoto markeru). Při restagingu onemocnění (např. vznik vzdálených metastáz) je vhodné stanovit hladiny markerů, které nebyly primárně zvýšeny, avšak jsou relevantní pro daný typ onemocnění. Při hodnocení vyšetření je třeba zvážit analytické interference a biologické faktory, které by mohly přispět k falešné pozitivitě výsledku (Tabulka 3 a Tabulka 4). Jde především o zvýšené hladiny nádorových markerů v důsledku jejich produkce u nemaligních onemocnění, nebo při poruchách jejich eliminace (zejména při zhoršené funkci ledvin nebo jater, srdečním selhávání apod.). U takovýchto stavů je nutné zvážit, zda vůbec nádorové markery vyšetřovat (typicky jaterní cirhóza). Při sledování dynamiky hladiny nádorových markerů (např. po chirurgickém odstranění tumoru) je nutné zvažovat také stabilitu markeru v cirkulaci (Tabulka 5).
Jako signifikantní bývají posuzovány tyto změny hladin nádorových markerů: a) bez terapie (v klinické remisi): stoupající trend koncentrace ve třech po sobě následujících odběrech i v hladinách do hodnoty cut-off značí obvykle recidivu, resp. progresi, b) během terapie: nárůst o více než 25 % značí progresi onemocnění, pokles více než 50 % parciální remisi. Kompletní remise však nemůže být hodnocena pouze pomocí změn v hladinách markerů a je ji třeba vždy hodnotit s ohledem na výsledky přešetření zobrazovacími metodami.
6. Charakteristika jednotlivých klinicky významných nádorových markerů a specifické doporučení k jejich používání v klinické praxi
Hodnoty cut-off obsažené v tomto doporučení jsou obvyklými hodnotami používanými klinicky pro detekci rekurence choroby; přes veškerou snahu o metodickou standardizaci se hodnoty cut-off mohou lišit dle užívané metodiky. Hodnota daného markeru vzhledem k hladině cut-off je jedním z kritérií při posuzování aktuálního stavu nádorového onemocnění. Hladinu nádorového markeru je nutné posuzovat s ohledem na možné zdroje interference, míru zvýšení a dynamiku v čase.
6.1. Solubilní nádorové markery
Pro vyšetření solubilních nádorových markerů se provádí zpravidla odběr krve, případně sběr moči či odběr vzorku stolice či mozkomíšního moku. V případě stanovení z krve je vyšetřovaným materiálem sérum nebo plazma, přičemž pokud není dále uvedeno jinak, jsou hladiny stanovených analytů v obou materiálech identické.
6.1.1. Markery vyšetřované z krve
CEA (karcinoembryonální antigen)
Jde o onkofetální glykoprotein s vysokým obsahem sacharidů o molekulové hmotnosti 180–200 kDa. Za fyziologických podmínek je CEA produkován ve vyvíjejícím se embryu. V dospělosti je omezeně syntetizován epiteliálními buňkami střevní sliznice, žaludku a bronchů. CEA patří do imunoglobulinové genové rodiny; podílí se pravděpodobně na procesu adheze a metastazování buněk.
Doporučené použití pro klinické účely: Pro screening i diagnostiku maligního onemocnění nelze CEA použít. CEA produkují karcinomy zažívacího traktu, plic (adenokarcinomy), mléčné žlázy, nádory ženských pohlavních orgánů (mucinózní adenokarcinomy), endometriální nádory i nádory děložního těla, karcinomy močového měchýře, ledvin, diferencované karcinomy prostaty a testikulární teratomy. Předoperační hodnoty CEA > 40 µg/L jsou charakteristické pro kratší interval bezpříznakového přežití nemocných s karcinomem mléčné žlázy. Na základě předoperačních hodnot lze posoudit možnost radikálního zásahu u kolorektálního karcinomu, avšak spolu s dalšími vyšetřeními jako PET/CT nebo PET/MRI. Monitorování průběhu onemocnění a odpovědi na léčbu patří k základním využitím CEA. Hodnoty vyšší než 10 µg/L znamenají obvykle progresi maligního procesu. Koncentrace vyšší než 50 µg/L svědčí s vysokou pravděpodobností o jaterních nebo kostních metastázách. Pro nádory zažívacího traktu se obvykle pohybuje senzitivita při návratu onemocnění pro kolorektální karcinom kolem 60 %, pro nádory žaludku asi 50 %. Pokles hodnot CEA po chirurgickém zákroku může poskytnout údaj o úspěšnosti terapie, podobně lze hodnotit efekt chemo - či radioterapie, pokud byly hodnoty před terapií zvýšené.
Zvýšení CEA v séru lze také pozorovat u benigních nebo premaligních lézí jako jsou jaterní cirhóza, Crohnova choroba, střevní polypy, onemocnění plic, ledvin, žlučníku, pankreatitida, benigní onemocnění prsu, dále u kuřáků a alkoholiků.
Hodnocení: obvyklá hodnota cut-off je kolem 5,0 μg/L.
AFP (α1-fetoprotein)
AFP je onkofetální glykoprotein, produkovaný v embryonálním žloutkovém vaku a ve fetálních játrech. V séru matky, kam přechází přes placentu, je důležitým ukazatelem fyziologického vývoje těhotenství. V dospělém zdravém organismu je syntéza AFP omezena na minimum. Významná je především jeho role transportní (vazba steroidů, některých těžkých kovů, bilirubinu, mastných kyselin, retinoidů, drog, antibiotik apod.).
Doporučené použití pro klinické účely: Screening maligního procesu pomocí AFP v séru je vhodný pouze u symptomatických nemocných s jaterní cirhózou nebo podezřením na germinativní nádory varlat (nesestouplé varle, nádory testes u sourozence – dvojčete). Monitorování průběhu onemocnění patří k základním využitím AFP. Pro hepatocelulární karcinom je AFP markerem první volby (senzitivita u neléčeného onemocnění je až 80 %) Tento karcinom je také jediným nádorem, kde je možné stanovit diagnózu bez bioptické verifikace – pokud je nalezen typický obraz pomocí zobrazovacích metod současně s vysokou hladinou AFP. U germinálních nádorů ovariálních i testikulárních je senzitivita rovněž vysoká: pro čisté embryonální nádory a u nádorů žloutkového vaku dosahuje hodnot až 80 %, u teratomů pouze 20 %, obvykle chybí v seminomech a choriokarcinomech. Exprese AFP u nádorů zažívacího traktu je pozorována asi u jedné pětiny nemocných.
Nemaligními příčinami zvýšené hladiny AFP v séru většinou bývají akutní virová i chronická hepatitida, cirhóza jater a těhotenství.
Hodnocení: obvyklá hodnota cut-off je kolem 10 μg/L.
hCG (lidský choriový gonadotropin)
Jde o glykoprotein tvořený dvěma rozdílnými podjednotkami: α (14,5 kDa) a β (22,2 kDa). In vivo může docházet k disociaci jednotek α a β, β-složka může být dále štěpena na močový gonadotropinový peptid (β-core fragment).
Doporučené použití pro klinické účely: V závislosti na použitém detekčním systému je stanovení specifické pro celkový β-hCG (tj. intaktní hormon-dimer + volná podjednotka β), pro intaktní hCG (dimer bez volné podjednotky β), pro volnou podjednotku β nebo pro β-core fragment (stanovení v moči). Screening maligního procesu pomocí hCG v séru lze provádět u symptomatických osob, např. při podezření na germinální nádory varlat s retencí varlat v anamnéze. Stanovení má význam pro zhodnocení stadia onemocnění, pro potvrzení histologické charakterizace nádorů testes a choriokarcinomů a pro jejich monitorování. Senzitivita pro neseminomy je asi 50 %, pro seminomy 10–20 %, pro choriokarcinomy téměř 100 %, pro další lokalizace nádorů (pankreas, GIT, plíce, mléčná žláza, ledviny, močový měchýř) je do 20 %.
Zvýšené hladiny hCG v séru mohou způsobovat fyziologické i patologické stavy v těhotenství, myomy a ovariální cysty.
Hodnocení: obvyklá hodnota cut-off je kolem 10 IU/L.
CA 19-9
Vyskytuje se jako glykolipid ve tkáni nebo mucin v séru. Obsahuje determinanty lidské krevní skupiny sialyl-Lewis (a). Kolem 5-10 % populace tento antigen netvoří.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy maligního onemocnění není vhodný, a to ani pro nádory pankreatu, kde dosahuje tento marker vysoké senzitivity (až 70-90 %) i výrazně vysokých hodnot v séru (až 106 kU/L). Exponenciální nárůst koncentrací v séru (nad 104 kU/L) je obvykle známkou vzdálených metastáz. Vysokou senzitivitu dosahuje tento marker i podle závažnosti onemocnění zvláště u karcinomů pankreatu, dále u nádorů kolorekta (18-58 %), u cholangiocelulárních karcinomů (22-49 %), u nádorů žlučových cest (55-79 %) a žaludku (25-60 %). Koncentrace CA 19-9 korelují dobře s efektem terapie. Mucinózní karcinomy ovaria mohou taktéž produkovat CA 19-9.
Značně zvýšené hladiny CA19-9 v séru působí cholestáza, ale i benigní a zánětlivá onemocnění žaludku, střeva, pankreatu a jater.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/L.
CA 15-3
Jde o antigen polymorfního epiteliálního mucinu PEM neboli MUC1. V dospělosti je syntetizován v epiteliálních buňkách vývodů mléčné žlázy, slinných žláz a bronchů. Alternativou stanovení CA 15-3 je stanovení antigenu CA 27.29, což je odlišný epitop téhož epiteliálního mucinu.
Doporučené použití pro klinické účely: Stanovení nelze použít pro screening nemocných s karcinomem prsu a stanovení této diagnózy vyjma vybrané skupiny rizikových pacientů a jejich rodin z indikace genetika. Koncentrace CA 15-3 korelují se stadiem onemocnění. Hlavní využití CA 15-3 je v monitorování nemocných s karcinomem prsu. Při 90 % specificitě dosahuje senzitivita u neléčených nemocných pouze 20 až 40 %, u metastazujících nádorů až 80 %. Relaps onemocnění bývá charakterizován senzitivitou CA 15-3 dosahující 60 až 90 %. Jeho „lead time“ umožňoval předpovědět návrat onemocnění s předstihem několika měsíců před některými zobrazovacími metodami v dobách před zavedením vyšetření PET/CT, či PET/MRI. Dynamika změn po terapii obvykle koreluje s terapeutickým efektem.
Nemaligní onemocnění, zvyšující hladinu CA 15-3 v séru zahrnují benigní onemocnění prsu, benigní onemocnění trávicího ústrojí, jaterní cirhózu, akutní a chronickou hepatitidu, chronickou renální insuficienci, chronickou bronchitidu či pneumonie.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/L.
CA 125
Jde o heterogenní glykoprotein s vysokým obsahem sacharidů. Je produkován fetálními epiteliálními tkáněmi coelomového původu. V dospělém věku může být omezeně syntetizován v normálním epitelu tkáně vejcovodů, bronchů, endometria, cervixu, ale i v mezotelu pleury, perikardu a peritonea.
Doporučené použití pro klinické účely: CA 125 je exprimován u 80 % karcinomů ovarií serózního (nemucinózního) typu. Senzitivita pro další gynekologické nádory je nižší. Produkce CA 125 u karcinomů mléčné žlázy, pankreatu, plic, žlučových cest reflektuje obvykle postižení pleury a peritonea. Zvýšená hladina CA 125 byla také pozorována u hepatocelulárního karcinomu a karcinomu žlučových cest. Vyšetření hladiny CA 125 za účelem screeningu karcinomu ovarií je prováděno pouze v případě rodinné predispozice. Stanovení CA 125 je vhodné pro potvrzení stadia choroby. Nárůst koncentrace CA 125 může předcházet klinickou diagnózu o 1–8 měsíců. Po odstranění primárního tumoru klesá koncentrace CA 125 o 75–90 % během prvního týdne, do 2–3 týdnů se hodnoty normalizují. Přetrvávající vysoké hodnoty mohou být indikací k „second look“ operaci.
Zvýšené hladiny CA 125 v séru způsobené nemaligním onemocněním obvykle zahrnuje jakékoli dráždění serózních blan, dále chronická onemocnění jater, peritonitidu, benigní onemocnění ovarií a endometria, leiomyom nebo selhání ledvin.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/L.
HE4 (Human Epididymal Protein 4)
Je produkován ve vysokých koncentracích u pacientek s karcinomem vaječníků. HE4 vykazuje vysokou senzitivitu v časných (st. I/II) stádiích onemocnění. U žen s rakovinou vaječníků a pacientek s benigním gynekologickým nálezem je popsána pro ovariální karcinom specificita HE4 96% při senzitivitě 67%.
Doporučené použití pro klinické účely: Až třetina žen s maligním nádorem, u nichž není zvýšena hladina CA 125 má zvýšenou koncentraci HE4, a to především u endometroidních a serózních karcinomů ovária. Je–li tento marker použit samostatně k detekci nádorů vaječníků, vykazuje nejvyšší senzitivitu (při vysoké specificitě) ze všech známých biomarkerů ovariálního karcinomu, při použití v kombinaci s ostatními markery (zejména CA 125) se senzitivita panelu zvyšuje. Nárůst hodnot HE4 lze využít také ke sledování průběhu choroby u pacientek s ovariálním karcinomem, její progrese a sledování účinnosti terapie, resp. návratu onemocnění.
Velmi významným faktorem zvyšujícím sérovou hladinu HE4 je snížená funkce ledvin, proto se doporučuje posuzovat hladiny HE4 vždy také s ohledem na jejich funkci. Dalším interferujícím faktorem může být zvýšená krvácivost.
Hodnocení: obvyklá hodnota cut-off je 50 pmol/L pro premenopauzální ženy a kolem 80 pmol/L pro postmenopauzální ženy.
ROMA (risk of ovarian malignancy) index z hodnot CA 125 a HE4
ROMA index je nástrojem pro odhad rizika epiteliálního nádoru ovaria při abnormálním ultrazvukovém nálezu na vaječnících u jinak asymptomatických osob. V praxi je používána i kalkulace ROMA indexu z hodnot CA125 a HE4 stanovených z téhož odběru stejným analytickým systémem (původně zaveden jako proprietární postup pro systémy Abbott Diagnostics). Kombinace HE4 a CA125 dosahuje u ovariálního karcinomu senzitivity 76% a specificity 95%. Kombinace CA 125 a HE4 je vhodná pro sledování pacientek s ovariálním karcinomem v 89,8 % případů, u žen s nemucinózním karcinomem to bylo až 95% z nich.
Pro výpočet ROMA indexu je k dispozici několik webových kalkulátorů.
Hodnocení: ROMA nad 25,3 % vysoké riziko pro premenopauzální ženy; ROMA nad 7,4 % vysoké riziko pro postmenopauzální ženy.
Vzhledem k tomu, že do kalkulace vstupují hodnoty CA 125 a HE4, platí pro ROMA index interference obou těchto nádorových markerů.
PSA (prostatický specifický antigen), fPSA (volná frakce PSA)
PSA je serinová proteináza umožňující zkapalnění seminální tekutiny, čímž usnadňuje pohyb spermií. PSA má enzymovou aktivitu chymotrypsinu. V séru je PSA inaktivován vazbou na α1-antichymotrypsin, méně na α2-makroglobulin. Určitý podíl PSA v séru se vyskytuje ve volné podobě.
Doporučené použití pro klinické účely: Význam screeningu karcinomu prostaty pomocí sérového PSA u asymptomatických mužů je diskutabilní. Vyšetření je vhodné provádět u starších mužů se symptomy poruch močových cest, ev. s rodinnou zátěží. Pro odlišení benigní hyperplasie od karcinomu se stanovuje poměr volného a celkového PSA. Zvýšení PSA o více než 0,75 mg/L ročně ve třech po sobě jdoucích vyšetřeních znamená 90 % pravděpodobnost karcinomu prostaty. Hladiny PSA nad 30 mg/L mohou signalizovat i vzdálenější metastázy. Přetrvávající zvýšené koncentrace v séru po radikální prostatektomii znamenají buď přítomnost zbytkové choroby či lokální návrat. Monitorování má význam rovněž při terapii - pokles PSA obvykle koreluje s délkou přežití.
Příčinou zvýšené hladiny PSA v séru bývá též předchozí digitální rektální vyšetření prostaty, předchozí biopsie prostaty, transuretrální resekce nebo jiné mechanické dráždění prostaty. Z nemaligních onemocnění je zvýšení pozorováno u hyperplasie prostaty nebo prostatitidy.
Hodnocení: cut-off se mění v závislosti na věku – do 50 let = 2,5 μg/L, do 60 let = 3,5 μg/L, do 70 let = 4,5 μg/L, starší = 6,5 μg/L. Pro odlišení malignity a benigní hyperplazie prostaty při hodnotách celkového PSA 4-20 μg/L se stanovuje poměr mezi fPSA a PSA. Frakce fPSA/PSA bývá u maligního nádoru 0 – 15 %, hraniční hodnoty jsou 15 – 20%, u benigního onemocnění nad 20 %.
PHI
Hodnota „prekursorové formy“ nazývaná [-2]proPSA spolu s hodnotami PSA a volného PSA (FPSA) slouží pro výpočet PHI (Prostate Health Index, tj. indexu zdravé prostaty), který lze použít ke stanovení relativního rizika karcinomu prostaty u jednotlivých mužů. Jde o proprietární vyšetření konkrétního výrobce (Beckman Coulter).
[-2]proPSA je proenzymová forma prostatického specifického antigenu, je frakcí v plasmě cirkulujícího free PSA. Samostatné hodnoty stanovení [-2]proPSA se pro interpretaci nepoužívají.
PHI slouží jako vodítko pro léčbu pacienta, uvažuje procentuální podíl detekovaných karcinomů (klinická citlivost) a podíl mužů bez karcinomu, u nichž je možné se vyhnout biopsii (klinická specificita). PHI zpřesňuje diagnostiku při hodnotách celkového PSA 2-10 µg/L. Muži s vyšším celkovým PSA a [-2]proPSA a nižším fPSA mají vyšší riziko klinicky manifestního karcinomu. Klinická specificita pro PHI je 2-3 x vyšší v porovnání s fPSA (při senzitivitě 90 – 95 %). Hodnoty PHI korelují i s agresivitou nádoru a Gleason skóre. Použitím vyšetření [-2]proPSA a vyhodnocením PHI by se mohl snížit počet biopsií prostaty až o 18 %.
Pravděpodobnost karcinomu prostaty u mužů s PSA mezi 2 a 10 µg/L je při PHI vyšším než 40 velmi vysoká.
CA 72-4
Antigen CA 72-4 (Tumor-asociovaný antigen, TAG 72) je definovaný jako epitop mucinu reagující se dvěma monoklonálními protilátkami. Fyziologicky je produkován v žaludku, jícnu a pankreatu vyvíjejícího se plodu.
Doporučené použití pro klinické účely: CA 72-4 se používá pro monitorování maligních nádorů horního GIT a mucinového typu ovariálního karcinomu. CA 72-4 je nevhodný pro screening a stanovení diagnózy maligního procesu horního GIT. Jeho hladina koreluje s přítomností vzdálených metastáz. Užívá se k monitorování průběhu onemocnění především u karcinomu žaludku. Příčiny zvýšení CA72-4 v séru u nemaligních chorob obvykle zahrnují jaterní cirhózu, akutní pankreatitidu, chronickou bronchitidu, vředovou chorobu žaludku a zánětlivá onemocnění GIT.
Hodnocení: obvyklá hodnota cut-off je kolem7,0 kU/L.
S-100 beta
Vyskytuje se jako homo - nebo heterodimer tvořený z podjednotek α a β. S-100 beta protein byl poprvé popsán v centrálním nervovém systému. V nervové tkáni (v gliálních a Schwanových buňkách) se nachází především S-100 β-β dimer. Složení (α–α) mají např. příčně pruhované svaly.
Doporučené použití pro klinické účely: Melanomy jsou charakteristické obsahem β–podjednotky tohoto proteinu. Přítomnost této formy S-100 beta v séru svědčí pro jeho invazivitu. V dysplastických névech je naopak prokazována především α–podjednotka. Pro screening a diagnostiku se neužívá, je vhodný pro monitorování nemocných s maligním melanomem. U metastatického onemocnění bývají přítomny vysoké koncentrace tohoto markeru, rovněž senzitivita při metastatickém procesu je až 80 %. Koncentrace měřené před primární terapií mají vysokou prognostickou hodnotu. Pozitivní hodnoty lze nalézt i u mozkových maligních nádorů ektodermálního původu. Zvýšené hladiny S-100 beta v séru mohou být způsobeny i akutním poškozením mozku, kostními zlomeninami, zánětlivým a infekčním onemocněním.
Hodnocení: obvyklá hodnota cut-off je kolem 0,1 µg/L.
NSE (neuron-specifická enoláza)
Jde o izoenzym enolázy (2-fosfo-D-glycerát hydrolyáza, EC 4.2.1.11), který katalyzuje přeměnu 2-fosfoglycerátu na fosfoenolpyruvát. Fyziologicky jej produkuje nervová a plicní tkáň plodu, v dospělosti je jeho výskyt v normálním stavu vázán především na neurony.
Doporučené použití pro klinické účely: Vzhledem k obsahu NSE v červených krvinkách a destičkách je třeba provést oddělení krevních elementů do jedné hodiny od odběru bez jejich strukturálního poškození. NSE není vhodná pro screening a stanovení diagnózy maligního procesu. Pro pacienty s neuroblastomy a malobuněčným karcinomem plic (SCLC) má stanovení NSE prognostický význam. Zvýšené hodnoty NSE u neléčených nemocných se SCLC se mohou vyskytovat až u 80 % případů. Monitorování průběhu onemocnění je vhodné především u SCLC, neuroblastomů, meduloblastomů, retinoblastomů, dále „apudomů“ (starší termín pro skupinu karcinoidů, feochromocytomů), u nádorů ledvin, ev. i u seminomů, melanomu a prostaty. Nejvyšší hodnoty bývají popisovány u dobře diferencovaných ganglioneuroblastomů a ganglioneuromů. Senzitivita při rozsevu onemocnění u SCLC bývá až 80 %.
Příčiny zvýšení NSE v séru nemaligních lézí zahrnují plicní onemocnění nebo jaterní choroby. U tohoto markeru je nezbytné dbát na správnou preanalytiku, včas separovat sérum od krevních elementů a posuzovat hladinu NSE v kontextu míry hemolýzy analyzovaného vzorku.
Hodnocení: obvyklá hodnota cut-off je kolem 15 µg/L.
SCCA (antigen skvamózních buněk)
je definován jako složka směsného antigenu TA-4, prokázaném v séru u pacientek s karcinomem čípku děložního. Byly identifikovány dva homologní proteiny SCC1 a SCC2. Tyto antigeny byly charakterizovány jako serin proteinázové inhibitory, tzv. serpiny. Marker je výrazně citlivý na kontaminaci slinami nebo potem během preanalytické fáze.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy se neužívá. Vysoké hodnoty u neléčených nemocných s karcinomem cervixu jsou prognosticky významné pro odhad dalšího vývoje onemocnění. Monitorování průběhu onemocnění pomocí SCCA se provádí především u pacientů s nádory orofaciální oblasti, epidermoidních nádorů plic, děložního čípku, těla dělohy, endometria, vulvy a vaginy.
Příčiny zvýšení SCCA v séru u nemaligních lézí zahrnují nemaligní gynekologická a plicní onemocnění, kožní nebo jaterní choroby.
Hodnocení: obvyklá hodnota cut-off je kolem 1,5 µg/L.
CYFRA 21-1 (fragment cytokeratinu 19)
Jde o solubilní fragment cytokeratinu 19. Předpokládá se, že jeho výskyt v séru nemocných s maligními nádory může souviset se smrtí buňky apoptózou či nekrózou. Vzhledem ke specifickému výskytu tohoto cytokeratinu v epiteliálních buňkách skvamózního (epidermoidního) typu má CYFRA 21-1 vyšší tkáňovou specificitu než ostatní cytokeratinové markery TPA nebo TPS.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy maligního procesu nelze toto vyšetření použít. Jeho hladina obvykle koreluje se stadiem onemocnění. Monitorování průběhu onemocnění a především monitorování úspěšnosti terapie je hlavní oblastí využití tohoto markeru. Senzitivita u epidermoidních karcinomů plic se pohybuje kolem 55 %, u velkobuněčných karcinomů a adenokarcinomů plic je nižší (35 a 28 %). Význam má rovněž pro sledování nemocných s karcinomem močového měchýře (senzitivita asi 30 %) a epidermoidních nádorů cervixu (spolu s SCCA) a nádorů oblasti hlavy a krku.
Příčin zvýšení hladiny CYFRA 21-1 z nemaligních příčin je celá řada a zahrnují jaterní cirhózu, chronické onemocnění ledvin, astma bronchiale, infekce respiračního traktu a další.
Hodnocení: obvyklá hodnota cut-off je kolem 3,3 µg/L.
TPA, TPS (tkáňový polypeptidový /specifický/ antigen)
TPA je polypetid ze solubilních fragmentů cytokeratinů typu středních filament (cytokeratin 8, 18, a 19). Antigen s velice podobnou charakteristikou, definovaný na podkladě reaktivity s jinou monoklonální protilátkou byl nazván TPS (tkáňový polypeptidový specifický antigen odpovídající cytokeratinu 18).
Doporučené použití pro klinické účely: Jde o velmi nespecifické nádorové markery, jejichž užití v klinické praxi je obsolentní a poslední dobou klesá. Je markerem s dobrou senzitivitou pro sledování nemocných s karcinomem močového měchýře. Vyšetření tohoto markeru nelze použít pro screening, diagnózu a staging onemocnění. Lze jej případně využít pro monitorování nemocných s nádory prsu, plic, GIT a ledvin. Dynamika jeho změn při terapii je obvykle rychlejší než u markerů diferenciačního typu.
Nespecificky je TPA/S v séru zvýšen při některých onemocněních jater (cirhóza, hepatitida), rovněž tak u infekčních onemocnění.
Hodnocení: obvyklá hodnota cut-off TPS je kolem 140 U/L; obvyklá hodnota cut-off TPA je kolem 75 U/L.
TK (thymidinkináza)
TK patří k enzymům syntézy DNA charakteristickým pro proliferující tkáň.
Jde o ATP: thymidin-5-fosfotransferázu (EC 2.7.1.21), která existuje v eukaryotických buňkách ve dvou izoenzymech: TK1 (fetální TK) a TK2 („dospělá“ TK). Fetální izoenzym je vázán na proces buněčného dělení a je lokalizován v cytoplasmě. Izoenzym TK2 je naopak přítomen v mitochondriích a jeho aktivita je stabilní v průběhu celého buněčného cyklu. TK katalyzuje přeměnu thymidinu na thymidinmonofosfát, čímž je umožněna syntéza DNA náhradní cestou. Za fyziologických podmínek je TK intenzivně syntetizována především v játrech během vývoje plodu, po porodu se syntéza zpomaluje. V séru převažuje fetální forma (95 %z celkového množství).
Doporučené použití pro klinické účely: Jde o biomarker proliferace. Některá cytostatika blokují základní („de novo“) syntézu DNA (methotrexát, 5-fluorouracil); následně je stimulována aktivita enzymů náhradní cesty a TK vykazuje falešnou pozitivitu. Vyšetření je třeba provádět před nasazením uvedené chemoterapie.
Pro screening a stanovení diagnózy nelze stanovení TK použít. U hematologických malignit (především u akutní leukemie nebo nehodgkinských lymfomů) koreluje aktivita TK se závažností onemocnění. Monitorování průběhu onemocnění a úspěšnosti terapie je hlavní oblastí využití tohoto markeru. Zvýšení sérové TK bývá pozorováno rovněž u maligního melanomu, nádorů štítné žlázy, případně dalších solidních nádorů.
Zvýšení hladiny TK v séru z nemaligních příčin zahrnuje respirační viroinfekty s lymfocytární aktivací, zánětlivá onemocnění plic a trávicího ústrojí, infekce EB virem, cytomegaloviry nebo herpesviry a revmatická a obecně autoimunitní onemocnění. Obdobně jako u cytokeratinových fragmentů TPA/S jeho využití v klinické praxi poslední dobou klesá a vzhledem k dostupnosti vyšetření PET/CT a PET/MRI jej lze považovat za hraničně obsolentní.
Hodnocení: obvyklá hodnota cut-off je kolem 9 U/L.
CgA (chromogranin A)
Chromogranin je kyselý glykoprotein vyskytující se v sekrečních granulích normálních i neoplastických neuroendokrinních tkáních. Významně vhodnějším materiálem k vyšetření CgA je plazma, hodnoty v séru se mohou lišit od hodnot měřených v plazmě, obvykle jsou vyšší. Zároveň je poměrně velký rozdíl mezi hodnotami získanými soupravami rozdílných výrobců. Vyšetřovaný materiál je nutné transportovat a krátkodobě ukládat při laboratorní teplotě, dlouhodobě při teplotě nižší než – 20 °C. Pro účely klinického sledování pacienta pomocí CgA je zásadní použití jednoho typu vyšetřovaného materiálu a soupravy.
Doporučené použití pro klinické účely: CgA vykazuje nejvyšší senzitivitu u nemocných s neuroendokrinními malignitami při srovnání s dosud užívanými metodami stanovení NSE nebo kyseliny 5-hydroxyindoloctové v moči. Senzitivita průkazu návratu choroby pro karcinoidy se pohybuje kolem 70 – 90 %. CgA vykazuje korelaci se změnami odpovídajícími vývoji onemocnění (progrese, stabilizace, kompletní remise). Cirkulující CgA byl prokázán i u sporadických gastroenteropankreatických neuroendokrinních tumorů i u dědičných mnohočetných endokrinních neoplasií typu 1 (MEN), u dětských neuroblastomů i u neuroendokrinní diferenciace karcinomu prostaty nereagujících na hormonální léčbu.
Zvýšené hladiny chromograninu A v séru či plasmě najdeme při terapii kortikoidy a inhibitory protonové pumpy, poruchách ledvin a jater.
Hodnocení: obvyklá hodnota cut-off pro plazmu je kolem 35 μg/L; obvyklá hodnota cut-off pro sérum je 98,1 µg/L.
PIVKA-II
Biomarker PIVKA-II (Protein Induced by Vitamin K Absence/Antagonist-II) je protein indukovaný absencí vitaminu K nebo užíváním antagonistů protrombinu (warfarin) v lidském séru nebo plazmě. Stanovení slouží jako důležitý nástroj při diagnostice hepatocelulárního karcinomu (HCC). Výsledky se musí interpretovat ve spojení s dalšími metodami v souladu se standardními klinickými doporučeními. PIVKA-II má údajně vyšší diagnostickou účinnost než AFP při detekci hepatocelulárního karcinomu a jeho odlišení od jiných jaterních onemocnění, vyniká nad ostatními markery v diferenciální diagnostice primárního karcinomu jater a cirhózy (citlivost 86 % a specifičnost 93 %). Kombinace PIVKA-II a AFP může diagnostiku výrazně zlepšit. PIVKA-II je také nezávislým prediktorem přítomnosti HCC a lepším diagnostickým biomarkerem než AFP pro rozlišení nádorových a nenádorových lézí u pacientů s cirhózou, kteří mají na ultrazvuku suspektní ložiska v jaterní tkáni.
Hodnocení: pro zdravou populaci se koncentrace PIVKA-II pohybuje v rozmezí 13,5 – 28,4 µg/L.
P1NP (N-terminální propeptid prokolagenu typu 1)
Prokolagen typu 1 je syntetizován fibroblasty a osteoklasty a je složen z N-terminálních a C-terminálních propeptidů. Při konverzi prokolagenu na kolagen jsou tyto propeptidy štěpeny specifickými proteázami a následně jsou začleněny do matrix kostí. Stanovení P1NP je využíváno při léčbě osteoporózy a diagnostice kostního rozsevu solidních tumorů a mnohočetného myelomu.
Doporučené použití pro klinické účely: P1NP (prokolagen typu 1 N terminální propeptid) spolu s β–CTX (β-CrossLaps, C-terminální telopeptid), jsou doporučovány v diagnostice kostního rozsevu i hodnocení efektu terapie u různých solidních tumorů, nejčastěji karcinomu prostaty, zejména v terapii bisfosfonáty. Je vhodným markerem jak pro monitorování anabolické terapie (teriparitid, stroncium ranelát), tak také pro antiresorpční terapii (bisfosfonáty, kalcitonin, HRT). V prvním případě by úspěšná léčba měla být doprovázena 40% a vyšším zvýšením hladin P1NP oproti výchozí hodnotě u sledovaného pacienta. Naopak v případě antiresorpční léčby by mělo dojít k více než 40% poklesu hodnot oproti bazální hladině P1NP (IOF – International Osteoporosis Foundation, doporučuje tento analyt pro monitorování antiresorpční léčby). Doporučený interval monitoringu je šest měsíců.
Hodnocení: obvyklá hodnota cut-off pro maligní kostní lézi je u mužů do 65 µg/L, u žen do 74 µg/L.
ICTP (C – Telopeptid kolagenu typu I)
ICTP je koncová, nehelikální část kolagenu typu I. Jde o části peptidových řetězců, spojených pomocí vazeb (cross-links). Vylučuje se ledvinami, jejichž zhoršená funkce (filtrace pod 50 ml/min) ovlivňuje sérovou koncentraci ICTP.
Doporučené použití pro klinické účely: Senzitivita tohoto markeru pro osteolytické metastázy se pohybuje mezi 70 – 80 % při 90% specificitě vyšetření. U metastáz karcinomu prostaty bývá udávána senzitivita ICTP o něco nižší (převažující typ kostních metastáz je osteoplastický, tedy převažuje novotvorba kosti). Z nemaligních procesů je ICTP zvýšen u revmatoidní artritidy, při imobilizaci pacienta a onemocnění ledvin. Doporučený interval monitoringu je 6 měsíců.
Hodnocení: obvyklá hodnota cut-off je kolem 5,3 µg/L.
B2M (β2-mikroglobulin)
B2M tvoří extracelulární doménu lidského leukocytárního antigenu HLA I. třídy. Je přítomen téměř ve všech buňkách kromě erytrocytů a trofoblastických buněk.
Doporučené použití pro klinické účely: Stanovení nelze použít pro screening a diagnostiku maligního onemocnění. B2M je zvýšen u systémového onemocnění B-lymfocytárního systému, u mnohočetného myelomu, chronické lymfocytární leukemie a nehodgkinských lymfomů B-lymfocytárního původu. K určitému zvýšení B2M v případě rozsevu onemocnění dochází i u solidních karcinomů.
Zvýšené hladiny B2M v séru se vyskytují zejména u poruch funkce ledvin a chronických zánětlivých autoimunitních onemocnění.
Hodnocení: obvyklá hodnota cut-off je kolem 2,4 mg/L.
Feritin
Jde o protein podílející se na regulaci homeostázy železa. Za fyziologických podmínek je feritin produkován retikuloendoteliálními buňkami sleziny, jater a kostní dřeně.
Doporučené použití pro klinické účely: Jeho význam jako nádorového markeru v poslední době klesá. Koncentrace feritinu v séru jsou závislé na věku a pohlaví. Snížení hladiny feritinu ukazuje na anémii z nedostatku železa. U hematologických malignit koreluje obvykle jeho hladina se závažností onemocnění a stanovení feritinu se využívá pro monitorování průběhu onemocnění a především monitorování terapie. Feritin je zvýšen především u akutní myeloblastické leukemie, hodgkinského i nehodgkinského lymfomu a mnohočetného myelomu, nespecifické zvýšení provází nádory prsu, maligní melanomy a testikulární nádory.
Nemaligními příčinami zvýšení hladiny feritinu v séru jsou zejména akutní onemocnění nebo poruchy metabolismu železa (hemochromatóza nebo předávkování železem), nespecifické jaterní léze.
Hodnocení: cut-off pro premenopauzální ženy je 150 µg/L, pro muže a postmenopauzální ženy je 400 µg/L.
LD (laktátdehydrogenáza)
Jde o enzym tvořený dvěma rozličnými polypeptidovými řetězci, které formují pět izoenzymů. Na zvýšení LD u maligních onemocnění se podílí zejména izoenzym 1 a 2, u solidních nádorů i ostatní izoenzymy.
Doporučené použití pro klinické účely: je vhodným doplňkovým markerem zejména pro monitorování nemocných s diferencovanými lymfocytárními i histiocytárními typy nehodgkinských lymfomů, leukémií, ale i solidních nádorů (testikulárních a jiných).
Hodnocení: není jednotná hladina cut-off; nález je informativní při posouzení změny katalytické koncentrace LD mezi dvěma časově odlišenými odběry. U dětí je hodnota LD fyziologicky vyšší. Laboratořím se doporučuje používat jako cut-off hodnotu horní meze jejich vlastního referenčního intervalu. V průběhu některých maligních chorob je možné pozorovat enormní zvýšení katalytické koncentrace LD.
Kalcitonin
Je produkován za normálních okolností C-buňkami (tj. parafolikulárními buňkami) štítné žlázy. Kalcitonin je odštěpen z velkého prekurzorového proteinu prokalcitoninu před sekrecí do extracelulárního prostředí. Stimulem pro sekreci je hyperkalcémie.
Doporučené použití pro klinické účely: Diagnosticky se stanovení kalcitoninu používá zejména u nádorů C-buněk štítné žlázy, tzn. při medulárním karcinomu štítné žlázy, včetně výskytu tohoto tumoru v rámci MEN syndromu. Stanovení kalcitoninu se rovněž využívá při pentagastrinovém testu, kdy osoby s medulárním karcinomem tyreoidey mají po aplikaci pentagastrinu větší vzestup kalcitoninu než osoby zdravé.
Hodnocení: obvyklá hodnota cut-off je pro ženy 17 ng/L, pro muže 26 ng/L.
TG (tyreoglobulin)
Tyreoglobulin je glykosylovaný a jodovaný protein, který je velmi silným autoantigenem. Je tvořen dvěma identickými podjednotkami. Tyreoglobulin se užívá především jako nádorový marker po odstranění štítné žlázy při sledování terapie u dobře diferencovaných nádorů štítné žlázy.
Ke stanovení Tg je doporučeno užívat pouze metody, které jsou kalibrovány na mezinárodní standard CRM - 457.
Doporučené použití pro klinické účely: Patologicky zvýšené hladiny TG jsou charakteristické pro různé maligní onemocnění štítné žlázy, především dobře diferencovaný folikulární a papilární karcinom. Při vyšetření tyreoglobulinu je vhodné zároveň stanovit i anti-TG protilátky, které mohou interferovat při stanovení. Indikací k vyšetření je také přítomnost plicních a kostních metastáz z nejasného zdroje a existence patologických zlomenin – v těchto případech jsou hodnoty výrazně zvýšené. Stanovení TG se doporučuje pro sledování pacientů po odstranění štítné žlázy pro karcinom. Zvýšené hladiny TG v séru nalezneme u Graves-Basedowovy choroby, eufunkční nodózní strumy, v graviditě a u zánětů štítné žlázy.
Stanovení TG u nádorů štítné žlázy by mělo být vždy doplněno stanovením protilátek proti TG k vyloučení falešně nízké hodnoty TG.
Hodnocení: obvyklá hodnota cut-off v závislosti na použité metodě je kolem 40 µg/L.
ProGRP (pro-Gastrin-Releasing Peptid)
Je prekurzorem GRP (Gastrin-Releasing Peptide). GRP je neuropeptid produkovaný CNS a neuroendokrinními tkáněmi gatrointestinálního a dýchacího traktu a prostaty, jeho exprese je popsána u SCLC. Fyziologickou funkcí GRP je stimulace sekrece tkáňových hormonů (např. gastrin, somatostatin aj.) a účast v homeostatických mechanismech (regulace tělesné teploty, vazodilatace v respirační soustavě aj.) GRP má malou stabilitu (poločas 2 minuty) pro praktické použití k detekci SCLC se hodí jeho prekurzor – ProGRP.
Doporučené použití pro klinické účely: ProGRP má význam v diferenciální diagnostice malobuněčných a nemalobuněčných karcinomů plic. Pro SCLC má vysokou specificitu a senzitivitu (47 – 86 %). Exprese ProGRP u SCLC není závislá na stádiu onemocnění a stoupá již v jeho časných fázích, takže stanovení tohoto markeru má význam pro časnou detekci tumoru u rizikových pacientů. Další využití ProGRP je ve sledování průběhu choroby, účinnosti terapie a odhalení recidivy.
Hodnocení: obvyklá hodnota u benigních onemocnění: 2 – 60 ng/L, u NSCLC a ostatní tumorů do 100 ng/L (s výjimkou pacientů s poruchou funkce ledvin), u SCLC při normální funkci ledvin: > 100 ng/L.
Inhibin B
Jde o heterodimerický glykoprotein, který je složen z A-podjednotky a jedné ze dvou možných R-podjednotek, (3A nebo 3B, spojených disulfidickým můstkem). V tělních tekutinách u člověka se vyskytují volné A-podjednotky. Syntéza a sekrece dimerického inhibinu A a B je omezena na reprodukční systém (ovaria, testes a fetoplacentární jednotka. Sérový inhibin je ovariální hormon, který se podílí na regulaci fertility a jeho hladina se po menopauze snižuje na nedetekovatelnou hladinu.
Doporučené použití pro klinické účely: Inhibin B je považován za vhodný nádorový marker pro sledování karcinomů granulózových buněk, kde je jeho senzitivita až 100%. Zvýšené hodnoty inhibinu lze zjistit i u většiny benigních nádorů vaječníků, serózních i jiných ovariálních nádorů. Hladina inhibinu se po chirurgickém zákroku snižuje k normálu do osmi dnů.
Hodnocení: obvyklá hodnota cut-off je kolem 10 ng/L.
ACTH a ACTH - like substance
Kortikotropní hormon (ACTH, adrenokortikotropin), je jednoduchý polypeptid o 39 aminokyselinách. Sekvence prvních 24 aminokyselin je dostačující pro biologickou aktivitu hormonu. ACTH je syntetizován v bazofilních buňkách přední hypofýzy. Pro toto stanovení je vzhledem k cirkadiánnímu rytmu třeba provést odběr ráno mezi 06 : 00 – 10 : 00 hodinou do předchlazené (ale nenamražené!!) zkumavky s K3EDTA (jako pro krevní obraz), zkumavka se bezprostředně stočí v chlazené centrifuze. Získaná plazma se oddělí a zamrazí, v tomto stavu ji lze odeslat k analýze.
Doporučené použití pro klinické účely: Stanovení plazmatického ACTH je užitečné při studiích abnormalit osy hypotalamus-hypofýza-nadledviny, a to jak při odhalování příčiny nadměrné produkce kortizolu (Cushingův syndrom), tak i jeho nedostatečné sekrece (např. Addisonova nemoc). Stanovení může být použito rovněž při výskytu neuroendokrinních nádorů, např. u malobuněčného plicního karcinomu, kde se často podílí na paraneoplastických jevech.
Hodnocení: referenční rozmezí je obvykle 10 – 60 ng/L; jde o fyziologicky se vyskytující hormon, není proto definována hodnota cut-off pro návrat choroby.
6.1.2 Markery vyšetřované z krve i z moče
Monoklonální imunoglobuliny
Vyšetřování a diagnostika monoklonálních gamapatií je aktuálně a podrobně řešena v Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií (https://www.cskb.cz/wp-content/uploads/2020/04/dop-GP.pdf).
Katecholaminy a metanefriny
Katecholaminy jsou tvořeny dření nadledvin a uvolňují se do oběhu jako odpověď na fyzický či psychický stres. Katecholaminy jsou společným názvem pro dopamin, noradrenalin, adrenalin a jejich metabolity. Z chemického hlediska jde o alkylaminoderiváty o-dihydroxybenzenu (pyrokatecholu). Jejich zvýšené množství v krevní plazmě se vyskytuje u nádorů produkujících katecholaminy (neuroendokrinní nádory – feochromocytom, neuroblastom). Stanovení metanefrinů je v současné době považováno za nejlepší indikátor zvýšené neuroendokrinní aktivity.
Doporučené použití pro klinické účely: při diagnostice a sledování úspěšnosti léčby hormonálně aktivních neuroektodermálních tumorů – u dětí s nálezem nádoru v břiše při podezření na neuroblastom a u osob s příznaky zvýšeného vylučování katecholaminů (záchvatovitě zvýšený tlak krve, bušení srdce, těžké bolesti hlavy, pocení) při podezření na feochromocytom.
Dříve se v této indikaci vyšetřovala kyselina vanilmandlová, v současné době je toto vyšetření považováno za překonané.
Hodnocení katecholaminů závisí na konkrétním analytu, metodě a analyzovaném materiálu; indikující lékař se řídí hodnotami laboratoře, kam odeslal materiál k vyšetření.
6.1.3. Markery vyšetřované z moče
Kyselina 5-hydroxyindoloctová (5-HIAA)
Je svalovým stimulantem, primárním metabolitem serotoninu, který je vylučován močí. Velké množství serotoninu může být produkováno karcinoidními tumory, které se mohou tvořit v zažívacím traktu na slepém střevě nebo v plicní tkáni.
Doporučené použití pro klinické účely: Při sledování léčby karcinoidního tumoru (zde je markerem volby CgA) znamená snížení hladin 5-HIAA úspěšnost léčby. Nezměněné či zvyšující se hodnoty pak znamenají neúspěšnou léčbu. Ke stanovení se požívá vzorek moče z 24hodinového sběru, dva dny před sběrem a během sběru je třeba dodržovat dietu bez kofeinu, nikotinu, alkoholu, ovoce apod. Vliv má těhotenství, stres, deprese a řada léků (alfa-methyldopa, inhibitory monoaminoxidázy, antiparkinsonika, sulfonamidy, antibiotika, diuretika, salicyláty, benzodiazepiny, efedrin, paracetamol).
Hodnocení: obvyklá hodnota do 50 µmol/24 h.
6.1.4. Markery vyšetřované ze stolice
Hemoglobin ve stolici
Přítomnost hemoglobinu ve stolici je indikátorem krvácení do střeva či konečníku a využívá se pro screening kolorektálního karcinomu. V současnosti se upouští od testů využívajících pseudoperoxidázové reakce hemové části hemoglobinu („hemokult“) pro jejich nízkou spolehlivost. Pro stanovení hemoglobinu se používají imunoanalytické metody detekující bílkovinnou složku hemoglobinu. Stanovení hemoglobinu se provádí v rámci screeningu kolorektálního karcinomu schváleného vyhláškou MZ ČR u asymptomatických osob nad 50 let.
Kritickým krokem při vyšetření hemoglobinu ve stolici je odběr vzorku prováděný pacientem a pro spolehlivost testu je zásadní, aby byl pacient podrobně poučen.
Doporučené použití pro klinické účely: Přítomnost globinové složky hemoglobinu ukazuje na možnou přítomnost karcinomu a dle citlivosti zvoleného přístupu může odhalit také prekancerózy; zvýšené hodnoty jsou indikací ke koloskopii. Zjištěná hladina hemoglobinu koreluje s rizikem nádorového onemocnění. Při pozitivním nálezu se doporučuje provedení kolonoskopie; bez odkladu v případě vysokých hodnot. U hraničního nálezu je možné laboratorní vyšetření zopakovat ve více vzorcích.
Hodnocení: obvyklá hodnota cut-off je 15 μg/g stolice.
Schváleno výborem ČSKB dne: 9. 6. 2020
Sources
- Fateh-Moghadam, A., Stieber, P. Tumormar-ker und ihr sinnvoller Einsatz. J. Hartman Verlag GmbH. 1991
- Clamp, A., Danson, S., Nguyen, H., Cole, D., Clemons, M. Assessment of therapeutic response in patients with metastatic bone disease. Lancet Oncol., 2004, 5, s. 607-616.
- Diamandis, E. P. et al. Tumor markers: physio-logy, pathobiology, technology and clinical application. Washington: AACC Press, 2002, 542 s.
- International Germ Cell Cancer Collaborative Group (IGCCCG). (1997) International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin. Oncol., 1997, 15(2), s. 594-603.
- Soletormos, G., Semjonow, A., Sibley, P. E. C., Lamerz, R., Petersen, P. H., Albrecht, W., Bialk, P., Gion, M., Junker, F., Schmid, H.-P. et al. Biological Variation of Total Prostate-Specific Antigen: A Survey of Published Estimates and Consequences for Clinical Practice. Clin. Chem., 2005, 51, s. 1342-1351.
- Zima T. et al. Laboratorní diagnostika. 3. doplněné a přepracované vydání. Praha: Galén, 2013, 1146 s.
- Wu, J. T. Circulating tumor markers of new mille-nium: targer therapy, early detection and prognosis. Washington: AACC Press, 2002, 173 s.
- Choi, J. S., Min, J. S. Significance of postoperative serum level of carcinoembryonic antigen (CEA) and actual half life of CEA in colorectal cancer patients. Yonsei Med. J., 1997, 38(1), s 1-7.
- Yoshikawa, T., Takano, M., Kita, T., Kudoh, K., Sasaki, N., Kato, M., Watanabe, A., Miyamoto, M., Goto, T., Furuya, K. Normal serum CA125 half-life and normal serum nadir CA125 level in patients with ovarian cancers. Eur J Gynaecol. Oncol., 2012 33(3), s. 269-73.
- Murray, M. J., Nicholson, J. C. α-Fetoprotein. Arch. Dis. Child. Educ. Pract. Ed., 2011, 96(4), s. 141-147
- Yoshimasu, T., Maebeya, S., Suzuma, T., Bessho, T., Tanino, H., Arimoto, J., Sakurai, T., Naito, Y. Disappearance curves for tumor markers after resection of intrathoracic malignancies. Int. J Biol. Markers, 1999, 14(2), s. 99-105.
- Brändle, E., Hautmann, O., Bachem, M., Kleinschmidt, K., Gottfried, H. W., Grünert, A., Hautmann, R. E. Serum half-life time determination of free and total prostate-specific antigen following radical prostatectomy-a critical assessment. Uro-logy, 1999, 53(4), s. 722-30.
- Ghanem, G., Loir, B., Morandini, R., Sales, F., Lienard, D., Eggermont, A., Lejeune, F. EORTC Melanoma Group. On the release and half-life of S100B protein in the peripheral blood of melanoma patients. Int. J Cancer., 2001, 94(4), s. 586-90.
- Wolf, A. M. D., Wender, R. C., Etzioni, R. B., Thompson, I. M., D’Amico, A. V., Robert, J., Volk, R. J., Brooks, D. D., Dash, C., Guessous, I., Andrews, K., DeSantis, C., Smith, R. A. Ame-rican Cancer Society Guideline for the Early Detection of Prostate Cancer Update 2010. CA Cancer J Clin., 2010, 60, s. 70–98.
- Sturgeon, C. M., Diamandis, E. P. Use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers. Laboratory medicine practice guidelines. The American Association for Clinical Chemistry, 2009, 91 s.
- Kalfeřt, D., Ludvíková, M. Nádorové markery u dlaždicových karcinomů hlavy a krku. Onkologie, 2012, 6(5), s. 241-247
- Sturgeon, C. M., Diamandis, E. P. Use of tumor markers in liver, bladder, cervocal, and gast-ric cancers. Laboratory medicine practice guidelines. Laboratory medicine practice guidelines. The American Association for Clinical Chemistry, 2010, 64 s.
- Bidart, J. M., Thuillier, F., Augereau, C., Chalas, J., Daver, A., Jacob, N., Labrousse, F., Voitot, H. Kinetics of serum tumor marker concentrations and usefulness in clinical monitoring. Clin. Chem., 1999, 45(10), s. 1695-707.
- Doporučení pro laboratorní diagnostiku funkčních a autoimunních onemocnění štítné žlázy, Klin. Biochem. Metab., 2011, č. 1, s. 48-61. Dostupné na www: http://www.cskb.cz/res/file/KBM-pdf/2011/2011-1/dop-thyreo.pdf
- Plebani, M. HE4 Study Group. HE4 in gynecological cancers: report of a European investigators and experts meeting. Clin. Chem. Lab. Med., 2012, 50(12), s. 2127-36.
- Chovanec, J., Selingerova, I., Greplova, K., Antonsen, S. L., Nalezinska, M., Høgdall, C., Høgdall, E., Søgaard-Andersen, E., Jochumsen, K. M., Fabian, P., Valik, D., Zdrazilova-Dubska, L. Adjustment of serum HE4 to reduced glomerular filtration and its use in biomarker-based prediction of deep myometrial invasion in endometrial cancer. Oncotarget, 2017, 8(64), s. 108213-108222.
- Saitta, C. et al. PIVKA-II is a useful tool for diagnostic characterization of ultrasound-detected liver nodules in cirrhotic patients. Medicine, 2017, 96, 26, e7266.
- Guazzoni, G., Nava, L., Lazzeri, M. et al. Prostate-specific antigen (PSA) isoform p2PSA signifi-cantly improves the prediction of prostate cancer at initial extended prostate biopsies in patients with total PSA between 2.0 and 10 ng/ml: results of a prospective study in a clinical setting. Eur. Urol., 2011, 60(2), s. 214–222.
- Fuchsová, R., Topolčan, O., Vrzalova, J. et al. Přínos stanovení [-2]proPSA v diferenciální diagnostice karcinomu prostaty. Česká urologie, 2014, 18(1), s. 21–25.
- Duffy, M. J. Biomarkers for prostate cancer: Prostate-specific antigen and beyond. Clin. Chem. Lab. Med., 2020, 58(3), s. 326-339.
- Vávrová, J., Kušnierová, P., Maisnar, V., Šolcová, L. Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií. Klin. Biochem. Metab., 2020, 28(49), č. 1, s. 26-34.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2021 Issue 1-
All articles in this issue
- EDITORIAL
-
Kvantitativní stanovení hemoglobinu ve stolici -
preanalytické a analytické aspekty - Overview of biomarkers of synovial fluid in joint diseases
- Measurement of anti-SARS-CoV-2 antibodies nucleocapsid versus spike, ECLIA versus ELISA
- Analytes of clinical biochemistry and hematology in COVID-19
- Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře: POCT metody v ordinaci praktického lékaře
- Doporučení České společnosti klinické biochemie ČLS JEP k využití nádorových markerů v klinické praxi
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Measurement of anti-SARS-CoV-2 antibodies nucleocapsid versus spike, ECLIA versus ELISA
-
Kvantitativní stanovení hemoglobinu ve stolici -
preanalytické a analytické aspekty - Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře: POCT metody v ordinaci praktického lékaře
- Overview of biomarkers of synovial fluid in joint diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


