-
Medical journals
- Career
Prostate Health Index v porovnání s biopsií a pooperační histologií v predikci karcinomu prostaty
: P. Brož 1,4; O. Dolejšová 2; R. Fuchsová 1; O. Topolčan 1; J. Racek 4; H. Sedláčková 2; O. Hes 3; V. Eret 2; L. Pecen 1; M. Hora 2; R. Kučera 1
: Oddělení imunochemické diagnostiky FN a LF v Plzni, Univerzita Karlova v Praze 1; Urologická klinika FN Plzeň 2; Šiklův ústav patologie FN a LF v Plzni, Univerzita Karlova v Praze 3; Ústav klinické biochemie a hematologie FN a LF v Plzni, Univerzita Karlova v Praze 4
: Klin. Biochem. Metab., 27, 2019, No. 1, p. 9-15
Cíle: Posoudit vhodnost Prostate Health Indexu (PHI) jako parametru vhodného ke zhodnocení agresivity karcinomu prostaty (PC) v porovnání s výsledkem preoperační biopsie a pooperační histologie prostaty.
Metodika: Do studie bylo zařazeno 474 pacientů indikovaných k radikální prostatektomii, u kterých byly preoperačně zjištěny koncentrace prostatického specifického antigenu (PSA), free PSA (fPSA), [-2]proPSA a vypočteny hodnoty %freePSA a PHI. Gleasonovo skóre (GS) bylo stanoveno z preoperačního bioptického vyšetření a z pooperační histologie po radikální prostatektomii. Za pomoci hodnoty GS byly vytvořeny 2 podskupiny: GS6 a GS≥7. Toto rozdělení bylo provedeno dvakrát, nejprve na základě výsledků preoperační biopsie, podruhé dle závěru pooperační histologie. Následně bylo provedeno porovnání hodnot PSA, [-2]proPSA, %freePSA a PHI mezi skupinami s GS6 a GS≥7 jak pro rozdělení dle preoperační biopsie, tak pro rozdělení dle pooperační histologie.
Výsledky: Při porovnání sledovaných parametrů mezi skupinami GS6 a GS≥7 vytvořených na podkladě výsledků preoperační biopsie byl zjištěn statisticky významný rozdíl v případě [-2]proPSA, PHI a PSA (p < 0,0001, p < 0,0001 a p = 0,0012), v případě %freePSA nebyl zjištěn statisticky významný rozdíl (p = 0,9306). Při porovnání sledovaných parametrů na základě definitivního GS byl mezi skupinami GS6 a GS≥7 zjištěn statisticky významný rozdíl ve všech sledovaných parametrech: PHI, [-2]proPSA, %freePSA a PSA (p < 0,0001, p < 0,0001, p < 0,0001 a p = 0,0012). Nejlepší hodnoty plochy pod křivkou (AUC) bylo dosaženo v případě PHI při rozdělení pacientů do skupin dle GS zjištěného na základě pooperační histologie (0,7649).
Závěr: PHI je nejlepší ze sledovaných parametrů při kategorizaci pacientů na GS6 a GS≥7. Jeho implementace do zavedených algoritmů může být přínosem v diagnosticko-terapeutickém managementu pacientů s PC. PHI může pomoci při volbě mezi sledováním a radikální prostatektomií, případně zjednodušit rozhodování, zda zvolit šetrnější chirurgický zákrok nebo radikálnější postup.
Klíčová slova:
Prostate Health Index – prostatický specifický antigen – rakovina prostaty – Gleason skóre – biopsie prostaty – radikální prostatektomie
Úvod
Prostatický specifický antigen (PSA) byl dlouho užíván v diagnostice karcinomu prostaty (prostate cancer - PC). Celkový PSA (tPSA) měl však v této indikaci omezenou diagnostickou senzitivitu i specifičnost. Nízká specifičnost vedla ke zvýšenému počtu biopsií prostaty a léčbě v neindikovaných případech, na druhé straně nízká senzitivita byla příčinou nedostatečné schopnosti detekovat zejména „low grade“ PC [1,2]. Zejména v nižších koncentracích nebyl PSA schopen spolehlivě identifikovat pacienty s PC. Uvedení [-2]proPSA a zejména Prostate Health Indexu (PHI) do klinické a laboratorní praxe vedlo ke zlepšení identifikace pa-cientů s PC [3]. Nyní tvoří PHI součást diagnostického algoritmu PC nejen před provedením biopsie prostaty, ale současně je využitelný v diagnosticko-léčebném procesu u pacientů podstupujících radikální prostatektomii (RP).
Od 60. let minulého století je užíváno GS jako jeden z hlavních nástrojů v diagnostice PC. Jedná se o systém pro „grading“ PC, který je založen na vzhledu vyšetřované tkáně ať z materiálu získaného punkční biopsií prostaty, transuretrální resekcí prostaty nebo ze vzorků po radikální prostatektomii. GS je jedním z klíčových faktorů rozhodujících o léčebném postupu. Hodnota GS může nabývat hodnot od 1 do 10, číslo je dáno v případě biopsie prostaty součtem nejčastějšího nálezu a nálezu s nejvyšším grade, v případě pacientů po resekci prostaty pak součtem nálezu u největšího ložiska a druhého největšího ložiska, popř. třetího nejčastěji zastoupeného nálezu, je-li přítomen ve více jak 5 % nádoru a má-li vyšší grade než největší ložisko. Systém hodnocení byl v průběhu let několikrát revidován a přepracován. Poslední revize byla provedena v roce 2016, kdy Mezinárodní uropatologickou společností (International Society of Urological Patology-ISUP) bylo GS6 klasifikováno jako ISUP grade 1, zatímco GS7 (3+4) bylo nově klasifikováno jako ISUP grade 2, GS7 (4+3) jako ISUP grade 3, GS8 jako ISUP grade 4 a GS9-10 jako ISUP grade 5 [4,5]. Jedna z největších recentních prací, multicentrická studie PROMETHEUS, potvrdila, že PHI je významným prediktorem PC a koreluje s hodnocením pomocí GS zjištěným biopticky [6].
V současnosti je stále snaha o nalezení dalších parametrů využitelných v diagnostice PC k predikci agresivity PC. Cílem naší studie je vyhodnotit PHI jako parametr použitelný k posouzení agresivity PC s ohledem na výsledek GS a jako parametr podílející se na volbě optimální léčebné strategie. Zaměřili jsme se zejména na případy s GS≤6, což je bráno jako stádium s velmi nízkým rizikem pro pacienta a některými autory je posuzováno jako hraniční z hlediska přítomnosti neoplazie [7,8].
Materiál a metody
Do studie byly zařazeny vzorky 474 pacientů nasbírané v období mezi červencem roku 2013 a červnem roku 2016. Ve všech případech byla provedena biopsie a následně RP. Základní charakteristiky souboru pa-cientů shrnuje Tabulka 1. Mezi indikační kritéria biopsie prostaty na Urologické klinice FN Plzeň t.č. patří: přítomnost uzlu při transrektálním vyšetření prostaty, hodnota PSA nad 20 µg/l a PHI nad 40. Před každou biopsií bylo provedeno vyšetření magnetickou rezonancí. Pacienti, u kterých nebyla provedena RP, byli vyloučeni ze studie, stejně tak pacienti léčení dutasteridem nebo pacienti s dříve provedenou biopsií prostaty.
1. Basic characteristics of patients and assessed parameters. Distribution of patients in groups according to the biopsy and definitive Gleason score. 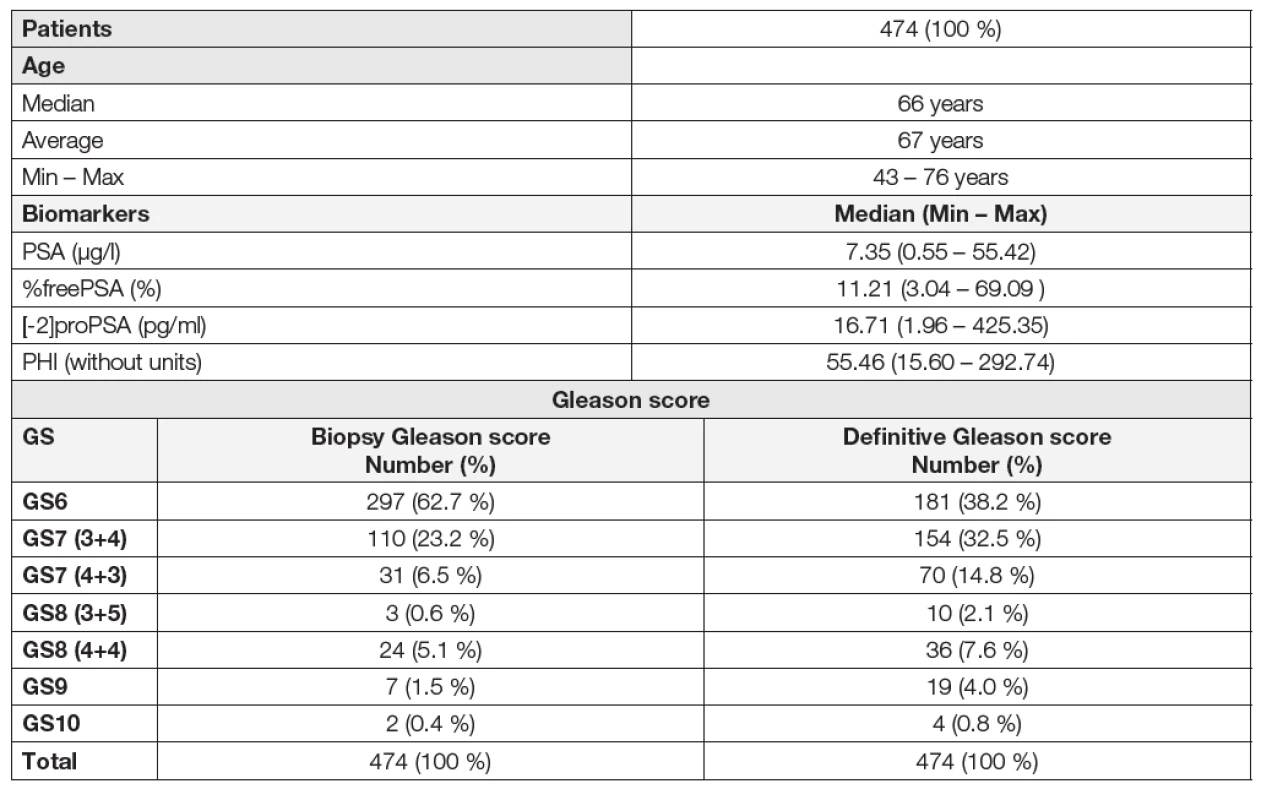
U všech pacientů byla určena hodnota GS na základě transrektální biopsie prostaty pod sonografickou kontrolou. Ve všech případech bylo při biopsii odebráno 12 vzorků. Následně byla na Urologické klinice FN Plzeň provedena laparoskopická RP a zkušeným patologem určena definitivní hodnota GS [9]. Na základě hodnot GS byla skupina pacientů rozdělena na dvě podskupiny: GS6 a GS≥7. Rozdělení bylo provedeno dvakrát, nejprve na podkladě hodnot GS z biopsie, podruhé dle definitivního GS stanoveného pooperačně.
U všech pacientů byly před jakýmkoli diagnostickým a léčebným zásahem odebrány vzorky krve do sérových zkumavek VACUETTE Z Serum Sep tubes (Greiner Bio-One, Kremsmünster, Austria). Vzorky byly zcentrifugovány do tří hodin od odběru a analyzovány. Koncentrace celkového PSA (tPSA), freePSA (fPSA) a [-2]proPSA byly analyzovány systémem ACCESS za užití originálních kitů firmy Beckman Coulter (Beckman Coulter, Brea, California). Procento freePSA (%freePSA) a PHI byly vypočteny užitím vztahů:
Hodnoty PSA, %freePSA, [-2]proPSA a PHI byly porovnány mezi oběma skupinami (GS6 a GS≥7) vytvořenými na základě rozdělení dle preoperační biopsie a poté i pooperační histologie.
Ke statistickému zhodnocení byl užit SAS 9.2 software (Statistical Analysis Software 9.2; SAS Institute Inc, Carry, North Carolina). Data jsou prezentována jako medián, dolní a horní kvartil, minimum a maximum. Byla sestrojena Receiver operating characteristic křivka (ROC) a vypočtena plocha pod křivkou (AUC). Byly určeny hodnoty cut off, odpovídající diagnostická senzitivita, specifičnost, pozitivní prediktivní hodnota (PV+), negativní prediktivní hodnota (PV-) a relativní riziko pro PHI. Wilcoxonův test byl užit ke srovnání hodnot mezi jednotlivými skupinami pacientů. Hodnota p<0,05 byla považována za statisticky významnou. Statistická významnost rozdílů mezi AUC jednotlivých křivek byla porovnána pomocí neparametrického přístupu dle DeLonga [10]. Studie byla schválena etickou komisí FN Plzeň 3. května 2012. Všichni pacienti zařazení do studie podepsali informovaný souhlas o účasti ve studii.
Výsledky
Jak dokladují data v Tabulkách 2 a 3, v naší kohortě 474 pacientů byla zjištěna rozdílná distribuce pacientů mezi skupinami GS6 a GS≥7 rozdělených na podkladě preoperační biopsie a pooperační histologie prostaty. Distribuce pacientů mezi jednotlivými skupinami (GS6/GS≥7) byla na podkladě preoperační biopsie 297/177, zatímco na podkladě pooperační histologie byla 181/293.
2. Data according to the biopsy Gleason score (GS6 vs GS≥7). 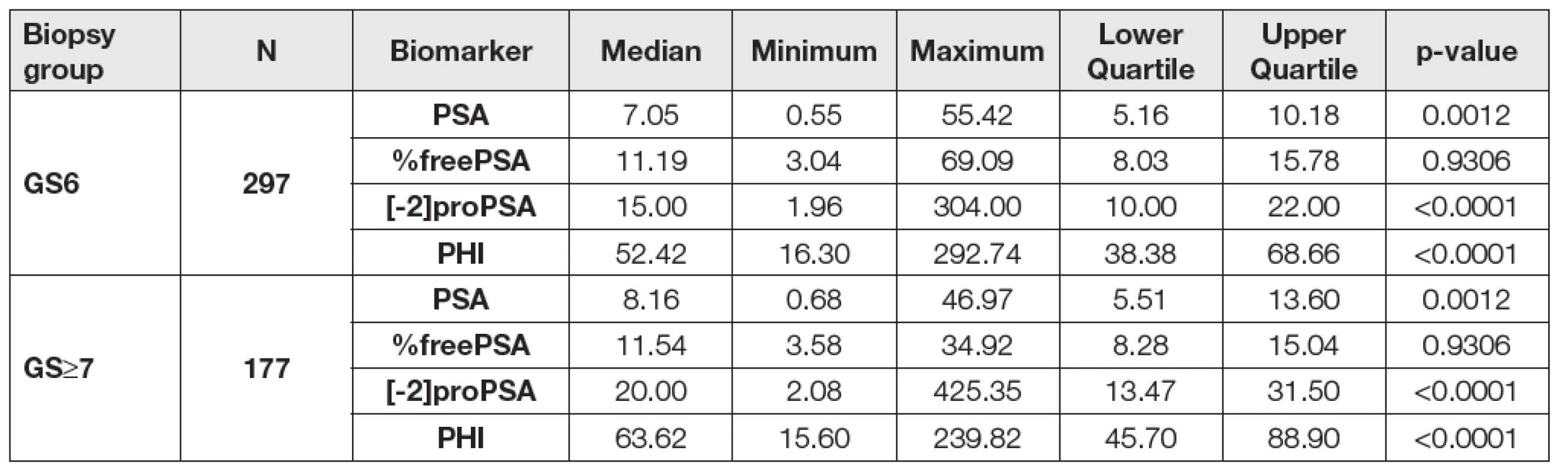
Units: PSA (μg/L), %freePSA (%), [-2]proPSA (pg/mL), PHI (without units). 3. Data according to the definitive Gleason score after radical prostatectomy (GS6 vs GS≥7). 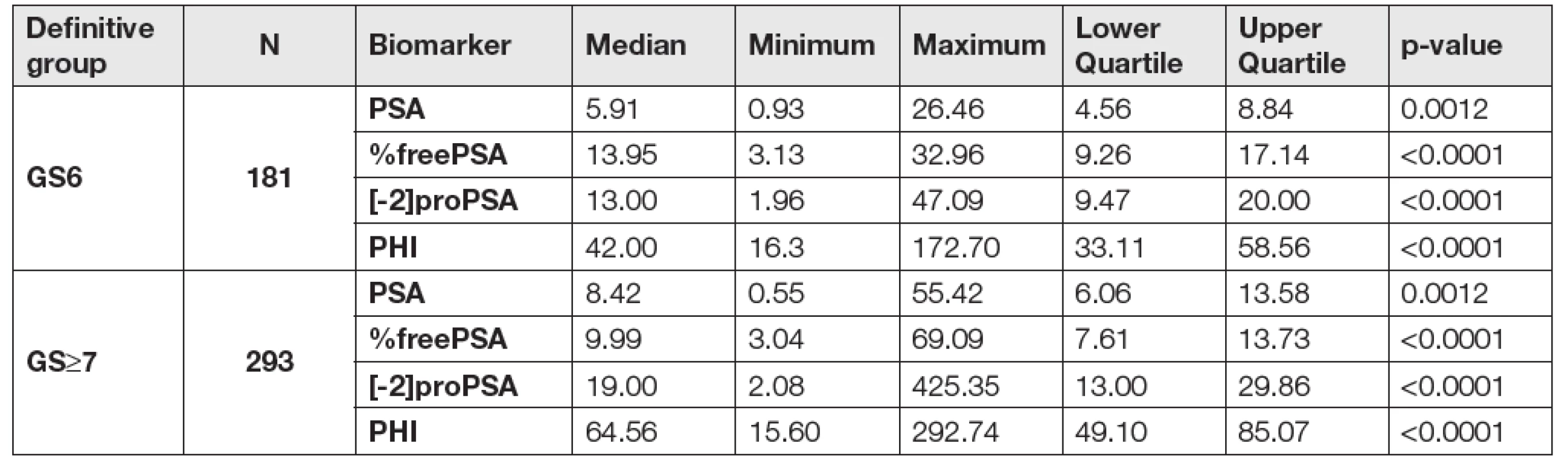
Units: PSA (μg/L), %freePSA (%), [-2]proPSA (pg/mL), PHI (without units). Při porovnání hodnot sledovaných parametrů mezi skupinami GS6 a GS≥7 určených dle preoperační biopsie byly mezi skupinami GS6 a GS≥7 shledány statisticky signifikantní rozdíly v případě [-2]proPSA, PHI a PSA (p < 0,0001, p < 0,0001 a p = 0,0012), v případě %freePSA nebyl zjištěn statisticky významný rozdíl (p = 0,9306). Data jsou shrnuta v Tabulce 2. V případě skupin GS6 a GS≥7 určených dle pooperační histologie byly statisticky signifikantní rozdíly shledány v případě PHI, [-2]proPSA, %freePSA i PSA (p < 0,0001, p < 0,0001, p < 0,0001 a p = 0,0012; Tabulka 3). ROC křivky sledovaných parametrů pro rozlišení mezi podskupinami GS6 a GS≥7 určenými dle preoperační biopsie a pooperační histologie jsou znázorněny na Obr. 1 a 2. Jak je patrné z grafů, nejlepších hodnot AUC bylo dosaženo v případě PHI vzhledem ke GS určeným dle pooperační histologie (AUC = 0,7649). AUC hodnoty sledovaných parametrů shrnuje Tabulka 4.
4. Area under the curve according to the biopsy Gleason score (GS6 vs GS≥7) and definitive Gleason score after radical prostatectomy (GS6 vs GS≥7). 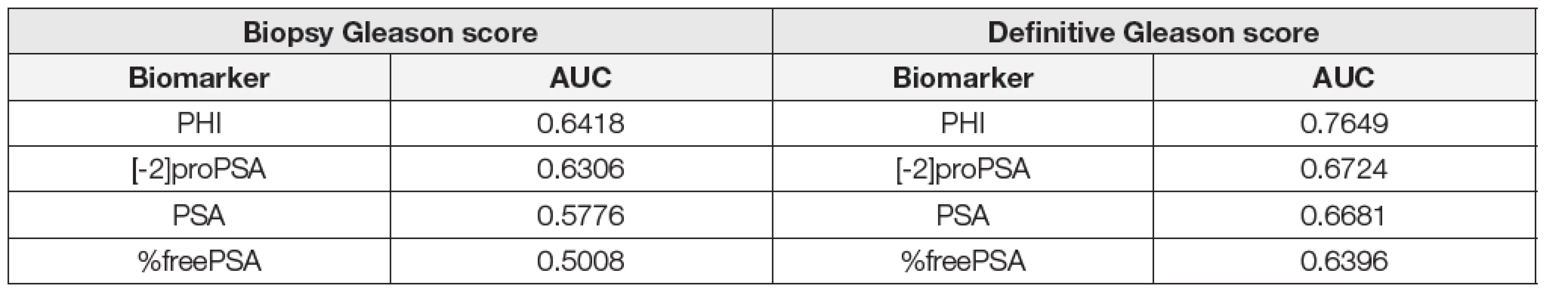
1. Receiver operating characteristic curves of assessed parameters according to the biopsy Gleason score (GS6 vs GS≥7). Details stated in Table 4. 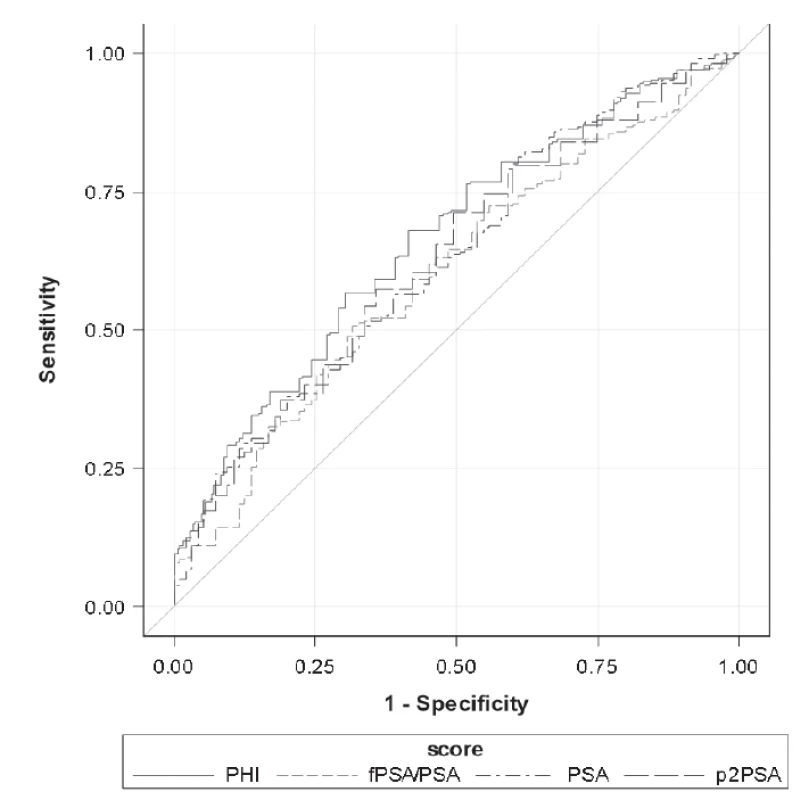
2. Receiver operating characteristic curves of assessed parameters for the defi nitive Gleason score after radical prostatectomy (GS6 vs GS≥7). Details stated in Table 4. 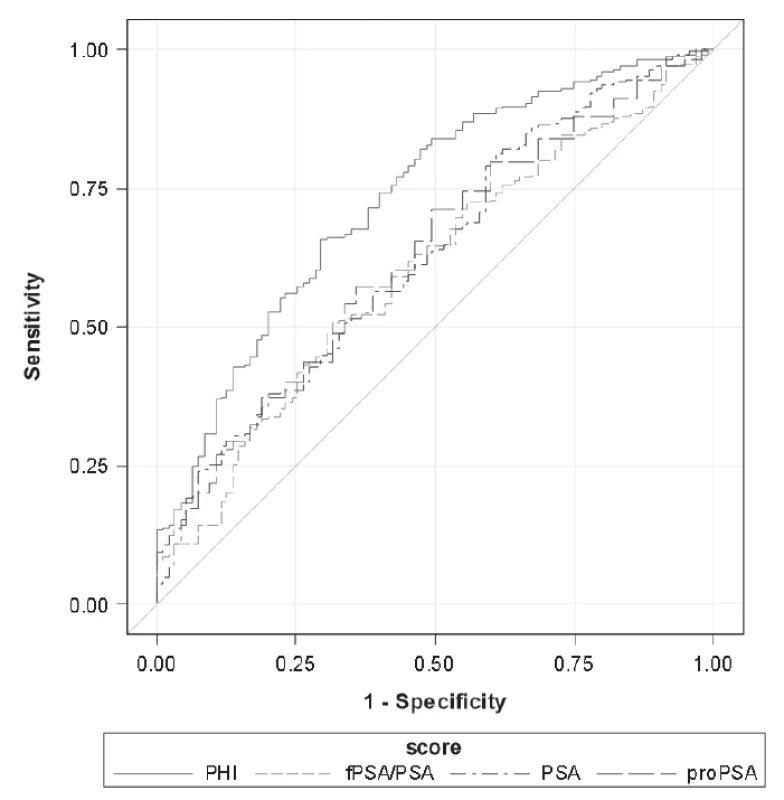
Diskuse
Žádný dostupný biomarker nemá sám o sobě dostačující vlastnosti k detekci a stratifikaci rizika PC. PHI se zdá být jednoduché a cenově dostupné řešení použitelné nejen v diagnostice, ale i managementu léčby pacientů s PC. PHI zvyšuje možnost odlišit iniciální stadia PC od pokročilých, případně od nenádorového postižení, např. chronického zánětu prostaty. Současně zvyšuje možnost predikce přítomnosti méně agresivních forem PC. PHI je vhodný rovněž k detekci možné přítomnosti recidivy PC u pacientů po RP [11].
Sanda a kol. na podkladě vyhodnocení PHI ve skupině 658 mužů s PC uvádí, že PHI zvyšuje možnost predikovat přítomnost „high-grade“ PC u pacientů s hodnotou PSA 4-10 ng/ml. Udává rovněž významnou korelaci hodnot PHI s biopticky zjištěnou hodnotou GS [12]. Lazzeri a spolupracovníci po vyhodnocení dat z multicentrické evropské studie PROMETHEUS zjistili, že [-2]proPSA jako proenzymová forma celkového PSA a parametry z něj odvozené, tedy %[-2]proPSA a PHI, jsou významné nezávislé prediktory PC ve vysoce rizikové populaci mužů s rodinnou anamnézou PC [6]. Jiní autoři poukazují na souvislost [-2]proPSA a PHI s výsledkem GS určeného z biopsie prostaty [13]. Naše závěry jsou ve shodě s výsledky této studie. Při porovnání hodnot sledovaných parametrů jsme při porovnání skupin GS6 a GS≥7 určených na základě preoperační biopsie zjistili statisticky signifikantní rozdíly v případě [-2]proPSA i PHI.
Výsledky metaanalýzy Wanga a kol. uvádí, že je možno pomocí PHI spolehlivě detekovat přítomnost PC s GS≥7 (AUC=0,90) [14]. V naší studii jsme se rozhodli hledat možnost, jak odlišit skupiny pacientů s GS6 a GS≥7, protože se jedná o významnou mez při volbě dalšího léčebného postupu, kdy se rozhoduje mezi aktivním sledováním a RP. Navzdory námi zvolené hodnotě GS = 6 v porovnání s uvedenou metaanalýzou vedly naše závěry k podobným závěrům. Nejlepších vlastností ROC křivky u PHI bylo dosaženo v případě, že hodnota GS byla zjištěna pomocí pooperační histologie (AUC = 0,7649; Tabulka 4, Obr. 2). Při porovnání AUC hodnot na základě určení GS pomocí preoperační biopsie je patrné, že přidání dalších parametrů nevede k významnému zvýšení diagnostické efektivity, přestože je možno vidět, že PHI patří mezi nejvhodnější z testovaných parametrů. Naopak z pohledu odlišení skupin GS6 a GS≥7 určených na podkladě pooperační histologie je patrné, že přidání [-2]proPSA a výpočet PHI zvyšuje v porovnání s celkovým PSA a %freePSA diagnostickou efektivitu (Tabulka 4).
Bioptické vyšetření hraje důležitou roli v doporučení pro diagnostiku a staging PC. Stanovení diagnózy PC je závislé na histopatologickém potvrzení. Naše data vykazují poměrně velkou nepřesnost při srovnání GS určeném pomocí preoperační biopsie a pooperační histologie. Stratifikace rizika je však jeden z významných faktorů při plánování strategie léčby. Na základě našich výsledků je možno s významně větší pravděpodobností odlišit, zda je biopticky potvrzený GS6 nález opravdu přítomen a zda je možno jej klasifikovat jako low-risk nález či nikoli. Tato klasifikace je klíčová pro následnou strategii léčby. Diagnostika low-risk nádoru mnohem častěji umožňuje volit konzervativnější postup místo radikálního chirurgického zákroku.
Dle aktuálních doporučení je aktivní sledování jednou z možností u pacientů s low-risk nálezy. Ačkoli rozhodovací kritéria nejsou ještě plně stanovena, jedno kritérium je jasné, za nízce rizikový nález z hlediska hodnoty GS se považuje GS6 a nižší [16-20]. Doporučení Evropské urologické asociace (EAU) v této problematice je diskutováno níže. Aktuálně jsou zkoumány další možnosti, jak docílit lepšího odlišení pacientů s low-risk a high-risk nálezy. Recentní data naznačují, že izoformy PSA, např. „prostate cancer antigene 3“ gen (PCA3) a genomické testy založené na analýze prostatické tkáně mohou být dalšími slibnými možnostmi z hlediska např. diferenciální diagnostiky [21]. Z pohledu prognostického významu je však v recentní přehledové publikaci zaměřené na biomarkery PC zmíněný PCA3 v porovnání s PHI uváděn jako marker méně vhodný [22]. V souladu s touto přehledovou prací naše data rovněž prokazují možnost využití PHI jako parametru vhodného k identifikaci pacientů s GS6 nálezem.
Jednou z dalších aktuálních otázek je radikálnost chirurgického zákroku u pacientů s PC. Základními možnostmi jsou RP a šetrnější tzv. nervy šetřící RP. Druhý zmiňovaný zákrok má neoddiskutovatelný příznivý efekt na zachování erektilní funkce, pooperační močovou inkontinenci a tedy celkovou kvalitu života pacienta po zákroku [16]. Dle doporučení EAU může být nervy šetřící zákrok proveden bezpečně u mužů s low-risk PC. Pacienti s high-risk nálezem a přítomností extrakapsulárního nálezu (kategorie T3 podle TNM klasifikace) ve stádiu GS7 a vyšším dle biopsie jsou k tomuto výkonu kontraindikováni. K predikci šíření PC extrakapsulárně jsou t.č. užívány nomogramy, současně též multiparametrická magnetická rezonance napomáhá k odlišení low - a high-risk pacientů [18]. V naší studii jsme se pokusili stanovit cut-off hodnotu pro PHI založenou na pooperačním GS k odlišení GS6 a GS≥7 nálezů. Cut off hodnota musí být nastavena tak, aby pouze pacienti s high-risk nálezy měli s nejvyšší pravděpodobností hodnoty vyšší než stanovená mez. Vybrali jsme hodnoty PHI 34 a 39. (Tabulka 5). Je-li nádor klasifikován jako GS6 a PHI hodnota je pod 34 (39), existuje vysoká pravděpodobnost, že se jedná o low-grade nádor. Naše závěry jsou velmi podobné závěrům uvedeným v Doporučení National Comprehensive Cancer Network (NCCN). Aktuální doporučení NCCN k časné detekci PC uvádí, že u mužů s PSA>3 µg/l a PHI>35 je vysoká pravděpodobnost přítomnosti high-grade PC [21].
5. Cut-off PHI based on the post-operative Gleason score (GS6 vs GS≥7). 
PV+; positive predictive value, PV-; negative predictive value, RR; relative risk. Jak je patrné z výsledků naší práce, PHI napomáhá v souvislosti s hodnocením GS lepší identifikaci nálezů, které jsou dle definitivní histologie hodnoceny jako GS6. Důsledkem je možnost lépe identifikovat pacienty indikované k observaci nebo šetrnějšímu chirurgickému zákroku.
Závěr
Testovali jsme panel aktuálních parametrů užívaných v diagnostice a sledování pacientů s PC a jejich schopnost odlišit mezi GS6 nálezy a nálezy GS≥7. Prokázali jsme, že PHI je parametr s nejlepšími vlastnostmi z testovaného panelu. PHI může lépe odlišit GS6 nálezy a zjednodušit rozhodování při volbě správného léčebného postupu u pacientů s PC. Jedná se o užitečný marker při rozhodování mezi aktivním sledováním a RP. V případech, kdy je indikována chirurgická léčba, může PHI napomoci při rozhodování mezi šetrnějším nebo radikálnějším postupem. Navzdory pozitivním zkušenostem s PHI je vyhledávání nových biomarkerů za účelem posouzení agresivity nálezů stále nezbytné.
Tato studie byla podpořena z projektu Ministerstva zdravotnictví České republiky Institucionální podpora na dlouhodobý koncepční rozvoj výzkumné organizace 00669806 – FN Plzeň.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 24. 10. 2018
Adresa pro korespondenci:
MUDr. Pavel Brož
Ústav klinické biochemie a hematologie FN Plzeň
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
Email: brozp@fnplzen.cz
Sources
1. Fuchsova, R., Topolcan, O., Windrichova, J., et al. PHI in the Early Detection of Prostate Cancer. Anticancer. Res. 2015, 35(9), p. 4855–7.
2. Wilt, T. J., Jones, K. M., Barry, M. J., et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Enql. J Med., 2017, 377(2), p. 132-142. doi: 10.1056/NEJMoa1615869.
3. Maxeiner, A., Kilic, E., Matalon, J., et al. The prostate health index PHI predicts oncological outcome and biochemical recurrence after radical prostatectomy - analysis in 437 patients. Oncotarget 2017. doi: 10.18632/oncotarget.17476. [Epub ahead of print].
4. Epstein, J. I., Egevad, L., Amin, M. B., et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg. Pathol., 2016, 40(2), p. 244-52. doi: 10.1097/PAS.0000000000000530.
5. Epstein, J. I., Zelefsky, M. J., Sjoberg, D. D., et al. A Contemporary Prostate Cancer Grading System: A Validated Alternative to the Gleason Score. Eur Urol., 2016, 69(3), p. 428–35.
6. Fossati, N., Buffi, N. M., Haese, A. et al. Preoperative Prostate-specific Antigen Isoform p2PSA and Its Derivatives, %p2PSA and Prostate Health Index, Predict Pathologic Outcomes in Patients Undergoing Radical Prostatectomy for Prostate Cancer: Results from a Multicentric European Prospective Study. Eur. Urol., 2016, 68(1), p. 132–8.
7. Kulac, I., Haffner, M. C., Yegnasubramanian, S., Epstein, J. I., De Marzo, A. M. Should Gleason 6 be labeled as cancer? Curr. Opin. Urol., 2015, 25(3), p. 238–45.
8. Carter, H. B., Partin, A. W., Walsh, P. C., et al. Gleason Score 6 Adenocarcinoma: Should It Be Labeled As Cancer? J Clin. Oncol., 2012, 30(35), p. 4294–6.
9. Pivovarcikova, K., Branzovsky, J., Bauleth, K., et al. Radical prostatectomy – analysis of 191 cases examined using whole-mount section method Czech Urol., 2014, 18(1), p. 26–32.
10. DeLong, E. R., DeLong, D. M., Clarke-Pearson, D. L. Comparing the Areas under Two or More Correlated Receiver Operating Characteristic Curves: A Nonparametric Approach. Biometrics, 1988, 44(3), p. 837–45.
11. Lepor, A., Catalona, W. J., Loeb, S. The Prostate Health Index: Its Utility in Prostate Cancer Detection. Urol. Clin. North. Am., 2016, 43(1), p. 1-6. doi:10.1016/j.ucl.2015.08.001.
12. Sanda, M., Wei, J., Broyles, D., Shin, S., Partin, A., Klee, G., et al. (2013) Evaluation of the Prostate Health Index (PHI) for improving prostate cancer detection and identification of clinically significant prostate cancer in the 4 to 10 ng/mL PSA range. In: Proceedings of American Urological Association Annual Meeting, San Diego.
13. Lazzeri, M., Haese, A., Abrate, A., et al. Clinical performance of serum prostate-specific antigen isoform
[-2]proPSA (p2PSA) and its derivatives, %p2PSA and the prostate health index (PHI), in men with a family history of prostate cancer: results from a multicentre European study, the PROMEtheuS project. BJU Int., 2013, 112(3), p. 313–21.14. Wang, W., Wang, M., Wang, L. et al. Diagnostic abi-lity of %p2PSA and prostate health index for aggressive prostate cancer: a meta-analysis. Sci Rep., 2014, 4, p. 5012.
15. Heidenreich, A., Aus, G., Bolla, M., Joniau, S. et al. European Association of Urology. EAU guidelines on prostate cancer. Eur Urol., 2008, 53(1), p. 68-80.
16. Toren, P., Alibhai, S. M., Matthew, A., et al The effect of nerve-sparing surgery on patient-reported continence post-radical prostatectomy. Can. Urol. Assoc. J., 2009, 3(6), p. 465-70.
17. Friedersdorff, F., Groß, B., Maxeiner, A., et al. Does the Prostate Health Index Depend on Tumor Volume?—A Study on 196 Patients after Radical Prostatectomy. Int. J Mol. Sci., 2017, 18(3), p. 488.
18. Beauval, J. B., Cabarrou, B., Gandaglia, G., et al. External validation of a nomogram for identification of pathologically favorable disease in intermediate risk prostate cancer patients. Prostate. 2017, 77(8), p. 928-933. doi: 10.1002/pros.23348.
19. Gandaglia, G., Schiffmann, J., Schlomm, T., et al. Identification of pathologically favorable disease in intermediate-risk prostate cancer patients: Implications for active surveillance candidates. Prostate. 2015, 75(13), p. 1484-91. doi: 10.1002/pros.23040.
20. Hendriks, R. J., van Oort, I. M., Schalken, J. A. Blood-based and urinary prostate cancer biomarkers: a review and comparison of novel biomarkers for detection and treatment decisions. Prostate Cancer Prostatic Dis., 2017, 20(1), p. 12–9.
21. NCCN Guidelines Version 1.2018, Prostate Cancer Early Detection, National Comprehensive Cancer Network, 2018.
22. Lamy, P. J., Allory, Y., Gauchez, A. S., et al. Prognostic Biomarkers Used for Localised Prostate Cancer Management: A Systematic Review. Eur. Urol. Focus, 2017, 7(17), Ahead of print
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist Urology
Article was published inClinical Biochemistry and Metabolism

2019 Issue 1-
All articles in this issue
- Editorial
- Verification of the reference range for examination of thyroid parameters (TSH, fT3 a fT4) on the analyzer DxI 800 from Beckman Coulter
- Utilization of Prostate Health Index in prediction of prostate cancer aggressiveness
- Quality, clinical effectivity and harmonisation of POCT
- Measurement uncertainty and error in medical laboratories
- Diabetes mellitus – laboratorní diagnostika a sledování stavu pacientů
- Cystatin C – Implementation in clinical laboratory practice
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Measurement uncertainty and error in medical laboratories
- Diabetes mellitus – laboratorní diagnostika a sledování stavu pacientů
- Utilization of Prostate Health Index in prediction of prostate cancer aggressiveness
- Verification of the reference range for examination of thyroid parameters (TSH, fT3 a fT4) on the analyzer DxI 800 from Beckman Coulter
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


