-
Medical journals
- Career
Výhody stanovení protilátek proti myeloperoxidáze a proteináze-3 chemiluminiscenční metodou u pacientů s ANCA asociovanou vaskulitidou
: I. Francová 1; Z. Hrušková 2; K. Malíčková 1; H. Lahoda Brodská 1; V. Tesař 2; T. Zima 1
: Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice a 1. lékařské fakulty University Karlovy, U Nemocnice 2, 128 08 Praha 2, Česká republika 1; Klinika nefrologie Všeobecné fakultní nemocnice a 1. lékařské fakulty University Karlovy, U Nemocnice 2, 128 08 Praha 2, Česká republika 2
: Klin. Biochem. Metab., 26, 2018, No. 3, p. 119-125
Cíl studie:
Ověřit diagnostickou senzitivitu a specificitu nové chemiluminiscenční metody (CLIA) pro stanovení protilátek proti myeloperoxidáze (anti-MPO) a proteináze 3 (anti-PR3). Porovnat tuto metodu se standardně využívanými metodami enzymové imunoanalýzy (ELISA). Vyhodnotit vzájemnou shodu porovnávaných metod s metodou nepřímé fluorescence (NIF) a posoudit využití metody CLIA jako skríningové metody pro pacienty s diagnózou s protilátkami proti cytoplazmě neutrofilů (ANCA) asociované vaskulitidy (AAV).
Typ studie:
retrospektivní.
Materiál a metody:
Ve skupině 101 pacientů s diagnózou ANCA asociované vaskulitidy s postižením ledvin jsme stanovovali protilátky proti myeloperoxidáze a proteináze 3 chemiluminiscenční metodou, ELISA metodami dvou výrobců a metodou nepřímé imunofluorescence.
Výsledky:
Diagnostickou senzitivitu, resp. specificitu metody CLIA jsme pro anti-MPO stanovili jako 91,7 %, resp. 100 % a pro anti-PR3 jako 96,2 %, resp. 100 %. Vzájemná kvantitativní shoda mezi jednotlivými metodami nebyla pro celý měřící rozsah metod prokázána, při vyšších hodnotách koncentrací narůstá kvantitativní odchylka mezi metodami ve prospěch CLIA, a to především v případě stanovení anti-MPO. V kvalitativním porovnání s metodou NIF byla nejvyšší celková shoda prokázána mezi metodami NIF a CLIA, pro anti-MPO 91,9 %, pro anti-PR3 90,6 %. Kohenovou kappa analýzou byla uspokojivá míra shody nalezena pouze mezi metodami NIF a CLIA (kappa = 0,455 pro anti-MPO a kappa = 0,410 pro anti-PR3).
Závěr:
Ověřili jsme výrobcem udávanou senzitivitu a specificitu nové chemiluminiscenční metody, výsledky pro námi definovanou skupinu jsou aplikovatelné dle doporučení výrobce. Pro náš definovaný soubor ANCA pozitivních AAV pacientů jsme prokázali vyšší diagnostickou senzitivitu pro metodu CLIA oproti běžně používaným ELISA metodám v případě obou sledovaných protilátek. Hodnoty diagnostické specificity byly shodně 100 %. Dále jsme prokázali dobrou kvalitativní shodu mezi metodami CLIA a NIF pro oba typy stanovovaných protilátek. Studií jsme ověřili vhodnost metody CLIA pro využití při skríningovém vyšetření protilátek proti antigenům cytoplazmy neutrofilů a její vhodnost pro zařazení do běžného rutinního laboratorního algoritmu jejich vyšetřování. Velkou výhodou metody CLIA je výrazně kratší doba odezvy a přístup stanovení „po pacientech“, což metodu činí použitelnou pro statimový režim.
Klíčová slova:
Protilátky proti cytoplazmě neutrofilů, ANCA, myeloperoxidáza, proteináza 3, ANCA asociovaná vaskulitida, chemiluminiscenční imunoanalýza, CLIA.
Úvod
Vaskulitidy jsou heterogenní skupinou onemocnění charakterizovaných zánětem cévní stěny s jejím možným poškozením až úplným zničením. Podjednotkou jsou autoimunitní nekrotizující vaskulitidy s postižením malých cév, které jsou až v 90-95 % případů asociovány s přítomností protilátek namířených proti antigenům cytoplazmy neutrofilů (ANCA – anti-neutrophil cytoplasmic antibodies) a jsou klasifikovány jako ANCA asociované vaskulitidy (AAV). Mezi AAV se řadí tyto klinicko-patologické jednotky [1]:
- Granulomatóza s polyangiitidou – dříve Wegenerova (GPA)
- Mikroskopická polyangiitida (MPA)
- Eosinofilní granulomatóza s polyangiitidou – syndrom Churga a Straussové (CSS)
- Renálně limitovaná vaskulitida (RLV) – dnes častěji řazena pod MPA
Vzhledem k vysokému procentu pozitivity ANCA protilátek u AAV i jejich souvislosti s patogenezí AAV [2] je detekce ANCA naprosto zásadní pro diagnostiku onemocnění, pro dlouhodobé sledování pacienta, hodnocení jeho odpovědi na léčbu, obvykle i hodnocení aktivity onemocnění, i když korelace není 100%, a v neposlední řadě i pro jejich prognostický význam [3,4]. AAV se mohou manifestovat rychle progredující glomerulonefritidou. V takovém případě je indikováno statimové vyšetření ANCA protilátek.
Pro AAV má zásadní význam stanovení dvou typů ANCA protilátek. Jsou to protilátky proti myeloperoxidáze (anti-MPO), které jsou nejčastěji asociovány s fluorescenčním obrazem perinukleární ANCA (pANCA), a protilátky proti proteináze 3 (anti-PR3), které jsou asociovány s fluorescenčním obrazem cytoplazmatické ANCA (cANCA). Pozitivita anti-PR3, resp. cANCA, je častěji pozorována u pacientů s GPA. Pozitivita pANCA a anti-MPO je častější u MPA a vyskytuje se také u CSS, kde však může být až 50 % pacientů ANCA negativních.
V algoritmech laboratorního stanovení těchto protilátek se uplatňují kombinace skríningových metod nepřímé fluorescence a kvantitativního stanovení imunoanalytickými metodami. Výsledkem kombinace metod je zvýšení diagnostické specificity stanovení ANCA až k 100 % se senzitivitou 55-80 % [4, 5]. Dle do nedávna platného doporučeného postupu pro diagnostiku ANCA [5] se základní skríningové vyšetření ANCA protilátek provádí na etanolem fixovaných lidských granulocytech metodou nepřímé fluorescence, v druhém kroku se pak konfirmuje pozitivita protilátek proti jednotlivým antigenům dalšími imunoanalytickými metodami. Aktuální revize doporučeného postupu připouští i možnost imunoanalytického stanovení anti-MPO a anti-PR3 bez nutnosti provedení nepřímé fluorescence, nicméně tato strategie musí být ještě ověřena v následujících studiích [6].
Problémem zůstává standardizace kvantifikace protilátek, kdy nejen různé principy stanovení, ale i diagnostické soupravy různých výrobců jsou jen těžko srovnatelné. Nejčastěji využívanou technikou stanovení je ELISA (enzym linked immuno sorbent assay – enzymová imunoanalýza na pevné fázi). Zdrojem variability výsledků je původ a čistota použitých antigenů, které mají vliv především na specificitu stanovení. Dále použitá technika ukotvení antigenů, a tím i dostupnost antigenních epitopů, která má vliv především na senzitivitu stanovení. Různí výrobci navíc používají různé jednotky (U/ml, index, CU atd.) bez stanovené návaznosti na mezinárodní referenční sérum. V současné době jsou k dispozici referenční séra CDC (Center of Disease Control and Prevention) pro anti-PR3 i anti-MPO (PR3-ANCA Human Reference Serum #16, Product Package Insert Catalogue #IS2721, MPO-ANCA Human Reference Serum #15, Product Package Insert Catalogue #IS2720). Jejich referenční hodnota je stanovena na 100 IU/ml. Ne všichni výrobci imunoanalytických souprav je však pro stanovení těchto protilátek při validaci používají.
Další vývoj imunoanalytických metod směřuje ke zlepšení analytických vlastností diagnostických souprav. Jednou z možností je zvyšování senzitivity ELISA metod zlepšením přístupnosti antigenních epitopů pro vazbu protilátek ze zkoumaného vzorku pomocí ukotvení molekuly antigenu na mikrotitrační destičku kovalentní vazbou na protilátku – technika „capture“ u ELISA 2. generace nebo pomocí kotevní molekuly – technika „anchor“ u ELISA 3. generace. Zvýšení specificity lze dosáhnout použitím vysoce čištěných nebo rekombinantních antigenů. Dále také zvýšením množství navázaného antigenu na pevné fázi, jak je tomu u metod využívajících jako pevnou fázi různé typy kuliček, a zvýšením citlivosti pomocí principu detekce, jak je tomu u chemiluminiscenčních a fluorescenčních metod. Výhodou tohoto uspořádání metod je oproti ELISA i možný přístup „po pacientech“, tedy bez nutnosti čekání na minimální počet požadavků, který by využil celou kapacitu mikrotitrační ELISA destičky, a rychlost provedení metody. Velkou výhodou je, že metody tohoto typu jsou dobře využitelné pro stanovení ve statimovém režimu.
Při zavádění těchto metod do laboratorního vyšetřovacího algoritmu je nutné provést porovnání s nejčastěji používanými ELISA metodami a zhodnotit diagnostickou výtěžnost nových metod.
Cílem předkládané studie je ověřit diagnostickou senzitivitu a specificitu nové chemiluminiscenční metody pro stanovení protilátek proti myeloperoxidáze a proteináze 3 a porovnat tuto metodu se standardně využívanými ELISA metodami. Dále pak vyhodnotit vzájemnou shodu porovnávaných metod s metodou NIF a posoudit možnost využití testu CLIA jako alternativní skríningové metody 1. volby.
Materiál a metody
Do studie jsme zařadili 101 pacientů s diagnózou ANCA asociované vaskulitidy. První soubor (AAV1) zahrnoval 48 vzorků od pacientů s diagnózou vaskulitidy asociované s pozitivitou anti-MPO nebo p-ANCA protilátek. Druhý soubor (AAV2) tvořilo 53 vzorků od pacientů s diagnózou vaskulitidy asociované s pozitivitou anti-PR3 nebo s c-ANCA pozitivitou. Ve všech těchto případech se jednalo o vzorky pacientů Kliniky nefrologie VFN a 1. LF UK. Šlo o nemocné s prokázanou diagnózou AAV, kteří jsou v naší laboratoři dlouhodobě sledováni a dlouhodobě vykazují pozitivitu zmiňovaných protilátek (nebyli zahrnuti AAV pacienti s negativitou protilátek), nicméně nebrali jsme do úvahy aktivitu onemocnění.
Kontrolní skupinu tvořili pacienti s různými poruchami imunity, které nejsou primárně sdruženy s ANCA pozitivitou, soubor 21 vzorků od pacientů se systémovými autoimunitními chorobami (revmatoidní artritida (RA), Sjögrenův syndrom (SjS), systémový lupus erythematodes (SLE)) a soubor 18 vzorků od pacientů s jinými než autoimunitními poruchami imunity (alergická rýma (AR), průduškové astma (PA), imunodeficience (ID)). Věkové rozmezí, věkový průměr a zastoupení mužů a žen v jednotlivých souborech viz Tabulka č. 1.
1. Patient’s groups summary 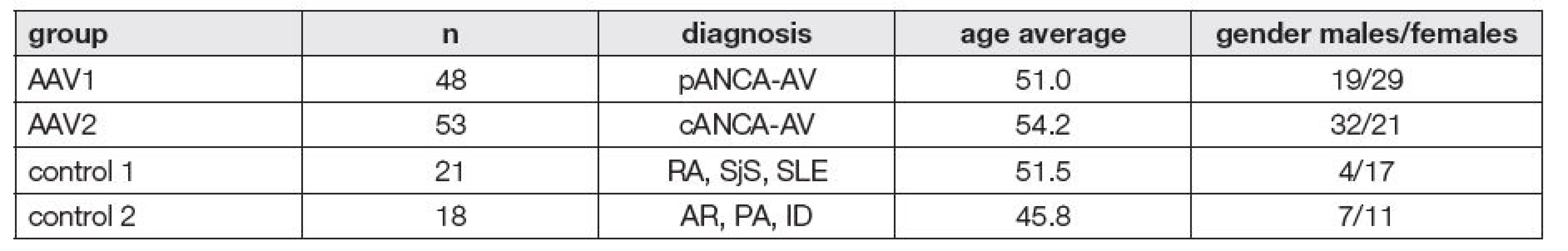
pANCA-AV – vasculitis associated with perinuclear anti-neutrophil cytoplasmic antibodies; cANCA-AV – vasculitis associated with cytoplasmic anti-neutrophil cytoplasmic antibodies; RA – rheumatoid arthritis; SjS – Sjörgen’s syndrome; SLE – systemic lupus erythematosus; AR – allergic rhinitis; PA – bronchial asthma; ID – immunodeficiency. Vzorky krve byly v rámci rutinního vyšetření odebrány venepunkcí do zkumavky bez aditiva a centrifugovány. Potřebný alikvot séra byl zamražen na -20 °C až do doby analýzy. Rozmražené vzorky byly důkladně promíchány a poté ihned testovány.
Ve všech skupinách byly semikvantitativně stanoveny ANCA protilátky metodou nepřímé imunofluorescence (NIF) a kvantitativně stanoveny anti-MPO a anti-PR3 třemi různými metodami, chemiluminiscence (CLIA) a dvěma systémy ELISA různých výrobců.
Semikvantitativní stanovení ANCA metodou nepřímé fluorescence (NIF)
Pro stanovení byly použity komerční diagnostické soupravy firmy INOVA, skríningové stanovení bylo provedeno v titru 20 na přístroji Helmed (Aesku). Preparáty byly hodnoceny s použitím fluorescenčního mikroskopu Olympus při zvětšení objektivu 400x. Hodnotili jsme intenzitu fluorescence a typ fluorescenčního obrazu – cANCA a pANCA. Pro skríning jsme jako subsbrát použili neutrofily fixované etanolem, ve druhém kroku jsme vzorky hodnocené jako pANCA slabě pozitivní a pozitivní konfirmovali pomocí neutrofilů fixovaných formaldehydem a stanovení antinukleárních (ANA) protilátek.
Kvantitativní stanovení protilátek proti MPO a PR3 metodou chemiluminiscence (CLIA)
QUANTA Flash® MPO a QUANTA Flash® PR3 (INOVA Diagnostics) jsou metody navržené pro plně automatické zpracování na analyzátoru BioFlash (BioKit SA) s luminometrickou detekcí. Antigeny (nativní purifikované antigeny lidských neutrofilů) jsou navázány na paramagnetických latexových kuličkách. V případě PR3 kovalentně a v případě MPO pomocí kotvící molekuly. Pro vyhodnocení test využívá předdefinované vzorové kalibrační křivky, která je specifická pro danou šarži a která je pomocí dvou hladin kalibrátorů upravena pro daný přístroj. Výsledky jsou vydávány v chemiluminiscenčních jednotkách (CU), rozhodovací meze byly stanoveny podle doporučení výrobce na 20 CU pro stanovení anti-MPO i anti-PR3. Metoda byla v rámci validace výrobcem porovnána na mezinárodní referenční sérum CDC s referenční hodnotou 100 U/ml. Konverzní faktor pro převod CU jednotek na IU/ml byl stanoven na 0,25 pro anti-PR3 a 0,3 pro anti-MPO.
Kvantitativní stanovení protilátek proti MPO a PR3 metodami enzymové imunoanalýzy (ELISA)
- QUANTA Lite® PR-3 a QUANTA Lite® MPO jsou ELISA metody 1. generace, antigeny (nativní purifikované antigeny lidských neutrofilů) jsou přímo adsorbovány na povrchu jamek mikrotitračních destiček. Vyhodnocení je prováděno z kalibrační křivky, která se zpracovává s každou analýzou, výsledky jsou vydávány v jednotkách U/ml. Rozhodovací meze byly stanoveny dle doporučení výrobce na 9 U/ml pro anti-MPO a 3,5 U/ml v případě anti-PR3.
- Orgentec MPO, PR3 jsou ELISA metody 1. generace, antigeny proteináza 3 a myeloperoxidáza jsou adsorbovány přímo na povrchu jamek mikrotitračních destiček. Vyhodnocení je prováděno z kalibrační křivky, která se zpracovává s každou analýzou. Rozhodovací meze byly stanoveny dle doporučení výrobce na 5 U/ml pro stanovení anti-MPO i anti-PR3 podle příbalového letáku výrobce.
Statistické zpracování dat
Pro porovnání kvantitativních metod použita kombinace lineární regrese a Bland-Altmanovy metody.
Kvalitativně byla shoda měření stejné veličiny mezi různými technikami (tzv. inter-technique error) posouzena Cohenovou kappa analýzou. Dále byla stanovena pozitivní, negativní a absolutní kvalitativní shoda mezi jednotlivými metodami a metodou NIF.
Výsledky
Stanovili jsme hodnoty senzitivity, specificity, pozitivní prediktivní hodnoty (PPV) a negativní prediktivní hodnoty (NPV) jednotlivých kvantitativních testů pro diagnózu AAV s pozitivitou ANCA. Shrnutí je uvedeno v Tabulce 2.
2. Sensitivity, specificity, positive and negative predictive values of anti-MPO and anti-PR3 assays for the diagnosis of AAV with ANCA positivity. 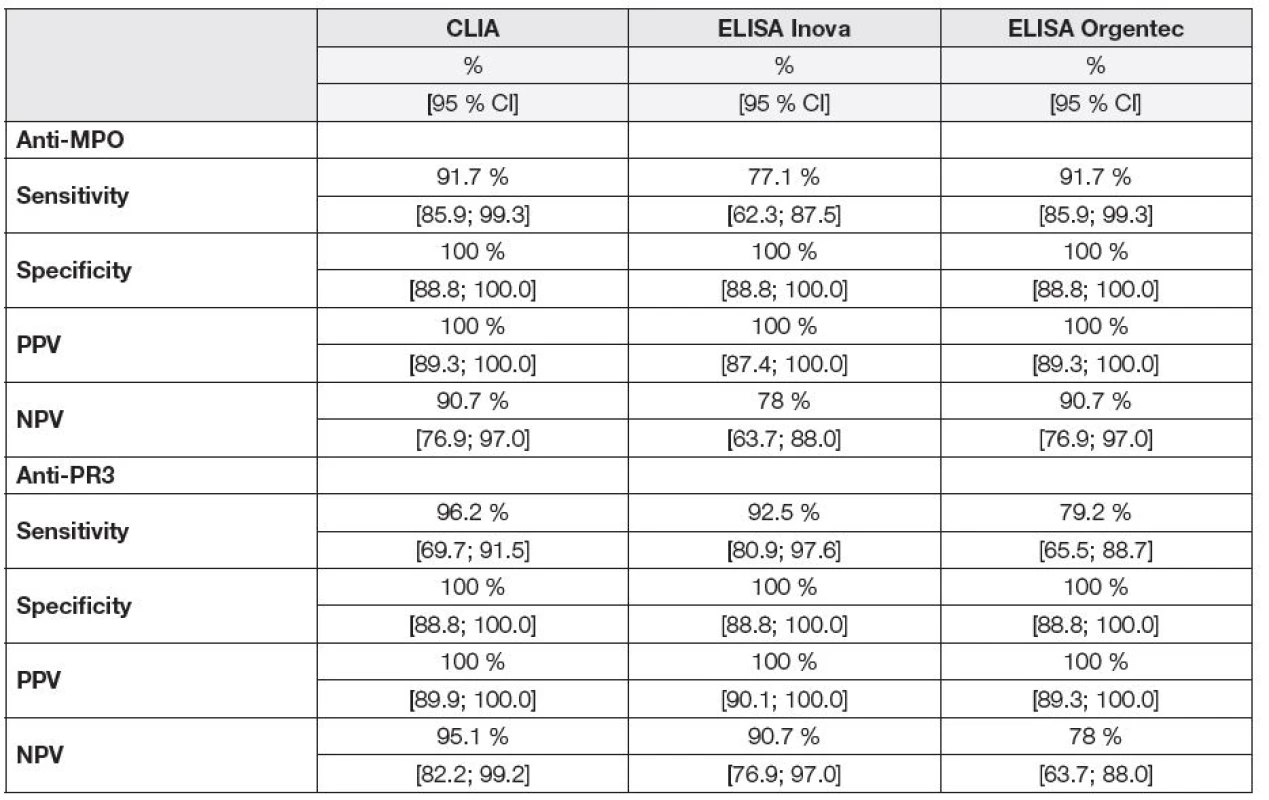
CLIA, chemiluminescence immunoassay; ELISA, enzyme immunoassay; anti-MPO, antibodies against myeloperoxidase; anti-PR3, antibodies against proteinase 3; PPV, positive predictive value; negative predictive value; 95 % CI, confidence interval 95 %. Pro vzájemné porovnání kvantitativních metod jsme výsledky vyjádřili indexem pozitivity, tedy poměrem koncentrace analytu a cut-off příslušné metody. V žádném vzorku kontrolních skupin non-AAV pacientů nebyly nalezeny zvýšené sérové hladiny anti-PR3 či anti-MPO ani jednou z testovaných metod.
Pro porovnání výsledků kvantitativních metod stanovení anti-MPO (obr. 1 - 3), resp. anti-PR3 (obr. 4 - 6), ve skupinách AAV1, resp. AAV2, jsme zvolili Bland-Altmanovu metodu s lineární regresí.
1. Bland-Altman analysis – comparison of CLIA and ELISA INOVA methods for quantitative detection of anti-MPO, linear regression is expressed with equation y = 0.2528x + 1.3311 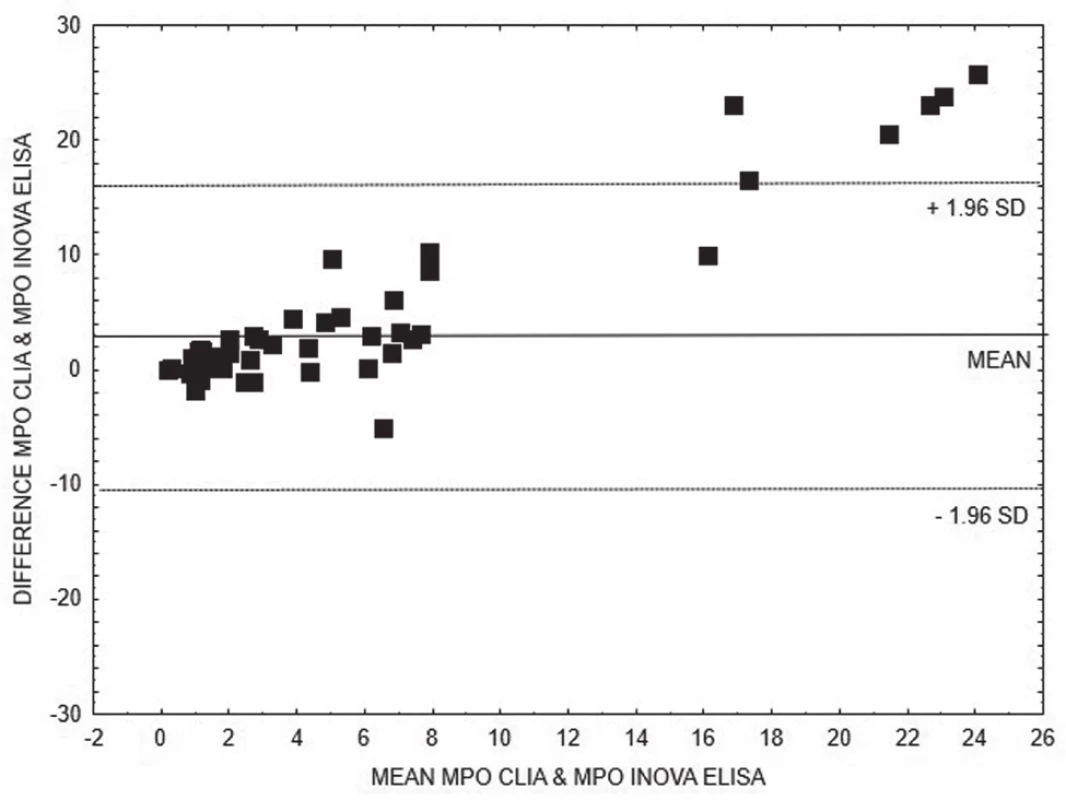
2. Bland-Altman analysis – comparison of CLIA and ELISA Orgentec methods for quantitative detection of anti- MPO, linear regression is expressed with equation y = 0.5382x + 3.904 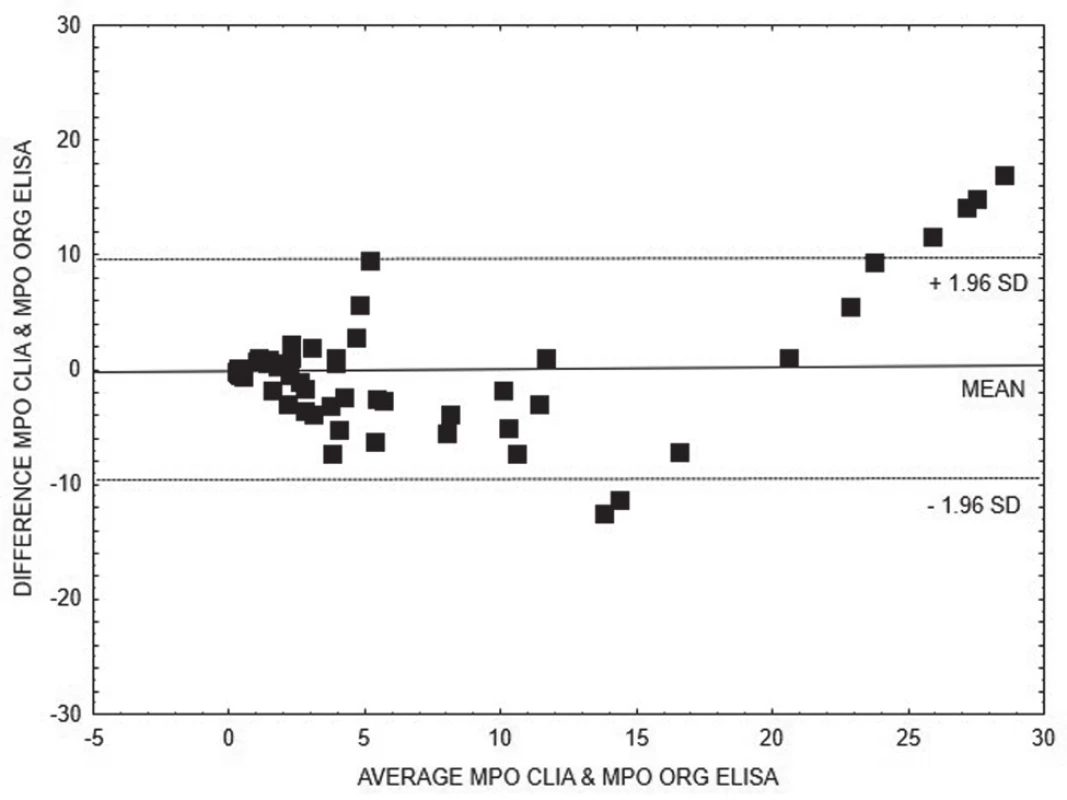
3. Bland-Altman analysis – comparison of ELISA INOVA and ELISA Orgentec methods for quantitative detection of anti-MPO, linear regression is expressed with equation y = 0.3601x + 0.4461 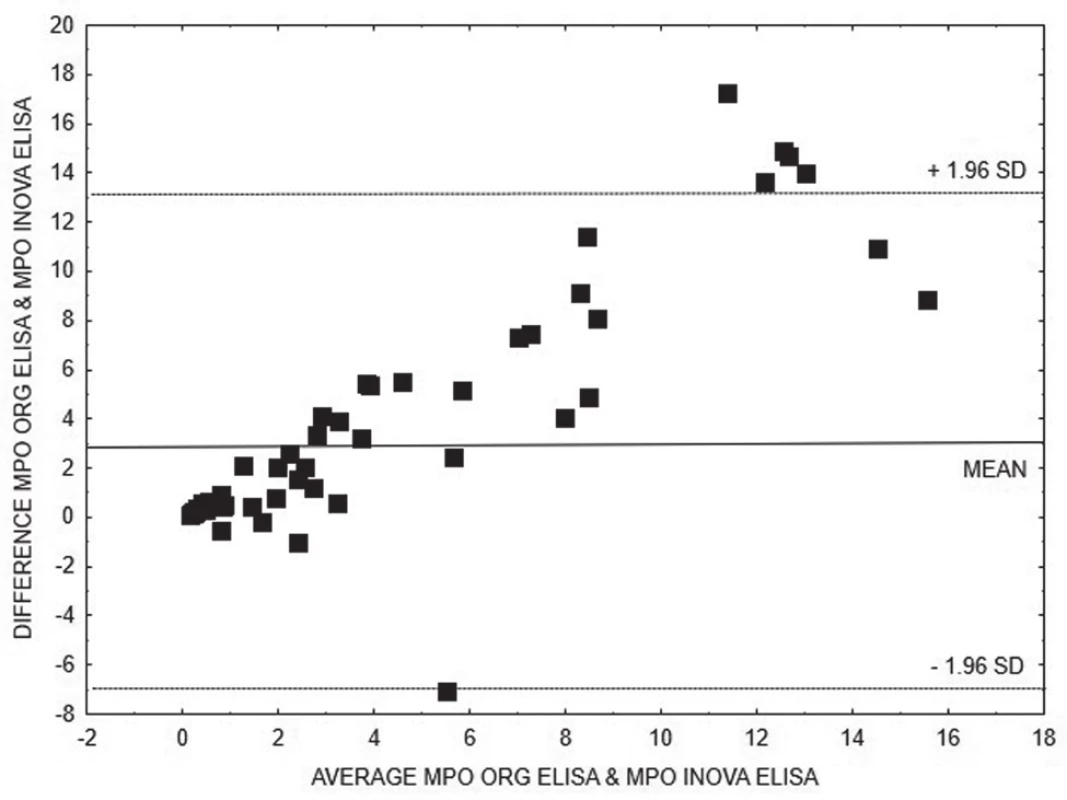
4. Bland-Altman analysis – comparison of CLIA and ELISA INOVA methods for quantitative detection of anti-PR3, linear regression is expressed with equation y = 0.2197x + 7.067 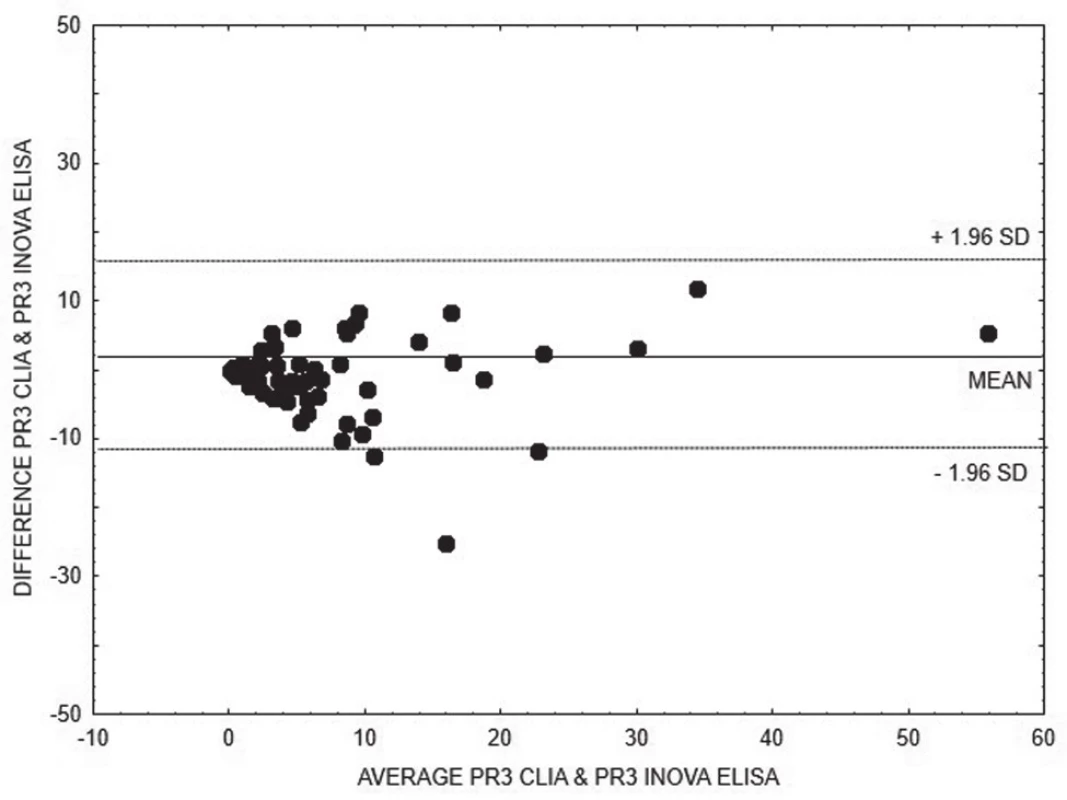
5. Bland-Altman analysis – comparison of CLIA and ELISA Orgentec methods for quantitative detection of anti-PR3, linear regression is expressed with equation y = 0.1693x + 4.2891 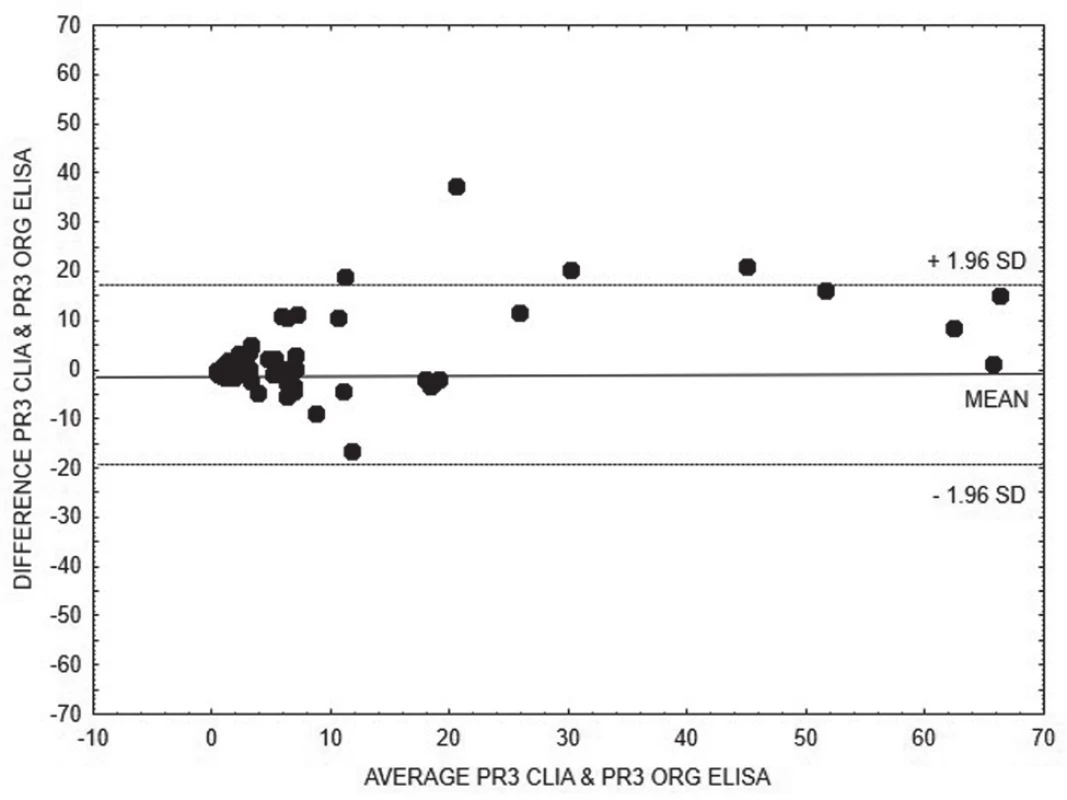
6. Bland-Altman analysis – comparison of ELISA INOVA and ELISA Orgentec methods for quantitative detection of anti-PR3, linear regression is expressed with equation y = 1.1582x + 2.4882 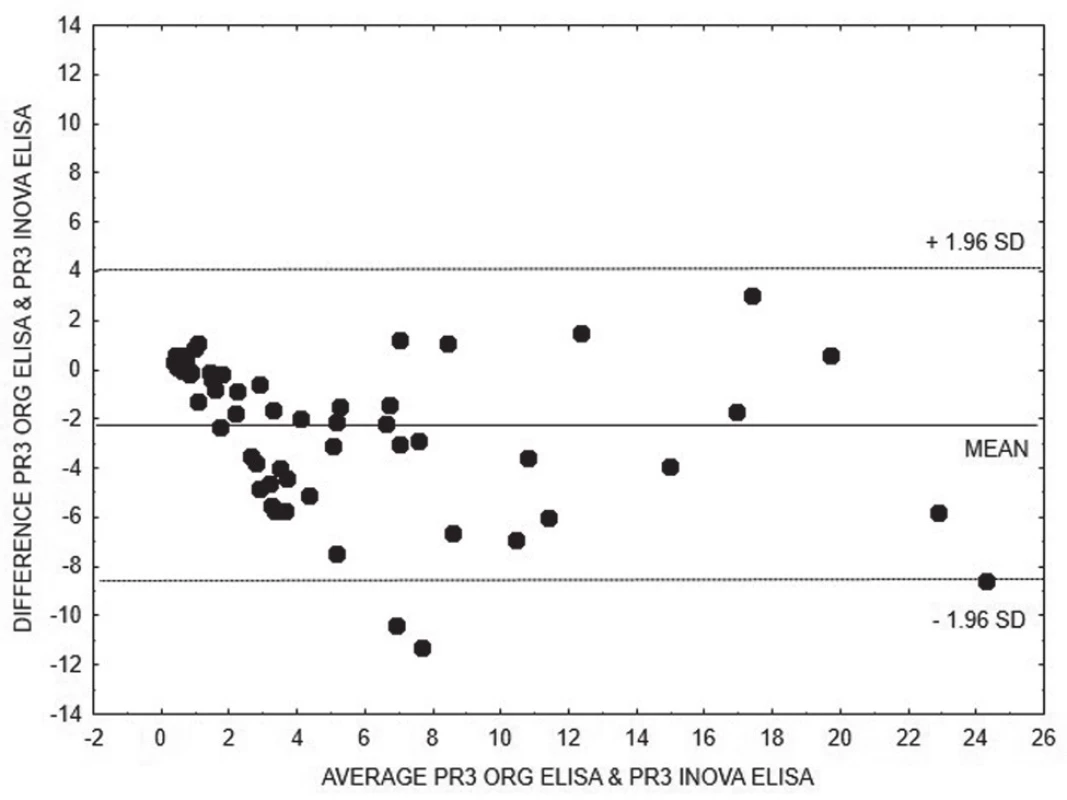
Skríningové vyšetření ANCA u nemocných s AAV s ANCA pozitivitou bylo provedeno metodou NIF. V souboru AAV1 (n=48) bylo 8 % pacientů s aktuálně negativním skríningovým vyšetřením autoprotilátek, a v souboru AAV2 (n=53) bylo 13 % negativních pacientů v laboratorní remisi onemocnění.
Stejná séra byla posléze analyzována na přítomnost anti-MPO/anti-PR3 metodami CLIA a ELISA. Kvalitativní shoda měření stejné veličiny mezi různými technikami (tzv. inter-technique error) byla posouzena Cohenovou kappa analýzou a vyjádřením pozitivní, negativní a celkové shody – Tabulka 3.
3. Qualitative agreement of different assays and IIF 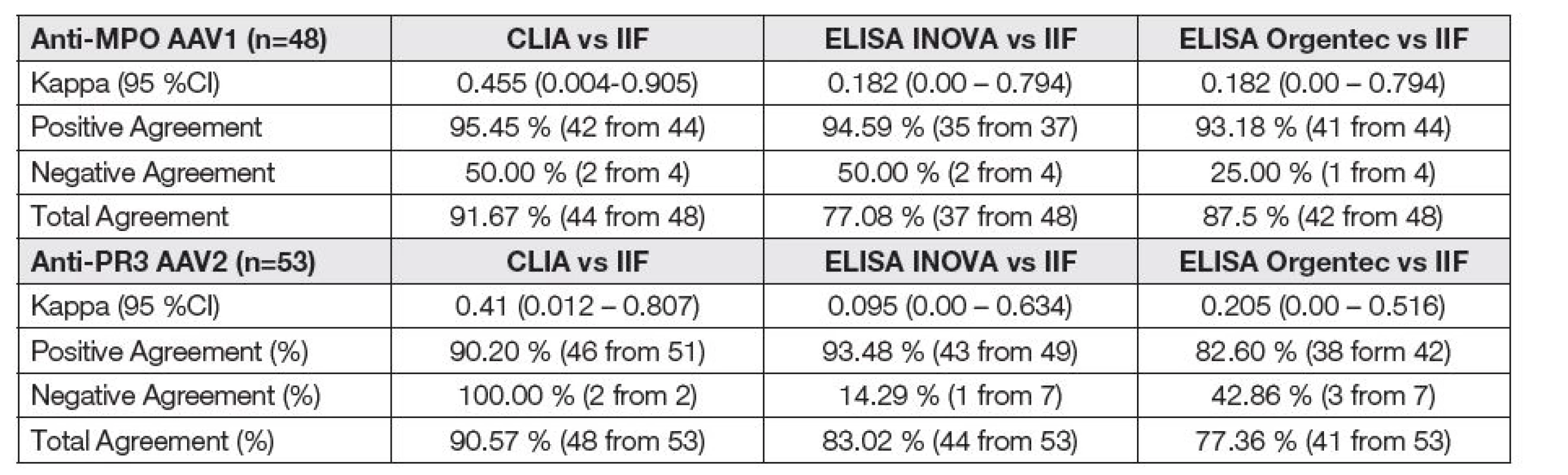
IIF, indirect immunofluorescence; CLIA, chemiluminescent immunoassay; CI, confidence interval. The relative strength of agreement associated with kappa statistics [7]:
kappa strength of agreement
< 0.00 poor
0.00 - 0.20 slight
0.21 - 0.40 fair
0.41 - 0.60 moderate
0.61 - 0.80 substantial
0.81 - 1.00 perfectDiskuse
Předkládaná studie je první analýzou diagnostické výtěžnosti CLIA, ELISA a NIF metod detekce anti-MPO a anti-PR3 v české odborné literatuře. Na našem souboru pacientů jsme ověřili hodnoty diagnostické senzitivity, specificity, pozitivní i negativní prediktivní hodnoty pro všechny tři použité kvantitativní detekční systémy pro diagnózu AAV.
Na námi definované skupině ANCA pozitivních AAV pacientů jsme potvrdili hodnotu diagnostické senzitivity a specificity metody CLIA udávané výrobcem. V obou případech byly v naší studii zjištěny vyšší hodnoty senzitivity: 91,7 % versus 79,8 % udávaných pro anti-MPO a 96,2 % versus 68,3 % udávaných pro anti-PR3. Námi naměřená specificita byla pro oba typy protilátek 100 % oproti 96,2 % pro anti-MPO a 97,4 % pro anti-PR3 udávaným výrobcem souprav.
Senzitivita a negativní prediktivní hodnota byla stanovena pro všechny tři kvantitativní testy. Vzhledem k uspořádání metody na paramagnetických kuličkách jako pevné fázi s chemiluminiscenční detekcí, jsme u CLIA předpokládali nejvyšší senzitivitu. To se potvrdilo v případě stanovení anti-MPO (senzitivita 91,7 % a NPV 90,7 %) i anti-PR3 protilátek (senzitivita 96,2 % a NPV 95,1%).
Námi naměřené 100 % hodnoty specificity a pozitivní prediktivní hodnoty pro všechny testované metody jsou dány výběrem pacientů. U všech pacientů skupin AAV1 i AAV2 byla již dříve diagnostikována AAV s pozitivitou sledovaných protilátek. Navíc je nutné zohlednit, že pro účely této studie nebyla sledována souvislost mezi koncentrací protilátek a aktivitou onemocnění. V aktuálním uspořádání se tak diagnostické vlastnosti metody mohou jevit optimističtěji než je realita. Pro ověření specificity testů byla zařazena i kontrolní skupina, do které byli vybráni pacienti s autoimunitním onemocněním (SLE, RA, SjS). V kontrolních skupinách jsme ani jednou z testovaných metod nedetekovali žádný případ falešné pozitivity.
Na základě vyhodnocení Bland-Altmanových grafů (obr. 1 – 6) a rovnic lineární regrese lze konstatovat, že metody pro kvantitativní stanovení koncentrací obou druhů protilátek jsou jen těžko porovnatelné v celém měřícím rozsahu metod. Platí, že kvantitativní odchylka mezi metodami CLIA a ELISA vzrůstá s hodnotou koncentrace protilátek, a to především v případě anti-MPO protilátek. Uspokojivou shodu pro kvantitativní vyhodnocení výsledků jsme prokázali pouze pro stanovení anti-PR3 protilátek oběma metodami ELISA.
Pro kvalitativní porovnání srovnávaných metod s metodou nepřímé imunofluorescence jsme zvolili Cohenovu kappa analýzu. Uspokojivá míra shody byla nalezena pouze mezi metodami NIF a CLIA (kappa = 0,455 pro anti-MPO a kappa = 0,410 pro anti-PR3). Ostatní metody vykázaly slabší míru vzájemné shody. Cohenova kappa analýza ovšem není jako míra opakovatelnosti bez problémů – nijak neseparuje různé varianty neshody a shodu agreguje do jediného podílu, tedy ukazuje pouze to, zda jsou přítomny rozdíly mezi způsoby hodnocení. Nevypovídá však nic o tom, jak dobře daný systém měření dosahuje správných stanovení. Vysoké pozitivní shody bylo nalezeno prakticky ve všech porovnáních, na rozdíl od negativní shody, která byla u některých porovnání dokonce nulová. Neuspokojivé hodnoty negativní shody jsou nápadnější u anti-PR3 měření. Metodou CLIA bylo nalezeno signifikantně méně negativních vzorků ve srovnání s oběma testovanými ELISA soupravami, nikoliv ovšem ve srovnání s NIF.
V rámci této studie jsme také chtěli ověřit vhodnost algoritmu pro vyšetřování ANCA u pacientů s AAV [5,8], který kombinuje vyšetřování metodami NIF a ELISA (respektive dalšími imunoanalytickými metodami pro detekci protilátek proti jednotlivým antigenům cytoplazmy neutrofilů). Pro diagnostiku „nových“ pacientů s AAV je jako skríningová metoda první volby doporučována NIF. Pozitivní nálezy mají být dále konfirmovány a kvantifikovány ELISA metodou se stanovením protilátek minimálně proti antigenům MPO a PR3. V případě již dříve diagnostikovaných pacientů je možno vyšetřovat už jen protilátky proti jednotlivým antigenům bez dalšího potvrzení pozitivity metodou nepřímé fluorescence.
S technologickým vývojem dochází ke zlepšování analytických vlastností nových diagnostických souprav, jak již bylo zmiňováno v úvodu této studie. Vyšší senzitivita a vyšší pozitivní prediktivní hodnoty „vylepšených“ souprav oproti ELISA 1. generace byly ověřeny v řadě studií [4,10-12]. Především z toho důvodu vyplynula potřeba revize stávajícího doporučeného algoritmu pro vyšetřování ANCA protilátek ve smyslu alternativního zařazení vysoce senzitivního imunoanalytického testu jako skríningového testu 1. volby [9, 10]. Z výsledků našich měření vyplývá, že ve skupině AAV1, tedy anti-MPO pozitivních vzorků, byl ve čtyřech případech výsledek NIF negativní (8 %). Ve skupině AAV2, tedy anti–PR3 pozitivních vzorků, byla negativita NIF prokázána v sedmi případech (13 %). Využití stanovení anti-MPO a anti-PR3 protilátek metodou CLIA pro primární skríning se na základě námi naměřených výsledků jeví jako vhodné.
Otázkou je samozřejmě nastavení cut-off metod. Námi zjištěná 100% specificita potvrzuje vhodnost metody CLIA pro použití v konfirmačním testu při cut-off nastaveném dle doporučení výrobce. Hodnoty senzitivity 91,7 % v případě anti-MPO a 96,2 % pro anti-PR3 při cut-off metod nastavených výrobcem se jeví jako vhodné i pro skríningové použití a je otázka, nakolik snížení cut-off metod povede k zvýšení senzitivity. Pro tento účel by bylo vhodné zpracovat další, ideálně prospektivní studie zohledňující i aktivitu procesu onemocnění včetně ROC analýz pro obě stanovení CLIA.
Závěr
Závěrem konstatujeme, že CLIA je vhodnou diagnostickou metodou pro kvantifikaci anti-MPO a anti-PR3. Lépe koreluje s výsledky skríningových NIF testů než standardně používané ELISA testy. Její diagnostická výtěžnost je v porovnání s ELISA testy srovnatelná nebo vyšší.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 9. 10. 2017
Adresa pro korespondenci
Mgr. Irena Francová
ÚLBLD – laboratoř klinické imunologie a alergologie
Karlovo náměstí 32,
128 08 Praha 2
Sources
1. Jennette, J. C., Falk, R. J., Bacon, P. A., Basu, N., Cid, M. C., Ferrario, F., Flores-Suarez, L. F., Gross, W. L., Guillevin, L., Hagen, E. C., Hoffman, G. S., Jayne, D. R., Kallenberg, C. G. M., Lamprecht, P., Langford, C. A., Luqmani, R. A., Mahr, A. D., Matteson, E. L., Merkel, P. A., Ozen, S., Pusey, C. D., Rasmussen, N., Rees, A. J., Scott, D. G. I., Specks, U., Stone, J. H., Takahashi, K. and Watts, R. A. Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis & Rheumatism, 2012, 65, s. 1–11. doi:10.1002/art.37715
2. Kallenberg, C. G. M. Pathogenesis of ANCA-associated vasculitides. Annals of the Rheumatic Diseases, 2011, 70, i59-i63.
3. Lionaki, S., Blyth, E. R., Hogan, S. L., Hu, Y., Senior, J. B. A., Jennette, C. E., Nachman P. H., Jennette J. C., Falk, R. J. Classification of ANCA vasculitides: The role of anti-neutrophil cytoplasmic autoantibody specificity for MPO or PR3 in disease recognition and prognosis. Arthritis and Rheumatism, 2012, 64(10), s. 3452–3462. http://doi.org/10.1002/art.34562.
4. Mahler, M., Radice, A., Yang, W., Bentow, C., Seaman, A., Bianchi, L., Sinico, R. A. Development and performance evaluation of novel chemiluminescence assays for detection of anti-PR3 and anti-MPO antibodies. Clin Chim Acta. 2012, 413(7-8), s. 719–726. Published online 2012 Jan 13. doi: 10.1016/j.cca. 2012.01.004
5. Lochman, I. Postup pro vyšetřování ANCA. Alergie 2/2012
6. Csernok E., Damoiseaux J., Bossuyt X. CS_1 evised international consensus recommendation on testing of anti-neutrophil cytoplasm antibodies (ANCA) in small vessel vasculitis: evaluation of ANCA testing by antigen specific assays, Rheumatology, 2017, 56(3), s. iii41–iii42.
7. Landis, J. R., Koch, G. G. The measurement of observer agreement for categorical data. Biometrics. 1977, 33(1), s. 159-74.
8. Savige, J., Gillis, D., Benson, E., Davies, D, Esnault, V., Falk, R. J., Hagen, E. C., Jayne, J., Jennette, J. C., Paspaliaris, B., Pollock, W., Pusey, C., Savage C. O. S., Silvestrini, J., Van der Woude, F., Wieslander, J., Wiik, A. International Consensus Statement on Testing and Reporting of Antineutrophil Cytoplasmic Antibodies (ANCA), American Journal of Clinical Pathology, 1999, 111(4), s. 507–513, https://doi.org/10.1093/ajcp/111.4.507.
9. Csernok E. and Moosig F. Current and emerging techniques for ANCA detection in vasculitis. Nature Reviews Rheumatology, 2014, 10(8), s. 494-501.
10. Damoiseaux, J., Csernok, E., Rasmussen, N., Moosig, F., van Paassen, P., Baslund, B., Vermeersch, P., Blockmans, D.,Tervaert, J.W.C, Bossuyt, X. Detection of antineutrophil cytoplasmic antibodies (ANCAs): a multicentre European Vasculitis Study Group (EUVAS) evaluation of the value of indirect immunofluorescence (IIF) versus antigen-specific immunoassays. Annals of the rheumatic diseases, Published Online First: 01 August 2016. doi: 10.1136/annrheumdis-2016-209507.
11. Hirose, O., Itabashi, M., Takei, T., Nitta, K.. Comparison of a novel chemiluminescence enzyme immunoassay (CLEIA) with enzyme-linked immunosorbent assay (ELISA) for the determination of MPO-ANCA in patients with ANCA-associated vasculitis, Mod Rheumatol., 2015, 25(2), s. 230-4. doi: 10.3109/14397595.2014.951113. Epub 2014 Nov 12.
12. Trevisin, M., Pollock, W., Dimech, W., Savige, J. Evaluation of a multiplex flow cytometric immunoassay to detect PR3-and MPO-ANCA in active and treated vasculitis, and in inflammatory bowel disease (IBD). Journal of immunological methods, 2008, 336(2), s. 104-112.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2018 Issue 3-
All articles in this issue
- Placental Growth Factor in Patients with pregnancy complications in the third trimester of pregnancy
- Advantages of anti-myeloperoxidase and anti-proteinase-3 antibodies detection by chemiluminescence method in patients with ANCA-associated vasculitis
- Deepening oxidative stress in pancreatic cancer due to malnutrition
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Advantages of anti-myeloperoxidase and anti-proteinase-3 antibodies detection by chemiluminescence method in patients with ANCA-associated vasculitis
- Placental Growth Factor in Patients with pregnancy complications in the third trimester of pregnancy
- Deepening oxidative stress in pancreatic cancer due to malnutrition
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

