-
Medical journals
- Career
Antifosfolipidový syndrom – diagnostika, manifestace a léčba
Authors: H. Ciferská
Authors‘ workplace: Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Published in: Kardiol Rev Int Med 2014, 16(5): 410-413
Category: Internal Medicine
Overview
Antifosfolipidový syndrom (APS) je autoimunitně podmíněné onemocnění s celou řadou potenciálně život ohrožujících manifestací. Vyskytuje se samostatně v primární podobě nebo jako sekundární doprovázející řadu chorobných stavů (autoimunitní, nádorová onemocnění atd.). Diagnostická kritéria zahrnují jak klinickou, tak laboratorní složku. Mezi klinické manifestace patří výskyt trombóz arteriálních či žilních a dále komplikace v těhotenství. Laboratorně musí být opakovaně prokázána přítomnost antifosfolipidových protilátek v minimálním odstupu 12 týdnů. Klinická manifestace APS může být velmi pestrá a často vyžaduje multidisciplinární přístup. Obávanou, ale vzácnou komplikací je tzv. katastrofický APS spojený s vysokou morbiditou a mortalitou. Včasná diagnóza spolu s terapií výrazně ovlivňuje prognózu pacientů s APS.
Klíčová slova:
antifosfolipidový syndrom – systémový lupus erythematodesÚvod
Antifosfolipidový syndrom (APS) je autoimunitní onemocnění manifestující se přítomností žilních a arteriálních trombóz a u žen ve fertilním věku těhotenskými komplikacemi charakteru spontánních potratů zvláště po 10. týdnu gravidity nebo výskytem preeklampsie v pozdějších fázích těhotenství. Pro APS je charakteristická přítomnost antifosfolipidových protilátek (aPL). APS je přesně definovaná jednotka a k diagnóze tohoto syndromu je nutné splnění minimálně jednoho klinického a jednoho laboratorního kritéria (tab. 1). APS se vyskytuje ve dvou formách, a to v primární a sekundární s přítomností dalšího chorobného stavu (autoimunitní onemocnění, malignity a další) (tab. 2). V revmatologii je APS nejčastěji přítomen jako jedna z komplikací systémového lupus erythematodes (SLE) [1 – 3].
Table 1. Diagnostická kritéria antifosfolipidového syndromu. 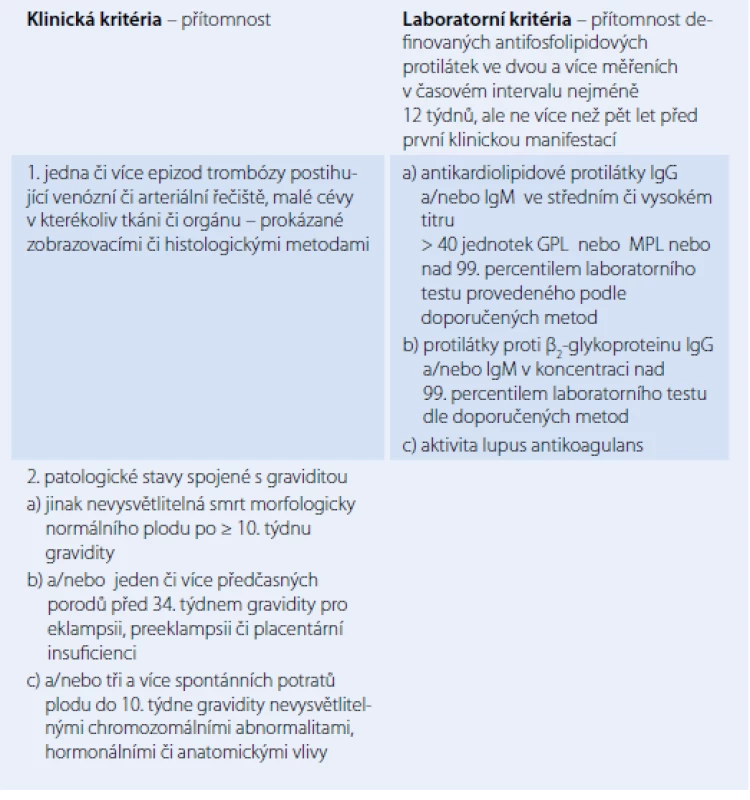
Table 2. Stavy provázené výskytem antifosfolipidových protilátek. 
Soubor příznaků a laboratorních abnormalit typických pro APS byl poprvé popsán v 80. letech minulého století u pacientů se SLE. Předpokládá se, že zhruba 10 % pacientů se SLE mají zároveň i projevy APS. Pozorování provedené na 70 pacientech s projevy ASP, ale bez přítomnosti jiného onemocnění, podpořilo možnost existence primárního ASP [4,5].
Přesný patogenetický mechanizmus vzniku APS není dosud objasněn. Role aPL je u jednotlivých stavů různorodá stejně jako mechanizmus jejich působení. Jedná se o poměrně složité interakce protilátek s jejich cílovými antigeny, které tvoří plazmatické proteiny navázané na negativně nabitý, převážně fosfolipidový povrch. Fosfolipidy jsou nedílnou součástí buněčných membrán a tvoří prostor pro interakci koagulačních faktorů s jejich inhibitory a umožňují transport signálu do intracelulárních kompartmentů. Fosfolipidy samy o sobě nemají imunogenní potenciál, ale svou povahou jsou velmi dynamickými molekulami, které mají schopnost tvořit komplexy s řadou proteinů, které již mohou tvořit cílové struktury pro řadu autoprotilátek [6].
Dosud byla popsána řada protilátek proti plazmatickým proteinům, které se váží na fosfolipidy, podílejících se na rozvoji trombofilního stavu. Dochází k interakci aPL s faktory koagulační kaskády (faktor Va, VIIa, Xa), dále ke zvýšení exprese prokoagulačních faktorů, např. von Willebrandův faktor (vWF), inhibitor aktivace plazminogenu (PAI‑1) a další přirozené inhibitory koagulace [7,8].
Klinická manifestace
Žilní a arteriální trombózy a komplikace v těhotenství patří k hlavním klinickým rysům APS. Nejčastější manifestací APS jsou žilní trombózy. Další časté stavy spojené s manifestním APS jsou opakované spontánní potraty, ztráty plodu, projevy preeklampsie, eklampsie, trombocytopenie, livedo reticularis, postižení CNS ve formě protrahovaných migrén či ischemických mozkových příhod. Mezi méně časté projevy patří hemolytická anémie, kardiovaskulární manifestace (chlopenní vady, koronární příhody) a další uvedené v tab. 3 [1,4].
Table 3. Stručný přehled klinických manifestací antifosfolipidového syndromu. 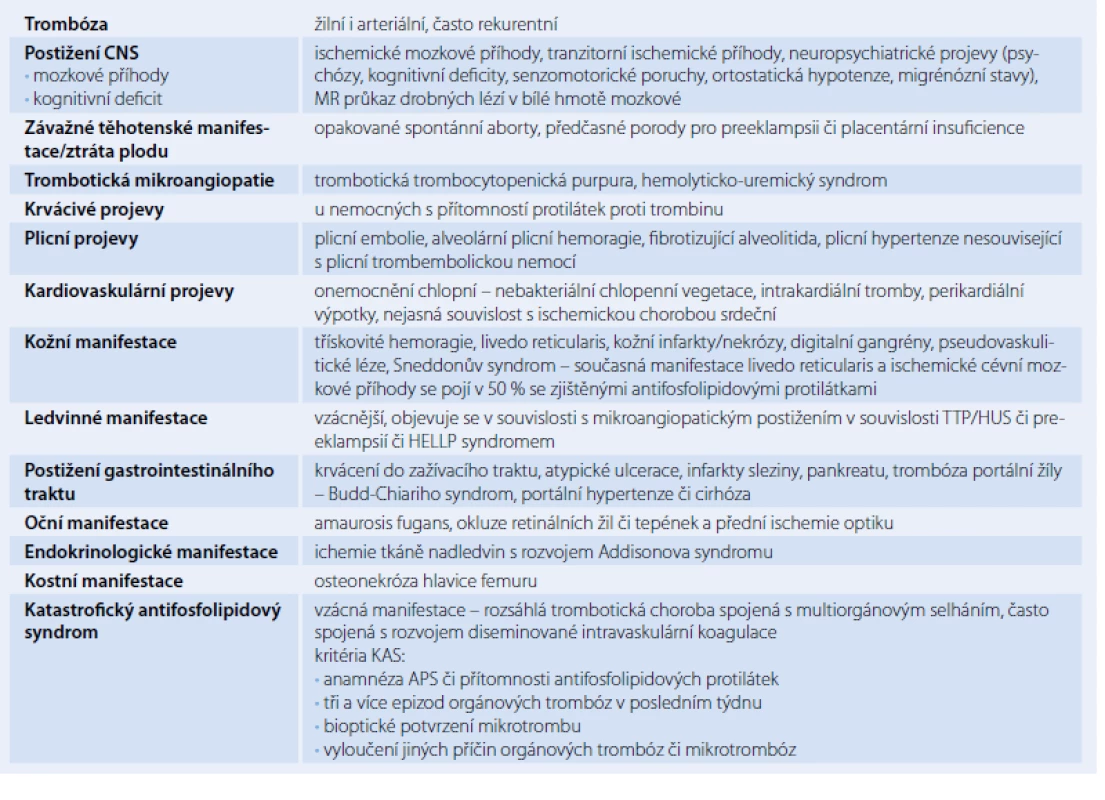
Přestože je APS považován za vzácnější onemocnění, je přibližně 10 % žen s anamnézou opakovaných potratů diagnostikováno s APS. Přítomnost APS zvyšuje riziko rozvoje preeklampsie, eklampsie a placentární insuficience u těhotných. U těhotných s APS bylo rovněž zaznamenáno vyšší riziko fetálního úmrtí, ale kauzální souvislost s APS nebyla dosud objasněna [9 – 11].
Obávanou, ale naštěstí vzácnou manifestací APS je katastrofický APS (KAS) manifestující se rozsáhlou trombotickou chorobou doprovázenou multiorgánovým selháním s vysokou mortalitou, obzvláště pokud dojde k rozvoji syndromu diseminované intravaskulární koagulace. Laboratorně jsou detekovány zvýšené hladiny fibrin degradačních produktů, D‑dimerů a s konsumpcí fibrinogenu. Pro diagnózu KAS je nutná přítomnost APS či aPL, tří a více epizod orgánových trombóz v posledním týdnu, bioptické potvrzení mikrotrombu a vyloučeních jiných příčin trombóz či mikrotrombóz [12].
Antifosfolipidové protilátky
Oxidační stres vedoucí ke strukturální alteraci glykoproteinu I patří k hlavním protrombotickým faktorům. Tento předpoklad je podpořen sníženou hladinou proteinů s antioxidativními vlastnostmi u pacientů s APS. Dochází k formaci disulfidických můstků β2 - glykoprotienu I a ke změně konfirmace glykoproteinu I z cirkulární na lineární formu, což může vést k expozici epitopů pro aPL na B lymfocytech [7]. Endoteliální změny způsobené změnou konfirmace proteinů společně s působením aPL tvoří terén pro vznik trombózy. Snížená aktivita syntetázy oxidu dusnatého je rovněž považována za rizikový faktor vzniku trombózy u pacientů s APS. Protilátky proti β2 - glykoproteinu I mají schopnost aktivovat celou řadu receptorů podílejících se na rozvoji trombotického stavu, mezi které patří toll‑like receptory 2 a 4 (TLR), annexin A2 a apo E receptory. Annexin 5 má schopnost se vázat na fosfatidylserin v průběhu endoteliálního poškození a zabraňuje alterovanému protrombogennímu stavu. U pacientů s APS byla popsána zvýšená exprese TLR ‑ 7 a TLR ‑ 8, které hrají zřejmě roli v patogenezi APS [13].
Laboratorní kritéria APS vyžadují laboratorní průkaz protilátek proti plazmatickým proteinům, které se váží na fosfolipidy. Metodou ELISA (Enzyme‑linked immunosorbent assay) lze detekovat antikardiolipinové protilátky a protilátky proti β2 - glykoproteinu I. Další lze prokázat pomocí koagulačního vyšetření, které prokazuje vliv protilátky na faktory koagulační kaskády závislé na fosfolipidech. V klinické praxi je využíván test lupus antikoagulans. Další antifosfolipidové protilátky se v běžné praxi nedetekují a nejsou zahrnuty do klasifikačních kritérií (antitrombinové protilátky, protilátky proti annexinu V, fosfatidilserinu, fosfatidilinositolu). Přítomnost antiprotrombinových protilátek je spojena nejen s rozvojem trombózy, ale i se zvýšenou krvácivostí [1,10,14].
Terapie
Základní terapeutický přístup se mezi primárním a sekundárním APS v zásadě neliší. Sekundární APS navíc vyžaduje potlačení aktivity základního onemocnění.
Terapeutický postup u dosud asymptomatických pacientů, kteří vykazují pouze přítomnost aPL, je konzervativní. Mnoho z těchto nemocných často ani trombembolickou příhodu neprodělá. V těchto případech nebývá indikována trvalá léčba, ale jsou doporučována režimová opatření při rizikových situacích a vyvarování se rizikovým aktivitám (kouření, obezita, orální hormonální antikoncepce). Vzhledem k heterogenním projevů APS je nezbytný individuální přístup k jednotlivým nemocným (tab. 4). V léčbě jsou využívána tato terapeutika: běžně se užívá heparin (nízkomolekulární LMWH či nefrakcionovaný), warfarin a kyselina acetylsalicylová v různém dávkování a kombinaci v závislosti na manifestaci tohoto heterogenního onemocnění. Zvláštní přístup vyžadují gravidní pacientky s APS (tab. 5) [1,4,10,12,15].
Table 4. Terapie antifosfolipidového syndromu – specifické klinické situace. 
ASA – kyselina acetyl salicylová, CMP – cévní mozková příhoda, LMWH – nízkomolekulární heparin, INR – International Normalized Ratio, SLE – systémový lupus erythematodes, TTP/HUS – trombotická trombocytopenická purpura/hemolyticko-uremický syndrom Table 5. Doporučení Americké porodnické asociace pro léčbu těhotných s antifosfolipidovým syndromem či přítomností antifosfolipidových protilátek. 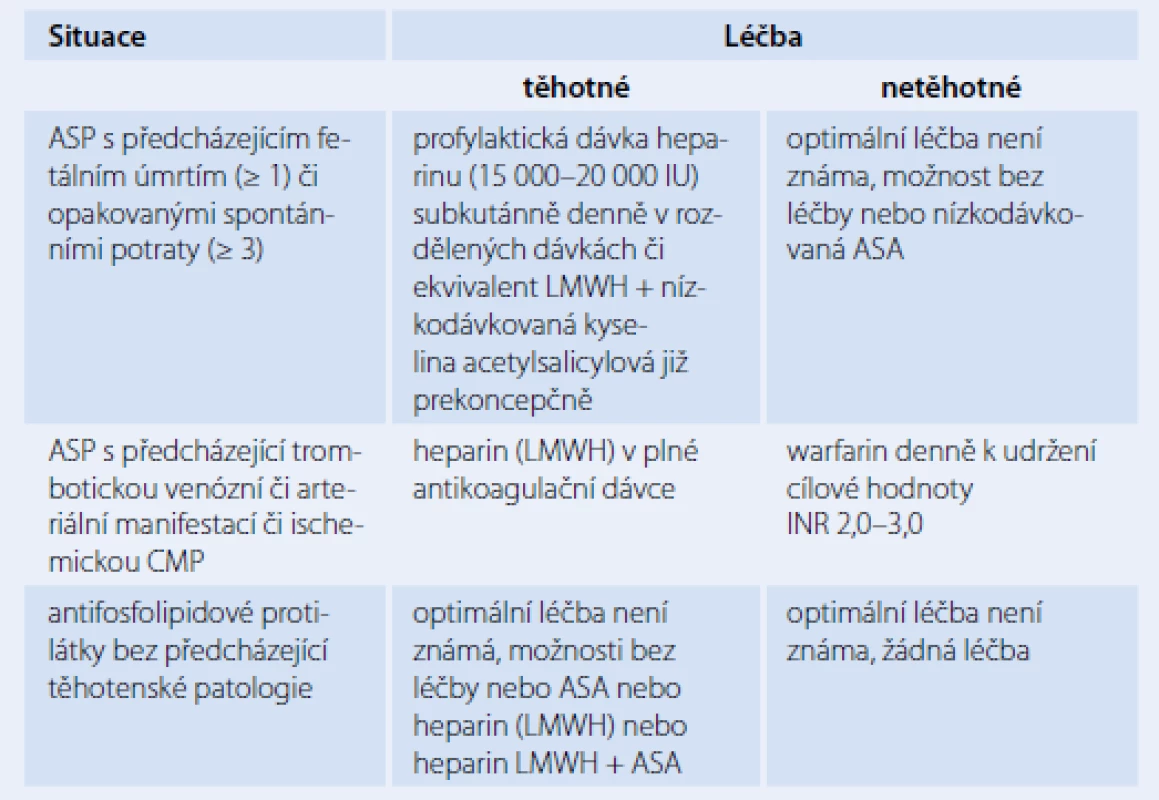
ASA – kyselina acetylsalicylová, CMP – cévní mozková příhoda, LMWH – nízkomolekulární heparin, INR – International Normalized Ratio Závěr
Diagnóza APS, vzhledem k často heterogenním příznakům, může představovat diagnostický problém. Nezbytný je multidisciplinární přístup jak v diagnóze, tak v následné dispenzarizaci nemocných.
Včasná diagnóza a terapie APS vede ke zlepšení morbidity a mortality nemocných s tímto onemocněním. Díky novým laboratorním a diagnostickým metodám jsou tito pacienti včas rozpoznáni a adekvátně léčeni. Dosud chybí jednoznačné terapeutické doporučení, jak postupovat u asymptomatických nemocných. Rovněž chybí klinické studie hodnotící účinnost nových antikoagulancií v terapii APS
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Doručeno do redakce: 15. 9. 2014
Přijato po recenzi: 6. 10. 2014
MUDr. Hana Ciferská, Ph.D.
www.revma.cz
ciferska@revma.cz
Sources
1. Erkan D, Lockshin MD. What is antiphospholipid syndrome? Curr Rheumatol Rep 2004; 6 : 451 – 457.
2. Miyakis S, Lockshin MD, Atsumi T et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4 : 295 – 306.
3. Kaul M, Erkan D, Sammaritano L et al. Assessment of the 2006 revised antiphospholipid syndrome classification criteria. Ann Rheum Dis 2007; 66 : 927 – 930.
4. Hughes GR. The antiphospholipid syndrome: ten years on. Lancet 1993; 342 : 341 – 344.
5. Asherson RA, Khamashta MA, Ordi ‑ Ros J et al. The ‘primary’ antiphospholipid syndrome: major clinical and serological features. Medicine (Baltimore) 1989; 68 : 366 – 374.
6. Giannakopoulos B, Krilis SA. The pathogenesis of the antiphospholipid syndrome. N Engl J Med 2013; 368 : 1033 – 1044. doi: 10.1056/ NEJMra1112830.
7. Galli M, Luciani D, Bertolini G et al. Anti‑β2 – glycoprotein I, antiprothrombin antibodies, and the risk of thrombosis in the antiphospholipid syndrome. Blood 2003; 102 : 2717 – 2723.
8. Giannakopoulos B, Gao L, Qi M et al. Factor XI is a substrate for xidoreductases: enhanced activation of reduced FXI and its role in antiphospholipid syndrome thrombosis. J Autoimmun 2012; 39 : 121 – 129. doi: 10.1016/ j.jaut.2012.05.005.
9. Sugi T, Matsubayashi H, Inomo A et al. Antiphosphatidylethanolamine antibodies in recurrent early pregnancy loss and mid ‑ to ‑ late pregnancy loss. J Obstet Gynaecol Res 2004; 30 : 326 – 332
10. The American College of Obstetricians and Gynecologists. Antiphospholipid Syndrome. ACOG Practice Bulletin No. 18 2011; 117 : 192 – 199. doi: 10.1097/ AOG.0b013e31820a61f9.
11. Cervera R, Piette JC, Font J et al. Euro‑Phospholipid Project Group. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum 2002; 46 : 1019 – 1027.
12. Asherson RA, Cervera R, de Groot PG et al. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus 2003; 12 : 530 – 534.
13. de Laat B, Wu XX, van Lummel M et al. Correlation between antiphospholipid antibodies that recognize domain I of β2 - glycoprotein I and a reduction in the anticoagulant activity of annexin A5. Blood 2007; 109 : 1490 – 1494.
14. Keeling D, Mackie I, Moore GW et al. British Committee for Standards in Hematology. Guidelines on the investigation and management of antiphospholipid syndrome. Br J Haematol 2012; 157 : 47 – 58. doi: 10.1111/ j.1365 ‑ 2141.2012.09037.x.
15. Ruiz ‑ Irastorza G, Cuadrado MJ, Ruiz ‑ Arruza I et al.Evidence‑based recommendations for the prevention and long‑term management of thrombosis in antiphospholipid antibody ‑ positive patients: report of a task force at the 13th International Congress on antiphospholipid antibodies. Lupus 2011; 20 : 206 – 218. doi: 10.1177/ 096120
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 5-
All articles in this issue
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

