-
Medical journals
- Career
Ledviny a akutní koronární syndrom
Authors: P. Widimský; I. Rychlík
Published in: Kardiol Rev Int Med 2011, 13(1): 17-19
Category: From Hypertension to Heart Failure
Overview
Zavedení perkutánních koronárních intervencí do rutinní léčby nemocných s akutními koronárními syndromy významně snížilo jejich mortalitu, ale současně otevřelo některé nové problémy. Jedním z hlavních problémů jsou závažná souběžná onemocnění – např. chronická onemocnění ledvin. Kardiorenální syndrom je pojem, který se někdy používá pro označení komplexních vztahů mezi srdečním a ledvinovým onemocněním. Nejde samozřejmě o skutečný syndrom, ale spíše o patofyziologické souvislosti. Nemocní s chronickým onemocněním ledvin a akutními koronárními syndromy mají obvykle velmi rozsáhlou a pokročilou koronární aterosklerózu (většinou s masivními kalcifikacemi ve stěnách věnčitých tepen), což zvyšuje riziko a snižuje úspěšnost revaskularizačních výkonů. Tento přehledný článek se zabývá některými aspekty vztahů mezi chronickým onemocněním ledvin a akutními koronárními syndromy včetně kontrastem indukované nefropatie.
Klíčová slova:
akutní koronární syndrom – renální insuficience – perkutánní koronární intervence – kontrastní látkyÚvod
Zavedení perkutánních koronárních intervencí (PCI) do rutinní léčby nemocných s akutními koronárními syndromy (AKS) významně snížilo jejich mortalitu, ale současně otevřelo některé nové problémy. Jedním z hlavních problémů jsou závažná souběžná onemocnění – např. chronická onemocnění ledvin (chronic kidney disease – CKD). Kardiorenální syndrom je pojem, který se někdy používá pro označení komplexních vztahů mezi srdečním a ledvinovým onemocněním. Nejde samozřejmě o skutečný syndrom, ale spíše o patofyziologické souvislosti. Tento termín nepoužíváme jako klinickou diagnózu, ale výhradně jako patofyziologický pojem za účelem lepšího pochopení patofyziologických dějů a vztahů. Pacienti s CKD a AKS představují často obtížný úkol pro intervenčního kardiologa nebo kardiochirurga. Jejich těžce difuzně sklerotické, zpravidla masivně kalcifikované tepny jsou náchylné k řadě komplikací: od prostého technického selhání revaskularizace (balonek či stent nelze zavést do masivně kalcifikované a kriticky zúžené tepny; bypass nelze našít distální anastomózou) přes riziko pozdějšího selhání revaskularizace (restenóza po PCI v důsledku suboptimálního roztažení stentu v kalcifikované tepně, uzávěr bypassu kvůli nedostatečnému odtoku z periferní anastomózy pro sklerotické postižení distálního povodí) až po katastrofické komplikace (ruptura koronární tepny s tamponádou během PCI, disekce porcelánové aorty při operaci).
Epidemiologie a prognóza renální insuficience při akutních koronárních syndromech
Prevalence CKD v dospělé populaci je udávána až 12% [1]. CKD jsou považována za rizikový faktor rozvoje a tíže koronární aterosklerózy [2]. Navíc přítomnost CKD zvyšuje riziko úmrtí (včetně vyššího rizika úmrtí při AKS či při PCI) [3–5]. Riziko se zvyšuje zejména při poklesu glomerulární filtrace < 60 ml//min/1,73 m2. Nemocní s CKD často nemají klasické příznaky ischemie myokardu – atypické potíže někdy oddalují stanovení správné diagnózy a tím dále zhoršují prognózu [6]. Čím závažnější je porucha funkce ledvin, tím vyšší je riziko kardiovaskulární mortality [7].
Patofyziologie
Kardiovaskulární onemocnění při CKD může být důsledkem postižení koronárních tepen akcelerovanou aterosklerózou a/nebo přímým (nekoronárním) poškozením myokardu v důsledku tlakového či objemového přetížení. Kalcifikace ve stěnách tepen postihují intimu nebo medii [8]. Uremie je spojena se zvýšeným oxidativním stresem, tvorbou cytokinů, zvýšením adhezních molekul v endotelu a dalšími zánětlivými faktory, které dále akcelerují rozvoj aterosklerózy. Snížená syntéza NO vede k vazokonstrikci a hypertenzi.
Diagnostický přístup k nemocným s renální insuficiencí a akutními koronárními syndromy
Stejně jako u jiných nemocných, diagnóza AKS je založena na příznacích, EKG a laboratorních vyšetřeních. Jak bylo již uvedeno, atypické příznaky mohou oddálit stanovení správné diagnózy a tím zvýšit mortalitu akutního infarktu myokardu u nemocných s CKD [9]. Publikovaná retrospektivní data [10] ukazují, že nemocní v dialyzačním programu měli významně méně často správně stanovenou diagnózu AKS při přijetí do nemocnice (v 55 % vs nemocní bez CKD v 79 %), méně často měli typické bolesti na hrudi (44 vs 68 %) nebo elevace úseků ST na EKG (19 vs 36 %). Výpočet glomerulární filtrace by měl být samozřejmostí u každého pacienta přijímaného pro AKS. Při podávání kontrastních látek je nutná opatrnost zejména u osob velmi starých, u diabetiků a u osob s nízkou tělesnou hmotností.
Existují dva důležité rozdíly v diagnostice AKS při CKD (oproti AKS bez CDK): a) interpretace hodnot troponinu musí být vždy založena na dynamice hodnot (zvýšení a poté snížení), jinak hrozí falešně pozitivní diagnóza infarktu myokardu; b) jakákoli vyšetřovací metoda vyžadující podání kontrastní látky (koronarografie, CT vyšetření) musí být před indikací pečlivě zvážena (včetně jejího načasování).
Volba a dávkování léků
Při závažném renálním selhání (CrCl << 30 ml/min) jsou některé léky kontraindikovány zcela nebo je nutná výrazná redukce jejich dávek [11]. Mnoho léků je ledvinami vylučováno a při zhoršené renální funkci dochází k jejich kumulaci v organizmu a vzniku nežádoucích vedlejších účinků. Při CKD je samozřejmě vysoké riziko lékových interakcí, proto by tito nemocní měli dostávat jen absolutně nezbytné léky a v nejnižších možných dávkách.
V praxi má největší význam redukce dávek nízkomolekulárního heparinu (low molecular weight heparin – LMWH). Pokud při snížení renálních funkcí není snížena dávka LMWH, je nemocný ohrožen závažnými krvácivými komplikacemi. Praktická doporučení pro podávání nejčastějších léků nemocným s AKS + CKD jsou v tab. 1.
Table 1. Doporučení pro podávání některých léků nemocným s AKS + CKD. 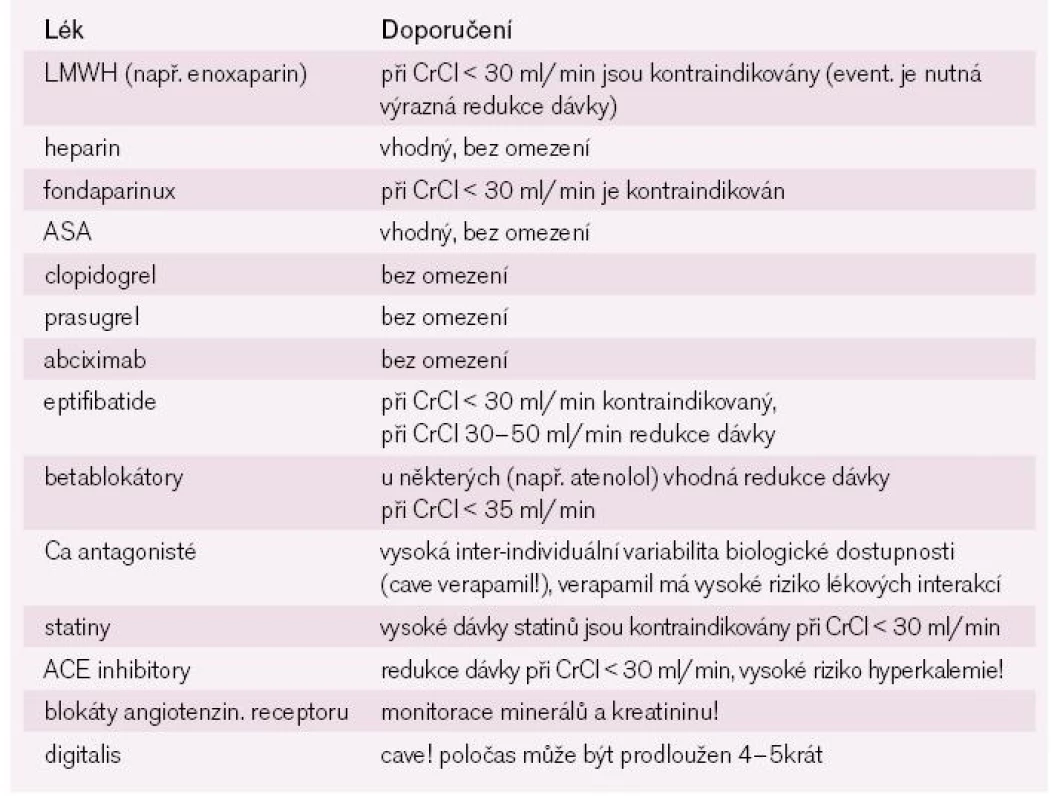
Kontrastem indukovaná nefropatie
Podání rentgenových kontrastních látek může způsobit akutní renální selhání či zhoršení preexistujícího chronického renálního selhání. Začíná zpravidla brzy po podání kontrastu a většinou bývá reverzibilní [12]. Kontrastem indukovaná nefropatie (CIN) je definována jako zvýšení hladiny sérového kreatininu (SCr) o 25–50 % nad vstupní hodnotu (před podáním kontrastu). CIN vzniká do 24 hod po podání kontrastu a vrcholí v prvních pěti dnech [13]. Většinou je plně reverzibilní, klinicky závažná CIN vyžadující hemodialýzu po koronarografii/PCI nebo po CT vyšetření je vzácná: po elektivních koronarografiích se vyskytuje v méně než 1 % [14], při AKS (včetně STEMI) až ve 12 % [15]. Zvýšené riziko vzniku CIN mají nemocní s eGFR < 60 ml/min/1,73 m2, zejména diabetici léčení biguanidy.
Prevence CIN
U rizikových nemocných je nutné přijmout následující opatření [16]:
- Pokud je nutné CT vyšetření, provést jej bez použití kontrastu. CT koronarografii u nemocných s AKS + CKD neindikujeme nikdy – jednak tito nemocní stejně většinou musí podstoupit klasickou koronarografii a jednak je u nich CT koronarografie kvůli kalcifikacím často nehodnotitelná.
- Nepoužívat vysokoosmolární kontrastní látky, upřednostňovat izoosmolární kontrasty.
- Použít nejnižší možnou dávku kontrastu, jaká stačí ke stanovení diagnózy či k provedení PCI na infarktové tepně.
- Neopakovat vyšetření brzy po sobě.
- Nikdy nemocným před katetrizací nezakazovat pití tekutin, naopak je k dostatečnému příjmu tekutin per os vybízet.
- Nepodávat nesteroidní antirevmatika.
- Infuze fyziologického roztoku před výkonem, během něj a několik hodin po něm [15,17].
- Názory na podávání acetylcysteinu (600–1 200 mg per os 2krát denně) den před výkonem a v den výkonu nejsou jednotné, výsledky různých studií dopadly protichůdně. I. v. podání se nedoporučuje (riziko anafylaxe).
- Manitol ani diuretika se nedoporučují.
- Metformin se musí vysadit 48 hod před podáním kontrastu.
- Profylaktická hemodialýza po podání kontrastu se doporučuje jen u nemocných v konečné fázi CKD, kteří již mají vytvořený cévní přístup pro dialýzu.
Revaskularizace
Revaskularizační zákroky provedené z indikace AKS zlepšují prognózu nemocných s CKD při jakémkoli stupni renálního postižení [11]. Nedávno publikovaná studie [18] ukázala, že koronarografie (s event. PCI) oproti medikamentózní léčbě nijak nezhoršuje dlouhodobý vývoj glomerulární filtrace u nemocných s CKD. Naopak, tato práce zdůraznila význam PCI pro záchranu života těchto nemocných. Rozhodnutí o provedení koronarografie/PCI musí být vždy individuálně zváženo (podle poměru kardiovaskulárního rizika úmrtí a renálního rizika rozvoje CIN). V urgentních případech (STEMI, klidové stenokardie s depresemi ST, akutní srdeční selhání či šok) se koronarografie provádí okamžitě bez ohledu na renální funkce. Naopak u stabilizovaného nemocného (bez stenokardií, bez známek srdečního selhání, bez elevací či depresí ST) lze výkon provést elektivně tehdy, až renální funkce bude stabilní. Takový elektivní výkon by se měl provádět jako „staged procedure“ (koronarografie následovaná až za několik dnů PCI nebo koronarografie + PCI jedné tepny následovaná za týden PCI dalších tepen).
Závěr
Nemocní s CKD mají vysoké riziko infarktu myokardu a kardiovaskulárního úmrtí. Proto by měli být indikováni ke koronarografii/revaskularizaci podle stejných kritérií jako pacienti bez CKD. Adekvátní hydratace a minimální dávka kontrastu jsou nejlepší prevencí CIN. Glomerulární filtrace by měla být vypočtena u každého nemocného přijatého pro AKS. Zvláštní pozornost je nutno věnovat starým pacientům, ženám a osobám s nízkou tělesnou hmotností, neboť u těchto osob i téměř normální hladina sérového kreatininu může zakrývat sníženou filtraci [11]. Heparin (UFH) korigovaný podle aPTT (či ACT) je nejvhodnějším antikoagulans při CKD.
Doručeno do redakce 16. 11. 2010
Přijato po recenzi 1. 12. 2010prof. MUDr. Petr Widimský, DrSc., FESC.1
prof. MUDr. Ivan Rychlík, CSc., FASN2
1Kardiocentrum, 3. LF UK a FN KV, Praha
2II. interní klinika FN KV a dialyzační středisko Fresenius Medical Care FN KV, Praha
widim@fnkv.cz
Sources
1. U.S. Renal Data System. USRDS 2008 Annual Data report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States. Am J Kidney Dis 2009; 1: S1.
2. Ix JH, Shlipak MG, Liu HH et al. Association between renal insufficiency and inducible ischemia in patients with coronary artery disease: the heart and soul study. J Am Soc Nephrol 2003; 14 : 3233–3238.
3. Al Suwaidi J, Reddan DN, Williams K et al. GUSTO-IIb, GUSTO-III, PURSUIT. Global Use of Strategies to Open Occluded Coronary Arteries. Platelet Glycoprotein IIb/IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy; PARAGON-A Investigators. Platelet IIb/IIIa Antagonism for the Reduction of Acute coronary syndrome events in a Global Organization Network. Prognostic implications of abnormalities in renal function in patients with acute coronary syndromes. Circulation 2002; 106 : 974–980.
4. Best PJ, Lennon R, Ting HH et al. The impact of renal insufficiency on clinical outcomes in patients undergoing percutaneous coronary interventions. J Am Coll Cardiol 2002; 39 : 1113–1119.
5. Keith DS, Nichols GA, Gullion CM et al. Longitudinal follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med 2004; 164 : 659–663.
6. Sosnov J, Lessard D, Goldberg RJ et al. Differential symptoms of acute myocardial infarction in patients with kidney disease: a community-wide perspective. Am J Kidney Dis 2006; 47 : 378–384.
7. Shlipak MG, Heidenreich PA, Noguchi H et al. Association of renal insufficiency with treatment and outcomes after myocardial infarction in elderly patients. Ann Intern Med 2002; 137 : 555–562.
8. London G, Guérin AP, Marchais SJ et al. Arterial media calcification in end-stage renal disease: impact on all-cause and cardiovascular mortality. Nephrol Dial Transplant 2003; 18 : 1731–1740.
9. Herzog CA. How to manage the renal patient with coronary heart disease: the agony and the ecstasy of opinion-based medicine. J Am Soc Nephrol 2003; 14: 2556–2572.
10. Herzog CA, Littrell K, Arko C et al. Clinical characteristics of dialysis patients with acute myocardial infarction in the United States: a collaborative project of the United States Renal Data System and the National Registry of Myocardial Infarction. Circulation 2007; 116 : 1465–1472.
11. Bassand JP, Hamm CW, Ardissino D et al. Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28: 1598–1660.
12. Asif A, Epstein M. Prevention of radiocontrast--induced nephropathy. Am J Kidney Dis 2004; 44 : 12.
13. McCullough PA. Contrast-Induced Acute Kidney Injury. J Am Coll Cardiol 2008; 51 : 1419–1428.
14. Weisbord SD, Hartwig KC, Sonel AF et al. The incidence of clinically significant contrast-induced nephropathy following non-emergent coronary angiography. Catheter Cardiovasc Interv 2008; 71: 879–885.
15. Recio-Mayoral A, Chaparro M, Prado B et al. The reno-protective effect of hydration with sodium bicarbonate plus N-acetylcysteine in patients undergoing emergency percutaneous coronary intervention: the RENO study. J Am Coll Cardiol 2007; 49 : 1283–1288.
16. Rudnick MR, Tumlin JA. Prevention of radiocontrast media-induced acute kidney injury. UpToDate in Nephrology and Hypertension. [www.uptodate.com] (last update Oct 16, 2008).
17. Mueller C, Buerkle G, Buettner HJ et al. Prevention of contrast media-associated nephropathy: randomized comparison of 2 hydration regiments in 1 620 patients undergoing coronary angioplasty. Arch Intern Med 2002; 162 : 329.
18. Inrig JK, Patel UD, Briley LP et al. Mortality, kidney disease and cardiac procedures following acute coronary syndrome. Nephrol Dial Transplant 2008; 23: 934–940.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2011 Issue 1-
All articles in this issue
- Medikamentózní léčba plicní arteriální hypertenze v roce 2011
- Osud nemocných na čekací listině transplantace srdce
- Postavení TOR inhibitorů po transplantaci srdce
- Index kompatibility: Má své místo u pacientů po transplantaci srdce?
- Mechanické podporné systémy v liečbe srdcového zlyhávania
- Nové poznatky v antiagregační léčbě na ESC 2010
- Latentní obstrukce ve výtokovém traktu levé komory srdeční u pacienta s hypertrofickou kardiomyopatií
- Léčba hypertenze u obezity
- Fixní kombinace u arteriální hypertenze
- Ledviny a akutní koronární syndrom
- Kardiogenní šok
- Jaký význam má modulace srdeční frekvence u nemocných se srdečním selháním
- Je prognóza nemocných s chronickým srdečním selháním stále tak špatná?
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kardiogenní šok
- Je prognóza nemocných s chronickým srdečním selháním stále tak špatná?
- Mechanické podporné systémy v liečbe srdcového zlyhávania
- Latentní obstrukce ve výtokovém traktu levé komory srdeční u pacienta s hypertrofickou kardiomyopatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

