-
Medical journals
- Career
Antiarytmika vs implantabilní kardiovertery-defibrilátory v prevenci náhlé srdeční smrti: definitivně vyřešená otázka?
Authors: M. Táborský; P. Heinc; V. Doupal
Authors‘ workplace: I. interní klinika FN Olomouc
Published in: Kardiol Rev Int Med 2010, 12(Supplementum): 26-31
Overview
První zmínka o vzájemné vazbě fibrilace komor a ischemické choroby srdeční se datuje již do roku 1779. Závažnost problematiky náhlé smrti si lékařská obec uvědomila až v 60. letech 20. stol., kdy začaly vznikat koronární jednotky, kde bylo možné arytmie monitorovat a pacienta okamžitě defibrilovat. V roce 1980 Mirowski poprvé implantoval pacientovi kardioverter-defibrilátor. V řadě randomizovaných studií, většinou s pacienty s ICHS a dysfunkcí levé komory nebo s pacienty s dokumentovanou maligní arytmií, bylo jednoznačně prokázáno, že kardioverter-defibrilátory dosahují v prevenci náhlé smrti lepších výsledků než antiarytmika. Výsledky studií zabývajících se antiarytmiky byly zklamáním. Blokátory sodíkových kanálů a „čisté“ blokátory draslíkových kanálů ve skutečnosti zvyšovaly mortalitu, blokátory kalciových kanálů neměly žádný účinek a u amiodaronu nebyl ve dvou rozsáhlých studiích prokázán žádný vliv na celkovou mortalitu, i když snižuje výskyt smrti v důsledku arytmií. Příznivý vliv na snížení incidence náhlé smrti byl prokázán pouze u beta-blokátorů. Výskyt náhlé smrti snižují všechny preparáty, které působí preventivně na ischemické příhody, či snižují jejich dopad, jako např. inhibitory angiotenzin konvertujícího enzymu, statiny a antagonisté aldosteronu.
Klíčová slova:
ischemická choroba srdeční – fibrilace komor – implantabilní kardioverter defibrilátor (ICD) – antiarytmikaHistorické aspekty
I když se o náhlé srdeční smrti hovoří už ve Starém zákoně, první studie spojující náhlou smrt s ischemickou chorobou srdeční se objevily až v 18. století. V roce 1779 John Hunter, anglický chirurg a anatom, a Edward Jenner, který se proslavil vakcínou proti neštovicím, téměř současně popsali rozsáhlou kalcifikaci koronárních arterií u pacientů s anginou pectoris, kteří náhle zemřeli. V experimentu se to jako prvnímu podařilo až Erichsenovi, který v roce 1840 prokázal, že podvázání koronární arterie v srdci psa vedlo k zastavení činnosti komor, přičemž „se srdce neustále trochu chvělo“ [1]. McWilliam na základě vlastních experimentálních studií v roce 1889 prokázal, že: „náhlá synkopa, k níž dochází v důsledku ucpání či obstrukce určité části koronárního systému, je velmi pravděpodobně výsledkem kontrakce svalových fibril v komorách. Srdeční pumpa je vyřazena a zbytek její životodárné energie je promrhán v zuřivé dlouhotrvající chaotické činnosti komorových stěn“ [2]. Tato teorie zůstala dlouhou řadu let zcela opomenuta a znovu se k ní vracíme teprve v šedesátých letech, kdy si kardiologové začali uvědomovat, že u akutní ischemie je fibrilace komor v časných fázích infarktu myokardu poměrně častým jevem. Julian již v roce 1962 v časopise Lancet uvedl: „Zástava srdce v důsledku fibrilace komor či asystolie je běžnou příčinou úmrtí v důsledku ischemie při akutním IM a každoročně vede k několika tisícům úmrtí, přičemž prodleva v poskytnutí účinné masáže srdce v délce více než 4 minuty znamená velmi vysokou mortalitu a morbiditu. Cenné minuty mohou být ztraceny při neúčinných úderech do hrudníku a aplikaci injekce adrenalinu do srdce. Toto zpoždění lze omezit dvěma způsoby. Zaprvé by všechen lékařský, střední zdravotnický a pomocný personál měl být proškolen ve způsobech poskytování srdeční masáže a umělého dýchání. Zadruhé by se u pacientů, o nichž se ví, že mají vysoké riziko vzniku fibrilace komor či asystolie, mohlo provádět trvalé monitorování srdečního rytmu. To znamená, že všechna oddělení, kam jsou přijímáni pacienti s akutním IM, by měla být vybavena systémem, který zvukovým signálem upozorňuje na začátek důležité změny srdečního rytmu a automaticky zaznamenává srdeční rytmus pomocí EKG“ [3]. Toto poznání vedlo postupně k systematickému zakládání koronárních jednotek. V této době byla externí defibrilace již možnou a dostupnou léčbou [4]. Již koncem sedmdesátých let byla prevence náhlé srdeční smrti vytyčena jako jeden z hlavních úkolů soudobé kardiologie [5].
Riziko výskytu náhlé srdeční smrti v obecné populaci
Jak je uvedeno na obr. 1, riziko náhlé smrti u populace nad 35 let se pohybuje v řádu 1–2 úmrtí na 1 000 osob za rok. Ve věku 40 až 65 let pozorujeme zřetelný nárůst těchto hodnot, přičemž hlavní příčinou je ICHS. U mládeže a v populaci mladých dospělých dosahuje riziko náhlé smrti 1% rizika obecné populace, přičemž hlavní roli v jejich případě hraje rodinná zátěž (modifikováno dle Myerburga).
Image 1. Riziko výskytu náhlé smrti mezi obecnou populací (mládež a mladí dospělí, všeobecná populace nad 35 let věku) a mezi dospělými s pokročilou srdeční chorobou, vztažené k věku. Pravděpodobné etiologii srdeční zástavy dominují u osob nad 35 let věku ICHS a kardiomyopatie a v mladších věkových skupinách různorodá skupina získaných a dědičných onemocnění (modifikováno dle Myerburga). 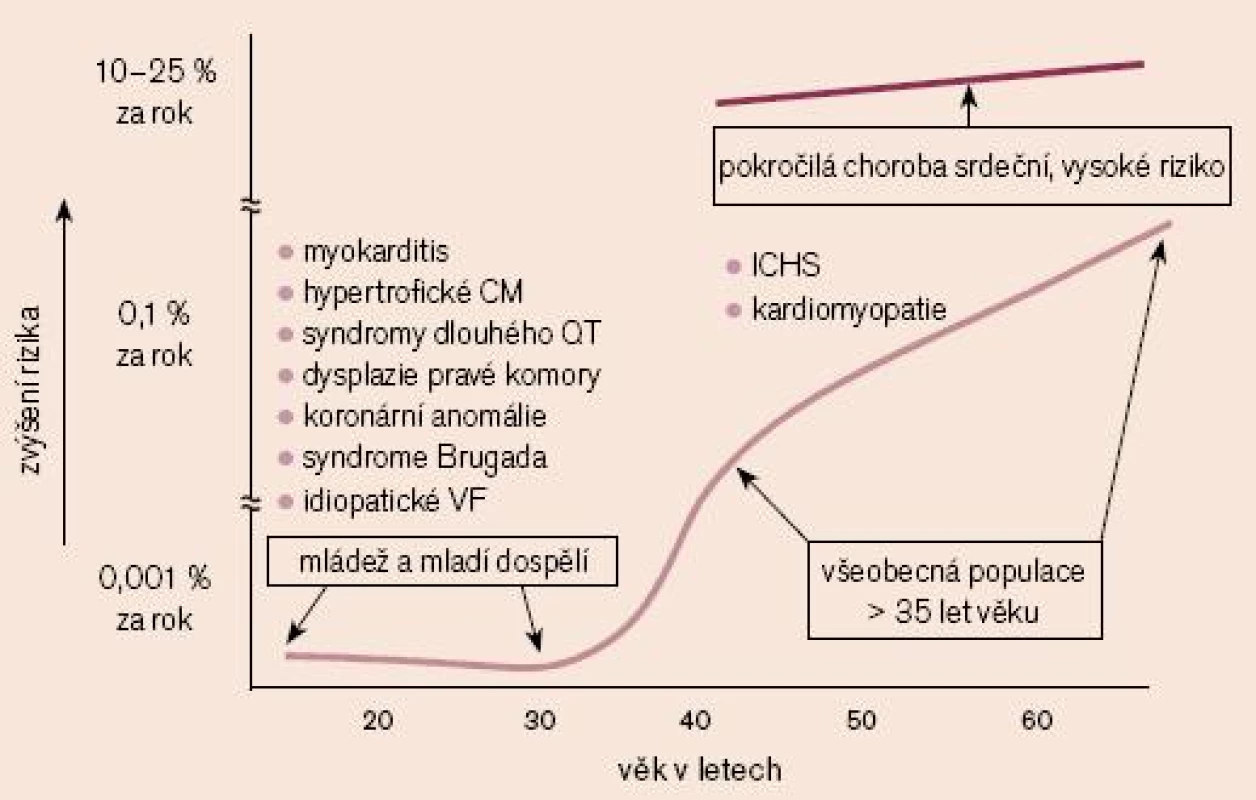
Patofyziologické aspekty srdečních arytmií
McWiliam jako první upozornil v roce 1887 na to, že za fibrilaci zřejmě mohou poruchy vedení vzruchu: „Zdá se, že trvalé rychlé pohyby komor mají kromě možnosti rychlých spontánních výbojů energie ve svalových vláknech i jinou příčinu. Peristaltické stahy, které putují v rámci určité struktury, jako je komorová stěna, musejí dosáhnout sousední svazky vláken v různou dobu a jelikož tyto svazky jsou mezi sebou spojeny pomocí anastomóz, dochází samozřejmě k propagaci od jednoho stahujícího se vlákna k dalšímu, které už má kontrakci za sebou. Tento pohyb tak pokračuje až do doby, než dojde ke snížení vzrušivosti svalové tkáně, takže už neodpovídá na rychlou sérii stahů“ [6]. Ve druhé polovině 20. stol. byly další poznatky o mechanizmu fibrilace zjištěny především na základě teoretické analýzy a počítačových modelů, než bylo možné získat současný záznam z několika míst fibrilujících síní nebo komor. Moe a Allesie, kteří používali počítačový model, vytvořili „hypotézu mnohočetných vln“. V tomto modelu byla fibrilace síní navozena rychlou sérií impulzů a udržována frakcionací přední části vln v částečně a nepravidelně excitabilních tkáních, takže docházelo ke vzniku nezávislých vln, které postupují kolem množství ostrůvků refrakterní tkáně s tím, že neustále dochází ke změně jejich místa, což vede i ke změně vedení vzruchu [7].
Fibrilace byla popsána jako náhodný reentrantní jev, při němž dochází ke změně velikosti, tvaru a místa funkčních reentrantních obvodů. Stále se vedou diskuze o tom, zda funkční reentrantní obvody mají spíše tvar „hlavního okruhu“, nebo kroutících se spirálových vln. Podle konceptu „hlavního okruhu“ je reentrantní mechanizmus založen na „nejmenší možné vzdálenosti, na níž může impulz cirkulovat, přičemž stimulační účinek cirkulujícího čela vlny je velký právě natolik, aby excitoval tkáň před vlnou, která se ještě nachází ve své relativní refrakterní fázi [8]. Bylo zjištěno, že k mechanizmu reentry dochází při komorové tachykardii a fibrilaci v akutní fázi IM, přičemž při fibrilaci, k níž dochází v důsledku ischemie, byly popsány způsoby aktivace tkáně, které odpovídají hypotéze mnohočetných vln [9,10]. V těchto studiích však byly prokázány i jiné než reentrantní mechanizmy, zejména v případě ektopických stahů, které vedou ke vzniku reentry.
Léčba a prevence
Elektrická kardioverze a defibrilace
Green v roce 1872 ve svém operačním sále instaloval galvanickou baterii a úspěšně resuscitoval šest ze sedmi případů zástavy srdce a dýchání v důsledku chloroformové anestezie [11]. Na přelomu minulého století již existovaly jak experimentální, tak i klinické důkazy o tom, že fibrilaci síní lze ukončit pomocí elektrického výboje [12]. Je poněkud překvapující, že to trvalo více než polovinu století, než se defibrilace pomocí elektrického výboje stala běžnou klinickou praxí.
Granty společností vyrábějící elektropřístroje umožnily provedení studií, které se zabývaly účinkem elektrických proudů na srdce. Jedním z důležitých výsledků těchto studií bylo zavedení defibrilace pomocí elektrického šoku a nepřímá masáž srdce podle Kouwenhovena [13]. V roce 1956 Zoll defibriloval pacienta, aniž by mu otevřel hrudník [14]. Poté, co Lown v roce 1962 zavedl DC defibrilátor [4], stala se defibrilace na koronárních jednotkách standardní terapií.
Důležitý krok učinil Michel Mirowski, který v roce 1970 implantoval první automatický kardioverter-defibrilátor (cardioverter-defibrillator – ICD) v experimentu u psů [15] a v roce 1980 u lidí [16]. Prvotní studie prokázaly, že tento přístroj je schopen rozpoznat fibrilaci komor a vydat vhodný výboj.
V průběhu posledních patnácti let byla provedena řada studií zabývajících se primární i sekundární prevencí pomocí ICD. Do studií sledujících otázku primární prevence byli zahrnuti pacienti, kteří byli považováni za velmi rizikové z hlediska vzniku život ohrožujících arytmií (ICHS, dysfunkce levé komory nebo spontánní či indukované komorové arytmie), zatímco ve studiích zabývajících se otázkou sekundární prevence měli nemocní již prokázanou spontánní život ohrožující arytmii.
Do studie MADIT-I (Multicenter Automatic Defibrillator Implantation Trial) [17] byli zahrnuti pacienti po prodělaném IM, se sníženou
funkcí levé komory (ejekční frakce levé komory (EFLK) ≤ 0,35), asymptomatickou neudržující se komorovou tachykardií a indukovatelnou udržující se komorovou tachykardií při elektrofyziologickém testování. Sto devadesát šest pacientů bylo randomizováno do skupiny pacientů léčených pomocí konvenční medikamentózní terapie a do skupiny pacientů, kterým byl implantován ICD. Ve skupině konvenčně léčených pacientů zemřelo 39 pacientů ve srovnání s 15 pacienty v skupině s ICD. V léčbě obou skupin nemocných existovaly určité rozdíly. Ve skupině s ICD dostávalo 26 % pacientů beta-adrenergní blokátory proti pouhým 8 % ve skupině konvenčně léčených pacientů. V případě amiodaronu byly tyto hodnoty 2%, resp. 75%. Vzhledem k tomu, že bylo prokázáno, že beta-blokátory snižují u pacientů po IM výskyt náhlé smrti, zatímco amiodaron u těchto pacientů nesnižuje mortalitu ze všech příčin (viz oddíl 4.2), může zde docházet k určitému zkreslení. Přesto byly výsledky studie poměrně rychle akceptovány americkou FDA jako indikační kritérium pro ICD třídy I B [17].Ve studii CABG Patch byli zahrnuti pacienti se symptomatickou ICHS, dysfunkcí levé komory (EFLK ≤ 0,35) a pozitivním EKG se zprůměrovaným signálem, kteří byli indikováni ke kardiochirurgické revaskularizaci. Po čtyřech letech byla studie přerušena, protože
nebyl zjištěn žádný rozdíl mezi mortalitou ze všech příčin ve skupině pacientů léčených pomocí ICD i bez ICD, přičemž možnost, že se
tento rozdíl projeví v pozdější fázi studie, byla nepravděpodobná [18]. Jednou z kritických námitek vůči studii CABG bylo, že zatímco na počátku studie byl pozitivní EKG se zprůměrovaným signálem považován za vhodný marker stratifikace vysokého rizika vzniku komorových arytmií, pozdější nálezy tento předpoklad zpochybnily [19].Studie MUST (Multicenter Unsustained Tachycardia Trial) zahrnovala nemocné s ICHS, ejekční frakcí levé komory ≤ 0,40 a s neudržující se komorovou tachykardií. Pacienti byli podrobeni elektrofyziologickému testování, a pokud se podařilo indukovat setrvalou
komorovou tachykardii, byli randomizováni do skupiny bez antiarytmické léčby a s antiarytmickou léčbou řízenou programovanou stimulací. Pokud se nepodařilo zjistit účinný antiarytmický preparát, byla pacientům nabídnuta možnost implantace přístroje ICD. Pětileté přežití bylo zaznamenáno u 75 % pacientů ve skupině s ICD, u 55 % pacientů léčených antiarytmiky a u 50 % pacientů bez léčby [20].Studie MADIT-II šla ještě dále. Bylo v ní testováno 1 232 pacientů po prodělaném IM s EFLK ≤ 0,30, kteří byli randomizováni do skupiny pacientů léčených v ICD (742 pacientů) a do skupiny pacientů s konvenční medikamentózní terapií (490 pacientů) v poměru 3 : 2. Hlavním sledovaným parametrem byla mortalita ze všech příčin. V průběhu průměrné doby sledování v délce 20 měsíců dosahovala mortalita ve skupině pacientů léčených pomocí ICD 14,2 % a ve skupině nemocných léčených konvenčně 19,8 % (95% CI = 0,51–0,93, P = 0,06). Autoři dospěli k závěru, že u pacientů po prodělaném IM a s pokročilou dysfunkcí levé komory zvyšuje preventivní implantace defibrilátoru dobu přežívání a měla by být považována za doporučenou terapii [21].
Ze sekundárních preventivních studií měla jednoznačně pouze studie AVID (Antiarrhythmic Versus Implantable Defibrillator) dostatečnou schopnost zjistit signifikantní rozdíl v celkové úmrtnosti mezi pacienty s ICD a pacienty léčených antiarytmiky (ve více než 95 % případů amiodaronem). Pacienti, kteří byli zařazeni do této studie, byli buď resuscitováni pro fibrilaci komor, nebo měli dokumentovanou udržující se komorovou tachykardii. V průběhu střední doby sledování v délce 18 měsíců dosahovala celková mortalita ve skupině s ICD 16 % ve srovnání s 24 % ve skupině pacientů léčených medikamentózně [22]. Stejně jako ve studii MADIT-I se používaly beta-blokátory častěji ve skupině s ICD než ve skupině pacientů léčených antiarytmiky (42 % vs 17 %).
Ve studii CASH (Cardiac Arrest Study Hamburg) byli pacienti po zástavě srdce randomizováni do čtyř skupin – s propafenonem (tato skupina musela studii v důsledku zvýšeného výskytu srdečních příhod ukončit předčasně), s amiodaronem, metoprololem a ICD. Studie neměla dostatečnou průkaznost k tomu, aby zjistila signifikantní rozdíly v přežívání mezi skupinami pacientů, přesto byla pozorována určitá tendence směrem k nižší mortalitě ve skupině pacientů léčených pomocí ICD [23].
Ve studii CIDS (Canadian Implantable Defibrillator Study) byla zjištěna nevýznamná tendence směrem k nižší mortalitě ve skupině s ICD ve srovnání se skupinou pacientů léčených amiodaronem u nemocných po předchozí zástavě srdce, pacientů s hemodynamicky nestabilní komorovou tachykardií nebo s nevysvětlitelnými synkopami [24].
Lze uzavřít, že terapie ICD u pacientů s vysokým rizikem maligních komorových arytmií vede ve srovnání s léčbou antiarytmiky, která u většiny pacientů představoval amiodaron, k delší době přežití a k prevenci náhlé smrti. Je nutné zmínit se, že v zemích Evropské unie existují významné rozdíly mezi počtem implantací ICD, přičemž nejvyšší míra implantací je v Německu (248 implantací na milion obyvatel) a nejnižší ve Velké Británii a ve Francii (71, resp. 128 implantací na milion obyvatel). Údaje jsou z roku 2008 [25].
Obr. 2 ukazuje vliv výsledků studií s ICD na populaci. Skupina vysoce rizikových pacientů z dokončených studií představuje pouze malou část pacientů, kteří umírají náhle.
Image 2. Riziko výskytu náhlé smrti mezi obecnou populací (mládež a mladí dospělí, všeobecná populace nad 35 let věku) a mezi dospělými s pokročilou srdeční chorobou, vztažené k věku. Pravděpodobné etiologii srdeční zástavy dominují u osob nad 35 let věku ICHS a kardiomyopatie a v mladších věkových skupinách různorodá skupina získaných a dědičných onemocnění (modifikováno dle Myerburga). 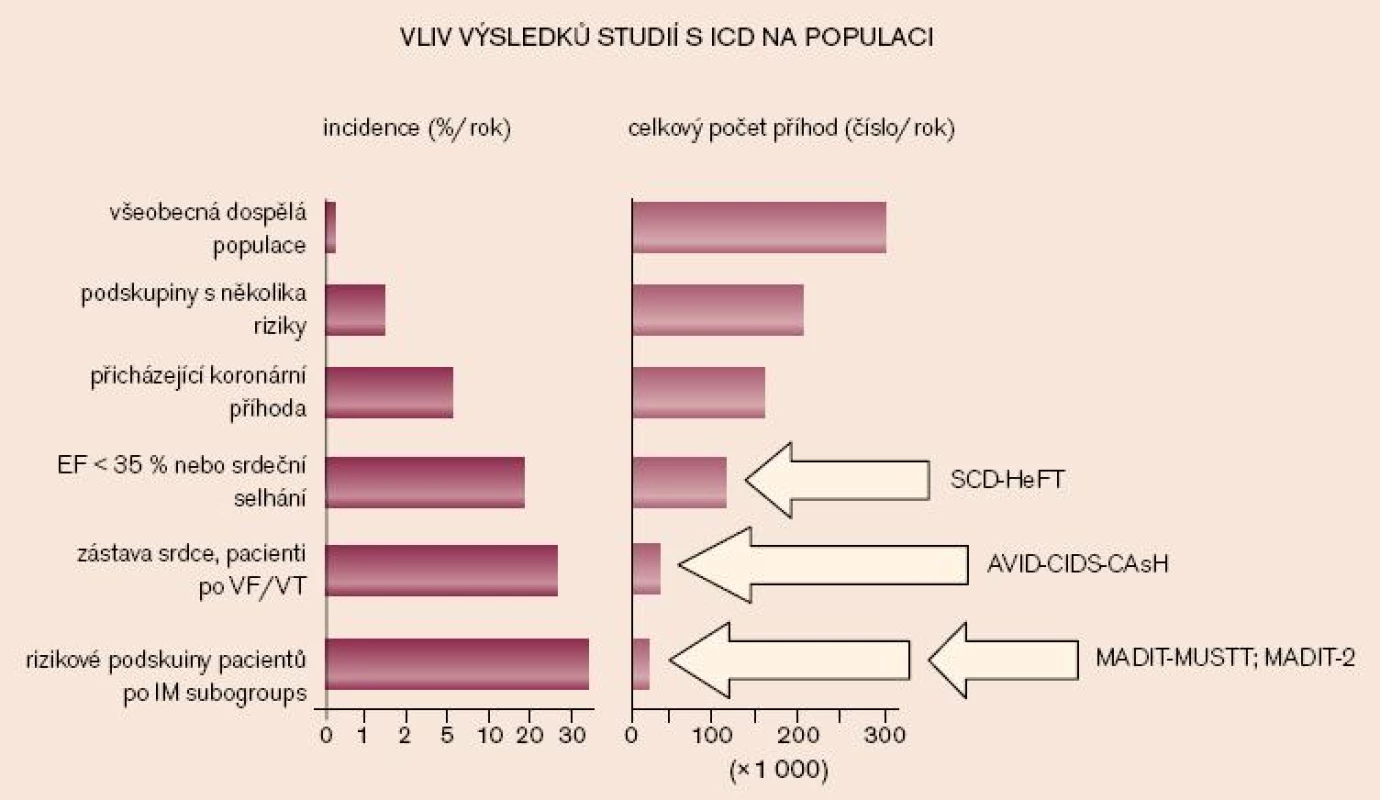
Antiarytmika
Neefektivita antiarytmik k prevenci náhlé smrti je všeobecně známa. Z tab. 1, která reprezentuje přehled 138 studií s antiarytmiky používanými k léčbě komorových arytmií celkem u 98 000 pacientů [24], je patrné, že blokátory kalciového kanálu v podstatě zvyšují mortalitu, vliv antagonistů kalcia je nulový, amiodaron vypadá slibně a beta-adrenergní blokátory představují jasný přínos. Blokátory sodíkového kanálu účinně potlačují komorové arytmie, avšak zvyšují výskyt náhlé smrti, zatímco beta-blokátory nejsou příliš účinné při léčbě arytmií, účinně však působí proti výskytu náhlé smrti. Bylo proto navrženo, že „nižší hodnoty srdečního tepu a snížení aktivity sympatiku jsou možná s ohledem na prevenci výskytu náhlé smrti slibnější než ambient arytmie zaznamenané pomocí Holterova monitorování“ [26]. Jak prokázal Kjekshus, nejúčinněji působily k prevenci náhlé smrti u pacientů po IM beta-blokátory, které vedly k největšímu zpomalení sinusového rytmu [27]. Ve dvou studiích, které se zabývaly hodnocením účinku beta-blokátorů u pacientů se srdečním selháním, bylo prokázáno, že bisoprolol a metoprolol vedou nejen k podstatnému snížení mortality ze všech příčin, ale také k incidenci náhlé smrti [28,29]. Není pochyb o tom, že beta-blokátory jsou jedinými antiarytmiky, která významně redukují riziko náhlé srdeční smrti.
Table 1. Souhrn dat týkajících se potlačení komorových arytmií (138 studií s antiarytmiky u 98 000 pacientů). 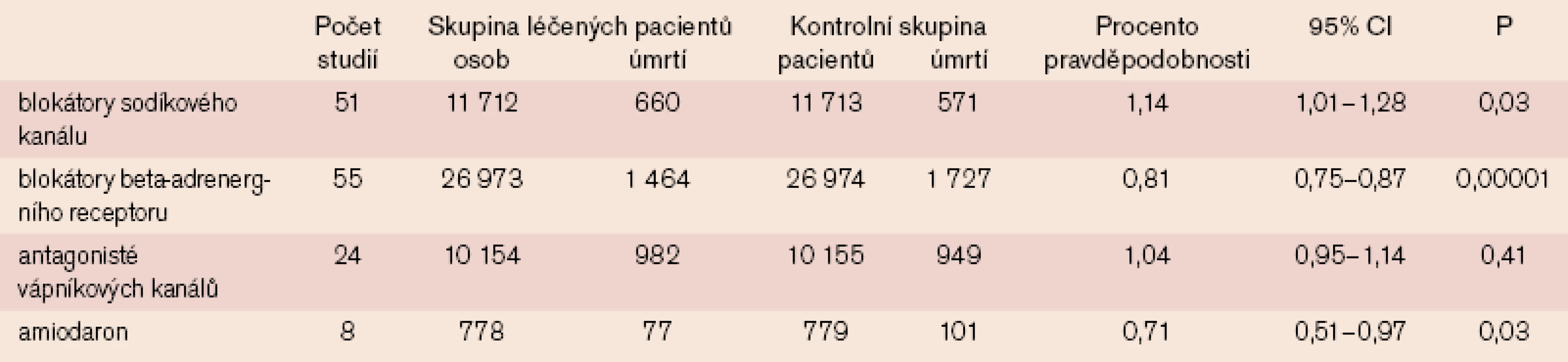
Vzhledem k neuspokojivým výsledkům studií sledujících vliv blokátorů sodíkových kanálů a neutrálnímu vlivu blokátorů vápníkových kanálů se studie s antiarytmiky soustředily v 90. letech 20. stol. na preparáty, které prodlužují akční potenciál, a tím i refrakterní dobu, na tzv. antiarytmika III. třídy. Existoval názor, že prodloužení refrakterní fáze by mohlo na základě prodloužení vlnové délky (součin rychlosti vedení vzruchu a refrakterní doby) zabránit vzniku reentrantních arytmií či je ukončit. Ve studii SWORD (Survival With Oral D-
sotalol) bylo hodnoceno „čisté“ antiarytmikum III. třídy – D-sotalol, který má na rozdíl od sotalolu minimální beta-blokující účinek. Do studie byli zařazeni pacienti po prodělaném IM a s EFLK ≤ 0,40. Studie byla předčasně ukončena z důvodu vyšší mortality v léčené skupině (5,0 % vs 3,1 % ve skupině s placebem). Předpokládá se, že příčinou vyšší úmrtnosti byla smrt způsobená arytmiemi. Přestože
byla incidence zdokumentovaných arytmií typu „torsade de pointes“ nízká (0,2 %), autoři uvádějí, že „se domnívají, že vyšší riziko úmrtí v důsledku aplikaci D-sotalolu u žen ve srovnání s muži poukazuje na to, že se v případě arytmie způsobující daný vedlejší účinek jednalo o arytmii typu „torsade de pointes“ [30].Studie DIAMOND (Danish Investigators of Arrhythmias and Mortality on Dofetilide Study Group) se zabývala dalším blokátorem draslíkových kanálů. Tento preparát pacienti dobře snášeli, neměl však významný vliv na mortalitu [31].
Pouze ve 3 ze 13 randomizovaných kontrolovaných studií s amiodaronem bylo prokázáno významné snížení mortality ze všech příčin ve
skupině léčených pacientů [32–34]. Do všech těchto tří studií však bylo zařazeno jen málo pacientů – od 127 do 516. Dvěma největšími studiemi s amiodaronem je studie EMIAT (European Myocardial Infarct Amiodarone Trial) a studie CAMIAT (Canadian Amiodarone Myocardial Infarction Trial), do nichž bylo zařazeno 1 486, resp. 1 202 pacientů [35,36]. Přestože do oboutěchto studií byli zařazeni pacienti po nedávném IM, kritéria pro jejich zařazení do studie i primární sledované parametry se lišily. Studie EMIAT je jedinou studií zabývající se antiarytmiky, mezi jejímiž kritérii pro zařazení do studie chyběla přítomnost komorových arytmií. V době, kdy byla studie plánována (1989), bylo již jasné, že potlačení arytmií nevede k prevenci náhlé smrti a že nejvýznamnějším faktorem, na jehož základě
lze předpovědět výskyt náhlé smrti, je dysfunkce levé komory [37]. Do studie EMIAT tak byli zařazeni pacienti po nedávno prodělaném IM s EFLK ≤ 0,40, tj. velmi podobná skupina pacientů jako v případě studie MADIT-II [21], přičemž primárním sledovaným parametrem byla celková mortalita. Do studie CAMIAT byli zařazeni pacienti po IM s komorovými arytmiemi a primárním sledovaným parametrem byla smrt v důsledku arytmií. Pacienti ve studii CAMIAT byli méně rizikoví než pacienti ve studii EMIAT, přičemž roční mortalita ve skupině s placebem dosahovala 6,4 %, resp. 8,2 %. V žádné z těchto studií nebylo prokázáno signifikantní snížení mortality ze všech příčin, v obou však bylo zjištěno významné snížení úmrtí v důsledku arytmií a resuscitované zástavy srdce (ve studii EMIAT bylo riziko nižší o 35 %, ve studii CAMIAT o 48,8 %). V metaanalýze všech studií s amiodaronem, jichž se zúčastnilo 6 500 pacientů, se dospělo k závěru, že preventivní podávání amiodaronu u pacientů po nedávno prodělaném IM nebo s městnavým srdečním selháním má za následek nižší výskyt náhlé smrti z důvodů arytmií, což vede k 13% snížení mortality ze všech příčin [38]. Klinický význam takové metaanalýzy není jasný, jelikož skupiny pacientů v různých studiích se liší. Vzhledem k vysokému počtu pacientů, kteří jsou zapotřebí, není pravděpodobné, že by výsledky této metaanalýzy potvrdila nějaká randomizovaná prospektivní studie. Z praktického hlediska lze poznamenat, že léčba amiodaronem byla přerušena u 41 % pacientů z důvodu výskytu vedlejších účinků, včetně poruchy funkce štítné žlázy (ve velké většině případů se jednalo o subklinickou dysfunkci), neuropatie, plicní infiltrace, bradykardie a poruchy jaterních funkcí.Závěr
Shrneme-li předchozí údaje, medikamentózní antiarytmická léčba v prevenci náhlé srdeční smrti – výjimkou betablokátorů – zdaleka nepřinesla očekávané výsledky. Blokátory sodíkových kanálů a „čisté“ blokátory draslíkových kanálů zvyšují mortalitu, antagonisté kalcia jsou neúčinné a amiodaron může zabránit smrti v důsledku arytmie, ve dvou největších studiích však neměl na mortalitu ze všech příčin žádný vliv. Na druhé straně je amiodaron efektivní pro stabilizaci pacientů s arytmickou bouří, kteří jsou již zajištěni implantací ICD a mají vysoký počet výbojů pro frekventní epizody komorových tachykardií nebo fibrilací komor. Systémovým řešením je pak pro takovéto pacienty provedení katetrizační ablace. Navíc amiodaron má po nasycení jednu velkou výhodu, a to takovou, že vynechání 1–2 denních dávek nevede k absenci efektivity tohoto antiarytmika. V současné době je v klinické praxi v České republice prakticky jediným „bezpečným“ antiarytmikem (s výjimkou sotalolu s jeho limitacemi) pro nemocné s těžkou dysfunkcí levé komory srdeční.
Absence efektu antiarytmik v prevenci náhlé srdeční smrti významně ovlivnila medicínské myšlení, a posunula tak pomyslné hranice léčby na úroveň léčby nefarmakologické ve smyslu implantace kardioverterů - defibrilátorů z primárně preventivních a sekundárně preventivních indikací u rizikových nemocných [41,42].
Bylo zjištěno, že léky působící preventivně proti ischemii srdce nebo omezující její důsledky jako velikost infarktu myokardu a léky, které ovlivňují remodelaci, hypertrofii a fibrózu, jako např. inhibitory angiotenzin konvertujícího enzymu, hypolipidemika a antagonisté aldosteronu, snižují výskyt náhlé smrti u pacientů po prodělaném IM nebo se srdečním selháním daleko více než antiarytmika [29,39,40]. Nicméně není nutno považovat antiarytmika za „mrtvou lékovou skupinu“. V současné době se intenzivně vyvíjí celá řada nových molekul, které jsou tkáňově specifické a budou působit buď na úrovni síní nebo na úrovni srdečních komor. Jako slibná se zdají antiarytmika modifikující kalciový metabolizmus. Příkladem jsou látky ovlivňující ryanodinové receptory (RyR2) – např. molekula s označením CL2 [43].
Rád bych chtěl vyjádřit poděkování panu Leu Recovi a paní Beatě Zapletalové z I. interní kliniky FNOL za pomoc při grafické úpravě článku.
doc. MUDr. Miloš Táborský, CSc., FESC, MBA
doc. MUDr. Petr Heinc, Ph.D.
MUDr. Vlastimil Doupal, Ph.D.
I. interní klinika FN Olomouc
milos.taborsky@fnol.cz
Sources
1. Erichsen JE. On the influence of the coronary circulation on the action of the heart. Lond Med Gaz 1841–1842; 2 : 561-565.
2. McWilliam JA. Fibrillar contraction of the heart. J Physiol (Lond) 1887a; 8 : 296-310.
3. Julian DG. Treatment of cardiac arrest in acute myocardial ischaemia and infarction. Lancet 1961; 14 : 840–844.
4. Lown B, Amarasingham R, Neumann J. New method for terminating cardiac arrhythmias. Use of synchronized capacitor discharge. JAMA 1962; 182 : 548–555.
5. Lown B. Sudden cardiac death: the major challenge confronting contemporary cardiology. Am J Cardiol 1979; 43 : 313–328.
6. McWilliam JA. On electrical stimulation of the heart. Trans Int Med Congress 1887b; 9th Session, Washington, III: 253.
7. Moe GK. On the multiple wavelet hypothesis of atrial fibrillation. Arch Int Pharmacodyn Ther 1962; 140 : 183–188.
8. Allessie MA, Bonke FIM, Schopman FJG. Circus movement in rabbit atrial muscle as a mechanism of tachycardia: III. The “leading circle” concept: A new model of circus movement in cardiac tissue without the involvement of an anatomical obstacle. Circ Res 1977; 41 : 9–18.
9. Janse MJ, van Capelle FJL, Morsink H et al. Flow of “injury” current and patterns of excitation during early ventricular arrhythmias in acute regional myocardial ischemia in isolated porcine and canine hearts. Evidence for two different arrhythmogenic mechanisms. Circ Res 1980; 47 : 151–165.
10. Pogwizd SM, Corr PB. Reentrant and nonreentrant mechanisms contribute to arrhythmogenesis during early myocardial ischemia: Results using three-dimensional mapping. Circ Res 1987; 61 : 352–371.
11. Green T. On death from chloroform: its prevention by galvanism. Br Med J 1872; 1 : 551–553.
12. Prevost JL, Batelli F. Sur quelques effects des décharges électriques sur le coeur des Mammiféres. C R Seances Acad Sci 1899; 129 : 1267–1268.
13. Kouwenhoven WB, Jude JR, Knickerbocker GG. Closed-chest cardiac massage. JAMA 1960; 173 : 1064–1067.
14. Zoll PM, Limenthal AJ, Gibson W et al. Termination of ventricular fibrillation in man by externally applied electric countershock. N Engl J Med 1956; 254 : 727–732.
15. Mirowski M, Mower MM, Staewen WS et al. Standby automatic defibrillator: An approach to prevention of sudden coronary death. Arch Int Med 1970; 126 : 158–161.
16. Mirowski M, Reid PR, Mower MM et al. Termination of malignant ventricular arrhythmias with an implanted automatic defibrillator in human beings. N Engl J Med 1980; 303 : 322–324.
17. Moss AJ, Hall WJ, Cannom DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmias. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 1996; 335 : 1933–1940.
18. Bigger JT jr for the Coronary Artery bypass Graft (CABG) Patch Trial Investigators. Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. N Engl J Med 1997; 337 : 1569–1575.
19. Moss AJ. Antiarrhythmic device trials. In: Malik M (ed.). Risk of Arrhythmia and Sudden Death. London: BMJ Books: 379–388.
20. Buxton AE, Lee KL, Fisher JD et al. A randomised study of the prevention of sudden death in patients with coronary artery disease. N Engl J Med 1999; 341 : 1882–1890.
21. The Antiarrhythmics Versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic - drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997; 337 : 1576–1583.
22. Kuck KH, Cappato R, Siebels J et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: The Cardiac Arrest Study Hamburg (CASH). Circulation 2000; 102 : 748–754.
23. CIDS Investigators: Canadian Implantable Defibrillator Study, Conolly SJ, Gent M, Roberts RS et al. A randomised trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 101 : 1297–1302.
24. Teo KK, Yusuf S, Furberg CD. Effects of prophylactic antiarrhythmic drug therapy in acute myocardial infarction: An overview of results from randomized controlled trials. JAMA 1993; 270 : 1589–1595.
25. Brugada J, Vardas P, Wolpert C. The EHRA White Book 2008. [http://www.escardio.org/communities/EHRA/publications/Documents/ehra-white-book-2008.pdf].
26. Kjekshus JK. Importance of heart rate in determining beta-blocker activity in acute and long-term acute myocardial infarction intervention trials. Am J Cardiol 1986; 57 : 43F–49F.
27. CIBIS-II Investigators. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): A randomized trial. Lancet 1999; 353 : 9–13.
28. MERIT-HF Study Group. Metoprolol CR/XL Effect of metropolol CR/XL in chronic heart failure. Randomised intervention trial in congestive heart failure (MERIT - HF). Lancet 1999; 353 : 2001–2007.
29. Waldo AL, Camm AJ, de Ruyter H et al for the SWORD investigators. Effects of D-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. Lancet 1996; 348 : 7–12.
30. Danish Investigators of Arrhythmias and Mortality on Dofetilide Study Group, Torp-Pedersen C, Møller M, Bloch-Thomsen PE et al. Dofetilide in patients with congestive heart failure and left ventricular dysfunction. N Engl J Med 1999; 341 : 857–865.
31. Burkart F, Pfisterer M, Kiowski W et al. Effect of antiarrhythmic therapy on mortality in survivors of myocardial infarction with asymptomatic complex ventricular arrhythmias: Basel Antoiarrhythmic Study of Infarct Survival (BASIS). J Am Coll Cardiol 1990; 16:
1711–1718.
32. Doval HC, Nul DR, Grancelli HO et al for Grupo de Estudio de la Sobrevida en la Insufficiencia Cardiaca en Argentina (GESICA). Randomised trial of low-dose amiodarone in severe congestive heart failure. Lancet 1994; 344 : 493–498.
33. Garguichevich JJ, Ramos JL, Gambarte A et al. Effect of amiodarone therapy on mortality in patients with left ventricular dysfunction and asymptomatic complex ventricular arrhythmias: Argentine Pilot Study of Sudden Death and Amiodarone. Am Heart J 1995; 130 : 494–500.
34. Janse MJ, Malik M, Camm AJ. Identification of post acute myocardial infarction patients with potential benefit from prophylactic treatment with amiodarone. A substudy of EMIAT (the European Myocardial Infarct Amiodarone Trial). Eur Heart J 1998; 19 : 85–95.
35. Boutitie F, Boissel JP, Conolly S et al. Amiodarone interarction with betablockers. Analysis of the merged EMIAT and CAMIAT databases. Circulation 1999; 99 : 2268–2275.
36. Pitt B. Sudden cardiac death: The role of left ventricular dysfunction. Ann NY Acad Sci 1982; 383 : 218–228.
37. Amiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: Meta-analysis of individual data from 6 500 patients in randomised trials. Lancet 1997; 350 : 1417–1424.
38. The CONSENSUS Trial Study Group. Effect of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316 : 1429–1435.
39. Gruppo Italiano per lo Studio della Streptochinasi nell´Infarto miocardico (GISSI). Effectiveness of thrombolytic therapy. Lancet 1986; 1 : 397–402.
40. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4 444 patients with coronary heart disease: The Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344 : 1383–1389.
41. Vardas EP, Auricchio A, Blanc JJ et al. European Society of Cardiology; European Heart Rhythm Association. Guidelines for cardiac pacing and cardiac resynchronization therapy : The Task Force for Cardiac Pacing and Cardiac Resynchronization Therapy of the European Society of Cardiology. Developed in collaboration with the European Heart Rhythm Association. Eur Heart J 2007; 28 : 2256–2295.
42. Táborský M, Kautzner J, Bytešník J et al. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a systémů pro srdeční resynchronizační léčbu 2009. Cor Vasa 2009; 51 : 602–614.
43. Scoote M, Poole-Wilson PA, Williams AJ. The therapeutic potential of new insights into myocardial excitation-contraction coupling. Heart 2003; 89 : 371–376.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue Supplementum-
All articles in this issue
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
- Supraventrikulární arytmie u akutního infarktu myokardu
- Bradykardie u akutního infarktu myokardu
- Antiarytmika vs implantabilní kardiovertery-defibrilátory v prevenci náhlé srdeční smrti: definitivně vyřešená otázka?
- Katetrová ablace elektrické bouře po infarktu myokardu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bradykardie u akutního infarktu myokardu
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Supraventrikulární arytmie u akutního infarktu myokardu
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

