-
Medical journals
- Career
Současné postavení pravastatinu v hypolipidemické léčbě
Authors: L. Špinarová; J. Vítovec
Authors‘ workplace: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
Published in: Kardiol Rev Int Med 2010, 12(3): 138-142
Overview
Autoři podávají přehled problematiky podávání statinů u nemocných s hyperlipoproteinemií se zaměřením na pravastatin. Jsou rozebrány indikace, nežádoucí účinky a srovnání s ostatními statiny. Dále jsou uvedeny příklady klinického použití u pacientů v primární a sekundární prevenci a po transplantaci srdce.
Klíčová slova:
hyperlipoproteinemie – pravastatin – transplantace srdceÚvod
Statiny jsou léková skupina, která blokádou reduktázy HMG (hydroxymetylglutaryl) koenzymu A v hepatocytech tlumí syntézu cholesterolu a indukuje tvorbu LDL-receptorů. Zvýšením exprese LDL-receptorů na povrchu hepatocytů dochází ke zvýšení vychytávání lipoproteinů LDL z krve a tím ke snížení LDL-cholesterolu. Základní dávka statinů snižuje LDL-cholesterol asi o 27 %, její zdvojnásobení vždy o dalších asi 7 %. Statiny také mírně snižují triglyceridy (TG) (v závislosti na jejich dávce) a mírně zvyšují HDL-cholesterol (nezávisle na dávce). Statiny mají i další nelipidové (pleiotropní) účinky: tlumí zánětlivou a imunitní reakci v cévní stěně a ovlivňují proliferaci hladkých svalových buněk a extracelulární matrix. To přispívá ke stabilizaci aterosklerotického plátu, i když pro stabilizaci plátu je nepochybně zásadní snížení LDL-cholesterolu v krvi a tím i v aterosklerotickém ložisku. Některé statiny omezují i riziko trombogeneze – tlumí syntézu PAI-1, trombomodulinu a tromboxanu B2. Zlepšují funkci cévního endotelu tím, že zvyšují syntézu oxidu dusnatého (NO) a snižují expresi endotelinu.
Imunomodulační účin je způsoben inhibicí cytotoxických T lymfocytů – „přirozených zabíječů“. Je zajímavé, že tento účin statinů nebyl prokázaný u nemocných, kteří nebyli transplantováni. Vysvětlením může být nutnost současného podávání cyklosporinu [1].
Kromě lovastatinu, který se lépe vstřebává při jídle, je vhodné brát ostatní statiny na lačno. Vzhledem k tomu, že syntéza endogenního cholesterolu je nejvyšší v noci, bývá doporučováno brát statiny na noc. Statiny jsou vylučovány převážně žlučí (70–95 %), lze je proto podávat i u nemocných s renální insuficiencí [2].
Pravastatin
Po perorálním podání je pravastatin rychle absorbován, maximální plazmatická koncentrace je dosažena za 1–1,5 hod. V průměru se vstřebává 34 % pravastatinu, biologická dostupnost je 17 %. Primární místo účinku je v játrech. Na rozdíl od ostatních statinů je hydrofilní a není metabolizován CYP450. Neinterferuje proto s léky, které jsou tímto cytochromem metabolizovány. Pravastatin se vylučuje stolicí (50 %) a ledvinami (50 %). Prochází do mateřského mléka, kojící žena proto nesmí přípravek užívat. Vazba na proteiny činí asi 50 % a jeho eliminační poločas se pohybuje kolem 1,8 hod. Významně snižuje adhezi krevních destiček a leukocytů. Je považován za „antitrombofilní statin“. Po několikaměsíční léčbě dochází k výrazné redukci destičkových trombů, snižuje se koncentrace PAI-1 a fibrinogenu, zvyšuje se syntéza NO endoteliemi. Pravastatin neinhibuje proliferaci buněk hladkého svalstva a syntézu kolagenu, tím dochází k zpevnění fibrózního plátu. Snižuje v plátech počet zánětlivých buněk i makrofágů a je pravděpodobné, že také moduluje imunitní systém organizmu [3].
Pravastatin je indikován pro léčbu primární hypercholesterolemie či k primární i sekundární prevenci kardiovaskulárních onemocnění v dávkách 10–40 mg denně na noc, maximální povolená dávka je 40 mg/den [4] (tab. 1).
Table 1. Souhrn základní charakteristiky statinů [2,5]. ![Souhrn základní charakteristiky statinů [2,5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/056524a048ce65f4968fd84d3e2395b3.png)
atorva – atorvastatin, fluva – fluvastatin, lova – lovastatin, prava – pravastatin, rosuva – rosuvastatin, simva – simvastatin Nežádoucí účinky statinů
Kromě pravastatinu jsou ostatní statiny metabolizovány přes cytochrom P450 (systém 3A4, 2C6, 2C9 a 2C19). Mnohé léky tento enzymový systém inhibují (tab. 2) a může dojít k nežádoucímu zvýšení plazmatických hladin statinů s rizikem myopatie až rhabdomyolýzy. Podle údajů z ohlášených případů myotoxicity v USA byla incidence rhabdomyolýzy na 1 mil. obyvatel následující: fluvastatin 0, pravastatin 0,04, atorvastatin 0,04, simvastatin 0,12 a lovastatin 0,19. Předzvěstí svalového postižení je podstatné zvýšení kreatinkinázy (CK) v séru. Riziko je zvýšené u pacientů po srdeční transplantaci, protože 8 % případů z uvedeného počtu tvořili pacienti současně užívající cyklosporin [6].
Naopak léky, které indukují CYP450 3A4 (barbituráty, třezalka atd.), hladiny statinů snižují. Je proto důležité znát léky, které tyto enzymy inhibují (zvýšení hladin) nebo indukují (snížení hladin). Některé příklady jsou uvedeny v tab. 2. Také kombinace statinů s fibráty může zvyšovat riziko myopatie až rhabdomyolýzy, zvláště při vyšších dávkách statinů. Další rizikové stavy pro vznik myopatie jsou současný diabetes mellitus, hypotyreóza, ledvinné a jaterní postižení, věk nad 70 let a vysoké dávky statinů (≥ 40 mg/den).
Table 2. Léky, které mohou ovlivnit plazmatické koncentrace statinů. 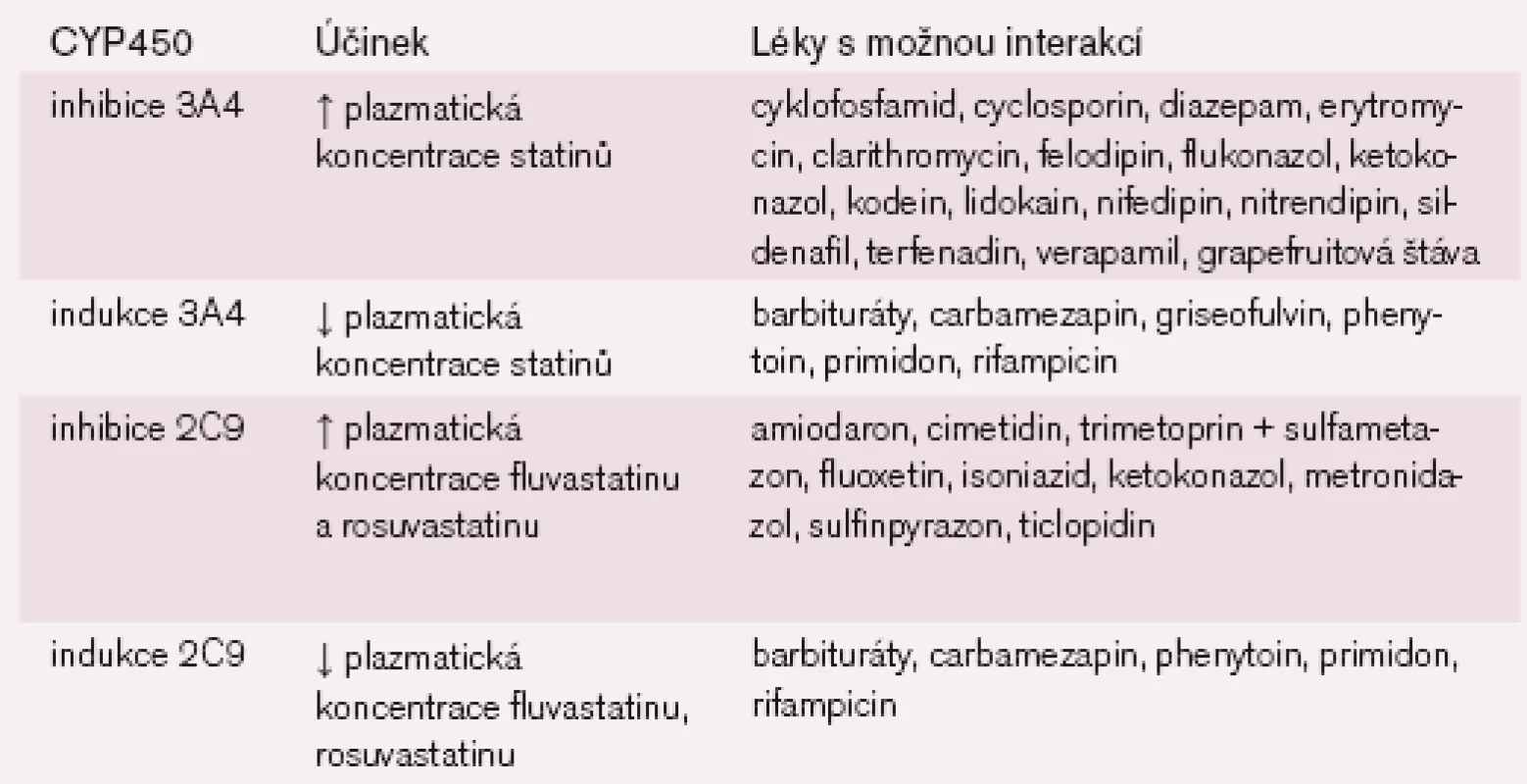
Z dalších vedlejších účinků statinů se mohou vyskytnout zažívací potíže, alergické reakce, poruchy usínání až nespavost. Bylo publikováno i zvýšené riziko periferní neuropatie. Hepatotoxicita se vyskytuje v méně než 1 % při vyšších dávkách statinů, může se projevit únavou, nechutenstvím, úbytkem na váze. Klinicky významné je zvýšení aminotransferáz 2–3krát nad normu (AST, ALT). Symptomy odezní po vysazení statinu. V graviditě (a také u žen ve fertilním věku bez bezpečné antikoncepce) jsou statiny pro možný teratogenní účinek na plod kontraindikovány. Statiny zvyšují účinek perorálních antikoagulancií, u těchto nemocných je proto při nasazení statinů nutné monitorovat INR a upravit dávku warfarinu.
Klinické studie
Základní důkazy pro podávání pravastatinu poskytují výsledky velkých klinických studií již z poloviny 90. let. Primárně preventivní studie WOSCOPS (West Of Scotland COronary Prevention Study) byla provedena již v roce 1995 a zahrnula 6 595 mužů. Průměrná doba sledování byla 4,9 roku. Prokázala snížení kardiovaskulární mortality a výskyt infarktu myokardu o 31 %, celkové mortality o 22 % (obr. 1) [7]. Z této studie byla zpracována další data po desetiletém sledování pacientů. Pět let po ukončení studie bylo 38,7 % z původní pravastatinové a 35,2 % z původní placebové skupiny léčeno statinem. Po desetiletém sledování bylo riziko úmrtí z kardiovaskulární příčiny nebo nefatální infarkt myokardu 10,3 % v původně placebové větvi oproti 8,6 % v původně pravastatinové skupině (p < 0,02). Byla rovněž významně snížena kardiovaskulární a celková mortalita (p < 0,01, p < 0,03). Pětiletá léčba pravastatinem příznivě ovlivnila přežívání a koronární příhody v dalších pěti letech [8].
Image 1. Studie WOSCOPS: West Of Scotland COronary Prevention Study [7]. ![Studie WOSCOPS: West Of Scotland COronary Prevention Study [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bc3bb0b6b05977521c0c35304b9f87e7.jpeg)
Studie CARE sledovala 4 159 pacientů po infarktu myokardu a potvrdila tyto výsledky i v sekundární prevenci. Studie byla publikována v roce 1999 (obr. 2) [9]. Primárním cílem byla kardiovaskulární mortalita nebo nefatální infarkt myokardu. Při léčbě pravastatinem oproti placebu došlo k poklesu o 24 %. Pokles cévních mozkových příhod byl o 31 %.
Image 2. Studie CARE: Cholesterol And Recurrent Events [9]. ![Studie CARE: Cholesterol And Recurrent Events [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ecc4e80c9a071c7109ec3ca3a7cda9aa.jpeg)
Další ze studií v oblasti sekundární prevence byla studie LIPID s 9 014 pacienty s ischemickou chorobou srdeční. Při podávání pravastatinu došlo ke snížení kardiovaskulární mortality o 24 % a celkové mortality o 22 % (obr. 3) [10].
Image 3. Studie LIPID: The Long-term Intervention with Pravastatin in Ischaemic Disease [10]. ![Studie LIPID: The Long-term Intervention with Pravastatin in Ischaemic Disease [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/75b5bf1e7506e0eb3c975dfc94930c1b.jpeg)
Podávání pravastatinu také vedlo ke zpomalení rozvoje aterosklerózy, jak prokázaly studie PLAC I (408 nemocných s ICHS), PLAC II (151 nemocných s ICHS a ultrazvukově prokázaným postižením karotid) a studie REGRESS (885 pacientů s ICHS a normálním nebo mírně zvýšeným cholesterolem) [11–13].
Svým zaměřením velmi zajímavou byla studie PROSPER, která zařadila do sledování 5 804 pacientů ve věku 70–82 let v sekundární prevenci kardiovaskulárního onemocnění nebo s významným kardiovaskulárním rizikem. V rámci studie byl podáván pravastatin v dávce 40 mg nebo placebo. Průměrná doba sledování byla 3,2 let. Primární cíl byl kombinovaný: kardiovaskulární úmrtí, infarkt myokardu a cévní mozková příhoda – fatální či nefatální. Léčbou pravastatinem byl tento cíl snížený o 15 %, došlo rovněž k poklesu kardiovaskulárních úmrtí a nefatálních infarktů myokardu o 19 % a tranzitorních mozkových ischemií o 25 % (obr. 4) [14].
Image 4. Studie PROSPER: PROspective Study of Pravastatin in the Elderly at Risk [14]. ![Studie PROSPER: PROspective Study of Pravastatin in the Elderly at Risk [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6dbb0f519b8e5cc23b741ce479bf517f.jpeg)
Klinické zkušenosti s podáváním statinů u pacientů po transplantaci
O prospěchu statinů u nemocných po srdeční transplantaci (STL) není pochybností a je řada důkazů, že jejich příznivý účinek je dán nejen snížením plazmatické koncentrace celkového a LDL-cholesterolu, ale také zpomalením rozvoje progrese koronární vaskulopatie a snížením hemodynamicky závažných rejekcí [15–17]. Při rozsáhlé analýze z amerického registru srdečních transplantací (Heart Transplant Lipid Registry), kde bylo zavzato 1 186 nemocných z 12 center, se ukázalo, že pacienti léčení statiny mají nižší mortalitu a nižší výskyt rejekcí, a tento výsledek byl nezávislý na hladině lipidů [18].
Co však zůstává stále problémem, je výskyt nežádoucích účinků, hlavně poškození svalů, od myalgie přes myozitidu až po rhabdomyolýzu. Rizikoví nemocní jsou: ženy s nízkou hmotností, polymorbiditou (zvláště renální selhání na podkladě diabetes mellitus), v pooperačním období a hlavně při současném podávání řady léků (interakce na CYP450 3A4) – fibráty, cyklosporin, tacrolimus, azolová antimykotika (ketokonazol, itrakonazol), makrolidová ATB, amiodaron, verapamil, diltiazem, nefazodon-thymoleptikum a v neposlední řadě pravidelné pití grapefruitové šťávy či abúzus alkoholu, který přispívá k rozvoji myopatie [19,20].
Je známo, že cyklosporin i tacrolimus se metabolizují cestou CYP450 3A4 stejně jako atorvastatin, lovastatin, simvastatin a na základě lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s následným nebezpečím myopatií. Naproti tomu pravastatin, jenž se přes systém CYP450 nemetabolizuje, fluvastatin či rosuvastatin, které se metabolizují cestou CYP450 2C9, event. 2C6, se jeví farmakologicky vhodné u nemocných po STL, protože nebezpečí lékových interakcí na CYP450 3A4 je minimální [21].
Ve srovnávací studii Keogha et al, kdy byl po dobu jednoho roku srovnáván pravastatin v dávce 20–40 mg denně a simvastatin v dávce 10–20 mg denně, však již byl rozdíl ve výskytu myopatií významný. Po simvastatinu mělo 13,3 % výskyt myozitidy a jeden nemocný měl klinicky významnou rhabdomyolýzu. Po pravastatinu nebyl žádný výskyt myopatie, ale u dvou nemocných byl pravastatin pro bolesti hlavy zaměněn za simvastatin! Podávání pravastatinu bylo také spojené s lepším přežíváním pacientů (obr. 5) [22]. Vyšší výskyt rhabdomyolýzy u simvastatinu byl zřejmě způsobený jeho vyšší dávkou. Obdobné závěry podává Kobashigawa et al jak po ročním, tak po desetiletém sledování léčby pravastatinem po STL, kdy pokles mortality či snížení koronární vaskulopatie nebyl provázen výskytem myopatie (obr. 6) [23,24].
Image 5. Pravastatin vs simvastatin u srdečních transplantací: přežívání [22]. ![Pravastatin vs simvastatin u srdečních transplantací: přežívání [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/29de8dbe8c8c1067f21a493cd8b722f9.jpeg)
Image 6. Vliv léčby pravastatinem u nemocných po srdeční transplantaci: rejekce* a vaskulopatie [23]. ![Vliv léčby pravastatinem u nemocných po srdeční transplantaci: rejekce* a vaskulopatie [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/76159cc5df6359c2a2a895eb5c418696.jpeg)
Zajímavé je, že při provedení meta-analýzy s léčbou simvastatinem nebo pravastatinem u pacientů po transplantaci srdce byla průměrná hladina LDL-cholesterolu mezi 100–130 mg/dl (2,58–3,36 mmol/l). Při tom bylo dosaženo významného snížení mortality a vaskulopatie [25].
Závěr: U kterých pacientů s hyperlipoproteinemií hledat místo pro pravastatin?
- U pacientů s průměrnými nebo mírně zvýšenými hladinami cholesterolu pro ověřené snížení morbidity a mortality.
- U pacientů léčených několika léky současně. Pravastatin má nízké riziko lékových interakcí.
- U pacientů vyššího věku, kde pravastatin má ověřené snížení mortality.
- U pacientů po transplantacích, kde pravastatin nemá interakce s imunosupresivy.
Podpořeno VZ MSM 002 1622 402.
prof. MUDr. Lenka Špinarová, Ph.D.
prof. MUDr. Jiří Vítovec, CSc., FESC
I. interní kardioangiologická klinika LF MU
a FN u sv. Anny v Brně
lenka.spinarova@fnusa.cz
Sources
1. Katznelson S, Wang XM, Chia D et al. The inhibitory effects of pravastatin on natural killer cell activity in vivo and on cytotoxic T-lymphocyte activity in vitro. J Heart Lung Transpl 1998; 17 : 335–340.
2. Widimský J. Léčba dyslipidémií. Praha: Triton 2002.
3. Vítovec J, Špinar J a kol. Farmakoterapie kardiovaskulárních onemocnění. 2. vyd. Praha: Grada 2004.
4. Češka R, Slíva J. Pravastatin a jeho místo v terapii dyslipidemií v roce 2010. Farmakoterapie 2009; 6 : 603–607.
5. Bellosta S, Paolleti R, Corsiny A. Safety of Statins. Focus on Clinical Pharmakokinetics and Drug Interactions. Circulation 2004; 109: III50–III57.
6. Thompson PD, Clarkson P, Karas RH et al. Statin-associated myopathy. JAMA 2003; 289 : 1681–1690.
7. Shepherd J, Cobbe SM, Ford I et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995; 333 : 1301–1307.
8. Ford I, Murray H, Packard CJ et al. Long-term follow-up of the West Scotland Coronary Prevention Study. N Engl J Med 2007; 357 : 1477–1486.
9. Pffeffer MA, Sacks FM, Moyé LA et al. Influence of baseline lipids on effectiveness of pravastatin in the CARE trial. Cholesterol And Recurrent Events. J Am Coll Cardiol 1999; 33 : 125–130.
10. The Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group: Prevention of cardiovascular events and death with pravastatin in patiens with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339 : 1349–1357.
11. Pitt B, Mancini GB, Ellis SG et al. Pravastatin limitation of atherosclerosis in the coronary arteries (PLAC I): Reduction in atherosclerosis and clinical events. PLAC I investigation. J Am Coll Cardiol 1995; 26 : 1133–1139.
12. Crouse JR 3rd, Byington RP, Bond MG et al. Pravastatin, lipids and atherosclerosis in the carotid arteries (PLAC II). Am J Cardiol 1995; 75 : 455–459.
13. Jukema JW, Bruschke AVG, van Boven AJ et al. Effects of lipid lowering by pravastatin on progression and regression of coronary artery disease in symptomatic men with normal to moderately elevated serum cholesterol levels. The Regression Growth Evaluation Statin Study (REGRESS). Circulation 1995; 91 : 2528–2540.
14. Shepherd J, Blauw GJ, Murphy MB et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. PROSPER study group. PROspective Study of Pravastatin in the Elderly at Risk. Lancet 2002; 360 : 1623–1630.
15. Špinarová L, Toman J. Pharmacotherapy after heart transplatation. Cor Vasa 2000; 42 : 335–340.
16. Shimizu K, Aikawa M, Takayama K et al. Direct Anti-Inflamatory Mechanisms Contribute to Attenuation of Experimental Allograft Arteriosclerosis by Statins. Circulation 2003; 108 : 2113–2120.
17. Vítovec J, Špinarová J. Jaký statin po srdeční transplantaci? Farmakologický předpoklad a klinická praxe. Cor Vasa 2004; 46 : 463–464.
18. Wu AH, Ballantyne CM, Short BC et al. Statin use and risks of death or fatal rejection in the Heart Transplant Lipid Registry. Amer J Cardiol 2005; 93 : 367–372.
19. Pasternak RC, Smith SC jr, Bairey-Merz CN et al. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Circulation 2002; 106 : 1024–1028.
20. Widimský J. Poškození svalů při léčbě inhibitory HMG CoA reduktázy statiny. Cor Vasa 2003; 45 : 376–386.
21. Špinarová L,Toman J. Fluvastatin u pacientů po transplantaci srdce. Vnitř Lék 1998; 44 : 13–16.
22. Keogh A, Macdonald P, Kaan A et al. Efficacy and Safety of Pravastatin vs Simvastatin After Cardiac Transplantation J Heart Lung Transplant 2000; 19 : 529–537.
23. Kobashigawa JA, Katznelson S, Laks H et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med 1995; 333 : 621–627.
24. Kobashigawa JA, Moriguchi JD, Cogert G et al. 10-year results of the pravastatin randomized trial in heart transplant recipients. ISHLT April 21–24, 2004 San Francisco, USA. Abstr. 218.
25. Bilchick KC, Henrikson CA, Skojec D et al. Treatment of hyperlipidemia in cardiac transplant recipients. Am Heart J 2004; 148 : 200–210.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue 3-
All articles in this issue
- Akutní infarkt myokardu u pacientů se srdečním selháním
- Výskyt srdečního selhání po infarktu myokardu v klinických studiích
- Studie SHIFT (The Systolic Heart Failure Treatment with the If Inhibitor Ivabradine Trial) a její význam pro léčbu srdečního selhání
- Kontrola krevního tlaku u diabetiků s ischemickou chorobou srdeční
- Rizikové faktory fibrilace síní
- Co musí vědět intervenční kardiolog o krevních destičkách
- Současné postavení pravastatinu v hypolipidemické léčbě
- Farmakoekonomika pro lékaře v klinické praxi
- Současné metody stanovení glomerulární filtrace a jejich klinický význam
- Je ischemická choroba srdca u žien iná ako u mužov?
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné metody stanovení glomerulární filtrace a jejich klinický význam
- Farmakoekonomika pro lékaře v klinické praxi
- Rizikové faktory fibrilace síní
- Je ischemická choroba srdca u žien iná ako u mužov?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

