-
Medical journals
- Career
Katetrizační uzávěr PFO a p aradoxní systémová embolizace
: P. Kala; M. Poloczek; T. Brychta; S. Nehyba; V. Chaloupka
: Interní kardiologická klinika FN Brno
: Kardiol Rev Int Med 2010, 12(2): 84-87
Otevřené foramen ovale (PFO) je častým nálezem v dospělosti. Jako cesta pro paradoxní systémovou embolizaci se různým způsobem podílí na patofyziologii některých onemocnění. Katetrizační uzávěr, který je bezpečný a efektivní, se po vyloučení jiných známých příčin indikuje nejčastěji u cévní mozkové příhody, provádí se ale i jako sekundární prevence dekompresní nemoci, systémových embolizací do jiných orgánů a v dalších indikacích. Diagnóza kryptogenní cévní mozkové příhody (CMP) či tranzitorní ischemické ataky (TIA) by tak měla být stanovena teprve po vyloučení klasických rizik včetně paradoxní embolizace při PFO, defektu septa síní či plicních zkratů. Výsledky multicentrických randomizovaných projektů porovnávajících farmakologickou léčbu a katetrizační uzávěr PFO u pacientů s CMP/TIA se očekávají v roce 2011.
Klíčová slova:
otevřené foramen ovale – katetrizační uzávěr – cévní mozková příhoda – paradoxní embolizaceÚvod
Otevřené nebo také perzistující foramen ovale (PFO) je anatomickou odchylkou mezisíňového septa, při které nedochází ke kompletnímu srůstu septum primum a septum secundum do dvou let po narození dítěte. Reziduální komunikace mezi pravou a levou srdeční síní se tak za určitých okolností může projevovat, přestože klinickou pozornost si tato odchylka postupně získává až během posledních 15–20 let. „Zásluhu“ na tom má především obecně narůstající počet pacientů s ischemickou cévní mozkovou příhodou (CMP), která je nejčastější příčinou invalidizace pacientů a třetí nejčastější příčinou úmrtí. Ve 30–40 % případů CMP vznikající na podkladě ischemie není příčina dostatečně ozřejmena [1–2]. Ještě vyšší je tento počet u pacientů mladších, ve věku pod 55 let, kde je diagnóza kryptogenní CMP stanovena u téměř 2/3 případů [3]. Je samozřejmé, že podmínkou stanovení této diagnózy je vyloučení jiných známých příčin, kterými jsou postižení velkých i malých mozkových tepen, aorty a emboly v oblasti levostranných srdečních oddílů.
Poprvé bylo poukázáno na možnou souvislost kryptogenní CMP a PFO již v roce 1877 [4], první podrobnější rozbor byl však publikován až v roce 1988 [5]. Patofyziologicky představuje PFO cestu pro paradoxní mozkovou embolizaci především trombů vznikajících v žilním systému nebo výjimečně přímo v PFO kanále. Je smutnou pravdou, že ani v současnosti, v době technologicky velmi vyspělé, nejsme schopni určit četnost výskytu drobných žilních trombóz probíhajících subklinicky a tedy ani určit výši jejich rizika.
Vyjdeme-li z autoptických studií, můžeme u dospělé populace počítat s prevalencí PFO v 15–25 % případů [6–7], z echokardiografických studií provedených u pacientů s anamnézou cévní mozkové příhody pak vyplývá četnost 7–24 % v případě transtorakálního [5,8] a 20–40 % v případě transezofageálního zobrazení [9–10]. Zdůvodnění poklesu prevalence PFO ve vyšším věku je pouze hypotetické, a to předčasným úmrtím postižených nebo spontánním uzávěrem, které se však považuje za méně pravděpodobné.
Při rozboru pravo-levých zkratů bylo zjištěno, že PFO je jejich příčinou přibližně v 95 %, ve 4 % se jedná o plicní arteriovenózní píštěle a 1 % tvoří defekty mezisíňové přepážky [11]. Z morfologického hlediska se za vyšší riziko paradoxní embolizace považuje přítomnost aneuryzmatu mezisíňového septa a/nebo Eustachovy chlopně. Tyto stavy umožňují nasměrování trombu z pravé do levé síně primárně nebo po jeho přechodném uchycení v aneuryzmaticky změněné oblasti mezisíňového septa, které je většinou definováno jeho centrálními exkurzemi v rozsahu minimálně 10 mm.
Samostatnou kapitolou je zhodnocení vlivu PFO na vyloučení plicní cirkulace a paradoxní průnik vzduchové embolie u hlubinných potápěčů, vazoaktivních působků u migrén především provázených aurou a dalšími onemocněními, která jsou uvedena v tab. 1.
1. Onemocnění a rizika spojená s paradoxní embolizací u PFO. 
Diagnostika PFO
Je nutné si uvědomit, jak velkou roli hraje technika při potvrzení či vyloučení PFO. Základním vyšetřením je kontrastní transtorakální echokardiografie (TTE), vyšetření s vyšší senzitivitou, ale nižší specificitou je tzv. bubble-test pomocí transkraniálního Doppleru provedeného při Valsalvově manévru po podání echokontrastní látky, zlatým standardem je však kontrastní jícnová echokardiografie (TEE) (podotkněme však, že podobně jako při všech instrumentálních metodách pouze ve zkušených rukou). Bubble - test, který je rutinní součástí ultrazvukových vyšetření zaměřených na diagnostiku PFO, je založen na následujících pozorováních: mikrobubliny o velikosti nad 8 μm jsou degradovány v plicním řečišti a během 0,19 s se rozpustí, přičemž čas průtoku krve plicním řečištěm je cca 1,6 s, tzn., že za normálních okolností se v levostranných srdečních oddílech žádné mikrobubliny nezobrazí [12]. Pro důkaz PFO nebo obecněji nitrosrdečního zkratu svědčí průnik mikrobublin doleva během prvních tří srdečních cyklů, bubliny, které se objeví později, pocházejí z plicních zkratů. Zvýšení senzitivity testu je dosaženo současným provedením Valsalvova manévru a ze zkušenosti autorů vyplývá, že ještě citlivějším je zakašlání pacienta.
Standardní vyšetřovací postup u pacientů s CMP/TIA by měl zahrnovat množství kroků, které jsou vzájemně provázány a měly by vést k potvrzení či vyloučení jednotlivých známých příčin či rizik: 1. zobrazovací metody: vyšetření mozkové tkáně pomocí počítačové tomografie (CT) nebo magnetické rezonance (MRI), cévní vyšetření pomocí duplexní sonografie magistrálních mozkových tepen s dopplerovskými toky, event. provedení mozkové angiografie, 2. kardiologické vyšetření: zhodnocení elektrické srdeční aktivity pomocí elektrokardiografické křivky (EKG) a Holterova monitorování, základní echokardiografické transtorakální vyšetření zaměřené na srdeční dutiny doplněné v případě potřeby o vyšetření kontrastní + transezofageální, 3. laboratorní: stanovení hladin iontů, krevní obraz, lipidogram, hladina glykemie nalačno, sérologické vyšetření na syfilis a přítomnost trombofilních stavů (obr. 1).
1. Vyšetřovací screening pacientů s dg. „kryptogenní“ CMP/TIA (jistě pod 55 let, individuálně i u starších pacientů). 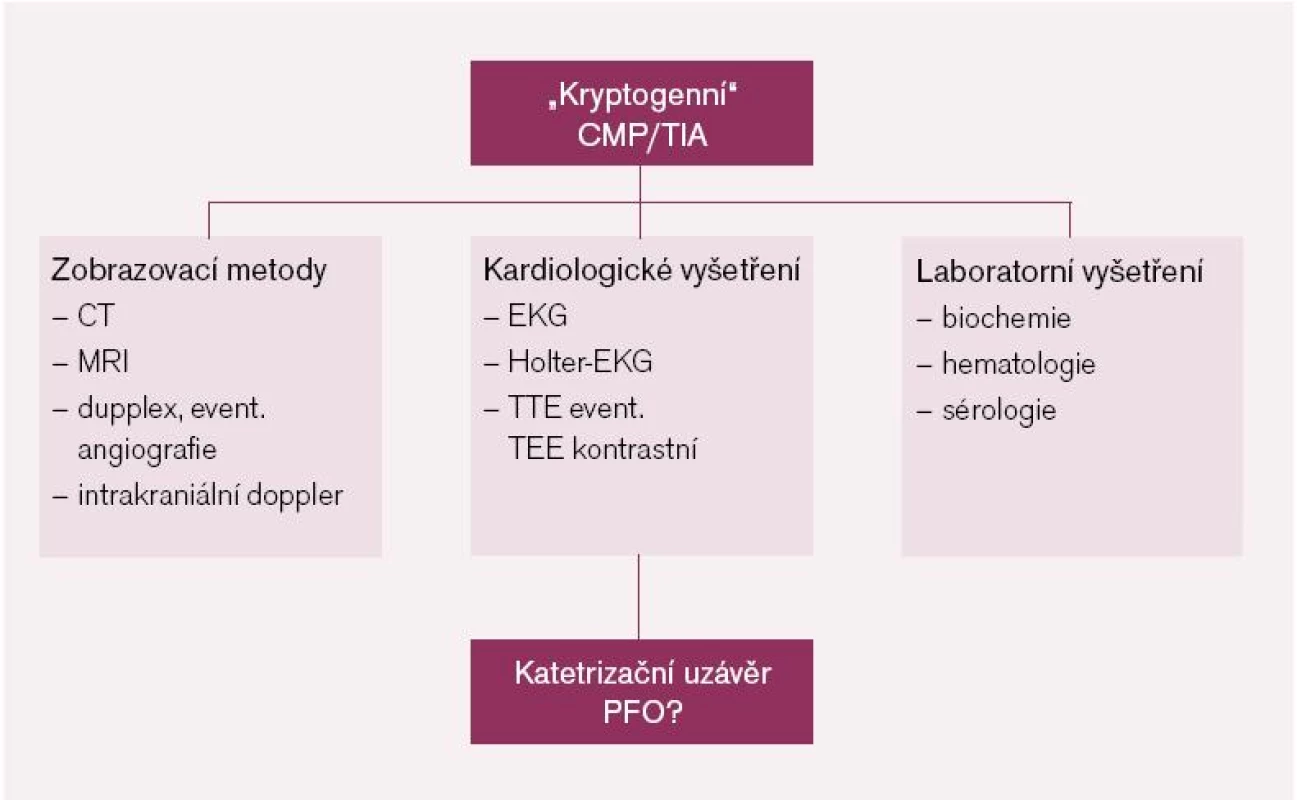
Katetrizační uzávěr PFO
Technika katetrizačního uzávěru je v současnosti velmi dobře propracována, neboť vychází z více než 30letých zkušeností s katetrizačními zákroky na mezisíňovém septu. Poprvé byl nechirurgický postup použit k léčbě a uzávěru defektu mezisíňového septa v roce 1975 [13], první soubor pacientů s katetrizačním uzávěrem PFO byl publikován v roce 1992 [14].
Vlastní zákrok se provádí pouze v lokální anestezii, analgosedaci, event. v některých zemích i v celkové anestezii v závislosti na tom, jakým způsobem je průběh výkonu kontrolován (pomocí TTE, TEE, intrakardiální echokardiografie nebo pouze RTG – tomu odpovídá i délka výkonu, která se pohybuje od 15 do 60 min). Prvním krokem je samozřejmě punkce stehenní žíly a prográdní průnik katetrem nebo pouze vodičem postupně přes dolní dutou žílu, pravou síň, PFO kanál až do levé síně a plicní žíly (obr. 2 a 3). Po výměně diagnostického instrumentária za speciální zaváděcí katetr pro vlastní okludér umístěný v levé síni nebo plicní žíle se zavede okludér, který je vyroben ve všech případech z kombinace kovu (slitiny niklu a titanu, tedy materiálu s unikátní tvarovou pamětí) a tkaniny vlastnostmi podobné Goretexu. Poté se uvolní nejdříve levosíňová část okludéru a posléze, po stažení na mezisíňové septum, část pravosíňová (obr. 4 a 5). Po pečlivé kontrole správného uložení je okludér uvolněn a stává se trvalou součástí mezisíňového septa (obr. 5 a 6). Je samozřejmé, že technika implantace různých typů okludérů i trvání vlastního výkonu se navzájem odlišují, princip však zůstává stejný.
2. Intrakardiální echokardiografie – změření PFO kanálu mezi septum primum a secundum při zavedeném vodiči do levé síně. 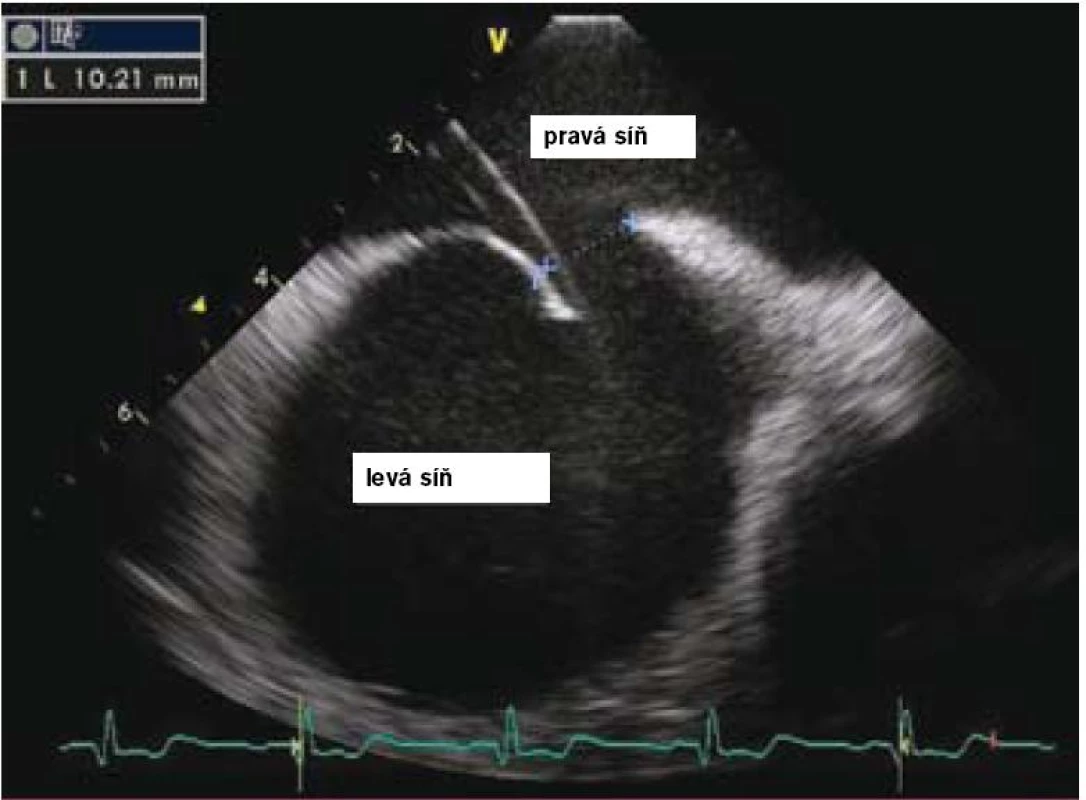
3. Intrakardiální echokardiografie – dopplerovské znázornění PFO kanálu. 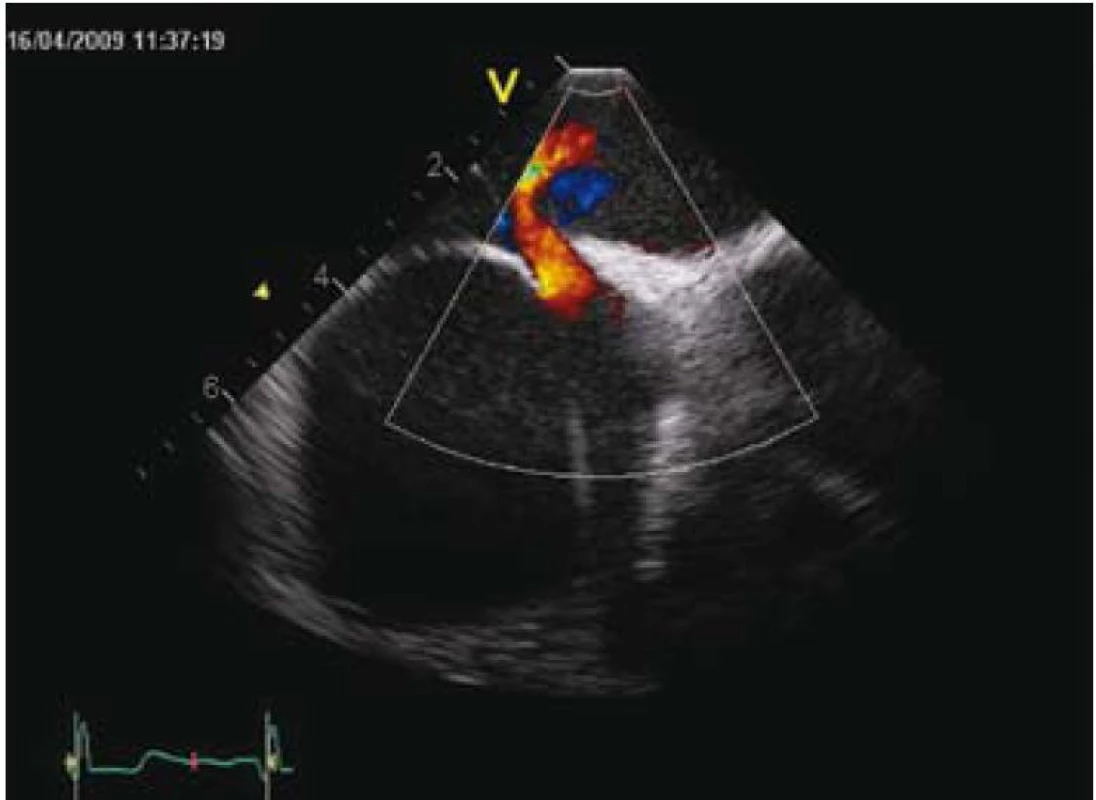
4. Intrakardiální echokardiografie – otevřený levosíňový disk Amplatzerova PFO okludéru 25 mm. 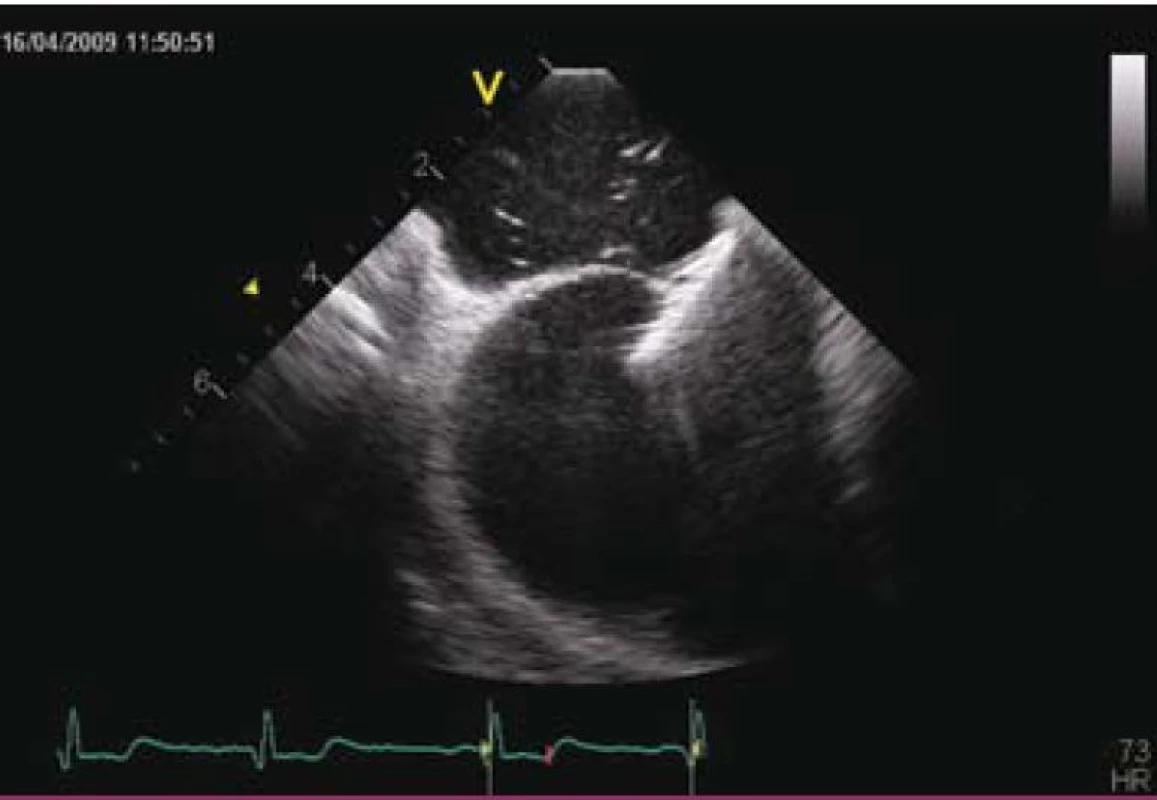
5. Intrakardiální echokardiografie – výsledek po uvolnění Amplatzerova PFO okludéru 25 mm. 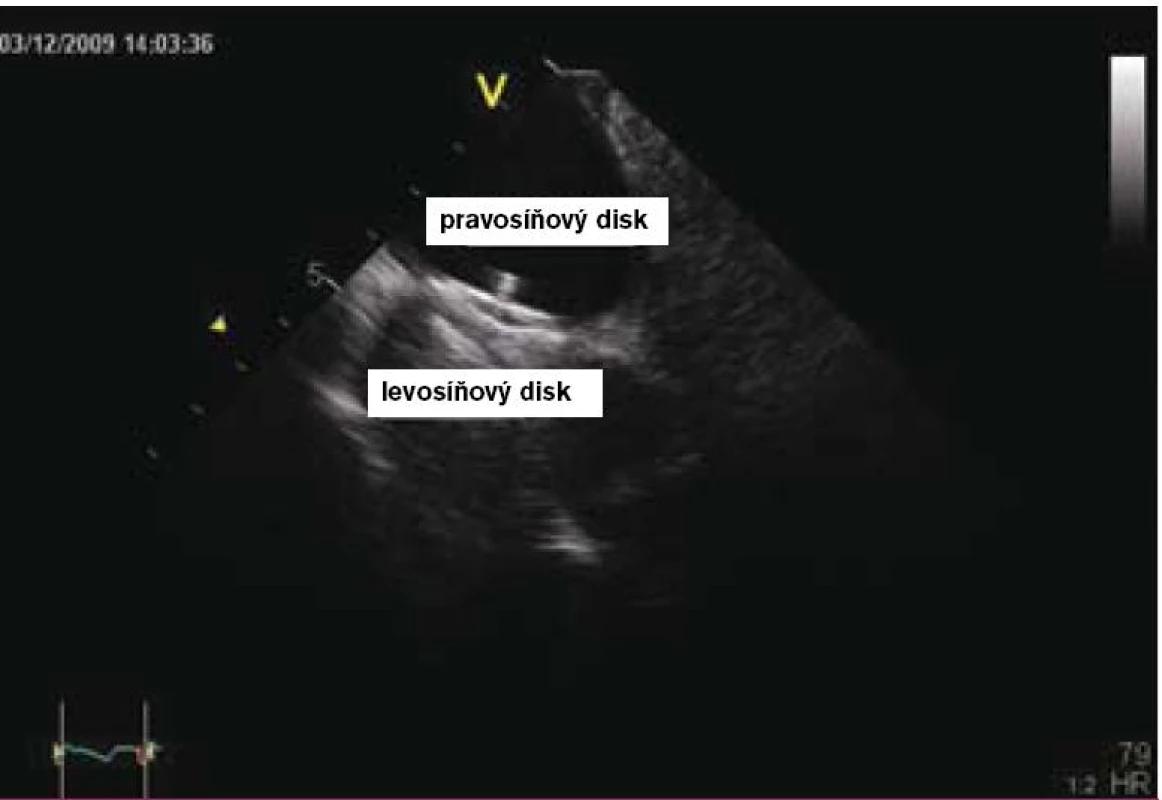
6. Angiografie – výsledný angiografický obraz uvolněného Amplatzerova PFO okludéru 25 mm. 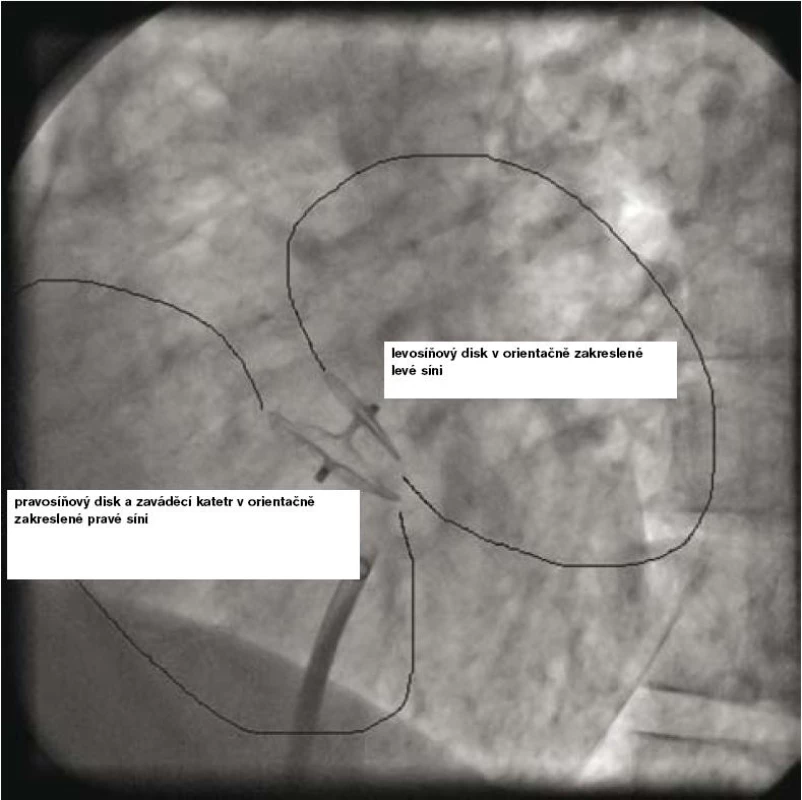
Z hlediska farmakoterapie přímo se vztahující ke katetrizačnímu uzávěru PFO je doporučeno, aby byl výkon proveden v plně antikoagulovaném stavu u pacienta připraveného kombinovanou antiagregační terapií, která by měla pokračovat minimálně po dobu tří měsíců v případě clopidogrelu a po dobu šesti měsíců v případě kyseliny acetylsalicilové. V současnosti se k provádění těchto zákroků využívá materiál od různých firem, a to s různou úspěšností a riziky [15]. Ve zkušeném katetrizačním centru se úspěšnost těchto zákroků blíží 100 % [16]. Relativně nejčastější komplikací výkonu jsou problémy lokální v místě punkce, výčet možných komplikací je však širší a zahrnuje riziko srdeční perforace, vzduchové embolie, indukce fibrilace síní či supraventrikulárních arytmií, nespecifickou alergickou reakci na nikl a trombózu okludéru, která je na TEE s odstupem čtyř týdnů ozřejmena v 0 až 7 % v závislosti na typu okludéru. Z tohoto pohledu se dosud nejbezpečnějším jeví Amplatzerův okludér (AGA Medical, Plymouth, Minnesota, USA).
Zatím pouze ve fázi aplikovaného výzkumu se pohybují další techniky zaměřené na vlastní PFO kanál, ať už aplikací radiofrekvenční energie, přímou suturou či zavedením speciálního implantátu. Již z výčtu těchto technik je jasné, že PFO je v oblasti kardiovaskulární medicíny věnována mimořádná pozornost.
Sekundární prevence CMP/TIA
V současnosti je indikace katetrizačního uzávěru založena na příznivých výsledcích nerandomizovaných studií a pozorování [17]. V roce 2011 se očekávají první publikace randomizovaných studií PC trial (Amplatzerův PFO okludér) a Closure-I (StarFlex okludér), po kterých by měly následovat další v letech 2013–2016 (RESPECT s implantací Amplatzerova PFO okludéru, CLOSE bez omezení typu okludéru a REDUCE s Helex okludérem). Teprve na základě výsledků těchto studií se bude rozhodovat, kterým směrem se tato problematika bude dále ubírat. Paralelně k vývoji v intervenční kardiologii probíhá intenzivní zkoumání na poli chronické farmakoterapie. V případě kryptogenní CMP jsou v současnosti doporučení nejasná – od antiagregační monoterapie po trvalou antikoagulační terapii antagonisty vitaminu K.
Za jistou indikaci uzávěru PFO se v současnosti považuje opakovaná CMP/TIA při optimálně vedené farmakoterapii (která je ovšem velmi nejasně definovaná), v ostatních případech je volba optimální léčebné strategie otázkou konsenzu a je také dána možnostmi a erudicí jednotlivých pracovišť.
Závěr
Katetrizační uzávěr otevřeného foramen ovale je bezpečnou a efektivní metodou v sekundární prevenci paradoxní systémové embolizace, která může být provázena mnohočetnými klinickými projevy.
Diagnóza kryptogenní CMP/TIA by měla být stanovena teprve po vyloučení klasických rizik včetně paradoxní embolizace při PFO, defektu septa síní či plicních zkratů.
Výsledky multicentrických randomizovaných projektů se očekávají v roce 2011.
MUDr. Petr Kala, Ph.D., FESC, FSCAI
MUDr. Martin Poloczek
MUDr. Tomáš Brychta
MUDr. Svatopluk Nehyba
doc. MUDr. Václav Chaloupka, CSc.
Interní kardiologická klinika FN Brno
pkala@fnbrno.cz
Sources
1. Sacco RL, Ellenbereg JH, Mohr JP et al. Infarcts of undetermined cause: the NINCDS Stroke Data Bank. Ann Neurol 1989; 25 : 382–390.
2. Mohr JP, Thompson JL, Lazar RM et al. Warfarin – Aspirin Recurrent Stroke Study Group. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med 2001; 345 : 1444–1451.
3. Mohr JP. Cryptogenic stroke. N Engl J Med 1988; 318 : 1197–1198.
4. Cohnheim J. Thrombose und embolie. Vorlesung über allgemeine Pathologie. Berlin: Hirschwald 1877; 1 : 134.
5. Lechat P, Mas JL, Lascault G et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988; 318 : 1148–1152.
6. Parsons FG, Keith A. Seventh report of the Committee of Collective Investigation of the Anatomical Society of Great Britain and Ireland, 1896–97. J Anat Physiol 1897; 32 : 164–186.
7. Hagen PT, Scholz DG, Edwards WD. Incidence and size of patent foramen ovale during the first 10 decades of life: an autopsy study of 965 normal hearts. Mayo Clin Proc 1984; 59 : 17–20.
8. Webster MW, Chancellor AM, Smith HJ et al. Patent foramen ovale in young stroke patients. Lancet 1988; 2 : 11–12.
9. Hausmann D, Mügge A, Becht I et al. Diagnosis of patent foramen ovale by transesophageal echocardiography and association with cerebral and peripheral embolic events. Am J Cardiol 1992; 70 : 668–672.
10. Van Camp G, Schulze D, Cosyns B et al. Relation between patent foramen ovale and unexplained stroke. Am J Cardiol 1993; 71 : 596–598.
11. Meier B. Catheter–Based Closure of the Patent Foramen Ovale. Circulation 2009; 120 : 1837–1841.
12. Mareedu RK, Shah MS, Mesa JE et al. Percutaneous Closure of Patent Foramen Ovale: A Case Series and Literature Review. Clinic Med Res 2007; 5 : 218–226.
13. King TD, Thompson SL, Steiner C et al. Secundum atrial septal defect. Nonoperative closure during cardiac catheterization. JAMA 1976; 235 : 2506–2509.
14. Bridges ND, Hellenbrand W, Latson L et al. Transcatheter closure of patent foramen ovale after presumed paradoxical embolism. Circulation 1992; 86 : 1902–1908.
15. Wahl A, Meier B. Patent foramen ovale and ventricular septal defect closure. Heart 2009; 95 : 75–82.
16. Poloczek M, Kala P, Brychta T et al. Katetrizační uzávěry na mezisíňovém septu – roční follow-up. XVII. výroční sjezd České kardiologické společnosti 2009.
17. Wahl A, Tai T, Praz F et al. Late results after percutaneous closure of patent foramen ovale for secondary prevention of paradoxical embolism using the amplatzer PFO occluder without intraprocedural echocardiography: effect of device size. JACC Cardiovasc Interv 2009; 2 : 116–123.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue 2-
All articles in this issue
- Hypertension treatment in patients with metabolic syndrome
- Primary hyperaldosteronism: the most common form of secondary hypertension
- Do we have sufficient evidence for cardiac resynchronization therapy indication in patients with cardiac failure and NYHA functional classification I-II?
- Catheter closure of PFO and paradoxical systemic embolisation
- Transcranial colour-coded duplex sonography to evaluate intracranial arteries in patients with cerebrovascular stenooclusive disease – review
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Catheter closure of PFO and paradoxical systemic embolisation
- Transcranial colour-coded duplex sonography to evaluate intracranial arteries in patients with cerebrovascular stenooclusive disease – review
- Primary hyperaldosteronism: the most common form of secondary hypertension
- Hypertension treatment in patients with metabolic syndrome
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

