-
Medical journals
- Career
Chirurgická léčba fibrilace síní
Authors: P. Němec
Authors‘ workplace: Centrum kardiovaskulární a transplantační chirurgie, Brno
Published in: Kardiol Rev Int Med 2009, 11(1): 8-10
Overview
Léčebné ovlivnění fibrilace síní (FS) jako nejčastější srdeční arytmie se dostává do popředí zájmu nejen kardiologů, ale i kardiochirurgů. Důvodem je frekvence výskytu zejména u dvou skupin nemocných, jejichž četnost narůstá. Jsou to pacienti ve vyšším věku a pacienti s dysfunkcí levé komory. Chirurgická léčba FS má za sebou již více než 20letou historii. Jejím výsledkem jsou „maze“ operace, které představují systém lineárních transmurálních lézí na srdečních síních, jejichž cílem je eliminace spouštěcí ektopické aktivity a přerušení reentry okruhů, potřebných pro vnik a udržení FS. Léze lze vytvořit chirurgicky (procesem incize a sutura) nebo pomocí alternativních zdrojů energie. Výsledky chirurgické léčby FS měřené trváním sinusového rytmu jsou úspěšné v průměru asi u 75–80 % pacientů s poměrně velkou variabilitou, která je dána zejména charakterem FS (paroxysmální, perzistující nebo permanentní), délkou trvání permanentní FS, velikostí levé síně, základním srdečním onemocněním a rozsahem výkonu (od ablace plicních žil po komplex lézí na obou srdečních síních).
Klíčová slova:
fibrilace síní – chirurgická léčba – maze operaceÚvod
Fibrilace síní (FS) je nejčastější formou srdeční arytmie. Její význam se v poslední době dostává do popředí vzhledem k postupnému stárnutí populace a častějšímu výskytu srdečního selhání. Frekvence výskytu FS je nejvyšší právě u těchto dvou skupin. Ve věkové kategorii nad 75 let se vyskytuje v 11% a u pacientů, kteří mají systolickou dysfunkci levé komory (LK), se její výskyt odhaduje až na 50%. K její významnosti přispívá i závažnost jejích možných komplikací, na prvním místě tromboembolických příhod. Léčbě FS je v posledních letech věnována velká pozornost. Vedle původní farmakologické léčby, která si svůj zásadní význam stále udržuje, ale jež má poměrně časté vedlejší negativní účinky, se hledaly nové cesty. V průběhu 80. a 90. let minulého století se tak vedle sebe vyvíjela léčba katetrizační a chirurgická.
Historie chirurgické léčby
První koncepty chirurgické léčby vycházely ze snahy zamezit převodu rychlého síňového rytmu na komory, tedy zabránit vzniku tachyarytmií. Tyto operace vycházely ze zkušeností s chirurgickými operacemi, při kterých se přerušovaly přídatné síňokomorové dráhy, nejčastěji při Wolffovu-Parkinsonovu-Whiteovu (WPW) syndromu. Výsledkem byly tedy operace, při nichž byla izolována nejprve jedna, později obě síně. Guiraudon [1] popsal v polovině 80. let operaci, při které byly izolovány obě síně a vytvořen „koridor“ mezi sinusovým uzlem přes síňové septum k atrioventrikulárnímu (AV) uzlu. Tím byl zabezpečen přímý přechod vzruchu a zajištěn pravidelný rytmus komor. Fibrilace síní však perzistovala, z hemodynamického hlediska tedy chyběl síňový příspěvek a navíc trvalo riziko tromboembolických příhod. Výsledky těchto výkonů nebyly tedy ideální [2–3].
Téměř ve stejné době se na základě elektrofyziologických znalostí začal tvořit odlišný koncept chirurgické léčby FS. Vycházel z experimentální zkušenosti, při které se podařilo FS vyléčit. Vznikla tak koncepce, při níž se vytvořením množství incizí eliminovala spouštěcí ektopická aktivita a přerušily se reentry okruhy, které jsou potřebné pro vznik a udržení FS. Systém incizí připomínal bludiště, kterým si impulz „hledal cestu“, a proto se tento výkon začal označovat termínem „maze“. Při této operaci zůstaly zachovány síňové kontrakce, byla tedy výhodnější jak z hemodynamického hlediska, tak i z pohledu prevence tromboembolických komplikací [4]. Tato první operace (maze I) byla však chirurgicky značně komplikovaná a přinášela problémy se zpožděním přenosu vzruchu přes síňový myokard. Přes velmi dobré výsledky autora operací se tyto operace pro svoji komplikovanost příliš nerozšířily. Proto Cox vypracoval další, již chirurgicky zjednodušené varianty (maze II a maze III). Poté, co na základě elektrofyziologických studií Haissaguerre [5] prokázal, že většina zdrojů ektopických impulzů je lokalizována do oblasti ústí plicních žil (PŽ) do levé síně (LS), se vyvinul názor, že bude stačit pouze ta část operace maze III, která je omezená na LS nebo jen na izolaci PŽ. Tím došlo k širokému rozvoji této metody.
S rozvojem nových technologií se ukázalo, že není třeba dělat výkon čistě chirurgicky (incizi stěny síně s následnou suturou), ale že je k přerušení myokardiálních vláken možné používat alternativní energetické zdroje jako radiofrekvenční energii, aplikaci mrazu (kryo sondou), mikrovlny, laser nebo v poslední době i fokusovaný ultrazvuk. Damiano a kol. [6] z pracoviště, které dlouhodobě určuje trendy v této oblasti, popsal právě s použitím bipolárních kleští využívajících radiofrekvenční energii další modifikaci této operace (maze IV).
Současný stav
Zdroje energie
Z histologických studií je známo, že pro dlouhodobou úspěšnost léčby je základní podmínkou vytvoření kontinuální a transmurální léze stěny srdeční síně [7]. Pokud není transmuralita zajištěna, je reálné riziko šíření vzruchu zbytkem svaloviny i přes místo léze. Na druhou stranu musí být energetický zdroj dostatečně bezpečný, aby nedošlo k poraněním okolních struktur, která byla při použití monopolární radiofrekvenční sondy popsána. Z energetických zdrojů, které jsou dnes používány, doznaly největšího rozšíření vzhledem k bezpečné transmurální lézi tři typy:
- Radiofrekvenční proud aplikovaný bipolární sondou, která má senzor pro transmuralitu léze. Méně bezpečná je transmuralita léze monopolární sondou, která se však dá použít pro výkony prováděné torakoskopicky.
- Nízká teplota aplikovaná pomocí kryo sondy se zmrazením přilehlého myokardu až na –140 °C.
- Fokusovaný ultrazvuk je nejnovější technologie vhodná zejména pro torakoskopické použití.
Výhodou kryoenergie ve srovnání s tepelnými zdroji je schopnost minimální indukce tvorby trombu a stenózy okolních cévních struktur. Nevýhodou je větší délka výkonu. Bipolární radiofrekvenční energie má přednost v rychlosti vzniku léze a kontrole transmurality. Nevýhodou je technická obtížnost vytvoření kompletních lézí na obou síních.
Typ výkonu
Vzhledem k tomu, že výkon pro FS byl a doposud většinou je doplňujícím výkonem při operaci, která je indikována pro jiné závažné srdeční onemocnění, ať už ICHS nebo chlopenní vadu, byla snaha o co největší zjednodušení a časovou úsporu. Proto se postupně dospělo až k úrovni pouhé izolace PŽ (obr. 1), tedy k výkonu obdobnému jako při intervenční léčbě FS. Při sledování pacientů se však ukázalo, že tento výkon je opodstatněn jen u paroxysmální FS s malou levou síní (do 5cm), kdy jsou jeho výsledky velmi dobré. Se zlepšením technického vybavení se izolace PŽ začala provádět i jako samostatný kardiochirurgický výkon videoasistovaným torakoskopickým přístupem [8].
Image 1. Schéma izolace plicních žil. 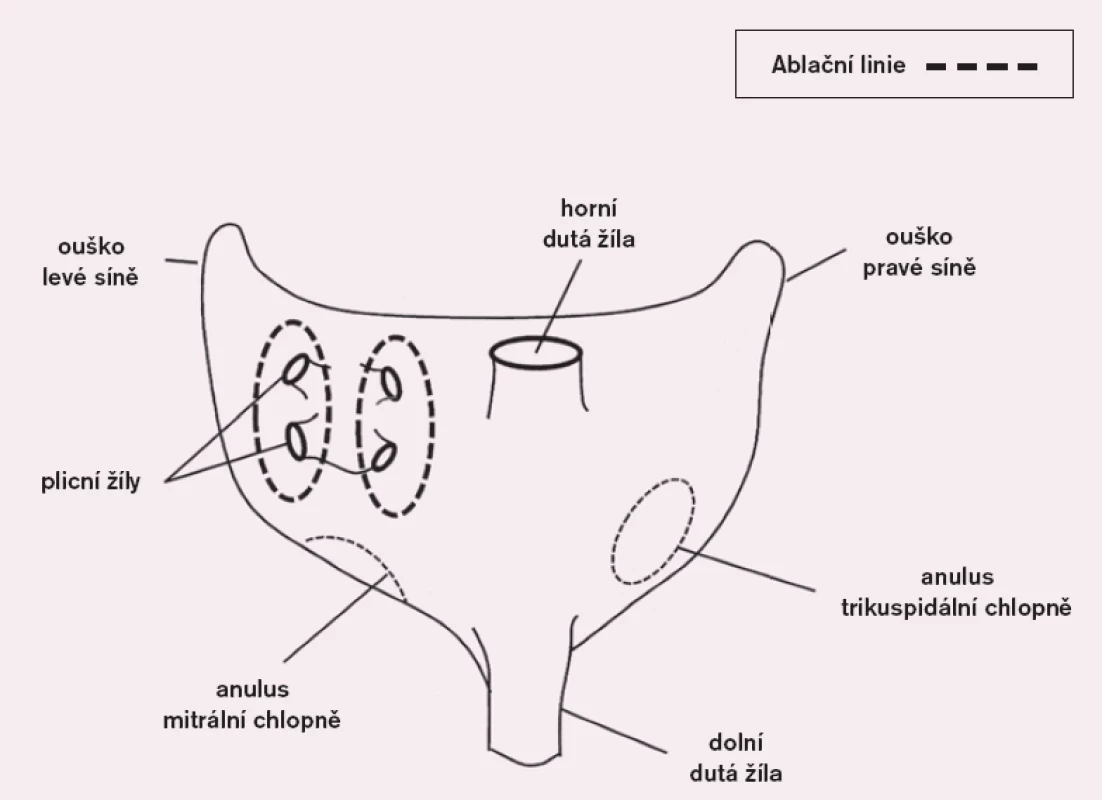
Při perzistující nebo permanentní formě je tento výkon nedostatečný a je třeba aplikovat další linie lézí v LS nebo ještě lépe v obou síních (obr. 2). Tento přístup byl podpořen výsledky peroperačního mapování, kdy bylo zjištěno, že při permanentní FS byl spouštěcí zdroj v LS jen u 40–50% nemocných (9). U ostatních nemocných dochází k elektrické remodelaci, kdy síně stále fibrilují bez nutnosti spouštěcího impulzu a postupně dochází i k remodelaci morfologické se zvětšením síně. Melby [9] došel k názoru, že nemocní s permanentní FS a další získanou (nejčastěji chlopenní) vadou a s dilatací LS představují zřejmě jinou skupinu nemocných než pacienti s paroxysmální FS bez další srdeční vady.
Image 2. Schéma kompletních lézí na obou síních při operaci maze III (modifikováno dle Gaynor [11]). ![Schéma kompletních lézí na obou síních při operaci maze III (modifikováno dle Gaynor [11]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2ede7c4b20e705ca4fbdbf03e1e2a01f.png)
V poslední době se objevují studie, které zdůrazňují důležitou roli, již hrají nervové ganglionární plexy lokalizované kolem síní. Jejich peroperační ablace snižuje rekurenci síňových dysrytmií po operaci [10].
Indikace k chirurgické léčbě
Chirurgická léčba FS je dnes stále u velké většiny nemocných indikována jako doplněk k léčbě jiného základního onemocnění. Může se jednat o chlopenní vadu nebo ICHS nebo kombinaci obou.
Důvodů k léčbě je několik:
- prevence tromboembolických komplikací,
- možnost vyhnout se nutnosti antiarytmické léčby a jejích častých nežádoucích účinků nebo antikoagulační léčby a jejím důsledkům,
- zlepšení hemodynamického stavu, neboť síňový příspěvek znamená zvýšení srdečního výdeje.
K chirurgické léčbě jsou indikovány všechny tři typy FS (paroxyzmální, perzistující a permanentní), přičemž je známo, že trvání permanentní FS má negativní vliv na její úspěšnost [11–12]. Stejně tak má negativní vliv na výsledek velikost srdečních síní. Proto někteří autoři považují chirurgickou redukci při velikosti LS nad 5–6cm za nezbytný krok k udržení sinusového rytmu (SR) [13–14].
Výsledky
Malou účinnost izolace plicních žil dokládá několik studií. Gaita [15] uvádí pouze 20% nemocných s chlopenní vadou po izolaci PŽ se SR dva roky po výkonu bez antiarytmické léčby a 59% s antiarytmickou léčbou. Pokud byly provedeny i další léze v LS, byla úspěšnost 57% bez antiarytmické léčby a 90% s touto léčbou. Isobe [16] udává SR u nemocných s izolací PŽ při propuštění u 71% nemocných, při průměrném sledování 2,3 roku trvání SR bylo 61%. Melby [9] uvádí perzistenci SR u této metody u 59% po dvou letech sledování.
Výsledky při kompletním levosíňovém výkonu jsou velmi variabilní a úspěšnost léčby měřená trváním SR se pohybuje od 44% do 82% při různé době sledování [17–18]. Nepříjemnou komplikací výkonu omezeného pouze na LS je pozdější výskyt síňového flutteru, který je udáván ve 13–21% 15–37 měsíců po operaci [12,19].
Nejlepší výsledky jsou dosahovány při výkonech na obou síních. Melby [9] udává trvání SR u 91% nemocných po 13 měsících. Někteří autoři však rozdíl mezi operacemi omezenými na LS a provedenými na obou síních nenašli [17].
Metaanalýzu 48 studií zabývající se chirurgickou léčbou FS publikoval Khargi [20]. Bylo do ní zahrnuto celkem 3 832 pacientů. Základním cílem bylo porovnat výsledky klasické chirurgické techniky s technikami při použití alternativních zdrojů energie. Výsledky potvrdily, že obě metody nevykazují statisticky významný rozdíl ve výskytu SR po operaci (78,3% oproti 84,9%).
V České republice je chirurgická léčba FS zavedenou metodou léčby na všech kardiochirurgických pracovištích. Nejčastěji se používá kryoenergie a bipolární radiofrekvenční energie. Celkové výsledky jsou srovnatelné s literaturou a úspěšnost měřená udržením SR rok po operaci se pohybuje kolem 80% [21].
Závěr
Chirurgická léčba fibrilace síní má za sebou více než 20letou historii, během které se postupně vyvíjely operační techniky. Pokrok ve vývoji jednotlivých typů přístrojů, které aplikují různé druhy energií, způsobil výrazné zjednodušení celého výkonu, a tím se tato metoda stala rutinní srdeční operací. Nejlepší výsledky jsou dosahovány při léčbě paroxyzmální formy FS, při provedení lézí v obou síních se zlepšily výsledky i u permanentní formy. Zlepšené výsledky vedou k tomu, že FS dnes není jen přídatným výkonem u dalšího srdečního onemocnění, ale začíná být i samostatnou indikací ke kardiochirurgickému výkonu.
Doručeno do redakce 30. 1. 2009
Přijato po recenzi 23. 2. 2009
doc. MUDr. Petr Němec, CSc.
Centrum kardiovaskulární a transplantační chirurgie, Brno
petr.nemec@cktch.cz
Sources
1. Guiraudon GM, Klein GJ, Guiraudon CM et al. Treatment of atrial fibrillation: preservation of sinoventricular impulse conduction: the Corridor operation. In: Olsson SB, Allessie MA, Campbell RWF (eds). Atrial fibrillation: Mechanisms and Therapeutic strategies. Armonk, NY: Futura Publishing Co 1994 : 349–371.
2. Guiraudon GM. Surgical treatment of atrial fibrillation. Herz 1993; 18 : 51–59.
3. Defauw JJ, Guiraudon GM, van Hemel NM et al. Surgical therapy of paroxysmal atrial fibrillation with the “corridor” operation. Ann Thorac Surg 1992; 53 : 564–570.
4. Cox JL, Schuessler RB, D‘Agostino HJ Jr et al. The surgical treatment of atrial fibrillation. III. Development of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991; 101 : 569–583.
5. Haissaguerre M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659–666.
6. Damiano RJ Jr, Gaynor SL. Atrial fibrillation ablation during mitral valve surgery using the Atricure device. Oper Tech Thorac Cardiovasc Surg 2004; 9 : 24–33.
7. Melby SJ, Lee AM, Zierer A et al. Atrial fibrillation propagates through gaps in ablation lines: Implications for ablative treatment of atrial fibrillation. Heart Rhythm 2008; 5 : 1296–1301.
8. Wolf RK, Schneegerger EW, Osterday R et al. Video-assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J Thorac Cardiovasc Surg 2005; 130 : 797–802.
9. Melby SJ, Zierer A, Bailey MS et al. A New Era in the Surgical Treatment of Atrial Fibrillation. The Impact of Ablation Technology and Lesion Set on Procedural Efficacy. Ann Surg 2006; 244 : 583–592.
10. Onorati F, Curcio A, Santarpino G et al. Routine ganglionic plexi ablation during Maze procedure improves hospital and early follow‑up results of mitral surgery. J Thorac Cardiovasc Surg 2008; 136 : 408–418.
11. Gaynor SL, Schuessler RB, Bailey MS et al. Surgical treatment of atrial fibrillation: Predictors of late recurrence. J Thorac Cardiovasc Surg 2005; 129 : 104–111.
12. Imai K, Sueda T, Orihashi K et al. Clinical analysis of results of a simple left atrial procedure for chronic atrial fibrillation. Ann Thorac Surg 2001; 71 : 577–581.
13. García-Villarreal OA, Rodriguez H, Treviňo A et al. Left atrial reduction and mitral valve surgery: The “functional-anatomic unit” concept. Ann Thorac Surg 2001; 71 : 1044–1045.
14. Marui A, Saji Y, Nishina T et al. Impact of left atrial volume reduction concomitant with atrial fibrillation surgery on left atrial geometry and mechanical function. J Thorac Cardiovasc Surg 2008; 135 : 1297–1305.
15. Gaita F, Riccardi R, Caponi D et al. Linear cryoablation of the left atrium versus pulmonary vein cryoisolation in patients with permanent atrial fibrillation and valvular heart disease: correlation of electroanatomic mapping and long‑term clinical results. Circulation 2005; 111 : 136–142.
16. Isobe N, Taniguchi K, Oshima S et al. Left atrial appendage outflow velocity is superior to conventional criteria for predicting of maintenance of sinus rhythm after simple cryoablation of pulmonary vein orifices. Circ J 2005; 69 : 446–451.
17. Doukas G, Samani NJ, Alexiou C et al. Left atrial radiofrequency ablation during mitral valve surgery for continuous atrial fibrillation: a randomized controlled trial. JAMA 2005; 294 : 2323–2329.
18. Deneke T, Khargi K, Grewe PH et al. Left atrial versus bi-atrial. Maze operation using intraoperatively cooled-tip radiofrequency ablation in patients undergoing open-heart surgery: safety and efficacy. J Am Coll Cardiol 2002; 39 : 1644–1650.
19. Golovchiner G, Mazur A, Kogan A et al. Atrial flutter after surgical radiofrequency ablation of the left atrium for atrial fibrillation. Ann Thorac Surg 2005; 79 : 108–112.
20. Khargi K, Keyhan-Falsafi A, Hutten BA et al. Surgical treatment of atrial fibrillation: a systematic review. Herzschrittmacherther Elektrophysiol 2007; 18 : 68–76.
21. Neužil P, Černý Š, Pirk J et al. Operace MAZE: Jaká je realita chirurgické léčby fibrilace síní v České republice? Cor Vasa 2007; 49 : 67–70.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2009 Issue 1-
All articles in this issue
- Chirurgická léčba fibrilace síní
- Ischemicko-reperfuzní poškození po srdeční zástavě a protektivní účinky hypotermie
- Máme v roce 2009 dostatek důkazů o tom, zda nemocným indikovaným k srdeční resynchronizační léčbě implantovat biventrikulární kardiostimulátor nebo kardioverter-defibrilátor?
- Současný stav srdeční resynchronizační léčby u nemocných se srdečním selháním
- Chronologie akutního koronárního syndromu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ischemicko-reperfuzní poškození po srdeční zástavě a protektivní účinky hypotermie
- Chirurgická léčba fibrilace síní
- Současný stav srdeční resynchronizační léčby u nemocných se srdečním selháním
- Máme v roce 2009 dostatek důkazů o tom, zda nemocným indikovaným k srdeční resynchronizační léčbě implantovat biventrikulární kardiostimulátor nebo kardioverter-defibrilátor?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

