-
Medical journals
- Career
Minimum znalostí pro angiology a kardiology léčící vaskulitidy
Authors: D. Karetová 1; R. Bečvář 2
Authors‘ workplace: II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha 1; Revmatologický ústav, Revmatologická klinika 2
Published in: Kardiol Rev Int Med 2008, 10(2): 74-78
Overview
Vaskulitidy jsou složité choroby s multisystémovým postižením, jejichž neblahý průběh se změnil díky možnosti podávat účinnou imunosupresivní terapii. Přiměřené úpravy této léčby během stonání nemocného jsou nutné s ohledem na aktivitu nemoci. Nutné je pečlivé sledování klinického stavu a laboratorních parametrů po celou dobu nemoci, současně je důležitá rutinní monitorace vedlejších účinků imunosupresiv.
Klíčová slova:
imunosupresiva – vaskulitidy malých cév – vaskulitidy velkých tepenÚvod
Glukokortikoidy a imunosupresiva jsou indikovány pro léčbu vaskulitid se systémovými projevy. Nicméně strategie léčby jednotlivých typů se liší. Zatímco u některých vystačíme se samotnými glukokortikoidy (např. u arteritid velkých tepen s mírným průběhem), u většiny musíme sáhnout ke kombinované, agresivnější léčbě.
Charakteristickým znakem všech systémových vaskulitid je zánět a nekróza cévní stěny. Výsledkem těchto procesů je ztluštění cévní stěny, někdy ale její ztenčení, a rozvoj aneuryzmat. Častěji však dochází k vazivové přeměně a vzniku stenóz. Zánět může vzplanout na krátkou dobu, ale často přechází do chronické fáze a stenózy se stávají příčinou ischemie cílových orgánů.
Projevy systémových vaskulitid jsou rozličné podle orgánů postižených cévními změnami, nicméně v akutní fázi (pokud ji zastihneme) vídáme obvykle celkové příznaky:
- horečka
- únava
- hubnutí s nechutenstvím
- bolesti svalů a kloubů
Pokud se u dosud zdravé osoby objeví tyto příznaky a běžné přeléčení antibiotiky nepřinese vymizení teplot a screening maligního procesu je negativní, je vždy na místě pomyslet na autoimunitní systémové onemocnění včetně vaskulitidy.
Některé vaskulitidy vznikají na základě určitého známého podnětu (tzv. sekundární), jiné jsou onemocněním s neznámou etiologií (idiopatické - tedy primární).
Základní charakteristika vybraných vaskulitid
Buergerova nemoc (thrombangiitis obliterans) – na počátku bývají přítomny záněty povrchových žil, poté nastupují projevy ischemie dolních končetin s postižením bércových tepen u mladších mužů, kuřáků cigaret nebo marihuany. Kožní defekty a gangrény se mohou vyskytnout i na prstech rukou, ale častěji se vyskytne ischemie nohou. Tato vaskulitida je jedna z mála, která nemá odezvu na imunosupresivní terapii.
Obrovskobuněčná arteritida – choroba se většinou vyskytuje u lidí starších 50 let, jde o zánětlivé postižení tepen horní části těla, přičemž nejtypičtějším projevem je zánět temporální arterie. Mezi typické příznaky této arteritidy patří bolest hlavy, zduření temporální tepny, klaudikace žvýkacích svalů nebo jazyka, zastřené nebo dvojité vidění, někdy až náhlé oslepnutí. Tato arteritida je velmi často (až v 40−50 % případů) spojena s příznaky polymyalgia revmatica (bolest a ztuhlost pletenců ramenních a pánevních s iradiací do končetin a zejména velkých kloubů s celkovými příznaky).
Takayasuova arteritida postihuje velké tepny, tedy aortu a její hlavní větve, typicky se objevuje u mladších žen (do 40 let věku). Postižení podklíčkových tepen se projevuje klaudikacemi horních končetin, fyzikálně neměřitelným tlakem a pulz v periferii je buď oslabený nebo nehmatný. Při postižení karotid jsou neurčité projevy zaujetí hlavy, rozmazané vidění (v závislosti na poloze hlavy), závratě při záklonu hlavy.
Churgův-Straussův syndrom (alergická granulomatóza) postihuje cévy plic, do obrazu patří cirkulační a tkáňová eosinofilie a prchavé plicní infiltráty, je sdružená s atopií a projevy astmatu. Postiženy mohou být i periferní nervy, ledviny a srdce.
Wegenerova granulomatóza postihuje primárně cévy horních cest dýchacích (zejména nosu, hrdla a sinů), posléze se nastupují systémové příznaky s glomerulonefritidou, granulomatózními lézemi v plicích a mozku. Typickými známkami je dušnost, pocit ucpání nosu, krvácení z nosu, známky sinusitidy a častých ušních infektů, dále pak různé exantémy až ulcerace.
Polyarteriitis nodosa postihuje cévy malého nebo středního kalibru na různých místech těla, včetně kůže, srdce, ledvin, periferních nervů, svalů a střeva. Do klinického obrazu patří purpura, livedo reticularis a další kožní léze, bolesti svalů a kloubů, bolesti břicha, zvýšená citlivost varlat, renální insuficience. Typický je abnormální arteriogram viscerálních tepen s průkazem stenóz a drobných aneuryzmat.
Mikroskopická polyangiitida je záležitost malých cév ledvin, plic a kůže. V popředí je postižení ledvin (glomerulonefritida), mezi další projevy patří kožní ulcerace, horečka, hubnutí, nervové postižení, krvácení z gastrointestinálního systému.
Esenciální smíšená kryoglobulinemie je obvykle sdružena s hepatitidou typu C, projevuje se purpurou na dolních končetinách, artritidou, slabostí a neuropatií.
Henochova-Schoenleinova purpura je charakteristická kožními změnami (hmatná purpura) zejména na hýždích, stehnech a nohou, kolikami, krví ve stolici nebo moči. Je častější v dětství, ale propuknout může v jakémkoliv věku.
K sekundárním vaskulitidám řadíme:
Hypersenzitivní (alergické) vaskulitidy se typicky hlásí červenými skvrnami a spouštěna je léky ze všech skupin.
Postinfekční vaskulitidymají obvykle kožní projevy, někdy renální manifestace a mohou být vyvolány nejrůznějšími patogeny.
Sekundární vaskulitidy spojené s difuzními chorobami pojiva, typicky např. s revmatoidní artritidou, mohou průběh revmatických chorob komplikovat. Postiženy mohou být oči, ledviny, srdce a kůže.
Diagnostika a průběh vaskulitid
Pro diagnostiku vaskulitid a jejich rozlišení nemáme zatím k dispozici žádné specifické laboratorní testy. Proto je ve většině případů nutné bioptické vyšetření (pokud je dostupné) s histologickým a imunohistochemickým průkazem typických změn. Obecně je vždy důležitý celkový souhrn klinických známek onemocnění podpořený zobrazovacími metodami (ultrasonografickými, angiografickými, magnetickou rezonancí s kontrastní látkou a dnes také pozitronovou emisní tomografií s CT zobrazením − PET-CT). V akutní fázi nemoci bývají zvýšeny obecné markery zánětu (FW, bílkoviny akutní fáze, v krevním obrazu bývá vyšší hladina leukocytů, anemie a trombocytemie). Manifestace nemoci celkově závisí na rozsahu a místě postižení cévní stěny.
Nejtěžší průběh bez léčby měly zejména tzv. ANCA pozitivní vaskulitidy, u nichž jsou pozitivní protilátky proti cytoplazmě neutrofilních leukocytů, neplatí to však absolutně.
V počáteční fázi diagnostiky je nutno vždy myslet na sekundární vaskulitidy při infekci, embolizaci, po některých lécích, u kalcifylaxe či amyloidózy, přičemž vztah maligního onemocnění je těsnější k ANCA pozitivním vaskulitidám.
Přehled léků užívaných v léčbě vaskulitid
Počáteční (indukční) léčba vaskulitid
Iniciální léčba po stanovení diagnózy záleží na specifické formě, a zejména na tíži onemocnění. V začátku je většinou indikována léčba glukokortikoidy v kombinaci s imunosupresivní medikací ve formě intravenózních pulzů.
Chronická léčba
Smyslem chronické medikace je udržení snížené aktivity onemocnění navozené iniciální léčbou. Jde o jemné balancování mezi postupným snižováním dávek imunosupresiv k zamezení jejich nežádoucích účinků a udržení remise.
Table 1. Přehled účinku imunosupresivních léků . 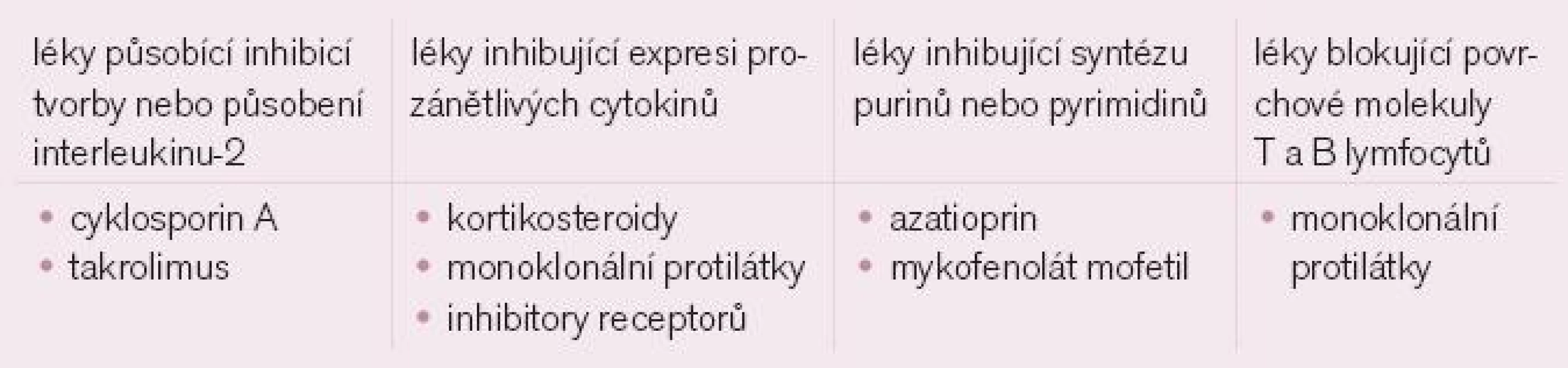
Glukokortikoidy
Glukokortikoidy ovlivňují imunitní odpověď tím, že ji potlačují, ale mají také vlastní protizánětlivé působení. Tyto léky brání klonální proliferaci T lymfocytů přes transkripci genu pro interleukin 2 (IL-2), nicméně snižují i transkripci mnohých genů pro cytokiny (anti-TNFα, IL-1 a dalších).
Iniciálně podáváme dávku 1 mg/kg tělesné hmotnosti přibližně po dobu 1 měsíce, přičemž se snižováním aktivity procesu (na základě klinických a laboratorních známek) postupně snižujeme hladinu kortikoidů na 20 mg/den. U dlouhodobého podávání je cílem redukce dávky na minimum,tj. na 5–10 mg prednisonu denně.
Hlavním nežádoucím účinkem dlouhodobého podávání je demineralizace kostí, které se snažíme zabránit podáváním kalcia, vitamínu D a event. i bisfosfonátů. Dalším nežádoucím metabolickým účinkem je možnost navození diabetes mellitus prostřednictvím mechanizmu posílené glukoneogeneze, která navodí inzulinovou rezistenci; objevit se může i systémová hypertenze. Tyto stavy monitorujeme a případně léčíme. Vedlejším účinkem bývá cushingoidní vzhled, ulcerace sliznice horní části zažívacího traktu, případně drobné krvácení při hemoragické gastropatii. Součástí podávání glukokortikoidů je tedy preventivní podávání inhibitorů protonové pumpy (omeprazolu, pantoprazolu apod).
Kromě toho jsou typické kožní změny – ve smyslu ztenčení a zvýšené fragility kůže; mohou se objevit projevy akné, fialové pajizévky (strie), objevit se může i hirzutizmus. Nutno počítat i s možnými poruchami nálady – ve smyslu sklonu k depresi, může se dostavit nespavost. U žen nelze vyloučit ani anovulační cykly a nepravidelnosti menstruace. Může se předčasně objevit katarakta, zvýšený sklon k infekcím. Kortikoidy navozují i určitou svalovou slabost, u starších jedinců spojenou s rizikem pádů.
Azatioprin (např. Imuran, Azamun)
Tento přípravek interferuje s tvorbou purinů a je cytotoxický. Při metabolizmu vzniká 6-merkaptopurin, analog purinů inhibující syntézu DNA. Potlačuje jak buněčnou, tak protilátkovou imunitní reakci. Je dobře absorbován po perorálním užití. Obvyklou iniciální dávkou je 3−5 mg/kg hmotnosti denně s postupným snížením na 1 mg/kg.
Hlavním nežádoucím jevem podávání azatioprinu je potlačení hematopoézy, zejména tvorby leukocytů se zvýšenou vnímavostí k infekcím (varicella, herpes simplex). Jinými nežádoucími účinky jsou nauzea, zvracení, kožní vyrážky a mírná hepatotoxicita.
Je třeba opatrnosti při současném podávání purinových analogů, např. alopurinolu, protože tento blokuje xantinoxidázu, klíčový enzym v katabolizmu azatioprinu. Pokud je nutné podávat oba léky, redukujeme tedy podávané množství azatrioprinu na třetinu, ale raději se této komedikaci vyhneme.
Mykofenolát mofetil (např. Cellcept, Myfortic)
Mykofenolát je semisyntetický derivát antibiotika, v organizmu je přeměněn na kyselinu mykofenolovou, která blokuje proliferaci T i B lymfocytů. Je také antimetabolitem purinů. Mykofenolát je prakticky vždy užíván s glukokortikoidy. Minimální účinná denní dávka jsou 2 g. Hlavním nežádoucím účinkem je myelotoxicita (navození leukopenie) a lokální iritace gastrointestinálního traktu (zvracení a průjmy).
Cyklofosfamid (např. Endoxan, Cyclophosphamide Orion, Cytoxan)
Cyklofosfamid je alkylační látka s cytotoxickým vlivem. Může být podáván jak venózně, tak perorálně. Je užíván primárně v onkologii k léčbě nonhodgkinských lymfomů, ovariálních karcinomů a solidních tumorů u dětí. Má silné imunosupresivní vlastnosti, a proto se užívá i v léčbě multisystémových vaskulitid, zejména Wegenerovy granulomatózy, polyarteriitis nodosa a vaskulitid spojených s rychle progredujícími glomerulonefritidami. Dále se užívá při neúčinnosti monoterapie glukoritkoidy. Perorálně obvykle podáváme 2 mg/kg tělesné hmotnosti, zaokrouhleno dolů k nejbližším 50 mg, nejčastěji užívanou dávkou je 100–150 mg na den. Tato dávka je podávána po cca 3 měsíce, dávku je nutno snížit při poklesu leukocytů pod 3,5.
Cyklofosfamid může mít významné nežádoucí účinky:
- toxicitu pro močový měchýř (projevující se hemoragickou cystitidou, fibrózou měchýře nebo dokonce vznikem karcinomu)
- toxicitu pro hemopoézu (anémie, trombocytopenie, leukopenie)
- riziko vzniku infekcí, zejména oportunních (Pneumocystis carinii, Herpes zoster, Mycobacterium tuberculosis)
- možnost navození gonadální dysfunkce až sterility a možný teratogenní vliv ještě několik měsíců po ukončení medikace
- riziko vzniku dalších nádorů – leukemie, lymfomů, kožních nádorů
Pokud máme zabránit vzniku těchto vážných nežádoucích účinků, musíme monitorovat močový nález, provádět cytologický rozbor a kontrolovat krevní obraz. Riziko karcinomu závisí na délce podávání a kumulativní dávce. Nemocnému léčenému cyklofosfamidem radíme, aby výrazně zvýšil příjem tekutin a aby měl po dobu užívání zajištěnou účinnou antikoncepci. V případě leukopenie podáváme současně antibiotikum. Relativně nižší riziko nežádoucích účinků má parenterální cyklofosfamidu ve formě bolusů (pulzů) v dávce 10−15 mg/kg v intervalu 3−5 týdnů.
Metotrexát (Methotrexat)
Metotrexát je antimetabolit kyseliny listové. Podává se zejména u vaskulitid s těžším průběhem a u nemocných s vaskulitidami velkých tepen v dávce 15–25 mg týdně (0,3 mg/kg), většinou v kombinaci s glukokortikoidy.
Charakteristická je toxicita pro jaterní parenchym s možným vznikem hepatální fibrózy nebo dokonce cirhózy. Toxicita se také projevuje vůči rychle se dělícím buňkám – v krevní dřeni a zažívacím traktu. Proto vznikají mukozitidy, myelosuprese s rizikem infekce, krvácení při trombocytopenii. Vzácněji se může vyvinout intersticiální pneumonitis, alopecie a poškození ledvin. K omezení těchto účinků se další den po podání metotrexátu užívá kyselina listová (5−10 mg).
Biologická léčba
Konvenční imunosupresivní léčba změnila dříve často fatální průběh vaskulitid. Cytotoxické nežádoucí účinky a možnost relapsů však vedou k vývoji nových léků. Zejména u ANCA pozitivních vaskulitid se zdá, že klíčový je zásah do interakce s cytokiny (TNFα, IL-1) ovlivněnými neutrofily. Tak dochází k jejich předčasné aktivaci a degranulaci, což má za následek poškození endotelií a další atrakci leukocytů. Zdá se, že terapeutické blokování TNFα a eliminace autoreaktivních B-lymfocytů jsou slibné cesty v ovlivnění patogeneze některých typů vaskulitid [3].
Mezi léky s tímto účinkem řadíme zejména preparáty blokující vliv TNFα – monoklonální protilátky infliximab (Remicade) a adalimumab (Humira inj), dále inhibitor receptoru TNFα spojený s Fc částí lidské molekuly IgG etanercept (Enbrel inj). Jako slibný se jeví preparát blokující vliv B lymfocytů pod názvem rituximab (Mabthera inf), což je monoklonální protilátka mířená proti CD20 (antigen specifický pro B lymfocyty, které produkují autoprotilátky).
Biologická léčba vaskulitid je rezervována pro nejtěžší formy nemoci, které neodpovídají na konvenční schémata. Zatím je užívána jen u malých skupin nemocných a v klinických studiích.
Výměna plazmy
Tento způsob léčby není užíván v prvé linii. Užívá se u polyarteriitis nodosa, refrakterní ke konvenční kombinované, imunosupresivní léčbě, zejména při progredující renální insuficienci [7]. Výměna plazmy byla použita v některých studiích u ANCA-pozitivních vaskulitid.
Imunoglobuliny
Převaha zpráv o pozitivním přínosu nitrožilní aplikace imunoglobulinů plyne ze zkušeností s Kawasakiho nemocí, použity byly i u léčby Wegenerovy granulomatózy a mikroskopické polyangiitidy [8]. Ani zde se však nejedná o léčebný přístup prvořadý, imunoglobuliny zůstávají další možností u nemocných neodpovídajících na kombinovanou imunosupresivní léčbu.
Komu a jaká imunosupresiva?
- Primární versus sekundární vaskulitida: Identifikace vaskulitidy jako primární nebo sekundární je důležité kritérium. Pokud je přítomnost vaskulitidy v organizmu druhotná, například při prokázané infekci (zejména virové: virus získané imunodeficience – HIV, parvoviry, virus Epsteina-Barrové – EBV, viry hepatitidy – HBV a HCV) nebo při maligním nádoru, je pro léčbu rozhodující eliminace primárního procesu. V dnešní době je virus hepatitidy B zodpovědný za velmi malé procento vaskulitid v Evropě, což je dáno zvýšenou bezpečností transfuzí a narůstajícím procentem očkovaných. Naopak virus hepatitidy C je dnes považován za etiologické agens více než 90 % nemocných s kryoglobulinemií [9]. Protivirová léčba je základem u nemocných s prokázanou infekcí, kombinovaná imunosuprese by mohla naopak replikaci viru zvýšit, proto je indikována pouze v případech, kdy selže protivirová strategie. Maligní procesy léčíme v souladu s obvyklými postupy.
- Závažnost vaskulitidy: V zásadě se liší přístup k vaskulitidě potenciálně ohrožující život (např. Wegenerova granulomatóza) a k ostatním vaskulitidám. Vaskulitidy velkých tepen, se kterými se angiolog, případně kardiolog setkává nejčastěji (tedy Takayasuova nemoc nebo Hortonova obrovskobuněčná arteriitida) nevyžadují tak agresivní léčebný přístup jako vaskulitidy středních a malých cév, zejména vykazují-li ANCA-pozitivitu (polyarteriitis nodosa, mikroskopická polyangiitis, syndrom Churga a Straussové) a projevy orgánového selhávání.
- Aktivita: aktivitu onemocnění můžeme stanovat například podle tzv. skóre 5 faktorů, které má jasné prognostické dopady. Jde o součet bodů podle přítomnosti: 1. proteinurie větší než 1 g, 2. renální insuficience, 3. kardiomyopatie, 4. postižení gastrointestinálního traktu, 5. postižení nervového systému. Zatímco 5letá mortalita v nepřítomnosti orgánového postižení (skóre 0) je 12%, mortalita se skóre vyšším než 2 byla 46%. Poměrně komplikované je Birminghamské skóre aktivity, které je užíváno v některých studiích. Skórovací systémy se tedy v běžné praxi neuplatňují a jsou vyhrazeny pro studie s novými léky.
Léčba vaskulitid velkých tepen
Obrovskobuněčná arteriitida Hortonova (arteriitis temporalis) postihuje starší osoby, více v severních částech Evropy (oproti Africe, Asii apod) a je nejčastější vaskulitidou velkých a středních tepen se systémovými projevy. Jejím nejobávanějším projevem je ischemie n. opticus s rizikem ireverzibilního oslepnutí při pozdním nasazením léčby. Tomu předchází dočasné zhoršení vidění na jedno oko nebo na obě oči, které může trvat několik minut až 1−2 hod, přítomna může být i diplopie.
Table 2. Klasifikace vaskulitid podle kalibru postižených cév. 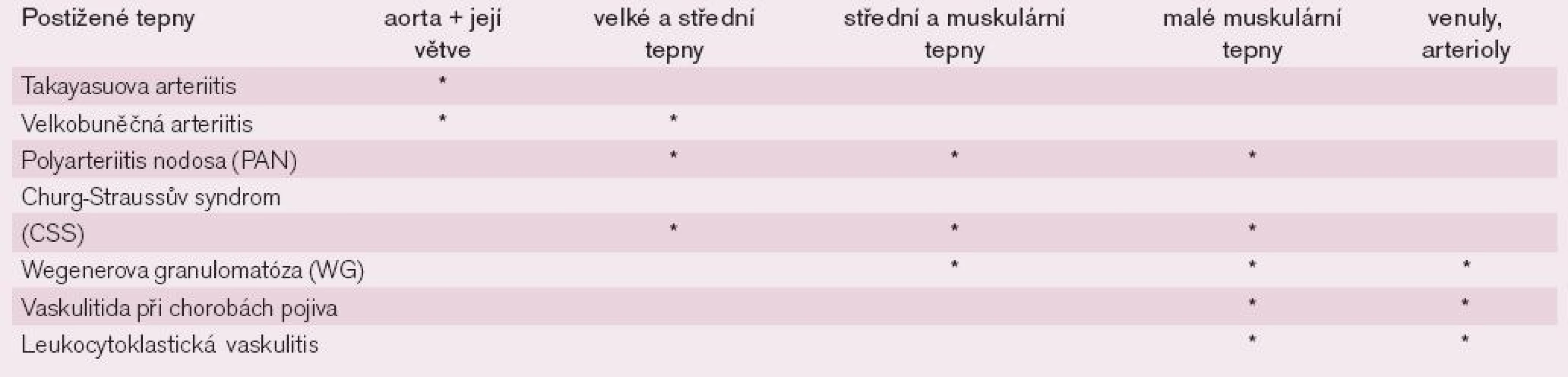
Table 3. Laboratorní monitorace možných nežádoucích účinků jednotlivých imunosupresív. 
Intenzita imunosupresivní léčby 
Současná léčebná strategie stále zahrnuje podávání vysokých dávek kortikosteroidů (v iniciálním pulzu metylprednizolonem 1 g denně po dobu 3 dnů s následným převedením na 1 mg/kg hmotnosti za den orálně, po dobu cca 4 týdnů) a pokračování snižujících se dávek orálních steroidů. Obvykle se kortikoterapie podává po dobu 1–2 let. V některých studiích byl při snížení dávky kortikoidů užíván k udržení remise metotrexát [10], některé studie vyzněly v tomto směru negativně [11]. Jsou zmínky i o příznivém účinku infliximabu k zamezení recidivy choroby [12]. Základním a jednoduchým prostředkem monitorace aktivity nemoci je stanovení sedimentace erytrocytů.
Dalším léčebným prostředkem k udržení průchodnosti tepny postižené zánětem, tedy k prevenci cerebrálních ischemických příhod, je užití protidestičkového léku – nejběžněji přípravky s kyselinou acetylsalicylovou [13,14,15].
Diagnóza temporální arteriitidy stojí na prvotním klinickém podezření na základě symptomů, přičemž jsou přítomny zvýšené markery zánětu (FW, CRP, trombocytemie); diagnózu definitivně potvrzuje histologie z biopsie temporální arterie.
Takayasuova arteriitida (bezpulzová nemoc) je další relativně častější vaskulitida, se kterou se může kardiolog nebo angiolog setkat. Jde o idiopatickou arteriitidu, pomalu progredující, postihující aortu a z ní odstupující velké tepny – karotické, subklaviální, renální a další. Akutní stadium nemoci není vždy zastiženo, postihuje častěji mladší ženy, zejména v regionu východní Asie a Japonska, avšak ani v našich podmínkách není tato nemoc neobvyklá.
Mezi základní diagnostická kritéria nemoci patří věk pod 40 let, oslabené (nebo dokonce chybějící) pulzace na periferních tepnách, diference měřeného krevního tlaku na horních končetinách větší než 10 mm Hg. Obvykle je současně slyšitelný drsný systolický šelest nad aortou a nad subklaviálními tepnami. Příznaky nemoci plynou z ischemie postižených regionů – objevují se poruchy visu a závratě při postižení karoticko-vertebrálního povodí, v horních končetinách při zátěži mají bolesti charakter klaudikací, může být přítomna renovaskulární hypertenze při stenotických lézích renálních tepen, která je obtížně korigovatelná. V některých případech současně dochází i k projevům ischemické choroby srdeční.
Základem léčby jsou glukokortikoidy, často však se samotnými nevystačíme a musíme v kombinaci přidat metotrexát nebo cyklofosfamid, u méně aktivních forem azatioprin nebo mykofenolát mofetil. Důležitá, ale svízelná, je terapie systémové hypertenze, protože korekce tlaku vede k intenzivnějším projevům zejména mozkové ischemie. Na druhou stranu nekorigovaná hypertenze vede k hypertrofii myokardu a může vyústit v srdeční selhání [16]. Dnes provádíme i u těchto nemocných revaskularizační výkony v místech stenóz nebo segmentálních okluzí, ať již endovaskulární či chirurgické. K zabránění trombotických událostí podáváme protidestičkové léky a k zábraně rozvoje aterosklerózy (v terénu změněné tepenné stěny s předpokládanou endoteliální dysfunkcí) nasazujeme statiny.
Závěr
Vaskulitidy jsou obtížnou kapitolou v medicíně především z hlediska diagnostiky, protože mají často velmi variabilní obraz a průběh. Další svízel přichází s léčbou, u které nejsou k dispozici tak pevná data jako u jiných kardiovaskulárních chorob, navíc máme malé léčebné zkušenosti, protože prevalence těchto chorob je nízká. Po nasazení indukční imunosupresivní terapie balancujeme mezi rizikem relapsu při snižování dávek a rizikem přeléčování se všemi možnými nežádoucími účinky. Dávky tedy upravujeme podle klinického stavu, vývoje laboratorních parametrů (nejčastěji se řídíme aktivitou zánětu podle sedimentace erytrocytů a hladin bílkovin akutní fáze), zohledňujeme míru navozených nežádoucích účinků (renální, jaterní funkce apod.) a věk nemocného. Z tohoto důvodu je nutná pravidelná laboratorní i klinická monitorace možných vedlejších účinků imunosupresiv, ať již z hlediska metabolických komplikací, útlumu kostní dřeně, vzniku malignit nebo infekce. Nová, tzv. biologická léčba snad ovlivní tyto choroby specifičtěji a vyhne se rizikům stávající terapie.
Tento referát byl zpracován za podpory Výzkumných záměrů MZd ČR č.0002372801.
MUDr. Debora Karetová1
doc. MUDr. Radim Bečvář, CSc.2
1II. interní klinika kardiologie a angiologie, 1. LF UK a VFN, Praha
2Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha
Sources
1.Brunton LL. The Pharmacological Basis of Therapeutics. 11 ed. New York: McGraw-Hill 2006 : 1405-1433.
2.Harvey RA, Champe PC. Pharmacology. 3. ed. Philadelphia: Lippincott Williams and Wilkins 2006 : 485-495.
3.Lamprecht P, Till A, Steinmann J et al. Current State of Biologicals in the Management of Systemic Vasculitis. Ann NY Acad Sci 2007; 1100 : 261-270.
4.Yazici Y. Vasculitis Update, 2007. Bull NYU Hosp Jt Dis 2007; 65(3): 212-214.
5.Guillevin L, Pagnoux Ch. When Should Immunosuppressants Be Prescribed to Treat Systemic Vasculitides? Intern Med 2003; 42 : 313-317.
6.Belmont HM. Treatment of ANCA-associated systemic Vasculitis. Bull NYU Hosp Jt Dis 2006; 64(1,2): 60-66.
7.Pusey CD, Rees AJ, Evans DJ et al. Plasma exchange in focal necrotizing glomerulonephritis without anti-GBM antibodies. Kidney Int 1991; 40 : 757-763.
8.Jayne DR, Renault VL, Lockwood CM. Anca anti-idiotype antibodies and the treatment of systemic vasculitis with intravenous immunoglobulin. J Autoimmun 1993; 6 : 207-219.
9.Rieu V, Cohen P, André MH et al. Characteristics and outcome of 49 patients with symptomatic cryoglobulinemia. Rheumatology 2002; 41 : 290-300.
10.Nuenninghoff DM, Matteson EL. The role of disease-modifying antirheumatic drugs in the treatment of giant cell arteriitis. Clin Exp Rheumatol 2003; 21(suppl 32): S29-S34.
11.Jover JA, Hernandez-Garcia C, Morado IC et al. Combined treatment of giant cell arthritis with methotrexate and prednisone. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 2001; 134 : 106-114.
12.Salvarani C, Macchioni PL, Manzini C et al. Infliximab plus prednisone or placebo plus prednisone for the initial treatment of polymyalgia rheumatica. Ann Intern Med 2007; 146 : 631-639.
13.Nesjet G, Berkun Y, Mates M et al. Low-dose aspirin and prevention of cranial ischemic complications in giant cell arthritis. Arthritis Rheum 2004; 50 : 1332-1337.
14.Danech-Meyer HV, Savino PJ. Giant cell arthritis. Curr Opin Ophtalmol 2007; 18 : 443-449.
15.Spiera RF, Spiera H. Therapy for Giant Cell Arteritis: Can We Do Better? Arthritis Rheum 2006; 54 : 3071-3074.
16.Rav-Acha M, Plot L, Peled N et al. Coronary involvement in Takayasu's arteritis. Autoimmun Rev 2007; 6(8): 566-571.
17.Tesař V. Systémové vaskulitidy. Angiologie pro praxi. 2. ed. Praha: Maxdorf 2007 : 160-177.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2008 Issue 2
Most read in this issue- Minimum znalostí pro angiology a kardiology léčící vaskulitidy
- Rehabilitace po CMP
- Kardiovaskulární onemocnění v těhotenství
- Léčba AIM kombinací přednemocničně podané tenekteplázy a akutní PCI
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


