-
Medical journals
- Career
Akutní infarkt myokardu u nemocných s renálním selháním I: prognóza a léčba
Authors: S. Janoušek
Authors‘ workplace: LF MU a FN Brno, pracoviště Bohunice ; Interní kardiologická klinika
Published in: Kardiol Rev Int Med 2007, 9(1): 13-21
Category: Editorial
Overview
Renální insuficience (RI) je významným negativním prognostickým faktorem u akutního infarktu myokardu (AIM), a to i při použití nejmodernější léčebné metody, kterou je v současnosti akutní perkutánní angioplastika. Příčiny jsou multifaktoriální: patří sem zejména těžší difuzní aterosklerotické postižení u nemocných s RI, dále zhoršené hojení nekrotického ložiska vinou katabolických procesů, zvýšená kumulace rizikových faktorů (hypertenze, diabetes mellitus, dyslipidemie) a častá anémie u renálních onemocnění i poruchy metabolizmu P, Ca, které významně akcelerují aterosklerózu. Při zhoršené funkci ledvin je podstatně hůře tolerováno podání kontrastních látek, což vede ke zvýšenému výskytu kontrastové nefropatie, která je spojena s významně vyšší mortalitou a dalšími kardiovaskulárními komplikacemi. Prevence zhoršení funkce ledvin je významnou cestou ke snížení mortality. Pozorování také opakovaně prokazují podstatně horší základní farmakoterapii u nemocných s RI a AIM. Především se jedná o méně časté podávání betablokátorů, kyseliny acetylsalicylové statinů i ACE-inhibitorů. Kvůli odchylnému metabolizmu a narušené renální eliminaci vznikají u nemocných s RI specifické problémy také při dávkování léků.
Klíčová slova:
renální insuficience, akutní infarkt myokardu, prognóza, perkutánní angioplastika, kontrastní nefropatie, farmakoterapie, dávkování lékůÚvod
Podrobný rozbor vztahu mezi chronickými nemocemi ledvin (CKD - chronic kidney disease) a kardiovaskulárními (KV) onemocněními byl dlouhou dobu opomíjen. Ale prodloužení lidského věku a zvyšující se podíl diabetiků II. typu na populaci vyspělých zemí, které jsou v přímé souvislosti s obezitou důsledkem zvyšující se životní úrovně, vedou ke zvýšení podílu CKD v populaci. RI dále akceleruje přítomnost primární nebo sekundární hypertenze [1].
Pokud diabetes mellitus (DM), typu I i typu II, trvá déle než 25 let, vyvíjí se nefropatie již u zhruba poloviny nemocných [2]. Také víme, že zhruba polovina všech terminálních stadií chronických nemocí ledvin (ESRD - end stage renal disease) je způsobena diabetickou nefropatií. Tato narůstající incidence CKD v populaci konečně vedla k úsilí podrobněji pochopit vztah mezi nemocemi ledvin a postižením myokardu, zvláště pak rozvojem koronární aterosklerózy.
Dnes jsou již k dispozici přesvědčivé důkazy, že CKD akcelerují aterosklerózu i další nemoci myokardu a podporují i vznik srdečních arytmií [3-6]. Zvláště výrazné je to u dialyzovaných nemocných v ESRD, kde se KV onemocnění podstatně podílejí na mortalitě nemocných [7].
Toto sdělení je podrobně věnováno specifickému léčebnému a diagnostickému problému, kterým je AIM u CKD, zvláště při vyvíjející se nebo plně rozvinuté chronické renální insuficienci (CRI).
Co je ukazatelem RI v běžné praxi?
Jako nejjednodušší hrubý ukazatel se jeví vstupní koncentrace sérového kreatinu (SKr), která ale podhodnocuje skutečnou přítomnost RI [8-10], zvláště u žen a starších osob. Proto se jako přesnější užívá hodnota kreatininové clearence (KrCl), ale místo přímého stanovení se obvykle pro praxi zjednodušeně určuje ze vzorce(modifikovaná Cockcroftova-Gaultova formule [11]):
Kreatinová clearence = (140 - věk) × váha (kg)/sérový kreatinin (µmol/l) × 0,8145
Pro ženy se tato hodnota dále násobí koeficientem 0,85.
(Byly vypracovány ještě poněkud přesnější (ale i komplikovanější) vzorce k nepřímému stanovení KrCl, v nichž se bere v úvahu i sérová koncentrace urey a albuminu [12], avšak v klinické praxi se neujaly.)
Tab. 1 ukazuje klasifikaci chronických onemocnění ledvin podle Americké nefrologické společnosti [13], kterou používáme i v tomto sdělení.
Table 1. Klasifikace chronických nemocí ledvin [13]. ![Klasifikace chronických nemocí ledvin [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/283dbbd300c9086f21a87dea7ba0dd92.jpg)
Výskyt mnoha různých patologických procesů (např. kontrastní nefropatie, restenózy po perkutánních koronárních angioplastikách (PCI), reinfarkty, městnavé srdeční selhání, arytmie i KV-mortalita obecně), významně akceleruje, když glomerulární filtrace (GF) klesá pod 60 ml/min/1,73 m2 [13,14,15,16,17], což zhruba koresponduje se SKr > 133 μmol/l.
Prognóza a léčba nemocných s AIM a RI
První sledování [7] ukázala vysokou KV-mortalitu i celkovou mortalitu, a z toho vyplývající velmi nepříznivou prognózu u dialýzovaných ve stadiu ESRD v období, v němž reperfuzní terapie bylaužívána minimálně (graf 1), což potvrdila i další pozorování [18]. Další výzkum prokázal i u lehčích stadií RI s AIM podstatně nepříznivější prognózu než u nemocných bez RI (graf 2) [9,10]. Je významné, že prognózu zhoršuje již relativně mírné zhoršení renálních funkcí respektive mírné zvýšení hodnot SKr [19,20]. Při srovnání nemocných s různým stupněm RI a AIM pak platí, že se zhoršováním GF se přímo úměrně zvyšuje i riziko mortality nebo jiných závažných KV příhod a komplikací (graf 3) [8,20-22].
Graph 1. Kumulativní mortalita po infarktu myokardu u pacientů v terminálním stadiu renálního selhání z amerického systému dat týkajícího se onemocnění ledvin [7]. ![Kumulativní mortalita po infarktu myokardu u pacientů v terminálním stadiu renálního selhání z amerického systému dat týkajícího se onemocnění ledvin [7].](https://pl-master.mdcdn.cz/media/image/4e3da04653a8e620a0c383e3ec7666a5.jpg?version=1537793887)
Graph 2. Úmrtnost v nemocnici při infarktu s elevacemi ST jako funkce kreatininové clearance (p < 0,001) [9]. ![Úmrtnost v nemocnici při infarktu s elevacemi ST jako funkce kreatininové clearance (p < 0,001) [9].](https://pl-master.mdcdn.cz/media/image/f2ae0e1ff5f66ed729d98ae248c6d59e.jpg?version=1537797610)
Graph 3. Tříletá mortalita po AIM v závislosti na glomerulární filtraci [20]. ![Tříletá mortalita po AIM v závislosti na glomerulární filtraci [20].](https://pl-master.mdcdn.cz/media/image/523e96fb2494b04acd381e30e7fb92d6.jpg?version=1537793983)
Je důležité, že u RI je krátkodobá i dlouhodobá prognóza po revaskularizačních zákrocích, a to jak neakutní PCI nebo aortokoronárních bypassech (CABG) [23,24], podstatně horší než u pacientů bez RI (graf 4, 5).Jak je patrno, zvláště nepříznivou prognózu po těchto zákrocích mají nemocní s DM a současnou RI (viz též následující kapitola o kontrastní nefropatii). Potvrzuje se, že také starší nemocní mají při AIM a CRI velmi nepříznivou prognózu [10].
Graph 4. Úmrtnost v období 1 roku po PCI [23]. ![Úmrtnost v období 1 roku po PCI [23].](https://pl-master.mdcdn.cz/media/image/7c7833d69b35f1b14e783ca501710ee8.jpg?version=1537794797)
Graph 5. Bez úmrtí na kardiovaskulární onemocnění po angioplastice nebo bypassu u studie BARI (Bypass Angioplasty Revascularization Investigation) [17]. ![Bez úmrtí na kardiovaskulární onemocnění po angioplastice nebo bypassu u studie BARI (Bypass Angioplasty Revascularization Investigation) [17].](https://pl-master.mdcdn.cz/media/image/ee47a87bc0dd307151c85d1d6a4344cf.jpg?version=1537797531)
Je celá řada důvodů, proč má AIM u nemocných s CRI horší průběh i prognózu [25]:
- Jednou z příčin RI je vaskulární nefropatie, která ukazuje na těžší difuzní aterosklerotické arteriální postižení (schéma 1), které uvádí některé faktory vedoucí k poškození arteriální stěny, a tím akcelerující rozvoj aterosklerózy).
- Výraznější zhoršení funkce ledvin zvyšuje katabolizmus, který zpomaluje hojení nekrotického ložiska.
- U RI bývá zvýšená kumulace rizikových faktorů (hypertenze, DM, dyslipidemie), což zhoršuje prognózu nemocných [17].
- Poruchy metabolizmu P, Ca, homocysteinu a lipidů u renálních onemocnění podporují rozsah a akceleraci aterosklerózy [26,27] včetně kalcifikace arteriální stěny [28,29], anémie obvykle přítomná u těžších stadií RI dále zhoršuje prognózu (graf 6) [30-32].
- Primární poruchy koagulace a agregace u nemocných s RI vedou ke zvýšené frekvenci rizika krvácení, ale současně i koronární trombózy. Uremie způsobuje dysfunkci destiček [33]. Na patologických procesech se také podílejí chronická hyperaktivace sympatického systému a nerovnováha mezi endotelinem (silný vazokonstriktor) a NO (vazodilatátor), které zhoršují stres cévní stěny a tak akcerelují aterosklerózu a zvyšují riziko ruptury aterosklerotických plátů, a tím i vzniku akutních koronárních syndromů (AKS).
- Při zhoršené funkci ledvin je hůře tolerováno podání kontrastních látek, které mohou vyvolat kontrastní (kontrastovou) nefropatii [34]. Ta je spojena s výrazně vyšší mortalitou i dalšími KV komplikacemi (viz následující samostatná kapitola).
- Na nepříznivé prognóze se podílí také zvýšený výskyt arytmií u těchto nemocných. Je známo, že uremie, hyperkalemie a poruchy metabolizmu Ca a P jsou spojeny s vysokým výskytem supraventrikulárních i komorových arytmií. K tomu přispívá hypertrofie a dilatace levé komory srdeční a chronické srdeční selhání často sdružené s RI [5]. U mnoha léků s antiarytmickým účinkem musí být dávkování pečlivě upraveno i monitorováno (tab. 4) [35]. Navíc se u nemocných s těžkou RI zvyšují defibrilační prahy, což může vést až k selhání implantabilního kardioverteru/defibrilátoru u nemocných s maligními arytmiemi [6].
- Studie opakovaně prokazují podstatně horší farmakoterapii u nemocných s RI a AIM [20,36-38], tzn. především méně časté podávání betablokátorů (BB), kyseliny acetylsalicylové (ASA), statinů [20] a inhibitorů konvertázy angiotenzinu (ACEI) [38], i významně nižší frekvenci koronarografií, trombolytické léčby, PCI a CABG [7,9,10,18,20,36]. A to nejen mezi nemocnými s RI a bez RI, ale i mezi jednotlivými skupinami nemocných s RI, kde jsou nemocní s vyšším stupněm RI zřetelně hůře léčeni [20,39]. Zvláště nemocní s těžkou RI (ESRD) jsou běžně v plné míře vystaveni tomuto terapeutickému nihilizmu [15,38].
Schéma. Cévní patologie u CRI [25]. ![Schéma. Cévní patologie u CRI [25].](https://pl-master.mdcdn.cz/media/image/be31baed05f55487d72c4b827f3b78c1.jpg?version=1537796326)
Graph 6. PPCI: relativní riziko 3leté mortality vycházející z GRF před PPCI a hematokritu [31]. ![PPCI: relativní riziko 3leté mortality vycházející z GRF před PPCI a hematokritu [31].](https://pl-master.mdcdn.cz/media/image/66407781790a66654f3ee6fe3beb93c4.jpg?version=1537794349)
Léčba AIM je v současnosti založena na medicíně založené na důkazech (EBM - evidence based medicine), tzn. především na analýze údajů získaných z rozsáhlých klinických studií. Je ironií, že jedním z obvyklých vylučovacích kritérií k zařazení do studií je RI. Proto jsou klinické studie zabývající se léčbou AIM u nemocných s RI zatím jen ojedinělé, s podstatně menšími počty pacientů a často vázané jen na jedno centrum. Údaje jsou často získávány ze subanalýz z celkově jinak zaměřených studií. Na základě retrospektivních studií lze jen obtížně posoudit přínos léčby. Obecně lze konstatovat, že nemocní s RI mají prakticky při všech léčebných postupech horší výsledky než obdobně léčení nemocní bez RI.
Intervenční a revaskularizační postupy
Neakutní revaskularizační léčba je vázána na přesnou koronarografickou diagnózu postižení koronárního řečiště, která se, jak již bylo výše uvedeno, provádí u nemocných s RI podstatně méně často [7,9,10,20,21,36]. Mortalita a výskyt komplikací u těchto nemocných je podstatně vyšší než u běžné populace při léčbě PCI (graf 6) [31,40] i při revaskularizací prostřednictvím CABG [24,41]. To se týká obecně revaskularizačních procedur u nemocných se závažným postižením více koronárních tepen, a to i pří mírném stupni RI. Situaci dále zhoršuje přítomnost DM (graf 5) [17]. Při srovnání revaskularizační terapie u nemocných po AIM se závažným nálezem na koronárních tepnách u lehké a středně těžké RI (stadium 1-3) se PCI i CABG ve srovnání s pouhou farmakoterapií jeví jako zřetelný přínos po stránce mortality. Avšak u nemocných s těžkým renálním selháním (stadium 4 a 5) je zřetelným dlouhodobým přínosem pouze revaskularizace prostřednictvím CABG [42].
Co se týče akutních intervencí, i úspěšná primární PCI má zvýšenou hospitalizační mortalitu u nemocných s renální dysfunkcí [40]. Také zde byl pozorován progresivní vzestup mortality od mírného zvýšení úvodního SKr při hodnotách vyšších než 177 μmol/l však už přesahovala 30 % (tab. 2).
Table 2. Úmrtnost v nemocnici u pacientů s AIM ve 3 pásmech hladin sérového kreatininu při přijetí. 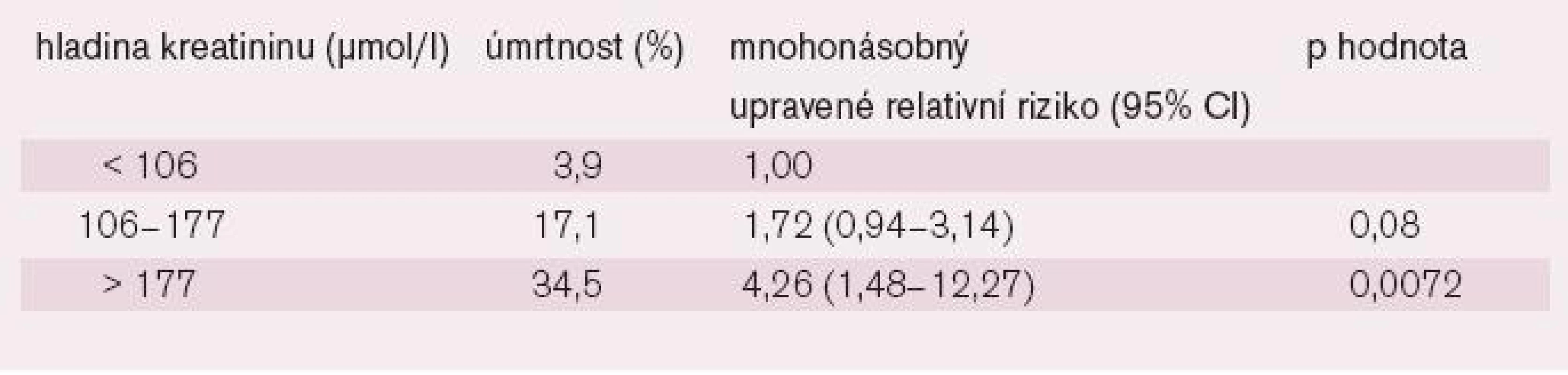
Odds ratios byly upraveny podle věku, pohlaví, hypertenze, předešlých infarktů myokardu, počtu zúžených cév, umístění infarktu myokardu a Killipovy klasifikace. Tyto údaje potvrdila i další obdobná analýza [43], která prokázala výrazně nepříznivý vliv RI na 30denní i jednoroční mortalitu i výskyt krvácení a restenóz u nemocných s AIM léčených primární PCI (graf 7), jakož i na nárůst mortality s tíží RI.
Graph 7. Multivariační analýza hlavních rizikových faktorů mortality u nemocných s AIM léčených primární PCI [43]. ![Multivariační analýza hlavních rizikových faktorů mortality u nemocných s AIM léčených primární PCI [43].](https://pl-master.mdcdn.cz/media/image/301d882256e42ebb9bbbe09e79d106b2.jpg?version=1537793335)
Také následující podrobná retrospektivní analýza z poslední doby prokázala u nemocných léčených primární PCI výrazně nepříznivý vliv CRI na 30denní i jednoroční mortalitu, a to i při používání intrakoronárních stentů [44]. Skórovací systém z těchto dat odvozený logistickou regresní analýzou (tab. 3) zařadil dokonce vstupní CRI jako ukazatele mortality na významnější místo než nepříznivý výsledek intervenčního zákroku nebo pokročilý věk nemocných.
Table 3. Bodovací systém pro prognózu po primární PCI (tzv. CADILLAC risk score) [44]. ![Bodovací systém pro prognózu po primární PCI (tzv. CADILLAC risk score) [44].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3e3ab0a927f05941bb7763c5ea48b587.jpg)
EF LK – ejekční frakce levé komory srdeční 3 VD – tripple vessel disease – významné postižení všech 3 hlavních koronárních tepen Jednou z nevýhod intervenčních zákroků včetně primární PCI je u nemocných s RI zvýšený výskyt KN, který významně zhoršuje krátkodobou i dlouhodobou prognózu (graf 8) [45]. Touto problematikou se bude podrobně zabývat následující samostatná kapitola.
Graph 8. Prognostický význam KN po PCI [46]. ![Prognostický význam KN po PCI [46].](https://pl-master.mdcdn.cz/media/image/a30e5de48091b585da44c0ff4d8f4f84.jpg?version=1537795683)
Jen jako zajímavost uvádíme, že letos byla publikována poněkud provokativní analýza ukazující na údajích z národního izraelského registru ACSIS, že nemocní s AIM a RI měli výrazně nižší mortalitu při trombolytické léčbě než při léčbě primární PCI [47]. Ovšem tento zcela překvapivý výsledek z retrospektivní analýzy bude samozřejmě vyžadovat ověření v prospektivních randomizovaných studiích.
Farmakoterapie
Retrospektivní studie ukazují na zjevný benefit podávání kyseliny acetylsalicylové (ASA), klopidogrelu, BB i statinů. Kontroverzní názory panují na podávání ACEI. U mírného renálního selhání je jejich podávání plně opodstatněno, neboť redukuje mortalitu i výskyt nefatálních KV příhod [48], ale obecně se nedoporučují u středně těžkého až těžkého renálního selhání. Objevují se ovšem práce prokazující jejich přínos právě u těchto nemocných [49].
I při dokonalé adjuvantní kardioprotektivní farmakoterapii je však mortalita nemocných s AIM a RI vyšší než u zdravé populace [23]; to nás ale nesmí vést k terapeutickému nihilizmu, profit této léčby vždy převažuje riziko, které by existovalo bez ní.
Farmakokinetika mnoha léků je nepříznivě ovlivněna při renálním selhání, například je snížena clearence destičkových inhibitorů IIb/IIIa [50] i nízkomolekulárního heparinu [51]. I když se obecně zdá, že i zde jsou terapeutickým přínosem, při těžší RI je nutno vždy zvažovat riziko excesivního krvácení, které by mohlo převážit nad léčebným benefitem [50,52].
U těchto nemocných ale vzniká složitá situace i při použití klasických kardioprotektivních léků. Zatím není jisté, zda nebude nutné zvolit u nemocných v tomto stadiu RI zásadně jinou léčebnou strategii než u nemocných v lehčím stadiu CKD (viz též kapitola o eliminačních metodách) Zde budou nezbytné další rozsáhlejší prospektivní randomizované studie ke stanovení optimálního léčebného postupu u vysoce rizikové podskupiny nemocných s AIM ve stadiu ESRD.
Specifickým problémem při RI je dávkování léků. Abychom mohli u konkrétního léku posoudit úpravu jeho aplikace při RI, je nezbytné znát jeho základní farmakokinetické vlastnosti, jako je např. resorpce při p.o. podání, distribuční objem, vazba na plazmatické bílkoviny, vztah mezi aktivními a inaktivními metabolity, poločas a cestu eliminace atd. Podrobný rozbor této problematiky výrazně přesahuje formát tohoto sdělení. Každý lék vyžaduje specifický přístup. V tab. 4 uvádíme pouze pro orientační ilustraci jedno z doporučených dávkování některých léků užívaných v kardiologii s progredujícím stupněm RI. Ještě složitější problémy s úpravou dávkování léků vznikají při léčbě starších osob s RI [54].
Table 4. Úprava dávkování některých léků používaných v kardiologii podle kreatininové clearence (ml/min) = GF (ml/min/1,73 m2) [podle 13,31,49]. ![Úprava dávkování některých léků používaných v kardiologii podle kreatininové clearence (ml/min) = GF (ml/min/1,73 m<sup>2</sup>) [podle 13,31,49].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/12697969a01f19df4531d4320dee00d4.jpg)
0 – dávku není nutno upravovat, ↓ – dávku snížit, SKr – sérový kreatinin, inf. – infuze, LMWH – nízkomolekulární heparin (low-molecular-weight heparin) Dalšího výzkumu je zapotřebí nejen k ověření optimální terapie, ale i k lepšímu pochopení patologických mechanizmů, které u CRI podporují rupturu aterosklerotických plátů, akcelerují aterosklerózu, vedou ke komplikacím u AKS a podporují vznik srdečního selhání a arytmií.
Nakonec nelze zcela vyloučit, že ani ty nejsofistikovanější a nejagresivnější nové léčebné postupy už nepovedou k dalšímu snížení mortality a KV komplikací. Tak se ukáže, že jedinou účinnou cestou bude nakonec cílená primární a sekundární prevence CKD.
Uzavíráme tuto kapitolu s tím, že nemocní s RI a AIM, mají podstatně horší krátkodobou (hospitalizační) i dlouhodobou prognózu, zvláště výrazné je to u nemocných v ESRD. Do jaké míry to souvisí pouze s podstatně méně častou reperfuzní léčbou, méně častým prováděním koronarografií a s omezeným podáváním standardně uznávaných kardiprotektiv (BB, ASA, ACE-I), bude nutno upřesnit cílenými studiemi. Na druhé straně i nemocní léčení primární PCI, která je považována za současnou nejmodernější léčbu AIM, mají oproti nemocným bez RI podstatně horší prognózu a totéž platí i o nemocných podstupujících bypassové operace. I když je zde řada nevyřešených otázek a problémů, nemůže to být důvodem k terapeutickému nihilizmu u nemocných s RI. Pokud je intervenční léčba indikována, nesmíme se jí vyhýbat, jen je nutno u všech pacientů provádět důslednou protekci KN, která je jednou z hlavních komplikací nepříznivě ovlivňujících prognózu (viz podrobně v další kapitole). A stejně tak je třeba aplikovat klasickou kardioprotektivní léčbu (především ASA, BB a statiny) pokud je indikována a pokud nejsou přítomny její kontraindikace.
Table 5. Randomizované dvojitě zaslepené, placebem kontrolované studie N-acetylcysteinu v prevenci kontrastové nefropatie. 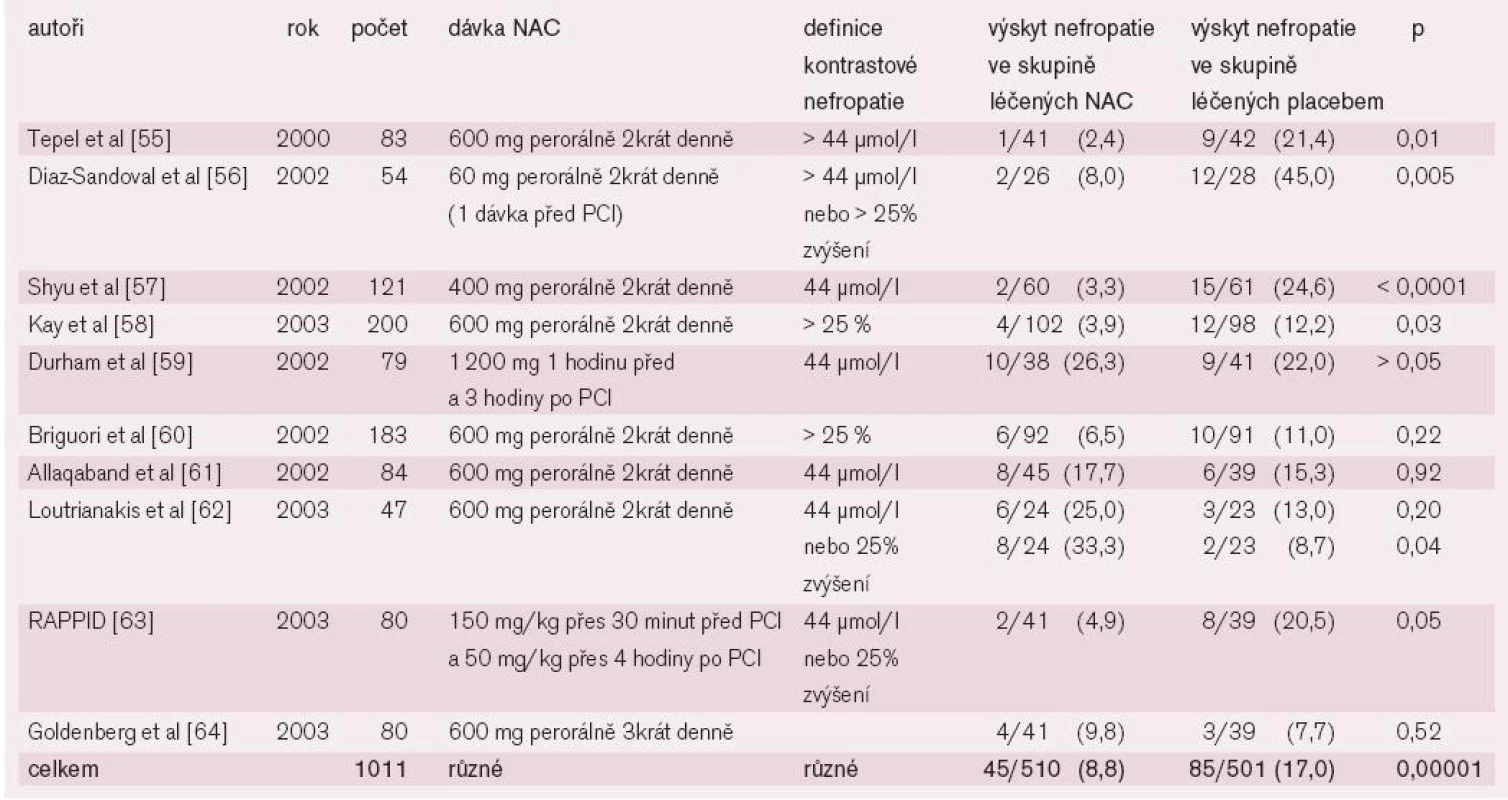
Graph 9. 2letá prognóza hemodializovaných nemocných léčených PCI. Randomizované srovnání nemocných léčených preventivně NAC v dávce 600 mg p.o. 2krát denně [98]. ![2letá prognóza hemodializovaných nemocných léčených PCI. Randomizované srovnání nemocných léčených preventivně NAC v dávce 600 mg p.o. 2krát denně [98].](https://pl-master.mdcdn.cz/media/image/710234cdcfe6e1c79695854bc7f37f5d.jpg?version=1537794572)
I když zatím postrádáme data z cílených randomizovaných studií, lze z dosavadních pozorování odvodit a shrnout současná doporučení pro léčbu AIM u nemocných s RI:
- Primární a akutní PCI zůstává základní doporučenou akutní reperfuzní metodou, pokud nemocní splňují indikační kritéria a neexistují kontraindikace nebo jiné důvody, proč tuto léčbu u nemocných s RI neprovádět.
- Trombolytická léčba zřejmě představuje relativně příznivou léčebnou alternativu při nedostupnosti časné primární PCI, především díky absenci rizika vzniku KN.
- Podání klopidogrelu je relativně bezpečné ve všech stadiích RI, aplikace LMWH (low-molecural-weight heparin) a antagonistů glykoproteinových receptorů IIb/IIIa, je bezproblémová u lehké a středně těžké RI (stadium 1-3), opatrnost je nutná u těžších RI (stadium 4,5).
- Podání základní kardioprotektivní léčby (ASA, BB a statinů) je plně indikováno. Při podání ACEI je zatím nutná opatrnost u těžších stadií RI.
- Provedení koronarografie by nemělo být opomíjeno v žádném stadiu RI, pokud předpokládáme možnost následné revaskularizace.
- Pokud je indikována revaskularizační léčba, jsou u lehkých a středně těžkých RI srovnatelné výsledky při léčbě prostřednictvím PCI a CABG. U těžkých RI (stadium 4 a 5) preferujeme CABG.
- U všech zákroků při nichž je diagnosticky (koronarografie) nebo terapeuticky použita kontrastní látka (KL) (primární nebo prostá PCI), provádíme důslednou a komplexní prevenci KN včetně podávání acetylcysteinu (viz následující kapitola).
- Při farmakoterapii pečlivě upravujeme dávkovací schéma podle farmakokinetiky každého léku, stupně RI i věku nemocných. Zvlášť důležité je to u nemocných ve stadiu ESRD.
- U všech léků, které ovlivňují srážení krve, je nutné cíleně sledovat možné krvácivé projevy.
- Vzhledem k tomu, že nemocní s RI (i v lehkém stadiu) mají i přes současnou optimální komplexní reperfuzní, revaskularizační i kardioprotektivní farmakoterapii podstatně horší prognózu než nemocní bez RI, je od počátku nutná trvalá spolupráce kardiologa a nefrologa od akutního stadia až po dispenzarizaci v poinfarktovém období.
Děkuji Daně Bábkové za neocenitelnou pomoc při přípravě a zpracování textu této práce.
Doručeno do redakce 31. 8. 2006
Přijato k otištění po recenzi 17. 11. 2006
doc. MUDr. Stanislav Janoušek, CSc.
Interní kardiologická klinika
LF MU a FN Brno, pracoviště Bohunice
stanislavjanousek@hotmail.com
Sources
1. Lewis CE, Jacobs DR Jr, McCreath H et al. Weight gain continues in the 1990s: 10-year trends in weight and overweight from the CARDIA study. Coronary Artery Risk Development in Young Adults. Am J Epidemiol 2000; 151 : 1172-1181.
2.Bakris GL, Williams M, Dworkin L et al. Preserving renal function in adults with hypertension and diabetes: A consensus approach. National Kidney Foundation Hypertension and Diabetes Executive Committees Working Group. Am J Kidney Dis 2000; 36 : 646-661.
3. McCullough PA. Cardiorenal risk: An important clinical intersection. Rev Cardiovasc Med 2002; 3 : 71-76.
4. Baigent C, Burbury K, Wheeler D. Premature cardiovascular disease in chronic renal failure. Lancet 2000; 356 : 147-152.
5. Soman SS, Sandberg KR, Borzak S et al. The independent association of renal dysfunction and arrhythmias in critically ill patients. Chest 2002; 122 : 669-677.
6. Wase A, Basit A, Nazir R et al. Does chronic renal insufficiency raise defibrillation threshold? Pacing Clin Electrophysiol 2002; 25(4): 594.
7. Herzog CA, Ma JZ, Collins AJ. Poor Long-Term Survival after Acute Myocardial Infarction among Patients on Long-Term Dialysis. N Engl J Med 1998; 339 : 799-805.
8. Gibson CM, Pinto DS, Murphy SA et al. Association of creatinine and creatinine clearance on presentation in acute myocardial infarction with subsequent mortality. J Am Coll Cardiol 2003; 42 : 1535-1543.
9. Wright RS, Reeder GS, Herzog CA et al. Acute Myocardial Infarction and Renal Dysfunction: A High-Risk Combination. Ann Intern Med 2002; 137 : 563-570.
10. Shlipak MG, Heidenreich PA, Noguchi H et al. Association of Renal Insufficiency with Treatment and Outcomes after Myocardial Infarction in Elderly Patients. Ann Intern Med 2002; 137 : 555-562.
11. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16 : 31-41.
12. Levey AS, Bosch JP, Lewis JB et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: A new prediction formula. Ann Intern Med 1999; 130 : 461-470.
13. National Kidney Foundation. Clinical Practice guidelines for chronic kidney disease: Evaluation, classification, and stratification. Am J Kidney Dis 2002; 2(Suppl 1): 1-266.
14. McCullough PA, Soman SS, Shah SS et al. Risks associated with renal dysfunction in patients in the coronary care unit. J Am Coll Cardiol 2000; 36 : 679-684.
15. Beattie JN, Soman SS, Sandberg KR et al. Determinants of mortality after myocardial infarction in patients with advanced renal dysfunction. Am J Kidney Dis 2001; 37 : 1191-1200.
16. Chertow GM, Lazarus JM, Christiansen CL et al. Preoperative renal risk stratification. Circulation 1997; 95 : 878-884.
17. Szczech LA, Best PJ, Crowley E, for the Bypass Angioplasty Revascularization Investigation (BARI) Investigators. Outcomes of patients with chronic renal insufficiency in the bypass angioplasty revascularization investigation. Circulation 2002; 105 : 2253-2258.
18. Chertow GM, Normand SLT, Silva LR, McNeil BJ. Survival after acute myocardial infarction in patients with end-stage renal disease: results from the Cooperative Cardiovascular Project. Am J Kidney Dis 2000; 35 : 1044-1051.
19. Walsh CR, O´Donnell CJ, Camargo Jr CA, Giugliano RP, Lloyd-Jones M. Elevated serum creatinine is associated with 1-year mortality after acute myocardial infarction. Am Heart J 2002; 144 : 1003-1011.
20. Anavekar NS, McMurray JJ, Velazquez EJ et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004; 351 : 1285-1295.
21. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351 : 1296-1305.
22. Wison S, Foo K, Cunningham J et al. Renal function and risk stratification in acute coronary syndromes. Am J Cardiol 2003; 91 : 1051-1054.
23. Naidu SS, Selzer F, Jacobs A et al. Renal insufficiency is an independent predictor of mortality after percutaneous coronary intervention. Am J Cardiol 2003; 92 : 1160-1164.
24. Gruberg L, Weissman NJ, Pichard AD et al. Impact of renal function on morbidity and mortality after percutaneous aortocoronary saphenous vein graft intervention. Am Heart J 2003; 145 : 529-534.
25. McCullogh PA. Why is chronic kidney disease the “spoiler” for cardiovascular outcomes? J Am Coll Cardiol 2003; 41 : 725-728.
12 McCullough PA, Manley HJ. Prediction and prevention of contrast nephropathy. J Interv Cardiol 2001; 14 : 547-558.
26. Friedman AN, Bostom AG, Selhub J et al. The kidney and homocysteine metabolism. J Am Soc Nephrol 2001; 12 : 2181-2189.
27. O´Hare AM, Glidden V, Fox CS, Hsu C. High prevalence of peripheral arterial disease in persons with renal insufficiency. Results from the national health and nutrition examination survey 1999-2000. Circulation 2004; 109 : 320-323.
28. Chertow GM, Burke SK, Raggi P for the Treat o Goal Working Group. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney Int 2002; 62 : 245-252.
29. Popowska-Drojecka J, Muszytowski M, Sobilo-Jarek L, Majewska A. Increased serum levels of troponin I and lesions in coronary angiography in hemodialysed patients. Rocz Akad Med Bialymst 2005; 50 : 311-313.
30. Silverberg DS, Wexler D, Sheps D et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneous erythropoietin and intravenous iron: A randomized controlled study. J Am Coll Cardiol 2001; 37 : 1775-1780.
31. Gurm HS, Lincoff M, Kleiman NS et al. Double Jeopardy of Renal Insufficiency and Anemia in Patients Undergoing Percutaneous Coronary Interventions. Am J Cardiol 2004; 94 : 30-34.
32. Gurm HS, Gupta R, Lauer MS, Raymond R, Ellis SG. Haemoglobin level is an independent predictor of mortality in patients undergoing percutaneous coronary artery intervention. J Am Coll Cardiol 2003; 41 : 4A.
33. Sica D. The implications of renal impairment among patients undergoing percutaneous coronary intervention. J Invasive Cardiol 2002; 14(Suppl B): 30-37.
34. Marenzi G, Lauri G, Assanelli E et al. Contrast-induced nephropathy in patients undergoing primary angioplasty for acute myocardial infarction. J Am Coll Cardiol; 2004; 44 : 1780-1785.
35. Jain P, Massie BM, Gattis WA et al. Current medical treatment for the exacerbation of chronic heart failure resulting in hospitalization. Am Heart J 2003; 145(Suppl 2): 3-17.
36. Masoudi FA, Plomondon ME, Magid DJ, Sales A, Rumsfeld JS. Renal insufficiency and mortality from acute coronary syndromes. Am Heart J 2004; 147 : 623-629.
37. Menon V, Sarnak MJ, Lessard D, Goldberg RJ. Recent trends in hospital management practices and prognosis after acute myocardial infarction in patients with kidney disease. Am J Cardiol 2004; 94 : 1290-1293.
38. Berger AK, Duval S, Krumholz HM. Aspirin, beta-blocker, angiotensin-converting enzyme inhibitor therapy in patients with end-stage renal diseases and an acute myocardial infarction. J Am Coll Cardiol 2003; 42 : 201-208.
39. McCullough PA, Sandberg KR, Borzak S et al. Benefits of aspirin and beta-blockade after myocardial infarction in patients with chronic kidney disease. Am Heart J 2002; 144 : 226-232.
40. Yamaguchi J, Kasanuki H, Ishii Y et al for the HIJC Study Group. Prognostic significance of serum creatinine concentration for in-hospital mortality in patients with acute myocardial infarction who underwent successful primary percutaneous coronary intervention (from the Heart Institute of Japan Acute Myocardial Infarction (HIJAMI) Registry). Am J Cardiol 2004; 93 : 1526-1528.
41 Kan CD, Yang YJ. Coronary artery bypass grafting in patients with dialysis-dependent renal failure. Tex Heart Inst J 2004; 31 : 224-230.
42. Reddan DN, Szczech LA, Tuttle RH et al. Chronic kidney disease, mortality and treatment strategies among patients with clinically significant coronary artery disease. J am Soc Nephrol 2003; 14 : 2373-2380.
43. Sadeghi HM, Stone GW, Grines CL et al. Impact of Renal Insufficiency in Patients Undergoing Primary Angioplasty for Acute Myocardial Infarction .Circulation 2003; 108 : 2769-2775.
44. Halkin A, Singh M, Nikolsky E et al .Prediction of mortality after primary percutaneous coronary intervention for acute myocardial infarction: the CADILLAC risk score. J Am Coll Cardiol 2005; 45 : 1397-1405.
45. McCullough PA, Wolyn R, Rocher LL et al. Acute renal failure after coronary intervention: Incidence, risk factors, and relationship to mortality. Am J Med 1997; 103 : 368-375.
46. Rihal CS, Textor SC, Grill DE et al. Incidence and prognostic importance of acute renal failure after percutaneous coronary intervention. Circulation 2002; 105 : 2259-2264.
47. Dragu R, Behar S, Sandach A et al. Should primary percutaneous coronary intervention be preferred method of reperfusion therapy for patients with renal failure and ST-elevation acute myocardial infarction? Am J Cardiol 2006; 97 : 1142-1145.
48. Mann JF, Gerstein HC, Pogue J et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001; 134 : 629-636.
49. Reddan DN, Szczech L, Bhapkar MV et al. Renal function, concomitant medication use and outcomes following acute coronary syndromes. Nephrol Dial Transplant 2005; 20 : 2105-2112.
50. Phillips DR, Scarborough RM. Clinical pharmacology of eptifibate. Am J Cardiol 1997; 80(4A): 11B-20B.
51. Hirsh J, Warkentin TE, Raschke R et al. Heparin and low-molecular-weight heparin: mechanism of action, pharmacokinetics, dosing considerations, monitoring. Efficacy and safety. Chest 1998; 114(Suppl 5): 489-510.
52. Bruno R, Baille P, Retout S et al. Population pharmacokinetics
and pharmacodynamics of enoxaparin in unstable angina and non-ST-segment elevation myocardial infarction. J Clin Pharmacol 2003; 56 : 407–414.
53. Risler T et al. Therapie-schemata. Nephrologie. München:
Urban und Schwarzenberg 1993.
54. Wyatt CM, Kim MC, Winston JA. Therapy insight: How
changes in renal function with increasing age affect cardiovascular drug prescribing. Nat Clin Pract Cardiovasc Med 2006; 3 : 102–109.
55. Tepel M, van der Giet M, Schwarzfield C et al. Prevention of radiographic-contrast-agent-induced reductions in renal function by acetylcysteine. N Engl J Med 2000; 343 : 180-184.
56. Diaz-Sandoval LJ, Kosowsky BD, Losordo DW. Acetylcysteine to prevent angiography-related renal tissue injury (the APART trial). Am J Cardiol 2002; 89 : 356–358.
57. Shyu KG, Cheng JJ, Kuan P. Acetylcysteine protects against acute renal damage in patients with abnormal renal function undergoing a coronary procedure. J Am Coll Cardiol 2002; 40 : 1383–1388.
58. Kay J, Chow WH, Chan TM et al. Acetylcysteine for prevention of acute deterioration of renal function following elective coronary angiography and intervention: A randomized controlled trial. JAMA 2003; 289 : 553–558.
59. Durham JD, Caputo C, Dokko J et al. A randomized controlled trial of N-acetylcysteine to prevent contrast nephropathy in cardiac angiography. Kidney Int 2002; 62 : 2202–2207.
60. Briguori C, Manganelli F, Scarpato P et al. Acetylcysteine and contrast agent-associated nephrotoxicity. J Am Coll Cardiol 2002; 40 : 298–303.
61. Allaqaband S, Tumuluri R, Malik AM et al. Prospective randomized study of N-acetylcysteine, fenoldopam, and saline for prevention of radiocontrast-induced nephropathy. Catheter Cardiovasc Interv 2002; 57 : 279–283.
62. Loutrianakis E, Stella D, Hussain A et al. Randomized comparison of fenoldopam and N-acetylcysteine to saline in the prevention of radiocontrast nephropathy. J Am Coll Cardiol 2003; 41 : 327A.
63. Baker CS, Wragg A, Kumar S et al. A rapid protocol for the prevention of contrast-induced renal dysfunction (RAPPID Study). J Am Coll Cardiol 2003; 41 : 39A.
64. Goldenberg I, Jonas M, Matetzki S et al. Contrast-associated nephropathy and clinical outcome of patients with chronic renal insufficiency undergoing cardiac catheterization: Lack of additive benefit of acetylcysteine to saline infusion. J Am Coll Cardiol 2003; 41 : 537A.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2007 Issue 1
Most read in this issue- Kardiostimulace u fibrilace síní
- Infarkt pravé komory
- Výhody fixní kombinační léčby
- Je možné perforaci pravé srdeční komory při implantaci ICD řešit konzervativně? Kazuistika.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

