-
Medical journals
- Career
Akustická denzitometrie a hibernovaný myokard
Authors: R. Panovský; V. Kincl; J. Meluzín
Authors‘ workplace: LF MU a FN U sv. Anny, Brno ; I. interní kardioangiologická klinika
Published in: Kardiol Rev Int Med 2007, 9(1): 6-11
Category: Editorial
Overview
Článek je zaměřen na akustickou denzitometrii a její využití v diagnostice hibernovaného myokardu. Shrnuje dosud dostupná fakta o této metodě a o viabilitě myokardu a zmiňuje i zkušeností autorů. V článku jsou v uvedeny výhody a nevýhody denzitometrie ve srovnání s běžnými metodami vyšetřování viability myokardu.
Klíčová slova:
Ischemická choroba srdeční - Akustická denzitometrie – Viabilní myokardAkustická denzitometrie
Konvenční echokardiografie je jednou z nejpřínosnějších neinvazivních metod v diagnostice kardiálních onemocnění. Je založena na odrazu ultrazvukového vlnění od rozhraní tkání s rozdílnou akustickou impedancí. Lze ji využít k hodnocení srdeční anatomie i funkce – pomocí dvourozměrné echokardiografie se zobrazí endokard, epikard a chlopenní struktury. Z těchto zobrazení lze získat informace o velikosti srdečních oddílů, tloušťce a ztlušťování stěn komor a dalších strukturách. Dopplerovské vyšetření navíc přináší možnost měření tlaků, tlakových gradientů a velikosti chlopenních ústí.
Nicméně, konvenční echokardiografické vyšetření neumožňuje získat informace o vnitřní struktuře myokardu. K tomuto účelu se jsou vyvíjeny echokardiografické metody a techniky, které se zakládají na principu takzvaného zpětného rozptylu (backscatter) [1]. Ultrazvukový rozptyl vznikne, pokud rozhraní (částice uvnitř srdečního svalu - například myocyt, krevní elementy apod.), je menší než vlnová délka ultrazvukového vlnění, které na něj dopadá. Energie tohoto vlnění je v myokardu rozptýlena všemi směry v závislosti na počtu, velikosti, prostorové orientaci a charakteru částic. Jako „zpětný rozptyl“ (nebo také energie zpětného rozptylu/backscattered energy) se označuje ta část rozptylu, která se vrací pod úhlem 180° zpět k sondě. Při konvenčním vyšetření je zpětný rozptyl odfiltrován a jsou zobrazeny pouze zrcadlové odrazy (specular echo) od velkých rozhraní. Ultrazvuková charakteristika tkání naopak využívá právě měření intenzity zpětného rozptylu [2].
Ultrazvuková tkáňová charakteristika je relativně nová metoda. První výzkumné práce se objevily přibližně v polovině 80. let 20. století. Je založena na hypotéze, že patologické procesy v srdečním svalu vedou ke změně fyzikálních vlastností tkáně, včetně akustických parametrů. Tato metoda je schopna podat informaci nejenom o strukturálním, ale i funkčním stavu srdečního svalu, například o kontraktilitě myokardu stěn levé komory nezávisle na jejich kinetice.
Nejčastěji využívaným parametrem akustické denzitometrie je takzvaný integrovaný zpětný rozptyl (integrated backscatter – IBS) [3]. Je to průměrná energie v celém frekvenčním rozsahu zpětně rozptýleného ultrazvukového vlnění. Hodnota IBS se udává v decibelech (dB) a lze ji získat z libovolného myokardiálního segmentu, stačí vyznačit oblast zájmu (region of interest – ROI). Dalším důležitým parametrem je cyklické kolísání zpětného rozptylu (cyclic variation of integrated backscatter – CVIB) a jeho maximální amplituda [4]. Fyziologická kontrakce a relaxace myokardu je provázena pravidelným kolísáním IBS – v parasternální dlouhé ose s maximem na konci diastoly a minimem na konci systoly [5], z apikálních projekcí naopak s maximem na konci systoly (obr. 1) [6-8].
Image 1. Ukázka křivky kolísání IBS a měření amplitudy CVIB. 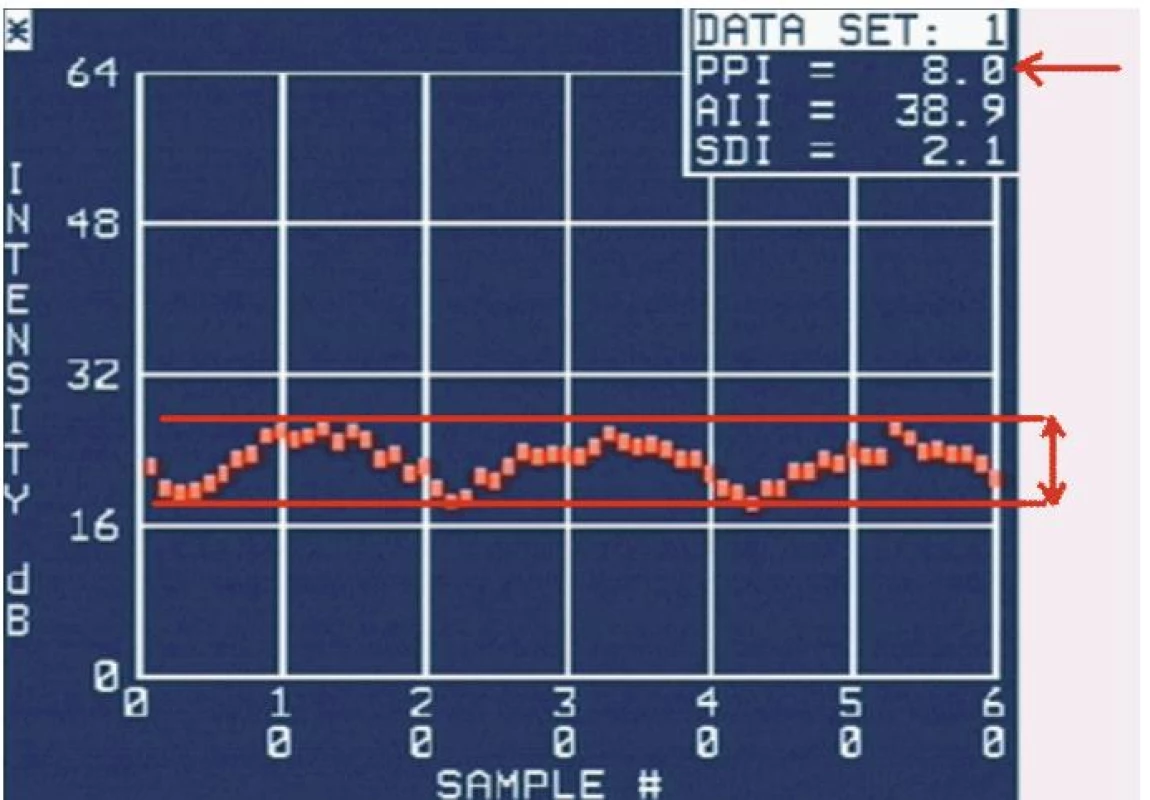
Červené čáry a šipky ukazují princip měření amplitudy CVIB a automaticky vyhodnocenou amplitudu CVIB. Normální hodnoty IBS prakticky nelze stanovit, protože do značné míry závisejí na nastavení přístroje (system gain, time-gain compensation, lateral gain compensation, compression, pre-processing, post-processing, persistence, focus, frame rate apod), individuálním habitu a intratorakálních poměrech [9]. Lze jej proto využít jen k případnému dlouhodobému sledování téhož pacienta, za předpokladu, že se zachová zcela identické nastavení ultrazvukového přístroje. Toto omezení se pravděpodobně netýká měření amplitudy CVIB, u kterého absolutní hodnoty nejsou důležité a hodnotí se rozdíl mezi maximální a minimální hodnotou IBS během cyklu, jenž je na výše uvedených skutečnostech nezávislý [10].
Akustická denzitometrie dokáže rozlišit normální a patologický myokard. Typickou reakcí na většinu patologií myokardu je zvýšení IBS a snížení CVIB ve srovnání se zdravým myokardem. Z předchozích prací vyplývá, že hlavní determinantou IBS je obsah kolagenu v srdečním svalu [11,12]. Sledování změn IBS a CVIB lze využít v diagnostice u řady patologických stavů. Amplituda CVIB odráží akustické vlastnosti myokardu. Je snížená například v jizvě po infarktu myokardu, při akutní ischemii [13], akutním infarktu myokardu [14], při fibróze myokardu z nejrůznějších důvodů, u kardiomyopatií – dilatační [15], hypertrofické [16], diabetické [17], po chemoterapii doxorubicinem [18], u hemodialyzovaných nemocných [19], při amyloidóze [20], progresivní systémové skleróze [21] a při myokarditidě. Sledování amplitudy CVIB lze využít k diagnostice a hodnocení rejekce alograftu po transplantaci srdce [22] a úspěšnosti antirejekční terapie [23]. Rovněž lze předpovědět reverzibilitu remodelace levé komory nemocných s chlopenní vadou [24]. Další práce zkoumají využití ultrazvukové charakteristiky tkání v diagnostice intrakardiálních tumorů a trombů [25], spontánního echokontrastu [26], respektive k popisu aterosklerotického plátu [27].
Hibernovaný myokard
Rozsah postižení věnčitých tepen koronární aterosklerózou a funkce levé komory jsou základní faktory, které ovlivňují prognózu u pacientů s ischemickou chorobou srdeční (ICHS). Při nálezu významně zhoršené funkce levé komory je pro posouzení prognózy i pro rozhodnutí o případné revaskularizaci myokardu velmi důležité správné posouzení funkčního stavu myokardu. Abnormální kontrakce myokardiálních segmentů (hypokineze, akineze nebo dyskineze) může být projevem ireverzibilní dysfunkce v důsledku fibrózy myokardu např. u poinfarktové jizvy. Významná část těchto segmentů má ale zachovalou metabolickou aktivitu myokardu a po případné revaskularizaci myokardu se jejich systolická i diastolická funkce upraví. Jedná se o hibernovaný myokard, kde jeho dysfunkce vzniká v důsledku opakovaných atak ischemií nebo downregulací kontraktilní funkce při chronické ischemii způsobené hypoperfuze postižené oblasti myokardu. Rozsah viabilního (dysfunkčního, ale živého) myokardu příznivě ovlivňuje perioperační i dlouhodobou prognózu, výskyt kardiálních symptomů, pracovní toleranci a kvalitu života po revaskularizaci. U pacientů bez revaskularizace představuje naopak nezávislý rizikový faktor vyšší mortality.
K odlišení viabilního myokardu od oblastí ireverzibilních změn lze použít řadu metod. Některé z nich hodnotí kontraktilní rezervu po artificiální stimulaci kontrakce, jiné popisují úroveň perfuze, metabolický stav myokardu, respektive integritu membrán myocytů těchto segmentů. Zátěžová echokardiografie s malými dávkami dobutaminu nebo s dipyridamolem prokazuje s vysokou spolehlivostí kontraktilní rezervu. Lze využít i nukleární metody – thaliovou scintigrafii a techneciovou fotonovou emisní tomografii nebo pozitronovou emisní tomografii, která prokazuje zachovalý metabolizmus myokardiálních buněk v oblastech se sníženou perfuzí.
Všechny výše uvedené metody dosahují poměrně slušné senzitivity k průkazu viabilního myokardu [28,29]. Vykazují však horší specificitu a mají i další nevýhody. Za zlatý standard v detekci viabilního myokardu je dnes považována pozitronová emisní tomografie (senzitivita kolem 80-96 %, specificita 54-75 %), která je však velmi drahá a pro běžnou kardiologickou praxi málo dostupná. Thaliová scintigrafie a dobutaminová echokardiografie mají podobnou senzitivitu (61-97 %), ale specificita echokardiografie je lepší (73-95 % versus 36-70 %). Výhodou dobutaminové echokardiografie je navíc nižší cena, menší časová náročnost a větší dostupnost. Nevýhodou je subjektivní a pouze semikvantitativní hodnocení a falešně negativní výsledky při těžké poruše perfuze dysfunkčního myokardu, neboť i malá dávka dobutaminu může v takové tkáni vyvolat ischemii bez zlepšení stažlivosti, přestože je myokard viabilní. V takových případech jsou naopak výhodnější radioizotopové metody. Limitací echokardiografických metod je dále horší zobrazitelnost všech myokardiálních segmentů u 15-20 % pacientů. K nevýhodám popsaných metod je nutno kromě falešně pozitivních a negativních výsledků počítat i radiační zátěž (i když relativně malou) radioizotopových metod a potenciální proarytmogenní účinek infuze dobutaminu.
Vzhledem k limitacím výše uvedených metod a enormní důležitosti znalosti viability myokardu jsou zkoumány i nové metody, např. různé techniky magnetické rezonance [30], tkáňové Dopplerovské zobrazení [31], kontrastní echokardiografie [32] a ultrazvuková charakteristika tkání.
Akustická denzitometrie v diagnostice hibernovaného myokardu
Využití akustické denzitometrie v diagnostice viability myokardu vychází z faktu, že vztah mezi ztlušťováním myokardu a CVIB není lineární. Kolísání IBS závisí více na intramurální kontraktilitě [12] než na vlastním viditelném ztlušťování myokardu. Omráčený myokard tedy vykazuje normální kolísání CVIB i při nálezu těžké poruchy kinetiky [33,34].
První práce zkoumající využití ultrazvukové charakteristiky tkání k rozlišení zdravého a ischemického myokardu od jizevnaté tkáně se objevovaly od roku 1989. Postupně bylo ověřeno, že se cyklické kolísání IBS po reperfuzi upravuje dříve než ztlušťování myokardu [35] a nemocní s časně zprůchodněnou infarktovou tepnou mají v jejím povodí vyšší hodnoty CVIB než pacienti s tepnou uzavřenou, a to nezávisle na kontraktilitě daného segmentu [36].
Na základě těchto pozorování bylo navrženo využití akustické denzitometrie v diagnostice viability myokardu a následně byly provedeny úspěšné experimenty na zvířecích modelech, při kterých se dařilo pomocí hodnot IBS a CVIB rozlišit viabilní a neviabilní myokard [37,38]. Od roku 1996 se již výzkum zaměřil na pacienty s dysfunkcí levé komory. Výsledky byly nadějné, avšak většina prací se potýkala s různými problémy. Jednalo se o studie s malým počtem nemocných, studie měly rozdílné metodiky akustické denzitometrie a často byly omezeny jen na parasternální projekce [34,39-41].
Následující větší práce byly proto zaměřeny na hledání ideální metodiky a určení hraniční hodnoty CVIB pro diagnostiku viability. Lin et al vyšetřili 30 pacientů týden po akutním infarktu myokardu pomocí dobutaminové echokardiografie a akustické denzitometrie [42]. U hraniční hodnoty CVIB k průkazu viability 5,8 dB měli senzitivitu 75 % a specificitu 100 %. Měření prováděli pouze z parasternální krátké osy, amplitudu CVIB přepočítávali dle fáze srdečního cyklu (PWV – phase-weighted variation). Nedostatkem bylo, že vyšetření s dobutaminem bylo považováno za referenční metodu a že chybělo následné sledování vývoje kontraktility.
Stejní autoři provedli u 103 pacientů měření CVIB pouze z parasternální projekce v krátké ose [43]. Při měření maximální amplitudy CVIB brali do úvahy takzvaný časový posun (time-delay). Tímto parametrem se popisuje stupeň asynchronie mezi kolísáním zpětného backscatteru a elektromechanickou kontrakcí. Time-delay je počítán z časového intervalu mezi R kmitem na EKG a nejhlubším místem křivky IBS. Tento časový údaj se následně dělí délkou QT intervalu. V případě velkého časového posunu (více než 1,2) se hodnota amplitudy CVIB hodnotí jako záporná, což významně změní výslednou průměrnou hodnotu CVIB od více pacientů. Za použití této metodiky spočítali s využitím ROC křivek hraniční hodnotu pro diagnostiku viability 1,4 dB.
Honma et al u 30 pacientů vyšetřili 37 dysfunkčních myokardiálních segmentů [44]. Všichni pacienti měli následně provedenu PTCA na tepně zásobující dysfunkční myokard a za 10 měsíců poté kontrolní echokardiografické vyšetření regionální kontraktility. Pomocí ROC křivky spočítali hraniční hodnotu CVIB pro diagnostiku viability myokardu 3,1 dB. Měření prováděli pouze z parasternálních projekcí, hraniční hodnotu nepočítali pro jednotlivé segmenty zvlášť a měřili fázově korigovanou amplitudu CVIB.
V roce 2002 prokázali Yuda et al, že pomocí amplitudy CVIB lze předpovědět koronární rezervu a rozlišit mezi viabilním dysfunkčním a neviabilním myokardem u 27 pacientů s chronickou dysfunkcí levé komory ischemické geneze [8]. Vyšetřovali celkem 194 segmentů z apikálních projekcí. Při použití hranice CVIB 5,3 dB měli 85% úspěšnost předpovědi zlepšení kontraktility. Hodnotu CVIB určovali z rozdílu mezi maximální a minimální hodnotou IBS nezávisle na fázi srdečního cyklu.
V zatím největší práci jsme na souboru 54 nemocných (celkem 576 dysfunkčních segmentů) prokázali, že se hodnoty amplitudy CVIB získané z dysfunkčních myokardiálních segmentů nemocných s chronickou ischemickou chorobou srdeční statisticky významně liší podle toho, zda se jedná o segmenty s viabilním nebo ireverzibilně postiženým myokardem (obr. 2, 3) [45]. CVIB jsme měřili ze všech myokardiálních segmentů. Měřili jsme je také jako rozdíly mezi maximálními a minimálními hodnotami IBS nezávisle na fázi srdečního cyklu. Optimální hraniční hodnoty CVIB dle ROC křivek byly z parasternální projekce v dlouhé ose pro anteroseptální segmenty a zadní stěnu 4,1 a 4,3 dB. Z apikálních projekcí pro interventrikulární septum, laterální stěnu, dolní stěnu, přední stěnu a apikální segmenty byly optimální hraniční hodnoty 4,4; 4,2; 4,5; 4,0 a 4,2 dB. Při užití těchto hraničních hodnot bylo dosaženo senzitivity a specificity měření CVIB pro průkaz viability myokardu 90,8 % a 81,3 %.
Image 2. Ukázka kolísání IBS z ireverzibilně postiženého dysfunkčního myokardiálního segmentu. 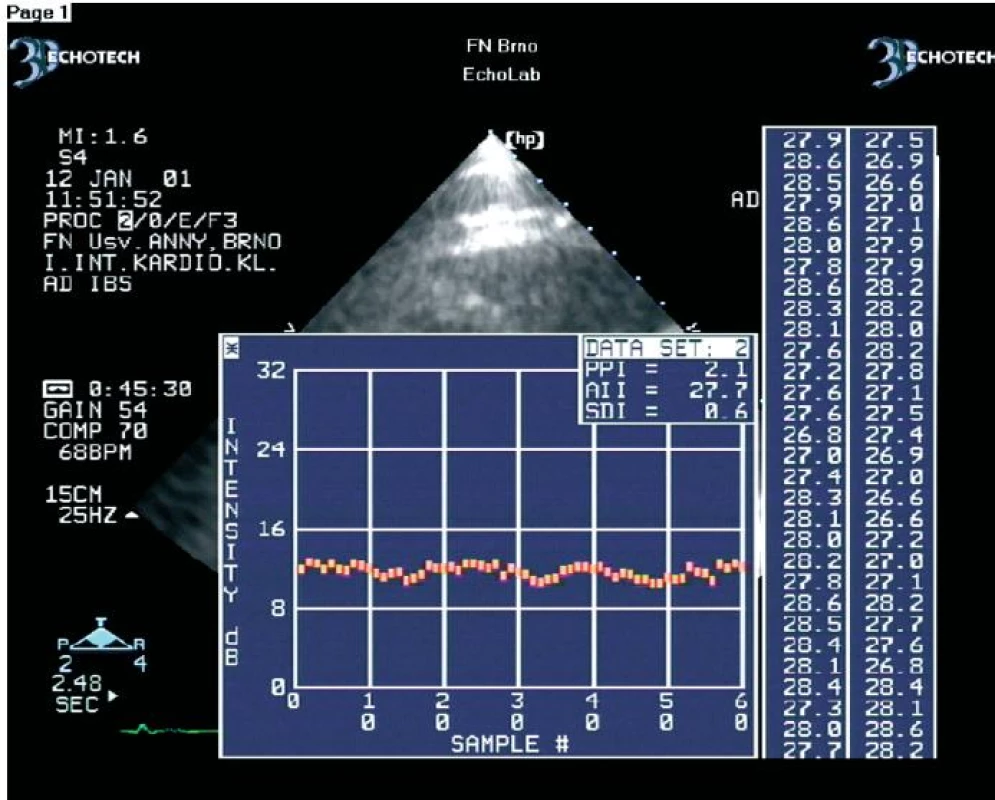
Image 3. Ukázka kolísání IBS z dysfunkčního, ale viabilního myokardiálního segmentu. 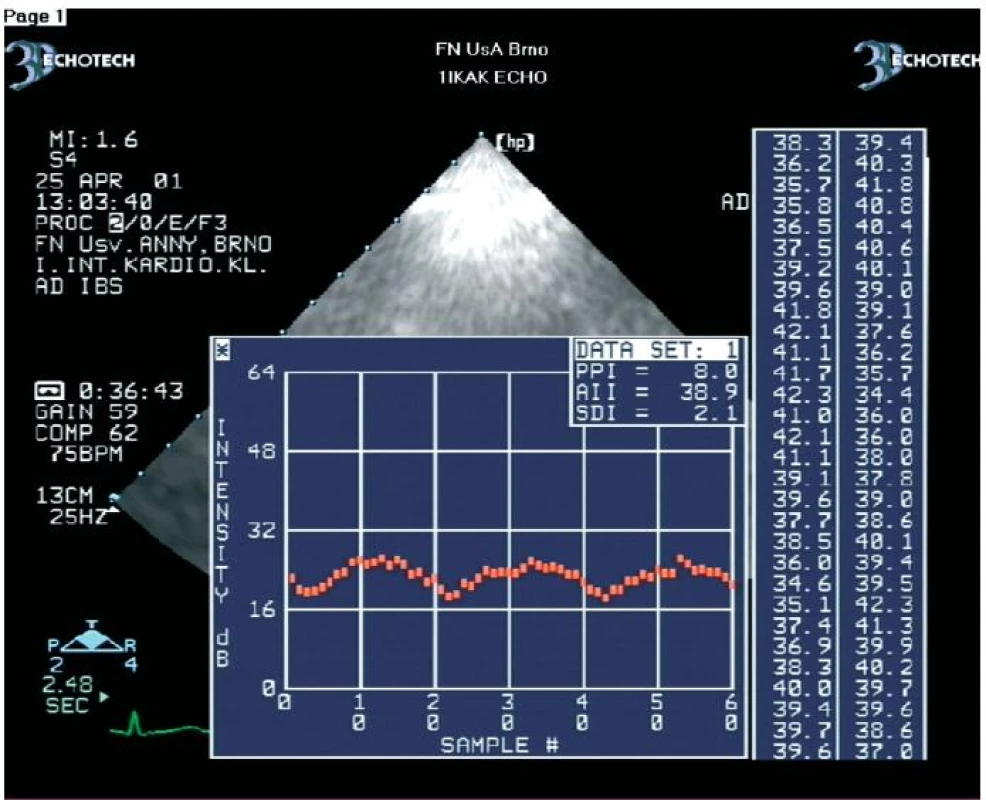
Srovnání akustické denzitometrie a dobutaminové echokardiografie v diagnostice viability myokardu
Bylo provedeno několik studií srovnávajících hodnocení viability akustickou denzitometrií s jinými běžnými metodami diagnostiky viability, nejčastěji se zátěžovou dobutaminovou echokardiografií. I v těchto studiích platí stejná omezení jako ve výše uvedených: většinou malý počet nemocných, rozdílné metodiky akustické denzitometrie a omezení jen na parasternální projekce.
Pasquet se spolupracovníky v roce 1998 zkoumali využití CVIB v diagnostice inotropní rezervy u 15 pacientů s ischemickou dysfunkcí LK [46]. Hodnoty CVIB z přední a diafragmatické stěny levé komory získané pomocí transezofageální echokardiografie srovnávali s reakcí dysfunkčních segmentů na malé dávky dobutaminu při transthorakálním vyšetření a našli významnou korelaci mezi oběma metodami. Podobných výsledků dosáhli i Muro et al, kteří porovnávali měření CVIB s dobutaminovou echokardiografií u dysfunkčních segmentů z parasternální projekce v dlouhé ose u 23 pacientů s ICHS [47]. CVIB hodnotili jako rozdíl mezi maximální a minimální hodnotou IBS během cyklu a při určené hraniční hodnotě CVIB 3,0 dB měli senzitivitu 81 % a specificitu 60 %. Hlavním nedostatkem těchto prací je absence kontroly kontraktility po revaskularizaci; zátěžová echokardiografie byla brána jako referenční metoda.
V jiné práci Castaldo et al opakovaně měřili CVIB u 12 pacientů těsně po akutním infarktu myokardu a po revaskularizaci [48]. Na začátku všem provedli i vyšetření viability dobutaminovou echokardiografií. Segmenty, které se po revaskularizaci ukázaly být viabilní, měly před zákrokem průměrnou hodnotu amplitudy CVIB 6,5 dB, zatímco neviabilní segmenty jen 3,2 dB. Pozitivní předpovědní hodnota CVIB a zátěžové echokardiografie pro diagnostiku viability byla 83 % a 72 %. Shoda mezi oběma metodami byla v 77 % původně dysfunkčních segmentů.
Již citovaní Lin et al vyšetřili 144 dysfunkčních segmentů na průkaz viability zároveň dobutaminovou echokardiografií, scintigrafií a akustickou denzitometrií [43]. Při použití hraniční hodnoty CVIB 1,4dB dosáhli ve srovnání s dobutaminovou echokardiografií a nukleárním vyšetřením senzitivitu CVIB v rozmezí 75-84 % a specificitu 73-76 %. Časově korigované CVIB měřili pouze z parasternální projekce v krátké ose. Velkým nedostatkem citované práce je absence kontroly kontraktility po případné revaskularizaci.
Honma et al porovnávali diagnostiku viability pomocí dobutaminové echokardiografie, měření CVIB v klidu a měření CVIB při dobutaminu [44]. Amplituda CVIB měřená v klidu měla ve srovnání s dobutaminovou echokardiografií vyšší senzitivitu (92 % versus 79 %) a přibližně stejnou specificitu (83 % versus 84 %) v predikci zlepšení regionální kontraktility po PTCA. V podskupině pacientů s EF LK pod 40 % byla senzitivita CVIB dokonce 100 %. Naopak pomocí měření CVIB při dobutaminu bylo dosaženo výrazně horších výsledků. Výsledků bylo dosaženo při hraniční hodnotě fázově korigované amplitudy CVIB 3,1 dB pouze pro parasternální projekce. Se stejnými limitacemi vyšetřili Lin et al 30 pacientů týden po akutním infarktu myokardu pomocí dobutaminové echokardiografie a akustické denzitometrie [42]. U hraniční hodnoty CVIB k průkazu viability 5,8 dB měli senzitivitu 75 % a specificitu 100 %.
Vzhledem k limitacím výše uvedených studií jsme porovnali akustickou denzitometrii a dobutaminovou echokardiografii [49]. Vyšetřili jsme 354 dysfunkčních segmentů u 34 nemocných před revaskularizační operací. Vyšetření akustickou denzitometrií bylo provedeno ze všech projekcí, a to podle výše uvedených hraničních hodnot. Akustická denzitometrie měla ve srovnání se zátěžovou echokardiografií nevýznamně lepší senzitivitu (90 % versus 83 %; p = NS) a horší specificitu (77 % versus 81 %; p = NS) v diagnostice viabilního myokardu (graf 1).
Graph 1. Srovnání senzitivity, specificity, pozitivní (PPH) a negativní předpovědní hodnoty (NPH) akustické densitometrie (AD) a dobutaminové echokardiografie (DE) v diagnostice viability myokardu. 
Výhody a nevýhody akustické denzitometrie
Nespornou výhodou akustické denzitometrie je její neinvazivnost. Na rozdíl od dobutaminové echokardiografie nejsou pacienti vystaveni riziku arytmií. Oproti nukleárním metodám je její předností nulová radiační zátěž a výrazná časová úspora. Díky tomu je použitelná i pro nestabilní pacienty, kde nelze uvažovat o jiné metodě [2].
K výhodám je třeba počítat i fakt, že na rozdíl od subjektivního hodnocení kontraktility myokardiálních segmentů při dobutaminové echokardiografii je měření CVB objektivní metoda a pravděpodobně umožňuje i částečnou kvantifikaci myokardiálního postižení.
Většina dosud provedených prací zkoumajících využití měření CVIB v diagnostice různých patologií myokardu dosáhla velmi nadějných a dobrých výsledků. Přesto má tato metoda několik nevyřešených problémů.
Již z výše uvedených rozvah vyplývá, že je to absence standardů v získávání a zpracování dat. Prakticky každý autor využívá svoji metodiku, a tudíž dochází k výsledkům, které potom nelze s ostatními srovnávat. Snad nejvíce se to týká vlastní definice a měření amplitudy CVIB, kde se dají vytušit zastánci 2 těžko slučitelných názorů. Příznivci striktního měření systolicko-diastolického rozdílu CVIB (respektive korigování amplitudy CVIB podle time-delay) dosahují výsledků prakticky jen v segmentech, kde lze zajistit kolmý dopad UZ paprsku na svalová vlákna myokardu, tedy v parasternálních projekcích. Argumentují tím, že ischemie nebo jiná patologie mění akustické vlastnosti tkáně a působí časový posun kontrakce a že opomenutí tohoto posunu může způsobit zkreslení výsledků. Naproti tomu měření prostého rozdílu mezi maximální a minimální hodnotou IBS nezávisle na fázi srdečního cyklu umožňuje změřit CVIB ze všech segmentů a projekcí [50,51]. Velkou výhodou tohoto postupu je omezení časové náročnosti analýzy a lepší použitelnost techniky pro běžnou praxi [52]. Software na našem přístroji neumožňoval zcela přesné měření časového posunu. Na našem pracovišti hodnotíme CVIB jako prostý rozdíl mezi maximální a minimální hodnotou IBS i z toho důvodu, že by další ztížení již poměrně časově náročného měření znemožnilo praktické využití této metody.
Problémy jsou i s přesností dat, většina prací vykazuje poměrně velkou variabilitu mezi hodnotami získanými různými vyšetřujícími a hodnotami získanými v rámci opakovaných vyšetření pacienta stejným vyšetřujícím [9,53]. Je jisté, že je nutná určitá zběhlost vyšetřujícího, že je zapotřebí se techniku metody naučit [8]. Jde zejména o manuální posun ROI, kde může velmi snadno dojít k chybě – například jakýkoliv, i sebemenší, kontakt s epikardem nebo endokardem způsobí výrazné falešné zvýšení amplitudy CVIB. Poměrně hodně diskuzí a úvah se týká anizotropie. Ta je definována jako závislost měření IBS na úhlu, který svírá UZ paprsek a svalové vlákno [54,55]. Pro mnoho studií byla anizotropie jedním z důvodů, proč byly hodnoceny jen některé segmenty. A je to jedno z vysvětlení skutečnosti, že stejný myokardiální segment má různé hodnoty IBS při vyšetření z různých projekcí [7] a anizotropie je zřejmě i příčinou poměrně velkých standardních odchylek některých prací [56,57].
Jako u každé echokardiografické metody je i u akustické denzitometrie kvalita získaných informací dána kvalitou zobrazení. V našich pracích byla dobrá vyšetřitelnost vstupním kritériem. I jiné práce poukazují na využití této metody pouze u dobře vyšetřitelných osob, počty nemocných, které nelze vyšetřit pomocí akustické denzitometrie se pohybují mezi 5-18 % [6,23]. Hledají se však cesty, jak do budoucna tento problém zmírnit – zkouší se měření CVIB z transezofageálního vyšetření [46,58], s použitím echokontrastu [59], testuje se využití automatické detekce hranic (automatic endocardial border detection). Velkou pomocí by byl i systém automatického posunu ROI během cyklu (automatic tracking systém), pokud by dobře fungoval [8].
Závěr
Akustická denzitometrie je poměrně nová metoda využitelná v diagnostice viability myokardu. Dosahuje dobrých hodnot senzitivity a specificity. Je schopna doplnit a v některých případech snad i nahradit stávající běžné metody. Její předností jsou absolutní neinvazivita a objektivnost hodnocení. Výraznějšímu rozšíření metody dosud brání její pracnost a především absence standardů pro získávání a hodnocení dat.
Práce byla podpořena Výzkumným záměrem MSM 0021622402.
Doručeno do redakce 13. 11. 2006
Přijato k otištění po recenzi 15. 1. 2007
MUDr. Roman Panovský, Ph. D.
MUDr. Vladimír Kincl
prof. MUDr. Jaroslav Meluzín, CSc.
I. interní kardioangiologická klinika LF MU a FN U sv. Anny, Brno.
roman.panovsky@fnusa.cz
Sources
1.Morse PM, Ingard KU. Theoretical acoustic. New York: McGraw-Hill 1968 : 400-441.
2.Schecter SO, Teichholz LE, Klig V et al Ultrasonic tissue characterization: Review of nonivasive technique for assessing myocardial viability. Echocardiography 1996; 13 : 415-430.
3.Pérez JE, Miller JG. Ultrasonic backscatter tissue characterization in cardiac diagnosis. Clinical Cardiology 1991;14(Suppl V): 4-9.
4.Mohr G, Vered Z, Barzilai B et al Automated determination of the magnitude and time delay ("phase") of the cardiac cycle dependent variation of myocardial ultrasonic integrated backscatter. Ultrason Imaging 1989; 11 : 245-259.
5.Olshansky B, Collins SM, Skorton DJ et al Variation of left ventricular myocardial gray level on two-dimensional echocardiograms as a result of cardiac contraction. Circulation 1984; 70 : 972-977.
6.Bouki KP, Lange A, Palka P et al Regional variations of ultrasonic integrated backscatter in normal and myopathic left ventricles. A new multi-view approach. Eur Heart J 1996; 17 : 1747-1755.
7.Vandenberg BF, Rath L, Shoup TA, Kerber RE, Collins SM, Skorton DJ. Cyclic variation of ultrasound backscatter in normal myocardium is view dependent: clinical studies with a real-time backscatter imaging system. J Am Soc Echocardiogr 1989; 2 : 308-314.
8.Yuda S, Dart J, Najos O et al Use of cyclic variation of intergrated backscatter to assess contractile reserve and myocardial viability in chronic ischemic left ventricular dysfunction. Echocardiography 2002; 19 : 279-287.
9.Stuhlmuller JE, Skorton DJ, Burns TL et al Reproducibility of quantitative backscatter echocardiographic imaging in normal subjects. Am J Cardiol 1992; 69 : 542-546.
10.Madaras EI, Perez JE, Sobel BE et al Anisotropy of the ultrasonic backscatter of myocardial tissue: II Measurements in vivo. J Acoust Soc Am 1988; 83 : 762-769.
11.Ciulla M, Paliotti R, Hess DB et al Echocardiographic patterns of myocardial fibrosis in hypertensive patients: endomyocardial biopsy versus ultrasonic tissue characterization. J Am Soc Echocardiogr 1997; 10 : 657-664.
12.Maceira AM, Barba J, Varo N et al Ultrasonic backscatter and serom marker of cardiac fibrosis in hypertensives. Hypertension 2002; 39 : 923-928.
13.Yu X, Hashimoto I, Ichida F et al Dipyridamole stress ultrasonic myocardial tissue characterization in patients with Kawasaki disease. J Am Soc Echocardiogr 2001; 14 : 682-690.
14.Saeian K, Rhyne TL, Sagar KB. Ultrasonic tissue characterization for diagnosis af acute myocardial infarction in the coronary care unit. Am J Cardiol 1994; 74 : 1211-1215.
15.Fujimoto S, Mizuno R, Nakagawa Y et al Ultrasonic tissue characterization in patients with dilated cardiomyopathy: comparison with findings from right ventricular endomyocardial biopsy. Int J Card Imaging 1999; 15 : 391-396.
16.Mizuno R, Fujimoto S, Yamaji K et al Myocardial ultrasonic tissue characterization for estimating histological abnormalities in hypertrofic cardiomyopathy: comparison with endomyocardial biopsy findings. Cardiology 2001; 96 : 16-23.
17.Di Bello V, Talarico L, Picano E et al Increased echodensity of myocardial wall in the diabetic heart: an ultrasound tissue characterization study. J Am Coll Cardiol 1995; 25 : 1408-1415.
18.Mimbs JW, O´Donnell M, Miller JG et al Detection of cardiomyopathic changes induced by doxorubicin based on quantitative analysis of ultrasonic backscatter. Am J Cardiol 1981; 47 : 1056-1060.
19.Mizushige K, Tokudome T, Seki M et al Sensitive detection of myocardial contraction abnormality in chronic hemodialysis patients by ultrasonic tissue characterization with integrated backscatter. Angiology 2000; 51 : 223-230.
20.Pinamonti B, Picano E, Ferdeghini EM et al Quantitative texture analysis in two-dimensional echocardiography: application to the diagnosis of myocardial amyloidosis. J Am Coll Cardiol 1989; 14 : 666-671.
21.Mizuno R, Fujimoto S, Nakano H et al Atrial involvement in patients with pregressive systemic sclerosis: relationship between ultrasonic tissue characterization of the atrium and interatrial conduction. Cardiology 1999; 91 : 134-139.
22.Angermann CE, Nassau K, Stempfle HU et al Recognition of acute cardiac allograft rejection from serial integrated backscatter analyses in human orthotopic heart transplant recipients. Comparison with conventional echocardiography. Circulation 1997; 95 : 140-150.
23.Masuyama T, Valantine HA, Gibbons R et al Serial measurement of integrated ultrasonic backscatter in human cardiac allografts for recognition of acute rejection. Circulation 1990; 81 : 829-839.
24.Hirooka K, Yasumura Y, Tsujita Y et al Enhanced method for predicting left ventricular reverse remodeling after surgical repair of aortic regurgitation: Application of ultrasonic tissue characterization. J Am Soc Echocardiogr 2002; 15 : 695-701.
25.Ho YL, Wu CC, Lin LC et al Integrated backscatter for quantification and risk stratification of blood stagnation in left atrial appendages of patients with rheumatic mitral stenosis. Cardiology 2000; 93 : 113-120.
26.Bashir M, Asher CR, Schaffer K et al Left atrial appendage spontaneous echo contrast in patients with atrial arrhythmias using integrated backscatter and transesophageal echocardiography. Am J Cardiol 2001; 88 : 923-927.
27.Kawasaki M, Takatsu H, Noda T et al Noninvasive quantitative tissue characterization and two-dimensional color-coded map of human atherosclerotic lesions using ultrasound integrated backscatter: Comparison between histology and integrated backscatter images. J Am Coll Cardiol 2001; 38 : 486-492.
28.Bax JJ, Wijns W, Cornel JH et al Accuracy of currently available techniques for prediction of functional recovery after revascularization in patients with left ventricular dysfunction due to chronic coronary artery disease: comparison of pooled data. J Am Coll Cardiol 1997; 30 : 1451-1460.
29.Perrone-Filardi P, Pace L, Prastaro M et al Assessment of myocardial viability in patients with chronic coronary artery disease. Rest-4-hour-24-hour 201-Tl tomography versus dobutamine echocardiography. Circulation 1996; 94 : 2712-2719.
30.Kim RJ, Wu E, Rafael A et al The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000; 343 : 1445-1453.
31.Katz WE, Gulati VK, Mahler CM et al Quantitative evaluation of segmental response during dobutamine stress by tissue Doppler echocardiography. Am J Cardiol 1997; 79 : 1036-1042.
32.Wang CH, Cherng WJ, Hung MJ et al Optimal analysis of intravenous myocardial contrast echocardiography for predicting myocardial functional recovery in patients with acute myocardial infarction. J Am Soc Echocardiogr 2002; 10 : 1262-1268.
33.Iwakura K, Ito H, Nishikawa N et al Use of echocardiography for predicting myocardial viability in patients with reperfused anterior wall myocardial infarction. Am J Cardiol 2000; 85 : 744-748.
34.Takiuchi S, Ito H, Iwakura K et al Ultrasonic tissue characterization predicts myocardial viability in early stage of reperfused acute myocardial infarction. Circulation 1998; 97 : 356-362.
35.Milunski MR, Mohr GA, Wear KA et al Early identification with ultrasonic integrated backscatter of viable but stunned myocardium in dogs. J Am Coll Cardiol 1989; 14 : 462-471.
36.Milunski MR, Mohr GA, Pérez JE et al Ultrasonic tissue characterization with integrated backscatter. Acute myocardial ischemia, reperfusion, and stunned myocardium in patients. Circulation 1989; 80 : 491-503.
37.Sagar KB, Pelc LR, Rhyne TL et al Role of ultrasonic tissue charcterization to distinguish from irreversible myocardial injury. J Am Soc Echo 1990; 3 : 471-477.
38.O´Brien WD Jr, Sagar KB, Warltier DC et al Acoustic propagation properties of normal, stunned, and infarcted myocardium. Morphological and biochemical determinants. Circulation 1995; 91 : 154-160.
39.Marini C, Picano E, Varga A et al Cyclic variation in myocardial gray level as a marker of viability in man. A videodensitometric study. Eur Heart J 1996; 17 : 472-479.
40.Nešković AN, Mojsilović A, Jovanović T et al Myocardial tissue characterization after acute myocardial infarction with wavelet image decomposition. A novel approach for the detection of myocardial viability in the early postinfarction period. Circulation 1998; 93 : 634-641.
41.Hirata N, Maeda S, Takiuchi S et al Real time assessment of myocardial revascularization during coronary artery bypass surgery by means of ultrasonic integrated backscatter. Eur J Cardiothorac Surg 1999; 16 : 156-159.
42.Lin LC, Wu CC, Ho YL et al Ultrasonic tissue characterization in predicting residual ischemia and myocardial viability for patients with acute myocardial infarction. Ultrasound Med Biol 1998; 24 : 1107-1120.
43.Lin LC, Yen RF, Hwang JJ et al Ultrasonic tissue characterization evaluates myocardial viability and ischemia in patients with coronary artery disease. Ultrasound Med Biol 2000; 26 : 759-769.
44.Honma H, Kusama Y, Matsuzaki T et al Resting ultrasonic tissue characterization and dobutamine stress echocardiography for prediction of functional recovery in chronic left ventricular ischemic dysfunction. Jpn Circ J 2001; 65 : 381-388.
45.Panovský R, Meluzín J, Kincl V et al Hodnocení viability myokardu akustickou denzitometrií u nemocných s chronickou ischemickou chorobou srdeční. Cor Vasa 2003; 45(7-8): 366-375.
46.Pasquet A, D'Hondt AM, Melin JA, Vanoverschelde JL. Relation of ultrasonic tissue characterization with integrated backscatter to contractile reserve in chronic left ventricular ischemic dysfunction. Am J Cardiol 1998; 81 : 68-74.
47.Muro T, Ota T, Watanabe H et al Prediction of contractile reserve by cyclic variation of integrated backscatter of the myocardium in patients with chronic left ventricular dysfunction. Heart 2001; 85 : 165-170.
48.Castaldo M, Funaro S, Veneroso G et al Detection of residual tissue viability within the infarct zone in patients with acute myocardial infarction: Ultrasonic integrated backscatter analysis versus dobutamine stress echocardiography. J Am Soc Echocardiogr 2000; 13 : 358-367.
49.Panovský R, Meluzín J, Kincl V et al Comparison of acoustic densitometry and dobutamine echocardiography for an assessment of myocardial viability. Echocardiography 2005; 22(7): 586-592.
50.Lange A, Moran CM, Palka P et al The variation of integrated backscatter in human hearts in differing ultrasonic transthoracic views. J Am Soc Echocardiogr 1995; 8 : 830-838.
51.Recchia D, Miller JG, Wickline SA. Quantification of ultrasonic anisotropy in normal myocardium with lateral gain compensation of two-dimensional integrated backscatter images. Ultrasound Med Biol 1993; 19 : 497-505.
52.Hancock JE, Cooke JC, Chin DT et al Determination of successful reperfusion after thrombolysis for acute myocardial infarction. A noninvasive method using ultrasonic tissue characterization that can be applied clinically. Circulation 2002; 105 : 157-161.
53.Bijnens B, D´hooge J, Sutherland G et al Robustness of integrated backscatter for myocardial tissue characterization. Ultrasound Med Biol 1999; 25 : 95-103.
54.Verdonk ED, Hoffmeister BK, Wickline SA et al Anisotropy of the slope of ultrasonic attenuation in formalin fixed human myocardium. J Acoust Soc Am 1996; 99 : 3837-3843.
55.Wickline SA, Verdonk ED, Miller JG. Three-dimensional characterization of human ventricular myofiber architecture by ultrasonic backscatter. J Clin Invest 1991; 88 : 438-446.
56.Holland MR, Wilkenshoff UM, Finch-Johnston AE et al Effects of myocardial fiber orientation in echocardiography: quantitative measurements and computer simulation of the regional dependence of backscattered ultrasound in the parasternal short-axis view. J Am Soc Echocardiogr 1998; 11 : 929-937.
57.Popp RL. Recent experience with ultrasonic tissue characterization. Am J Cardiol 1992; 69 : 112H-116H.
58.Pingitore A, Kozáková M, Picano E et al Acute myocardial gray level intensity changes detected by transesophageal echocardiography during intraoperative ischemia. Am J Cardiol 1993;72 : 465-469.
59.Angermann CE, Krűger TM, Junge R et al Intravenous albumex during transesophageal echocardiography: quantitative assessment by videodensitometry and integrated backscatter analysis from unprocessed radiofraquency signals. J Am Soc Echocardiogr 1995; 8 : 839-853.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2007 Issue 1
Most read in this issue- Kardiostimulace u fibrilace síní
- Infarkt pravé komory
- Výhody fixní kombinační léčby
- Je možné perforaci pravé srdeční komory při implantaci ICD řešit konzervativně? Kazuistika.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

