-
Medical journals
- Career
Intenzívna liečba dyslipoproteinémií v regionálnej kardiologickej ambulancii
: Alexander Klabník
: Kardiologická ambulancia, Námestovo
: AtheroRev 2017; 2(3): 169-174
: Reviews
Stručne prezentujeme počiatočné skúsenosti ambulantného kardiológa v prvom MedPed centre na Orave. Zníženie hladiny LDL-cholesterolu je najúčinnejším prístupom pri redukcii kardiovaskulárnych príhod. Familiárna hypercholesterolémia ako často nerozpoznaná príčina predčasnej manifestácie aterosklerózy je celosvetovo nedostatočne liečená, hoci existuje urgentná potreba včasnej, dlhodobej a agresívnej liečby. V rutinnej praxi viacerí lekári nezvyšujú dávku statínu a mnohí pacienti nedosahujú cieľových hodnôt LDL-cholesterolu aj kvôli nonkompliancii alebo intolerancii či nedostatočnej účinnosti liečby. Odporúčané ciele je obťažne dosiahnuť u väčšiny pacientov pomocou široko dostupnej liečby (maximálne tolerovateľné dávky vysoko účinných statínov v monoterapii alebo v kombinácii s ezetimibom). Sľubné výsledky klinických štúdií s PCSK9 inhibítormi otvárajú nové horizonty v liečbe, ale existujú pochybnosti o ich vysokej cene.
Kľúčové slová/Klíčová slova:
alirokumab, evolokumab,ezetimib, familiárna hypercholesterolémia, statín vo vysokej dávkeÚvod
Dyslipoproteinémie patria nepochybne medzi najdôležitejšie ovplyvniteľné kardiovaskulárne (KV) rizikové faktory. Najčastejšou a súčasne aj najzávažnejšou formou je familiárna hypercholesterolémia (FH). Dôsledkom extrémne vysokej hladiny cholesterolu (C) v priebehu celého života sú predčasné úmrtia na KV-komplikácie včasnej aterosklerózy [1].
Vlastné skúsenosti
Naša kardiologická ambulancia ako prvé MedPed (Make Early Diagnosis and Prevent Early Deaths in Medical Pedigrees) centrum na Orave aktívne vyhľadáva pacientov s FH úzkou spoluprácou s lokálnym laboratóriom v Námestove, ktoré pri hodnote celkového cholesterolu ≥ 7,5 mmol/l alebo LDL-C ≥ 5,0 mmol/l pridáva k výsledkom aj upozornenie v znení „zvažujte vylúčenie FH“ [2]. U dvoch pacientov s podozrením na FH (LDL-C > 6,5 mmol/l) sme odhalili dovtedy nerozpoznanú hypotyreózu.
Častá polygénová hypercholesterolémia
Približne 60 % pacientov s klinickou diagnózou FH nemá prítomnú patologickú mutáciu. Teda zvýšenie cholesterolu spôsobujú skôr polygénové príčiny ako typicky monogénová FH (s autosómovo dominantnou dedičnosťou). Pozitívna mutácia sa odhalí cca u 20–30 % pacientov s pravdepodobnou FH a 60–80 % s definitívnou FH [1].
Vlastné skúsenosti
V roku 2016 sme potvrdili heterozygotnú formu FH aj geneticky iba u 8 našich pacientov z celkovo 54 vyšetrení (2 odmietli). Zistili sme nasledovné mutácie v LDL-receptore: 4 pacienti mali c. 1775 G>A (p. Gly592Glu), 2 pacienti c. 798 T>A (p. Asp266Glu), 1 pacient c. 1048 C>T (p. R350Stop) a 1 pacient mal c. 626 G>A (p. Cys209Tyr). Využitím ultrasonografického vyšetrenia Achillovej šľachy pri výbere pacientov vhodných na genetické vyšetrenie sa zvýšila záchytnosť patologických mutácií na 50 %: pozitívna u 3 probandov z posledných 6 pacientov, č. 51 až 56. V roku 2017 čakáme na výsledky genetiky u pacientov č. 57 až 77.
Použitím holandských diagnostických kritérií FH (Dutch Lipid Network) mohla byť klinická diagnóza pravdepodobnej FH preklasifikovaná na definitívnu FH až pri dôkaze patologickej mutácie. Všetci naši pacienti mali pozitívnu osobnú aj rodinnú anamnézu predčasnej aterosklerózy. Drvivá väčšina pacientov dosiahla maximálne 6 bodov (b) nasledovne: rodinná anamnéza (1 b) + osobná anamnéza (2 b) + hladina LDL-C ≥ 5 mmol/l (3 b). Ale celkovo iba 3 pacienti s LDL-C do 6,4 mmol (3 b) mali pozitívne genetické vyšetrenie. U 2 pacientok s LDL-C > 8,5 mmol/l (8 b) nemáme výsledky genetiky. Z 13 pacientov s LDL-C v rozmedzí 6,5–8,4 mmol/l (5 b) bola potvrdená mutácia zatiaľ u 5 pacientov; u ďalších 6 pacientov ešte čakáme na výsledky genetických testov. Nenašli sa varianty súvisiace s FH v géne pre apolipoproteín B100 (exón 26). U 10 z 24 pacientov s LDL-C > 6 mmol/l (z nich 6 > 7 mmol/l) bola negatívna aj MLPA analýza; u zvyšných ju ešte dopĺňame. Multiplex ligation-dependent probe amplification (MLPA) zistí určité typy mutácií (veľké delécie alebo inzercie) v LDL-receptore, ktoré sa prehliadnu u FH-pacientov s falošne negatívnym výsledkom genetiky pri štandardnej sekvenčnej analýze (iba „bodové“ mutácie).
Xantómy
Výskyt xantómov je patognomickým fyzikálnym nálezom pri FH (6 b podľa holandských kritérií FH).
Vlastné skúsenosti
V našej ambulancii sme začali rutinne vykonávať ultrasonografické vyšetrenie Achillovej šľachy, ktoré umožňuje lepšie odhalenie xantómov aj pri statínovej liečbe. Súčasne pomáha odlíšiť monogénovu FH od polygénovej hypercholesterolémie (pre FH svedčí hrubšia šľacha spolu s xantomatóznou echogenitou), čím možno ekonomicky výhodnejšie odhaliť čo najviac nových jedincov s FH v rodinách pomocou kaskádovitého skríningu [3]. Žiaľ, kaskádovitý skríning FH u príbuzných doposiaľ využila u nás iba jedna osoba.
Liečba podľa KV-rizika
Hlavným cieľom liečby je zabrániť alebo aspoň oddialiť vznik KV-ochorení. Rozhodnutie o potrebe liečby nezávisí iba od výšky hladiny C, ale najmä od celkového KV-rizika (čím vyššie riziko, tým vyšší prínos liečby). Napriek tomu v reálnom živote je častá liečba bez ohľadu na celkové riziko: „podužívanie“ statínov u vysokorizikových pacientov, a naopak „nadužívanie“ statínov u nízkorizikových osôb. Viac ako polovica hypolipidemík v primárnej prevencii vo Veľkej Británii bola predpísaná neindikovaným pacientom [4]. Po opätovnom prehodnotení potreby liečby bolo možné v Holandsku približne u 40 % pacientov ukončiť liečbu statínmi vzhľadom na nízke KV-riziko [5].
Vlastné skúsenosti
V našej ambulancii liečime pacientov s veľmi vysokým KV-rizikom, prevažujú muži s priemerným vekom okolo 60 rokov (tab. 1).
1. Základné charakteristiky pacientov v MedPed centre 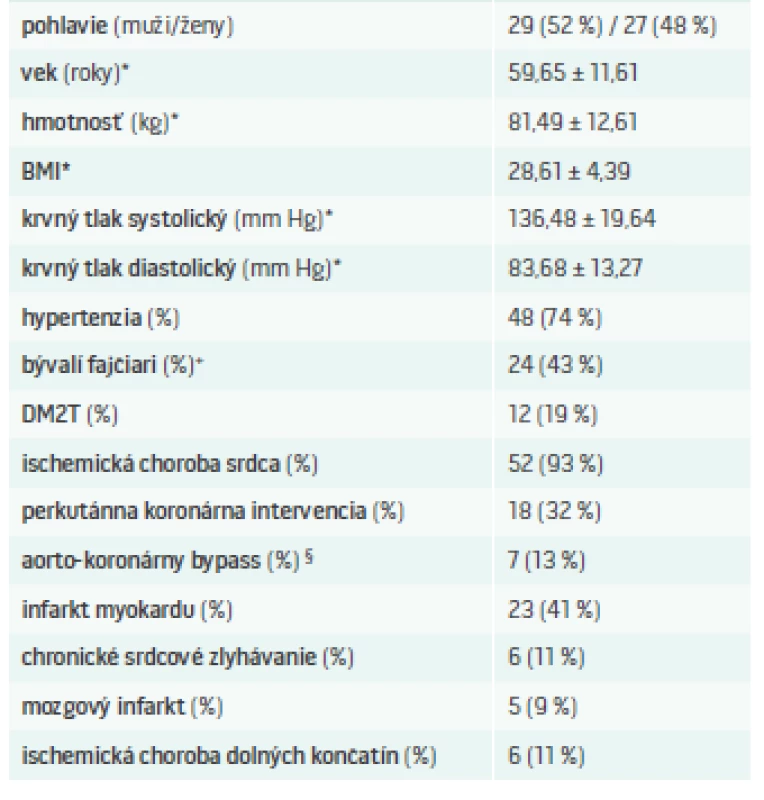
*priemer ± SD (standard deviation/štandardná odchýlka)+ v roku 2016 nikto nefajčí § naviac 2 pacienti po periférnom revaskularizačnom zákroku DM2T – diabetes mellitus 2. typu Pre LDL platí ono známe „čím nižšie, tým lepšie“ (čím nižšia hladina LDL-C sa dosiahne, tým výraznejšie sa redukujú KV-príhody). Je dokázané, že intenzifikovaná liečba (vysokými dávkami) potentnými statínmi prináša nielen ďalšie zníženie C, ale najmä aj redukciu KV-príhod v porovnaní so štandardnými dávkami [6]. V štúdii REVERSAL (Reversing Atherosclerosis with Aggressive Lipid Lowering) [7] koronárna ateroskleróza signifikantne progredovala (+ 2,7 %) počas 18-mesačnej liečby s 40 mg pravastatínu, ale pri podávaní atorvastatínu v dávke 80 mg nebola dokázaná (-0,4 %).
(Ne)dosiahnuteľné cieľové hodnoty LDL-C
Na zabezpečenie maximálneho prínosu pre pacienta je nutné dosiahnuť cieľové hodnoty LDL-C podľa odporúčaní [8]:
- LDL-C < 2,5 mmol/l pre vysoké KV-riziko: výrazne vysoká hodnota jedného rizikového faktora (pri FH, závažnej hypertenzii) alebo vypočítané rizikové SCORE 5–10 %
- LDL ≤ 1,8 mmol/l (< 70 mg/dl) alebo aspoň 50% redukcia oproti počiatočnej hodnote LDL-C pre veľmi vysoké KV-riziko: najmä v sekundárnej KV-prevencii, u diabetikov s poškodením cieľových orgánov (mikroalbuminúria), stredná až závažná nefropatia, vypočítané SCORE ≥ 10 %
Odporúčania navrhujú ešte nižšie cieľové hodnoty LDL-C (< 55 mg/dl = 1,43 mmol/l) pre novú kategóriu s „extrémne“ vysokým KV-rizikom, t. j. pacienti s už dokázaným KV-ochorením pri FH, cukrovke alebo stredne závažnej nefropatii, s predčasným KV-ochorením (pred 55. rokom veku u mužov a u žien mladších ako 65 rokov) a s progresívnym KV-ochorením napriek dosiahnutiu LDL-C < 1,8 mm/l.
V reálnej praxi iba veľmi málo pacientov dosiahne cieľové hodnoty LDL-C. Napr. v štúdii L-TAP [9] dosiahlo len 37 %, resp. 18 % pacientov s vysokým, resp. veľmi vysokým rizikom, z čoho je zrejmé, že je obťažnejšie dosiahnuť prísnejšie ciele LDL-C v dôsledku narastajúceho KV-rizika.
Vlastné skúsenosti
Pri príchode do MedPed centra dosiahlo cieľovú hodnotu LDL-C < 1,8 mmol/l iba 9 % pacientov s klinicky pravdepodobnou diagnózou FH (tab. 2). Vďaka liečbe postupne v roku 2016 poklesol maximálny C aj LDL-C (tab. 3).
2. Cieľové hladiny LDL-C pri vstupe do MedPed centra 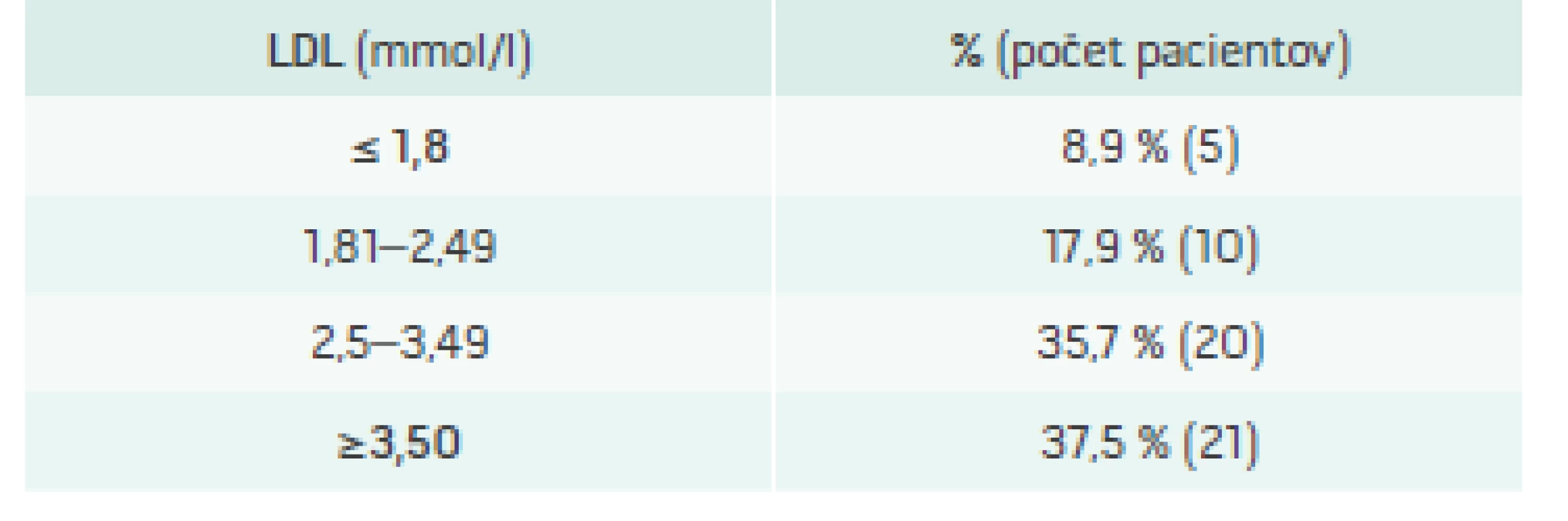
3. Pokles cholesterolu po liečbe v MedPed centre* 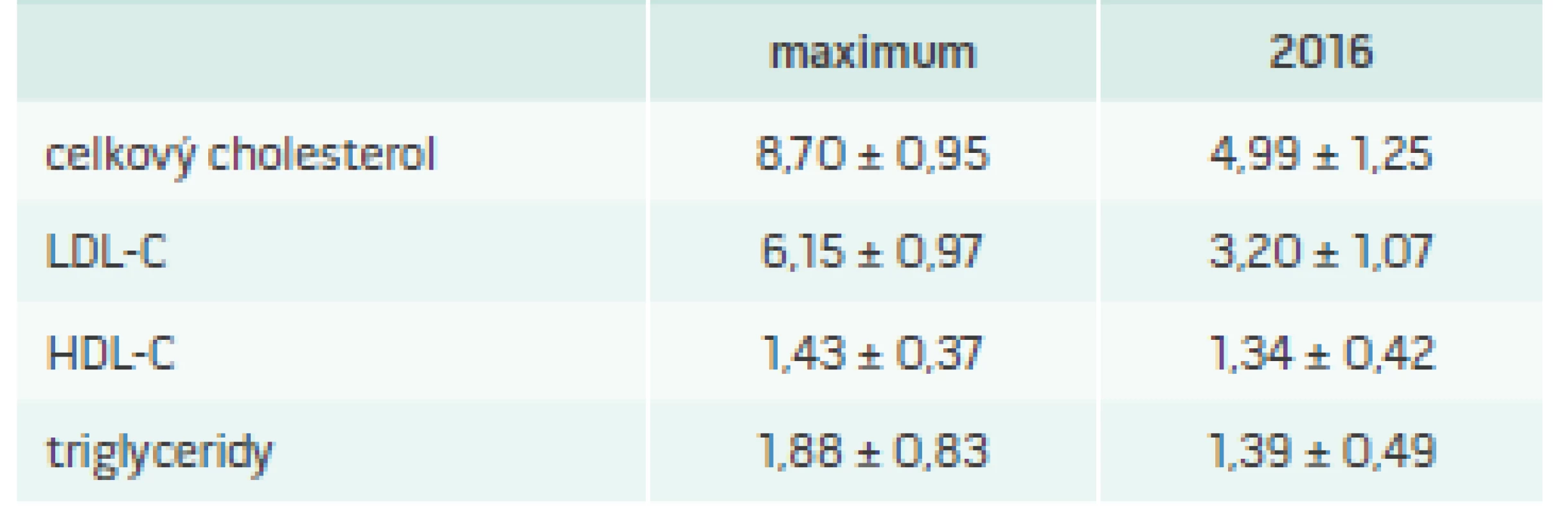
* priemerné hodnoty v mmol/l ± SD Prečo nedosahujeme cieľové LDL?
Najčastejšími dôvodmi nedosahovania cieľových hodnôt LDL-C je nízka adherencia pacientov, nedostatočné dávkovanie statínov alebo nesprávny odber krvi. Častokrát sa zabúda, že pred odberom krvi na stanovenie C je nutné minimálne 15 minút pokojne sedieť v čakárni. Pretože hladina C je vyššia v stoji (o 16 % vyššie v stoji po 15 minútach a o 9 % vyššie už o 5 minút po postavení sa). Podobne zaškrtenie hornej končatiny pri odbere dlhšie ako 5 minút zvyšuje C o 10 % [10].
Statíny sú často predpisované v nízkej dávke, po nasadení úvodnej dávky nie je v budúcnosti zabezpečená titrácia dávky nahor, bez ohľadu na pokles LDL-C. Pre redukciu C platí pravidlo piatich (každé zdvojnásobenie dávky statínu prinesie redukciu C o 5 %) a pre redukciu LDL-C platí pravidlo siedmich (každé zdvojnásobenie dávky statínu prinesie redukciu LDL o 7 %). Čo umožňuje určiť ekvipotentné dávky jednotlivých statínov: porovnateľné zníženie LDL o 41 % dosiahneme rosuvastatínom v dávke 10 mg, ktorý je rovnako účinný ako 20 mg atorvastatínu či 40 mg simvastatínu. Preto sa nezriedka môže dosiahnuť adekvátna kontrola (splnenie cieľových hodnôt LDL-C) len s použitím potentného statínu vo vysokých dávkach [1].
Adherencia pacientov k liečbe
Poprvé spolupráca pacientov pri liečbe je slabá: každý desiaty vôbec nezačne užívať predpísaný liek a až tretina do roka svojvoľne ukončí liečbu. Mnohí dlhé roky vedia o tom, že majú vysoký C. Žiaľ, neuvedomujú si dôležitosť liečby, najmä v primárnej prevencii, pretože im vysoké hladiny cholesterolu nespôsobujú žiadne ťažkosti, a až po relatívne dlhom období prichádzajú KV-príhody („tichý zabijak“). Pacienti odmietajú liečbu z obavy pred nežiadúcimi účinkami, častokrát užívajú nevhodné lieky (od príbuzných, priateľov, z predošlej liečby, neodôvodnene uprednostňujú voľnopredajné prípravky). Mnohí neužívajú lieky tak, ako majú odporúčané lekárom: samovoľne si zvýšia alebo znížia dávku lieku, zabudnú si vziať ďalšiu dávku, nedodržujú časový interval medzi dávkami, užívajú predpísané lieky len pred kontrolou u lekára alebo pred odberom krvi, nedostavia sa na plánovanú kontrolu [1,11].
Podruhé adherenciu zhoršuje aj vysoká cena liečby (našťastie sú dostupné aj lacnejšie generiká), a najmä neodôvodnená kritika statínov lekárnikom, iným lekárom alebo iným pacientom alebo v médiách. Pri liečbe cerivastatínom vznikala rabdomyolýza 10 - až 50-krát častejšie ako pri iných statínoch, preto bol v auguste 2001 za výdatnej pozornosti médií stiahnutý z trhu. Je však asi 20-násobne pravdepodobnejšie, že človek zomrie pri dopravnej nehode, ako na poškodenie svalov pri liečbe statínmi. Napriek tomu je na internete množstvo článkov o toxických účinkoch týchto liečiv. V Dánsku po zverejnení negatívnych správ o statínoch došlo k nárastu infarktov myokardu o 26 % u pacientov, ktorí ukončili liečbu, v porovnaní s tými, čo v liečbe pokračovali [14].
Zlepšenie adherencie podporujú praktické a názorné informácie, písomné inštrukcie, opakované pripomínanie, opätovné predvolanie pacientov, ktorí neprišli na plánovanú kontrolu [11].
Viaceré štúdie poukázali na význam zapojenia zdravotnej sestry do multidisciplinárneho programu KV-prevencie: zlepšenie kontroly rizikových faktorov, lepšie dosiahnutie terapeutických cieľov, zvýšenie adherencie pacientov. Ich hlavnou úlohou je edukácia, motivácia a podpora pacientov [12].
Motiváciu u mužov k užívaniu statínov môže stimulovať fakt, že statíny signifikantne zlepšujú erektilnú dysfunkciu (ED): až o 3,4 bodu. Zlepšenie ED statínmi dosahovalo tretinu až polovicu veľkosti účinku sildenafilu, s rastúcim benefitom pri klesajúcej lipofilite statínu. Avšak jedná sa o kontroverzný nález, pretože niektorí autori naopak popisovali potenciál statínov k zhoršovaniu ED (znížením hladiny testosterónu). Argument o „okamžitom“ prínose zlepšenia ED môže zvýšiť adherenciu k statínu v rámci primárnej prevencie viac ako „príliš vzdialená“ prevencia KV-príhod v budúcnosti [13].
Dlhodobá a včasná liečba
Prerušenie liečby (napr. v prípade normalizácie C) vedie v krátkom čase k opätovnému zvýšeniu C. Dokonca sa môže zhoršiť základné ochorenie a stav pacienta pri náhlom vysadení statínu alebo zámene za iný druh statínu v neekvivalentnej dávke. Podobne ako pri liečbe betablokátormi je aj u statínov známy „syndróm vynechania“ [15,16], najmä u pacientov s akútnym koronárnym syndrómom, pričom krátkodobé prerušenie liečby u stabilných pacientov nezvyšovalo riziko [16].
Vždy platí pravidlo, že čím skôr sa začne s liečbou, tým lepšie (ateroskleróza začína už v detstve). Dôležitosť včasnej liečby ilustruje kumulatívne celoživotné „bremeno“ vysokého C, ktoré postačuje k vzniku ischemickej choroby srdca vo veku 55 rokov u pacienta bez FH. Pri FH sa dosiahne už od 35 rokov života (bez liečby), ale až vo veku 48, resp. 53 rokov pri začiatku liečby už od 18, resp. 10 rokov [1]. Optimálna kontrola C v strednom a mladšom veku naprogramuje pozitívne „pamäť“ ciev, a tak sa predlžuje prínos krátkodobej intenzívnej liečby aj počas dlhšieho obdobia od vysadenia lieku [17].
Statíny ako liek prvej voľby a možné vedľajšie účinky
V randomizovanej štúdii nefarmakologické spôsoby liečby (rybí olej, zmena životného štýlu) dosiahli porovnateľné zníženie LDL-C ako simvastatín 40 mg počas 3 mesiacov. Ale na dlhodobé dosiahnutie cieľových hodnôt LDL-C častokrát nepostačujú [18].
Spomedzi hypolipidemík sú najúčinnejšie a najpoužívanejšie statíny. Disponujú najrozsiahlejšou medicínou dôkazov v primárnej aj sekundárnej prevencii. Naviac majú dokázané aj priaznivé pleiotropné účinky, ktoré nezávisia od veľkosti zníženia C [1].
Najväčší problém pri liečbe statínmi predstavuje myopatia (5 až 10 % pacientov v klinickej praxi v závislosti od dávky). Najčastejšie sa prejavuje vo forme myalgií bez zvýšenia kreatínkinázy. Avšak približne polovica pacientov s anamnézou intolerancie statínov dlhodobo toleruje iný statín alebo aspoň pôvodný statín v nižšej dávke, či podávaný intermitentne (napr. obdeň) [19].
Najnovšie údaje ukazujúce na zvýšenú incidenciu diabetes mellitus (DM) pri liečbe vysokými dávkami statínov nesmú zabrániť použitiu statínov u vysokorizikových pacientov, pretože absolútna redukcia rizika KV-príhod prevažuje nad možným veľmi malým nárastom výskytu DM: bolo potrebné liečiť 1 rok vysokou dávkou statínu iba 155 pacientov na prevenciu jednej KV-príhode, ale až 495 pacientov je potrebných na vznik nového DM [20]. V štúdii TNT (Treating to New Targets: atorvastatin 80 mg vs 10 mg) ani v štúdii IDEAL (Incremental Decrease in Endpoints through Aggressive Lipid Lowering: atorvastatin 80 mg vs simvastatin 20 mg) nebol zistený signifikantný rozdiel vo výskyte novozisteného DM: zvýšenie relatívneho rizika o 10–19 %. Avšak v štúdii SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels: 80 mg atorvastatin vs placebo) sa vyvinul novozistený DM signifikantne častejšie o 37 % (8,71 % vs 6,06 %, p = 0,011). Nezávislými prediktormi vzniku nového DM [21] boli vo všetkých štúdiách vstupná glykémia nalačno a znaky metabolického syndrómu (triglyceridy, obezita).
Kombinovaná hypolipidemická liečba
Veľa pacientov napriek maximálne tolerovaným dávkam statínu v monoterapii nedosahuje cieľové hodnoty LDL-C. Zlepšenie úrovne kontroly FH najmä v sekundárnej KV-prevencii vyžaduje kombináciu s iným dostupným hypolipidemikom.
Živice
Živice – sekvestranty žlčových kyselín (cholestyramín) nie sú bežne používané pre časté nežiadúce účinky (až 35 % zápcha, nadúvanie). Znižujú LDL-C o 10–35 % (liek 3. voľby), mierne zvyšujú HDL-C (o 5 %), ale nepriaznivo zvýšia aj triglyceridy (TG). Nevstrebávajú sa do krvného obehu, a preto ich možno používať aj u detí, gravidných a u pacientov s hepatopatiou. Odporúča sa podávať iné lieky hodinu pred podaním alebo 4 hodiny po ich podaní, pretože znižujú absorpciu liekov [22].
Fibráty
Fibráty sú určené najmä na úpravu TG a HDL-C, ale znižujú aj LDL-C o cca 20 %. Pri liečbe so statínom zvyšujú riziko myopatie, je dostupná fixná kombinácia fenofibrátu so simvastatínom. V štúdii FIELD (Fenofibrate Intervention and Event Loweringing in Diabetes) bol preukázaný benefit fenofibrátu na redukciu KV-príhod iba u diabetikov so zvýšením TG alebo nízkym HDL-C [23].
Ezetimib
Ezetimib (Eze) v kombinácii so statínom selektívnou inhibíciou vstrebávania C z čreva redukuje LDL-C o ďalších priemerne 24 %. Máme k dispozícii aj fixné kombinácie Eze so simvastatínom alebo atorvastatínom. Onedlho očakávame dostupnosť generika Eze. Neutrálne výsledky kontroverznej štúdie ENHANCE (The Ezetimibe and Simvastatin in Hypercholesterolemia Enhances Atherosclerosis Regression) boli sklamaním, pretože napriek zníženiu LDL-C nedošlo k spomaleniu progresie aterosklerotického plátu u pacientov s FH [24]. V štúdii IMPROVE-IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial) sa napriek zvýšeniu počtu zaradených pacientov s akútnym koronárnym syndrómom o 40 % (z 12 500 na 18 000) dokázal iba „mierny“ prínos Eze v kombinácii so simvastatínom 40 mg (ten sa však pri AKS neodporúča) na redukciu KV-príhod [25].
Inhibítory PCSK9
Inhibítory proprotein konvertázy subtilizin/kexin typ 9 (PCSK9i) preukázali neuveriteľné zníženie LDL-C o 40 až 70 %, aj pri liečbe statínmi. Alirokumab 75–150 mg a evolokumab 140 mg sa aplikujú subkutánne každé 2 týždne. Neutralizujúce protilátky voči bokocizumabu (humanizovaná monoklonálna protilátka) spôsobili významné oslabenie a variabilitu v redukcii LDL-C, čo viedlo k predčasnému ukončeniu štúdií SPIRE (Evaluation of Bococizumab (PF-04950615;RN316) in Reducing the Occurrence of Major Cardiovascular Events in High Risk Subject) [26]. Výsledky štúdie ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes after an Acute Coronary Syndrome during Treatment with Alirocumab) s alirokumabom ešte neboli zverejnené. V štúdii FOURIER (Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk) evolokumab znížil primárny zložený ukazovateľ o 15 % (pomer rizika, HR 0,85; 9,8 % vs 11,3 %), pričom redukoval LDL-C priemerne o 60 %, 87 % pacientov dosiahlo LDL-C ≤ 1,8 mmol/l a 42% zníženie ≤ 25 mg/dl [27].
Inhibítory PCSK9 nie sú cenovo efektívne pri súčasnej vysokej cene, ktorá by musela poklesnúť na 4 536 USD za rok [28]. Autori štúdie sponzorovanej firmou Amgen po započítaní aj nepriamych nákladov stanovili ročnú cenu liečby na 9 669 USD, aby bol splnený prah pre cenovú efektívnosť evolokumabu alebo by museli byť liečení rizikovejší pacienti [29]. Hradená liečba vyžaduje predchádzajúci súhlas revízneho lekára zdravotnej poisťovne po splnení indikačných obmedzení. Bez intenzívnej úpravy hypolipidemík by splnila tieto kritériá teoreticky štvrtina až tretina pacientov v závislosti od KV-rizika. Ale väčšina z nich môže dosiahnuť cieľové hodnoty LDL-C uptitráciou dávky statínu a pridaním ezetimibu, čím sa zúži priestor pre indikáciu inhibítorov PCSK9 na 10 až 14 %. Reálna potreba je 16,5 % pri započítaní intolerancie hypolipidemík [30,31].
Vlastné skúsenosti
V roku 2016 sme v našej ambulancii postupne zvyšovali dávku atorvastatínu (graf). Maximálnou dávkou bolo liečených 68 % pacientov a priemerná denná dávka sa zvýšila z 24 mg na 66 mg. U 3 diabetikov sme k monoterapii statínom pridali fenofibrát. Ezetimib sme použili (celkovo v 54 %) 2-krát v monoterapii a u 6, resp. 24 pacientov v kombinácii s atorvastatínom 20–40 mg, resp. 80 mg.
Graf. Zmeny v dávkovaní atorvastatínu (A) v MedPed centre 
Dávkovanie atorvastatínu (absolútne počty pacientov) dosiahnuté v roku 2016 v porovnaní s údajmi pri vstupe do MedPed centra. V našej ambulancii by bez intenzívnej úpravy hypolipidemík mohlo užívať inhibítory PCSK9 teoreticky až 21 pacientov (37,5 %). Pri hlbšej analýze však nesplnili indikačné obmedzenia 2 pacienti pre nonkomplianciu a pre pokles LDL-C < 3,5 mmol/l po pridaní fenofibrátu 1 diabetik, resp. po pridaní ezetimibu 6 pacienti. U 9 pacientov sme sa pre intoleranciu pokúsili o zmenu statínu alebo jeho intermitentné podávanie. Donedávna nám zamietli všetky podané žiadosti o schválenie inhibítorov PCSK9. Po opätovnej komunikácii s revíznym lekárom máme od 30. 8. 2017 prvý súhlas s úhradou lieku a k 30. 9. 2017 máme súhlas už pre 3 pacientov.
Doručené do redakcie/ Doručeno do redakce/Received: 12. 9. 2017
Prijaté po recenzii/ Přijato po recenzi/Accepted: 5. 10. 2017
MUDr. Alexander Klabník, PhD.
klabnik@oralek.sk
www.oralek.sk
Sources
1. Nordestgaard BG, Chapman MJ, Humphries SE et al. [European Atherosclerosis Society Consensus Panel]. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Consensus Statement of the European Atherosclerosis Society. Eur Heart J 2013; 34(45): 3478–3490. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht273>.
2. Bell DA, Hooper AJ, Bender R et al. Opportunistic screening for familial hypercholesterolaemia via a community laboratory. Ann Clin Biochem 2012; 49(Pt 6): 534–537. Dostupné z DOI: <http://dx.doi.org/10.1258/acb.2012.012002>.
3. Junyent M, Gilabert R, Daniel Zambón D et al. The use of Achilles tendon sonography to distinguish familial hypercholesterolemia from other genetic dyslipidemias. Arterioscler Thromb Vasc Biol 2005; 25(10): 2203–2208.
4. Wu J, Zhu S, Yao GL et al. Patient factors influencing the prescribing of lipid lowering drugs for primary prevention of cardiovascular disease in UK general practice: a national retrospective cohort study. PLoS ONE 2013; 8(7): e67611. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0067611>.
5. van Duijn HJ, Belo JN, Blom JW, Velberg ID et al. Revised guidelines for cardiovascular risk management – time to stop medication? A practice-based intervention study. Br J Gen Pract 2011, 61(587): e347–352. Dostupné z DOI: <http://dx.doi.org/10.3399/bjgp11X578025>.
6. LaRosa JC, Grundy SM, Waters DD et al. [Treating to New Targets (TNT) Investigators]. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352(14): 1425–1435.
7. Nissen SE, Tuzcu EM, Schoenhagen P et al. [REVERSAL Investigators]. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial. JAMA 2004; 291(9): 1071–1080.
8. Jellinger PS, Handelsman Y, Rosenblit PD et al. American association of clinical endocrinologists and American college endocrinology guidelines for management of dyslipidemia and prevention of cardiovascular disease. Endocrine Practice 2017; 23 (Suppl 2): 1–87. Dostupné z DOI: <http://dx.doi.org/10.4158/EP171764.APPG>.
9. Pearson TA, Laurora I, Chu H et al. The lipid treatment assessment project (L-TAP): a multicenter survey to evaluate the percentages of dyslipidemic patients receiving lipid-lowering therapy and achieving low-density lipoprotein cholesterol goals. Arch Intern Med 2000; 160(4): 459–467.
10. Hansen WE, Seitz I, Ortner A. Enfluss der Korperlage und der venosen Stauung auf die Blutfettspiegel. Dtch Med Wochenschr 1990, 115(11): 408–411.
11. Piťha J. Jak (s)tvořit spolupracujícího pacienta pro antihypertenzní a hypolipidemickou léčbu. Vnitř Lék 2017; 63(4): 272–276.
12. Jorstad HT, von Birgele C, Alings AMW et al. Effect of a nurse-coordinated prevention programme on cardiovascular risk after an acute coronary syndrome: main results of the RESPONSE randomised trial. Heart 2013, 99(19): 1421–1430. Dostupné z DOI: <http://dx.doi.org/10.1136/heartjnl-2013–303989>.
13. Kostis JB, Dobrzynski JM. The effect of statins on erectile dysfunction: a meta-analysis of randomized trials. J Sex Med 2014; 11(7):1626–1635. Dostupné z DOI: <http://dx.doi.org/10.1111/jsm.12521>.
14. Nielsen SF, Nordestgaard BG. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur Heart J 2016; 37(11): 908–916. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv641>.
15. Thomas M, Mann J. Increased thrombotic vascular events after change of statin. Lancet 1998; 352(9143): 1830–1831.
16. McGowan MP. There is no evidence for an increase in acute coronary syndromes after short-term abrupt discontinuation in stable cardiac patients. Circulation 2004; 110(16): 2333–2335.
17. Ford I, Murray H, McCowan C et al. Long-term safety and efficacy of lowering low-density lipoprotein cholesterol with statin therapy: 20-year follow-up of West of Scotland Coronary Prevention Study. Circulation 2016; 133(11): 1073–1080. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.115.019014>.
18. Becker DJ, Gordon RY, Morris PB et al. Simvastatin vs therapeutic lifestyle changes and supplements: randomized primary prevention trial. Mayo Clin Proc 2008; 83(7): 758–764. <http://dx.doi.org/10.4065/83.7.758>.
19. Murín J, Pernický M, Wawruch M. Intolerancia statínov. Cardiology Lett 2015; 24(6): 451–457.
20. Preiss D, Seshasai SR, Welsh P et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011; 305(24): 2556–2564. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.860>.
21. Waters DD, Ho JE, DeMicco DA et al. Predictors of new-onset diabetes in patients treated with atorvastatin: results from 3 large randomized clinical trials. J Am Coll Cardiol 2011; 57(14): 1535–1545. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2010.10.047>.
22. Rašlová K, Tkáč I, Fábryová Ľ. Racionálna liečba dyslipoproteinémií. Metodický list Ústrednej komisie racionálnej farmakoterapie a liekovej politiky MZ SR č. 36, Marec 2005; 9(1): 1–8. Dostupné z WWW: <https://zona.fmed.uniba.sk/uploads/media/Liecba_dyslipoproteinemii.pdf>.
23. Aguiar C, Alegria E, Bonadonna RC et al. A review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidaemia: a report from an expert consensus meeting on the role of fenofibrate-statin combination therapy. Atheroscler Suppl 2015; 19 : 1–12. Dostupné z DOI: <http://dx.doi.org/10.1016/S1567–5688(15)30001–5>.
24. Kastelein JJ, Akdim F, Stroes ES et al. [ENHANCE investigators]. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008; 358(14): 1431–1443. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0800742>. Erratum in N Engl J Med 2008; 358(18): 1977.
25. Cannon CP, Blazing MA, Giugliano RP et al. [IMPROVE-IT investigators]. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372(25): 2387–2397. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1410489>.
26. Ridker PM, Revkin J, Amarenco P et al. [SPIRE cardiovascular outcome investigators]. Cardiovascular efficacy and safety of bococizumab in high-risk Patients. N Engl J Med 2017; 376(16):1527–1539. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1701488>.
27. Sabatine MS, Giugliano RP, Keech AC et al. [FOURIER steering committee and investigators]. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376(18): 1713–1722.10.1056/NEJMoa1615664
28. Kazi DS, Penko J, Coxson PG et al. Updated cost-effectiveness analysis of PCSK9 inhibitors based on the results of the FOURIER trial. JAMA 2017; 318(8): 748–750. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2017.9924>.
29. Fonarow GC, Keech AC, Pedersen TR et al. Cost-effectiveness of evolocumab therapy for reducing cardiovascular events in patients with atherosclerotic cardiovascular disease. JAMA Cardiol 2017; August 23. Dostupné z DOI: <http://dx.doi.org/10.1001/jamacardio.2017.2762>.
30. Virani SS, Akeroyd JM, Nambi V et al. Estimation of eligibility for proprotein convertase subtilisin/kexin type 9 inhibitors and associated costs based on the FOURIER trial (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk): insights from the department of Veterans Affairs. Circulation 2017; 135(25): 2572–2574. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.117.028503>.
31. Cannon CP, Khan I, Klimchak AC et al. Simulation of Lipid-Lowering Therapy Intensification in a Population with Atherosclerotic Cardiovascular Disease. JAMA Cardiol 2017; 2(9): 959–966. Dostupné z DOI: <http://dx.doi.org/10.1001/jamacardio.2017.2289>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adults
Article was published inAthero Review

2017 Issue 3-
All articles in this issue
- What do we know and what can we really do for families with familial hypercholesterolemia: case report
- Opinion of the Committee of the Czech Society for Atherosclerosis on the ESC/ EAS Recommendations for Dyslipidemia Diagnostics and Treatment 2016
-
Cardiovascular diseases and dietary fatty acids
Polemic view to new guidelines AHA.
Comment on the article N. Teicholz and E. Thorn (Medscape 2017; July 12) - Debate over the Recommendations of the American Heart Association on the Effects of Fat on Cardiovascular Diseases
- Secondary dyslipidemia
- Intensive treatment of dyslipidemia in regional outpatient cardiology office
- The role of functional food and nutraceuticals in therapy of hypercholesterolemia
- Athero Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Secondary dyslipidemia
- Opinion of the Committee of the Czech Society for Atherosclerosis on the ESC/ EAS Recommendations for Dyslipidemia Diagnostics and Treatment 2016
- Intensive treatment of dyslipidemia in regional outpatient cardiology office
- What do we know and what can we really do for families with familial hypercholesterolemia: case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

