-
Medical journals
- Career
Prehľad liekových interakcií a rizík statínovej liečby
: Jana Sirotiaková
: Interné oddelenie NsP, Levice
: AtheroRev 2017; 2(1): 10-14
: Reviews
Statíny (inhibítory HMG CoA reduktázy) patria v súčasnosti k najčastejšie používaným farmakologickým skupinám. V praxi sa uplatňujú predovšetkým ich významné hypolipidemické účinky, statíny sú vysoko účinné pri znižovaní plazmatických hladín celkového a LDL-cholesterolu, ktoré sú významným prediktorom kardiovaskulárnej morbidity a mortality. Okrem hypolipidemického účinku majú aj viaceré účinky pleiotrópne. Statíny majú vo všeobecnosti dobrú znášanlivosť, o čom svedčia aj výsledky početných významných klinických štúdií a metaanalytické vyhodnotenia. Frekvencia závažných nežiaducich účinkov je relatívne nízka, ale v prípade liečby rizikového pacienta môže dôjsť ku vzniku závažných poliekových poškodení. Skutočné riziko statínov nevyplýva iba z rizikového profilu ich molekúl, interakcií s inými liečivami, ale aj z podávania pacientom z rizikových skupín.
Kľúčové slová/Klíčová slova:
inhibítory HMG CoA reduktázy, liekové interakcie, statíny, riziko liečbyÚvod
Statíny (inhibítory HMG CoA reduktázy) si získali v ostatnom desaťročí nezastupiteľné miesto vo viacerých farmakologických postupoch a vďaka svojím tzv. pleiotropným účinkom majú široké uplatnenie v liečbe kardiovaskulárnych a metabolických ochorení. Statíny boli objavené v 70. rokoch minulého storočia a zaujali dôležité postavenie nielen v liečbe viacerých kardiovaskulárnych ochorení, ale aj v prevencii ich komplikácií.
Klinický význam statínov vyplýva z ich farmakologického mechanizmu účinku, sú predovšetkým vysoko účinnými hypolipidemikami. Pri liečbe statínmi dochádza k poklesu sérovej koncentrácie LDL-cholesterolu a k súčasnému zvyšovaniu hladín HDL-cholesterolu. Práve táto vlastnosť ich predurčuje v praxi k poklesu kardiovaskulárnej morbidity a mortality, čo bolo dokázané vo veľkom množstve klinických štúdií, na základe ktorých sa odvíja ich odporúčanie pre klinickú prax (tab. 1) [1].
1. Základné farmakodynamické vlastnosti statínov 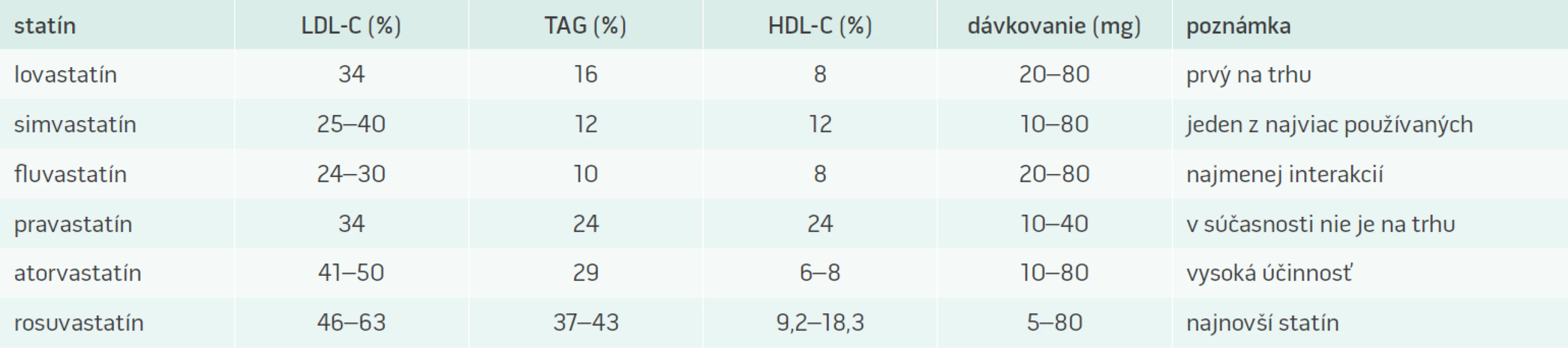
V liečbe kardiovaskulárnych a metabolických ochorení sa veľmi často využívajú tiež pleiotropné účinky statínov. Tento dôležitý farmakodynamický proces nie je závislý od ich hypolipidemického pôsobenia. K najvýznamnejším doposiaľ známym pleiotropným účinkom patrí ovplyvnenie biologickej dostupnosti oxidu dusnatého (NO), mobilizácia progenitorových endotelových buniek , pokles aktivity mitogénom aktivovanej proteínkinázy, lipooxygenázy 1 a taktiež pokles CRP. Svojím antiflogistickým účinkom môžu priaznivo ovplyvniť endotelovú dysfunkciu, a tým efektívne pôsobiť v prevencii a liečbe aterosklerózy [2,3].
V súčasnosti existuje veľké, až neprehľadné množstvo článkov zaoberajúcich sa problematikou statínov. Na jednej strane sú to odborné články, ktoré prinášajú pohľad na statínovú liečbu opierajúc sa o výsledky dôležitých klinických štúdií a poznatky z klinickej praxe. Na druhej strane sa stretávame s neodbornými (laickými) článkami, ktoré sú poväčšine publikované v populárnych časopisoch a cestou internetu. Tieto články často predstavujú statínovú liečbu z negatívneho pohľadu a ich skreslené a často nepravdivé informácie môžu vzbudzovať u pacientov pochybnosti o správnosti liečby statínmi. Musíme si uvedomiť, že tak ako každý iný liek, aj statínová liečba má svoje úskalia a môže byť sprevádzaná viacerými nežiaducimi účinkami. Statíny tvoria nehomogénnu skupinu liečiv, a preto pri ich zaraďovaní do terapie je veľmi dôležité, aby boli zohľadňované farmakodynamické a farmakokinetické vlastnosti konkrétneho statínu. Skutočné riziko liečby statínmi nevyplýva iba priamo z rizikového potenciálu molekúl statínov, ale viac z profilu rizikových skupín pacientov. Zvýšená opatrnosť by mala byť samozrejmosťou pri liečbe rizikových pacientov. Cieľovou skupinou pre liečbu statínmi sú často pacienti polymorbídni a starší pacienti, pre ktorých je typické užívanie viacerých liečiv z rôznych farmakologických skupín. Súčasným trendom vo viacerých medicínskych odvetviach je kombinovaná liečba a liekové interakcie statínov s inými liečivami predstavujú významné riziko pri liečbe statínmi práve pre možnosť viacerých liekových interakcií, ktoré môžu mať aj veľmi závažný a nepriaznivý klinický priebeh. Najčastejšie liekové interakcie so statínmi sú uvedené v tab. 2.
2. Najčastejšie liekové interakcie statínov 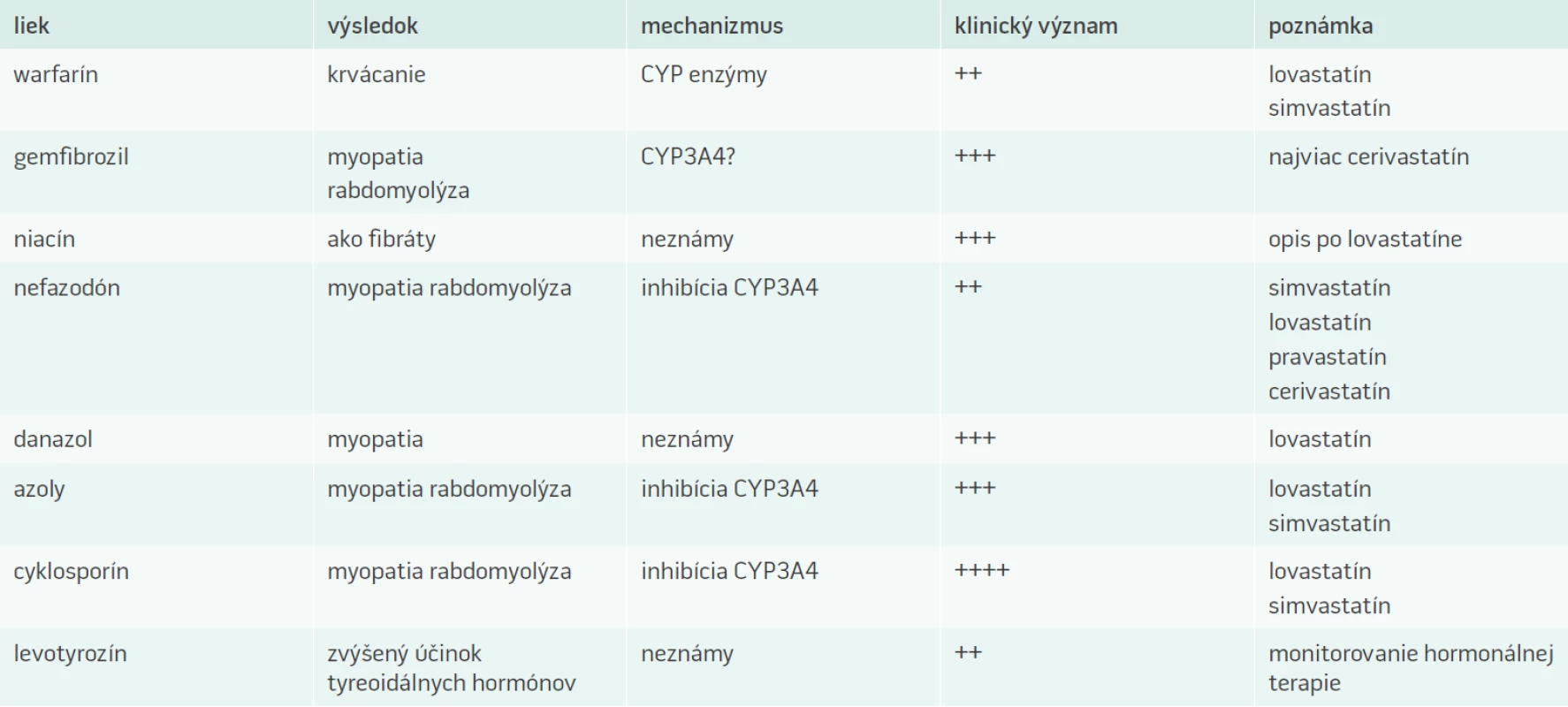
Atorvastatín, jeden z najviac používaných statínov v súčasnosti, je metabolizovaný cytochrómom P450 izoenzýmom 3A4. Interakcie môžu nastať pri podávaní atorvastatínu s inhibítormi tohto izoenzýmu. Medzi inhibítory P450 3A4 patrí cyklosporín, makrolidové antibiotiká vrátane erytromycínu a klaritromycínu, nefazodón a antimykotiká azolového typu vrátane itrakonazolu. Súčasné podávanie týchto liečiv môže viesť ku zvýšeným koncentráciám atorvastatínu v plazme. Opatrnosť z hľadiska liekových interakcií vyžaduje najmä podávanie vysokých dávok atorvastatínu.
Najčastejšou potravinovou interakciou so statínmi predstavuje grapefruitová šťava. Táto obsahuje jednu alebo viac zložiek, ktoré inhibujú CYP3A4 a môžu zvýšiť plazmatické koncentrácie liekov, ktoré sú metabolizované CYP3A4 [4].
Rosuvastatín nie je inhibítorom ani induktorom izoenzýmov cytochrómu P450. Navyše rosuvastatín je slabým substrátom pre tieto izoenzýmy. Liekové interakcie v súvislosti s metabolizmom sprostredkovaným cytochrómom P450 sa preto neočakávajú. Môžu sa však vyskytnúť interakcie s antagonistami vitamínu K, s perorálnymi kontraceptívami, azatanavirom a cyklosporínom [5].
Statíny a myopatia
Najväčším problémom pri liečbe všetkými prípravkami zo skupiny statínov je vznik myopatie (od myalgie až po rabdomyolýzu). Doposiaľ neboli jednoznačne objasnené mechanizmy a príčiny jej vzniku. Jedná sa o skupinový efekt statínov. Rabdomyolýza môže vzniknúť pri liečbe akýmkoľvek statínom, a to kedykoľvek v jej priebehu [6]. Prodromálne symptómy pri možnosti vzniku myopatie sú rôzne. Asi u 5 % pacientov sa v priebehu liečby statínmi vyskytujú bolesti svalstva a kĺbov, pri ktorých sa však signifikantne nezvýši hladina kreatínkinázy (CK) [7,8]. U niektorých pacientov môže naopak dôjsť k vzostupu CK bez svalových ťažkostí [9]. Údaje o výskyte závažnej myopatie s bolesťami, svalovou slabosťou a únavou, ktoré sú sprevádzané zvýšením CK nad 10-násobok hornej hranice normy sú rôzne. Najčastejší výskyt závažných myopatií bol zaznamenaný pri liečbe cerivastatínom , v porovnaní s inými statínmi išlo o 16 až 80-krát vyšší výskyt. Najzávažnejšie prípady sa týkali kombinovanej liečby cerivastatínom s gemfibrozilom. Pre tento vysoký výskyt nežiaducich účinkov bol cerivastatín celosvetovo stiahnutý z trhu (deregistrovaný).
Pri vzniku myopatie spôsobenej statínovou liečbou zohrávajú úlohu viaceré faktory. Na prvom mieste je to dávka alebo zvýšenie plazmatických hladín statínov ako následok liekových respektíve potravinových interakcií. Postihnutí sú zvyčajne pacienti s viacerými chronickými ochoreniami, alebo pacienti, ktorí užívajú viaceré lieky súčasne. Do úvahy prichádzajú tiež farmakogenetické faktory, liekové interakcie na metabolickej úrovni a iné predispozičné faktory zo strany pacienta (napríklad genetický polymorfizmus štruktúry myoglobínu). Jednoznačne je potrebné brať do úvahy, že sa jedná o multifaktoriálnu genézu tohto nežiaduceho účinku statínov. V metaanalýze, pri ktorej sa hodnotil výskyt rabdomyolýzy u 170 000 pacientov liečených intenzívnou statínovou terapiou, bolo zaznamenaných celkovo 28 prípadov výskytu v aktívne liečených skupinách a 15 prípadov v kontrolných skupinách [10]. Väčšie riziko nárastu závažnej myotoxicity predstavovali pacienti, ktorí užívali v dennej dávke 80 mg simvastatínu. Podobné výsledky priniesla klinická štúdia SEARCH so simvastatínom. Na základe týchto nálezov bolo odporučené vyvarovať sa u nových pacientov liečby simvastatínom v aplikovanej dennej dávke 80 mg [11,12]. Vo vzťahu jednotlivých statínov k vzniku myopatií existujú určité molekulové rozdiely.
Najúčinnejšie statíny (atorvastatín a rosuvastatín) sú z hľadiska myotoxicity, ktorá bola dokumentovaná výsledkami viacerých klinických štúdií, porovnateľné. Je pravda, že v prípade atorvastatínu existuje väčšie množstvo dôkazov, ktoré deklarujú jeho bezpečnosť použitia, a to aj v prípadoch podávania vysokých dávok. Týka sa to aj rizikovejšej skupiny , akú predstavuje populácia starších pacientov [13]. Vzhľadom na to, že sa stále rozširuje spektrum pacientov, ktorí budú užívať statínovú liečbu, je potrebné myslieť aj na výskyt nežiaducich účinkov a liečbu a jej riziká posudzovať individuálne s ohľadom na konkrétneho pacienta. Symptómy svalového poškodenia je potrebné v bežnej klinickej praxi aktívne vyhľadávať. Ak sa vyskytnú, mala by byť liečba prerušená a po odznení klinických symptómov je možné pacientovi podať niektorý iný typ statínu. Mali by sme vyskúšať aspoň tri molekuly statínov. V tomto prípade je veľmi dôležitá spolupráca špecialistu s praktickým lekárom, ktorý má možnosť takýchto pacientov lepšie a častejšie monitorovať [14].
Pri laboratórnom vyšetrení sledujeme sérovú hodnotu kreatínkinázy (CK). Prvé vyšetrenie by sa malo realizovať pred začatím statínovej liečby a potom vždy pri zvyšovaní dávky alebo pri klinických príznakoch svalového poškodenia [15]. Liečba statínom by mala byť prerušená pri asymptomatickom zvýšení CK nad 5-násobok horného limitu normálnej hodnoty. U pacienta s klinickými príznakmi myopatie by mala byť liečba prerušená alebo upravená bez ohľadu na aktivitu CK.
Statíny a diabetes
V posledných rokoch sa často stretávame s problematikou statínovej liečby, a to z hľadiska možného zvyšovania rizika vzniku diabetu. V roku 2010 bola publikovaná práca Sattar et al, ktorá prináša metaanalýzu z viacerých randomizovaných klinických štúdií, ktorá preukázala, že liečba statínom môže zvýšiť riziko vzniku diabetu 2. typu o 10 % [ 16].
Zatiaľ neexistuje jednoznačné vysvetlenie, akým mechanizmom dochádza k tomuto zvýšenému riziku vzniku diabetu. Posledné výskumy naznačujú, že hlavná príčina statínmi indukovaného diabetu spočíva v zhoršenej funkcii beta buniek pankreasu s následným znížením schopnosti pankreasu produkovať dostatočné množstvo inzulínu. Jedným z možných procesov je inhibícia transportérov glukózy a spomalenie produkcie ATP s následkom poklesu sekrécie inzulínu. Koncovým štádiom poškodenia beta bunky pankreasu môže byť apoptóza [17]. Toto riziko je vyššie u pacientov, ktorí majú ďalšie rizikové faktory pre vznik diabetu (napríklad metabolický syndróm alebo pozitívnu rodinnú anamnézu ohľadom výskytu diabetu, vysoký BMI) a tiež u tých, ktorí užívajú vysoké dávky statínov, najmä rosuvastatín. Je však potrebné zdôrazniť, že diabetogenný účinok majú všetky molekuly statínov. Rosuvastatínová štúdia JUPITER bola však prvá, ktorá na zvýšené riziko vzniku diabetu u pacientov užívajúcich statíny upozornila. V štúdii JUPITER bola hlásená celková frekvencia diabetes mellitus 2,8 % u rosuvastatínu a 2,3 % u placeba, väčšinou u pacientov s glykémiou nalačno 5,6–6,9 mmol/l [18].
Faktormi zvyšujúcimi riziko vzniku diabetu sa tiež zaoberala analýza štúdií s vysoko dávkovaným atorvastatínom. V tejto analýze predstavovalo zvýšenie hodnôt glykémie nalačno najsilnejší prediktor zvyšujúci riziko s podávaním statínu,a to takmer 6-násobne. Na druhom mieste bolo zvýšené BMI spojené s 3-násobným nárastom rizika. Pacienti s hypertriglyceridémiou mali pri podávaní atorvastatínu 2-násobné riziko rozvoja diabetu oproti pacientom v placebovej skupine. V kategórii pacientov s vysokým a veľmi vysokým rizikom však prospech liečby statínom jednoznačne prevyšoval toto riziko, a preto nie je dôvod prehodnocovať v praxi indikáciu statínov [19]. Je však dôležité všímať si príznakov zvýšeného rizika vzniku diabetu u pacientov liečených statínmi a starostlivo sledovať glukózovú homeostázu a súčasne zdôrazňovať dodržiavanie režimových opatrení podľa príslušných odporúčaní. Zvýšenú pozornosť je potrebné venovať najmä pacientom v štádiu poruchy glukózovej tolerancie a zvážiť súčasnú liečbu metformínom.
Statíny a nádorové ochorenia
Známe pozorovania z epidemiologických štúdií, ktoré dokladujú nepriamu úmernosť medzi koncentráciou cholesterolu v plazme a výskytom nádorových ochorení stále podnecujú diskusiu o možnom riziku statínovej terapie (aktívnym znižovaním plazmatických koncentrácií aterogenných lipidov) vo vzťahu k možnej kancerogenéze. Táto problematika sa stala súčasťou mnohých klinických štúdií, ktoré sa vo svojich dizajnoch venovali incidencii nádorových ochorení. Výsledky niektorých štúdií preukázali zvýšenie výskytu malignít pri statínovej terapii. Napríklad v pravastatínovej štúdii PROSPER autori zaznamenali u staršej populácie vyšší výskyt gastrointestinálnych tumorov [20].
V súčasnosti existuje dostatočné množstvo dôkazov na to, aby sme mohli konštatovať, že pri statínovej terapii nebolo zvýšené riziko maligných ochorení preukázané. Metaanalýza 27 klinických štúdií, ktorá zahŕňala viac ako 170 000 pacientov, publikovaná v roku 2012, preukázala, že ani u podskupiny dosahujúcej v liečbe statínom koncentráciu LDL-cholesterolu 1,3 mmol/l sa neobjavila zvýšená incidencia nádorových ochorení. Táto najväčšia metaanalýza preukázala, že statíny neznižujú riziko vzniku ani nezlepšujú prognózu žiadneho typu nádorového ochorenia [21]. V súčasnosti prevláda názor, že podávanie statínov (a s tým súvisiaci pokles plazmatických koncentrácií LDL-cholesterolu) má z hľadiska nádorových ochorení neutrálny charakter.
Statíny a pečeňové funkcie
Podľa správy, ktorú vydala FDA (Food and Drug Administration) roku 2012 po dôslednej analýze dostupných dát, všetky v súčasnosti používané statíny majú veľmi nízke riziko závažnej hepatotoxicity, a preto vôbec neodporúča rutinné vyšetrovanie hepatálnych aminotransferáz u osôb liečených statínmi. Porovnanie dvoch najúčinnejších statínov poukazuje na mierne vyšší výskyt elevácie hladín aminotransferáz u skupiny pacientov užívajúcich atorvastatín oproti rosuvastatínu. V priamom porovnaní realizovanom v štúdii SATURN bol výskyt zvýšenia ALT (alanín – aminotransferáza) na viac ako 3-násobok horného limitu normy v atorvastatínovej skupine 2 % a 0,7 % u pacientov liečených rosuvastatínom [22]. Tento výsledok možno považovať za jednoznačný dôkaz, že použitie oboch najúčinnejších statínov možno z hľadiska hepatotoxicity považovať za bezpečné.
Metaanalýza štúdií, ktoré sledovali účinnosť a bezpečnosť statínovej liečby v porovnaní s tzv. „bežnou liečbou“, preukázala zvýšenie výskytu elevácie hladín transamináz, ktorý bol približne 4-krát častejší v skupine pacientov liečených intenzívnou liečbou. Aj v intenzívnych ramenách klinických štúdií bol vzostup hladín transamináz pozorovaný väčšinou u menej ako 4 % pacientov a prerušenie liečby z týchto dôvodov bolo vzácne [23].
Statíny a obličkové funkcie
Molekuly statínov sa vyznačujú tým, že sa líšia svojím pôsobením na ovplyvnenie obličkových funkcií. V súčasnosti je dobre známe, že rosuvastatín (najmä na začiatku liečby) môže spôsobiť mierny pokles glomerulovej filtrácie a zvýšiť podiel chorých s proteinúriou (najskôr tubulárneho pôvodu). Tomu odpovedá aj kontraindikácia podávania rosuvastatínu u pacientov s chronickým ochorením obličiek klasifikovaným stupňom 3 a viac (glomerulová filtrácia, e-GFR 30–59 ml/min a nižšia) [5]. Oproti tomu podávanie atorvastatínu možno považovať u tejto skupiny pacientov za bezpečné. Prítomnosť ochorenia obličiek alebo zvýšené riziko jeho vzniku môže byť teda kritériom, ktoré nám môže pomôcť pri rozhodovaní o typu statínovej liečby. Pokiaľ ide o vplyv statínov na obličkové funkcie a progresiu ich poklesu, táto bola sledovaná v mnohých klinických štúdiách, ktoré priniesli nie celkom jednoznačné závery. Väčšina klinických štúdií preukázala skôr priaznivý vplyv statínovej terapie hodnotený spomalením poklesu glomerulovej filtrácie pri porovnávaní skupín liečených statínom a placebom. Podobný bol aj pozorovaný vplyv statínovej liečby na výskyt proteinúrie. Záverom možno konštatovať, že podávanie statínov možno považovať z hľadiska ovplyvnenia funkcie obličiek za bezpečné [12,23].
Statíny a gravidita
Všetky statíny sú kontraindikované v gravidite. Stále sa však častejšie stretávame s tým, že sa gravidita posúva do neskoršieho veku oproti tomu, ako to bolo v minulosti, a tým sa zvyšuje používanie statínov vo fertilnom období, čo má za následok zvýšenie expozície statínovej liečby aj počas gravidity. V kontraste s niektorými staršími publikáciami, ktoré upozorňovali na teratogénne účinky statínov, novšie observačné štúdie sa snažia túto problematiku opäť otvoriť a nájsť jednoznačnú odpoveď na možné riziko statínov pri užívaní počas gravidity. Skutočnosť, či sú statíny zodpovedné za kongenitálne anomálie alebo iné komplikácie v gravidite, ostáva aj naďalej dôležitou klinicko-farmakologickou otázkou. V roku 2016 publikovali americkí autori výsledky 16 klinických štúdií formou systematického prehľadu. Údaje z týchto observačných štúdií nezaznamenali zvýšenú prevalenciu kongenitálnych anomálií u žien, ktoré užívali počas gravidity statíny v porovnaní s kontrolnými skupinami gravidných žien z bežnej populácie. Výsledky týchto sledovaní podporujú závery, že statíny nie sú pravdepodobne teratogénne, ale pokiaľ nebude k dispozícii viacero jednoznačných údajov, statíny by sa nemali počas gravidity užívať [24].
Záver
Statíny sú v súčasnosti považované za jednu z najčastejšie používaných farmakoterapeutických skupín. Ich spotreba úmerne narastá s novými poznatkami o ich možnostiach použitia vo viacerých indikáciách, vo veľkej miere sa uplatňujú práve ich pleiotropné účinky. Aj keď ich možno zaradiť medzi látky s veľmi dobrou znášanlivosťou a širokým „terapeutickým oknom“, pri rozsiahlom používaní predovšetkým u rizikových skupín pacientov musíme mať na zreteli aj ich možné riziká a individuálne posudzovať pravdepodobnosť vzniku nežiaducich účinkov. Ide často o celoživotnú liečbu, a preto je na mieste jej klinický a laboratórny monitoring a taktiež posúdenie komplexnej liečby u daného pacienta, a to najmä z pohľadu liekových interakcií. Aj pri liečbe statínmi sa môže objaviť „syndróm z vynechania“ po náhlom prerušení liečby, a pravé preto je pri liečbe statínmi dôležité dbať na dobrú komplianciu, nakoľko prerušovanie terapie môže priniesť opačný efekt, a to vo forme zvýšenia morbidity a mortality.
Doručené do redakcie/Doručeno do redakce/Received 12. 1. 2017
Prijaté po recenzii/Přijato po recenzi/Accepted 30. 1. 2017
doc. MUDr. Jana Sirotiaková, PhD.
jana.sirotiakova@nsplevice.sk
Sources
1. Rašlová K, Tkáč I, Fábryová Ľ. Racionálna liečba dyslipoproteinémií. Metodický list Ústrednej komisie racionálnej farmakoterapie a liekovej politiky MZ SR 2005; 9(36): 1–6.
2. Werner N, Nickenig G, Laufs U. Pleiotropic effects of HMG-CoA reductase inhibitors. Basic Res Cardiol 2002; 97(2): 105–116.
3. Pella D, Mechírová V, Rybár R et al. Pleiotropné účinky statínov. Interná med 2004; 4(4): 259–261.
4. Böger RH. Drug interaction of the statins and consequences for drug selection. Int J Clin Pharmacol Ther 2001; 39(9): 369–382.
5. Gajdoš M. Rosuvastatín: nový inhibítor 3-hydroxy-3-methylglutaryl koenzým A reduktázy. Interná med 2003; 3(12): 753–754.
6. Murty M, Mc Morran M, Vu D. Statins : rhabdomyolysis and myopathy. CMAJ 2002; 166(1): 85–86; 90–91.
7. Framer JA. Learning from the cerivastatin experience. Lancet 2001; 358(9291): 1383–1385.
8. Pedersen TR, Tobert JA. Benefits and risks of HMG-CoA reductase inhibitors in the prevention of coronary heart disease: a reappraisal. Drug Saf 1996; 14(1): 11–24.
9. Pasternak RC, Smith SC, Bairey-Merz NC et al. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins, J Am Coll Cardiol 2002; 40(3): 567–572.
10. [Cholesterol Treatment Triallists´ (CTT) Collaboration]. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta – analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376(9753): 1670–1681. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(10)61350–5>.
11. SEARCH Collaborative Group. SLCO1B1 Variants and statin-Induced Myopathy – A Genomewide Study. N Engl. J Med 2008; 359(8): 789–799. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0801936>.
12. FDA Drug Safety Communication: Important safety label changes to cholesterol-lowering statin drugs. [28.2.2012]. Dostupné z WWW: <http://www.fda.gov/Drugs/DrugSafety/ucm293101.htm>.
13. Hey-Hadavi JH, Kuntze E, Luo D et al.Tolerability of atorvastin in a population aged ˃ or 65years: a retrospective pooled analysis of results from fifty randomized clinical trials. Am J Geriatr Pharmacother 2006; 4(2): 112–122.
14. Vrablík M. Co se děje v současnosti kolem statinů? Remedia 2013; 23(2): 151–154.
15. Catapano AL, Reiner Z, De Backer G et al. ESC/EAS Guidelines for the management of dyslipidemias. Atherosclerosis 2011; 217(1): 3–46.
16. Sattar N, Preiss D, Murray HM et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375(9716): 735–742. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)61965–6>.
17. Sampson UK, Linton MF, Fazio S. Are statins diabetogenic? Curr Opin Cardiol 2011; 26(4):342–347. Dostupné z DOI: <http://dx.doi.org/10.1097/HCO.0b013e3283470359>.
18. Ridker PM, Pradhan A, MacFadyen JG et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet 2012; 380(9841): 565–571. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)61190–8>.
19. Waters DD, Ho JE, Boekholdt S et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline riskfactors for diabetes. J Am Coll Cardiol 2013; 61(2): 148–152. Dostupné z DOI: http://dx.doi.org/10.1016/j.jacc.2012.09.042>.
20. Shepherd J, Blauw GJ, Murphy MB et al. Pravastatin in elderly individualsat risk of vascular disease (PROSPER): randomised controlled trial. Lancet 2002; 360(9346): 1623–1630.
21. Emberson JR, Kearney PM, Blackwell L et al. [Cholesterol Treastment Triallists´(CTT) Collaboration]. Lack of effect of lowering LDL cholesterol on cancer: meta-analysis of individualdata from 175,000people in 27randomised trialson statin therapy. PLoS One 2012; 7(1): e29849. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0029849>.
22. Nicholls SJ, Borgman M, Nissen SE et al. Impact of statins on progression of atherosclerosis: rationale and design of SATURN (Study of Coronary Atheroma by Intravascular Ultrasound : effect of Rosuvastatin versus Atorvastatin. Curr Med Res Opin 2011; 27(6): 1119–1129. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2011.570746>.
23. Chan DK, O´Rourke F, Shen Q et al. Meta-analysis of the cardiovascular benefits of intensive lipid lowering therapy with statins. Acta Neurol Scand 2011; 124(3): 188–195. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–0404.2010.01450.x>.
24. Karalis DG, Hill AN, Clifton S et al. The risks of statin use in pregnancy: A systematic review. J Clin Lipidol 2016; 10(5): 1081–1090. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2016.07.002>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adults
Article was published inAthero Review

2017 Issue 1-
All articles in this issue
- The review of drug interactions and risks of statin therapy
- Adherence to treatment – an important part of reaching therapeutic effects on chronic conditions
- Adherence to treatment according to the psychologist
- A diabetologist‘s view on the metabolic surgery in the treatment of patients with type 2 diabetes
- The common position of the Czech professional associations on the consensus of the European Atherosclerosis Society and the European Federation of Clinical Chemistry and Laboratory Medicine regarding investigation on blood lipids and interpretation of their levels
- Athero Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adherence to treatment – an important part of reaching therapeutic effects on chronic conditions
- The review of drug interactions and risks of statin therapy
- Adherence to treatment according to the psychologist
- A diabetologist‘s view on the metabolic surgery in the treatment of patients with type 2 diabetes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

