-
Medical journals
- Career
Přelom v léčbě hypercholesterolemie – inhibitory PCSK9. Co zatím víme o alirokumabu (přípravku Praluent®)
: Richard Češka 1; Lucie Votavová 2; Tanja Aleksičová 2
: Centrum preventivní kardiologie, III. interní klinika 1. LF UK a VFN v Praze, Česká republika 1; ScreenPro FH, z. s., Praha, Česká republika 2
: AtheroRev 2016; 1(1): 34-41
: Reviews
Dnes již jsou celosvětově (alirokumab byl prvním lékem této skupiny na světě registrovaným americkou lékovou agenturou FDA), tak v Evropě registrována zcela nová hypolipidemika, která se v mnoha směrech odlišují od léků do současnosti podávaných. Přinášejí přitom další významný posun v léčbě poruch tukového metabolizmu i v preventivní kardiologii. Registrovanými přípravky jsou alirokumab, Praluent a evolokumab, přípravek Repatha. Alirokumab je plně humánní monoklonální protilátka proti enzymu PCSK9 (proprotein konvertáza subtilizin kexin 9). Enzym PCSK9 hraje významnou roli v metabolizmu LDL-cholesterolu tím, že ovlivňuje odbourávání, a posléze pak i počet a aktivitu LDL-receptorů. Pro každodenní klinickou praxi je podstatné, že se léky této skupiny podávají parenterálně, subkutánní injekcí. V případě Praluentu® je interval podání jedenkrát za dva týdny. Dávka je potom 75 nebo 150 mg v injekci s obsahem 1 ml. Z klinického hlediska je významné především to, že alirokumab snižuje koncentraci LDL-cholesterolu o 50–60 %, snižuje hladinu lipoproteinu a o 25–30 %, pozitivně ovlivňuje i další složky lipidového metabolizmu a především má velmi pravděpodobně potenciál ke snížení kardiovaskulárního rizika. I když výsledky morbiditně-mortalitních studií jsou očekávány až v příštích letech, první analýzy vyznívají výrazně ve prospěch klinicky významného snižování KV-příhod. Alirokumab (Praluent®) je možno podávat v monoterapii (zejména u nemocných se statinovou intolerancí), zejména však bude podáván v kombinaci s dalšími hypolipidemiky (zejména statiny) u nemocných, u kterých se nedaří dosáhnout cílových hodnot.
Klíčová slova:
alirokumab – familiární hypercholesterolemie – hypercholesterolemie – hypolipidemika – Praluent®Úvod
Terapie hyperlipoproteinemií a dyslipidemií (HLP a DLP) je v současné době akceptována jako racionální a obecně akceptovaný přístup v prevenci kardiovaskulárních onemocnění (KVO) podmíněných aterosklerózou. Navzdory obrovskému pokroku v terapii HLP, který je dokumentován například metaanalýzami statinových studií, ale i pozitivními výsledky studie IMPROVE IT, která potvrdila platnost LDL principu a redukci KVO na základě „nestatinového“ snížení LDL-cholesterolu, stále existuje významný počet nemocných, u kterých se KVO projeví, a mnozí na něj umírají. Podíváme-li se na výsledky studie POSCH (Program on the Surgical Control of the Hyperlipidemias – léčba HLP ileálním by-passem) dokladující regresi aterosklerózy po léčbě LDL-aferézou, nemůžeme přehlédnout, že naším zásadním terapeutickým opatřením v prevenci KVO musí být snaha o maximální snížení LDL-cholesterolu (LDL-C). A protože současná léčba (především statiny, vysokodávkovanými statiny a statiny v kombinaci s ezetimibem), jakkoliv je velmi účinná, nevede u vysokého procenta nemocných s HLP k dosažení cílových hodnot, nelze se divit snaze o vývoj nových ještě účinnějších hypolipidemik. Toto úsilí o přípravu nových hypolipidemik vedlo k přípravě několika skupin léků, z nichž největší perspektivu lze předpokládat u skupiny PCSK9 inhibitorů. V Evropě i v USA jsou již lékovými agenturami registrovány alirokumab Praluent® společnosti Sanofi, a evolokumab Repatha® společnosti Amgen. Toto sdělení je zaměřeno na alirokumab a přináší přehled výsledků a prvních zkušeností s tímto přípravkem.
Poznámky k historii objevu PCSK9-inhibitorů
Velmi zajímavá je historie, jak byla skupina inhibitorů PCSK9 objevena. Pozoruhodná je také rychlost, s jakou vývoj probíhal. V roce 2003 byla PCSK9 objevena, v roce 2005 byla prokázána vazba na LDL-R a začátek „klinického“ výzkumu a vývoje je spojen s průkazem nízkých koncentrací cholesterolu a především pak poklesem výskytu KVO u skupiny Američanů, kteří měli defekt v tomto enzymu (2006). Od tohoto nálezu se pak odvíjely snahy jak PCSK9 ovlivnit léčebně. Z několika potenciálních cest postoupila nejdále, nyní již ke klinickému využití, inhibice PCSK9 monoklonálními protilátkami. Jen jako zajímavost uvedu, že první pacient byl MAB proti PCSK9 léčen v roce 2010.
Mechanizmus účinku PCSK9 inhibitorů
PCSK9 inhibitory (nebo monoklonální protilátky) představují skupinu léků, které blokují enzym PCSK9 (proprotein konvertáza subtilizin kexin 9). Tento enzym je zodpovědný za degradaci LDL receptorů (LDL-R) v buňce. Jestliže se podaří PCSK9 zablokovat, LDL-R nejsou odbourány v lyzosomu, mohou recirkulovat na povrch buňky, kde se zvyšuje jejich počet a zvyšuje se odbourávání LDL částic z plazmy. Následný pokles plazmatických koncentrací celkového i LDL-C je pak samozřejmě logickým důsledkem. Mechanizmus účinku alirokumabu je znázorněn na obr. 1 a obr. 2. Alirokumab je plně humánní monoklonální protilátka (MAB) proti PCSK9. Některými autory jsou právě proto léky této skupiny označovány jako protilátky, převažuje však pragmatičtější označení „inhibitory“.
1. Mechanizmus účinku PCSK9 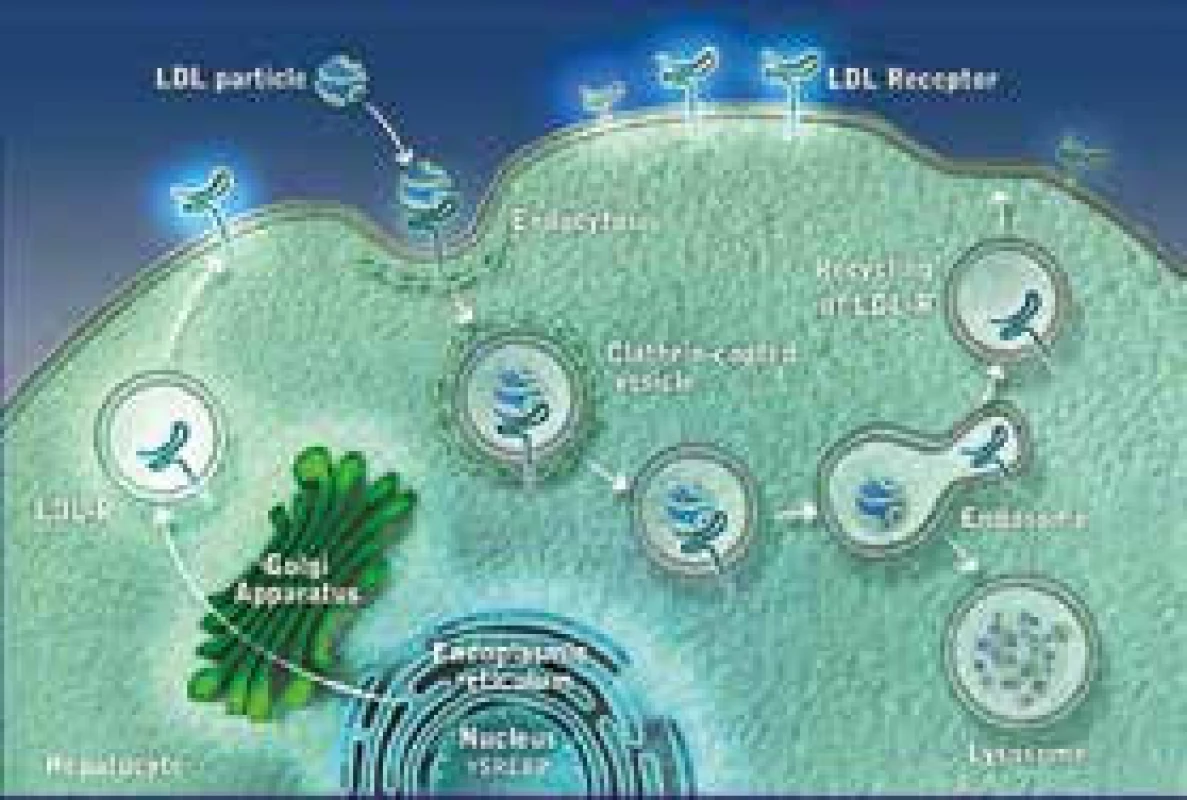
LDL particle – částice LDL LDL Receptor – receptor LDL-R – receptor LDL Recycling of LDL-R – recyklace LDL receptoru Endocytosis – endocytóza Clathrin-coated vesicle – vezikuly potažené klatrinem Endosome – endosom Lysosome – lyzosom Endoplasmic reticulum – endoplazmatické retikulum Nucleus – jádro Hepatocyte – hepatocyt 2. Mechanizmus účinků PCSK9 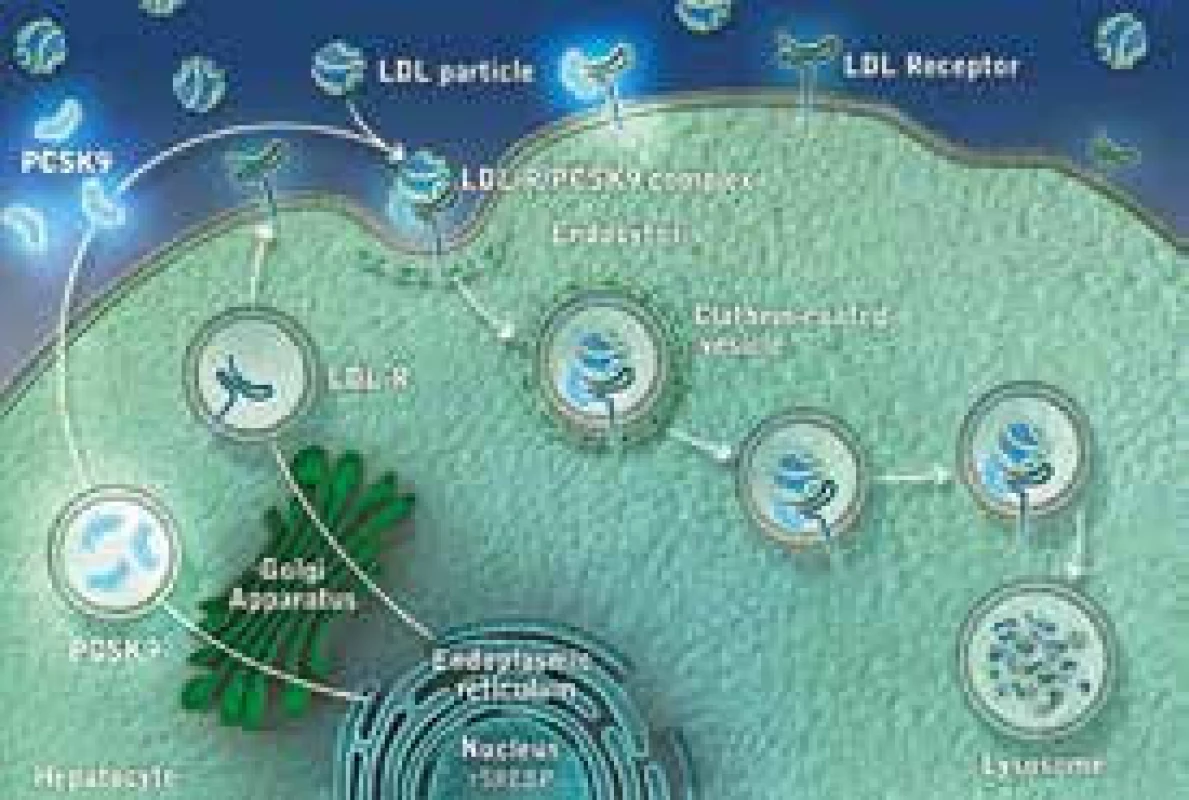
LDL particle – částice LDL LDL Receptor – receptor LDL-R – receptor LDL Recycling of LDL-R – recyklace LDL receptoru Endocytosis – endocytóza Clathrin-coated vesicle – vezikuly potažené klatrinem Endosome – endosom Lysosome – lyzosom Endoplasmic reticulum – endoplazmatické retikulum Nucleus – jádro Hepatocyte – hepatocyt Přehled studií s Praluentem®
Alirocumab (Praluent®) byl pochopitelně od počátku vývoje experimentálně testován v rozsáhlém programu studií, který následuje S ohledem na to, že se naše centrum preventivní kardiologie účastnilo celé řady studií, ve kterých byly a jsou ověřovány účinky alirokumabu, uvedu na počátek vlastní zkušenost. Inhibitory PCSK9 nebyly prvními hypolipidemickými léky, které se podávají parenterálně, nicméně musím uvést, že zkušenost s těmito léky byla až překvapivě dobrá (na tomto místě ponechávám trochu stranou subjektivní představu, že pacienti nebudou chtít „kvůli cholesterolu“ aplikovat injekce: opak byl pravdou a za použití aplikátoru jsou pacienti s autoaplikací více než spokojeni). Pacienti tolerují alirokumab (75 mg nebo 150 mg 1krát za dva týdny, subkutánní injekce 1 ml v předplněné stříkačce/aplikátoru – obr. 3) velmi dobře, nežádoucí účinky prakticky nejsou. V bezpečnostní laboratoři, pokud jde o vynikající hypolipidemický účinek, musím slevit ze subjektivního pohledu a odkázat na oficiální publikovaná data, protože studie jsou zaslepené.
3. Předplněné stříkačky, aplikátory pro autoinjekce pro PRALUENT<sup>®</sup> alirokumab 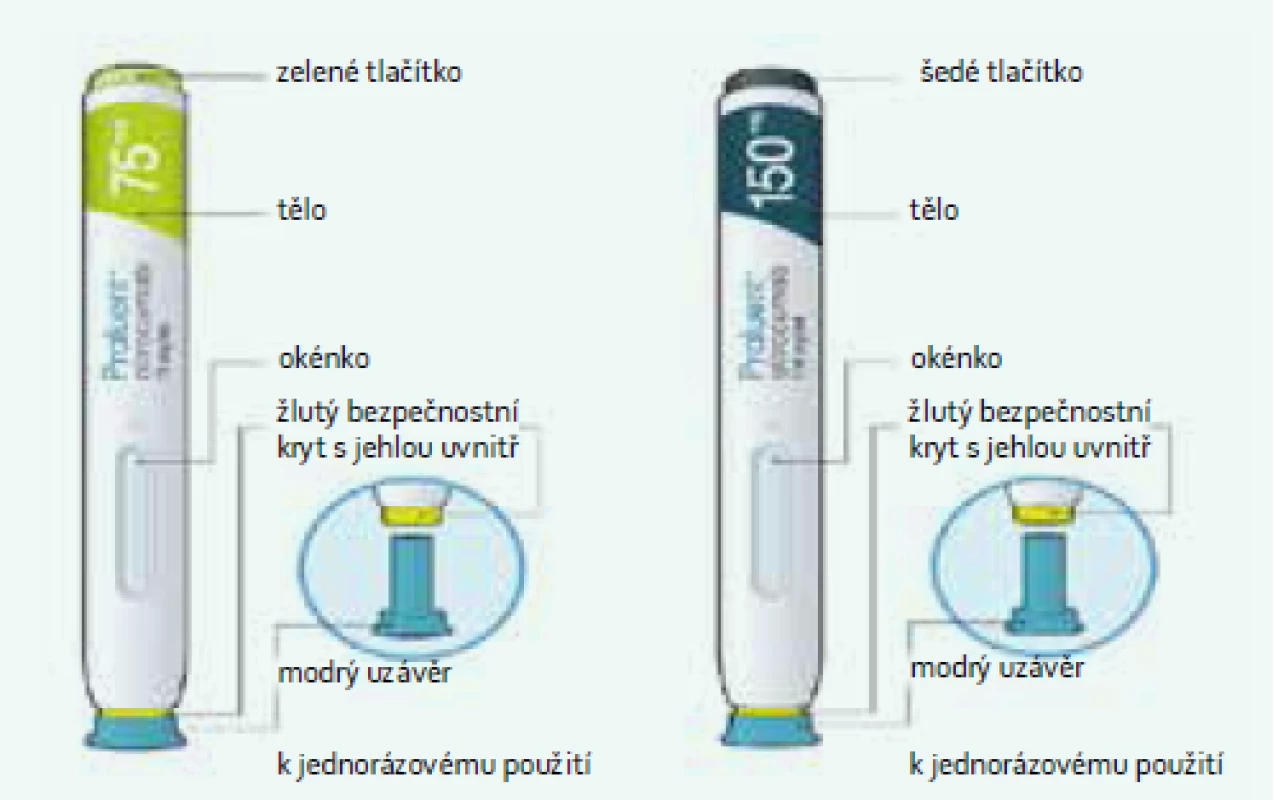
Alirokumab a jeho bezpečnost a účinnost byly a jsou ověřovány v rozsáhlém programu ODYSSEY. Praluent® byl nejdříve ověřován ve studiích na zvířatech, posléze na zdravých dobrovolnících a finálně samozřejmě u indikovaných nemocných.
Nechci čtenáře unavovat podrobným výčtem studií s jejich přesnými výsledky, proto jen pro přehled uvedu, že alirokumab byl ověřován ve studiích:
- u nemocných s familiární hypercholesterolemií (FH), studie Odyssey FH I, FH II a high FH
- u nemocných se statinovou intolerancí, Odyssey Alternative
- v monoterapii, Odyssey mono
- v kombinaci se statiny a ezetimibem, Odyssey Opitions I a II, Odyssey Combo I a II
- v dlouhodobé studii, Odyssey Long Term
V každém případě jsou výsledky až neuvěřitelně konzistentní, samozřejmě, s jistou variabilitou odpovídající studované populaci, ale rozhodně jednoznačné. Koncentrace LDL-C se snižuje o 50 až > 60 %, hladina apoB klesá o 40–50 %, koncentrace nonHDL-C se snižuje o zhruba 50 %. K pozitivním změnám dochází i u parametrů, které nejsou primárním cílem léčby alirokumabem, u HDL-C a triglyceridů.
Při hodnocení výsledků je třeba uvést jednu důležitou metodologickou poznámku. Při interpretaci výsledku je vždy třeba uvést, zda konečnou hodnotu porovnáváme s hodnotou vstupní, nebo se jedná o srovnání placebo vs aktivní léčba na konci studie (častým jevem je totiž vzestup hodnot po placebu, a tím pádem optickému zvýraznění výsledku).
Jiným pohledem na účinnost inhibitorů PCSK9 je zhodnocení procenta nemocných, kteří dosahují cílových hodnot LDL-C. Opět samozřejmě záleží na charakteristice sledované skupiny a také na tom, jakou cílovou hodnotu jsme stanovili na počátku studie. V každém případě ale léčba alirokumabem vedla k výraznému nárůstu nemocných, kteří cíle LDL-C dosáhli. Cílové hodnoty dosahovalo nejčastěji okolo 70 % nemocných (se širším rozmezím od 40 do 80 %). Protože jsou, jak je uvedeno, výsledky studií velmi homogenní, dovolím si pro ilustraci uvést výsledky několika studií (graf 1–3). Graf 1 demonstruje velmi průkazný pokles LDL-C o více než 60 % ve studii Odyssey long term. Pokles LDL-C přitom není závislý na výchozí koncentraci LDL-C. Graf 2 potom ukazuje, že účinek alirokumabu nastupuje velmi rychle, plný účinek je patrný již po několika týdnech léčby. Účinek je potom setrvalý a nedochází k jeho zmenšení v čase. Graf 3 znázorňuje účinek alirokumabu na sekundární sledované lipidové parametry. Významný pokles non-HDL-C by bylo lze očekávat, podobně jako pokles koncentrace apolipoproteinu B. Poněkud překvapivým, ale o to pozitivnějším nálezem je snížení LP(a), který je, jak známo, samostatným rizikovým faktorem pro rozvoj KVO. Hladiny Lp(a) se dosud nedařilo žádným reálně používaným hypolipidemikem ovlivnit. Alirokumabem dosahovaný pokles Lp(a) ve většině studií zhruba o 30 % může mít z preventivně kardiologického hlediska skutečně velký význam. Ten by mohl být ještě více vyjádřen třeba u nemocných s familiární hypercholesterolemií, u kterých bude Praluent® jistě často indikován. Právě u těchto nemocných se zvýšeným koncentracím Lp(a) připisuje mimořádný nárůst KV-rizika. Bude proto mimořádně zajímavé sledovat klinický odraz snížení tohoto významného rizikového parametru.
1. Po Praluentu se LDL-C snižuje rychle a setrvale 
2. Snížení LDL-C podle výchozí koncentrace LDL-C: ODYSSEY LONG TERM 
3. Ovlivnění lipidových parametrů Praluentem 
adjustované LS mean (SE) vykázané pro Lp(a) Trochu odlišným pohledem na problematiku účinnosti hypolipidemik je dosahování cílových hodnot. I když sám jsem zastáncem principu „čím níže, tím lépe“, alespoň pro LDL-C, nemohu přehlédnout výsledky, které znázorňuje graf 4. Převážná většina nemocných, kteří jsou léčeni alirokumabem přidaným k zavedené hypolipidemické léčbě dosahuje cílových hodnot LDL-C. Přitom je samozřejmě jasné, že do klinického sledování byli zařazeni vysoce rizikoví nemocní, kteří měli již vstupně výrazně zvýšené hodnoty LDL-C a dosažení cílových hodnot bylo standardní léčbou téměř nemožné.
4. Dosahování cílových hodnot LDL-C Praluentem 
ITT-analýza – analýza podle původního léčebného záměru (intent-to-tret) LLT – hypolipidemická léčba (lipid-lowering therapy) Bezpečnost a tolerance léčby alirokumabem
V současné době je stále trochu podceňovaná otázka tolerance a nežádoucích účinků. Ta se totiž velmi často pojí s tím, jak bude léčba pacienty užívána. A zejména v oblasti preventivní kardiologie (včetně léčby statiny, ale i antihypertenzivy) je kompliance a adherence k léčbě poměrně významným problémem.
Studie alirokumabem prokázaly skutečně mimořádně dobrou toleranci léčby nemocnými. Výskyt nežádoucích účinků je řídký, velmi podrobně byly v tomto směru sledovány skupiny nemocných, u kterých docházelo k velmi výraznému poklesu cholesterolu a ani u nich nebyly hlášeny žádné alarmující signály.
Ovlivnění KV-příhod po PCSK9-inhibitorech?
Všechny výše uvedené účinky na lipidový a lipoproteinový metabolizmus stejně jako dobrá tolerance nemocnými a praktická absence nežádoucích účinků jsou samozřejmě pozitivní. Na druhé straně je nepopiratelným faktem, že hladiny lipidů ovlivňujeme proto, abychom zlepšili prognózu našich nemocných. Mortalitně-morbiditní studie s inhibitory PCSK9 ještě probíhají. Výsledek studie Odyssey outcomes s alirokumabem, která ověří schopnost Praluentu® ovlivnit KV-morbiditu a mortalitu, bude k dispozici až v letech 2017–2018. Musíme tedy počkat. Na druhé straně nelze přehlédnout pozitivní výsledek analýzy bezpečnostních dat při léčbě alirokumabem, který byl v letošním roce publikován v New England Joural of Medicine. Již roční léčba alirokumabem vedla nejen k pozitivním změnám v lipidovém profilu, ale především k poklesu KV-rizika (KV-příhod) o 54 %! Jakkoliv nelze tento výsledek přeceňovat, nejde opravdu o data z morbiditně-mortalitní studie, je třeba uvést, že výsledky podporují hypotézu, že léčba alirokumabem se ubírá, z hlediska prevence KVO, správným směrem (graf 5).
5. Pokles kardiovaskulárních příhod (data z bezpečnostní analýzy) 
Pro koho je Praluent?
V současné době jsou inhibitory PCSK9 indikovány především u nemocných s těžkou hyperchoelsterolemií, jejímž typickým představitelem bude především familiární hypercholesterolemie, u nemocných se statinovou intolerancí a u pacientů v nejvyšším KV-riziku, kteří při maximální dostupné léčbě nedosáhnou cílových hodnot.
Podívejme se na tyto skupiny trochu podrobněji.
Familiární hypercholesterolemie (FH) je autosomálně dominantně přenášeným onemocněním. Je považována za receptorovou nemoc. Snadné pochopení molekulárního defektu, který je příčinou FH, nám usnadní obr. 1 a obr. 2. Typické projevy FH ukazuje obr. 4 a obr. 5.
4. Šlachové xantomy u FH (foto archiv autora) 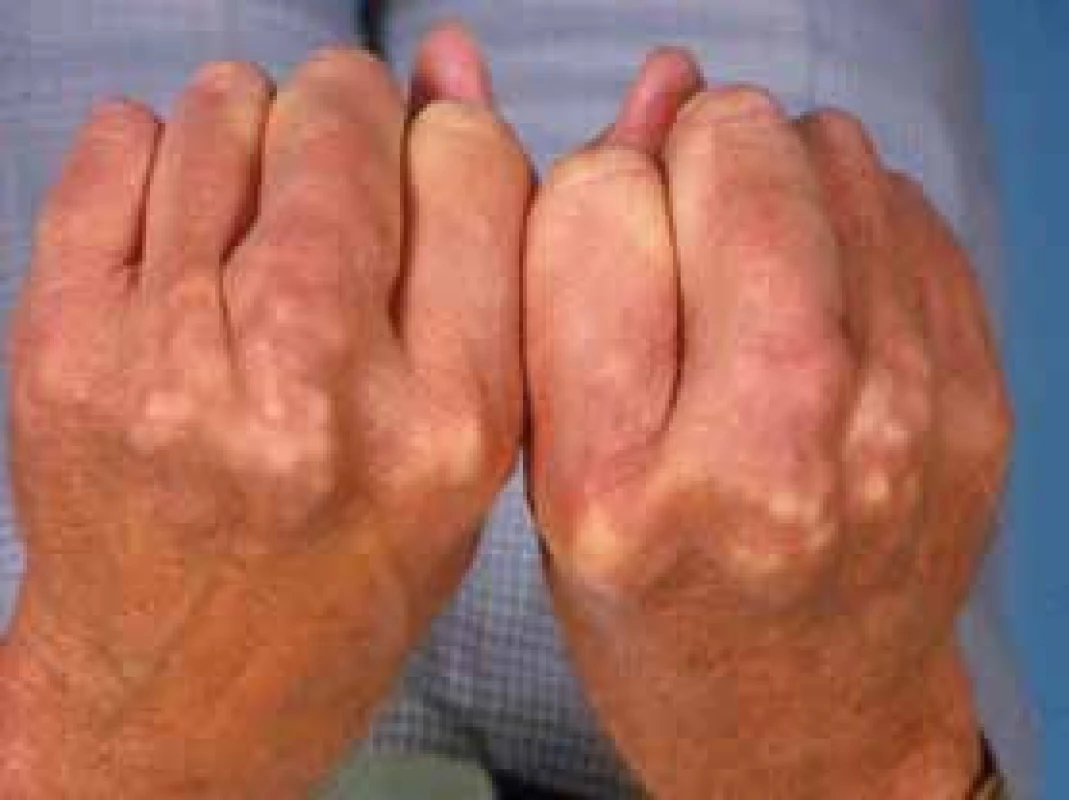
5. Arcus lipoides a xanthelasma palpebrae u FH (foto archiv autora) 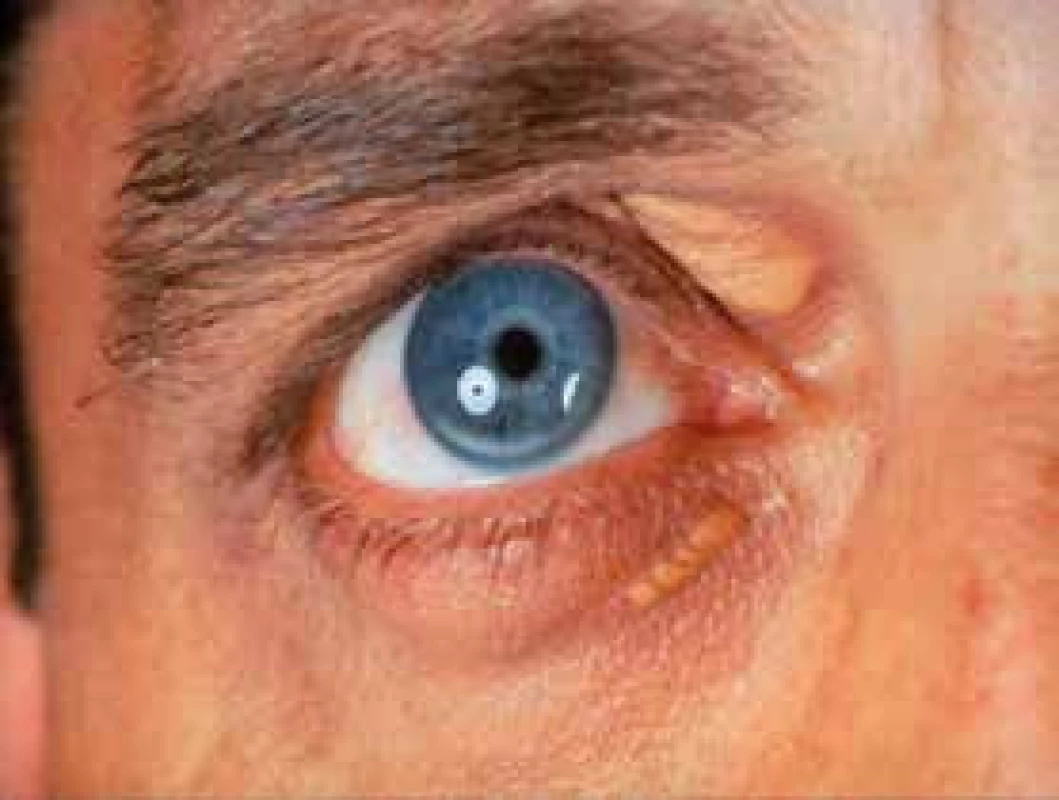
LDL-receptor (LDL-R) je bílkovina, která je umístěna na povrchu buňky a v zásadě „vystupuje“ z buněčné membrány. Má 4 domény, z nichž hlavní z hlediska funkce je doména vazebná. V ní dochází k vazbě LDL částice, při které hraje na straně partikule zásadní roli vazebné místo apolipoproteinu B-100 (apoB-100). LDL-R je vytvářen v endoplazmatickém retikulu, odkud je transportován do Golgiho komplexu a odsud posléze na povrch buňky. Typickou lokalizací LDL-R je oblast potažené jamky (coated pit), v níž dochází k vlastní interakci s LDL částicí. Komplex LDL-R + LDL částice je pak internalizován, zavzat do buňky, dále transportován v „potaženém váčku“ a dále pak dochází, po působení lyzosomů a štěpení, k využití jednotlivých částí. Cholesterol je využit pro potřeby buňky. LDL-R jsou buď recyklovány a putují na povrch buňky, kde nadále standardně fungují, nebo jsou degradovány v lyzosomech. K degradaci LDL-R přispívá výše zmíněný enzym proprotein konvertáza subtilizin/kexin-9 (PCSK-9). Pokud se PCSK-9 naváže na LDL-R, ten je odbourán v lyzosomu a nerecirkuluje na povrch buňky. V důsledku toho pak dochází ke snížení počtu (a tedy i funkčnosti) LDL-R. V důsledku pak dochází k hromadění LDL v plazmě. Elevace LDL-C pak dává vznik aterosklerotickým lézím a je příčinou rozvoje aterosklerózy a KVO.
Nejčastější příčinou FH je chybění/snížení počtu poruch a funkce LDL - receptorů. Druhou možností pro rozvoj FH je defekt apolipoproteinu B (FDB-100). Třetí možností je potom zvýšená funkce enzymu PCSK9. Klinický obraz je u všech poruch obdobný, ne-li totožný.
Jak častá je FH v populaci?
FH jako autozomálně dominantě přenášené onemocnění se samozřejmě vyskytuje ve 2 formách. Homozygotní a heterozygotní. Homozygoté FH jsou raritní a jejich frekvence v obecné populaci je zhruba 1 : 1 000 000 (v současné době některé nové studie uvádějí výskyt vyšší 1 : 200 000), výskyt heterozygotů byl po dlouhá léta uváděn 1 : 500, i toto číslo je však v současné době korigováno a uvádí se častěji 1 : 200. To znamená, že v praxi většina lékařů nepotká homozygota FH, na druhé straně „běžně“ budou v „kartotéce“ praktického lékaře 4–10 pacientů s heterozygotní FH, které je potřeba správně a včas identifikovat a léčit.
Nejzávažnější klinickou manifestací FH je ICHS. V době „před statiny“ byla mortalita nemocných s FH ve věku 20–40 let 100násobně vyšší než u „normální“ populace! ICHS se objevuje u homozygotů již v prvních dekádách a pacienti umírají (pokud nejsou léčeni hypolipidemicky, ale především včasnou revaskularizací a stále častěji též transplantací srdce) do 30 let věku. Jen pro zajímavost bych si dovolil podotknout, že první transplantace srdce byla prof. Barnardem provedena v Kapském Městě právě u nemocného s FH. U heterozygotů je průběh závažnější u mužů, polovina jich umírá na ICHS do 60 let, zatímco žen „pouze“ 15 %. U žen dochází k manifestaci ICHS cca o 9 let dříve než u mužů. K manifestaci ICHS dochází u mužů ve věku 42–46 let, u žen je tomu ve věku 51–52 let. Je zajímavé, že pacienti, zejména homozygoti mají horší prognózu, pokud mají „receptor negativní“ mutaci ve srovnání s nositeli mutace „receptor defektní“. Prognózu zhoršuje především kouření cigaret a někdy hypertenze. Pokud jde o lokalizaci aterosklerotických změn, u FH je častější postižení kmene levé koronární arterie a „triple vesel disease“.
O významu FH, resp. o významu účinné farmakoterapie svědčí fakt, že výše uvedená 100násobně zvýšená mortalita u skupiny nemocných ve věku 20–40 let se dramaticky snížila po zavedení léčby statiny.
Typický laboratorní nález u FH
Typickým laboratorním nálezem při FH je izolované zvýšení hladiny cholesterolu v plazmě při normální nebo jen hraničně zvýšené koncentraci TG. Cholesterol se pohybuje u dospělých heterozygotů v průměrných hodnotách 7–10mmol/l, výjimkou však není ani nález cholesterolu 15mmol/l nebo vyšší! Hladiny choelsterolu u homozygotů se obvykle pohybují v rozmezí 15–30mmol/l.
Diagnostická kritéria FH
Pro diagnostiku FH bylo vytvořeno několik skórovacích systémů. Známý je systém ze Spojeného Království: Simon Broom a kritéria MEDPED z USA. Podle našeho názoru nejpropracovanější kritéria představují tzv „Dutch Lipid Clinic Network“ kritéria.
I když kritéria jsou důležitá a z hlediska exaktní diagnostiky ve specializované poradně nezbytná, pro vyhledávání nemocných v každodenní praxi považuji za velmi důležité zásadní ocenění zásadních lipidových kritérií.
Určitě si zaslouží komplexnější vyšetření každý nemocný s celkovým cholesterolem nad 7,5 (určitě 8) mmol/l nebo LDL-C nad 5,5 (určitě 6) mmol/l. Je to obrovské zjednodušení, které si jistě zaslouží kritiku (které se vůbec nebudu bránit, je oprávněná). Na druhé straně, pokud by se všichni nemocní s TC nad 8mmol/l či LDL-C nad 6mmol/l dostali do péče specializované „lipidové ambulance či kliniky“, myslím, že by bylo ve vyhledávání FH z poloviny vyhráno. Rodinní příslušníci, kteří třeba nedosahují těchto hodnot, by byli tak jako tak posléze pozváni k vyšetření, stejně jako děti a adolescenti.
Statinová intolerance
Za intoleranci statinů v užším slova smyslu považujeme přítomnost svalových obtíží nebo dalších nežádoucích příznaků (nebo laboratorních abnormalit) spojených s terapií statiny, které vedou k jejímu vysazení nebo znemožňují titraci léčby k dávce dostatečné k dosažení cílové hodnoty LDL-cholesterolu V širším smyslu se jedná o více možných nežádoucích účinků – diabetogenní riziko, obavy z demence apod.
O diagnostice, výpočtech KV-rizika a identifikaci nejrizikovějších nemocných je asi zbytečné se široce rozepisovat.
Závěr
V oblasti prevence KV-onemocnění hraje léčba hyperlipoproteinemií zásadní roli. Nová skupina hypolipidemik, která právě vstupuje do klinického používání, tzv. inhibitory PCSK9, mají podle výsledků výzkumu i dosud provedených studií velkou budoucnost. V předloženém sdělení jsou shrnuty některé základní poznatky o alirokumabu, který byl jako Praluent® schválen ke klinickému užívání v EU, samozřejmě včetně České republiky. Zatím je možno uvést schválení alirokumabu Evropskou lékovou agenturou. Podle té je Praluent® schválen pro dospělé nemocné s primární hypercholesterolemií (heterozygotní familiární i nefamiliární) nebo se smíšenou DLP jako přidání k dietě:
- v kombinaci se statiny nebo statiny a dalšími hypolipidemiky u nemocných, kteří nedosahují cíle LDL-C při maximální tolerované dávce statinu nebo
- v monoterapii či v kombinaci s další hypolipidemickou terapií u nemocných, kteří netolerují statiny, nebo jsou u nich statiny kontraindikovány
Lucie Votavová
votavova@interna-cz.eu
ScreenProFH, z.s.
www.screenprofh.com
Doručeno do redakce 13. 1. 2016
Přijato po recenzi 29. 1. 2016
Sources
1. Češka R et al. Familiární hypercholesterolemie. TRITON: Praha 2015. ISBN 978–80–7387–843–6.
2. Watts GF, Gidding S, Wierzbicki AS et al. Integrated Guidance on the Care of Familial Hypercholesterolaemia from the International FH Foundation. Int J Cardiol 2014; 171 (3): 309–325.
3. Reiner Z, Catapano AL, De BG et al. ESC/EAS Guidelines for the management of dyslipidaemias: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011; 32(14): 1769–1818.
4. Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society.Eur Heart J 2013; 34(45): 3478–3490.
5. Robinson JG, Farnier M, Krempf M. Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med 2015; 372(16): 1489–1499.
6. Moriarty PM, Jacobson TA, Bruckert E et al. Efficacy and safety of alirocumab, a monoclonal antibody to PCSK9, in statin-intolerant patients: Design and rationale of ODYSSEY ALTERNATIVE, a randomized phase 3 trial. J Clin Lipidol 2014; 8(6): 554–561.
7. Lunven C, Paehler T, Poitiers F et al. A randomized study of the relative pharmacokinetics, pharmacodynamics, and safety of alirocumab, a fully human monoclonal antibody to PCSK9, after single subcutaneous administration at three different injection sites in healthy subjects. Cardiovasc Ther 2014; 32(6): 297–301.
8. Kereiakes DJ, Robinson JG, Cannon CP et al. Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: the ODYSSEY COMBO I study. Am Heart J 2015; 169(6): 906–915.
9. Cannon CP, Cariou B, Blom D et al. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J 2015; 36(19): 1186–1194.
10. Robinson JG, Farnier M, Krempf M et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1489–1499.
11. Bays H, Gaudet D, Weiss R et al. Alirocumab as add-on to atorvastatin versus other lipid treatment strategies: ODYSSEY OPTIONS I randomized trial. J Clin Endocrinol Metab 2015; 100(8): 3140–3148.
12. Bays H, Farnier M, Gaudet D et al. Efficacy and safety of combining alirocumab with atorvastatin or rosuvastatin versus statin intensification or adding ezetimibe in high cardiovascular risk patients: ODYSSEY OPTIONS I and II [abstract]. Circulation 2015; 130(23): 2118–2119.
13. Roth E, Rader DJ, Moriarty P. Phase 3 randomized trial evaluating alirocumab every four weeks dosing as add-on to statin or as monotherapy: ODYSSEY CHOICE I [abstract no. 0254]. In: 17th International Symposium on Atherosclerosis. 2015.
14. Roth EM, Taskinen MR, Ginsberg HN et al. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: results of a 24 week, double-blind, randomized phase 3 trial. Int J Cardiol 2014; 176(1): 55–61.
15. Moriarty PM, Thompson PD, Cannon CP et al. ODYSSEY ALTERNATIVE: efficacy and safety of the proprotein convertase subtilisin/kexin type 9 monoclonal antibody, alirocumab, versus ezetimibe, in patients with statin intolerance as defined by a placebo run-in and statin rechallenge arm. Circulation 2014; 130(23): 2108–2109.
16. Kastelein JJ, Robinson JG, Farnier M. Efficacy and safety of alirocumab in patients with heterozygous familial hypercholesterolaemia not adequately controlled with current lipid-lowering therapy: results of ODYSSEY FH I and FH II studies [abstract no. 2125]. In: European Society of Cardiology 2015.
17. Ginsberg HN, Rader DJ, Raal FJ. ODYSSEY HIGH FH: efficacy and safety of alirocumab in patients with severe heterozygous familial hypercholesterolemia. Circulation 2014; 130(23): 2119.
18. Rosenson RS, Baker SK, JacobsonTA, Kopecky SL, Parker BA. An assessment by the statin muscle safety task force: 2014 update. J Clin Lipidol 2014; 8(3 Suppl): S58–S71.
19. Stroes ES, Thompson PD, Corsini A et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J. 2015; 36(17):1012–1022.
20. Bruckert E, Hayem G, Dejager S et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients--the PRIMO study. Cardiovasc Drugs Ther 2005; 19(6): 403–414.
21. Banach M, Rizzo M, Toth PP et al. Statin intolerance - an attempt at a unified definition. Position paper from an Internanational Lipid Expert Panel. Expert Opin Drug Saf 2015; 14(6): 935–955.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adults
Article was published inAthero Review

2016 Issue 1-
All articles in this issue
- Statin-associated myopathy: clinical guideline of Slovak Atherosclerosis Association and Czech Society for Atherosclerosis
- Challenging atherosclerosis, aggressiveness versus timing?
- Familial hypercholesterolemia: clinical reports, molecular genetics and differential diagnosis
-
What is the most important for patients with familial hypercholesterolaemia?
MedPed project in the Czech and Slovak - Turn in hypercholesterolemia treatment – PCSK9 inhibitors. What we know about the alirocumab (product Praluent®) yet?
- PCSK9 inhibitors in the management of patients with high cardiovascular risk – effective treatment to reach
- Athero Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Familial hypercholesterolemia: clinical reports, molecular genetics and differential diagnosis
- PCSK9 inhibitors in the management of patients with high cardiovascular risk – effective treatment to reach
- Turn in hypercholesterolemia treatment – PCSK9 inhibitors. What we know about the alirocumab (product Praluent®) yet?
- Statin-associated myopathy: clinical guideline of Slovak Atherosclerosis Association and Czech Society for Atherosclerosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

