-
Medical journals
- Career
Biochemické vyšetření moči v intenzivní péči –
naučme se ho používat častěji
Authors: P. Navrátil 1,2; D. Astapenko 2,3; V.- Černý 2 7
Authors‘ workplace: Urologická klinika, Fakultní nemocnice Hradec Králové 1; Lékařská fakulta v Hradci Králové, Univerzita Karlova 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 3; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 4; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 5; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 6; Technická univerzita v Liberci 7
Published in: Anest. intenziv. Med., 32, 2021, č. 1, s. 55-57
Category: Clinical Physiology
Úvod
Biochemickému rozboru moči nevěnujeme v klinické praxi často tolik pozornosti, kolik si z pohledu svého přínosu zaslouží. Analýza moči může přinést často zcela unikátní informaci k hodnocení aktuálního stavu vnitřního prostředí pacienta. Složení moči odráží nejen samotnou perfuzi ledvin, ale i elektrolytové složení séra a zásoby elektrolytů v organismu. Biochemický rozbor moči tak může zásadním způsobem přispět v diferenciální diagnostice akutního poškození ledvin a etiologie šoku [1]. Existující literatura je ohledně klinické použitelnosti měření elektrolytů v moči smíšená [2], nicméně novější studie shledávají přínos v diagnostice a léčbě hypovolemie, akutního poškození ledvin (acute kidney injury, AKI) a poruch acidobazické rovnováhy a elektrolytů [3]. Interpretace biochemického vyšetření moči patří mezi základní oblasti klinické propedeutiky.
Změny v efektivním cirkulujícím objemu krve
Sodík je primární extracelulární kation, hlavní determinanta tonicity, a tedy objemu extracelulární tekutiny. Za fyziologických podmínek je vylučování a příjem sodíku v dynamické rovnováze. U většiny nemocných v kritickém stavu dochází k nepoměru mezi objemem extracelulární tekutiny (extracellular volume, ECV) a perfuzí orgánů, ECV tak lze při určitém zjednodušení považovat za ekvivalent intravaskulárního objemu, která ovlivňuje perfuzi orgánů. Při snížení ECV se přes hormonální osu renin‑angiotensin‑aldosteron v ledvinách zadržuje sodík, dochází k poklesu jeho koncentrace v moči (U_Na) a zvyšuje se vylučování draslíku (U_K). Naproti tomu expanze ECV a s tím spojená distenze srdečních síní indukují uvolňování síňového natriuretického peptidu, jehož účinky jsou v protipólu s účinky aldosteronu. Ke zohlednění účinku reabsorpce vody na vztah mezi U_Na a cirkulujícím objemem lze stanovit frakční exkreci sodíku (Fe_Na), která představuje podíl z celkově profiltrovaného natria, který je vyloučen močí. Výhodou tohoto parametru je, že stačí vyšetřit koncentraci sodíku v séru (S_Na) a v jednorázovém vzorku moči (U_Na) a odpadá celodenní sběr.

Fe_Na – frakční exkrece sodíku (referenční meze 0,4–1,2 %).
S_krea – koncentrace kreatininu v séru (referenční meze u mužů 70–110 μmol/l; u žen 60–100 μmol/l).
U_krea – koncentrace kreatininu v moči (referenční meze 5,7–14,7 mmol/l).
S_Na – koncentrace sodíku v séru (referenční meze 135–145 mmol/l).
U_Na – koncentrace sodíku v moči (nemá referenční meze, koncentrace v moči závisí na příjmu sodíku, při izostenurii se ustálí koncentrace sodíku v moči na 50–70 mmol/l).Parametry U_Na a Fe_Na lze považovat za nepřímé indikátory stavu cirkulujícího objemu. Nízká U_Na (< 40 mmol/l nebo nižší než U_K) může signalizovat retenci sodíku vyvolanou hypovolemií. Je však nutné znát faktory, které mohou interpretaci zmíněného parametru zásadně modifikovat: hodnota U_Na není závislá na koncentraci Na v séru, některé typy renálního selhání mohou zvyšovat U_Na (počínající sepse, intersticiální nefritida, těžká ischemická nefropatie, podání kontrastní látky, hemolýza, rhabdomyolýza). Navíc i současné užití diuretik, dopaminu, aminoglykosidů nebo přítomnost osmotické diurézy (např. při hyperglykemii) může hladinu U_Na zvýšit nezávisle na cirkulujícím objemu. Také sekrece ADH independentní na cirkulujícím objemu (nízký srdeční výdej, vazodilatační stavy) může hladinu U_Na ovlivnit [1].
Akutní poškození ledvin
Akutní poškození ledvin je tradičně rozdělováno na tzv. prerenální, renální a postrenální formy. Tato klasifikace je však často doplňována hodnocením reverzibility poškození. Některé práce při hodnocení prerenální příčiny dále doporučují rozdělení na transientní AKI, které se může zlepšit podáním tekutin, a které jako dynamický proces může přejít v perzistentní AKI [4]. Biochemické vyšetření moči může pomoci v rozlišení transientního a perzistentního AKI: transientní AKI je s vysokou pravděpodobností při U_Na < 20 mmol/l, Fe_Na < 1 % a Fe_K (frakční exkrece draslíku) mezi 10–15 % [5]. Získané hodnoty mohou být ovlivněny podanými diuretiky, rozvojem myoglobinurie, přítomností glomerulonefritidy nebo nefropatie způsobené kontrastní látkou. Při užívání diuretik je transientní AKI pravděpodobná při Fe_urea (frakční exkrece urey) < 35 % [6, 7] (obr. 1). Další výzkum se upírá směrem ke zhodnocení využitelnosti biochemického vyšetření moči v časné detekci pacientů s poruchou ledvin, které by předcházelo zvýšené S_krea a sníženému objemu moči [8, 9].
Image 1. Schéma odlišení tranzientního a perzistentního AKI na základě biochemického vyšetření moči 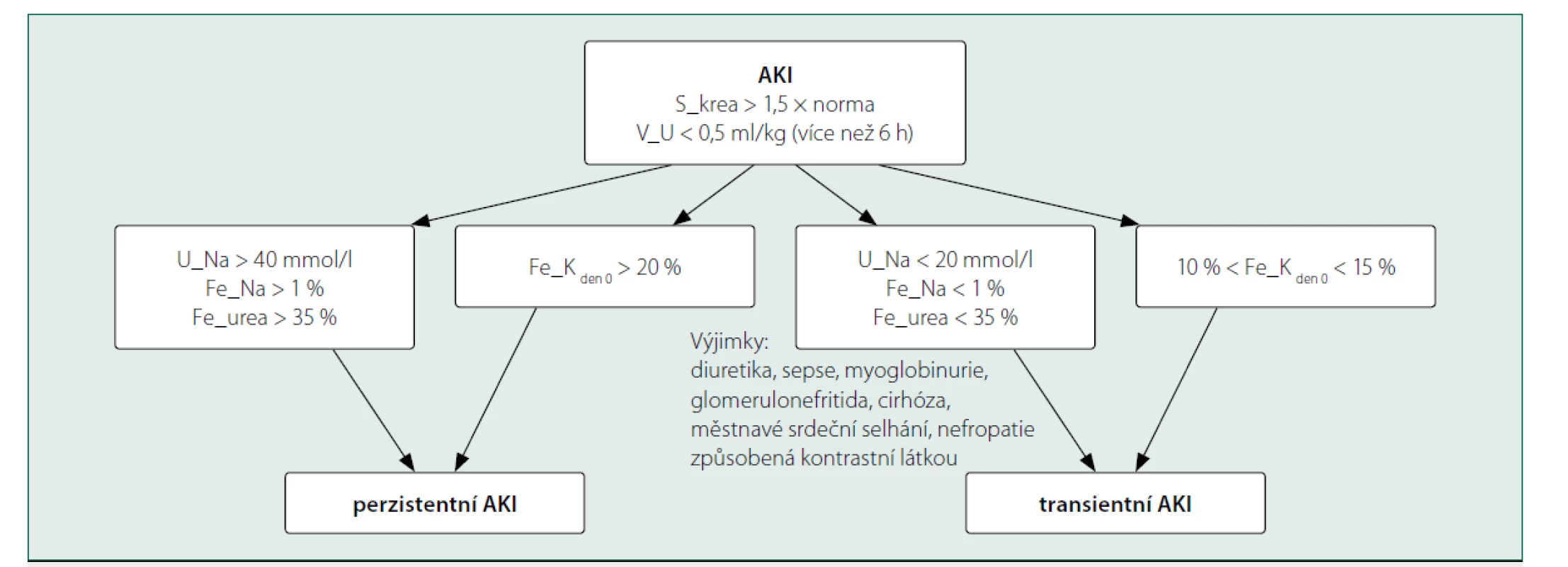
Legenda: S_krea – koncentrace kreatininu v séru, V_U – objem moči, U_Na – koncentrace sodíku v moči, Fe_Na – frakční exkrece sodíku, Fe_urea – frakční exkrece urey, Fe_Kden 0 –frakční exkrece draslíku v den 0).
Převzato z Umbrello M, Formenti P, Chiumello D. Urine electrolytes in the intensive care unit: From pathophysiology to clinical practice. Anesthesia and Analgesia 2020; 131(5): 1456–1470.Poruchy acidobazické rovnováhy (ABR)
Biochemické vyšetření moči je užitečné i v rámci komplexní analýzy ABR – umožňuje doplnit náš pohled na míru kompenzace poruchy. Za fyziologických okolností ledviny vylučují bikarbonáty (HCO3 -), při acidóze jsou naopak bikarbonáty vstřebávány a pro zachování zákonu elektro‑neutrality se zvyšuje U_Cl. Analogicky jako v séru lze použít rozdíl nábojů silných iontů v moči (SID_U). Ten je definován jako rozdíl mezi měřenými silnými kationty a anionty:
SID_U = U_Na + U_K – U_Cl
Při metabolické acidóze, pokud je pH moči kyselé a SID_U nízký nebo negativní, je kompenzační odpověď ledvin přítomna. V opačném případě ledviny nejsou schopny metabolické kompenzace acidózy a tento stav je spojen s horší prognózou [1, 8].
Poruchy natremie
Analýza moči je základním krokem posuzování jakékoliv poruchy natremie projevující se její abnormální hodnotou v séru. K hodnocení příčin hyponatremie lze využít stanovení elektrolytů v moči po vyloučení: 1. pseudohyponatremie při hyperproteinemii nebo hyperlipidemii, 2. hypertonické hyponatremie při hyperglykemii. Při hypovolemii může být retence sodíku vysvětlena extrarenálními faktory (např. ztráty gastrointestinálním traktem). Hodnoty U_Na > 50 mmol/l nebo Fe_Na > 1 % svědčí spíše pro tzv. renální ztráty (účinek diuretik nebo nedostatek mineralokortikoidů) nebo syndrom cerebrálně podmíněné ztráty soli (cerebral salt‑wasting syndrome, CSWS). Za předpokladu normovolemie je hyponatremie asociována obvykle se zvýšenou hodnotou U_Na a způsobena syndromem nepřiměřené sekrece antidiuretického hormonu (SIADH), hypokortizolismem nebo hypotyreózou. Pokud jsou přítomny klinické známky hypervolemie, hodnocení elektrolytů v moči může přispět k odlišení mezi selháním ledvin a srdečním selháním nebo jaterní cirhózou [1] (obr. 2).
Image 2. Schéma vyšetření příčin hyponatremie na základě biochemického vyšetření moči 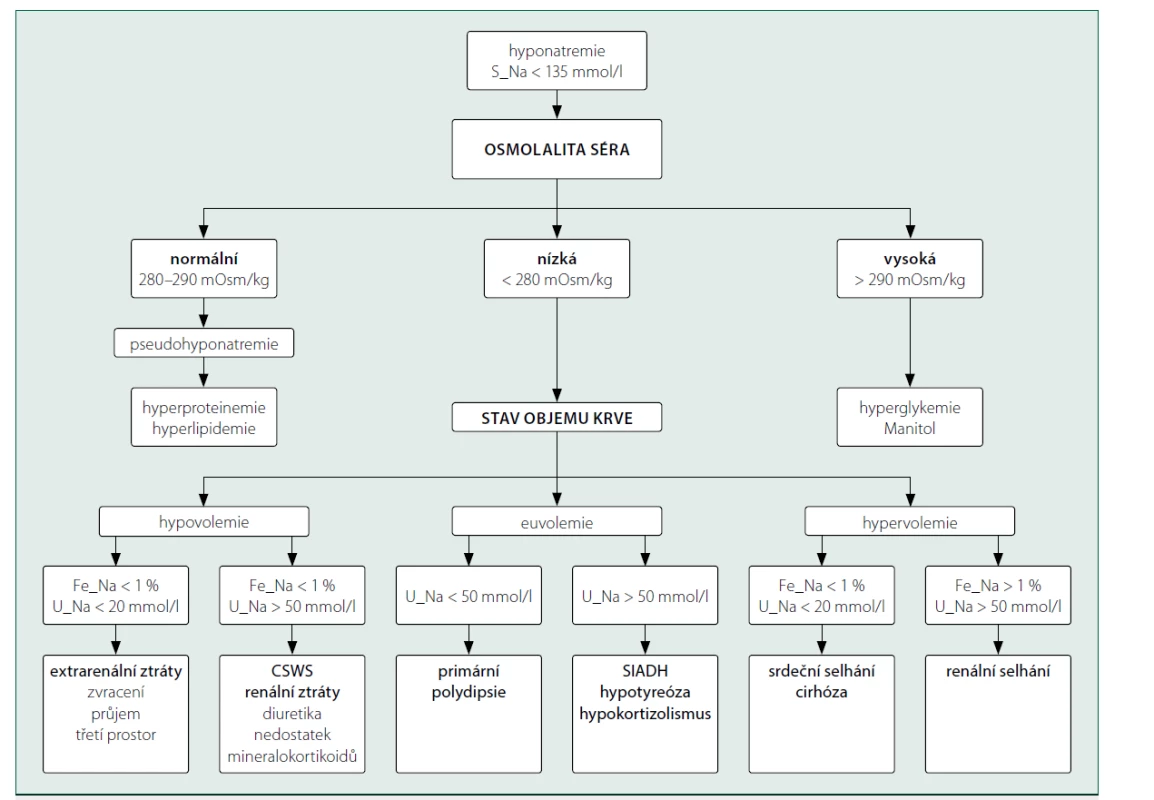
Legenda: Fe_Na – frakční exkrece sodíku, U_Na – koncentrace sodíku v moči, CSWS –syndrom cerebrálně podmíněné ztráty soli, SIADH – syndrom nepřiměřené sekrece antidiuretického hormonu.
Převzato z Umbrello M, Formenti P, Chiumello D. Urine electrolytes in the intensive care unit: From pathophysiology to clinical practice. Anesthesia and Analgesia 2020; 131(5): 1456–1470.Závěr
Přínos analýzy moči může být v diagnostice řady klinických stavů zásadní, bez ohledu na limity její interpretace. Snadnost získání vzorku moče u pacientů v intenzivní péči dělá z uvedené metody nedílnou součást laboratorního vyšetření kriticky nemocných.
Body k zapamatování:
Biochemické vyšetření moči je nutno vnímat jako jedno ze základních biochemických vyšetření v intenzivní medicíně.
Parametry U_Na a Fe_Na lze využít k posouzení stavu cirkulujícího objemu.
Močová diference silných iontů může usnadnit analýzu poruch ABR.
Znalost koncentrace sodíku v moči je zásadní v diagnostice poruch natremie.
Znalost limitů interpretace je předpokladem přínosu klinického využití metody.
PROHLÁŠENÍ AUTORA: Financování: Publikace byla podpořena projektem PROGRES Q40/04.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. David Astapenko, Ph.D.
Cit. zkr: Anest intenziv Med. 2021; 32(1): 55–57
Sources
1. Umbrello M, Formenti P, Chiumello D. Urine electrolytes in the intensive care unit: From pathophysiology to clinical practice. Anesth Analg Lippincott Williams and Wilkins 2020; 131(5): 1456–1470.
2. Harrington JT, Cohen JJ. Measurement of Urinary Electrolytes – Indications and Limitations. N Engl J Med New England Journal of Medicine (NEJM/MMS) 1975; 293(24): 1241–1243.
3. Palmer BF, Clegg DJ. The use of selected urine chemistries in the diagnosis of kidney disorders. Clinical Journal of the American Society of Nephrology 2019 [online] American Society of Nephrology 2019.
4. MacEdo E, Mehta RL. Prerenal failure: From old concepts to new paradigms. Current Opinion in Critical Care 2009 [online] Curr Opin Crit Care 2009.
5. Maciel AT, Nassar AP, Vitorio D. Very Transient Cases of Acute Kidney Injury in the Early Postoperative Period after Cardiac Surgery: The Relevance of More Frequent Serum Creatinine Assessment and Concomitant Urinary Biochemistry Evaluation. J Cardiothorac Vasc Anesth W.B. Saunders 2016; 30(1): 56–63.
6. Maciel AT, Park M, Macedo E. Physicochemical analysis of blood and urine in the course of acute kidney injury in critically ill patients: A prospective, observational study. BMC Anesthesiol BMC Anesthesiol 2013; 13(1): 31.
7. Carvounis CP, Nisar S, Guro‑Razuman S. Significance of the fractional excretion of urea in the differential diagnosis of acute renal failure. Kidney Int Blackwell Publishing Inc. 2002; 62(6): 2223–2229.
8. Balsorano P, Romagnoli S, Evans SK, Ricci Z, De Gaudio AR. Urinary Strong Ion Difference as a Marker of Renal Dysfunction. A Retrospective Analysis. PLoS One. 2016 Jun 3; 11(6): e0156941.
9. Kannapiran M, Nisha D, Madhusudhana Rao A. Underestimation of impaired kidney function with serum creatinine. Indian J Clin Biochem Springer India 2010; 25(4): 380–384.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2021 Issue 1-
All articles in this issue
- Vzdělávání mladých lékařů v době COVIDu
-
Positive pressure application of oxygen using Venturi nozzle Corovalve made on a 3D printer.
A simple and inexpensive method applicable in emergency conditions on a mass scale - Mezinárodní konsenzuální doporučení k postintenzívnímu syndromu
-
Point of care examination of blood clotting –
current possibilities - Gabapentinoids in the perioperative period
- Ketamin – nezávislost disociativní a analgetické působnosti
- Perorální dexmedetomidin?
- One hundred and ninety years since discovery of chloroform – history of inhalational anaesthetics. Part 1
- Peroperační maligní hypertermie – bude vhodný předoperační genetický skríning?
- Fascial planes for regional anesthesia of the lower limb
- A rare complication of central venous catheter insertion
- Pneumothorax, which was not a pneumothorax
- Posttraumatická stresová porucha – až znepokojivý postintezivní výskyt
- Předejde umělá inteligence peroperační hypotenzi?
- Shaken adult syndrome or a neurological complication of epidural anesthesia?
-
Biochemické vyšetření moči v intenzivní péči –
naučme se ho používat častěji - Mimotělní eliminace CO2 u pacientů v intenzivní péči – konsenzus evropského kulatého stolu
- Doporučení pro anestezii a sedaci u kojících žen
-
Stanovisko výboru ČSARIM 14/2021
Aktuální stav dostupnosti a poskytování intenzivní péče v rámci pandemie onemocnění COVID-19 -
MEZIOBOROVÉ STANOVISKO (evidenční číslo ČSARIM: 15/2021)
K POUŽITÍ BAMLANIVIMABU U PACIENTŮ S COVID-19 - Zajímavosti, tipy a triky, informace z jiných oborů
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučení pro anestezii a sedaci u kojících žen
-
Point of care examination of blood clotting –
current possibilities - Ketamin – nezávislost disociativní a analgetické působnosti
- Fascial planes for regional anesthesia of the lower limb
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

