-
Medical journals
- Career
Nová definice status epilepticus a možnosti jeho farmakologické léčby
Authors: O. Strýček 1; V. Šrámek 2
Authors‘ workplace: I. neurologická klinika, Lékařská fakulta, Masarykova univerzita, Fakultní nemocnice u sv. Anny 1; Anesteziologicko-resuscitační klinika, Lékařská fakulta Masarykovy univerzity, Fakultní nemocnice u sv. Anny 2
Published in: Anest. intenziv. Med., 29, 2018, č. 4, s. 207-216
Category: Review Article
Overview
Status epilepticus je život ohrožující stav s vysokou mortalitou, který vyžaduje okamžitou léčbu. S cílem ujednotit pohled na tuto problematiku vznikl návrh nové definice, která lépe než předešlé odráží patofyziologii jeho vzniku. Především vyzdvihuje časový faktor, který hraje při rozvoji epileptického statu zásadní roli, a upozorňuje na možnost nevratných změn mozku, které probíhající epileptická aktivita vyvolává.
V léčbě epileptického statu je rozhodující výběr vhodného léčiva – vedle tradičních léků (fenytoin, valproát) se objevují léky nové, které slibují významné výhody (levetiracetam, lakosamid). Zmíněny jsou i některé rescue postupy (např. ketamin). Důležitá je také volba správné agresivity léčby. Častou chybou je totiž používání jednoho léčebného schématu na všechny druhy epileptického statu, i když tento postup nemá klinické opodstatnění a mnohdy pacientův stav ještě zhoršuje – zvláště nonkolvuzivní epileptický status vyžaduje jiný přístup.
Klíčová slova:
status epilepticus – definice – klasifikace – léčba – antiepileptika
DEFINICE, KLASIFIKACE A EPIDEMIOLOGIE
Dlouhou dobu se jako status epilepticus (SE) označoval klinický a/nebo elektrografický záchvat nebo opakující se záchvaty, mezi nimiž nedochází k plné úpravě poruchy vědomí, trvající déle než 30 minut. Nicméně již dlouho bylo z praxe a ze studií známo, že většina generalizovaných tonicko-klonických záchvatů trvá 2–3 minuty. Po 5 minutách trvání tohoto typu záchvatu je nepravděpodobné, že se ukončí spontánně. To vedlo v roce 2015 k návrhu revize definice (znění v tab. 1) [1]. Jednoduše řečeno je podle této definice SE záchvat a/nebo opakující se záchvaty, mezi nimiž nedochází k plné úpravě, trvající déle než 5 minut (v případě konvulzivního SE) nebo déle než 10 minut (v případě fokálního SE s poruchou vědomí). Navíc je v definici zdůrazněn vliv neléčeného SE na mozek. Kromě následků, které jsou důsledkem probíhající epileptické aktivity v mozku, je třeba zmínit neméně důležité systémové účinky (především v případě konvulzivního SE) – srdeční arytmii, dysregulaci tělesné teploty, elektrolytovou a glukózovou dysbalanci, rhabdomyolýzu, plicní edém, koagulopatii a následné multiorgánové selhání [2].
Table 1. Definice status epilepticus 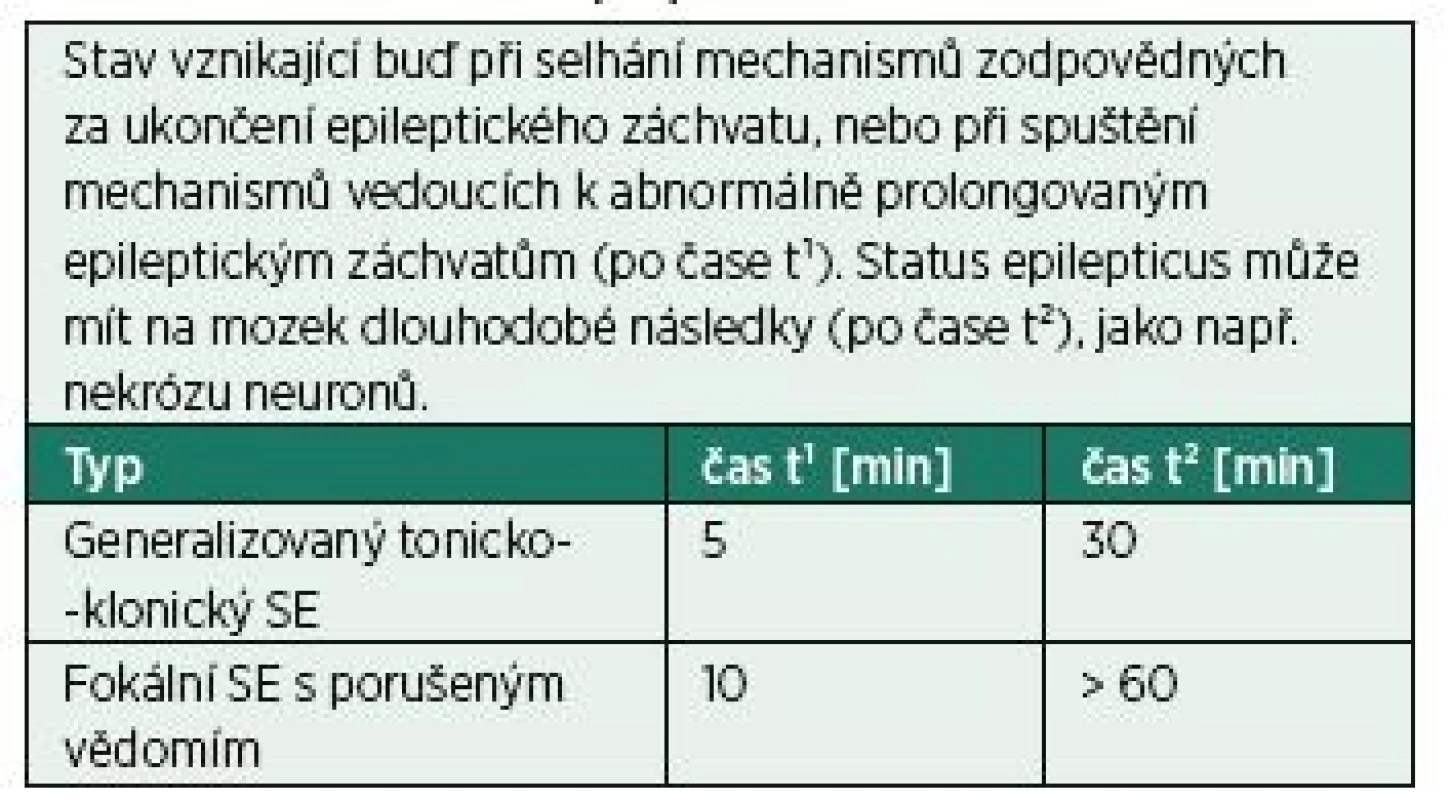
Reprodukováno volně dle Trinka et al. [1] SE – status epilepticus Na SE můžeme pohlížet z mnoha směrů. Z klinického hlediska můžeme rozdělit SE na dva základní typy: s prominentními a bez prominentních motorických projevů (tab. 2) [1]. Pro tyto typy lze také použít označení konvulzivní (convulsive status epilepticus – CSE) a nonkonvulzivní (nonconvulsive status epilepticus – NCSE). Pokud ale mluvíme o konvulzivním SE, máme na mysli generalizovaný tonicko-klonický SE. Proto se někdy pro upřesnění tento typ označuje jako generalizovaný konvulzivní SE, aby se jasně odlišil tzv. fokální motorický SE (dříve označovaný jako fokální konvulzivní SE). Ten se taktéž může projevovat konvulzemi (křečemi), jejichž distribuce na těle je na jedné či více ipsilaterálních částech. Rozdělení na konvulzivní a nonkonvulzivní má smysl především kvůli léčebné strategii, neboť každý z nich má být léčen jinak. Zvláštním případem je pak CSE, který po jisté době bez adekvátní léčby přechází do NCSE. Projevuje se poruchou vědomí (často až na úrovni kómatu) a pouze minimálními motorickými projevy, které velmi snadno uniknou pozornosti (mírné záškuby svalstva měnlivé lokalizace, třes, nystagmus). Tento stav se pak označuje jako „subtle status epilepticus“ [3]. Proto je důležité u pacienta s CSE, u kterého byly úspěšně zaléčeny motorické projevy a trvá porucha vědomí, vždy co nejdříve zhodnotit EEG (elektroencefalograf), jinak nám tento typ SE může v diagnostice uniknout.
Table 2. Klasifikace status epilepticus dle klinických projevů 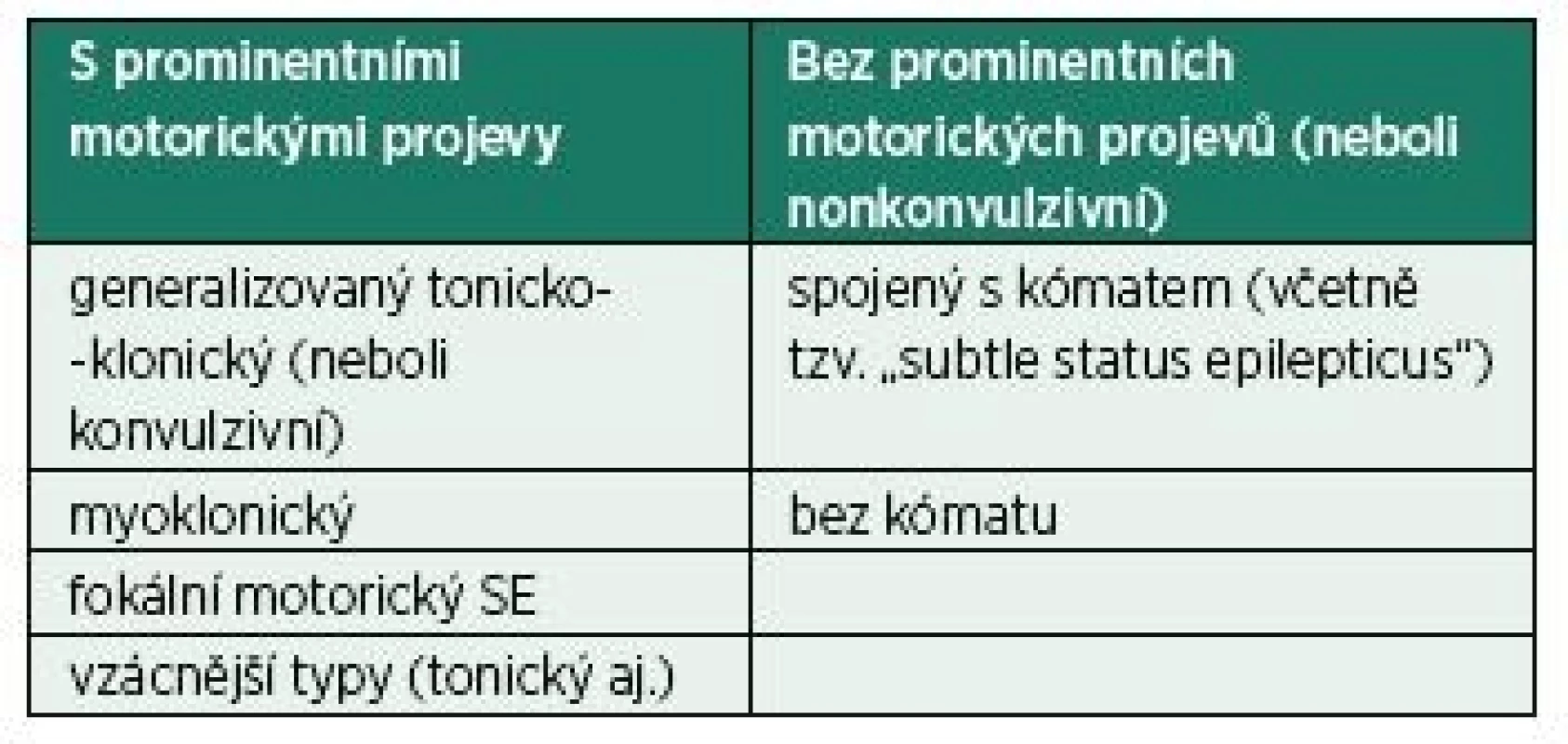
Reprodukováno volně dle Trinka et al. [1]
SE – status epilepticusIncidence SE se pohybuje mezi 3,5–41/100 000 obyvatel/rok. CSE je nejčastějším (45–74 % všech případů) a rovněž nejnebezpečnějším typem SE [4, 5]. Z publikovaných dat je však zřejmé, že NCSE je pravděpodobně poddiagnostikován a je především v podmínkách intenzivní medicíny častější než CSE [6].
Z hlediska délky trvání a odpovědi na léčbu rozdělujeme SE na několik typů. Jako časný SE se označuje záchvat trvající alespoň 5 minut (platí pro CSE). Rozvinutý SE je takový, který nereaguje na adekvátní léčbu benzodiazepinem (BZD). Refrakterní SE (RSE) nereaguje na BZD ani na antiepileptikum (AE) II. volby a tvoří až 43 % případů SE [7]. Až 20 % RSE pak přechází do posledního typu, který označujeme jako super-refrakterní SE (SRSE). SRSE je takový SE, který trvá déle než 24 hodin i přes adekvátní léčbu [8].
Zásadní roli v prognóze pacienta hrají především dva faktory – etiologie SE a věk nemocného. Společně s léčbou samotného SE je vždy nutná velmi rychlá identifikace a následná léčba jeho příčiny. Nejčastěji vzniká SE v těsné časové souvislosti s probíhajícím postižením CNS (nízká hladina AE, čerstvá cévní mozková příhoda, hypoxie mozku), takový označujeme jako akutní symptomatický. Méně často vzniká SE jako reakce na již proběhlé poškození mozku (trauma, cévní mozková příhoda), takový označujeme jako tzv. pozdní (remote) symptomatický SE. Další možnou příčinou je progredující onemocnění mozku (např. neurodegenerativní onemocnění, rostoucí mozkový nádor). Pouze ve 3 % případů se nepodaří odhalit příčinu a takový SE pak označujeme jako kryptogenní [9]. Nejčastější příčiny SE uvádíme v tab. 3. Nejhorší prognózu má SE při postanoxickém poškození mozku, kdy dosahuje mortality 71 %. Vysoká mortalita je však v tomto případě dána především závažností jeho primární příčiny. U ostatních příčin je mortalita významně nižší.
Table 3. Etiologie a mortalita status epilepticus 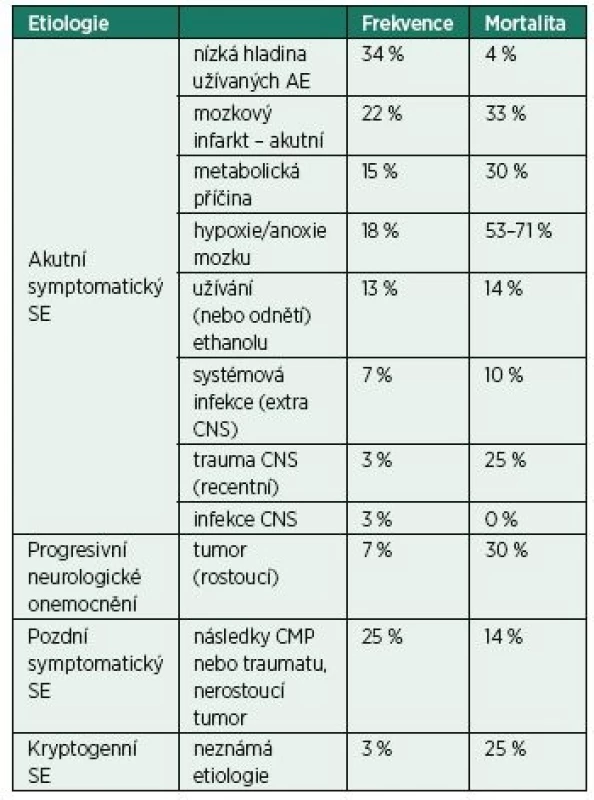
Reprodukováno volně dle DeLorenzo et al. [9]
SE – status epilepticus, AE – antiepileptikum, CNS – centrální nervová soustava, CMP – cévní mozková příhodaVěk je druhým zásadním prognostickým faktorem – nejlepší prognózu mají děti mladší deseti let (mortalita 3 %), nejhorší pak pacienti starší 80 let (mortalita 20 %) [4].
Do dalších faktorů ovlivňujících mortalitu patří délka trvání SE, pro kterou platí, že s délkou trvání SE stoupá mortalita – např. pro RSE platí, že přibližně 1/3 pacientů zemře, 1/3 má trvalý neurologický deficit a 1/3 je bez deficitu [10].
LÉČBA KONVULZIVNÍHO EPILEPTICKÉHO STATU DOSPĚLÝCH
Většina doporučení se zaobírá léčbou generalizovaného konvulzivního SE, u něhož je hlavním cílem léčby co nejrychlejší zastavení epileptické aktivity. Všeobecně platí, že pokud generalizovaný tonicko-klonický záchvat trvá déle než 5 minut, měl by být vždy léčen jako SE [11]. S přibývající délkou trvání SE totiž klesá pravděpodobnost jeho úspěšné léčby – jinými slovy, nejpravděpodobněji vyléčíme časný a nejméně pravděpodobně super-refrakterní SE. Upozorňujeme, že izolovaný epileptický záchvat nebo i kumulace záchvatů (nenaplňující kritéria SE) neléčíme jako status epilepticus (tedy agresivně, vysokými dávkami antiepileptik). Pokud je v tomto případě indikováno nasazení AE, dávkujeme je v závislosti na riziku opakování záchvatů, nejlépe dle doporučení v souhrnu údajů o přípravku (při kumulaci záchvatů volíme rychlejší dávkovací schéma).
Nedílnou součástí algoritmu léčby SE je přednemocniční péče a léčba při příjmu do nemocnice, která je spojená se zajištěním vitálních funkcí – tzn. výměny plynů (zabránění hypoxii) a kardiovaskulární stability. U NCSE většinou postačí oxygenoterapie maskou, u CSE je vzhledem k doprovodné protrahované těžké poruše vědomí často nutná intubace. Při zajištění dýchacích cest se řídíme zásadami pro emergentní intubaci – tzv. crush úvod (RSI, rapid sequence intubation/induction). Hypnotikem volby je propofol nebo benzodiazepin (midazolam), ze svalových relaxancií lze v této situaci použít sukcinylcholin či rokuronium v intubační dávce. Oba léky mají potenciální nevýhody – sukcinylcholin může teoreticky zhoršit hyperkalemii, na kterou v situaci protrahovaných křečí musíme myslet hlavně při změnách na EKG, po použití rokuronia by zase vzhledem k jeho delšímu účinku měla následovat EEG monitorace k vyloučení pokračujícího SE. Obecný algoritmus iniciálního managementu SE shrnujeme v tab. 4. Dále se soustředíme na farmakologickou léčbu samotného SE dospělých. Můžeme ji rozdělit, podobně jako SE, do čtyř fází: léčbu časného, rozvinutého, refrakterního a super-refrakterního SE.
Table 4. Obecný algoritmus iniciálního managementu SE 
CT – computed tomography (výpočetní tomografie), MR – magnetická rezonance, EEG – elektroencefalografie V léčbě časného SE se uplatňují benzodiazepiny (BZD), které jsou efektivní, bezpečné a dobře tolerované. Jejich úspěšnost je dána především jejich účinkem na GABA-A receptory, které hrají zásadní roli v iniciální fázi SE. S postupujícím trváním epileptické aktivity pravděpodobnost efektu BZD klesá [12]. V České republice (ČR) je nejčastěji používán intravenózní diazepam v dávce 10–20 mg, který lze jednorázově ve stejné dávce po 5 minutách opakovat. Efektivní je taktéž intravenózní klonazepam v dávce 0,015 mg/kg, který má v porovnání diazepamem lepší bezpečnostní (méně výrazná respirační deprese) a farmakologický (rychlejší nástup účinku a kratší poločas) profil [13]. Alternativou je rektálně podaný diazepam v dávce 10 mg nebo intramuskulárně podaný midazolam v dávce 5–15 mg [14]. V terénu může být velmi výhodné i podání midazolamu bukálně, které ve srovnávací studii vykazovalo podobnou účinnost jako intravenózně podaný diazepam [15]. Dobrou účinnost vykazuje midazolam podaný intravenózně (v dávce 0,15 mg/kg), tento postup se ale nevyužívá a není ani standardně doporučovaný. Účinnost preparátů je podobná a zásadní roli hraje především, v jakém čase od vzniku SE a v jaké dávce je léčivo podáno. Velmi názorně je tento fakt prokázán ve studii Silbergleita [16]. V ní byl srovnáván efekt intravenózně podaného lorazepamu (v ČR nedostupného) a intramuskulárně podaného midazolamu. V této studii vyšel jako efektivnější midazolam, a to především proto, že intramuskulární aplikace léčiva byla jednodušší, a tedy rychlejší než zajištění žilního vstupu a následné podání léčiva intravenózně. BZD je vždy nutné podávat v adekvátní dávce, jinak se zvyšuje refrakternost SE k léčbě. Je prokázáno, že pouze 31 % pacientů bylo léčeno v časném stadiu SE adekvátní dávkou BZD [17].
Pokud v terapii selžou BZD, mluvíme o rozvinutém SE. V jeho léčbě se uplatňují AE s různými mechanismy účinků (tzv. antiepileptika II. volby). Z historického hlediska je stále velmi často používán fenytoin (PHT). Jeho oblíbenost pramení z jeho dobré účinnosti a především z dlouholeté zkušenosti, kterou s jeho podáváním většina lékařů má. Tento lék má ale řadu nevýhod. Jednou z nejzásadnějších je, že se PHT může podávat rychlostí max. 50 mg/min bez ohledu na tělesnou hmotnost pacienta (to znamená, že např. u 90 kg člověka trvá podání celkové dávky až 36 minut!). Další nevýhodou jsou jeho akutní nežádoucí účinky (NÚ), především kardiální, které jsou hlavním determinantem omezení rychlosti jeho podávání. Mezi další negativa PHT patří úzké terapeutické rozmezí, které je, vzhledem k jeho nelineární farmakokinetice, obtížně dosažitelné. PHT se významně (až v 90 %) váže na plazmatické bílkoviny, proto je nutné buď přímo změřit, nebo vypočítat jeho volnou frakci, která jediná odpovídá za jeho terapeutický efekt. Tato volná frakce může být promptně zvýšena, pokud je PHT ze své vazby na bílkoviny vytěsněn jiným lékem (např. valproátem) [18]. Rovněž je u PHT významný jeho interakční potenciál. Jako induktor jaterního metabolismu (indukuje cytochrom P450 a glukuronyltransferázu) snižuje hladinu mnoha ostatních léčiv (v intenzivní péči se můžeme setkat především se snížením hladin amiodaronu, digoxinu, warfarinu, fentanylu, haloperidolu, myorelaxancií, imunosupresiv, jiných AE – např. valproátu). Naopak hladina PHT může být zvýšena např. amiodaronem, z antibiotik cotrimoxazolem, metronidazolem, azolovými antimykotiky, některými AE (např. valproátem) [19, 20].
Dalším lékem volby je valproát (VPA). Jeho velkou výhodou je možnost rychlého podání – teoreticky lze u každého pacienta, bez ohledu na jeho hmotnost, podat plnou dávku VPA během 6 minut. Jedná se opět o velmi účinný lék, se kterým jsou mnohaleté zkušenosti. Má širší terapeutické rozmezí (v porovnání s PHT), ale taktéž množství NÚ. Z nich zasluhuje pozornost encefalopatie, která je většinou asociována s hyperamonemií (tzv. valproátem indukovaná hyperamonemická encefalopatie). Při léčbě VPA je proto třeba vždy zkontrolovat hladinu amoniaku, a to i při normální či mírně elevované hladině jaterních transferáz [21]. VPA se stejně jako PHT významně (až v 90 %) váže na bílkoviny a může jiné léky (např. zmíněný PHT nebo warfarin) vytěsnit z jejich vazby na bílkoviny, a tím zvýšit jejich volnou frakci [22, 23]. Je významným inhibitorem jaterního metabolismu (enzymů cytochromu P450 a glukuronyltransferázy), proto zvyšuje hladinu celé řady ostatních léčiv (z AE např. PHT, z ostatních léčiv např. tricyklickými antidepresivy) [19, 20]. Jeho hladina může být snížena jinými léčivy – např. typicky podáním karbapenemů.
Levetiracetam (LEV) je další alternativou. Stejně jako VPA, lze i LEV podat velmi rychle (bez ohledu na hmotnost pacienta lze teoreticky plnou dávku podat během 8 minut). Má širší terapeutické rozmezí než PHT a velmi nízký interakční potenciál – není induktorem ani inhibitorem jaterních enzymů, minimálně se váže na plazmatické bílkoviny (pod 10 %) a podléhá renální eliminaci [24]. Je dobře tolerovaný, má nevýznamné NÚ [25].
Na závěr je třeba zmínit lakosamid (LCM), který ale není v ČR zatím v léčbě SE schválen. Můžeme jej ale s výhodou použít jako přídatnou terapii. S jeho použitím je zatím při léčbě SE málo zkušeností, čím dál častěji se ale objevují důkazy o jeho dobré účinnosti. Například v recentní studii porovnávající efekt VPA a LCM u rozvinutého SE oba vykazovaly podobnou efektivitu [26]. LCM má velmi nízký interakční potenciál, podléhá renální eliminaci. Kromě AV blokády nejsou ostatní NÚ nebezpečné a lék je dobře tolerovaný [27]. Poslední alternativou v této fázi SE je podání fenobarbitalu. Jelikož se tento léčebný postup u dospělých pacientů v ČR nepoužívá, dále se o něm nezmiňujeme.
Není zatím prokázáno, že by některé z antiepileptik: PHT, VPA, LEV nebo LCM bylo vyloženě efektivnější v léčbě SE než ostatní. Ale z recentní metaanalýzy porovnávající efektivitu léčby pacientů s rozvinutým konvulzivním SE vyplývá, že bylo nejlepšího výsledku (ukončení SE) dosaženo u 76 % pacientů léčených VPA, 69 % léčených LEV a u 50 % pacientů léčených PHT [28]. Pro kritické zhodnocení efektivity LCM sice zatím není dostatek dat, dostupné výsledky však ukazují jeho dobrou účinnost srovnatelnou s ostatními AE. LEV má dobrý bezpečnostní a farmakologický profil a ve studiích vykazuje velmi dobrou efektivitu. Ale pouze dvě z těchto studií jsou randomizované klinické (randomized controlled trial). Naopak hned několik takových randomizovaných klinických studií je k dispozici v případě PHT i VPA. Aktuálně probíhá studie Established Status Epilepticus Treatment Trial (ESETT) srovnávající fosfofenytoin (lék podobný fenytoinu), LEV a VPA v léčbě SE, která snad poskytne další konkluzivní výsledky [29].
Ve volbě AE hrají roli i další faktory. Jedním z nich je předpoklad dlouhodobé terapie. LEV i LCM (méně VPA) jsou běžně užívané v dlouhodobé terapii epilepsie, proto pokud jsou tyto léky nasazeny v akutní péči, lze v terapii pokračovat. Naopak PHT se v chronické terapii epilepsie nyní používá pouze zřídka. Pokud je tedy v akutní péči PHT úspěšně použit a je nutné u pacienta v léčbě antiepileptiky pokračovat, je často stejně nahrazen jiným lékem s lepším bezpečnostním profilem (např. LEV). Ve volbě AE je z praktického hlediska důležitá i dostupnost a cena preparátů – zatímco v případě PHT je cena léčiva podaného za 24 hodin (u průměrného člověka) cca 100 Kč, v případě VPA 700 Kč, u LEV je cena 1 500 Kč a u LCM 1 800 Kč.
Základním pravidlem léčby rozvinutého CSE je vždy co nejrychlejší vysycení adekvátní dávkou zvoleného antiepileptika ihned po selhání léčby BZD. Jedním z důležitých faktorů refrakternosti k léčbě je totiž poddávkování nebo zbytečné otálení s nasazením AE. S cílem zefektivnit léčbu, zjednodušit algoritmus a vyloučit možné poddávkování vydala American Epilepsy Society v roce 2016 doporučení, které se od aktuálních českých mírně liší. Iniciální – vysycovací dávky LEV a VPA jsou vyšší (pro LEV je to 60 mg/kg a pro VPA 40mg/kg), je ale omezena maximální dávka (pro VPA na 3 000 mg a pro LEV na 4 500 mg). Iniciální dávka PHT se v těchto doporučeních od českých neliší (20 mg/kg), maximální dávka je omezena na 1 500 mg [30].
Léčba RSE je méně úspěšná než léčba fází předešlých. Její podstatou je ve většině případů terapeutické kóma. To má být navozeno po selhání léčby BZD a antiepileptikem II. volby. Velmi důležité je v této fázi zajistit kontinuální EEG nebo alespoň EEG v pravidelných intervalech (nejméně 1× za 24 hodin) kontrolovat. Bedside EEG monitoring představuje nespornou výhodu v terapii SE především vzhledem k možnosti optimalizovat terapii (hloubku anestezie) a zachytit eventuální recidivu SE. Dobrých výsledků v detekci epileptické aktivity je dosaženo i při použití alespoň čtyř elektrod [31]. K optimalizaci terapie může být využito programů využívajících další zpracování EEG signálu. Pomocí kvantitativně zpracovaného EEG můžeme optimalizovat hloubku anestezie. Dále může software pro automatickou detekci epileptiformních grafoelementů významně zkrátit čas při identifikaci elektrografických záchvatů, nicméně senzitivita záchytu záchvatů těmito softwary je 51–68 % a u určitých typů záchvatů a grafoelementů je ještě nižší [32]. Klasické 23svodové EEG zhodnocené zkušeným elektroencefalografistou tak zůstává zlatým standardem v léčbě SE.
Není přesně stanoveno, jaký by měl být optimální cíl léčby RSE – nejdůležitější je vždy potlačení epileptické aktivity, a pokud to stav pacienta dovolí, tak dosažení tzv. burst-suppression vzorce v EEG – úseků výbojů (burst) a následné utlumené aktivity (suppression) [33]. Úseky výbojů by neměly být příliš dlouhé – ideální je dosažení dlouhých (optimálně alespoň deset sekund trvajících) úseků utlumené aktivity (suppression), které jsou ojediněle vystřídané výboji (trvající max. 1–2 sekundy) [34]. Potlačení epileptické aktivity či vzorce burst-suppression by mělo být dosaženo alespoň na 24–48 hodin, poté by měla být celková anestezie pomalu (během 12–24 hodin) redukována. V případě opětovného rozvoje SE opět uvádíme pacienta do celkové anestezie a postup opakujeme. V průběhu redukce medikace se mohou objevit ojedinělé záchvaty (tzv. withdrawal), které však nejsou indikací k opětovnému navození celkové anestezie. Kolikrát je opakování celkové anestezie účelné, není stanoveno a záleží na konkrétní situaci a pacientovi. Kontroverzní je používání antiedematózní terapie, která se v algoritmech léčby často doporučuje. Probíhající SE sice může způsobovat edém mozku, není ale prokázáno, že by antiedematózní terapie zlepšovala pacientovu prognózu. Proto by měla být použita pouze v indikovaných případech.
V ČR se při léčbě RSE používá thiopental, midazolam a propofol [14]. Účinnost léků je podobná – RSE bývá iniciálně ukončen u 64 % pacientů léčených thiopentalem, 78 % midazolamem a 68 % propofolem. Průlomové záchvaty (jakékoli záchvaty, které se vyskytnou po iniciálním zaléčení SE) se ale objeví u 3 % pacientů léčených midazolamem, u 1 % propofolem a u žádného z léčených thiopentalem. V tomto ohledu se zdá být thiopental optimální, ale při posuzování celkové mortality během léčby vychází naopak ze všech nejhůře (mortalita dosahuje při léčbě thiopentalem 19 %, midazolamem 2 % a propofolem 8 %). U thiopentalu je taktéž nejvyšší riziko záchvatů z vysazení (withdrawal), které vznikají při ukončení léčby [35]. Nevýhodami thiopentalu jsou také jeho nežádoucí účinky (především kardiodepresivní a vazodilatační) a jeho významná akumulace v těle, což se odráží v delším poločasu při dlouhodobém podávání, a tedy následném komplikovanějším weaningu. Výhodou propofolu, na rozdíl od barbiturátů, je velmi krátký poločas (i při jeho dlouhodobém podávání). S délkou podávání propofolu ale stoupá riziko vzniku závažného propofolového syndromu (potenciálně fatální srdeční selhání, laktátová acidóza, renální selhání, hypertriglyceridemie a rhabdomyolýza). Midazolam má v porovnání s ostatními nižší účinnost. Při prolongovaném podávání midazolamu se zase prodlužuje jeho biologický poločas a vzniká riziko tachyfylaxe (zrychlené vymizení účinku léku při jeho opakovaném podání v krátkých intervalech), proto je nutné jeho dávku často upravovat. V léčbě lze taktéž použít celkovou anestezii s využitím isofluranu nebo etomidátu, tento postup je ale používán zřídkakdy a nemá lepší výsledky než intravenózní anestezie [36, 37]. Shrnutí standardně používaných léků v léčbě rozvinutého a refrakterního SE uvádíme v tab. 5.
Table 5. Léky používané v léčbě rozvinutého a refrakterního status epilepticus dospělých 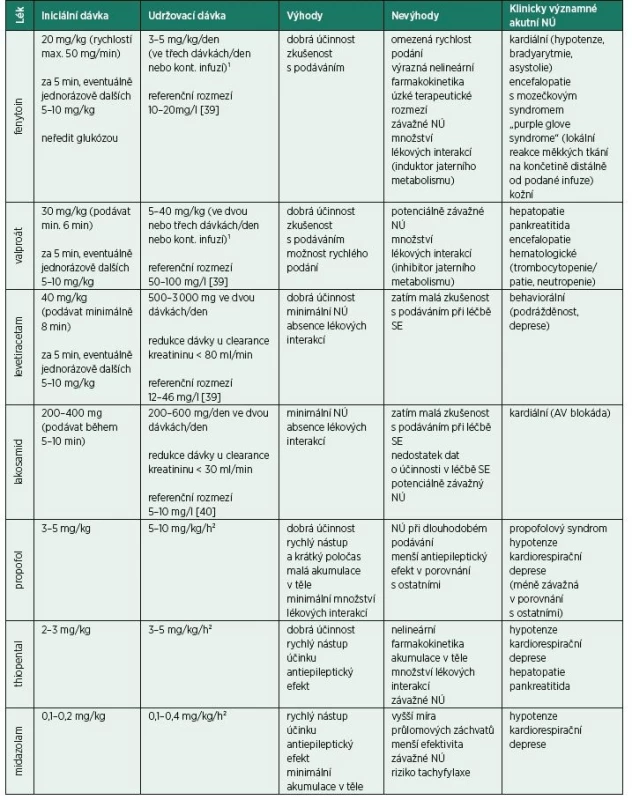
¹Udržovací dávky upravovat vždy dle sérových hladin léku
²Udržovací dávky upravovat vždy dle EEG (vymizení epileptické aktivity či dosažení burst-suppression vzorce)
NÚ – nežádoucí účinky, SE – status epilepticusManagement SRSE je velmi obtížný a v léčbě se nemůžeme opřít o žádnou randomizovanou klinickou studii. Základem je anestezie a kombinace AE. AE vybíráme individuálně (v závislosti na komorbiditách pacienta, eventuálně interakcích s dalšími léčivy) a vyhýbáme se přílišné polyterapii. Velmi nevhodné jsou časté a rychlé změny v terapii, které samy o sobě mohou záchvaty provokovat. Jako přídatnou terapii lze podávat i léky dostupné v perorální formě, přitom je ale nutné brát v potaz možnost sníženého vstřebávání AE z trávicího traktu. Z antiepileptik dostupných pouze v perorální formě byla v léčbě SRSE prokázána dobrá efektivita u topiramátu [38] a klobazamu [39], nicméně lze zvolit i antiepileptika jiná. Vzhledem k NÚ dlouhodobě podávaných vysokých dávek anestetik lze jako přídatnou terapii zvolit ketamin. Jeho nespornou výhodou jsou minimální kardiodepresivní účinky. Považuje se za neuroprotektivní, ale může mít paradoxně i účinky neurotoxické. K minimalizaci neurotoxických účinků by měl být podáván souběžně s gabaergními léky (např. benzodiazepiny, propofol) [40]. Nevýhodou je malá zkušenost s jeho podáváním v této fázi SE. Často je podán až ve velmi pozdních fázích SRSE, když už veškerá terapie selhala. Pokud má být ale ketamin účinný, měl by se použit časněji (např. v iniciální fázi SRSE), kdy vykazuje dobrou efektivitu, a ne až jako poslední možnost, kdy je šance na ukončení SE nízká [41]. Otázka imunoterapie u SRSE není stále vyřešena. Její použití vychází z patofyziologie epileptogeneze, při níž hraje zánět velmi důležitou roli. V léčbě se používají kortikosteroidy, imunoglobuliny a plazmaferéza. Jasný průkaz prospěšnosti imunoterapie ale prokázán nikdy nebyl. Dalším používaným lékem je intravenózně podávaný magnesium sulfát. Publikovaných dat prokazujících účinnost je málo, ale vzhledem k minimálním NÚ spojeným s jeho podáním by měl být v léčbě vždy alespoň vyzkoušen. Pokud má léčba příznivý efekt, měla by pokračovat dále, pokud efekt nemá, měla by být ukončena. Dalšími možnostmi léčby SRSE jsou řízená hypotermie, ketogenní dieta a eventuálně epileptochirurgie [35]. Dávky léčiv používaných v léčbě SRSE jsou shrnuty v tab. 6.
Table 6. Léky používané v léčbě super-refrakterního status epilepticus dospělých 
Reprodukováno volně dle Ferlisi a Shorvon [35] NONKONVULZIVNÍ STATUS EPILEPTICUS A JEHO LÉČBA U DOSPĚLÝCH
Nonkovulzivní status epilepticus je pravděpodobně nejčastější typ epileptického statu, ale je často poddiagnostikován. Zajímavé výsledky v tomto ohledu přinesla studie Laccheo et al. [6], která prokázala nonkovulzivní záchvaty nebo přímo SE u 21 % nemocných přijatých na neurologickou JIP s alterovaným vědomím. Projevy NCSE jsou různorodé. Typická je pro něj porucha vědomí různé úrovně, mohou se ale objevit i poruchy chování, paměti, nystagmus, automatismy, nepatrné myoklony končetin a tváře a v neposlední řadě taktéž fokální neurologické příznaky (například fatická porucha) [42]. Zásadní roli v diagnostice hraje EEG, i když ne vždy lze na jeho základě spolehlivě rozhodnout, zda se o NCSE skutečně jedná. V případě diagnostických rozpaků může napomoci podání BZD s následným zlepšením jak klinického stavu, tak EEG nálezu. Problematika EEG kritérií pro NCSE je však nad rámec tohoto článku.
Na rozdíl od CSE neexistuje pro léčbu NCSE žádné direktivní léčebné doporučení. Taktéž se při léčbě nemůžeme opřít o žádnou randomizovanou klinickou studii a názory na jeho léčbu se mezi odborníky liší. Od léčby konvulzivního se léčba nonkonvulzivního SE liší především agresivitou – jak rychle a jakou dávku AE podat a jak rychle přistoupit k celkové anestezii (propofol, midazolam). Ukazuje se totiž, že přílišná agresivita, která s sebou přináší nežádoucí účinky (především kardiorespirační útlum), v určitých případech dokonce zhoršuje prognózu pacienta. Chybou by bylo rigidně používat v léčbě nonkonvulzivního SE stejné schéma jako u konvulzivního SE. Obecně platí, že léčbu musíme „ušít na míru” pacientovi, přičemž musíme brát v potaz především přítomnost a tíži poruchy vědomí, etiologii SE a komorbidity pacienta.
NCSE bez poruchy vědomí (například projevující se jako fatická porucha) není spojen s významným poškozením mozku ani při protrahovaném průběhu. V terapii kombinujeme různá AE, přičemž nepoužíváme tak vysoké dávky jako u CSE a nejsme omezeni pouze na AE dostupná v intravenózní formě. Zřídkakdy používáme celkovou anestezii [43]. Tento postup mimochodem taktéž použijeme u již dříve zmíněného fokálního motorického statu bez poruchy vědomí (příkladem může být SE projevující se jako klonické křeče na ipsilaterálních končetinách, popř. i na polovině tváře). Ten sice nepatří do NCSE, ale záměrně jej zmiňujeme až zde, protože algoritmus jeho léčby je stejný.
Naopak NCSE s poruchou vědomí může být spojen s potenciálním poškozením mozku, které nastává ovšem později než u CSE [1]. U tohoto typu můžeme použít agresivnější postup při dávkování a podávání léčiv, ale i zde před uvedením do celkové anestezie vyzkoušíme více AE a jejich kombinace. Vždy ovšem záleží na tíži poruchy vědomí – terapeutické kóma s dosažením vzorce burst-suppression je opodstatněnou léčbou NCSE již spojeného s kómatem, ale např. u pacientů s fokálním SE s poruchou vědomí mírnější tíže (například projevujícím se jako zmatenost) tento agresivní postup pacientovu prognózu zhorší, především kvůli nežádoucím účinkům anestetik [44].
V závislosti na etiologii volíme méně agresivní postupy u pacientů s dobrou prognózou – typicky tedy při NCSE u pacientů léčených s epilepsií a nízké hladině AE, naopak agresivní postup zvolíme u pacientů se závažnou prognózou primárního onemocnění (intracerebrální hematom). Velmi kontroverzní je léčba NCSE u pacientů s posthypoxickým poškozením mozku s velmi špatnou prognózou. U nich je porucha vědomí především projevem závažného poškození mozku, a nikoli probíhajícího SE. V tomto případě převažuje názor léčit všeobecně méně agresivně, jelikož agresivní léčba nezlepší celkově špatnou prognózu [45]. Ale i mezi těmito pacienty jsou takoví, kteří mohou z agresivního postupu léčby profitovat (např. pacienti se zachovalými kmenovými reflexy, zachovalou reaktivitou EEG pozadí či výbavnými kortikálními somatosenzorickými evokovanými potenciály) [46].
ZÁVĚR
Status epilepticus je emergentní stav, který vyžaduje rychlou a správnou léčbu. V posledních letech se jeho problematice věnovalo mnoho úsilí, které vyústilo především v návrh jeho nové definice a změnu terapeutických postupů. Aktuální návrh zkrátil dobu, po které se probíhající záchvat označuje jako epileptický status, a nově zdůraznil negativní vliv probíhající epileptické aktivity na mozek. Důležitou součástí jeho managementu je volba vhodné agresivity léčby. Konvulzivní status epilepticus by měl být vždy zaléčen co nejdříve adekvátní dávkou antiepileptika. U nonkovulzivního epileptického statu je naopak někdy účelné být v léčbě opatrnější a brát v potaz více faktorů (etiologii, komorbidity, stav pacienta).
Léky používané v léčbě SE jsou sice podobě účinné, ale odlišují se především ve svém bezpečnostním profilu. Antiepileptika jako fenytoin či valproát jsou sice osvědčená, ale jejich použití přináší celou řadu úskalí (interakce, nežádoucí účinky, nutnost monitorace hladin, u fenytoinu omezení rychlosti podávání). Naopak levetiracetam (v budoucnu zřejmě i lakosamid) má na jednu stranu velmi dobrý bezpečnostní profil, ale na stranu druhou je zatím málo důkazů o jeho účinnosti. Srovnávací randomizované klinické studie nám snad v budoucnu pomohou tento problém vyřešit.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Oba autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
- SO: 80 %
- ŠV: 20 %
Poděkování: prof. MUDr. Milanu Brázdilovi, Ph.D., za cenné připomínky.
Do redakce došlo dne 2. 5. 2018.
Do tisku přijato dne 6. 7. 2018.
Adresa pro korespondenci:
MUDr. Ondřej Strýček
Sources
1. Trinka E, Cock H, Hesdorffer D, et al. A definition and classification of status epilepticus-Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015;56 : 1515–1523.
2. Walton NY. Systemic effects of generalized convulsive status epilepticus. Epilepsia.1993;34:S54–S58.
3. Treiman DM, DeGiorgio CM, Salisbury S, et al. Subtle generalized convulsive status epilepticus. Epilepsia. 1984;25 : 653.
4. Dham BS, Hunter K, Rincon F. The epidemiology of status epilepticus in the United States. Neurocrit Care. 2014;20 : 476–483.
5. DeLorenzo RJ, Hauser WA, Towne AR, et al. A prospective, population-based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology. 1996;46 : 1029–1035.
6. Laccheo I, Sonmezturk H, Bhatt AB, et al. Non-convulsive status epileptici and non-convulsive seizures in neurological ICU patients. Neurocrit Care. 2015;22 : 202–211.
7. Holtkamp M, Othman J, Buchheim K, Meierkord H. Predictors and prognosis of refractory status epilepticus treated in a neurological intensive care unit. J Neurol Neurosurg Psychiatry. 2005;76 : 534–539.
8. Kantanen AM, Reinikainen M, Parviainen I, et al. Incidence and mortality of super-refractory status epilepticus in adults. Epilepsy Behav. 2015;49 : 131–134.
9. DeLorenzo RJ, Pellock JM, Towne AR, Boggs JG. Epidemiology of status epilepticus. J Clin Neurophysiol. 1995;12 : 316–325.
10. Shorvon SD, Ferlisi M. The outcome of therapies in refractory and super-refractory convulsive status epilepticus and recommendations for therapy. Brain. 2012;135 : 2314–2328.
11. Lowenstein DH, Bleck T, Macdonald RL. It’s time to revise the definition of status epilepticus. Epilepsia. 1999;40 : 120–122.
12. Mazarati AM, Baldwin RA, Sankar R, Wasterlain CG. Time-dependent decrease in the effectiveness of antiepileptic drugs during the course of self-sustaining status epilepticus. Brain Res. 1998;814 : 179–185.
13. Alvarez V, Lee JW, Drislane FW, et al. Practice variability and efficacy of clonazepam, lorazepam, and midazolam in status epilepticus: A multicenter comparison. Epilepsia. 2015;56 : 1275–1285.
14. Kolektiv autorů. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií EpiStop 2017 [Internet]. Dostupné z http://www.clpe.cz/Epistandardy_2017_web.pdf
15. Talukdar B, Chakrabarty B. Efficacy of buccal midazolam comparedto intravenous diazepam in controlling convulsions in children: Arandomized controlled trial. Brain Dev. 2009;31 : 744–749.
16. Silbergleit R, Durkalski V, Lowenstein D, et al. NETT Investigators. Intramuscular versus intravenous therapy for prehospital status epilepticus. N Engl J Med. 2012;366 : 591–600.
17. Mohamed, W., Mahulikar, A., Rao, S., et al. Inadequacy of Benzodiazepine dosing in Status Epilepticus patients admitted to Neurointensive Care Unit (P4. 223). Neurology. 2017;88:P4–223.
18. Perucca E, Hebdige S, Frigo GM, et al. Interaction between phenytoin and valproic acid: plasma protein binding and metabolit effects. Clin Pharmacol Ther. 1980;28 : 779–789.
19. De Jong MJ, Karch AM, Lippincott's Critical Care Drug Guide. 1st edition. Philadelphia: Lippincott Williams & Wilkins, 2000.
20. Johannessen SI, Landmark CJ. Antiepileptic Drug Interactions – Principles and Clinical Implications. Current Neuropharmacology. 2010;8 : 254–267.
21. Annagur BB, Sayin AA, Akbaba N, Selvi Y. Valproic acid induced hyperammonemic encephalopathy: report of one case. In European Psychiatry. 2013;28 : 1.
22. Perucca E. Pharmacological and therapeutic properties of valproate: a summary after 35 years of clinical experience. CNS Drugs. 2002;16 : 695–714.
23. Yoon HW, Giraldo EA, Wijdicks EF. Valproic acid and warfarin: an underrecognized drug interaction. Neurocrit Care. 2011;15 : 182–185.
24. Trinka E, Dobesberger J. New treatment options in status epilepticus: a critical review on levetiracetam. Ther Adv Neurol Dis. 2009;2 : 79–91.
25. Patsalos PN. Pharmacokinetic profile of levetiracetam: toward ideal characteristics. Pharmacol Ther. 200l;85 : 77–85.
26. Zaccara G, Perucca P, Loiacono G, et al. The adverse event profile of lacosamide: a systematic review and meta-analysis of randomized controlled trials. Epilepsia. 2013;54 : 66–74.
27. Cross SA, Curran MP. Lacosamide: in partial-onset seizures. Drugs. 2009;69 : 449–459.
28. Yasiry Z, Shorvon SD. The relative effectiveness of five antiepileptic drugs in treatment of benzodiazepine-resistant convulsive status epilepticus: a meta-analysis of published studies. Seizure. 2014;23 : 167–174.
29. Bleck T, Cock H, Chamberlain J, et al. The established status epilepticus trial 2013. Epilepsia. 2013;54 : 89–92.
30. Glauser T, Shinnar S, Gloss D, et al. Evidence-Based Guideline: Treatment of Convulsive Status Epilepticus in Children and Adults: Report of the Guideline Committee of the American Epilepsy Society. Epilepsy Currents. 2016;16 : 48–61.
31. Young GB, Sharpe MD, Savard M, et al. Seizure detection with a commercially available bedside EEG monitor and the subhairline montage. Neurocrit Care. 2009;11 : 411–416.
32. Haider HA, Esteller R, Hahn CD, et al. Sensitivity of quantitative EEG for seizure identification in the intensive care unit. Neurology. 2016;87 : 935–944.
33. Lowenstein DH, Alldredge BK. Status epilepticus. N Engl J Med. 1998;338 : 970–976.
34. Betjemann JP, Lowenstein DH. Status epilepticus in adults. Lancet Neurol. 2015;14 : 615–624.
35. Ferlisi M, Shorvon S. The outcome of therapies in refractory and super-refractory convulsive status epilepticus and recommendations for therapy. Brain. 2012;135 : 2314–2328.
36. Yeoman P, Hutchinson A, Byrne A, et al. Etomidate infusions for the control of refractory status epilepticus. Intensive Care Med. 1989;15 : 255–259.
37. Zeiler FA, Zeiler KJ, Teitelbaum J, et al. Modern inhalational anesthetics for refractory status epilepticus. Can J Neurol Sci. 2015;42 : 106–115.
38. Synowiec AS, Yandora KA, Yenugadhati V, et al. The efficacy of topiramate in adult refractory status epilepticus: experience of a tertiary care center. Epilepsy Res. 2012;98 : 232–237.
39. Sivakumar S, Ibrahim M, Parker D Jr, et al. Clobazam: An effective add-on therapy in refractory status epilepticus. Epilepsia. 2015;56:e83–e89.
40. Rossetti AO, Lowenstein DH. Management of refractory status epilepticus in adults: Still more questions than answers. Lancet neurology. 2011;10 : 922–930.
41. Wijdicks EF, Rabinstein AA, Hocker SE, Fugate JE. Neurocritical Care.2nd edition. New York: Oxford university press, 2016.
42. Patsalos PN, Berry DJ, Bourgeois BF, et al. Antiepileptic drugs-best practice guidelines for therapeutic drug monitoring: a position paper by the subcommission on therapeutic drug monitoring, ILAE Commission on Therapeutic Strategies. Epilepsia. 2008;49 : 1239–1276.
43. Jacob S, Nair AB. An Updated Overview on Therapeutic Drug Monitoring of Recent Antiepileptic Drugs. Drugs in R&D. 2016;16 : 303–316.
44. Sutter R, Semmlack S, Kaplan PW. Nonconvulsive status epilepticus in adults – insights into the invisible. Nat Rev Neurol. 2016;12 : 281–293.
45. Meierkord H, Holtkamp M. Non-convulsive status epilepticus in adults: clinical forms and treatment. Lancet Neurol. 2007;6 : 329–339.
46. Marchi NA, Novy J, Faouzi M, et al. Status epilepticus: impact of therapeutic coma on outcome. Crit Care Med. 2015;43 : 1003–1009.
47. Ferguson M, Bianchi MT, Sutter R, et al. Calculating the risk benefit equation for aggressive treatment of non-convulsive status epilepticus. Neurocrit Care. 2013;18 : 216–227.
48. Rossetti AO, Oddo M, Logroscino G, Kaplan PW. Prognostication after cardiac arrest and hypothermia: a prospective study. Ann Neurol. 2010;67 : 301–307.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine Neurology Paediatrics General practitioner for children and adolescents
Article was published inAnaesthesiology and Intensive Care Medicine

2018 Issue 4-
All articles in this issue
- Porovnanie katétrovej vysokofrekvenčnej dýzovej ventilácie pľúc a konvenčnej ventilácie počas intervenčnej bronchoskopie u pacientov s obštrukciou dýchacích ciest
- Calprotectin a calgranulin C v krvi u polytraumatizovaných pacientů
- Spontánní návrat antikoagulačního účinku kumulovaného dabigatranu po odeznění účinku antagonisty: Kazuistika pacienta s život ohrožujícím krvácením
- Nová definice status epilepticus a možnosti jeho farmakologické léčby
- Využití ultrazvuku v intervenční léčbě bolesti
- Překlady pacientů mezi pracovišti a „spádová“ zdravotnická zařízení
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nová definice status epilepticus a možnosti jeho farmakologické léčby
- Překlady pacientů mezi pracovišti a „spádová“ zdravotnická zařízení
- Využití ultrazvuku v intervenční léčbě bolesti
- Calprotectin a calgranulin C v krvi u polytraumatizovaných pacientů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

