-
Medical journals
- Career
Generalizovaný konvulzivní status epilepticus v dětském věku
Authors: Š. Aulická 1; P. Aulický 2; K. Česká 1; K. Španělová 1; H. Ošlejšková 1
Authors‘ workplace: Klinika dětské neurologie, Lékařská fakulta, Masarykova univerzita, Fakultní nemocnice Brno 1; Oddělení anesteziologie, resuscitace a intenzivní medicíny, Nemocnice Milosrdných bratří 2
Published in: Anest. intenziv. Med., 29, 2018, č. 3, s. 139-147
Category: Review Article
Overview
Generalizovaný konvulzivní status epilepticus (GCSE) je u dětí nejčastějším emergentním neurologickým stavem. Jedná se o generalizovaný konvulzivní záchvat trvající > 5 minut. Kojenecký a zejména novorozenecký věk představuje nejrizikovější období pro rozvoj GCSE. Febrilní status epilepticus je nejčastější příčinou. Rozlišují se 4 stadia GCSE: 1. časný (5–20 minut), 2. rozvinutý (20–40 minut), 3. refrakterní (> 40 minut) a 4. superrefrakterní (> 24 hodin). Generalizovaný konvulzivní záchvat v prvních pěti minutách bývá označován jako hrozící GCSE. Během pěti minut musí být zahájena adekvátní léčba vedoucí k terminaci záchvatu. Tato léčba sleduje dvě současně probíhající linie: 1. zajištění vitálních funkcí (podle pravidel A – B – C) a 2. léčbu určitými antiepileptiky podle stadia GCSE. Současně je potřeba řešit příčinu GCSE, je-li zjištěna. Všechna antiepileptika mají být aplikována intravenózně. Lékem 1. volby ve fázi časného GCSE je benzodiazepin: diazepam nebo klonazepam. Pro léčbu 2. volby ve fázi rozvinutého GCSE máme na výběr jedno z těchto nebenzodiazepinových antiepileptik: fenytoin, kyselina valproová, levetiracetam, eventuálně i fenobarbital či lakosamid. Nedojde-li ke kontrole GCSE, zahajujeme ve fázi refrakterního GCSE celkovou anestezii jedním ze tří intravenózních celkových anestetik: midazolam, thiopental, propofol. Celková anestezie má trvat 24–48 hodin a její hloubka má být kontinuálně monitorována prostřednictvím EEG. GCSE recidivující během vyvádění z > 24 hodin trvající adekvátní celkové anestezie bývá označován jako superrefrakterní a bývá spojen s vysokou morbiditou a mortalitou.
klíčová slova:
konvulzivní status epilepticus – refrakterní status epilepticus – děti
ÚVOD
Generalizovaný konvulzivní status epilepticus (GCSE) je u dětí nejčastějším emergentním neurologickým stavem. Jedná se o závažný, často život ohrožující stav, vyžadující neodkladnou terapeutickou intervenci.
DEFINICE
GCSE je definován jako generalizovaný tonicko-klonický záchvat trvající > 5 minut (podle tradiční definice > 30 minut) [1–3]. Jedná se o > 5 minut trvající křeče s bezvědomím nebo o opakované záchvaty křečí, mezi nimiž pacient nenabývá vědomí. Během pěti minut musí být zahájena adekvátní léčba vedoucí k terminaci záchvatu.
V roce 2015 byla Mezinárodní ligou proti epilepsii (International League Against Epilepsy, ILAE) stanovena nová definice SE [4]. Tato definice klade důraz na dva kritické body:
- t1 – čas, při jehož překročení je spontánní terminace epileptické aktivity nepravděpodobná, a nejpozději v tomto bodě by měla být zahájená adekvátní terapie,
- t2 – čas, při jehož překročení pokračující epileptická aktivita může způsobovat dlouhodobé patologické změny v mozku (alterace funkce neuronálních sítí, neuronální poškození, až smrt).
V případě GCSE je časové hledisko nejlépe definováno, časový bod t1 = 5 minut, t2 = 30 minut. Během úvodního pětiminutového časového okna proto musí být zahájena adekvátní léčba. Při generalizovaném konvulzivním záchvatu, který není pod kontrolou do pěti minut, hrozí jeho pokračování, přičemž při překročení 30 minut s rizikem ireverzibilního poškození mozku. Zpožděné zahájení léčby je tedy spojeno s horší odpovědí na léčbu. U jednotlivých typů SE se tyto časové hranice mění, a zejména v případě non-konvulzivních SE nejsou jasné. Například u fokálního SE s alterací vědomí je časem t1 10 minut a časem t2 60 minut a v případě absence SE t1 10–15 minut.
EPIDEMIOLOGIE
Odhadovaná incidence SE v dětském věku je 20/100000/rok [1]. Kojenecký a zejména novorozenecký věk představují nejrizikovější období pro rozvoj SE. Febrilní SE (tzn. SE spuštěný horečkou) je nejčastější příčinou [5]. U 10–20 % dětí s epilepsií se SE vyskytne minimálně jednou [1]. U 12 % dětí je SE první manifestací epilepsie [1].
PATOFYZIOLOGIE
Z patofyziologického hlediska SE vzniká selháním mechanismů odpovědných za ukončení záchvatu a/nebo rozvojem mechanismů vedoucích k udržování záchvatu [1]. V rozvoji SE hrají rozhodující roli inhibiční gabaergní (GABA A) receptory a excitační glutamátergní N-metyl-D-aspartátové (NMDA) receptory [1]. Glutamát je hlavním excitačním neurotransmiterem v mozku. Dalšími excitačními neurotransmitery jsou aspartát a acetylcholin. Kyselina gama-amino-máselná (GABA) je naopak hlavním inhibičním neurotransmiterem v mozku. Potenciace inhibice neuronální aktivity zprostředkovaná GABA je podstatou mechanismu účinku benzodiazepinů (BZD), barbiturátů a propofolu, které se vážou na GABA A receptory. Pokračující záchvatová aktivita vede k úbytku inhibičních GABA A receptorů na postsynaptické membráně a současně zde stoupá počet excitačních NMDA receptorů. Úbytkem GABA A receptorů se vysvětluje rychlá ztráta účinku BZD. Tyto změny, ke kterým dochází během minut až hodin, udržují stav zvýšené excitability. Předpokládá se, že během SE dochází k neuronálním ztrátám [1]. Při opakovaných epileptických statech se ztráty kumulují a výsledkem může být (různou měrou vyjádřený) kognitivní deficit.
KLASIFIKACE
Klasifikace epileptických statů je podobná klasifikaci epileptických záchvatů. Rozlišují se čtyři typy [1]:
- Fokální SE bez poruchy vědomí (dříve simplexní parciální SE) – kontinuální nebo recidivující fokální motorická (křeče) nebo senzorická záchvatová aktivita bez alterace vědomí.
- Fokální SE s poruchou vědomí (dříve komplexní parciální SE) – kontinuální nebo recidivující fokální motorická (automatismy) nebo senzorická záchvatová aktivita s alterovaným vědomím.
- Generalizovaný konvulzivní SE – tonicko-klonické, tonické nebo klonické křeče vždy spojené s bezvědomím.
Poznámka: Generalizované konvulzivní záchvaty se rozdělují na primárně generalizované (u geneticky podmíněných idiopatických generalizovaných epilepsií) a sekundárně generalizované. Tyto vznikají generalizací záchvatové aktivity epileptogenního fokusu. Klinicky oba typy většinou nelze odlišit (ke generalizaci totiž obvykle dochází tak rychle, že se případné fokální symptomy nestihnou projevit).
- Absence SE – generalizovaná záchvatová aktivita charakterizovaná alterací vědomí, ale ne vždy bezvědomím.
Poznámky ke klasifikaci:
- Absence SE, fokální SE (s poruchou vědomí nebo bez ní) bez motorické symptomatiky jsou označovány termínem non-konvulzivní SE. Non-konvulzivní SE lze diagnostikovat pouze elektroencefalograficky.
- Tzv. subtle SE může následovat neléčený nebo nedostatečně léčený GCSE [6]. Pacienti bývají komatózní, s nenápadnými klinickými příznaky, jakými jsou např. drobné generalizované myoklonie či záškuby očních bulbů, nebo bez nich. Jinými autory bývá subtle SE začleňován do skupiny non-konvulzivních SE. V tomto případě by se jednalo o non-konvulzivní SE s nejhorší prognózou.
- Do klasifikace není zahrnován myoklonický SE. Jedná se o velmi heterogenní skupinu epileptických statů. Kontinuální myoklonie se totiž mohou vyskytovat u onemocnění širokého spektra závažnosti. Od benigních epileptických syndromů (juvenilní myoklonická epilepsie) po stavy s obvykle infaustní prognózou (postanoxická encefalopatie).
- Psychogenní neepileptické záchvaty (PNES) bývají diferenciálně-diagnostickým problémem zejména u teenagerů [2]. Tito pacienti občas bývají přiváženi na urgentní příjmy pro opakující se epizody atypických křečí, které nereagují na standardní antikonvulzivní terapii. PNES se typicky vyskytují u pacientů s afektivními a anxiózními poruchami (zejména pak u těch s epilepsií v rodinné anamnéze) [2]. Mnoho pacientů s PNES současně mívá i epileptické záchvaty. PNES mohou být odlišeny od SE elektroencefalografií.
ETIOLOGIE
SE se může objevit na podkladě již diagnostikované epilepsie nebo může být první manifestací epilepsie. SE také může být akutním symptomem neurologického nebo i jiného onemocnění. Mezi možné příčiny SE patří např.:
- meningoencefalitida,
- akutní hypoxicko-ischemický inzult (u dětí obvykle asfyxie),
- metabolické onemocnění (např. hypoglykemie),
- elektrolytová dysbalance (např. hyponatremie),
- kraniocerebrální trauma,
- intoxikace,
- cerebrovaskulární příhoda,
- mozkový nádor.
Table 1. Poruchy vnitřního prostředí spojené se signifikantním rizikem vzniku akutních symptomatických epileptických záchvatů [7, 8] ![Poruchy vnitřního prostředí spojené se signifikantním
rizikem vzniku akutních symptomatických epileptických záchvatů
[7, 8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/25f61e4ed11c625bd843daec936c72b4.jpeg)
*Laboratorní hodnoty, při kterých je signifikantně zvýšená záchvatová pohotovost V posledních letech je v popředí zájmu tzv. new onset refractory status epilepticus (NORSE) [9]. Patogeneze je nejasná. Některé případy mohou reprezentovat autoimunní nebo paraneoplastickou encefalitidu způsobenou protilátkami proti synaptickým proteinům (např. NMDA receptorům), přičemž může být efektivní imunomodulační terapie [10]. Ostatní případy NORSE však bývají k imunoterapii (steroidy, IVIG, plazmaferéza) refrakterní a jsou spojeny s vysokou morbiditou a mortalitou [11]. Podtypem NORSE je tzv. febrile infection related epilepsy syndrome (FIRES), což je refrakterní SE předcházený horečnatým infekčním onemocněním [12].
DIAGNOSTICKO-LÉČEBNÝ POSTUP U GENERALIZOVANÉHO KONVULZIVNÍHO STATUS EPILEPTICUS
GCSE je nejdramatičtěji probíhajícím a nejnebezpečnějším epileptickým statem.
TERAPIE V JEDNOTLIVÝCH STADIÍCH GCSE
Časy jednotlivých stadií v literatuře nejsou jednotné, níže uvedené rozdělení vychází z nových doporučení American Epilepsy Society, 2016 [13].
- Stadium 1 (časný GCSE; 5–20 minut): Zahájení obecné terapie, monitorace a diagnostiky. Bolusy benzodiazepinu. Čas 0–5 min bývá označován jako hrozící GCSE.
- Stadium 2 (rozvinutý GCSE; 20–40 minut): Pokračující GCSE po podání dvou bolusů benzodiazepinu, zahájení infuze nebenzodiazepinového antiepileptika.
- Stadium 3 (refrakterní GCSE; > 40 minut): Pokračující GCSE i po podání adekvátních dávek benzodiazepinu a nebenzodiazepinového antiepileptika, indikace buď k léčbě jiným nebenzodiazepinovým antiepileptikem, nebo přímo k intravenózní celkové anestezii.
- Stadium 4 (superrefrakterní GCSE; > 24 hodin): GCSE pokračující i při intravenózní celkové anestezii včetně případů, kdy dojde k rekurenci záchvatu po vysazení či snížení anestezie.
Přestože existují doporučení pro terapii GCSE, nelze je rigidně aplikovat na všechny pacienty. V uvedeném textu čas „0“ znamená začátek generalizovaného konvulzivního záchvatu. Uvedené časování může odpovídat léčbě pacienta v nemocničním prostředí. Začne-li záchvat mimo nemocnici, zahájení léčby týmem přednemocniční péče (základní postupy a aplikace léčiv 1. volby) může být o 10–20 i více minut zpožděno. Proto je u epileptiků důležité, aby léčba byla zahájena např. rodiči dítěte aplikací rektálního diazepamu nebo intranazálního, příp. bukálního midazolamu. Do nemocnice se pak pacient může dostat po 20–30 i více minutách, přičemž léčiva 2. volby bývají obvykle aplikována právě až v nemocničním prostředí. Často se však stává, že tým přednemocniční péče při neefektivitě bolusu benzodiazepinu přistupuje přímo k úvodu do celkové anestesie (CA), intubaci a umělé plicní ventilaci (UPV).
HROZÍCÍ GCSE (0–5 MINUT)
- Elevace hlavy a trupu 30°.
- Oxygenoterapie maskou s rezervoárem.
- Monitorace SpO2 a EKG (jeden svod), neinvazivní měření TK à 5 min.
- Zajištění žilního vstupu (optimálně dvou žilních vstupů).
- Odběr kapilární krve k vyšetření glykemie a při hypoglykemii bolus glukózy i.v. (u novorozenců 10% glukóza, u větších dětí je možné použít až 40% glukózu).
- Odběr žilní krve k vyšetření krevního obrazu, biochemie, hladin antiepileptik (viz výše).
- Kontrola teploty v případě horečky či hypertermie.
- Monitorace vitálních funkcí pokračuje po celou dobu terapie GCSE.
- Kdykoli (nejen v prvních pěti minutách) během terapie GCSE v případě poruchy oxygenace (desaturace, cyanóza) a/nebo ventilace (hypoventilace, apnoe) → úvod do CA, intubace a UPV.
ČASNÝ GCSE (5–20 MINUT)
Léky 1. volby (benzodiazepiny [BZD] aplikované formou i.v. injekce):
- Diazepam* 0,15–0,2 mg/kg i.v. (max. 10 mg/dávku) [13]. Pokud po pěti minutách přetrvávají křeče, lze dávku zopakovat. Případné podání třetí dávky BZD (ne dříve než po dalších pěti minutách) může být zváženo, není-li kompromitována ventilace a oxygenace.
Poznámky:
- Podle doporučení EpiStop se u dětí do tří let podává diazepam i.v. v dávce 0,5 mg/kg,u dětí starších 0,3 mg/kg pro dosi [14].
- Alternativou diazepamu je klonazepam. Podle doporučení EpiStop dávkování i.v. představuje přibližně 1/10 dávky diazepamu – tj. do tří let věku 0,05 mg/kg, u dětí starších 0,03 mg/kg [14].
- Terapie BZD může být zahájena už v prvních pěti minutách.
- V USA je lékem první volby lorazepam.
- Pokud není žilní vstup: Midazolam intramuskulárně, intranazálně nebo bukálně 0,2 mg/kg (max. 10 mg/dávku) [2], eventuálně diazepam 0,2–0,5 mg/kg (max. 20 mg/dávku) rektálně [13]. Při nemožnosti zajištění i.v. vstupu je indikováno zavedení vstupu intraoseálního.
Poznámky:- Doporučení EpiStop pro intramuskulární, intranazální nebo bukální aplikaci midazolamu: 0,2–0,3 mg/kg pro dosi [14].
- Doporučení EpiStop pro rektální aplikaci diazepamu: u dětí pod 15 kg tělesné hmotnosti 5 mg, nad 15 kg 10 mg pro dosi [14].
- V domácím prostředí přichází v úvahu rektální diazepam (ve formě gelu) a intranazální či bukální midazolam (ve formě spreje).
*Diazepam je vysoce lipofilní lék s rychlým průnikem přes hematoencefalickou barieru. Efekt diazepamu lze pozorovat 10–20 sekund po podání. Vzhledem k následné rychlé redistribuci léku do tukové tkáně antikonvulzivní efekt diazepamu trvá zpravidla < 20 minut. Klonazepam má ve srovnání s diazepamem delší trvání účinku.
Dojde-li k terminaci GCSE bolusem, eventuálně bolusy BZD, u pacientů bez antiepileptické medikace je na místě zvážit nasazení antiepileptika (jehož smyslem je prevence rekurence GCSE).
ROZVINUTÝ GCSE (20–40 MINUT)
Léky 2. volby (fenytoin, kyselina valproová, levetiracetam, aplikované formou i.v. infuze):
Léčbu jedním z těchto farmak zahajujeme po dvou dávkách BZD. Některé algoritmy doporučují terapii nebenzodiazepinovým antiepileptikem zahájit již po první dávce BZD. Tento postup může být racionální v případě první manifestace GCSE. Výběr léku druhé volby je nutné individuálně zvážit. Nejvíce zkušeností je s fenytoinem.
- Fenytoin* 20 mg/kg (max. 1,5 g/dávku) rychlostí max. 50 mg/min (tzn. např. 1 g fenytoinu ve 20minutové infuzi) [2, 13].
Poznámky:- Podle doporučení EpiStop se fenytoin podává u dětí do 12 let v saturační dávce 20–30 mg/kgi.v. a rychlost podání se doporučuje pomalejší než u dospělých (25 mg/min) [14].
- Riziko hypotenze a/nebo bradykardie (zvýšená opatrnost u pacientů s onemocněním srdce – v tomto případě zvážit jiný lék druhé volby!).
- Ředit do fyziologického roztoku (ne do 5% glukózy – došlo by k vysrážení fenytoinu).
- V případě idiopatických generalizovaných epilepsií (např. juvenilní myoklonická epilepsie) použít spíše kyselinu valproovou nebo levetiracetam [15].
- Fenytoin nemusí být účinný na křeče při intoxikacích (křeče způsobené kokainem, lokálními anestetiky a teofylinem dokonce může zhoršovat).
- V USA je namísto fenytoinu používán fosfenyotin.
*Fenytoin je antiepileptikum s prolongovaným účinkem. Účinek nastupuje po 10–30 minutách od zahájení aplikace. Z toho vyplývá, že terapii fenytoinem musí předcházet aplikace antiepileptika s rychlým nástupem účinku, tzn. benzodiazepinu.
- Kyselina valproová 20–40 mg/kg (max. 3 g) v 5–10minutové infuzi [2, 13].
Poznámka:- Nedávat při závažné hepatopatii a/nebo podezření na mitochondriální poruchy.
- Levetiracetam 40–60 mg/kg (max. 4,5 g) v 15minutové infuzi [2, 13].
Poznámky: - Alternativně může být použit lakosamid 10 mg/kg [16] (max. 400 mg/dávku) v infuzi.
- Lékem druhé volby může být i fenobarbital 15–20 mg/kg rychlostí max. 50 mg/min (tzn. např. 1 g fenobarbitalu ve 20minutové infuzi) [2, 13]. Avšak ve srovnání s ostatními léky druhé volby, především v kombinaci s BZD, je při jeho použití riziko hypotenze, a především dechového útlumu. Může však být použit jako lék druhé volby pro terapii GCSE kojenců a zejména při křečích způsobených intoxikacemi. Fenobarbital je stále lékem 1. volby pro terapii novorozeneckých záchvatů.
Účelem bolusu BZD je zastavit GCSE, účelem infuze léku druhé volby je zabránit rekurenci GCSE. Dojde-li k terminaci GCSE bolusy BZD současně s infuzí léku druhé volby, je na místě pokračovat v udržovací terapii tímto lékem druhé volby.
Po GCSE většina dětí nabývá vědomí během 20–30 minut od ukončení křečí. Dvěma nejčastějším důvody pro opožděné zotavování jsou sedativní efekt antiepileptik a non-konvulzivní SE, což bez EEG nebývá možné odlišit. EEG má být provedeno nejpozději během několika málo hodin, pokud pacient zůstává nekontaktní.
Poznámka: Znalost předchozí odpovědi na léčbu a znalost aktuální farmakologické anamnézy mohou být vodítkem pro terapii GCSE. Jestliže např. je známo, že epileptické záchvaty nereagovaly na fenytoin, nabízí se použití i.v. kyseliny valproové nebo levetiracetamu. Naopak, pokud víme, že pacient byl kompenzován např. při léčbě kyselinou valproovou a že vynechal jednu nebo více dávek (nebo předpokládáme snížení hladiny kyseliny valproové např. následkem opakovaného zvracení), je racionální i.v. aplikace právě tohoto antiepileptika.
REFRAKTERNÍ GCSE (> 40 MINUT)
Pokud GCSE není zastaven bolusy BZD se současnou infuzí nebenzodiazepinového antiepileptika, tzn. v čase 30–40 minut od rozvoje, obvykle postupně dochází k mitigování křečí a GCSE spěje do obrazu tzv. subtle SE (viz výše). V této situaci obvykle bývá nezbytné zahájení CA s intubací a UPV.
V případě méně dramatické situace – tzn. není-li významně kompromitována oxygenace a/nebo ventilace – je možné zahájit infuzi druhého léku druhé volby (např. když GCSE trvá i po skončení infuze fenytoinu, přistoupit k terapii kyseliny valproové nebo levetiracetamu) a k CA přistoupit až v případě selhání i tohoto druhého léku druhé volby.
K úvodu do CA a jejímu udržování máme na výběr jedno z těchto tří intravenózních celkových anestetik: midazolam, thiopental a propofol (midazolam je, přesněji řečeno, benzodiazepinové hypnotikum). Pentobarbital není v ČR dostupný. U dětí bývá anestetikem první volby midazolam, méně často thiopental. Použití propofolu je spojeno s rizikem rozvoje tzv. propofolového infuzního syndromu (viz níže). Propofol má ovšem významnou výhodu – ve srovnání s midazolamem a zejména thiopentalem – a sice výrazně kratší dobu účinku, a tím i výrazně rychlejší zotavení z celkové anestezie. Naproti tomu midazolam – ve srovnání s propofolem a thiopentalem – nezpůsobuje tak výraznou depresi oběhu (hypotenzi).
- Midazolam 0,2 mg/kg (případně přídatné bolusy à 0,1‒0,2 mg/kg do dosažení efektu) → 0,1‒2 mg/kg/h [2].
- Thiopental 3‒5 mg/kg (případně přídatné bolusy à 1‒2 mg/kg do dosažení efektu) →3‒5 mg/kg/h [17].
- Propofol 1–2 mg/kg (případně přídatné bolusy à 1–2 mg/kg do dosažení efektu) →2–4 mg/kg/h [17]. Není-li při tomto dávkování dosaženo požadovaného efektu (burst suppression – viz níže), kombinovat s midazolamem (nezvyšovat dávku).
Po úvodu do CA je potřeba dosáhnout optimální hloubky CA, což bez kontinuální EEG monitorace nelze. Příliš mělká CA totiž vede k rekurencím GCSE po snižování a vysazení celkového anestetika. Naopak příliš hluboká CA způsobuje nežádoucí útlum vitálních funkcí, přičemž hlavním nebezpečím je těžká kompromitace oběhu, resp. hypotenze (dýchání může být plně nahrazeno řízenou ventilací). Cílem terapie je celková anestezie, při které bývá v EEG vzorec burst suppression. Adekvátní celková anestezie má být – za kontinuální EEG monitorace (cílové dávkování celkového anestetika se totiž může měnit v čase) – udržována po dobu 24–48 hodin. Současně s CA je na místě pokračovat v udržovací terapii lékem, eventuálně léky druhé volby. U léčených epileptiků je navíc snaha o dosažení plných hladin (případným navýšením dávek) užívaných antiepileptik. Antiepileptika, která nejsou dostupná v injekční formě, se podávají enterálně cestou nazogastrické sondy. Smyslem těchto postupů je prevence rekurence GCSE po snižování a vysazení celkového anestetika.
Ukončování CA má probíhat postupně. Příliš rychlé ukončení CA s sebou nese riziko rekurence GCSE. Např. dávkování propofolu bývá snižováno o 5 %/h. Midazolam a zejména thiopental mohou být – vzhledem k delšímu trvání účinku – vysazovány rychleji. Kontinuální EEG monitorace je zde obzvláště důležitá, protože rekurence elektrografických záchvatů může předcházet rekurenci křečí.
PROPOFOLOVÝ INFUZNÍ SYNDROM
Propofolový infuzní syndrom (PRIS) je zřídkavý, ale potenciálně fatální syndrom s vysokou mortalitou, který se vyskytuje u kriticky nemocných dětí v návaznosti na dlouhotrvající kontinuální infuzi propofolu ve vysokých dávkách. Patofyziologickým podkladem je porucha utilizace volných mastných kyselin na mitochondriální úrovni, což vede k selhání buněčného energetického metabolismu [18, 19]. Dochází také k blokádě beta-adrenoreceptorů a kalciových kanálů v myokardu, což vede k poměrně náhle vzniklé refrakterní bradykardii s tendencí k progresi do asystolie [18, 19]. Současně bývá přítomen alespoň jeden z následujících příznaků: 1. rhabdomyolýza s myoglobinurií, která sekundárně vede k akutnímu renálnímu selhání s hyperkalémií, 2. hepatomegalie nebo jaterní steatóza s elevací jaterních enzymů, 3. hyperlipidemie, resp. hypertriglyceridemie, a 4. těžká metabolická, resp. laktátová acidóza [18, 19]. Časnou známkou rozvoje PRIS bývá jinak nevysvětlitelná laktátová acidóza, elevace kreatinkinázy, myoglobinu a hypertriglyceridemie. Zejména rozvoj etiologicky nejasné laktátové acidózy časně po začátku infuze propofolu může predikovat rozvoj PRIS.
Rozvoj PRIS hrozí v případě podávání propofolu v kontinuální infuzi déle než 48 hodin v dávce vyšší než 4 mg/kg/h [18, 19]. Mezi rizikové faktory vzniku PRIS patří současná léčba kortikoidya/nebo katecholaminy a sepse, eventuálně septický šok [18, 19].
Terapie PRIS: Při podezření na rozvoj PRIS je nutné okamžitě zastavit infuzi propofolu. Nezbytná je rovněž symptomatická terapie: dočasná kardiostimulace, inotropní a vazopresorická podpora oběhu, hemodialýza atd. I přes adekvátní terapii je mortalita PRIS nepřijatelně vysoká.
Prevence PRIS: U rizikových pacientů zvážit použití jiného celkového anestetika (midazolam, thiopental). V případě rozhodnutí o použití propofolu pak nepřekračovat dávku 4 mg/kg/h, zejména když je potřeba jeho více než 48hodinová aplikace.
SUPER-REFRAKTERNÍ GCSE (> 24 HODIN)
GCSE, který – i přes 24–48 hodin trvající adekvátní CA – recidivuje při vysazování celkového anestetika, bývá častěji spojen s nepříznivou prognózou. V těchto případech má být pacient „vrácen“ zpět do burst-suppression vzorce na dobu dalších 24–48 hodin [2]. V této situaci je odůvodněným postupem použít k další celkové anestezii jiné anestetikum – např. thiopental či propofol v případě neúspěchu midazolamu (obě tato anestetika lze také s midazolamem kombinovat). Současně je možné zvážit jednu či více z následujících možností:
- Intravenózní celkové anestetikum ketamin v dávkování 1–5 mg/kg/h [20, 21] (obvyklou úvodní dávkou je bolus 1–2 mg/kg). Ketamin lze kombinovat se všemi třemi uvedenými i.v. celkovými anestetiky.
- Vysoké dávky magnesium sulfuricum i.v. – případně až do cílových hladin Mg 3,5 mmol/l [20, 21].
- Vysoké dávky pyridoxinu i.v. (30 mg/kg a následně až 300 mg/den) v případech, kdy nelze vyloučit pyridoxin dependentní epilepsii [20, 21].
- Pulsní dávky methylprednisolonu + - IVIG+ - plazmaferéza, pokud nelze vyloučit autoimunní etiologii GCSE [20, 21]. Např. při podezření na NMDA-receptor encefalitidu. Při průkazu této encefalitidy lze – v případě neúspěchu uvedené imunoterapie – zvažovat použití cyklofosfamidu či rituximabu [22].
- Intravenózní lokální anestetikum lidokain (2 mg/kg a následně 2 mg/kg/h) [21].
- Inhalační anestetika – isofluran nebo desfluran (ne sevofluran) [20]. Přestože při dosažení adekvátních hladin inhalačního anestetika jde o efektivní řešení, při vysazování bývá tendence k rekurenci GCSE.
- Terapeutická hypotermie 32–35 °C [20, 21]. Racionální je chlazení na cílovou centrální teplotu 34–35 °C (při teplotách < 34 °C riziko závažných nežádoucích účinků).
- Ketogenní dieta (při ketogenní dietě je kontraindikováno použití propofolu) [20, 21].
- Epileptochirurgická resekce jednoznačně prokázaného epileptogenního fokusu v operabilní oblasti mozku [20].
- Implantace vagového stimulátoru – v případech, kdy nelze jednoznačně prokázat epileptogenní fokus [20].
- Různé formy stimulační terapie (transkraniální magnetická stimulace, hluboká mozková stimulace, elektrokonvulzivní terapie) a drenáže likvoru [20] je nutno považovat za experimentální.
- Existují ojedinělé reference o úspěšné terapii superrefrakterního SE neurosteroidem allopregnanolonem [23] a úspěšné terapii FIRES antagonistou receptoru pro interleukin 1 – farmakem anakinra [24].
DIAGNOSTIKA PŘÍČINY GCSE
- Laboratorní vyšetření provádíme v prvních pěti minutách od vzniku křečí, případně nejpozději hned po jejich ukončení.
- V rámci vyšetřování příčiny GCSE po stabilizaci stavu pacienta zvažujeme provedení CT či přímo MR mozku. Zobrazení mozku je indikováno vždy v případě, kdy u pacienta zobrazovací vyšetření zatím nebylo provedeno, a jestliže po terminaci křečí nedochází k přepokládané obnově vědomí pacienta. U každého pacienta, který prodělal GCSE, má být výhledově provedena MR mozku, přestože ve fázi akutní může být CT vyšetření mozku dostačující.
- Při podezření na meningoencefalitidu má být provedena lumbální punkce k vyšetření likvoru (vždy po předchozím zobrazení mozku, které vyloučí nitrolební hypertenzi). Zobrazení mozku a lumbální punkce – jsou-li indikovány – mají být provedeny, jakmile dojde ke kontrole křečí konvenčními antiepileptiky. V případě refrakterního GCSE pak v prvních hodinách celkové anestezie.
- EEG má v časných fázích křečí význam pro odlišení psychogenních neepileptických záchvatů (při podezření na ně). Ve fázi refrakterního a superrefrakterního GCSE je úloha EEG při monitoraci hloubky celkové anestezie nenahraditelná. U pacienta ve fázi zotavování lze pouze prostřednictvím EEG odlišit pokračující elektrografickou záchvatovou aktivitu jako příčinu trvající poruchy vědomí.
Image 1. Algoritmus léčby generalizovaného konvulzivního status epilepticus v dětském věku 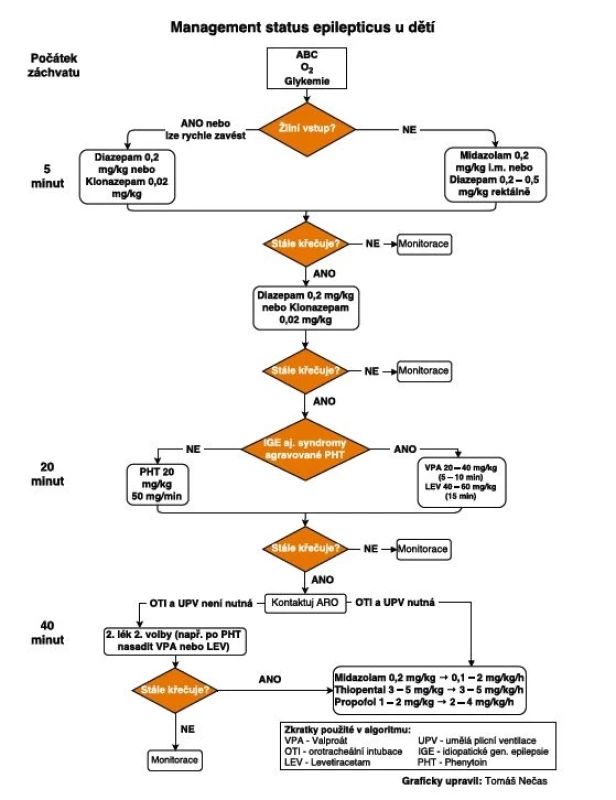
SYSTÉMOVÉ KOMPLIKACE
Často se objevují zejména u protrahovaných GCSE a významně přispívají ke zvýšení morbidity a mortality. Patří sem:
- Hypoxemie: Bývá následkem zhoršené ventilace, zvýšené spotřeby kyslíku nebo aspirace. Hypoxemie vede k poruše utilizace glukózy, deplecí ATP v mozku a rozvoji laktátové acidózy. Těžká deplece ATB způsobuje závažné neuronální poškození, až smrt [1].
- Acidemie: Její příčinou je metabolická, resp. laktátová acidóza a respirační acidóza (retence CO2 vznikající na podkladě hypoventilace) vede k poruše kontraktility myokardu, snížení kardiálního výdeje a hypotenzi, která dále prohlubuje tkáňovou (tzn. i mozkovou) hypoxii [1].
- Změny glykemie: V počátku GCSE dochází následkem masivního uvolňování katecholaminů k elevaci glykémie. Protrahované záchvaty ale naopak vedou k hypoglykemii vlivem zvýšených nároků na metabolismus a vyčerpání rezerv glukózy [1].
- Změny tlaku krve: V počátku GCSE dochází vlivem masivního uvolňování katecholaminů k nárůstu tlaku krve, tepové frekvence a centrálního žilního tlaku, což vede k silnému zvýšení cerebrální perfuze, a tím i k výraznému vzestupu nitrolebního tlaku. Při perzistujícím GCSE dochází naopak k poklesu TK i cerebrální perfuze, která se stává nedostačující k pokrytí zvýšených metabolických nároků [1].
- Zvýšený nitrolební tlak: V průběhu GCSE dochází k nitrolební hypertenzi na podkladě hypoxemie, laktátové acidózy a retence CO2 s kompenzační vazodilatací a zvýšenou cerebrální perfuzí. Nitrolební hypertenze zhoršuje zásobování mozkové tkáně glukózou a kyslíkem a vede k rozvoji mozkového edému, což nitrolební tlak dále zvyšuje [1].
- Rhabdomyolýza: Opakované kontrakce svalů v průběhu GCSE vedou k elevaci svalových enzymů (kreatinkináza, myoglobin) až rhabdomyolýze, kterou provází hypertermie potencující pokračování GCSE. Myoglobinurie (zejména v kombinaci s hypotenzí) může vést k akutnímu renálnímu selhání s hyperkalemií [1]. Závažná hyperkalemie je spojena s rizikem srdeční zástavy.
PROGNÓZA
GCSE je onemocnění s možným fatálním zakončením či rizikem ireverzibilních neurologických defektů a rekurence záchvatů. Výsledný stav po proběhlém GCSE závisí na jeho etiologii, trvání, a věku dítěte v době manifestace GCSE [25].
Příčinou mortality může být inzult vedoucí k rozvoji GCSE (např. akutní mozkový infarkt) nebo respirační, kardiovaskulární či metabolická komplikace GCSE [26]. Hlavním prediktorem mortality je etiologie GCSE (nejhorší je postanoxická encefalopatie).
Mezi neurologické následky GCSE patří fokální motorický deficit, mentální retardace, poruchy chování a chronická epilepsie [1]. Neurologické následky bývají obvykle způsobeny vlastní příčinou GCSE, nicméně při opakovaných prolongovaných záchvatech může docházet např. k prohlubování fokálního i kognitivního neurologického deficitu.
SPECIFIKA ZÁCHVATŮ V NOVOROZENECKÉM VĚKU
Novorozenecké období je nejkritičtější pro rozvoj epileptických záchvatů. Ke zvýšené záchvatové pohotovosti v tomto věku predisponuje nedokončená maturace mozku. Z tohoto pohledu jsou nejrizikovější skupinou nedonošení novorozenci. Ve většině případů se jedná o symptomatické záchvaty, a je proto prioritou stanovit a léčit jejich příčinu (např. abnormitu vnitřního prostředí) [27]. Jestliže záchvaty nereagují na léčbu příčiny, případně příčinu nelze ovlivnit či je neznámá, rozhodujeme se pro farmakoterapii. Nejčastější příčinou novorozeneckých záchvatů je hypoxicko-ischemická encefalopatie [27].
Lékem první volby je v novorozeneckém věku fenobarbital v dávce 20–30 mg/kg i.v. (rychlostí5 mg/kg/min) [27]. Mezi léky druhé volby patří fenytoin, levetiracetam, lidokain a midazolam [27]. Lze použít i klonazepam [27]. Výběr léku druhé volby záleží na kardiorespirační stabilitě novorozence a eventuálně přítomnosti renální či hepatální dysfunkce. V případě, že záchvaty jsou refrakterní ke konvenčním antiepileptikům, má být podán pyridoxin (100 mg i.v. nebo 15–30 mg/kg/den orálně) a pyridoxal-5-fosfát (60 mg/kg/den orálně) [27]. Jestliže ani po aplikaci pyridoxinu a pyridoxal-5-fosfátu nedochází ke kontrole záchvatů, může být podán leukovorin (kyselina folinová) v dávce 2,5 mg i.v. [28]. V efektivní léčbě se má pokračovat do kontroly (klinických a elektrografických) záchvatů [27].
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
AŠ 40 %, AP 30 %, ČK 10 %, ŠK 10 %, OH 10 %
Poděkování:
Tento projekt byl podpořen Lékařskou fakultou Masarykovy Univerzity [číslo grantu ROZV/25/LF/2017].
Do redakce došlo dne 12. 2. 2018.
Do tisku přijato dne 22. 4. 2018.
Adresa pro korespondenci:
doc. MUDr. Hana Ošlejšková, Ph.D.
Sources
1. http://www.uptodate.com/contents/clinical-features-and-complications-of-status-epilepticus-in-children
2. https://www.uptodate.com/contents/management-of-convulsive-status-epilepticus-in-children
3. Glauser T, Shinnar S, Gloss D, et al. Evidence-Based Guideline: Treatment of Convulsive Status Epilepticus in Children and Adults: Report of the Guideline Committee of the American Epilepsy Society. Epilepsy Currents. 2016;16 : 48. doi: 10.5698/1535-7597-16.1.48.
4. Trinka E, Cock H, Hesdorffer D, et al. A definition and classification of status epilepticus – Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015;56 : 1515–1523.
5. Singh RK, Stephens S, Berl MM, et al. Prospective study of new-onset seizures presenting as status epilepticus in childhood. Neurology. 2010;74 : 636.
6. https://emedicine.medscape.com/article/1164462-overview#a2
7. Beghi E, Carpio A, Forsgren L, et al. Recommendation for a definition of acute symptomatic seizure. Epilepsia. 2010;51 : 671 – 675. doi: 10.1111/ j.1528 - 1167.2009. 02285.
8. Meldrum BS. Pathophysiology. In: A Textbook of Epilepsy. Eds.: Laidlaw J, Richens A, Oxley J. Churchill Livingstone. 1988;203–235.
9. Gaspard N, Foreman BP, Alvarez V, et al. Critical Care EEG Monitoring Research Consortium (CCEMRC). New-onset refractory status epilepticus: Etiology, clinical features, and outcome. Neurology. 2015;85 : 1604–1613. doi: 10.1212/WNL.0000000000001940.
10. Khawaja AM, DeWolfe JL, Miller DW, et al. New-onset refractory status epilepticus (NORSE)--The potential role for immunotherapy. Epilepsy Behav. 2015;47 : 17.
11. Howell KB, Katanyuwong K, Mackay MT, et al. Long-term follow-up of febrile infection-related epilepsy syndrome. Epilepsia. 2012;53 : 101.
12. Fox K, Wells ME, Tennison M, et al. Febrile Infection-Related Epilepsy Syndrome (FIRES): A Literature Review and Case Study. Neurodiagn J. 2017;57 : 224–233. doi: 10.1080/21646821.2017.1355181.
13. Glauser T, Shinnar S, Gloss D, et al. Evidence-Based Guideline: Treatment of Convulsive Status Epilepticus in Children and Adults: Report of the Guideline Committee of the American Epilepsy Society. Epilepsy Curr. 2016;16 : 48–61. doi: 10.5698/1535-7597-16.1.48. PMCID: PMC4749120.
14. www.epistop.cz
15. https://www.uptodate.com/contents/juvenile-myoclonic-epilepsy
16. Poddar K, Sharma R, Ng YT. Intravenous Lacosamide in Pediatric Status Epilepticus: An Open-Label Efficacy and Safety Study. Pediatr Neurol. 2016;61 : 83–86. doi: 10.1016/j.pediatrneurol.2016.03.021.
17. James L, Linda H, Paul K, et al. Guideline for the management of convulsive status epilepticus in infants and children. BC MEDICAL JOURNAL. 2011;53–56.
18. https://lifeinthefastlane.com/ccc/propofol-infusion-syndrome/
19. Nee-Hooi W, Priya N. Propofol infusion syndrome. Continuing Education in Anaesthesia, Critical Care & Pain. 2013;13 : 6.
20. Shorvon S, Ferlisi M. The treatment of super-refractory status epilepticus: a critical review of available therapies and a clinical treatment protocol. Brain. 2011;134 : 10.
21. Aroor S, Shravan K, Mundkur S, et al. Super-refractory status epilepticus: A Therapeutic Challenge in Paediatrics. Journal of Clinical and Diagnostic Research. 2017;11:SR01–SR04.
22. https://www.uptodate.com/contents/paraneoplastic-and-autoimmune-encephalitis#H2973236366
23. Broomall E, Natale JE, Grimason M, et al. Pediatric Super-Refractory Status Epilepticus Treated With Allopregnanolone. Ann Neurol. 2014;76 : 911–915.
24. Kenney-Jung DL, Vezzani A, Kahoud RJ, et al. Febrile infection-related epilepsy syndrome treated with anakinra. Ann Neurol. 2016;80 : 939–945.
25. Raspall-Chaure M, Chin RF, Neville BG, et al. The epidemiology of convulsive status epilepticus in children: a critical review. Epilepsia. 2007;48 : 1652.
26. Lambrechtsen FA, Buchhalter JR. Aborted and refractory status epilepticus in children: a comparative analysis. Epilepsia. 2008;49 : 615.
27. https://www.uptodate.com/contents/treatment-of-neonatal-seizures
28. Nicolai J, van Kranen-Mastenbroek VH, Wevers RA, et al. Folinic acid-responsive seizures initially responsive to pyridoxine. Pediatr Neurol. 2006;34 : 164.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine Neurology Paediatrics General practitioner for children and adolescents
Article was published inAnaesthesiology and Intensive Care Medicine

2018 Issue 3-
All articles in this issue
- Zlepšení kognitivních funkcí po oboustranné karotické endarterektomii. Jsou nízké hodnoty rSO2 zjištěné NIRS indikací ke kyslíkové léčbě?
- Regionální anestezie k operacím ramene – současné trendy
- Selhání analýzy rytmu automatizovaným externím defibrilátorem u mimonemocniční náhlé zástavy oběhu
- Generalizovaný konvulzivní status epilepticus v dětském věku
- Anesteziologická problematika u dětí s Williamsovým syndromem
- Současné postavení kortikoidů v regionální anestezii a analgezii
- Urgentní infraglotické zajištění dýchacích cest – koniopunkce, koniostomie, BACT
- „Slavné osmičky“ v historii anesteziologie
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urgentní infraglotické zajištění dýchacích cest – koniopunkce, koniostomie, BACT
- Generalizovaný konvulzivní status epilepticus v dětském věku
- Regionální anestezie k operacím ramene – současné trendy
- Současné postavení kortikoidů v regionální anestezii a analgezii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

