-
Medical journals
- Career
Regionální anestezie a léky ovlivňující hemokoagulaci – co přináší nejnovější doporučení?
: M. Jelínek
: Anesteziologicko-resuscitační klinika Fakultní nemocnice u svaté Anny v Brně
: Anest. intenziv. Med., 27, 2016, č. 6, s. 367-374
:
Provádění regionální anestezie u pacientů na antikoagulační nebo antiagregační terapii s sebou nese zvýšené riziko krvácivých komplikací. Nejzávažnější komplikaci představuje vznik intraspinálního epidurálního hematomu při neuroaxiální punkci. Řada světových a národních odborných anesteziologických společností vydala doporučení, jak vést management antitrombotické léčby ve vztahu k regionální anestezii. Cílem tohoto textu je porovnat jednotlivá aktuální doporučení.
Klíčová slova:
regionální anestezie – neuroaxiální anestezie – spinální anestezie – epidurální anestezie – antikoagulace – antiagregace – doporučení – intraspinální hematom
Incidence intraspinálních, zpravidla epidurálních hematomů není častá, přesto je oprávněně obávanou komplikací neuroaxiálních blokád, protože vzniklý neurologický deficit je většinou trvalý, s malou šancí na reparaci.
Po subarachnoidální (spinální) a epidurální punkci dochází ke krvácení nejčastěji traumatizací bohatých tenkostěnných žilních plexů v epidurálním prostoru, ale mohou být poraněny i drobné cévy subarachnoideálně. Mechanismus poškození nicméně zůstává stejný – rostoucí hematom způsobuje v uzavřeném prostoru páteřního kanálu útlak míchy, caudy equiny nebo míšního kořene, vedoucí k ischemizaci nervové tkáně se vznikem infarktu.
Kontinuální katétrové techniky – ať už epidurální nebo subarachnoidální – jsou považovány za rizikovější než jejich jednorázové obdoby. Jakákoli manipulace/extrakce katétru podléhá stejným pravidlům jako samotná punkce.
Přesná incidence intraspinálních hematomů není známa. Tradičně byla uváděna jako 1/150 000 epidurálních anestezií a 1/220 000 spinálních anestezií, tento odhad vycházející z dat do roku 1993 zřejmě podhodnocuje současný stav, protože od té doby došlo k zavedení prakticky paušální perioperační tromboprofylaxe [1]. Z retrospektivní analýzy dat z let 1990–1999 ze Švédska připadlo 25 interspinálních hematomů na přibližně 450 000 epidurálních anestezií (1/18 000) a 8 na 1 260 000 spinálních anestezií (1/158 000). Zároveň jsou vidět pacientské a proceduální rozdíly, nízké riziko připadalo na porodnické epidurální analgezie 1/200 000, zatímco incidence u pacientek s operací totální endoprotézy kolene byla vysoká 1/3600 [2].
Rizikové faktory pro vznik intraspinálního hematomu jsou kromě poruchy krevního srážení (vrozené, získané nebo indukované léky), také krvavá traumatická punkce a anatomické abnormality páteře, zejména spinální stenóza. Tato je spojená s vyšším věkem a ženským pohlavím a představuje riziko nejen pro vznik hematomu, ale zejména pro jeho klinickou prezentaci a vážnost neurologických následků, tj. při stejném objemu hematomu je neurologický deficit těžší již při primárně zmenšeném objemu spinálního kanálu. Různé formy spinální stenózy se vyskytují až u 19 % pacientů nad 60 let, často nediagnostikované [3].
Jak ze švédské analýzy, tak ze starších dat vyplývá jako jeden z nejdůležitějších rizikových faktorů porucha krevního srážení nebo podání protisrážlivé medikace v periproceduálním období. Ze vzniklých hematomů bylo takto asociováno 33 %, respektive 87 % [3, 4].
Nejčastějšími příznaky rozvoje intraspinálního hematomu je senzitivní nebo motorický deficit, dysfunkce močového měchýře, střevní dysfunkce. Na rozdíl od útlaku způsobeného herniací disku nejsou radikulární bolesti typické. Bolesti zad jsou zcela nespecifické a vyskytují se stejně často po neuroaxiálních blokádách jako po celkové anestezii a jsou dány spíše vynucenou polohou v perioperačním období. Problémem je hodnocení senzitivního a motorického deficitu při použití kontinuálních katétrových technik, což by mělo vést k použití co nejnižších koncentrací lokálních anestetik a v případě nepřiměřeného deficitu a pochybností k dočasnému přerušení regionální analgezie, aby šlo pacienta neurologicky monitorovat.
AKTUÁLNÍ DOPORUČENÍ
Podávání antikoagulační a antitrombotické terapie je významným rizikovým faktorem pro vznik intraspinálního hematomu, proto se zaměřila na management těchto léků v perioperačním období řada doporučení odborných společností. V současné době je asi nejcitovanější a nejkonzervativnější 3. edice doporučení Americké společnosti regionální anestezie a léčby bolesti (ASRA) z roku 2010 [5]. Na americká guidelines zareagovala novelizací svých doporučení i ESA v roce 2010 [6] a řada národních odborných společností – Skandinávie 2010 [7], Velká Británie 2013 [8]. Nyní se očekává vydání 4. edice amerických doporučení, ale ASRA na svých internetových stránkách zatím pouze uveřejnila krátký návrh doporučení ohledně nových léků. V roce 2015 bylo vydáno doporučení zahrnující intervenční výkony na páteři a v algeziologii pod hlavičkou ASRA, ESRA, světových, amerických a evropských algeziologických a neuromodulačních společností [9]. Tyto guidelines se primárně netýkají jen neuroaxiálních a periferních blokád v algeziologické praxi, ale výkonů výrazně invazivnějších, část postupů je ale aplikovatelná i na periooperační období. Samozřejmě řada výkonů v léčbě bolesti je výrazně rizikovějších, pro ty pak platí restrikce přísnější.
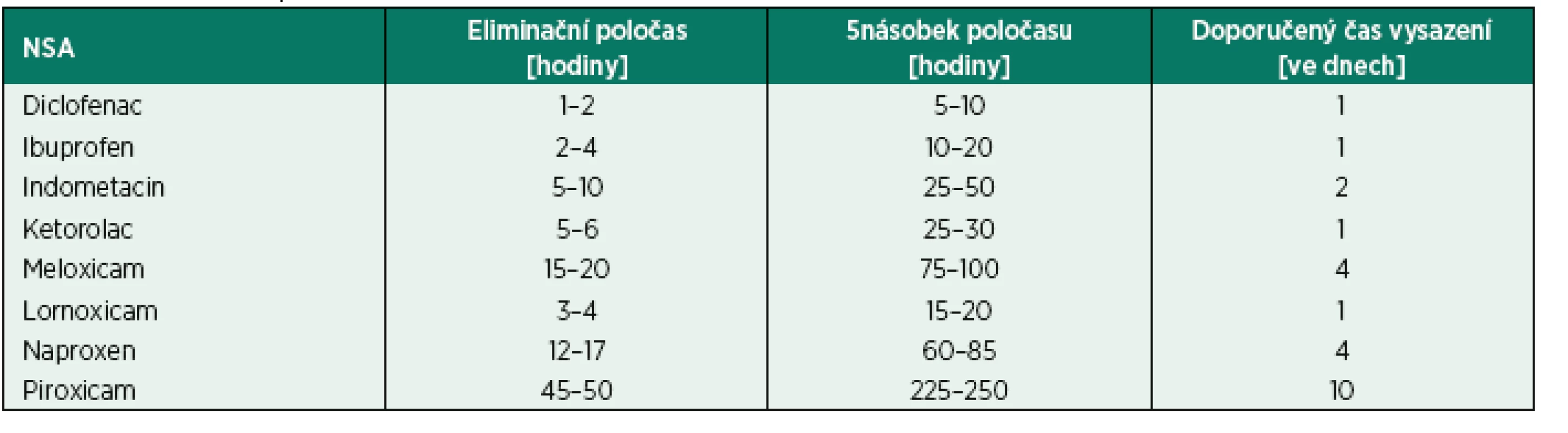
Vzhledem k nízké incidenci intraspinálních hematomů je hodnota důkazů, ze kterých daná doporučení vycházejí, nízká. Většinou se jedná o expert opinion, kalkulující s farmakokinetikou a farmakodynamikou protisrážlivé medikace, výjimečně pak observační studie. Často se vychází z dat z katetrizací v kardiologii a neurologii. V zásadě platí, že pro výkony vysoce rizikové by od posledního podání protisrážlivé medikace do punce měl uplynout 5násobek eliminačního poločasu, pro výkony s nízkým rizkem krvácení 2násobek. Koagulum se považuje za stabilní po 10 hodinách, pro podání antikoagulace po punkci tedy platí – 10 hodin minus čas do nástupu účinku.
PERIFERNÍ BLOKÁDY
Ačkoli jsou periferní blokády a blokády nervových pletení také zatíženy rizikem krvácivých komplikací, je toto riziko výrazně nižší než u neuroaxiálních technik. Krvácení pak ohrožuje pacienta vzniklou krevní ztrátou, popř. hematomem utlačujícím nervové struktury (a nejen je) nebo vznikem intraneurálního hematomu, při traumatizaci subepineurálních cév. Přísné doporučení ASRA 2010 říká, že pro provedení hlubokých periferních blokád se mají dodržovat stejná pravidla jako pro neuroaxiální blokády. Ještě ke všemu ve zkrácené verzi doporučení vypadlo slovíčko „deep“, a tak bylo mylně interpretováno jako stejná pravidla pro centrální i periferní blokády. Doporučení vychází z několika případů někdy i smrtelných krvácení při psoas kompartment bloku, což je ale svou povahou hluboká paravertebrální blokáda a je z „periferních“ blokád jednoznačně nejrizikovější a několika hematomů při transarteriální axilární blokádě. Případy intraneurálních hematomů nejsou známy z klinické praxe, existují pouze kazuistiky spontánních intraneurálních hematomů u pacientů na antikoagulační léčbě (zpravidla předávkované) a u pacientů s traumatem a možný vznik těchto hematomů je dokumentován na zvířecím modelu při intraneurální aplikaci [10, 11]. Rozvoj ultrazvukové navigace při provádění periferních blokád během posledních 15 let dále zvyšuje bezpečnost a snižuje nechtěnou punkci větších cév [12]. Naštěstí tedy jak britská, tak algeziologická doporučení upravují guidelines ASRA a doporučují stratifikaci regionálně anesteziologický metod podle rizika vzniku krvácivých komplikací (tab. 1).
1. Riziko krvácení podle typu blokády 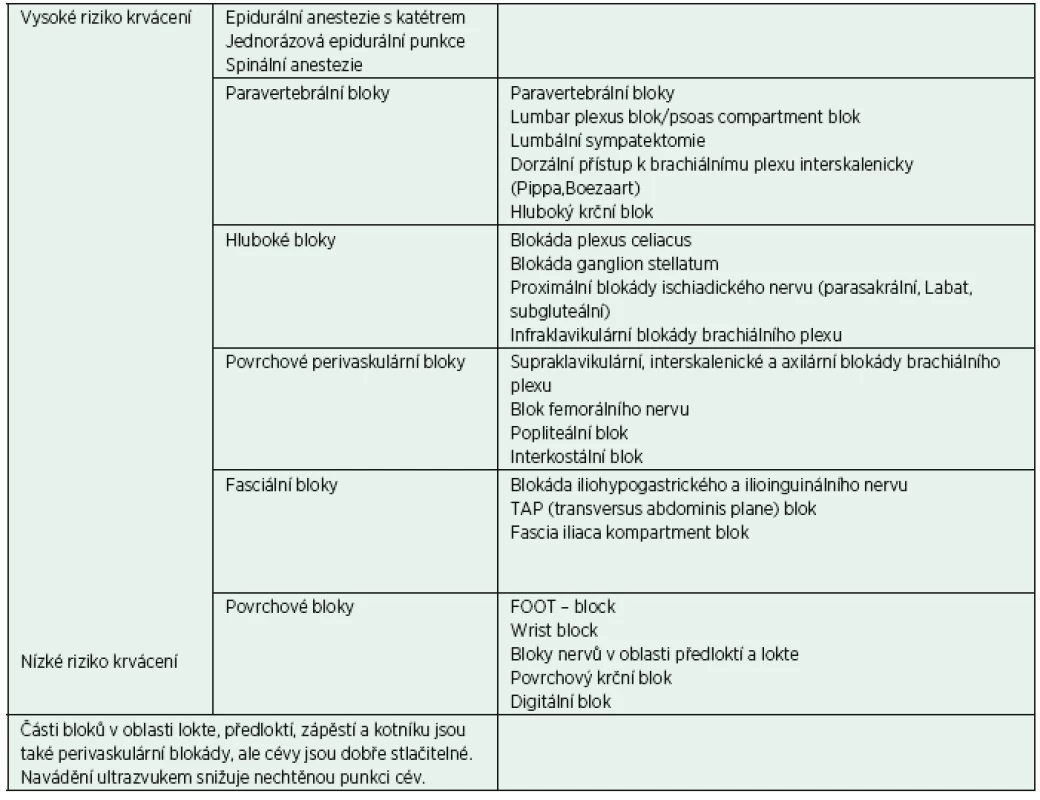
Načasování vysazení a znovu nasazení antikoagulace v periooperčním období je záležitostí celého týmu lékařů – praktiků, internistů, chirurgů, anesteziologů. Vysazení antikoagulace s sebou kromě snížení rizika krvácení nese zvýšené riziko trombembolie. Antikoagulace by měla být vysazena jen na nezbytně dlouhou dobu a součástí anesteziologického plánu pro daného pacienta by mělo být i přizpůsobení anesteziologické techniky i nutnosti nasazení antikoagulace pooperačně.
ANTIKOAGULANCIA
Antagonisté vitaminu K – warfarin
Antikoagulační účinek warfarinu je nepřímý, blokádou syntézy koagulačních faktorů závislých na vitaminu K v játrech – faktory II (trombin), VII, IX, X a proteinu C a S. Riziko krvácení je zvýšené, pokud se hodnota některého z těchto faktorů blíží 20–40 % jejich normálních hodnot. Biologický poločas těchto faktorů a tím nástup účinné antikoagulace se liší u jednotlivch faktorů. Nejkratší biologický poločas má faktor VII 6–8 hodin, nejdelší trombin 50–80 hodin. K monitorování účinnosti se z laboratorních testů používá PT (protrombinový čas, Quickův test), respektive INR (mezinárodní normalizovaný poměr), které jsou primárně citlivější k poklesu faktoru VII a hodí se k dlouhodobému hodnocení antikoagulace. Existuje hypotetické riziko normalizace INR při normalizaci hladin faktoru VII, zatímco ostatní faktory nemusí ještě dosahovat hladin nad 40 %.
Standardně se doporučuje vysazení warfarinu 5 dnů před výkonem, den před výkonem kontrola INR. Delší čas potřebný k normalizaci lze očekávat u pacientů primárně předávkovaných (INR nad 3,0), s jaterní dysfunkcí, starších pacientů a s diluční koagulopatií při krvácení. U pacientů na účinné antikoagulaci warfarinem jsou neuroaxiální techniky kontraindikovány. ASRA trvá na normalizaci INR (0,8–1,2), Evropa INR ≤ 1,4. Zcela nejliberálnější je skandinávské doporučení, které dovoluje provedení spinální anestezie při INR < 2,2 a epidurální při INR < 1,8, pokud existují mortalitní data podporující provedení těchto technik u daných výkonů a nekriticky neuroaxiální techniky favorizují. Nasazení warfarinu pooperačně doporučuje Evropa až po extrakci epidurálního katétru, zatímco v USA je běžná praxe nasazení warfarinu v den operace až 48 hodin před extrakcí katétru, výjimečně i 24 hodin předoperačně, nicméně je nutné monitorování INR, katétr by měl být extrahován při INR ≤ 1,5. Nízce rizikové výkony regionální anestezie lze provádět během účinné warfarinizace INR 2,0–3,0.
V případě nutnosti lze účinek warfarinu antagonizovat podáním vitaminu K, efekt lze očekávat v řádu 24 hodin, pokud je potřeba akutní antagonizace, je doporučeno podání PCC (koncentrátu protrombinového komplexu), to samozřejmě není standardní doporučení k umožnění RA, ale v případě vážného krvácení, třeba vzniku intraspinálního hematomu.
V ČR se z kumarinových derivátů používá téměř výhradně warfarin. V Evropě je také acenocoumarol, s kratším poločasem, u kterého stačí vysazení 3 dny před výkonem.
Nefrakciovaný heparin
Nefrakciovaný heparin inaktivuje faktory IIa, IXa a Xa působením své pentasacharidové molekuly na antitrombin. Podává se kontinuální i. v. infuzí, bolusově nebo subkutánně. V profylaxi DVT se podávají dávky 10–15 000 j/d, při terapeutické antikoagulaci se léčba cílí podle účinku monitorovaného pomocí aPPT, se snahou o 1,5 - až 2,5násobek. Při podávání heparinu déle než 4–5 dní je nutné zkontrolovat množství trombocytů k vyloučení HIT. Zásadní rozdíly v doporučeních nejsou. Pro provedení neuroaxiálních technik při intravenózním podání je nutné vyčkat: 2–4 hod. ASRA, 4–6 hod. Evropa, zkontrolovat aPPT < 40. Při profylaktickém subkutánním podání 5 000 j 2 x/d není omezení v provedení RA (vhodné vyčkat 4–6 hod. od posledního podání, algeziologické doporučení 8–10 hod.). Pro dávkování 5 000 j 3xd subkutánně neexistují data. Peroperační podání 5–10 000 j heparinu, časté v cévní chirurgii, by nemělo následovat dříve než 1 hodinu po punkci. Pokud je tato punkce traumatická/krvavá, neexistují data podporující automatické odložení výkonu o 24 hod., ale při neurgentním výkonu lze toto akceptovat. Algeziologické doporučení radí vyčkat 24 hod. s opětovným nasazením heparinu, pokud byla punkce krvavá. Výhodou heparinu je možnost rychlého zrušení účinku pomocí protaminu.
Nízkomolekulární hepariny (LMWH)
Antikoagulační efekt LMWH je zprostředkován inhibicí faktoru Xa a IIa. Jedná se o poměrně homogenní skupinu léků lišící se částečně farmakokinetikou. Většina studií byla prováděna a data platí pro enoxaparin, ale standardně se aplikuje na všechny léky ze skupiny. Je nutné porovnat zejména jejich eliminační poločas, který je u LMWH v rozmezí 3–6 hodin po subkutánním podání. Monitorování pomocí hodnocení anti-Xa se standardně neprovádí, pouze u pacientů s renální insuficiencí, u nichž se výrazně prodlužuje eliminační poločas (až na 16 hodin). Terapeutické dávkování je 1 mg/kg 2krát denně. Vzhledem k rozdílům v doporučeném profylaktickém podávání LMWH mezi Evropou (40 mg s. c. 1 x d) a USA (30 mg 2 x d) a vzhledem k tomu, že v úvodu této praxe došlo v USA k poměrné četnému výskytu intraspinálních hematomů (více než 60 případů), je vidět konzervativní přístup ASRA. V předoperačním podávání se doporučení neliší, při běžném profylaktickém podávání LMWH je doporučený minimální interval od podání 12 hodin, pokud se podávají dávky vyšší a terapeutické a pro dalteparin (i v profylaktickém podávání), je doporučený interval 24 hodin. Rozdíly jsou dávkování LMWH po neuroaxiální punkci. Evropa doporučuje minimální interval 4 hodiny, ať už se jedná o profylaktické nebo terapeutické dávkování. Pro vytažení nebo manipulaci s katétrem platí stejná pravidla jako pro punkci a při profylaktickém režimu dávkování 2krát denně doporučují vynechat jednu dávku. Pro terapeutické dávkováni by to znamenalo vynechání LMWH více než na 28 hodin a je spíše na zvážení použití EPI analgezie. ASRA doporučuje nasazení LMWH při profylaxi v režimu 1 x d za 6–8 hod., v režimu 2 x d za 24 hod. po punkci, nedoporučují kontinuální neuroaxiální techniky při profylaxi LMWH 2 x d (nasazení LMWH v režimu 2krát denně je u operačních výkonů se středním a vysokým rizikem pooperačního krvácení v USA doporučeno po 24 hod. nezávisle na způsobu anestezie). Při traumatické/krvavé punkci doporučují nasazení jakékoli dávky LMWH po 24 hod. Algeziologická guidelines doporučují nasazení LMWH 4 hod. po nízkorizikových procedurách, ale 12–24 hodin po výkonech se středním rizikem (sem patří i epidurální punkce) a vysokorizikových procedurách.
NOAC/DOAC
Zkratky pro původně nová perorální antikoagulancia (Novel Oral AntiCoagulants) správněji pak non-vitamin K působící perorální antikoagulancia (Non-vitamin K antagonist Oral AntiCoagulants) nebo přímá perorální antikoagulancia (Direct Oral AntiCoagulants). Jedná se o skupinu léků, která v současné době nahrazují warfarin v některých jeho indikacích. Patří sem dabigatran a xabany (apixaban, rivoroxaban, edoxaban).
Dabigatran
Je přímý inhibitor trombinu, špičkové hladiny dosahuje za 0,5–2 hod. po p. o. podání, eliminační poločas je 12–17 hod., vzhledem k téměř 80% renální clearance se při renální insuficienci prodlužuje až na 28 hod. Je kontraindikován při CrCl pod 30 ml/min. Denní dávka je 150–300 mg. Je indikován při fibrilaci síní a jako prevence VTE po ortopedických výkonech v Evropě a Kanadě, nikoli však v USA (byl zaznamenán vyšší výskyt krvácivých komplikací). Běžně se terapeutická účinnost neměří, ale lze ji monitorovat pomocí dTT (dilutovaný trombinový čas) a ECT (ecarin clotting time), výrazné prodloužení aPPT je známkou předávkování, PT je velice citlivý i k minimální přítomnosti dabigatrinu v krvi. Problémem je, že nevíme, jaké hodnoty dTT a ECT jsou rizikové stran krvácení, a tak se trvá na jejich normalizaci. Původní doporučení z roku 2010 se k dabigatranu vyjadřují minimálně, byl teprve zaváděn do praxe jako profylaxe v pooperačním období. Britská doporučení upravují dobu vysazení před punkcí podle kreatinové clearance na 2–4 dny (CrCl > 80 ml/min – 2dny, CrCl 50–80 ml/min – 3dny, CrCl 30–50 ml/min – 4 dny). Návrh ASRA 2015 doporučuje vysazení 5 dní. Algeziologické doporučení je 4–5 dní, u renální insuficience dokonce 6 dní. Katétr in situ je kontraindikací podání dabigatranu. Neliší se doporučení pro podání po punkci 6 hod., pouze algeziologická doporučují 12–24 hod. Nově je dostupné antidotum idarucizumab, jinak byla antagonizace účinku svízelná.
Rivoroxaban
Inhibitor faktoru Xa dosahuje účinné hladiny za 2–4 hod. po p. o. podání, eliminační poločas je 5–9 hod., u starších pacientů může být až 11–13 hod. 33 % rivoroxabanu je vylučováno ledvinami, 33 % stolicí, 33 % se metabolizuje v játrech. Denní dávka je 10–20 mg/d. Indikací je fibrilace síní, prevence i léčba TEN. Standarní testy nejsou vhodné k monitorování účinku, možnost stanovení anti Xa aktivity specifické pro rivoroxaban. Antagonizace účinku – pouze nespecificky a s nejistým učinkem. Ve vývoji je antidotum Andexanet alfa, což je rekombinantní modifikovaný humální factor Xa. Při profylaktických dávkách do 10 mg/d ESA doporučuje vysazení 22–26 hod. před punkcí, v britských doporučeních je to 18 hod. Při terapeutických dávkách 20 mg/d ASRA 2015 i algeziologické doporučení radí vysazení 3 dny, britská 2 dny. Nasazení po punkci lze za 4–6 hod., pouze algeziologická 12–24 hod. Epidurální katér in situ je kontraindikací nasazení.
Apixaban
Je také inhibitor faktoru Xa a až na farmakokinetické údaje se významně neliší od ostatních xabanů. Účinné hladiny dosahuje za 1–2 hod. po p. o. podání, eliminační poločas je 8–14 hod., 27 % apixabanu je vylučováno ledvinami, velká část metabolismu je závislá na jaterních funkcích. Denní dávka je 5–20 mg/d. Při profylaktických dávkách do 5 mg/d ESA doporučuje vysazení 26–30 hod. před punkcí, britská doporučení 24–48 hod. Při terapeutických dávkách 10–20 mg/d ASRA 2015 vyžaduje 3 dny, algeziologické doporučení radí vysazení na 3–5 dnů. Nasazení po punkci 6 hod., pouze algeziologická opět 12–24 hod.
Fondaparinux
Syntetické antikoagulans selektivně inhibující faktor Xa, bývá používáno jako náhrada heparinu a LMWH u pacientů s HIT I. typu a anamnézou HIT. Dlouhý eliminační poločas 16–21 hod. umožňuje dávkování jednou denně. Má renální clearance. Profylaktická dávka je 2,5 mg, terapeutická až 10 mg, lze monitorovat anti Xa aktivitu. Vzhledem k malým klinickým zkušenostem s antikoagulací fondaparinuxem a RA a ne zcela reálným požadavkům na provedení punkce v klinických studiích (z prvního vpichu, atraumatická punkce) nedává ASRA jasné doporučení, rozhodně nedoporučuje použití fondaparinuxu u katétru in situ a po krvavé punkci. Evropa doporučuje vysazení 36–42 hod. před punkcí, možnost nasazení 6–12 hod. po punkci pouze při profylaktickém dávkování. Dávky 5–10 mg/d jsou kontraindikací neuroaxiální blokády. Algeziologické doporučení je vysadit 3–4 dny před punkcí, a nasazení po punkci za 24 hodin.
Inhibitory trombinu (Bivalirudin, Argatroban, Desirudin, Lepirudin)
Inhibitory volného i vázaného trombinu, jsou indikovány pacientům s nutností antikoagulace při HIT II. typu. Situace nutnosti neuroaxiální blokády je u těchto pacientů samozřejmě zřídkavá. Eliminační poločas je 25 minut pro Bivalirudin, 30–35 minut pro Argatroban a jsou podávány kont i. v. infuzí. Účinnost se hodnotí podle aPPT, snaha dosáhnout 2–3násobku. Desirudin, lepirudin jsou podávány s. c. v prevenci DVT/PE po endoprotetických výkonech v ortopedii. Většina doporučení se staví spíše zamítavě k provedení blokády pro nedostatek zkušeností. Britské a evropské doporučení radí vyčkat od posledního podání u hirudinů (bivalirudin, lepirudin, desirudin) 8–10 hod. a u Argatrobanu 4 hod. nebo do normalizace aPPT. Znovu možno nasadit 6 hodin po punkci, britská a evropská doporučení uvádějí dokonce 2–4 hod. Katétr in situ je kontraindikací podání.
Danaparoid
Danaparoid je heparinoid, ačkoli je chemicky příbuzný s heparinem, má jiná vazebná místa pro proteiny, a proto má malou zkříženou reaktivitu (10%) u pacientů s HIT, v jejichž léčbě se využívá. Skládá se ze směsi heparan sulfátu, dermatan sulfátu a chondroitin sulfátu. Působí antitrombinem mediovanou inhibici faktoru Xa. Je určen k prevenci DVT/PE po operačních výkonech. Přestože má dlouhý eliminační poločas 22–24 hod., podává se 2 x d. Vzhledem k malým zkušenostem a dlouhému poločasu je doporučeno se neuroaxiálním blokádám vyhnout.
PROTIDESTIČKOVÉ LÉKY
Kyselina acetylsalicylová (ASA) a nesteroidní antiflogistika (NSA)
Jak ASA, tak NSA blokují cyklooxygenázu, enzym odpovědný za syntézu prostaglandinů a tromboxanů. Protisrážlivý efekt je způsoben blokádou tromboxanu A2 v trombocytech. Blokáda cyklooxygenázy je v případě ASA ireverzibilní a protisrážlivý efekt je spojen s životností trombocytů. Naopak v případě NSA je blokáda reverzibilní a její trvání je vztaženo k eliminačnímu poločasu jednotlivých NSA. Ačkoliv tyto léky zvýšují riziko krvácení, toto zůstává stále nízké. Zatímco vysazení ASA, zejména pokud je používaná v sekundární prevenci, s sebou nese riziko trombózy, vysazení NSA riziko nepředstavuje. V doporučeních ASRA, ESA i britských není omezení při podávání těchto léků ve vztahu k neuroaxiální blokádě. Ve skandinávských doporučeních je doba podání před blokádou 12 hod., pokud pacienti užívají ASA v sekundární prevenci, a 3 dny, pokud v primární prevenci. NSA u plánovaných výkonů by měly být vysazeny po dobu odpovídající 5násobku eliminačního poločasu (tab. 2). Velice podobné stanovisko zastává algeziologické doporučení pro výkony s vysokým rizikem krvácení (což jsou ale rizikovější výkony oproti standardní neuroaxiální punkci).
Thienopyridiny (clopidogrel, ticlopidin, prasugrel)
Ireverzibilně blokují agregaci trombocytů, inhibují vazbu ADP na destičkový receptor P2Y12. Ticlopidin má dlouhý biologický poločas, takže trombocyty jsou nově ovlivněny až 3 dny po posledním podání léku. Ticlopidin i clopidogrel mají na rozdíl od prasugrelu pomalý nástup účinku. Jsou využívány v sekundární prevenci koronárního syndromu, ischemické CMP i periferní vaskulární choroby, často jako duální antiagregace dohromady s ASA. Oproti ASA je jejich účinek výraznější, stejně jako riziko perioperačního krvácení, stejně tak i riziko vzniku intraspinálního hematomu, takže terapie těmito léky musí být s předstihem ukončena: Ticlopdine 14 dní podle ASRA, 10 dní podle ESA, 5 dní podle skandinávských doporučení, Clopidogrel 7 dní shodně všechna doporučení, v případě vysokého rizika trombózy 5 dní, Prasugrel 7–10 shodně všechna doporučení. Jen některá doporučení se vyjadřují k možnosti znovunasazení léčby po punkci nebo po extrakci katétru (katétr in situ je kontraindikací těchto léků). Britská doporučení uvádějí časový interval 6 hod. pro všechny léky, ASRA 6 hod. pro prasugrel, algeziologická guidelines doporučují 12 hod. pro clopidogrel (75 mg) a 24 hod. pro prasugrel nebo sytící dávku clopidogrelu (300–600 mg).
Ticagrelor
Je také antagonista na P2Y12 receptoru trombocytů, ale na rozdíl od předchozích má vazebné místo jiné než ADP a funguje jako allosterický antagonista a jeho blokáda je reverzibilní. Má rychlý nástup účinku 2,5 hod. Velice účinná blokáda agregace přetrvává 48–72 hod. ESA, algeziologické a britské doporučení radí vysadit ticagrelor 5 dní před neuroaxiální punkcí, ASRA má ve svém návrhu 7 dní a doporučuje znovu nasadit 6 hod. po punkci.
Inhibitory fosfodiesterázy 3 (Dipyridamol, Cilostazol)
Zvyšují hladinu cyklického adenosine monofosfátu a tím působí slabou reverzibilní blokádu agregace trombocytů a vazodilataci. Eliminační poločas je u cilostazolu 21 hod. a je vázaný na jaterní i renální clearance. Samostatně podávaný dipyridamol není účinnější než ASA a je většinou součástí kombinovaných preparátů s ASA v prevenci ischemické CMP. Cilostazol je využíván v léčbě periferní vaskulární nemoci. Dipyridamol samotný není kontraindikací neuroaxiálních blokád (britská, skandinavská). Ačkoliv kombinace s ASA zvyšuje riziko krvácení, algeziologické guidelines doporučují postupovat stejně jako u ASA samotné. Pro cilostazol doporučuje ESA interval před punkcí 42 hod. (2násobek eliminačního poločasu). Jen pro doplnění pro vysoce rizikové výkony je algeziologické doporučeni pro dipyridamol i cilostazol 48 hodin.
Inhibitory glykoproteinu IIb/IIIa (eptifibatid, tirofiban, abciximab)
Velice potentní inhibitory agregace krevních destiček používané periproceduálně při intervencích na koronárních tepnách, blokáda glykoproteinu je reverzibilní. Abciximab zároveň tlumí generaci trombinu, jeho účinnek je prolongovaný a ireverzibilní, částečně patrný i za 10 dní. Naproti tomu u eptifibatidu a tirofibanu je po 4 hod. od ukončení infuze zpět 50–80 % agregační kapacity trombocytů. Vzhledem k indikaci těchto léků je nutnost RA zřídkavá. Možnost punkce (vytažení katétru) po ukončení infuze je pro eptifibatid a tirofiban 8 hod. podle doporučení ESA, britských a skandinávských, algeziologické doporučuje 8–24 hod. Pro abciximab 48 hod. uvádí ESA, britské a skandinávské, algeziologické 2–5 dní. Vzhledem k prakticky okamžitému nástupu protisrážlivého účinku by doba podání po punkci měla být 8–12 hod., jak radí algeziologické doporučení, skandinávské riskantně radí 2 hod. a britské 6 hodin.
Trombolytická léčba
Indikace trombolytické léčby je zpravidla neodkladná. Byly popsány spontánní spinální epidurální hematomy, stejně jako kazuistiky v souvislosti s podáním trombolýzy časně po punkci. Po podání trombolytické léčby lze punkci provést po 10 dnech podle ASRA a britských doporučení, stejně jako podání trombolýzy po punkci. Algeziologické guidline doporučuje nyní interval 48 hod., ale s monitorováním hladiny fibrinogenu. Stejně jako skandinávské, to však uvádí intervaly pro jednotlivá trombolytika. Pro streptokinázu 24 hod., alteplázu 6 hod. a možnost podat trombolytika 2 hod. po punkci, lépe samozřejmě 10 dnů, ale zvažují zpravidla život zachraňující indikaci trombolýzy.
Selektivní inhibitory zpětného vychytávání serotoninu (SSRI)
Tyto pandemicky užívaná antidepresiva snižují lehce funkci trombocytů. Některé studie ukazovaly na riziko větších krevních perioperačních ztrát, jiné studie toto nepotvrdily. Ačkoliv se jedná o široce užívané léky, zatím nebyl popsán intraspinální hematom v souvislosti se SSRI a neuroaxiální punkcí a nejsou doporučena žádná omezení, nicméně je nutné přičíst tuto medikaci k dalším protisrážlivým lékům při naší rozvaze. Algeziologické doporučení radí vysadit SSRI při vysoce rizikových výkonech 1–2 týdny, podle biologického poločasu (Fluoxetin 5 týdnů), zvláště pokud jsou užívány souběžně s ASA nebo NSA .
Přírodní přípravky – doplňky stravy
Přípravky obsahující česnek, ginko, ženšen, dong quai (angelika čínská) a danshen jsou spojeny s antiagregačními a antikoagulačními účinky, které ale nejsou příliš výrazné. Účinek česneku na trombocyty je ireverzibilní a přetrvává 7 dní, u ženšenu a ginka je účinek kratší – 24 hod., respektive 36 hod. Samotné tyto doplňky nejsou kontraindikací neuroaxiálních blokád.
Kombinace léků
Antikoagulační i antiagregační medikace s sebou ponese vždy riziko krvácení, které je v perioperačním období zvýšené. Zejména kombinace antikoagulační a antiagregační medikace toto riziko výrazně potencuje. Zatímco podávání samotné ASA a NSA nepředstavuje výrazné nebezpečí, jejich kombinace s antikoagulací, např. s LMWH, s sebou nese riziko podle ASRA nepřiměřeně vysoké. ASRA zásadně nedoporučuje provádět neuroaxiální blokády, pokud pacienti užívají více než jeden lék ovlivňující srážení krve. Ostatní doporučení v tomto tak striktní nejsou.
ZÁVĚR
Perioperační vysazení antikoagulační a antiagregační terapie s sebou vždy nese zvýšené riziko trombembolizačních příhod a musí být vždy naplánováno ve shodě s ošetřujícím lékařem – internistou, chirurgem a anesteziologem. Musíme vždy zvážit riziko krvácení a riziko trombózy tak, abychom v součtu tato rizika minimalizovali v zájmu pacienta. Neuroaxiální techniky, epidurální anestezie s katétrem více než jednorázová spinální anestezie, a paravertebrální blokády představují výkony z tohoto pohledu poměrně rizikové. Navíc se jedná o techniky, které můžeme částečně nahradit periferními blokádami, infiltrační analgezií nebo systémovou analgezií. V současné době neexistují jasná EBM data potvrzující mortalitní rozdíly při použití celkové nebo regionální anestezie. Existují pouze pozitivní data pro některé typy výkonu a typy pacientů. Například u pacientů s chronickým plicním onemocněním po velkých břišních výkonech vedlo použití epidurální analgezie ke snížení plicních komplikací. Současná doporučení stran vysazení protisrážlivé medikace nelze chápat dogmaticky, mají nám poskytnout návod, jak se zachovat, abychom minimalizovali riziko vzniku krvácivých komplikací ve vztahu k regionální anestezii. Riziko však nepředstavuje pouze medikace, musíme do něj zahrnout i anatomické poměry pacienta (spinální stenóza, obezita) a v neposlední řadě anesteziologovy zkušenosti a dovednosti (je doporučeno, aby výkony s rizikem krvácení neprováděli lékaři ve výcviku – méně punkcí = menší riziko). Jako u každého výkonu musíme zvážit benefity a rizika a alternativy, které máme. A pokud už se rozhodneme provést blokádu u rizikového pacienta, musíme vždy zajistit řádné monitorování v pooperačním období, minimalizovat koncentraci lokálního anestetika, abychom předešli motorické blokádě a v případě podezření na vznik hematomu toto urychleně řešit.
Současná doporučení se liší jen částečně. Nejkonzervativnější jsou doporučení ASRA, zejména se to týká doporučení stran LMWH v pooperačním období a periferních blokád. Na druhou stranu evropská, zejména skandinávská doporučení nekriticky favorizují neuroaxiální blokády před CA a u některých nových léku, s kterými je zatím malá klinická zkušenost, doporučují intervaly neodpovídající farmakokinetice těchto preparátů. Nová algeziologická doporučení z roku 2015 jsou vhodným racionálním průsečíkem těchto doporučení, jen jsou obtížněji interpretovatelná vzhledem k rozsahu procedur, které pokrývají. Běžná epidurální punkce s katétrem je hodnocena jako výkon se středním rizikem. Uvidíme, co přinesou nová guidelines, jak si poradí s rozvojem používání ultrazvuku v navigaci při regionální anestezii a jaké budou zkušenosti s novými protisrážlivými léky.
Autor prohlašuje, že nemá střet zájmů.
Do redakce došlo dne 26. 7. 2016.
Do tisku přijato dne 15. 8. 2016.
Adresa pro korespondenci:
MUDr. Milan Jelínek
Merhautova 925/3
61300 Brno
e-mail: milan.jelinek@fnusa.cz
Sources
1. Tryba, M. Epidural regional anesthesia and low molecular heparin: Pro. Anasthesiol. Intensivmed Notfallmed Schmerzther, 1993, 28, 3, p. 179–181.
2. Moen, V., Dahlgren, N., Irestedt, L. Severe neurological complications after central neuraxial blockades in Sweden 1990–1999. Anesthesiology, 2004, 101, 4, p. 950–959.
3. Kalichman, L., Cole, R., Kim, D. H. Spinal stenosis prevalence and associated symptoms: the Framingham Study. Spine J., 2009, 9, 7, p. 545–550.
4. Vandermeulen, E. P., Van Aken, H., Vermylen, J. Anticoagulants and spinal-epidural anesthesia. Anesth. Analg., 1994, 79, 6, p. 1165–1177.
5. Horlocker, T. T., Wedel, D. J., Rowlingson, J. C. et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg. Anesth. Pain Med., 2010, 35, 1, p. 64–101.
6. Gogarten, W., Vandermeulen, E., Van Aken, H., Kozek, S., Llau, J. V., Samama, C. M. European Scoeity of Anaesthesiology Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur. J. Anaesthesiol., 2010, 27, 12, p. 999–1015.
7. Breivik, H., Bang, U., Jalonen, J. et al. Nordic guidelines for neuraxial blocks in disturbed haemostasis from the Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol. Scand., 2010, 54, 1, p. 16–41.
8. Harrop-Griffiths, W., Cook, T., Gill, H., Hill, D., Ingram, M., Makris, M., Malhotra, S., Nicholls, B., Popat, M., Swales, H., Wood, P. Regional anaesthesia and patients with abnormalities of coagulation: the Association of Anaesthetists of Great Britain & Ireland The Obstetric Anaesthetists‘ Association Regional Anaesthesia UK. Anaesthesia, 2013, 68, 9, p. 966–972.
9. Narouze, S., Benzon, H. T., Provenzano, D. A., Buvanendran, A., De Andres, J., Deer, T. R., Rauck, R., Huntoon, M. A. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications: guidelines from the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Therapy, the American Academy of Pain Medicine, the International Neuromodulation Society, the North American Neuromodulation Society, and the World Institute of Pain. Reg. Anesth. Pain Med., 2015, 40, 3, p. 182–212.
10. Steinfeldt, T., Nimphius, W., Werner, T., Vassiliou, T., Kill, C., Karakas, E., Wulf, H., Graf, J. Nerve injury by needle nerve perforation in regional anaesthesia: does size matter? Br. J. Anaesth., 2010, 104, 2, p. 245–253.
11. Steinfeldt, T., Poeschl, S., Nimphius, W., Graf, J., Zoremba, M., Mueller, H. H., Wulf, H., Dette, F. Forced needle advancement during needle-nerve contact in a porcine model: histological outcome. Anesth. Analg., 2011, 113, 2, p. 417–420.
12. Neal, J. M., Brull, R., Chan, V. W., Grant, S. A., Horn, J. L., Liu, S. S., McCartney, C. J., Narouze, S. N., Perlas, A., Salinas, F. V., Sites, B. D., Tsui, B. C. The ASRA evidence-based medicine assessment of ultrasound-guided regional anesthesia and pain medicine: Executive summary. Reg. Anesth. Pain Med., 2010, 35, 2 Suppl., p. S1–9.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2016 Issue 6-
All articles in this issue
- Depth of anaesthesia monitoring
- Management of sepsis-induced disseminated intravascular coagulopathy using antithrombin and heparin, and the use of thromboelastometry in establishing the diagnosis of heparin resistance
- Ultrasound-guided blockade of the second and third trigeminal branches in geriatric patients
- Regional anaesthesia and haemostasis-modifying drugs – latest recommendations
- Preventive immobilisation of the cervical spine in pre-hospital emergency care in trauma patients: update
- Thrombophilic conditions during pregnancy
- Critical airway obstruction during general anaesthesia caused by anterior mediastinal mass managed by ECMO and tracheobronchial stenting
- Statistics in biomedical research I
- Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Depth of anaesthesia monitoring
- Thrombophilic conditions during pregnancy
- Regional anaesthesia and haemostasis-modifying drugs – latest recommendations
- Preventive immobilisation of the cervical spine in pre-hospital emergency care in trauma patients: update
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career