-
Medical journals
- Career
Etorikoxib v premedikaci před tonzilektomií
Authors: Leštianský Boris 1; Hakl Marek 1; Pešlová Marie 1; Veselá Vladimíra 2; Pavlík Tomáš 3; Kostřica Roman 2
Authors‘ workplace: Anesteziologicko-resuscitační klinika LF MU a FN u sv. Anny v Brně 1; Klinika otorinolaryngologie, chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně 2; Institut biostatistiky a analýz Masarykovy univerzity v Brně 3
Published in: Anest. intenziv. Med., 22, 2011, č. 3, s. 137-145
Category: Anaesthesiology - Original Paper
Overview
Cíl studie:
Zjistit analgetický efekt etorikoxibu podaného perorálně před tonzilektomií.Typ studie:
Interdisciplinární, prospektivní, randomizovaná, studie.Typ pracoviště:
JIP KOCHHK Fakultní nemocnice.Metodika:
Do studie byli zařazeni pacienti podstupující jednoduchou tonzilektomii, kteří byli kategorizováni do skupiny předoperačního rizika podle ASA I a II. Vylučovacím kritériem byly jakékoli obecné kontraindikace k podání COX-2 inhibitorů, nesouhlas anebo nezletilost. Výkon proběhl v celkové doplňované anestezii s orotracheální intubací. Celkový počet tvořily dvě skupiny pacientů, skupina koxibová (n = 38) a kontrolní (n = 37). Ve sledování jsme se primárně zaměřili na hodnocení intenzity akutní posttonzilektomické bolesti pomocí VAS škály. Analyzovali jsme také pooperační spotřebu analgetik (metamizol vs piritramid) během prvních 24 hodin po tonzilektomii. Dále jsme vyhodnocovali kvalitu pooperační bolesti (řezavá, tupá) a její výskyt v obou skupinách. Sekundárně jsme sledovali incidenci pooperačního krvácení z lůžka a následnou nutnost chirurgické revize.Výsledky:
Prokázali jsme statisticky významnou redukci v pooperační spotřebě analgetik po 3 (p = 0,004) a 24 hodinách (p = 0,019) ve prospěch etorikoxibové skupiny. Signifikantní rozdíly mezi skupinami jsme pozorovali v charakteru (klidová bolest 15,8 % vs 51,4%, p = 0,001), rovněž tak i v kvalitě bolesti (řezavá 50 % vs tupá 81,1 %). Analýza VAS skóre prokázala spíše stacionární intenzitu bolesti ve skupině s etorikoxibem.Závěr:
Závěrem lze konstatovat celkově nižší spotřebu neopioidní pooperační analgezie (p = 0,001), lepší kvalitativní složku a relativně stabilní intenzitu bolesti v koxibové skupině.Klíčová slova:
premedikace etorikoxibem – tonzilektomie – inhibitory COX-2Úvod
Moderní soudobá léčba akutní pooperační bolesti (dále jen APB) by měla splňovat určité základní atributy. Komplexní a organizovaný přístup k pacientovi by měl umožnit komfortní a adekvátní kontrolu APB během celého perioperačního období (tj. pre-, intra - a postoperačně). Multimodální doplňovaná analgetická terapie znamená optimální vyvážení jednotlivých farmakologických komponent a v neposlední řadě přesně cílenou analgezii podle typu a rozsahu operační intervence, tzn. „procedure specific analgesia“. Klinický výzkum prokázal, že i krátkodobě působící intenzivní noxa či přímé poškození aferentních senzitivních nervových vláken a zakončení může vést k dlouhodobým změnám v centrální neuroplasticitě, což může v konečném důsledku indukovat perzistující pooperační bolesti (persistent postsurgical pain – PPSP) a různé projevy hypersenzitivity CNS (dysestezie, allodynie, hyperalgezie) i přesto, že vyvolávající stimulus již dávno přestal působit [1, 2, 3, 4]. Předoperační podání analgetik s vhodným spektrem účinnosti má za cíl pozitivně ovlivnit tyto pronociceptivní procesy. Z historického hlediska se otázkou „předoperační analgezie“ poprvé reálně začali zabývat Crile a Wall koncem 80. let minulého století. Wall publikoval jednu z prvních prací, ve které testoval předoperační intratekální podání morfinu na krysím modelu, s cílem ovlivnit intenzitu APB [5]. Poté začalo období, ve kterém proběhla celá řada klinických a experimentálních studií s cílem potvrdit tuto hypotézu. Analgezie podaná jako součást premedikace má za úkol nejen oslabit a redukovat intraoperační nocicepci a intenzitu pooperační bolesti, ale především modulovat a předcházet hyperexcitabilitě neuronů, zejména na cerebrospinální úrovni známé jako centrální senzitizace [3, 4, 6]. Ta odpovídá za potenciální pooperační rizika ve smyslu zesílení následných bolestivých aferentací z operační rány a traumatizovaných tkání, které vedou ve svém důsledku k intenzivnější APB a větší spotřebě analgetik. Důležitým momentem, který ovlivňuje požadovaný výsledek analgetika podaného v premedikaci, je optimální načasování („timing“) jeho aplikace [4]. Supraspinální COX-2 inhibice hraje důležitou roli v modulaci centrální nocicepce [6]. V naší klinické studii jsme se snažili zjistit analgetický účinek předoperačně perorálně podaného selektivního inhibitoru cyklooxygenázy-2 (dále jen COX-2) – etorikoxibu. Patří mezi COX-2 inhibitory druhé generace s vysokou afinitou k izoformě COX-2, po farmakochemické stránce je tvořen sulfonovou strukturou [7]. Farmakokinetika etorikoxibu se vyznačuje dobrou absorpcí a biologickou dostupností. Etorikoxib se podává perorálně s jídlem nebo nalačno. Nástup účinku léčivého přípravku může být rychlejší, pokud se přípravek podává nalačno. Při podávání 120 mg jednou denně byla zjištěna maximální koncentrace v plazmě přibližně 1 hodinu (cmax. 0,5–2 h) po podání dospělým lačným pacientům [8]. Eliminace etorikoxibu probíhá renální cestou, jeho jaterní biometabolity jsou jen slabě aktivními COX-2 inhibitory. Poločas rozpadu t1/2max činí 19–32 h, což umožňuje komfortní dávkování jednou za 24 hodin [7]. Potenciální nebezpečí dlouhodobé terapie inhibitory COX-2 jsou v nynější době dobře známá. Dávka pro léčbu akutní bolesti nemá překročit 120 mg denně, s omezením na maximální délku léčby 8 dnů. Obávaná negativní kardiovaskulární rizika etorikoxibu byla v četných studiích srovnávána s diklofenakem, přičemž nebyl shledán významný statistický rozdíl v morbiditě a mortalitě mezi jednotlivými skupinami [8]. Mechanismus účinku spočívá ve specifické enzymové inhibici, zejména induktivní formy COX-2, která odpovídá za celou řadu proinflamačních biologických účinků včetně těch, které se podílejí na procesu hypersenzitivity CNS a centrální nocicepce. Obecně lze konstatovat, že etorikoxib potlačuje syntézu prostanoidních mediátorů v různých tkáních a systémech, z čehož plynou i příslušné biologické účinky. Významným atributem etorikoxibu v předoperačním období je jeho poměrně dlouhý farmakodynamický účinek přetrvávající obvykle prvních 24 hodin po podání. Další relativní výhodou je ve srovnání s ostatními inhibitory COX-2 jeho extrémně nízký gastrotoxický ulcerogenní profil, za který rovněž odpovídá vysoká COX-2 selektivita [9, 10]. Ačkoliv má etorikoxib nízký gastrotoxický profil, je relativně kontraindikován u pacientů s peptickou lézí, rovněž tak u špatně kompenzovaných hypertoniků a pacientů s pokročilejším stadiem hepato-renální dysfunkce. Indikační spektrum etorikoxibu je především v léčbě chronické revmatické bolesti (osteoartóza, dna, ankylozující spondylitida), nicméně jeho farmakokinetický profil a komfortní dávkování z něj dělají relativně vhodný lék pro krátkodobé užití v perioperační medicíně. Jeho podání v rámci premedikace před tonzilektomií je „off-label“. Cílem studie bylo objektivizovat analgetický účinek etorikoxibu v jednorázové předoperační dávce v rámci premedikace před tonzilektomií ve srovnání s placebem.
Materiál a metodika
Klinická studie byla schválena Multicentrickou etickou komisí Fakultní nemocnice u svaté Anny v Brně pod jednacím číslem 14V/2009.
Klinická studie probíhala po dobu 15 měsíců. Do studie bylo celkem zařazeno 75 dospělých pacientů kategorie ASA I–II, kteří byli otorinolaryngologicky (dále jen ORL) indikováni k jednoduché bilaterální tonzilektomii (TE) pro chronickou tonzilitidu. Po splnění vstupních kritérií studie nesměli mít žádné obecné kontraindikace k podání etorikoxibu. Pacienti byli posléze pečlivě verbálně informováni o průběhu studie, podstatě klinického výzkumu, způsobu hodnocení bolesti, rovněž tak o možném riziku spojeném s jejich zařazením do studie a podepsali informovaný souhlas. Pacienti byli vyloučeni ze studie, pokud v rámci předanestetického vyšetření bylo zjištěno jedno nebo více z následujících vylučujících kritérií: tělesná hmotnost pacienta pod 45 kg, jakákoliv alergická reakce na nesteroidní antiflogistika, věk pod 18 let, gravidita, aktivní vředová choroba žaludku, předchorobí, krvácení z trávicího traktu, obtížně kontrolovatelný vysoký krevní tlak, kardiovaskulární onemocnění (onemocnění věnčitých tepen srdce, srdeční infarkt atd.), poruchy krevní srážlivosti a poruchy funkce ledvin či jaterní nedostatečnost. Dalším kritériem neumožňujícím zařazení do studie byla ORL indikace – tzv. rozšířené TE s krční disekcí pro primárně onkologický proces tonzily. Pacienti byli rozděleni do dvou skupin bez možnosti ovlivnit rozdělení. Žádný se zařazených pacientů neudával předoperační bolesti, které by byly lokalizované do oblasti tonzil. Předchorobí chronické bolesti tím bylo vyloučeno. Randomizace byla zaslepena pro pacienty, zdravotnický personál i pro ošetřující sestry JIP, které pomáhaly pacientům vyplňovat hodnoticí protokol. Rozdělení do dvou skupin bylo nahodilé. Etorikoxibová skupina obdržela perorálně lékovou kombinaci etorikoxib 120 mg (Arcoxia, Merck) a diazepam 5–10 mg (Diazepam, Zentiva) 2 hodiny před TE. Pacientům druhé skupiny (skupina kontrolní, placebová) byl perorálně podán diazepam v obvyklé premedikační dávce 5–10 mg podle tělesné hmotnosti ve stejném časovém intervalu před výkonem. Obě skupiny dostaly 2 tablety v rámci premedikace, aby zaslepení mezi pacienty zůstalo nenarušeno. Pacienti byli zařazeni do operačního programu v dopoledních hodinách. Při hodnocení APB jsme se zaměřili na dva hlavní parametry, kvalitativní a kvantitativní složku. Kvalita APB v pooperačním protokolu studie měla za cíl objasnit charakter bolesti (tupá/difuzní anebo řezavá/bodavá). Kvantitativní složka měla odrážet prožívanou intenzitu bolesti vyjádřenou pomocí VAS od 0–100 mm. Při výskytu pooperačních bolestí bylo navrženo následovné analgetická schéma. V prvním kroku byl intravenózně podáván metamizol v dávce 15 mg . kg-1 těl. hm. v pomalé 30minutové infuzi s fyziologickým roztokem (analgezie č. 1). Při jejím nedostatečném efektu (tj. bez poklesu hodnoty VAS alespoň o 2, anebo při progresi kvalitativní složky APB) bylo přistoupeno k podání piritramidu v dávce 15 mg subkutánně (analgezie č. 2). Anestezie v průběhu TE byla vedena jako celková doplňovaná anestezie (intravenózní úvod: propofol 2,0 mg . kg-1 těl. hm. + sufentanil 0,15 μg . kg-1 těl. hm. + rokuronium 0,6 mg . kg-1 těl hm., udržována inhalačně směsí O2 + N2O + izofluran (ET 0,7 až 0,8/MAC 1,0) se suplementací intravenózních opioidů – sufentanilem (0,1 μg . kg-1 těl. hm. podle hemodynamické odpovědi na chirurgickou stimulaci) se zajištěním dýchacích cest orotracheální intubací a tamponádou hypofaryngu. Výkon byl prováděn zkušeným otorinolaryngologem u anestezovaného pacienta v poloze na zádech, kdy po orotracheální intubaci byl naložen tonzilektomický ústní rozvěrač a tím se vytvořil dostatečný manipulační prostor k provedení TE. Před preparací byla provedena infiltrace patrových oblouků fyziologickým roztokem. Poté byly skalpelem naříznuty patrové oblouky paralelně s jejich mediálním okrajem. Byla provedena tupá preparace a odstraněna tonzila paralelně s pouzdrem. Tenká stopka při dolním pólu byla přerušena kličkou nebo po předchozí elektrokoagulaci ostře nůžkami. Na závěr byla provedena pečlivá hemostáza, u kapilárního krvácení komprese tampony, výraznější krvácení bylo stavěno elektrokoagulací, výjimečně opichem krvácející cévy. Vyvedení z celkové anestezie probíhalo bez použití naloxonu. Lokální infiltrační anestezie lůžka tonzil před výkonem nebyla použita. V případě výskytu PONV (pooperační nauzea a zvracení) byl podáván tiethylperazin v jednorázové dávce 6,5 mg intravenózně. Po skončení výkonu a vyvedení z celkové anestezie byli pacienti přeloženi na JIP ORL kliniky k bezprostřední intenzivní péči a pooperačnímu dohledu po TE. Zde probíhalo i klinické hodnocení a sběr dat formou záznamu do pacientského protokolu studie prvních 24 hodin po tonzilektomii. Po adekvátním kognitivním zotavení z celkové anestezie (nejpozději do 1 hodiny po příjmu na JIP) byli dotázáni na bazální intenzitu bolesti (tj. bez jakékoliv pooperační analgezie) pomocí VAS. Intenzita APB byla zaznamenávána po 3 hod. jako VAS prvních 24 hodin po TE. Při spánku pacienta byla analgezie hodnocena číslem 2, tj. jako dostatečná, jelikož pacient neudával bolesti. Centrálně účinkující a tlumivé léky (kromě piritramidu jako tzv. „rescue analgezie“) nebyly pacientům během studie podávány. Při vzestupu VAS > 4 v klidu a 5–6 při polykání nebo při zhoršování kvality bolesti byla podána analgezie č. 1. V případě nedostatečného analgetického efektu směsi 1 byla po uplynutí 1 hodiny od podání aplikována analgezie č. 2 (tzv. záchranná analgetická terapie obsahující piritramid). Veškerá podaná analgetika byla zaznamenána časovým údajem a hodnotou VAS. Hlavním cílem (primární outcome) sledování bylo stanovení kvantitativního a kvalitativního rozdílu v APB mezi sledovanými skupinami a rozdíl celkové spotřeby analgetik prvních 24 hodin po TE. Vedlejším cílem (sekundární outcome) bylo sledování incidence pooperačního krvácení z posttonzilektomického lůžka a nutnost chirurgického stavění krvácení první 2 dny po výkonu a stanovení rozdílu mezi skupinami.
Popis souboru pacientů a sledovaných charakteristik byl proveden pomocí frekvenčních tabulek a standardních popisných statistik průměru, směrodatné odchylky, mediánu, minima a maxima. Testování rozdílu věku a VAS bylo vzhledem k nesplněnému předpokladu normality dat provedeno pomocí neparametrického Mannova-Whitneyova testu. Hodnocení vztahu kategoriálních proměnných bylo provedeno pomocí odpovídajícího testu pro kontingenční tabulky, Fisherova exaktního testu pro dvě kategorie binárního charakteru (ano/ne) a Pearsonova chí-kvadrát testu pro hodnocení vztahu dvou proměnných s více než dvěma kategoriemi. Pro stanovení statistické významnosti byla použita standardní hladina α = 0,05.
Výsledky
Do studie bylo zařazeno 38 pacientů, kterým byl předoperačně podán etorikoxib a 37 pacientů, kterým bylo předoperačně podáno placebo. Základní charakteristiky pacientů jsou uvedeny v tabulce 1. Výsledné p-hodnoty ukazují, že mezi oběma skupinami nebyl statisticky významný rozdíl ve věkové struktuře a pohlaví.
Table 1. Základní charakteristika souboru pacientů 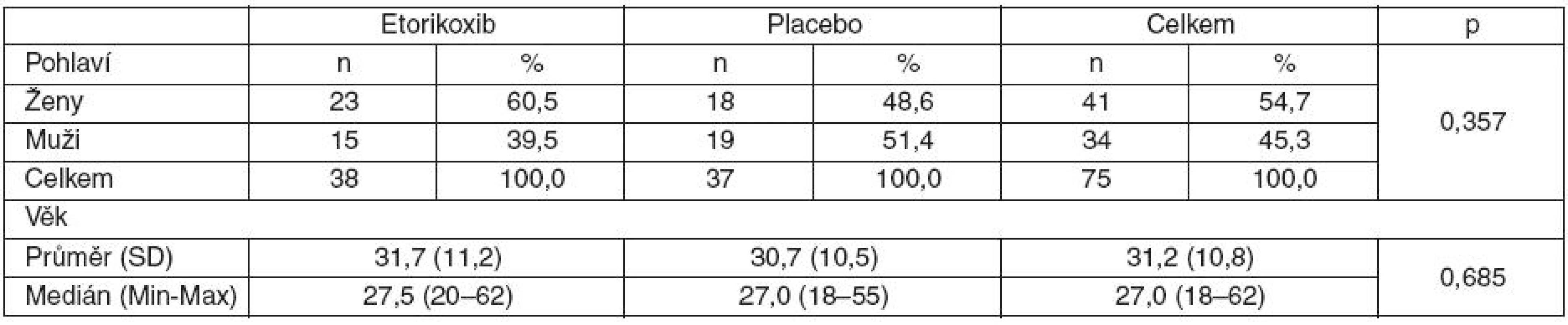
Tabulka 2 ukazuje srovnání spotřeby analgetik v čase po tonzilektomii u sledovaných skupin. Je vidět, že ve všech časech je spotřeba analgetik nižší u skupiny s etorikoxibem, po 3 hod. (p = 0,004) a 24 hod. (p = 0,019) je tento rozdíl statisticky významný. Statisticky významně rozdílná je zejména spotřeba analgetické směsi č. 1 (p < 0,001), což je vidět v tabulce 3, která ukazuje celkovou spotřebu obou směsí ve sledovaných skupinách.
Table 2. Srovnání spotřeby analgetik v čase po tonzilektomii (TE) u sledovaných skupin 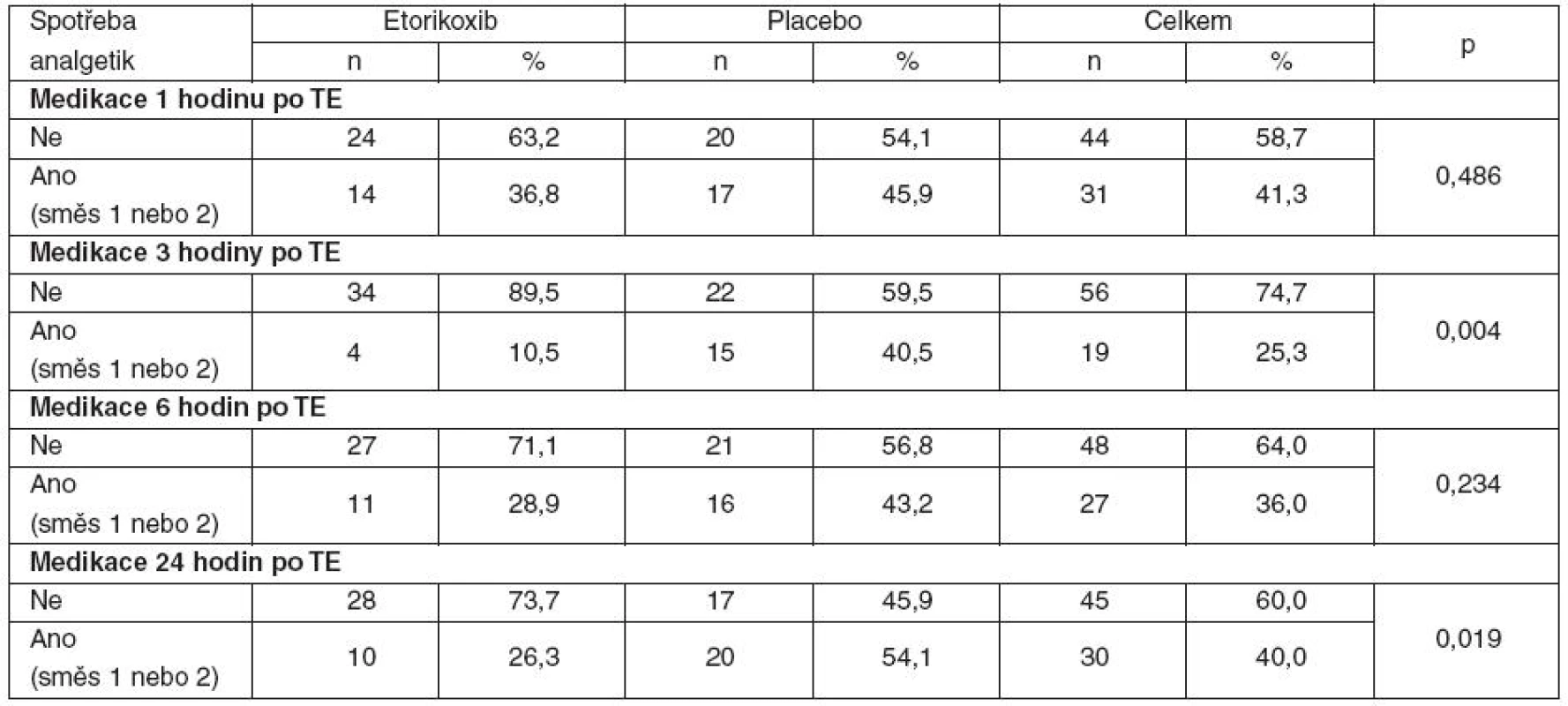
Table 3. Celková spotřeba analgetik prvních 24 hodin po tonzilektomii u sledovaných skupin 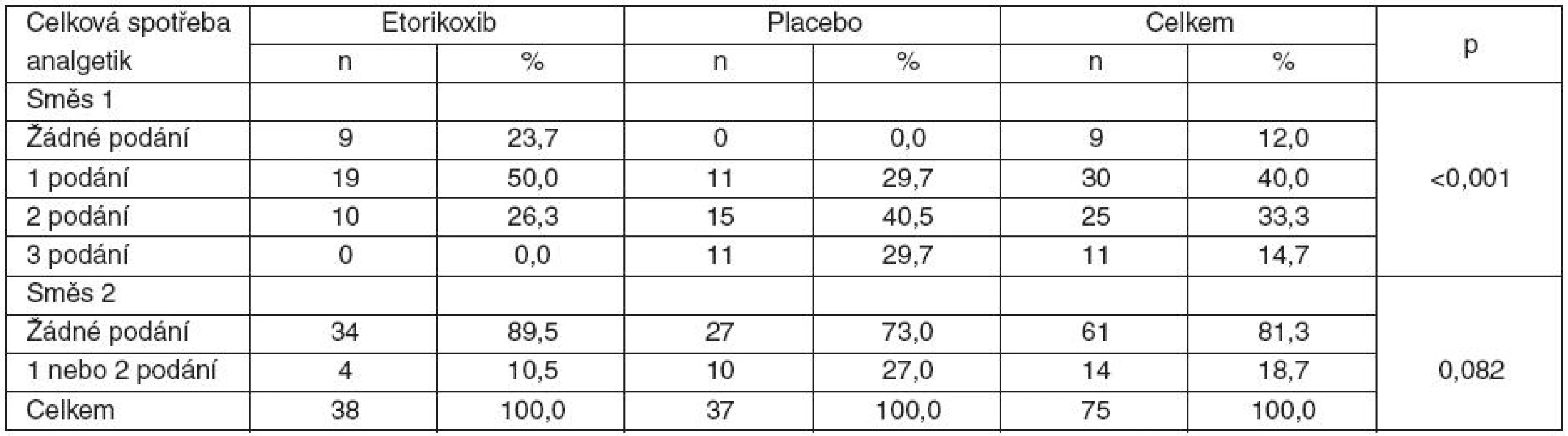
Jako primární cílový parametr byl hodnocen pokles VAS v čase. Analýza změn byla provedena s ohledem na to, jakou medikaci pacienti dostávali v jednotlivých časových bodech, ve kterých bylo VAS zjišťováno, abychom se vyhnuli vlivu medikace podávané až po tonzilektomii (hodnoty VAS v čase byly ovlivněny jak experimentálním cílem, etorikoxib vs placebo, ale také současně podávanou medikací). Tabulka 4 shrnuje výchozí stav (VAS skóre 1 hodinu po TE). Je vidět, že 1 hodinu po TE nebyl mezi skupinami v kvantifikaci bolesti statisticky významný rozdíl. Graf 1 shrnuje ve sledovaných skupinách změny ve VAS mezi jednotlivými časovými body vzhledem k medikaci analgetiky. Kladné hodnoty diference značí zmírnění bolesti, záporné hodnoty naopak zhoršení bolesti. U pacientů, kteří v jednotlivých časech dostali analgetika (analgetickou směs 1 nebo 2), nelze vzhledem k premedikaci etorikoxibem prokázat statisticky významný rozdíl v poklesu VAS skóre mezi 1. a 3. hod. (graf 2a, p = 0,984), 3. a 6. hod. (graf 2b, p = 0,596), ani mezi 6. a 24. hod. (graf 2c, p = 0,121) po TE (u obou skupin došlo ke zmírnění bolesti). Naopak u pacientů, kteří v jednotlivých časech analgetika nedostali, lze vzhledem k premedikaci etorikoxibem prokázat statisticky významný rozdíl v poklesu VAS skóre mezi 1. a 3. hod. (p = 0,023) a mezi 6. a 24. hod. (p = 0,031) po TE. V obou obdobích došlo u skupiny s placebem spíše ke zhoršení bolesti, zatímco u skupiny s etorikoxibem byla intenzita APB beze změny.
Table 4. Hodnoty VAS 1 hodinu po tonzilektomii (TE) podle sledovaných skupin 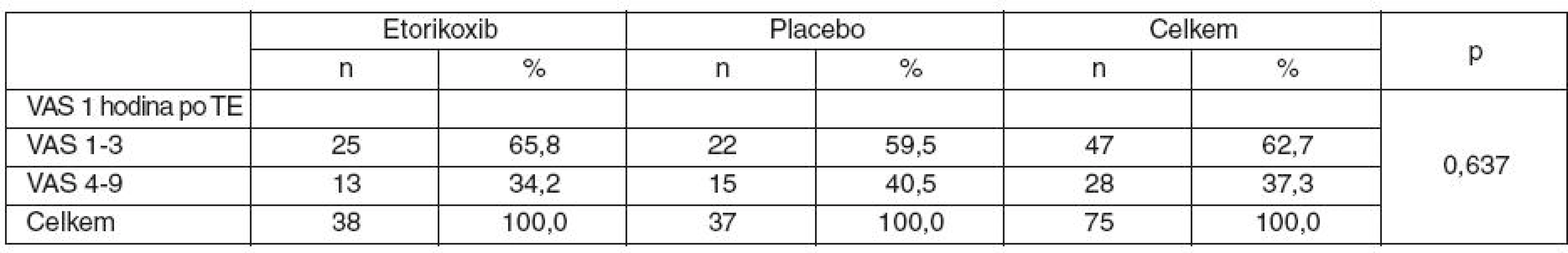
Graph 1. Změna VAS skóre mezi jednotlivými časy po tonzilektomii podle ramene studie a současně použité analgezie Kladné hodnoty diference značí zmírnění bolesti, záporné hodnoty naopak zhoršení bolesti. 
Kvalitativní složku bolesti sledovaných skupin a její charakter shrnuje tabulka 5. V obou skupinách je patrný statisticky významný rozdíl v zastoupení typu i charakteru bolesti. Ve skupině pacientů s etorikoxibem jsou častější bolesti, které se projevují pouze při polykání (n = 32, 84,2 %), naopak ve skupině pacientů s placebem byla pozorována častěji bolest řezavá nebo bodavá (n = 30, 81,1 %). Sekundárně sledovaným cílem byl rozdíl ve výskytu pooperačního krvácení po TE, eventuálně nutnosti revize pro pooperační krvácení. Vliv na výskyt této nejobávanější komplikace během prvních dvou pooperačních dnů nebyl potvrzen. Z celého souboru pacientů byla indikována reoperace pro krvácení pouze u jedné pacientky z kontrolní větve. Během studie nedošlo k výskytu žádných nežádoucích účinků ani k jiným závažným negativním projevům souvisejících s podáním etorikoxibu.
Table 5. Vztah charakteru, typu bolesti a sledovaných skupin 
Diskuse
Posttonzilektomická bolest je nejintenzivnější bezprostředně po operaci a během prvních tří dnů. Je charakterizována většinou zpočátku klidovou řezavou až bodavou bolestí v krku a posléze, po obnově příjmu tekutin/potravy, také bolestí při polykání, která působí často až iradiačně a může mít kvalitu pooperační glossofaryngeální neuralgie. Navíc v pozdějším období po konzumaci jídla a častějším polykání může klidová bolest ještě delší dobu přetrvávat. Základní faktory ovlivňující její intenzitu jsou technika operačního postupu (velikost resekční plochy, použití elektrokauterizace atd.), velikost periferní (vlivem lokálního zánětu) a centrální senzitizace, a stejně tak i kvalita perioperační analgezie. Výsledky naší studie prokázaly statisticky signifikantní rozdíl ve spotřebě pooperační neopioidní analgezie (p < 0,001) během prvních 24 hodin ve prospěch pacientů, kteří dostali předoperačně etorikoxib. V potřebě opioidní pooperační analgezie nebyly významné rozdíly (p = 0,082). Její aplikace byla spíše použita jako rescue analgetický postup. Ačkoliv většina studií hodnotí spotřebu silných opioidů v pooperační analgezii, intenzita posttonzilektomické bolesti hodnocená jako VAS nebyla v naší studii tak vysoká, aby jejich použití bylo časté. Lze proto považovat i signifikantní rozdíl v pooperační spotřebě metamizolu prvních 24 hodin jako pozitivní výsledek. Relativně restriktivní indikace piritramadu bezprostředně po tonzilektomii jsou důsledkem obávaných rizik z pohledu otorinolaryngologů. Zejména pro možnost zvýšené incidence opioidy indukované pooperační nauzey a zvracení (PONV), které by mohly mít významně negativní vliv na včasné pooperační krvácení. První hodinu po TE nebyly pozorované rozdíly v kvantitě bolesti v obou skupinách (viz tabulka 2). Přisuzujeme to doznívajícímu efektu celkové anestezie a intraoperační analgezie. Významný rozdíl mezi oběma skupinami v intenzitě APB hodnocené pomocí VAS prvních 24 hodin nebyl shledán, nicméně při srovnávání pacientů, kteří nedostali žádnou pooperační analgezii byla intenzita APB stabilnější a bez větších oscilací právě v etorikoxibové skupině. Statisticky významný rozdíl v poklesu VAS skóre mezi 1. a 3. hodinou v etorikoxibové skupině bez jakékoliv analgezie po TE lze vysvětlit jednak dosažením maximální plazmatické koncentrace etorikoxibu (cmax. 0,5–2 h), případně možným vlivem odeznívajícího účinku peroperačně podaného sufentanilu. Nižší spotřebu analgetik po 24 hodinách od ukončení TE lze zdůvodnit potencováním pooperační analgezie již předoperačně podaným etorikoxibem. Je zřejmé, že bolest u těchto pacientů byla lépe kontrolována, což potvrzuje i vyhodnocení kvality (charakteru) bolesti. Ve skupině s etorikoxibem byl výskyt klidových bolestí pouze u necelých 16 % pacientů ve srovnání s placebem, kde činil 51,4 %. Pacienti v placebo skupině popisovali své bolesti spíše jako řezavé až bodavé, což následně odráželo i nutnost pooperační analgezie a individuální hranici tolerance bolesti. U pacientů s etorikoxibem v premedikaci bylo subjektivní hodnocení bolesti vyrovnané. Při hodnocení bolesti je nutno vždycky mít na paměti, že se jedná o subjektivní vjem a existují určité interindividuální rozdíly. Volili jsme proto jako pomůcku popisnou charakteristiku kvality bolesti (řezavá, bodavá, tupá, neostrá), abychom usnadnili pacientům jejich rozhodování v hodnocení charakteru bolesti. Ve studii jsme podávali univerzální jednorázovou předoperační dávku etorikoxibu 120 mg všem randomizovaným pacientům této skupiny. Vycházeli jsme přitom z údajů o NNT (number needed to treat) platných pro etorikoxib, který je účinnější ve vyšších dávkách v léčbě akutní bolesti (NNT = 1,4) [8, 10]. Farmakodynamika a analgetická účinnost etorikoxibu po jednorázové dávce se jeví jako vhodná pro použití v premedikaci. Nežádoucí účinky (dyspepsie, včasné alergické reakce atd.) ve sledované skupině nebyly téměř žádné. Pouze v jednom případě došlo u mladé pacientky k výskytu diastolické hypertenze (≤ 110 torr), přičemž u ní nebyla shledána jiná relevantní klinická příčina hypertenzní reakce (nízká hodnota VAS, dostatečná analgezie, absence vazokonstrikčních látek či kardiovaskulární patologie). Po podání malé dávky sublinguální formy kaptoprilu byla dále normotenzní. Ačkoliv TE patří k rozsahově menším výkonům v ORL chirurgii, lze jí individuálně klasifikovat jako proceduru s mírnou až středně silnou pooperační bolestivostí. Somatosenzitivní inervace patrových tonzil je zprostředkována cestou n. glossopharyngeus (n. IX) a částečně z 2. větve n. trigeminus (n. V) čili maxilárního nervu. Senzitivní jádra těchto nervů jsou anatomicky lokalizována v mozkovém kmeni, tudíž k prevenci vzniku centrální senzitizace po TE by mělo analgetikum s požadovaným antinociceptivním působením prostupovat hematoencefalickou bariérou. Etorikoxib tuto vlastnost má a tím přispívá k modulaci centrální nocicepce [8]. Minimální COX-dependentní antiagregační profil jej dělá zajímavou látkou z pohledu rizika perioperačního krvácení potencovaného nesteroidními antiflogistiky (NSA) [9]. Optimální gastroprotektivní vlastnosti etorikoxibu mohou být prospěšné zejména při perorální aplikaci v rámci premedikace u rizikových skupin pacientů. Několik velkých studií (kupř. studie CONDOR s celekoxibem) prokázalo, že COX-2 inhibitory jsou mnohem šetrnější alternativou k NSA v profylaxi vzniku i krátkodobé GIT toxicity a intolerance [11]. Obecně je problematika podávání NSA v pooperační analgezii u ORL výkonů zatížená potenciálními riziky. Jedním z nejobávanějších rizik je zvýšená incidence pooperačního, zejména kapilárního krvácení, které mohou NSA indukovat a potencovat svým antitrombocytárním působením. Vzhledem k tomu, že většina ORL výkonů probíhá v terénu dobře vaskularizovaných sliznic dýchacích cest, jsou tyto obavy opodstatněné. Navíc, sliznice dutiny ústní a urogenitálního traktu mají poměrně dobrou zásobu fibrinolytického koagulačního systému, tudíž riziko difuzního pooperačního krvácení může být zvýšené [12]. Z klinického hlediska je nutno si uvědomit, že výskyt těchto nežádoucích účinků NSA použitých v perioperačním období se může zvyšovat s délkou terapie a poklesem selektivity k jednotlivým izoformám cyklooxygenázy. Z doposud dostupných metaanalýz vyplývá, že NSA sice nezvyšují incidenci perioperačního krvácení po tonzilektomii, ale zvyšují nutnost reoperací pro krvácení po jejich podávání [13]. Poslední retrospektivní pediatrická studie (n = 1160) neshledala statisticky významný rozdíl ve výskytu postadenotonzilektomického krvácení oproti placebu při podávání ibuprofenu v pooperačním období [14]. Ve skupině neselektivních NSA existují značné rozdíly mezi jednotlivými látkami a jejich destičkové toxicitě. Zvýšený výskyt krvácení po TE byl v literatuře pozorován zejména po ketorolaku [13]. Recentní studie zabývajících se problematikou NSA v ORL udávají, že celekoxib podávaný v dávce 200 mg per os je ekvivalentní k paracetamolu v dávce 2000 mg per os před ORL výkony [15]. Ačkoliv celekoxib vykazuje značný dávkově dependentní efekt, jako prevence akutní bolesti se doporučuje minimální jednorázová dávka až 400 mg [16]. Premedikace valdekoxibem před orofaciálními výkony v dávce 40 mg se jevila jako optimální z hlediska krátkodobé pooperační analgezie [17]. V ČR není valdekoxib registrován pro léčbu APB, ačkoliv jeho inaktivní injekční prodrug (prolék) parekoxib má hlavní indikační pole právě v perioperačním tlumení bolesti. Podle některých studií je valdekoxib účinnější než rofekoxib v terapii APB po ORL výkonech [18]. Studie s etorikoxibem prokázala dostatečně dlouhý a optimální analgetický účinek v dentoalveolární chirurgii [19]. Dále tato studie rovněž prokázala méně vedlejších nežádoucích účinků ve skupině s etorikoxibem než ve skupině s analgezií obsahující opioidy. V nynější době probíhá i další poměrně velká studie, která má za cíl upřesnit postavení a rizika etorikoxibu v perioperační analgezii u torakochirurgických a intraabdominálních výkonů [9]. Předoperační aplikace NSA nezlepšovala významně intenzitu pooperační bolesti, nicméně pozitivně korelovala s poklesem ve spotřebě analgetik, a stejně tak prodloužila časový interval do podání první analgezie [3, 6, 20]. Data prokazující zvýšenou incidenci perioperačního krvácení po podání NSA u různých typů operačních výkonů v této metaanalýze byla spíše konfliktní a nejednoznačná, pravděpodobně pro heterogenitu a nejednotnost chirurgických výkonů [3]. Některé koxiby použité ve vyšším dávkování po dobu přibližně jednoho týdne neodhalily zvýšené riziko negativních efektů na agregaci deštiček a čas krvácení v perioperačním období [6]. Podobné výsledky a závěry přinesla i další metaanalýza [20]. Ačkoliv zvýšené riziko závažných nežádoucích projevů COX-2 inhibitorů (zejména kardiovaskulárních a renálních) nebylo prokázáno, je nutno i nadále pacienty pečlivě indikovat k jejich podání. Účinnost předoperačně podaného etorikoxibu byla shledána jako adekvátní i u některých typů ambulantních výkonů [21]. Statisticky významný analgetický efekt amidových lokálních anestetik (ropivakain, bupivakain) aplikovaných předoperačně formou peritonzilární infiltrace nebyl prokázán [22, 23]. Některé studie srovnávaly podání lokálního anestetika a diklofenaku a dospěly ke stejným výsledkům v ovlivnění APB v obou skupinách [24]. Použití některých adjuvantních léků (koanalgetik) podaných předoperačně před tonzilektomií s cílem redukovat intenzitu pooperační bolesti jak tomu bylo ve studii s dexametazonem, rovněž nepřineslo očekávaný efekt [25].
Závěr
Předoperačně zahájená antinociceptivní terapie pokračující do včasné pooperační periody by měla poskytnout lepší a vyváženější kontrolu nad vznikem centrální senzitizace [2]. Ačkoliv jsou koxiby v redukci intenzity APB stejně efektivní jako neselektivní NSA, postrádají některé jejich významné nežádoucí účinky pro perioperační období [7]. Etorikoxib se jeví z farmakologického hlediska relativně vhodným a bezpečným lékem v modulaci APB u výkonů, kde jsou jiné NSA relativně kontraindikovány, zejména pro vyšší riziko krvácení a gastrointestinální toxicity. Rozhodujícími faktory účinnosti je správné načasování podání etorikoxibu, velikost dávky a případně opakovaný interval aplikace. V našem hodnocení premedikačního účinku etorikoxibu vedlo jeho podání k lepší kontrole intenzity posttonzilektomické bolesti bez větších oscilací, subjektivně přijatelnější kvalitativní složce bolesti a v neposlední řadě i k redukci spotřeby neopioidních analgetik prvních 24 hodin po výkonu. Etorikoxib se zdá být bezpečnou variantou použití neselektivních NSA u výkonů se zvýšeným rizikem pooperačního krvácení v ORL. Problémem však zůstává délka a intenzita posttonzilektomické bolesti, která trvá přibližně prvních 10 dnů. Slibný výsledek v oblasti spokojenosti pacientů s kvalitou pooperační analgezie je vhodné prokázat dalšími studiemi. V nynější době stále platí názor, že COX-2 inhibitory by měli být rezervované jako léky „druhé volby“ pro vybrané skupiny chirurgických pacientů [7].
Práce byla prezentována 9. 10. 2010 na kongresu Česko-slovenské dialogy o bolesti v Oloumouci jako přednáška.
Došlo dne 18. 10. 2010.
Přijato dne 1. 4. 2011.Adresa pro korespondenci:
MUDr. Boris Leštianský
Vídeňská 91
639 00 Brno
e-mail: lestiansky@fnusa.cz
Sources
1. Katz, J. Prediction and prevention of acute postoperative pain: moving beyond preemptive analgesia. In Shorten, G., Carr, D., B., Harmon, D. et al. Postoperative pain management: an evidence-based guide to practice. Saunders Elsevier, 2006, p. 109 – 117.
2. Reuben, S., S., Gadsden, J. Preemptive analgesia, regional anesthesia and the prevention of chronic postoperative pain. In Hadzic, A. Textbook of regional anesthesia and acute pain management. McGraw-Hill Medical, 2007, p. 1087–1103.
3. Ong, C., Lirk, Ph., Seymour, R., A., Jenkins, B., J. The efficacy of preemptive analgesia for acute postoperative pain management: a meta-analysis. Anesth. Analg., 2005, 100, p. 757–773
4. Grape, S., Tramer,M., R. Do we need a preemptive analgesia for the treatment of postoperative pain. Best Pract. Res. Clin. Anaesth., 2007, 21, I, p. 51–63.
5. Aida, S. The challenge of preemptive analgesia. Pain, 2005, Vol. XIII, No. 2, Suppl. clinical updates, p.1–4.
6. Kaye, A., D., Baluch, A., Kaye, A., J. et al. Pharmacology of cyclooxygenase-2 inhibitors and preemptive analgesia in acute pain management. Current Opinion in Anaesthesiology, 2008, 21, p. 439
7. Shi, S., KLotz, U. Clinical use and pharmacological properties of selective COX-2 inhibitors. Eur. Clin. J. Pharmacol., 2008, 64, p. 233–252.
8. SPC etorikoxibu (SUKL online).dostupný na www: http:// www.sukl.cz/modules/medication/search.php?data[search_ for]=arcoxia&data[code]=&data[atc_group]=&data [material]=&data[path]=&data[reg]=&data[radio]=none&data [with_adv]=0&x=0&y=0
9. Fleckenstein, J., Kramer, S., Offenbacher, M. et al. Etoricoxib – preemptive and postoperative analgesia (EPPA) in patients with laparotomy and thoracotomy – design and protocols. Trials 2010, 11 : 66, doi:10.1186/1745-6215--11-66.
10. McQuay, H., J., Moore, R., A. NSAIDs and Coxibs: clinical use. In McMahon, S., B., Koltzenburg, M., Wall and Melzack’s Textbook of Pain. 5th edition, 2005, Elsevier, Chpt. 30, p. 1–10.
11. Chan, F., K., Lanas, A., Scheine, K. Celecoxib versus omeprazole and diclofenac sodium in patiens with osteoarthritis and rheumatoid arthritis (CONDOR): a randomised trial. The Lancet, 2010, Vol. 376, Issue 9736, p. 173–179.
12. Schafer, A. I. Effects of nonsteroidal anti-inflammatory therapy on platelets. Am. J. Med., 1999, 106, 25S–36S.
13. Moiniche, S., Romsing, J., Dahl, J. B., Tramer, M. R. Nonsteroidal anti-inlfammatory drugs and the risk of operative site bleeding after tonsillectomy: a quantitative systemic review. Anesth. Analg., 2003, 96, p. 68–77.
14. Jeyakumar, A., Brickman, T. M., Williamson, M. E. Nonsteroidal anti-inlammatory drugs and postoperative bleeding following adenotonsillectomy in peadiatric patients. Arch. Otolaryngol. Head neck Surgery, 2008, 134, p. 24–27.
15. Issioui, T., Klein, K.,W., White, P. F. et al. The efficacy of premedication with celecoxib and acetaminophen in preventing pain after otolaryngologic surgery. Anesth. Analg., 2002, 94, p. 1188–1193.
16. Recart, A., Issioui, T., White, P. F. The efficacy of celecoxib premedication on postoperative pain and recovery times after ambulatory surgery: a dose ranging-study. Anesth. Analg., 2003, 96, p. 1631–1635.
17. Desjardins, P. J., Shu, V. S., Recker, D. P. A single preoperative oral dose of valdecoxib, a new cyclooxygenase – 2 specific inhibitor, relieves postoral surgery and buniectomy pain. Anesthesiology, 2002, 97, p. 565–573.
18. Fricke, J., Varkalis, J., Zwillich, S. et al. Valdecoxib is more efficacious than rofecoxib in relieving pain associated with oral Surgery. Am. J. Ther., 2002, 9, p. 89–97.
19. Malmstrom, K., Kotey, P., Coughlin, H. et al. A randomized, double – blind, parallel group study comparing the analgesic effect of etoricoxib to placebo, naproxen sodium, and acetaminophen with codeine using the dental impaction pain model. Clin. J. Pain, 2004, 20, p. 147–155.
20. Straube, S., Derry, S., McQuay, H. J., Moore, R. A. Effect of preoperative Cox-II-selective NSAIDs (coxibs) on postoperative outcomes: a systematic review of randomized studies. Acta Anaesthesiol. Scand., 2005, 49, p. 601–613.
21. Liu, W., Loo, C. C., Chiu, J. W., Tan, H. M. et al. Analgesic effecacy of pre-operative etoricoxib for termination of pregnancy in an ambulatory centre. Singapore Med. J., 2005, 46, 8, p. 397–400.
22. Vasan, N. R., Stevenson, S., Ward, M. Preincisional bupivacaine in posttonsillectomy pain relief: a randomized prospective study. Arch. Otolaryngol. Head Neck Surg., 2002, 128, 2, p. 145–149.
23. Likar, R., Morianz, U., Wieser, S. et al. Pre-emptive analgesia with ropivacaine in adult tonsillectomy. Anaesthesist, 1999, 48, 6, p. 373ٲ -378
24. Al-Khtoum, N. Comparative study of local infiltration of bupivacaine and parenteral administration of diclofenak sodium for post tonsillectomy pain in adults. Middle East J. Fam. Med., 2006, 4 (3), p. 52–53.
25. Giannoni, C., White, S., Kayser, E. F. Does dexamethasone with preemptive analgesia improve pediatric tonsillectomy pain? Otolaryngology – Head and neck surgery, 2002, 126, 3, p. 307–317.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2011 Issue 3-
All articles in this issue
- Úskalí pooperační péče po výkonech na krčních tepnách
- Serotoninergní syndrom – kazuistika
- Svalová slabost kriticky nemocných
-
Zajištění dýchacích cest – souhrny přednášek
Praha 11. 11. 2010 - Etorikoxib v premedikaci před tonzilektomií
- Intraoseální přístup do cévního řečiště při transplantaci jater
- Koncept ideální supraglotické pomůcky
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Svalová slabost kriticky nemocných
- Serotoninergní syndrom – kazuistika
-
Zajištění dýchacích cest – souhrny přednášek
Praha 11. 11. 2010 - Úskalí pooperační péče po výkonech na krčních tepnách
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


