-
Medical journals
- Career
Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
Authors: Kunstýř Jan 1; Lipš Michal 1; Bělohlávek Jan 2; Prskavec Tomáš 3; Mlejnský František 3; Koucký Michal 4; Sebroň Václav 4; Stříteský Martin 1; Bartáková Hana 1; Balík Martin 1
Authors‘ workplace: Klinika anestezie, resuscitace a intenzivní medicíny, VFN Praha 1; II. interní klinika, VFN Praha 2; II. chirurgická klinika kardiovaskulární chirurgie, VFN Praha 3; Gynekologicko-porodnická klinika, VFN Praha 4
Published in: Anest. intenziv. Med., 21, 2010, č. 5, s. 258-261
Category: Intesive Care Medicine - Case Report
Overview
Autoři popisují případ těhotné pacientky, která byla hospitalizována ve 22. týdnu těhotenství s těžkým ARDS na podkladě plicní infekce virem H1N1. Konvenční léčba byla neúčinná a agresivní ventilace vedla navíc k barotraumatu, proto byla nemocná připojena na venovenózní mimotělní membránovou oxygenaci (Extracorporeal Membrane Oxygenation – ECMO). Pacientka 30 hodin po připojení na ECMO spontánně porodila. Porod, kromě přechodného vysazení heparinu, nevyžadoval jinou změnu ve strategii vedení ECMO. V diskusi autoři komentují specifika ECMO léčby u těhotných pacientek a zmiňují také přínos použití komplexní ultrazvukové diagnostiky.
Klíčová slova:
mimotělní membránová oxygenace – ARDS – chřipka typu A – porodÚvod
Randomizovaná klinická studie CESAR publikovaná v roce 2009 [1] a zkušenosti z různých pracovišť na celém světě s nedávno proběhlou pandemií infekce virem H1N1 [2] oživily diskusi o úloze mimotělní membránové oxygenace (Extracorporeal Membrane Oxygenation – ECMO) v léčbě těžkého syndromu dechové tísně dospělých (ARDS). V australské studii, prezentující soubor 68 pacientů s respiračním selháním při infekci H1N1 léčených touto metodou [2], byl medián věku 34 roků (26–43), 6 z nich byly těhotné ženy (9 %) a 4 ženy v šestinedělí (6 %). Autoři dalších prací zaměřených na těhotné pacientky s H1N1 infekcí také uvádějí významně zvýšenou četnost závažných komplikací u této skupiny nemocných [3–6]. V naší kazuistice popisujeme případ těhotné pacientky, u které selhala konvenční ventilační strategie léčby ARDS a následně byla předána do našeho ECMO centra. Během mimotělní oxygenace spontánně předčasně porodila na jednotce intenzivní péče.
Kazuistika
Žena (26 let) bez anamnézy chronického onemocnění byla ve 22. týdnu gravidity přijata s oboustrannou pneumonií a globální respirační insuficiencí na resuscitační oddělení spádové nemocnice. Byla zaintubována a připojena na umělou plicní ventilaci (UPV) s agresivním režimem. V bronchoalveolární laváži a ve výtěru nosohltanu byl zachycen virus influenza A subtyp H1N1, a proto byla zahájena cílená antivirotická léčba oseltamivirem a zanamivirem. Při výměně centrální žilní kanyly došlo k iatrogennímu pneumotoraxu (PNO), který vyžadoval drenáž. Nemocná byla tracheostomována a pro suspektní bakteriální superinfekci jí byla cíleně nasazena antibiotika (piperacilin s tazobaktamem a vankomycin). Komplexní léčba s opakovanou pronační polohou nevedla ke zlepšení, a proto byla nemocná po 16 dnech UPV přeložena na naše pracoviště k ECMO.
Při příjmu byla hluboce sedována, febrilní – 39,3 °C, opocená, s hyperkinetickou cirkulací (sinusový rytmus 140/min, tlak 145/100 mm Hg), bez farmakologické podpory oběhu. Režim UPV: Bilevel 22/14 cm H2O, Vt 127–400 ml, MV 13,5 l . min-1, FiO2 0,8. Saturace na pulzním oxymetru (SpO2) se pohybovala v rozmezí 85–92 % a parciální tlak oxidu uhličitého (PaCO2) v arteriální krvi byl 76 mm Hg, parciální tlak kyslíku (PaO2) v arteriální krvi byl 65 mm Hg, pH 7,37, BE 15,9 mmol . l-1, laktát 1,3 mmol . l-1. Murray skóre měla 3,75, SOFA 11, APACHE II 37 a její predikovaná mortalita byla 87%. Příjmový skiagram hrudníku ukázal difuzní oboustranné nehomogenní infiltrace plicního parenchymu. Vzdušné byly zachovány pouze vrcholy plic.
Po konsenzuálním rozhodnutí nemocničního ECMO týmu (kardiolog, kardiochirurg, anesteziolog/intenzivista, perfuzionista) byla nemocná krátce po přijetí napojena na venovenózní ECMO. Drenážní kanyla 24 F cestou v. femoralis i návratová kanyla 20 F (obě Duraflo Edwards Lifesciences, Irvine, CA, USA) cestou v. jugularis interna vpravo byly zavedeny perkutánně a spojeny s oxygenátorem Maquet PLS v uzavřený systém poháněný centrifugálním čerpadlem Maquet Rotaflow RF32 (Maquet Cardiopulmonary AG, Hirrlingen, Germany). Místa punkce, umístění zavaděčů i polohy konců kanyl byly ověřeny sonograficky, respektive echokardiograficky (konec drenážní kanyly při vyústění dolní duté žíly do pravé síně a konec přítokové kanyly v horní duté žíle). Průtok krve byl nastaven na 5–6 l . min-1 a nemocná byla antikoagulována kontinuální infuzí nefrakcionovaného heparinu v takové dávce, aby bylo dosaženo hodnoty aktivovaného času srážení (ACT) 160–180 s, respektive aktivovaného parciálního trombinového času (APTT) 60 s. Po zahájení podpory došlo k okamžitému zlepšení oxygenačních i oběhových parametrů, což umožnilo zásadní snížení agresivity ventilačního režimu. Nemocná spontánně ventilovala frekvencí 10–14 dechů/min na tlakové podpoře 12 H2O s PEEP 10 cm H2O a FiO2 0,4. Vrcholové tlaky v dýchacích cestách dosahovaly hodnot do 24 cm H2O, Vt 300–350 ml a SpO2 94–96 %. Transezofageální echokardiografické vyšetření (TEE) prokázalo normální funkci levé komory, dilataci pravé komory a lehkou plicní hypertenzi se systolickým tlakem 45–50 mm Hg. Podle hrudního ultrazvukového (USG) vyšetření byl vedle plicního intersticiálního syndromu (obr. 1) přítomen i ventrální pneumotorax vpravo a nevýznamný druhostranný fluidotorax (cca 300–400 ml). Pneumotorax byl drenován, nicméně opakovaným USG byl intermitentně detekován, což potvrdilo CT plic (obr. 2), a regredoval definitivně až po aplikaci podtlaku 30 cm H2O a zlepšení compliance plíce. Fluidotorax jsme monitorovali USG a punktovali na ECMO až 6. den po příjmu, když dosáhl významného množství (1000 ml).
Obr. 1a, b. Obraz B linií levé plíce ventrálně (šipky) – konzistentní se zmnožením plicní vody ve smyslu plicního intersticiálního syndromu Vlevo phased array sonda, vpravo lineární sonda a definitivní vyloučení ventrálního pneumotoraxu, B linie jsou patrné i při malé hloubce zobrazení. 
Image 1. CT plic – extenzivní parenchymové konsolidace s negativním bronchogramem a ventrálním pneumotoraxem vpravo (bílá šipka) Pneumotorax přetrvával i přes správnou polohu hrudního drénu. Je patrný také hrudní výpotek vlevo před drenáží (tmavá šipka). 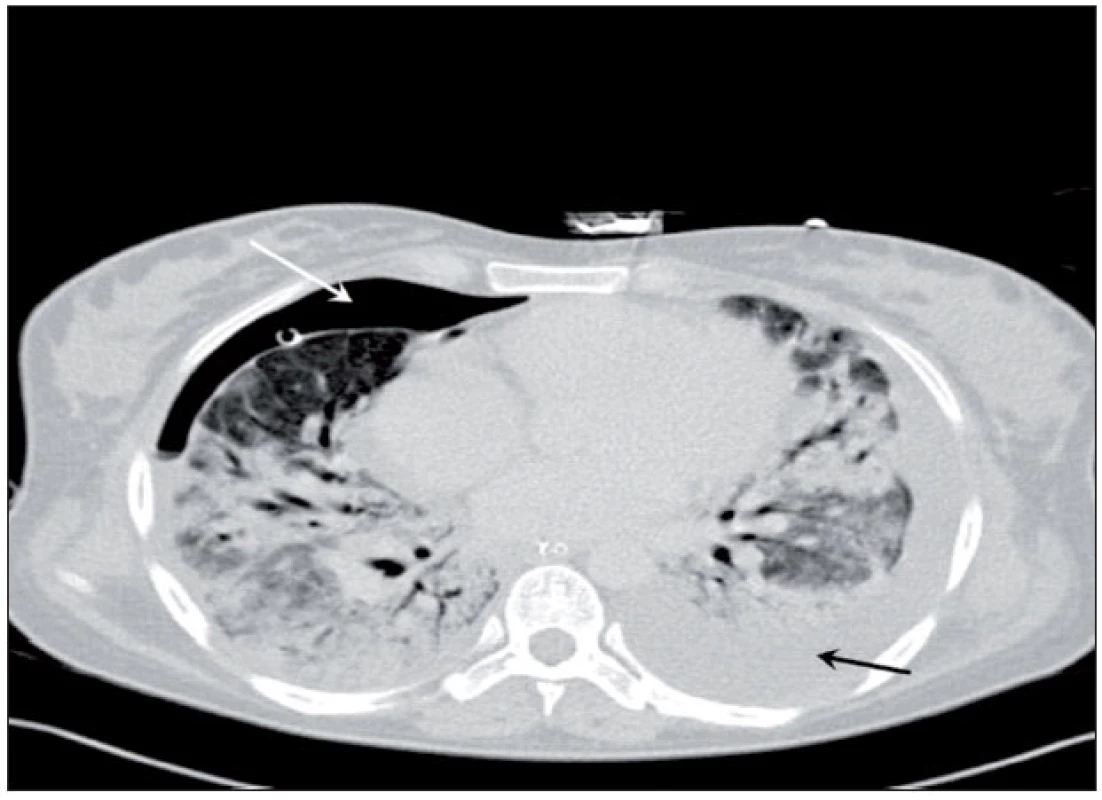
Gynekolog podle klinického a USG vyšetření konstatoval, že v děloze se nachází živý plod v labilní poloze s pravidelnou srdeční akcí. Placenta byla na přední děložní stěně bez známek odlučování a množství plodové vody bylo přiměřené. Monitorování děložní činnosti a ozev plodu nebylo pro časnou fázi gravidity indikováno. Následující den po přijetí na naše oddělení a 30 hodin po připojení na ECMO došlo ke spontánnímu předčasnému porodu (SPP), na který byl ošetřující personál upozorněn zvýšeným neklidem nemocné. Současně byly přítomné nespecifické známky zánětu – febrilie a tachykardie. Porozené, extrémně nezralé děvče bylo hypotonické, bez cyanózy, bradykardické (cca 60–70/min) a dýchalo lapavě. Vážilo 635 g, měřilo 32 cm a obvod hlavičky byl 21 cm. Novorozence jsme odsáli z dýchacích cest a zahájili nepřímou srdeční masáž s dýcháním z úst do úst, protože jednotka intenzivní péče pro dospělé není technicky vybavena pro léčbu novorozenců. Ve 20. minutě života byla dívka zaintubována akutně přivolanými neonatology, kteří ji aplikovali surfaktant intratracheálně.
Od chvíle, kdy bylo zjištěno, že porod probíhá, byl ukončen heparin. ACT měřený těsně po porodu byl 177 s. Po vybavení plodu byla podána uterotonika ve standardní dávce, 4 jednotky erytrocytární masy a 3 jednotky zmrazené plazmy. Pacientka byla v průběhu porodu i po něm oběhově stabilní. Bezprostředně po porodu u ní došlo k dalšímu zlepšení oxygenace. SPP neměl vliv na činnost ECMO, ani si nevyžádal zásadní změny v jeho nastavení. Kontinuální podávání heparinu bylo obnoveno za 3 hodiny, po opakovaném USG vyšetření a vyloučení děložního krvácení. V té době klesla hodnota ACT na 160 s.
V dalším průběhu byla nemocná denně echokardiograficky a ultrasonograficky monitorována se zaměřením na zhodnocení stavu plic a pleurálních dutin. Vyšetření žil odhalilo trombózu pravé cefalické žíly. Nozokomiální superinfekce (Pseudomonas, Stenotrophomonas, Enterobacter, Candida v dýchacích cestách a moči) byla léčena podle citlivosti (postupně tigecyklin, sulfametoxazol + trimethoprim, nebulizovaný colistin, primothren, fluconazol, amikin, piperacilin s tazobaktamem). Nemocná podstoupila opakovanou diagnostickou a terapeutickou bronchoskopii, mj. pro hemoragickou bronchitidu. Při postupném zlepšování laboratorních ukazatelů i klinického stavu byla po 15 dnech odpojena z ECMO a následně po 18 dnech i od UPV. Tracheostomická kanyla byla odstraněna 22. den hospitalizace na našem oddělení.
Novorozená dívka byla 3 hodiny po transportu na neontologickou jednotku intenzivní péče (NJIP) extubována a dále ventilovala s podporou CPAP zvýšenou frakci kyslíku (FiO2 0,3). Nicméně, pro progresi respirační dysfunkce jí byla aplikována v 50. hodině života druhá dávka surfaktantu a od 5. do 7. dne byla pro vyšší frekvenci apnoí opět intubována a připojena na UPV. Její tělesný vývoj byl symetrický a eutrofický – hodnoty odpovídaly 50. percentilu ve 24. postmenstruačním týdnu. Během 7týdenního pobytu na NJIP byla léčba komplikována krvácením do GIT. V horních dýchacích cestách a tracheálním sekretu byl 5. den života metodou PCR prokázán vir influenza A subtyp H1N1. Předchozí vyšetření z 1. dne, následující z 2. týdne života, stejně jako všechny hemokultury byly PCR negativní. Od 4. týdne až do propuštění z NJIP dívka prospívala a její vývoj byl přiměřený extrémní nezralosti. Nyní, v pátém měsíci života, váží 4250 g a její vývoj odpovídá věku. Matka plně zvládá péči o rodinu a jednou týdně dochází ambulantně na rehabilitaci.
Diskuse
I přes nedávno publikované slibné výsledky studie CESAR [1], zůstává zatím ECMO mimo postupy doporučené v léčbě pacientů s nejtěžší formou ARDS [7]. Nedávno proběhlá pandemie H1N1 tak jistě přináší důvody k zamyšlení nad racionálním indikováním ECMO u závažného ARDS způsobeného virovou pneumonitidou, kdy jsou možnosti konvenční ventilace omezené a kdy může být použití této léčby život zachraňující. Dobré výsledky lze očekávat u pacientů, u kterých nepřekročí doba agresivní UPV více než 7 dní [1, 2].
Podle dostupných studií [1, 2] a informací z registru The Extracorporeal Life Support Organisation (www.elso.med.umich.edu) byla prognóza naší pacientky spíše nepříznivá, jelikož byla přemístěna na naše pracoviště pozdě. Indikační kritéria k ECMO jsou u těhotných žen stejná jako u ostatních pacientů. Vzhledem k tomu, že těhotenství je rizikový faktor závažného průběhu ARDS vzniklého na podkladě virové pneumonitidy [2–6], lze předpokládat, že v úvahách o strategii léčby můžeme v konkrétních případech častěji počítat s možností připojit na ECMO i gravidní ženy. U naší nemocné hrála roli při rozhodování o zahájení podpory její negativní anamnéza a také skutečnost, že již byla matkou pětileté dcery.
Vzhledem k použití heparinem potažených komponent okruhu a vysokým průtokům jsme neměli obavu z přerušení systémové heparinizace v peripartálním období. Hodnoty ACT neklesly k normě ani po 3 hodinách po přerušení antikoagulace heparinem, nicméně pravděpodobně díky fyziologické hyperkoagulaci nedošlo k masivnímu děložnímu krvácení. Hemodynamická a oxygenační situace, rovněž i stav vnitřního prostředí se významně zlepšily po zahájení podpory. Dobrou situaci plodu doložil i normální USG nález. Zůstává tedy otázkou, co bylo příčinou spuštění SPP a zda bylo možné tuto situaci včas zachytit.
U naší pacientky se mohly uplatnit jako možné příčiny SPP: deciduální krvácení, předčasná fetální endokrinní aktivita vyvolaná stresem, intrauterinní infekce nebo systémový zánět [8]. Tyto příčiny mohou existovat společně a kulminovat týdny, než se projeví SPP [9]. Febrilie a zánětlivá reakce jsou velmi silnými podněty ke SPP, zejména u těhotných s pneumonií při pandemické H1N1 chřipce A, což je spojeno s vysokou fetální i neonatální morbiditou a mortalitou [2–6]. Například v sérii 43 případů H1N1 infekce u těhotných žen sledovaných mezi květnem a červencem v australském státě Victoria, bylo zaznamenáno jedno úmrtí matky, 2 porody mrtvého plodu a 1 úmrtí novorozence [6].
Rutinní kardiotokografii považujeme za méně vhodnou metodu monitorování před 30. týdnem gravidity, především vzhledem k časté falešné pozitivitě i negativitě záchytu distressu plodu i predikci hrozícího SPP [10]. Subjektivní hodnocení, bohužel, v případě hluboce sedovaných pacientek, využít nelze. Domníváme se, že pro zachycení známek fetálního disstresu a případně i nastupujícího SPP u těhotných pacientek na ECMO, je použitelné každodenní USG vyšetření plodu a cervikometrie, popř. vyšetření fetálního fibronektinu (FFN) z vaginálního sekretu. FFN odráží lokální změny porodních cest a má vysokou negativní prediktivní hodnotu SPP – až 95% [11].
Komplexní USG diagnostiku považujeme obecně u pacientů na JIP a tím spíše těch indikovaných k mimotělní podpoře za velmi přínosnou. Jednak umožní nejen bezpečnou punkci, ale i výběr optimálních velikostí kanyl a případně predikci potřeby dalšího vstupu k zajištění dostatečného průtoku ECMO. Echokardiografická kontrola polohy konců kanyl je důležitá pro dosažení dostatečného průtoku a minimalizaci recirkulace, která snižuje účinnost metody. Rovněž je nepochybný význam USG kontroly při kanylacích centrálních žil u antikoagulovaných pacientů či pravidelného monitorování hrudníku pro diagnostiku významných fluidotoraxů a pneumotoraxů [12, 13], jejichž evakuace, respektive drenáž může mít významný vliv jak na hemodynamiku, tak na léčbu ARDS. Konečně žilní USG monitorování umožní časnou diagnózu trombózy a navede ošetřující lékaře k prohloubení antikoagulační léčby či případně k zavedení kaválního filtru.
Závěr
Těhotenství představuje nezávislý rizikový faktor závažného průběhu ARDS vzniklého na podkladě virové pneumonitidy [2–5] a vzhledem ke zkušenostem z jiných pracovišť není použití venovenózního ECMO u těhotných pacientek výjimečné. Ošetřující tým by měl být technicky i personálně připraven na monitorování plodu, uteroplacentární jednotky a případnou rychlou progresi SPP. V posledních týdnech gravidity lze v případě porodu na mimotělní podpoře jistě očekávat ze strany matky mnohem závažnější cirkulační i ventilační odezvu vyžadující podstatnější změny ve vedení ECMO, než tomu bylo u naší nemocné.
Došlo dne 26. 5. 2010.
Přijato dne 6. 7. 2010.
Adresa pro korespondenci:
MUDr. Jan Kunstýř
KARIM VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: kunstyr.jan@vfn.cz
Sources
1. Peek, G. J., Mugford, M., Tiruvoipati, R. et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet, 2009, 374, p. 1351–1363.
2. Davies, A., Jones, D., Balley, M. et al (The Australia and New Zealand Extracorporeal Membrane Oxygenation Influenza Investigators) Extracorporeal Membrane Oxygenation for 2009 influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA, 2009, 302, 17, p. 1888–1895.
3. Seppelt, I. et al. Critical illness due to 2009 A/H1N1 influenza in pregnant and postpartum women: population based cohort study. BMJ, 2010, 340, p. 1279.
4. Lapinsky, S. E. H1N1 novel influenza A in pregnant an immunocompromised patients. Crit. Care Med., 2010, 38, p. e52–57.
5. Siston, A. M. et al. Pandemic influenza A (H1N1) virus illness among pregnant women in the United States. JAMA, 2010, 303, p. 1517–1525.
6. Hewagama, S., Walker, S. P., Stuart, R. L. et al. 2009 H1N1 Influenza A and Pregnancy Outcomes in Victoria, Australia. Clin. Infect. Dis., 2010, 50, p. 686–690.
7. Wheeler, A. P., Bernard, G. R. Acute lung injury and the acute respiratory distress syndrome: a clinical review. Lancet, 2007, 369, p. 1553–1565.
8. Simhan, N. H., Cartinis, S. N. Prevention preterm delivery. N. Engl. J. Med., 2007, 357, p. 477–487.
9. Lockwood, C. J., Kuczynski, E. Risk stratification and pathological mechanisms in preterm delivery. Paediatr. Perinat. Epidemiol., 2001, 15, Suppl 2, p. 78–89.
10. Hájek, Z. a kol. Rizikové a patologické těhotenství. Praha: Grada 2004.
11. Sanchez-Ramos, L., Delke, I., Zamora, J., Kaunitz, A. M. Fetal fibronectin as a short-term predictor of preterm birth in symptomatic patients: a meta-analysis. Obstet. Gynecol., 2009, 114, 3, p. 631–640.
12. Balik, M., Plasil, P., Waldauf, P., Pazout, J., Fric, M., Otahal, M., Pachl, J. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med., 2006, 32, 2, p. 318–321.
13. Guillorya, R. K., Gunter, O. L. Ultrasound in the surgical intensive care unit. Current Opinion in Critical Care, 2008, 14, p. 415–422.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 5-
All articles in this issue
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
- Efekt časného nasazení vysokofrekvenční oscilace v léčbě dětí s respiračním selháním
- Pacienti s pandemickou chřipkou A (H1N1) 2009 v intenzivní péči
- Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
- Efekt časného nasazení vysokofrekvenční oscilace v léčbě dětí s respiračním selháním
- Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

