-
Medical journals
- Career
Dynamické parametry preloadu při ventilaci tlakovou podporou
: Suk Pavel; Zvoníček Václav; Pavlík Martin; Štětka Pavel; Šrámek Vladimír
: Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny a Masarykova univerzita, Brno
: Anest. intenziv. Med., 20, 2009, č. 3, s. 137-142
: Intensive Care Medicine - Original Paper
Cíl studie:
Ověřit spolehlivost variací pulzního tlaku (PPV) a tepového objemu (SVV) v předpovědi reakce na podání tekutiny u pacientů ventilovaných v režimu tlakové podpory (PSV) a určit závislost respiračních změn plnících tlaků na tlaku pleurálním.Typ studie:
Prospektivní klinická studie.Typ pracoviště:
Multioborové resuscitační oddělení univerzitní nemocnice.Materiál a metoda:
Pacienti se sinusovým rytmem na PSV, u kterých byl měřen srdeční index (CI) termodilucí. Arteriální, centrální venózní tlak (CVP) a tlaky v plicnici včetně tlaku v zaklínění (PAOP) byly zaznamenány a bylo vypočteno: PPV, SVV, inspirační pokles CVP (∆CVP) a PAOP (∆PAOP). Jícnový tlak (Pes) byl sledován balonkovým katétrem. Tekutinový test: 500 ml HES během 30 minut. Data – medián a rozsah mezi kvartily.Výsledky:
17 pacientů, 2 vyřazeni pro novou fibrilaci síní. Po podání tekutiny byl trend ke zvýšení CI z 4,6 l . min-1 . m-2 (3,4–5,6 l . min-1 . m-2) na 4,9 l . min-1 . m-2 (3,6–6,1 l . min-1 . m-2), p = 0,098. Pozitivní odpověď na tekutiny (vzestup CI > 10 %) byla v 6 případech. PPV se nelišilo mezi pacienty reagujícími 6,7 % (2,7–13,8 %) a nereagujícími 6,3 % (4,3–9,0 %) na tekutiny (p = 0,851); pro SVV 11,3 % (6,1–17,4% ) versus 9,1 % (5,5 až 12,8 %), p = 0,64. ∆Pes byl 17 cm H2O (7–19 cm H2O). Korelace ∆PAOP a ∆Pes: r2 = 0,69; p < 0,001, pro ∆Pes a ∆CVP: r2 = 0,53; p < 0,001.Závěr:
U pacientů na PSV selhaly PPV a SVV v předpovědi reakce na podání tekutin. ∆PAOP a orientačně i ∆CVP lze použít k odhadu změn pleurálního tlaku.Klíčová slova:
interakce srdce-plíce – ventilace tlakovou podporou – variace pulzního tlaku – variace tepového objemu – srdeční výdej – tlak v zaklíněníÚvod
Podání tekutin je základním opatřením pro stabilizaci hemodynamiky. Doporučovaným postupem je tzv. tekutinová výzva – podání definovaného množství tekutiny během krátkého času. Terapeutickým cílem je zvýšení srdečního výdeje – jako pozitivní odpověď je hodnoceno zvýšení srdečního indexu (cardiac index, CI) alespoň o 10 %. Ke zvýšení srdečního výdeje po podání bolusu tekutiny však dochází přibližně u poloviny pacientů [1, 2]. U ostatních nemocných může být naopak podání tekutiny spojeno s objemovým přetížením.
Statické parametry předtížení, a to jak plnící tlak pravé komory (centrální žilní tlak – CVP), tak levé komory (tlak v zaklínění v plicnici – PAOP), selhaly v předpovědi reakce na podání tekutin u pacientů na řízené ventilaci [1, 2]. Situace u pacientů se spontánní dechovou aktivitou je podobná – ani CVP, ani PAOP není spolehlivý parametr preloadu [3]. Jediným užitečným parametrem se zdá inspirační pokles CVP, jak prokázal Magder ve své práci již v roce 1992 [4].
Pro určení potřeby tekutin je výhodnější využití dynamických parametrů preloadu, které vznikají interakcí mezi plícemi a srdcem. Při řízené ventilace dochází k ovlivnění preloadu i afterloadu obou srdečních komor, a tím i tepového objemu. V důsledku toho dochází ke vzestupu tepového objemu levé komory během inspiria a k poklesu v exspiriu. Vzhledem k tomu, že tepový objem levé komory je hlavní determinantou arteriálního tlaku, dochází k jeho variacím v průběhu dechového cyklu. Variace jednak systolického, ale hlavně pulzního tlaku (PPV – pulse pressure variation) [5] a tepového objemu stanoveného analýzou arteriální křivky (SVV – stroke volume variation) [6] umožňují při respektování omezení spolehlivě rozpoznat, kteří pacienti budou reagovat na objemovou expanzi vzestupem srdečního výdeje.
Uvedené parametry prokázaly svou spolehlivost při předpovědi reakce na podání tekutiny u řízeně ventilovaných nemocných bez spontánní dechové aktivity, případně po podání svalových relaxancií. Naší snahou je však pacienty co nejméně tlumit a naopak zachovat u nich co největší podíl spontánního dýchání. U některých pacientů jde o spouštění dechů, pacienti ventilovaní v režimu tlakové podpory (PSV – pressure support ventilation) se podílí i na průběhu inspiria a cyklování. Zda lze využít interakcí srdce-plíce u těchto nemocných, není jasné.
Cílem práce bylo ověřit, zda lze PPV a SVV během podpůrné ventilace využít k předpovědi reakce na podání tekutiny. Dalším úkolem bylo zhodnotit závislost ventilací vyvolaných změn CVP a PAOP na ezofageálním tlaku a jejich význam v predikci odpovědi na tekutiny.
Soubor pacientů a metoda
Prospektivní klinická studie byla schválena nemocniční etickou komisí. Vzhledem k poruše vědomí zkoumaných pacientů byl písemný informovaný souhlas získán od nejbližších příbuzných. Do studie byli zařazeni pacienti ventilovaní v režimu tlakové podpory, u kterých bylo zvažováno provedení tekutinové výzvy. Byla stanovena následující vylučovací kritéria: jiný než sinusový rytmus, více než 2 extrasystoly za minutu, klinické známky interference s ventilátorem, patologie jícnu (nemožnost zavedení ezofageálního katétru), nesouhlas nejbližších příbuzných, tlak v zaklínění > 20 mm Hg.
Monitorování: Všichni pacienti měli zaveden arteriální katétr a kontinuálně měřený arteriální tlak. Převaděče byly vynulovány na střed hrudníku. Dávka vazopresorů (noradrenalin) byla upravována, aby se střední arteriální tlak (MAP) udržel ± 10 % od hodnoty na začátku protokolu. Hemodynamika byla sledována plicnicovým katétrem (monitor S/5, GE Healthcare, Velká Británie) nebo systémem PiCCO (Pulsion, Německo). Srdeční výdej byl měřen (transpulmonální) termodilucí. Měření proběhlo třikrát a synchronizovaně s dechovým cyklem (indikátor byl podán na začátku exspiria). Chybná měření byla vyřazena, odchylka ostatních byla do 10 %, v případě většího rozptylu byl počet měření zvýšen na 5. Srdeční výdej byl vypočten jako průměr z kvalitních měření. Hodnoty ze spirometrie (modul Spiro2, GE Healthcare, Velká Británie), arteriální, centrální venózní (CVP) a případně plicnicový tlak včetně tlaku v zaklínění (PAOP) byly zaznamenány softwarem S/5 Collect (GE Healthcare, Velká Británie) do počítače pro následnou analýzu. Všichni nemocní byli napojeni na ventilátor Avea (Viasys Healthcare, USA). Nastavení PSV byla ponechána podle ošetřujícího lékaře, pouze trigger byl nastaven na 1 l . min-1. Pro měření jícnového tlaku (Pes) byl zaveden do jícnu speciální katétr SmartCath (Viasys Healthcare, USA) s balonkem naplněným vzduchem. Správná poloha byla ověřena inspiračním okluzním testem. Principem je fakt, že při okluzi dýchacích cest během inspiria je výchylka Pes shodná se změnou tlaku v dýchacích cestách (Paw). Pro zařazení do studie byla vyžadována alespoň 80% shoda (ΔPes/ΔPaw > 0,8) [7].
Protokol studie: Po zavedení monitorování bylo provedeno měření základních hodnot. Následně bylo podáno 500 ml hydroxyetylškrobu 130/0,4 během 30 minut. Ihned po dokapání infuze byla měření zopakována. Za pozitivní reakci na tekutiny je považováno zvýšení srdečního výdeje minimálně o 10 %.
Analýza: Analýza křivek byla provedena pomocí softwaru Windaq Waveform Browser verze 2.46 (DataQ Instruments, USA). Ve 3 po sobě následujících dechových cyklech byly změřena minimální a maximální hodnota pulzního tlaku (rozdíl maximálního a minimálního arteriálního tlaku) a tepového objemu (plocha pod arteriální křivkou nad diastolickým tlakem v průběhu systoly). Hodnoty PPV a SVV byly vypočteny podle vzorce:
variace = (max – min)/[ (max + min)/2 ].
Metodika měření inspiračního poklesu plnících tlaků – inspirační pokles CVP (ΔCVP) a inspirační pokles PAOP (ΔPAOP) – je na obrázku 1. Výsledné hodnoty byly vypočteny jako aritmetický průměr ze 3 dechových cyklů.
1. Metodika měření inspiračního poklesu CVP a PAOP 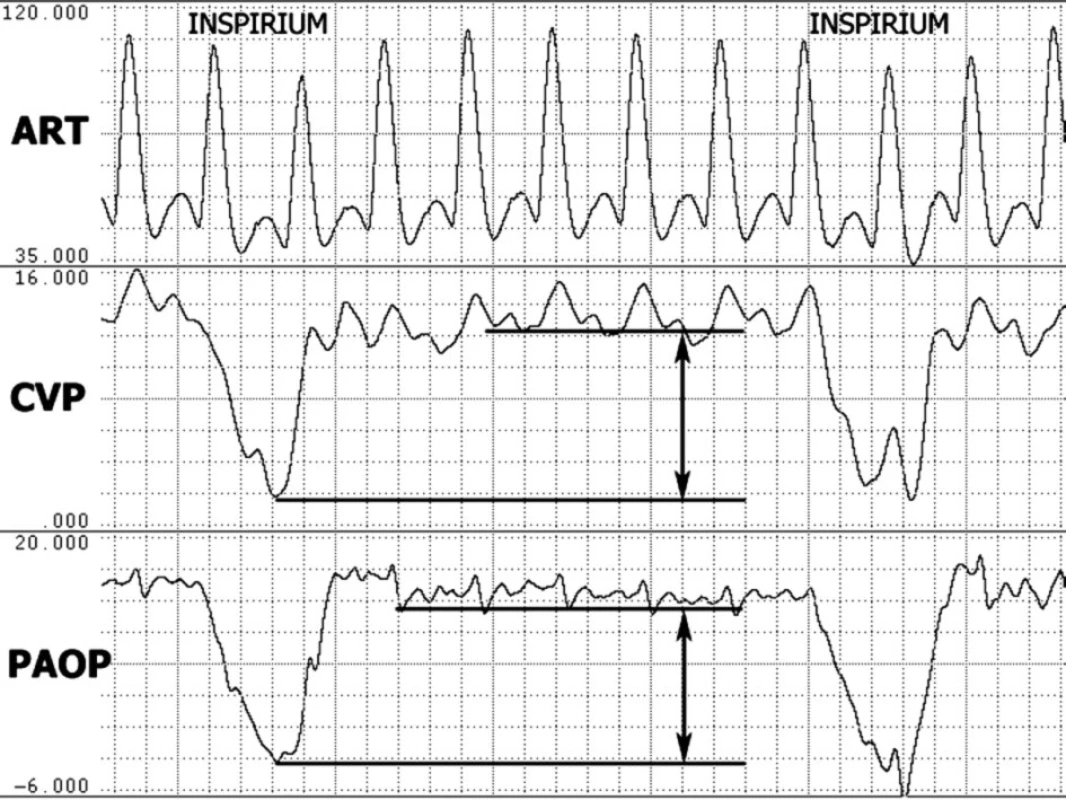
Statistika: Data jsou uvedena jako medián a rozsah mezi kvartily. Pro shodu proměnných byla použita korelace a lineární regrese. Rozdíly mezi skupinami a vývoj v čase byly porovnány odpovídajícím neparametrickým testem (Mannův-Whitneyův U-test a Wilcoxonův párový test). Hodnota p < 0,05 je považována za statisticky významnou.
Výsledky
Do studie bylo zařazeno celkem 17 pacientů. Dva byli vyloučeni pro nově vzniklou fibrilaci síní v průběhu měření, proto je dále hodnoceno 15 nemocných ve věku 63 let (33 – 84 let), 11 mužů a 4 ženy. U 3 pacientů byly provedeny 2 tekutinové testy po sobě. U třech pacientů, kterým byl srdeční výdej měřen systémem PiCCO, není dostupný tlak v zaklínění.
Po podání tekutiny byl trend ke zvýšení CI z 4,6 l . min-1 . m-2 (3,4–5,6 l . min-1 . m-2 na 4,9 l . min -1. m-2 (3,6–6,1 l . min-1 . m-2), p = 0,098. Pozitivní odpověď na bolus tekutiny byla zaznamenána v 6 případech (33,3 %). Všechny 3 opakované tekutinové testy skončily negativně. Třináct nemocných (86,7 %) vyžadovalo podporu oběhu noradrenalinem. Dávka noradrenalinu po podání tekutiny poklesla z hodnoty 0,10 µg . kg . min-1 (0,00–0,19 µg . kg-1 . min-1) na 0,06 µg . kg-1 . min-1 (0,00–0,16 µg . kg-1 . min-1), p < 0,01.
Hodnoty PPV se nelišily mezi pacienty, kteří reagovali – 6,7 % (2,7–13,8 %) a nereagovali – 6,3 % (4,3 až 9,0 %) na podání tekutiny (p = 0,851; obr. 2). Podání tekutiny snížilo hodnotu PPV z 6,3 % (3,8–9,6 %) na 4,3 % (2,4–6,7 %), p = 0,025. Podobně nebyl nalezen rozdíl u SVV: 11,3 % (6,1–17,4 %) u pozitivní a 9,1 % (5,5–12,8 %) u negativní reakce na tekutiny (p = 0,64; obr. 3). Podobně jako u PPV byl zaznamenán trend k poklesu SVV před 9,1 % (6,1–15,9 %) a po podání tekutiny 7,5 % (3,5–10,5 %), p = 0,078. Korelace mezi změnou srdečního výdeje a PPV (r2 = 0,29) a SVV (r2 = 0,21) je slabá. Nebyla prokázána ani závislost PPV a SVV se sledovanými ventilačními parametry – dechovým objemem (r2 = 0,18 a r2 = 0,17) a inspiračním poklesem Pes (r2 = 0,19 a r2 = 0,15).
2. Hodnoty PPV u pacientů s pozitivní a negativní odpovědí na tekutiny 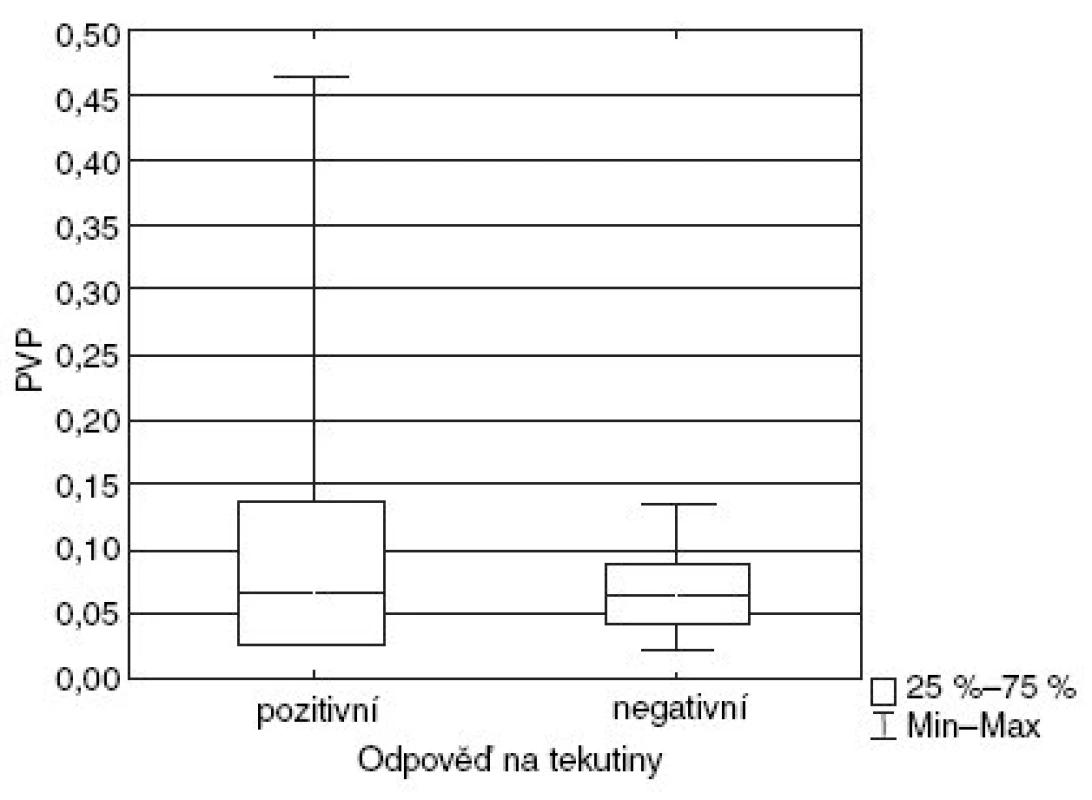
3. Hodnoty SVV u pacientů s pozitivní a negativní odpovědí na tekutiny 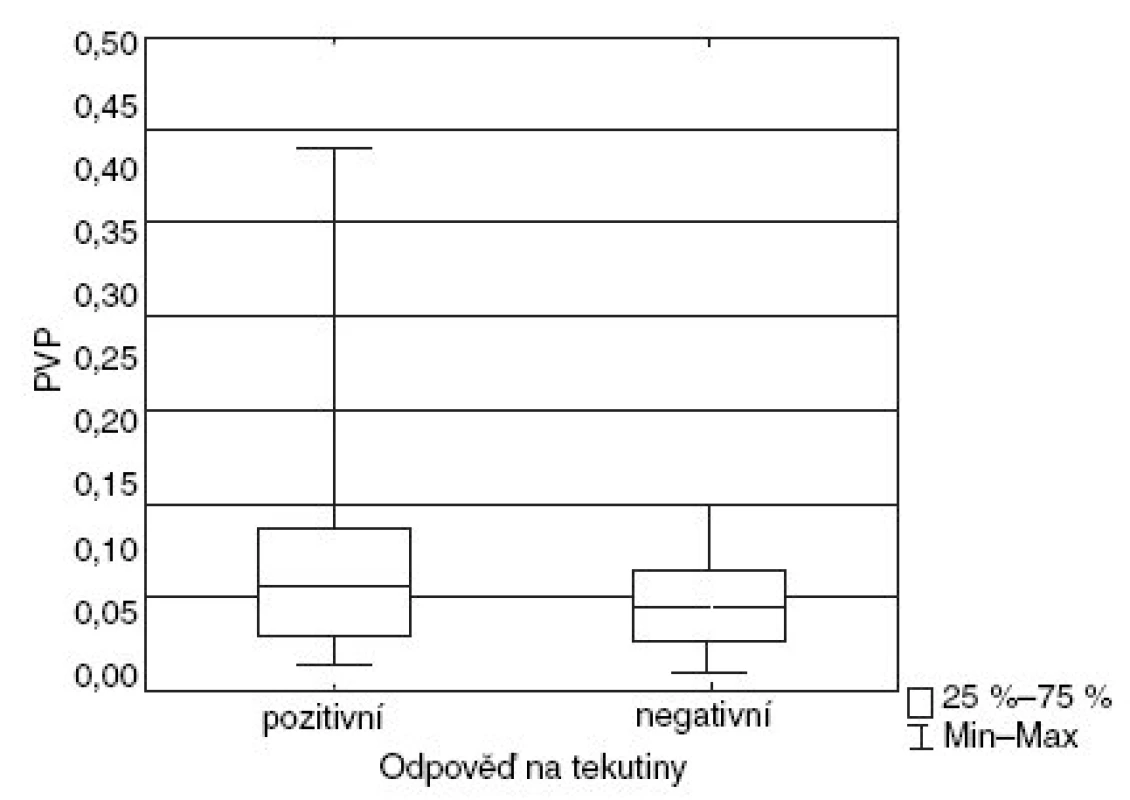
Plnící tlaky nebyly přínosné pro hodnocení preloadu. CVP se nelišilo mezi pacienty s pozitivní 11 mm Hg (10–14 mm Hg) a negativní 11 mm Hg (9–14,5 mm Hg) odpovědí na tekutiny (p = 0,64). Podobná je i výpovědní hodnota plnících tlaků levé komory – PAOP: 15 mm Hg (14–16 mm Hg) versus 16,5 mm Hg (11–18 mm Hg), p = 0,58. Inspirační pokles CVP (∆CVP) byl srovnatelný u pacientů s pozitivní 6,4 mm Hg (2,2–11,1 mm Hg) a negativní 5,4 mm Hg (3,5–9,5 mm Hg) reakcí na tekutinu (p = 0,95). Stejná situace byla u ∆PAOP: 12,9 mm Hg (12,7–20,9 mm Hg) vs 15,4 mm Hg (10,9–21,9 mm Hg), p = 0,81.
Většina z 15 sledovaných nemocných měla výrazně dechové úsilí: inspirační pokles Pes (ΔPes) byl 17 cm H2O (7–19 cm H2O). Pouze ve 2 případech nebyla dechová aktivita (tj. negativní výchylka Pes) přítomna během celého inspiria. Pro hodnocení inspiračního úsilí byly hodnoceny inspirační poklesy plnících tlaků. Změny PAOP dobře korelovaly s ΔPes: r2 = 0,69; p < 0,001, lineární regrese:
Pes = 0,3 + 0,7155 × PAOP cm H2O (obr. 4).
4. Závislost mezi inspiračním poklesem PAOP a jícnového tlaku 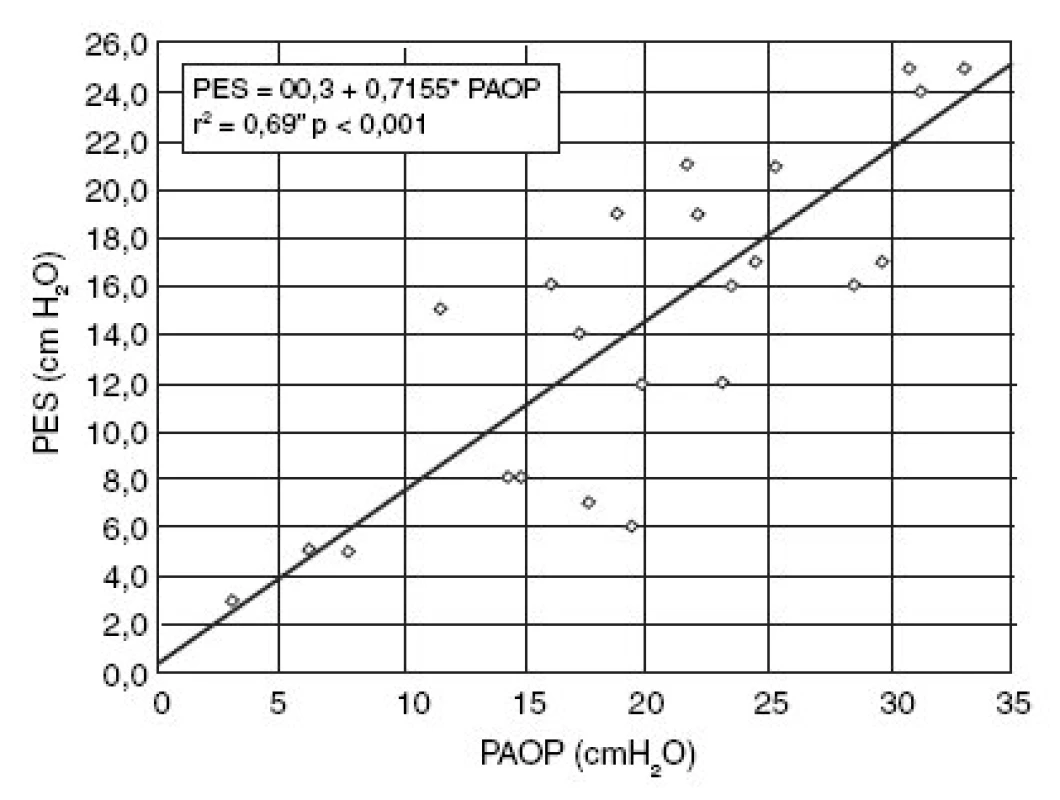
Závislost na Pes na CVP byla slabší:
r2 = 0,53; p < 0,001; lineární regrese:
Pes = 4,7 + 1,1256 × CVP cm H2O (obr. 5).
5. Závislost mezi inspiračním poklesem CVP a jícnového tlaku 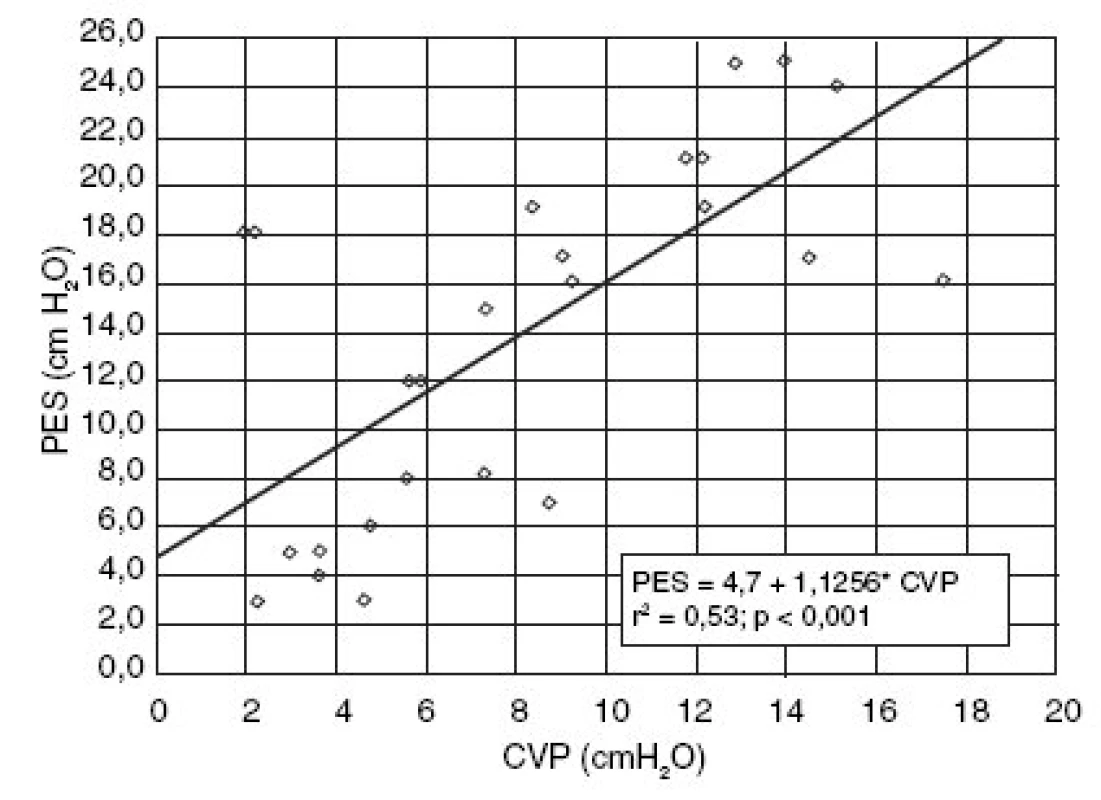
Diskuse
Na rozdíl od sedovaných a řízeně ventilovaných nemocných, PPV a SVV selhaly v předpovědi změny srdečního výdeje po podání bolusu tekutin. Variace před podáním objemové náhrady se nelišily mezi pacienty s pozitivní a negativní reakcí na tekutinu. Podání tekutiny sice snížilo hodnotu PPV a SVV, ale změna nebyla klinicky významná a nebyla spojena se vzestupem srdečního výdeje. Ani ostatní parametry preloadu – plnící tlaky pravého a levého srdce – neumožnily rozlišit, kteří pacienti budou profitovat z podání tekutin.
V průběhu studie bylo publikováno několik prací hodnotících spolehlivost PPV nebo SVV u nemocných se spontánní dechovou aktivitou. Perner et al. [8] zkoumali u 30 septických nemocných ventilovaných v režimu PSV, zda SVV měřená systémem PiCCO dokáže předpovědět pozitivní reakci (vzestup srdečního výdeje minimální o 10 %) na podání 500 ml koloidu. Na rozdíl od řízeně ventilovaných byla hodnota SVV u nemocných nezávislých na preloadu vyšší (16 %) než u hypovolemických (13 %). SVV neumožnilo předpovědět reakci na objem u nemocných na PSV (ROC AUC = 0,52).
Podobnou práci u nemocných spontánně ventilujících (n = 12) a na PSV (n = 9) publikovali Heenen et al. [9]. Obdobně jako SVV ve studii Pernera byla PPV vyšší u pacientů nezávislých na preloadu (15 %) než u hypovolemických (9 %). Schopnost předpovědi reakce na tekutiny byla vyšší pro tlak v zaklínění (ROC AUC = 0,73) než pro PPV (ROC AUC = 0,69). PPV se ukázala jako málo spolehlivý parametr, přesnost nezvýšilo ani vyřazení nemocných s aktivním exspiriem, kde byly očekávány velké změny nitrohrudního tlaku s falešně vysokou PPV.
Obě studie dospěly ke stejnému závěru jako naše práce. PPV a SVV nepřinášejí informace o případné hypovolémii nemocných. Jedinou práci, která je v rozporu s výše uvedenými a potvrzuje spolehlivost PPV, publikoval Soubrier [10] v roce 2007. Na rozdíl od ostatních prací byli sledováni výhradně spontánně ventilující nemocní a srdeční výdej byl měřený pomocí transthorakální echokardiografie. PPV s prahovou hodnotou 12 % umožnilo s vysokou specificitou 92% a senzitivitou 63% (ROC AUC = 0,81) předpovědět pozitivní reakci na tekutinu, definovanou jako vzestup srdečního indexu min. o 15 %. Objemová expanze (500 ml 6% škrobu za 20 min) také snížila PPV z 11 ± 5 % na 6 ± 4 %.
Počet potenciálně hypovolemických pacientů ventilovanýchch v režimu PSV byl mnohem menší, než jsme očekávali. V akutní fázi onemocnění (první hodiny až dny šokového stavu) je většina nemocných řízeně ventilována. Převedení na podpůrnou ventilaci následuje až po hemodynamické stabilizaci a odtlumení. Tito pacienti v subakutním stadiu mají obvykle dostatečnou intravaskulární náplň (tomu odpovídá i medián CI 4,6 l . m-2 . min-1) a obvykle se snažíme spíše o negativní tekutinovou bilanci. S tím pravděpodobně souvisí i menší podíl pozitivních reakcí na tekutinový test – v jiných pracích zvýší srdeční výdej po tekutině cca 50 % pacientů, v naší skupině však pouze 33,3 %.
U většiny sledovaných pacientů byl pozorován výrazný pokles Pes během inspiria, což svědčí pro větší podíl spontánního dechového úsilí než podpory ventilátorem. Tomuto závěru odpovídá i výpočet provedený ventilátorem, kdy pacienti vykonávali větší dechovou práci než ventilátor. Tento poznatek vysvětluje, proč u všech pacientů došlo k opačné změně arteriálního tlaku než u řízeně ventilovaných – inspiračnímu poklesu arteriálního tlaku. Hemodynamické účinky ventilace tlakovou podporou se ve sledovaném souboru pacientů blíží spontánní ventilaci. Z tohoto důvodu nelze očekávat možnost klinického využití interakcí srdce-plíce pro hodnocení hemodynamiky a řízení volumoterapie.
Inspirační vzestup nitrohrudního tlaku s poklesem preloadu pravé komory je považován za nejvýznamnější patofyziologický fenomén podílející se na vzniku variace tepového objemu u řízeně ventilovaných pacientů. Proto jsme očekávali, že velikost změn nitrohrudního tlaku (∆Pes), a tím i preloadu pravé komory, bude ovlivňovat PPV a SVV. Ve sledované skupině nemocných však tato závislost byla velmi slabá (r2 = 0,19 pro PPV a r2 = 0,15 pro SVV). U pacientů na řízené ventilaci je prokázána závislost PPV na velikosti dechového objemu [11], který jednak odpovídá afterloadu pravé komory, jednak souvisí se vzestupem nitrohrudního tlaku a poklesem žilního návratu. Ani v tomto případě se tato závislost nepotvrdila při ventilaci tlakovou podporou (r2 = 0,18 pro PPV a r2 = 0,17 pro SVV). Dalším faktorem, který může ovlivnit PPV a SVV, je aktivní exspirium, kdy dochází ke vzestupu nitrobřišního i nitrohrudního tlaku. Výsledný efekt na žilní návrat, a tím i na PPV a SVV, je obtížně odhadnutelný, ale vyřazení pacientů s aktivním exspiriem v již zmiňované studii Heenen et al. [9] neovlivnilo spolehlivost PPV.
Pro hodnocení dechové aktivity pacienta je třeba znát pleurální tlak. V praxi je často nahrazován měřením jícnového tlaku, které je však stále poměrně invazivní a technicky obtížné. Z těchto důvodů jsme se snažili najít parametr, který by nám pomohl posoudit dechovou aktivitu pacienta. U řízeně ventilovaných nemocných bylo prokázáno, že výchylky PAOP během dechového cyklu odpovídají změnám pleurálního (a jícnového) tlaku [12]. Naše výsledky potvrdily dobrou závislost mezi ΔPes a ΔPAOP použitelnou v praxi, např. pro hodnocení neúčinného spouštění dechů nebo respiračního úsilí. Závislost mezi ΔCVP a ΔPes je slabší a lze ji použít jen k orientačnímu hodnocení.
Variace dechového objemu v průběhu záznamu křivek nebyla sledována. Vzhledem k tomu, že pro zařazení do studie byla vyžadována klidná ventilace bez zjevné interference ventilátorem, variace v dechových objemech byly nízké. Dalším omezením vlivu změny dechového objemu byly výpočty PPV a SVV, které byly měřeny zvlášť v každém dechovém cyklu a následně průměrovány. Tato metoda sice může podhodnocovat PPV a SVV oproti delším časovým úsekům [13], ale vzhledem k výpočtu průměru za 3 dechové cykly omezuje vliv nerovnoměrnosti jednotlivých dechových objemů. Další důkazem malého významu variace dechového objemu jsou (s výjimkou jednoho pacienta) nevýznamné rozdíly mezi PPV a SVV změřenými v jednotlivých dechových cyklech.
Jak tedy řídit tekutinou strategii u pacientů se spontánní dechovou aktivitou? Na základě výsledků naší studie i ostatních prací [3, 8, 9] nebyl prokázán spolehlivý parametr, který umožňuje předpovědět reakci na podání tekutin. Proto při klinickém podezření na hypovolémii můžeme pouze hodnotit, zda podání malého množství tekutin během krátkého časového úseku vedlo ke zlepšení hemodynamiky (vzestup srdečního výdeje, pokles dávky katecholaminů, vzestup diurézy). Postup se zdá bezpečný z hlediska objemového přetížení a rizika plicního edému [14]. Alternativu představuje krátkodobá „autotransfuze“ z dolních končetin vyvolaná jejich elevací (passive leg raising) [15].
Závěr
Parametry získané interakcí srdce-plíce, konkrétně PPV a SVV, selhaly v předpovědi reakce na podání tekutin u pacientů ventilovaných v režimu tlakové podpory. Změny plnících tlaků (PAOP a CVP) v průběhu dechového cyklu odpovídají více dechovému úsilí (změně pleurálního tlaku) než přetížení srdečních komor.
Použité zkratky:
PPV – variace pulzního tlaku
SVV – variace tepového objemu
CVP – centrální žilní tlak
MAP – střední arteriální tlak (mean arterial pressure)
PAOP – tlak v zaklínění
Pes – jícnový tlak
Paw – tlak v dýchacích cestách
ROC AUC – plocha pod křivkou Receiver Operating Characteristic
PSV – ventilace tlakovou podporou (pressure support ventilation)
CI – index srdečního výdeje (cardiac index)
Práce byla podpořena grantem IGA MZ ČR NR/8777-3.
Došlo 12. 1. 2009.
Přijato 18. 3. 2009.
Adresa pro korespondenci:
MUDr. Pavel Suk
Anesteziologicko-resuscitační klinika, FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: pavel.suk@fnusa.cz
Sources
1. Michard, F., Teboul, J. L. Using heart–lung interactions to assess fluid responsiveness during mechanical ventilation. Crit. Care, 2000, 4, p. 282–289.
2. Osman, D., Ridel, C., Ray, P., Monnet, X., Anguel, N., Richard, C., Teboul, J. L. Cardiac filling pressures are not appropriate to predict hemodynamic response to volume challenge. Crit. Care Med., 2007, 35, p. 64–68.
3. Coudray, A., Romand, J. A., Treggiari, M., Bendjelid, K. Fluid responsiveness in spontaneously breathing patients: A review of indexes used in intensive care. Crit. Care Med., 2005, 33, p. 2757–2762.
4. Magder, S. A., Georgiadis, G., Cheong, T. Respiratory variations in right atrial pressure predict response to fluid challenge. J. Crit. Care, 1992, 7, p. 76–85.
5. Michard, F., Boussat, S., Chemla, D., Anguel, N., Mercat, A., Lecarpentier, Y., Richard, C., Pinsky, M. R., Teboul, J. L. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory failure. Am. J. Respir. Crit. Care Med., 2000, 162, p. 134–138.
6. Berkenstadt, H., Margalit, N., Hadani, M., Friedman, Z., Segal, E., Villa, Y., Perel, A. Stroke volume variation as a predictor of fluid responsiveness in patients undergoing brain surgery. Anesth. Analg., 2001, 92, p. 984–989.
7. Baydur, A., Behrakis, P. K., Zin, W. A., Jaeger, M., Milic-Emili, J. A simple method for assessing the validity of the esophageal balloon technique. Am. Rev. Respir. Dis., 1982, 126, p. 788–791.
8. Perner, A., Faber, T. Stroke volume variation does not predict fluid responsiveness in patients with septic shock on pressure support ventilation. Acta Anaesthesiol. Scand., 2006, 50, p. 1068–1073.
9. Heenen, S., DeBacker, D., Vincent, J. L. How can the response to volume expansion in patients with spontaneous respiratory movements be predicted? Crit. Care, 2006, 10, p. R102.
10. Soubrier, S., Saulnier, F., Hubert, H., Delour, P., Lenci, H., Onimus, T., Nseir, S., Durocher, A. Can dynamic indicators help the prediction of fluid responsiveness in spontaneously breathing critically ill patients? Intensive Care Med., 2007, 33, p. 1117–1124.
11. Reuter, D. A., Bayerlein, J., Goepfert, M. S., Weis, F. C., Kilger, E., Lamm, P., Goetz, A. E. Influence of tidal volume on left ventricular stroke volume variation measured by pulse contour analysis in mechanically ventilated patients. Intensive Care Med., 2003, 29, p. 476–480.
12. Bellemare, P., Goldberg, P., Magder, S. A. Variations in pulmonary artery occlusion pressure to estimate changes in pleural pressure. Intensive Care Med., 2007, 33, p. 2004–2008.
13. Hyung, K. K., Pinsky, M. R. Effect of tidal volume, sampling duration, and cardiac contractility on pulse pressure and stroke volume variation during positive-pressure ventilation. Crit. Care Med., 2008, 36, p. 2858–2862.
14. Matejovic, M., Krouzecky, A., Rokyta, R. Jr., Novak, I. Fluid challenge in patients at risk for fluid loading-induced pulmonary edema. Acta Anaesthesiol Scand., 2004, 48, p. 69–73.
15. Monnet, X., Rienzo, M., Osman, D., Anguel, N., Richard, C., Pinsky, M. R., Teboul, J. L. Passive leg raising predicts fluid responsiveness in the critically ill. Crit. Care Med., 2006, 34, p. 1402–1407.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 3-
All articles in this issue
- Analgosedation in Intensive Care Units (ICU) in the Czech Republic – the results of questionnaire study
- Dynamic parameters of preload in pressure support ventilation
- Regional cooling of blood in the extracorporeal circuit: New way of anticoagulation during CRRT
- Catheter-related blood stream infections
- Blood and tissue glucose level in critically ill patients: Comparison of different methods of measuring interstitial glucose levels
- Delirium during the postoperative period and in the intensive medicine
- Polarography – major contribution of Jaroslav Heyrovský to the intensive therapy
- Dr. Zdeněk Křivánek: Krivanek’s Anaesteshesiologist Biannual Meeting in Pardubice
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analgosedation in Intensive Care Units (ICU) in the Czech Republic – the results of questionnaire study
- Delirium during the postoperative period and in the intensive medicine
- Catheter-related blood stream infections
- Dynamic parameters of preload in pressure support ventilation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

