-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Trombóza asociovaná s malignitou – liečba a prevencia priamymi inhibítormi faktora Xa
Cancer-associated thrombosis – treatment and prevention with direct oral factor Xa inhibitors
Background: Venous thromboembolism (VTE) is a frequent cause of morbidity and mortality in patients with cancer. Moreover, management of VTE is frequently connected with complications, namely risk of recurrent VTE and bleeding. Low molecular weight heparins (LMWH) therapy administrated for 3–6 months is currently considered a standard for the treatment of cancer-associated VTE (CA-VTE). Direct oral factor Xa inhibitors (FXaI) apixaban, edoxaban and rivaroxaban have emerged as a new possibility for long-term antithrombotic therapy for VTE. These agents expose several advantages in individuals with cancer, and might overcome several disadvantages connected with LMWH therapy. Purpose: First clinical studies with oral FXaI for the treatment of CA-VTE with very promising results were recently published. The article summarizes current data regarding the use of oral FXaI in the treatment of CA-VTE.
Keywords:
cancer-associated venous thromboembolic disease – Pulmonary embolism – Deep vein thrombosis – direct oral factor Xa inhibitors
Autoři: K. Grilusová 1; T. Bolek 1; I. Škorňová 2; J. Staško 2; M. Samoš 1; M. Mokáň 1
Působiště autorů: I. Interná klinika JLF UK a UN Martin, Slovenská republika 1; Klinika hematológie a transfuziológie, Národné centrum trombózy a hemostázy SR, JFK UK Martin, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2021; 34(4): 283-290
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2021283Souhrn
Východiská: Žilový (venózny) tromboembolizmus (VTE) je častou príčinou morbidity a mortality u pacientov so zhubným nádorom. Manažment VTE je často spojený s komplikáciami, vrátane rizika opakovaného VTE a krvácania. Podávanie heparínov s nízkou molekulovou hmotnosťou (LMWH) po dobu najmenej 3–6 mesiacov je súčasným štandardom liečby VTE asociovaného s onkologickými ochoreniami (cancer-associated VTE – CA-VTE). Priame orálne inhibítory faktora Xa (FXaI) apixaban, edoxaban a rivaroxaban rozšírili možnosti dlhodobej antitrombotickej liečby VTE. U ľudí s onkologickými ochoreniami sa tieto lieky javia ako atraktívne alternatívy na liečenie VTE, s potenciálom prekonať niektoré obmedzenia LMWH. Ciel: Len nedávno boli publikované prvé klinické štúdie o použití orálnych FXaI v liečbe CA-VTE, s veľmi sľubnými výsledkami. Článok sumarizuje súčasne dostupné dáta o možnosti využitia orálnych FXaI v liečbe CA-VTE.
Klíčová slova:
venózna tromboembolická choroba asociovaná s malignitou – pľúcna embólia – hlboká žilová trombóza – priame inhibítory faktora Xa
Úvod
Žilový (venózny) tromboembolizmus (VTE) asociovaný s onkologickým ochorením (cancer-associated venous thromboembolism – CA-VTE) je rozšírené ochorenie, ktoré predstavuje 20–30 % všetkých trombotických príhod. Až 20 % pacientov so zhubným nádorom má v priebehu choroby najmenej jednu venóznu tromboembolickú príhodu a riziko vývoja VTE je 4–7x vyššie v porovnaní s pacientmi bez onkologického ochorenia [1,2].
Priame orálne inhibítory faktora Xa (FXaI) apixaban, edoxaban a rivaroxaban rozšírili možnosti antikoagulačnej liečby u pacientov s VTE. Tieto lieky vykazujú výhodný farmakologický profil (tab. 1), orálnu cestu podania, málo klinicky relevantných liekových a potravinových interakcií; naopak nevyžadujú rutinne laboratórne monitorovanie. Tieto vlastnosti môžu byť výhodne využité práve u pacientov s CA-VTE. Nedávno boli publikované výsledky prvých klinických štúdií skúmajúcich použitie orálnych FXaI v liečbe CA-VTE s veľmi povzbudivými výsledkami, pričom v súčasnosti vidíme reálnu snahu o použitie orálnych FXaI pri liečbe CA-VTE v klinickej praxi [3,4]. Tento článok sumarizuje súčasné dôkazy o prevencii a liečbe CA-VTE pomocou orálnych FXaI.
Edoxaban v prevencii a liečbe CA-VTE
Edoxaban (tab. 1) je orálny reverzibilný, priamy FXaI (obr. 1) s rýchlou absorpciou a predikovateľným, od dávky závislým, antikoagulačným účinkom. Edoxaban má biologickú dostupnosť 65 % a jeho absorpcia nie je ovplyvnená súčasným príjmom potravy. Maximálne plazmatické koncentrácie sú dosiahnuté za 1–3 hodiny od jeho perorálneho podania, plazmatický polčas edoxabanu je 7–10 hodín. Približne 50 % z podanej dávky sa vylučuje v nezmenenej forme močom. Zvyšné množstvo sa metabolizuje v pečeni hydrolýzou a enzymatickými procesmi sprostredkovanými cytochrómom P 450 (CYP) 3A4. Edoxaban je substrátom glykoproteínu P, potentné induktory a inhibítory tohto transportného proteínu môžu ovplyvniť farmakokinetiku edoxabanu [5].
Za prelomovú štúdiu využitia orálnych FXaI v liečbe CA-VTE možno pokladať randomizovanú klinickú štúdiu HOKUSAI VTE CANCER, ktorá zaradila dospelých pacientov s aktívnym onkologickým ochorením (celkovo bolo analyzovaných 1 046 pacientov) a akútne symptomatickou alebo náhodne zistenou proximálnou hlbokou venóznou trombózou (HVT) a/alebo pľúcnou embóliou (PE). Zaradení pacienti boli randomizovaní na liečbu edoxabanom 60 mg 1x denne (alebo 30 mg, spĺňajúce kritériá na zníženie dávky) po premostení z liečby LMWH (v trvaní najmenej 5 dní), alebo na liečbu dalteparínom v dávke 200 IU/kg počas 1. mesiaca, po ktorej nasledovala znížená dávka 150 IU/kg. Minimálne požadované trvanie liečby bolo 6 mesiacov, po ktorých sa odporučilo pokračovanie až do 12 mesiacov s odporučením ošetrujúceho lekára [3,4,6]. Primárnym výsledkom štúdie bol výskyt rekurencie VTE a krvácania.
Výsledky štúdie preukázali, že edoxaban bol non-inferiórny ku liečbe dalteparínom (miera výskytu primárneho výsledku 12,8 vs. 13,5 %; HR 0,97). Miera opakovanej venóznej tromboembólie bola pri edoxabane numericky nižšia ako pri dalteparíne (7,9 vs. 11,3 %; p = 0,09), ale miera veľkého krvácania bola významne vyššia (6,9 vs. 4,0 %; p = 0,04), pričom rozdiel bol spôsobený prevažne nadmerným krvácaním z hornej časti gastrointestinálneho traktu pri liečbe edoxabanom. V období klinického sledovania zomrelo celkovo 39,5 % pacientov liečených edoxabanom a 36,6 % pacientov liečených dalteparínom, pričom vo väčšine prípadov išlo o úmrtia asociované s progresiou malígneho ochorenia. V štúdii zomrelo 6 pacientov v obidvoch sledovaných skupinách pacientov v súvislosti s rekurenciou VTE alebo v dôsledku významného krvácania [3,4,6].
Výsledky štúdie HOKUSAI VTE CANCER teda potvrdili non-inferioritu edoxabanu oproti subkutánnemu podaniu dalteparínu v liečbe CA-VTE v rámci výskytu kompozitného primárneho výsledku; v skupine pacientov liečenej edoxabanom bol pozorovaný nižší výskyt rekurencie VTE a vyšší výskyt krvácania. Za výhodné zistenie možno považovať lepšiu toleranciu a lepšiu adherenciu k dlhodobej liečbe edoxabanom. Výsledky štúdie otvorili cestu pre ďalší klinický výskum a poukázali na možnosti využitia orálnych FXaI v liečbe CA-VTE. Doteraz však nebola publikovaná štúdia priamo zameraná na využitie edoxabanu v prevencií CA-VTE.
Rivaroxaban v prevencii a liečbe CA-VTE
Rivaroxaban (tab. 1) je priamy, selektívny FXaI (obr. 1). Rivaroxaban je dobre rozpustný vo vode, rýchlo sa absorbuje, pričom maximálne plazmatické koncentrácie sa po jeho perorálnom podaní dosiahli za 2–4 hodiny. Vstrebávanie rivaroxabanu je urýchlené pri jeho súčasnom podávaní s potravou. Rivaroxaban má vysokú väzbu na plazmatické proteíny, vylučuje buďto nezmenený obličkami (36 %) alebo po jeho enzymatickej metabolizácii a degenerácii hepatobiliárnym traktom. Rivaroxaban je substrátom glykoproteínu P, metabolizuje sa prostredníctvom CYP 3A4/5, CYP 2J2, ako aj metabolickými cestami independentnými od CYP. Plazmatický polčas rivaroxabanu je 5–9 hodín u mladších jedincov a 11–13 hodín u starších pacientov. Celková expozícia rivaroxabanu je zvýšená u starších jedincov, najskôr v dôsledku zníženej renálnej eliminácie. Rivaroxaban má málo liekových interakcií. Absorpcia a farmakokinetický profil rivaroxabanu sa nezdajú byť ovplyvnené žalúdočným pH [7].
Tab. 1. Základné farmakologické vlastnosti priamych orálnych inhibítorov faktora Xa. 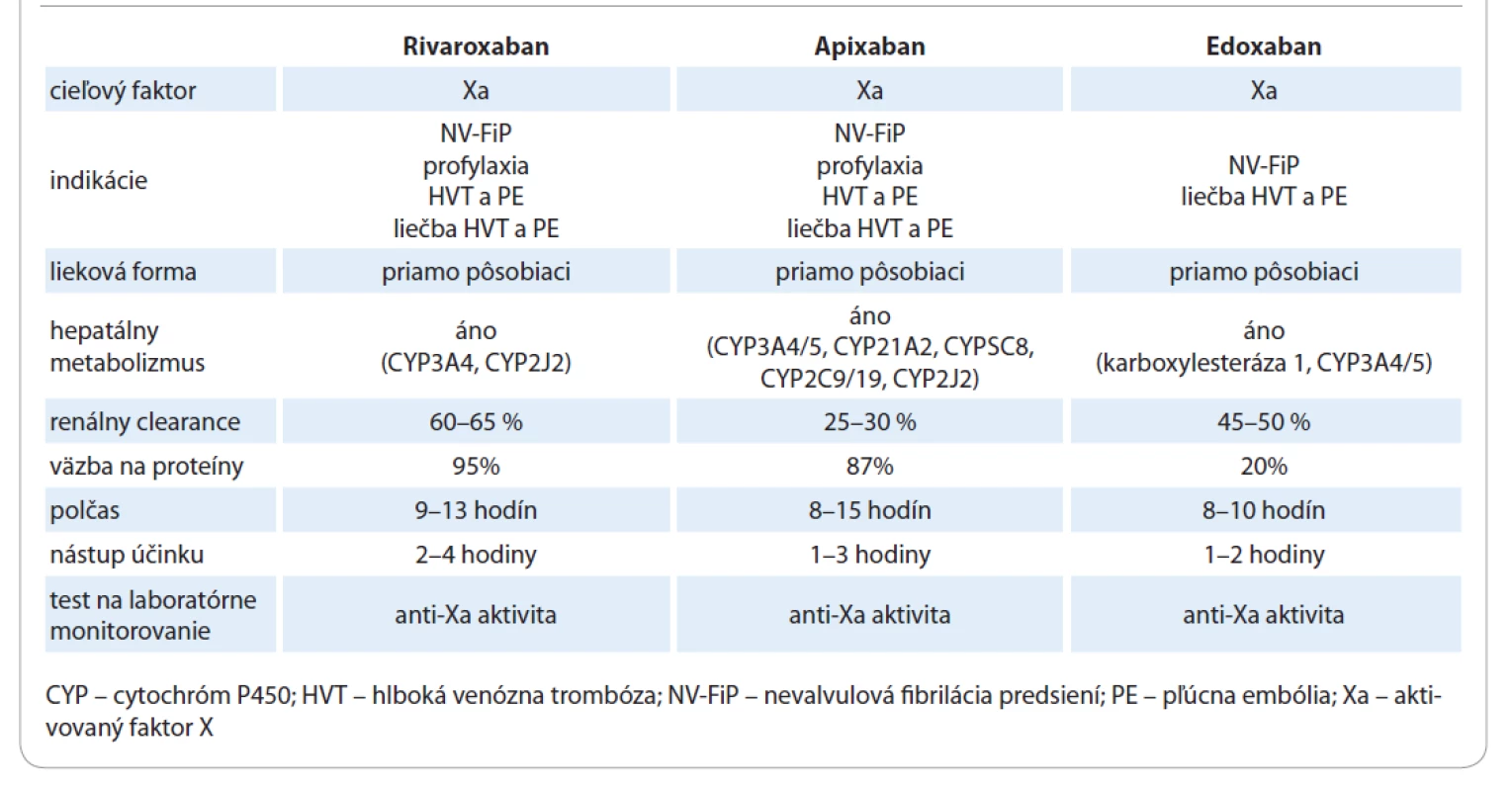
Rivaroxaban je efektívny pri primárnej a sekundárnej tromboprofylaxii s najväčším množstvom dôkazov a štúdii, väčšina v rámci programu CALISTO [8]. Cieľom randomizovanej, multicentrickej, pilotnej štúdie, Select-D bolo potvrdiť či perorálny FXaI rivaroxaban ponúka alternatívnu liečbu VTE u pacientov s rakovinou. Celkovo bolo do štúdie zaradených 406 pacientov s aktívnym onkologickým ochorením, ktorí mali symptomatickú pľúcnu embóliu (PE), náhodnú PE alebo symptomatickú trombózu hlbokých žíl dolnej končatiny (DVT) [9]. Autori porovnávali liečebnú stratégiu dalteparínu (200 IU/kg denne počas prvého mesiaca, potom 150 IU/kg denne počas 2–6 mesiacov) alebo rivaroxabanu (15 mg 2x denne počas 3 týždňov, potom 20 mg 1x denne počas 6 mesiacov). Primárnym sledovaným výsledkom bol výskyt recidívy VTE po 6 mesiacoch, sekundárny výsledok bol rozšírený o výskyt závažného krvácania a klinicky relevantného nezávažného krvácania (clinically relevant non-major bleeding – CRNMB).
Recidíva VTE sa v ramene s dalteparínom vs. v ramene s rivaroxabanom vyskytla v 11,0 vs. 4,0 % (HR 0,43; 95% CI 0,19–0,99). Kumulatívna miera závažného krvácania za 6 mesiacov bola 4 % pre dalteparín a 6 % pre rivaroxaban (HR 1,83; 95% CI 0,68–4,96). Zodpovedajúce miery CRNMB boli 4 a 13 %. Rivaroxaban bol spájaný s relatívne nízkou recidívou VTE, ale s vyššou CRNMB v porovnaní s dalteparínom [10].
Štúdia CASSINI bola uskutočnená s cieľom zhodnotiť účinnosť a bezpečnosť tromboprofylaxie rivaroxabanom u pacientov s onkologickými ochoreniami. Do multicentrickej, dvojito zaslepenej, randomizovanej, placebom kontrolovanej štúdie autori náhodne zaradili pacientov so solídnym nádorom alebo lymfómom; v období 180 dní štúdia porovnávala účinok rivaroxabanu v dávke 10 mg a placeba. Primárnym výsledkom účinnosti bolo objektívne potvrdenie proximálnej hlbokej žilovej trombózy v dolnej končatine, PE, symptomatickej DVT a úmrtia pre VTE. Z 1 080 zaradených pacientov malo 49 (4,5%) trombózu pri skríningu. Z ostatných 841 pacientov, ktorí podstúpili randomizáciu, sa primárny cieľový rezultát vyskytol u 6,0 % v skupine s rivaroxabanom a u 8,8 % v skupine s placebom (HR 0,66; 95% CI 0,40–1,09; p = 0,10). Závažné krvácanie ako primárny výsledok bezpečnosti sa vyskytlo u 2,0 % pacientov v skupine s rivaroxabanom a u 1,0 % v skupine s placebom (HR 1,96; 95% CI 0,59–6,49). V skupine s rivaroxabanom sa vyskytla jedna smrteľná príhoda krvácania [11].
Program CALLISTO zahàňa ďalšie štúdie s rivaroxabanom (CONKO-011, CASTA-DIVA, CASTA-DIVA IIR, PRIORITA a COSIMO). Z hľadiska problematiky CA-VTE je zaujímavá najmä štúdia CASTA-DIVA zameraná na porovnanie bezpečnosti a účinnosti rivaroxabanu a dalteparínu u pacientov s vysokým rizikom recidívy VTE a s high-grade lymfómom alebo myelómom, liečeným imunomodulačnými liekmi (talidomid alebo lenalidomid). Výsledky z nedávno dokončenej fázy III tejto otvorenej randomizovanej štúdie budú zverejnené v blízkej budúcnosti [12].
Mantha et al vyhodnotil prvú prospektívnu, kohortovú štúdiu hodnotiacu rivaroxaban v terapii VTE u pacientov s malignitou. Kumulatívny výskyt opakujúceho sa VTE a veľkého krvácania boli v tejto štúdii 4,4 % (95% CI 1,40–7,40) a 2,2 % (95% CI 0–4,20) za obdobie 6 mesiacov [13]. Ďalšie informácie o účinnosti a bezpečnosti priamych orálnych antikoagulancií (vrátane rivaroxabanu) v liečbe CA-VTE má priniesť randomizovaná štúdia CANVAS, ktorej výsledky by mali byť zverejnené už čoskoro [14].
Sumárne možno teda konštatovať, že u rivaroxabanu doteraz realizované štúdie konkluzívne potvrdzujú nižšiu mieru recidívy VTE a súčasne vyšší výskyt krvácavých komplikácií pri liečbe CA-VTE rivaroxabanom (v porovnaní s dalteparínom), čo poukazuje na skutočnosť, že liečba rivaroxabanom (v dávke 15 mg 2x denne počas prvých 21 dní antikoagulácie, následne 20 mg denne počas 3–6 mesiacov) môže byť výhodnou alternatívou k liečbe LMWH u pacientov s CA-VTE a s normálnou funkciou obličiek, a u ktorých nie je vysoké riziko gastrointestinálneho alebo urogenitálneho krvácania.
Apixaban v prevencii a liečbe CA-VTE
Apixaban (tab. 1) je potentný, perorálny, vysoko selektívny, priamy a reverzibilný inhibítor FXa (obr. 1). Apixaban je aktívny metabolit, ktorý vykazuje pH-independentnú rozpustnosť vo vode, lineárnu farmakokinetiku a biologickú dostupnosť > 50 %. Maximálne plazmatické koncentrácie sú po perorálnom podaní apixabanu dosiahnuté za 2–4 hodiny, priemerný polčas eliminácie apixabanu je 8–15 hodín. Účinnosť liečby apixabanom sa nezdá byť ovplyvnená vekom a pohlavím pacienta. Súčasný príjem potravy viedol k zmene maximálnych plazmatických koncentrácií apixabanu o 14 %, čo sa nepovažuje za klinicky relevantné. Apixaban sa vstrebáva najmä v distálnej tretine tenkého čreva, má malý distribučný objem, metabolizuje sa enzýmami CYP 3A4 a v menšej miere aj CYP 1A2, 2C8, 2C9, 2C19 a 2J2. Apixaban je tiež substrátom glykoproteínu P a má 87% väzbu na plazmatické bielkoviny. Po perorálnom podaní je väčšina vstrebaného apixabanu vylúčená biliárnou alebo intestinálnou exkréciou stolicou. Renálnou exkréciou je eliminovaných zhruba 27 % zo vstrebaného apixabanu [15].
V klinickej rozsiahlej štúdii AMPLIFY bola retrospektívne hodnotená účinnosť a bezpečnosť apixabanu v neselektovanej skupine pacientov s VTE v bežnej klinickej praxi. V tejto štúdii bola incidencia významného krvácania nižšia v ramene s apixabanom oproti ramenu s warfarínom [16]. Ďalšie dáta podporujúce priaznivý bezpečnostný profil apixabanu priniesla štúdia AVERT, ktorá porovnávala liečbu apixabanom oproti placebu v prevencii VTE u pacientov s metastatickým onkologickým ochorením (celkovo bolo randomizovaných 563 pacientov) podstupujúcich liečbu chemoterapiou. Apixaban viedol v štúdii k významnej redukcii výskytu VTE – 4,2 % v skupine pacientov liečenej apixabanom oproti 10,2 % v skupine s placebom (HR 0,41; 95% CI 0,26–0,65; p < 0,001), pričom výskyt významného krvácania v skupine liečenej apixabanom bol len 2,1 % [17].
Medzinárodná, prospektívna, randomizovaná štúdia Caravaggio [18] bola realizovaná s cieľom posúdiť, či je liečba perorálne podávaným apixabanom non-inferiórna v porovnaní s konvenčnou liečbou subkutánnym LMWH dalteparínom pri akútnej proximálnej DVT a/alebo PE u pacientov s malignitou počas obdobia 6 mesiacov klinického sledovania. Apixaban sa podáva v dávke 10 mg 2x denne počas prvých 7 dní a potom 5 mg 2x denne; dalteparín sa podáva v dávke 200 IU/kg počas 1. mesiaca a potom 150 IU/kg 1x denne. Primárnym sledovaným výsledkom štúdie je objektívne potvrdená opakujúca sa VTE, primárnym bezpečnostným výsledkom je výskyt veľkého krvácania (definované podľa usmernení Medzinárodnej spoločnosti pre trombózu a hemostázu). Výsledky tejto multicentrickej štúdie boli zverejnené len nedávno. Kumulatívne riziko VTE bolo 7,9 % v skupine na dalteparínu vs. 5,6 % v skupine na apixabanu (HR 0,63; 95% CI 0,37–1,07; p < 0,001 pre non-inferioritu). Nepatrný vyšší výskyt krvácania bol pozorovaný v skupine pacientov liečenej dalteparínom (4,0 %) oproti skupine pacientov liečenej apixabanom (3,8 %) (HR 0,82; 95% CI 0,40–1,69; p = 0,60). Autori tejto štúdie konštatujú, že perorálny apixaban je non-inferiórny v porovnaní so subkutánnym LMWH dalteparínom pri liečbe CA-VTE [19].
Na základe výsledkov štúdie Caravaggio možno teda konštatovať, že liečba apixabanom je u pacientov s CA-VTE účinná a porovnateľne bezpečná ako liečba LMWH dalteparínom. Apixaban je teda druhým orálnym FXaI, ktorý má dôkaz o účinnosti a akceptovateľnej bezpečnosti v liečbe CA-VTE z randomizovanej klinickej štúdie.
Post-marketingové klinické skúsenosti a odporúčania odborných spoločností
Ako už bolo spomenuté, v súčasnosti je k dispozícii niekoľko klinických randomizovaných štúdií potvrdzujúcich účinnosť a akceptovateľnú bezpečnosť orálnych FXaI v liečbe CA-VTE; otázkou zostáva, či výsledky týchto štúdií korešpondujú aj s reálnou klinickou praxou a aké sú teda súčasne dostupné klinické skúsenosti s použitím orálnych FXaI v liečbe VTE u onkologických pacientov.
V jednej z prvých dostupných post-marketingových analýz pre edoxaban Ikeda et al [20] porovnávali účinnosť edoxabanu v liečbe VTE v závislosti od prítomnosti onkologického ochorenia. Autori tejto práce retrospektívne analyzovali výsledky liečby u 125 pacientov s VTE (z toho 61 pacientov malo CA-VTE), pričom v štúdii nebol pozorovaný rozdiel v účinnosti liečby ani vo frekvencii recidívy VTE medzi onkologickými pacientmi a pacientmi bez onkologického ochorenia. Shimizu et al [21] zas v ďalšej z publikovaných prác retrospektívne porovnávali účinnosť a bezpečnosť liečby priamymi orálnymi FXaI (edoxabanom, rivaroxabanom alebo apixabanom) u pacientok s onkogynekologickým ochorením. Zo 107 prípadov CA-VTE analyzovaných v tejto štúdii bolo 54 pacientok liečených FXaI, ostatné boli liečené VKA. Autori práce pozorovali non-inferioritu liečby FXaI pre sledovaný primárny výsledok štúdie zahrňujúci výskyt rekurencie VTE a závažného krvácania (HR 0,31; 95% CI 0,03–3,12; p = 0,363).
V ďalšej z dostupných prác autori prezentovali prípad pacientky s pokročilým karcinómom žalúdka a CA-VTE a s hraničnou indikáciou k redukcii dávky edoxabanu (telesná hmotnosť pacientky bola 63 kg a jej clearence kreatinínu bol 46 ml/min.) Pacientka bola zo začiatku liečená redukovanou dávkou edoxabanu (30 mg denne) bez výraznejšieho efektu; k rezolúcii pľúcneho embolu došlo až po zvýšení dávky edoxabanu na 60 mg denne [22]. Uvedený prípad poukazuje na doteraz nie celkom zodpovedanú problematiku optimalizácie dávkovania FXaI u pacientov s CA-VTE, ktorí majú nepochybne vyššie riziko krvácavých komplikácií pri antitrombotickej liečbe, čo môže viesť k tendencii použiť redukované dávkovanie orálnych FXaI, s určitým rizikom poddávkovania liečby. Ďalšou otázkou je, či možno pri individualizácii a bezpečnom riadení liečby CA-VTE edoxabanom využiť laboratórne monitorovanie (stanovenie anti-Xa aktivity). Touto otázkou sme sa zaoberali v našej predchádzajúcej práci, v ktorej sme prezentovali naše klinické skúsenosti s liečbou CA-VTE edoxabanom a s použitím stanovenia špecificky kalibrovanej anti-Xa aktivity edoxabanu (tab. 2) pri riadení tejto liečby [23]. Edoxaban v dávke 60 mg denne sme použili v liečbe 3 pacientov s CA-VTE, pričom ani jeden z pacientov nemal na uvedenej liečbe recidívu VTE. Jedna pacientka však mala krvácania pri liečbe (zdrojom krvácania bola pravdepodobne malígna infiltrácia duodena základným onkologickým ochorením – karcinóm obličky), ktoré recidivovalo napriek úprave dávkovania edoxabanu (redukcia na 30 mg denne s kontrolou a overením vyhovujúcej anti-Xa aktivity po redukcii dávky) a viedlo k úmrtiu pacientky. Pri druhej epizóde závažného krvácania bola realizovaná kontrola anti-Xa aktivity edoxabanu, ktorá nebola nadmerne vysoká (17,6 ng/ml). Toto pozorovanie poukazuje na skutočnosť, že etiológia krvácavých komplikácií u pacientov s CA-VTE je komplexná a že za výskyt krvácania pri antikoagulačnej liečbe CA-VTE môže byť zodpovedných viacero faktorov (v našom prípade infiltrácia duodena základným onkologickým ochorením), nielen liečbou navodená antikoagulácia. Nakoľko v súčasnosti neexistuje žiadna ďalšia štúdia overujúca použitie stanovenia anti-Xa aktivity pri riadení antikoagulačnej liečby FXaI u pacientov s CA-VTE, na definitívne stanovenie úlohy laboratórneho monitorovania pri riadení liečby bude potrebný ďalší výskum. Celkovo sa však liečba edoxabanom zdá byť u pacientov s CA-VTE účinná, a je potrebné uviesť, že sa zdá byť rovnako účinná aj v prípade pacientov so subakútnou CA-VTE [24] a v porovnaní s liečbou LMWH a VKA sa ukazuje jej výhodný pomer cena/benefit [25,26].
Tab. 2. Stanovenie anti-Xa aktivity edoxabanu [4,49]. ![Stanovenie anti-Xa aktivity edoxabanu [4,49].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/149b4ea5eeaf9dc3814baa13f456fcc0.png)
Ako už bolo spomenuté, výsledky randomizovanej štúdie overujúcej účinnosť a bezpečnosť rivaroxabanu v liečbe CA-VTE sa očakávajú [12,14], existuje však pomerne rozsiahla klinická skúsenosť s použitím rivaroxabanu v liečbe CA-VTE vychádzajúca z menších klinických štúdií a z klinickej praxe. Pignato et al publikovali ich retrospektívnu analýzu liečby 400 pacientov s prevažne solídnymi nádormi (61% z nich malo generalizované onkologické ochorenie) a CA-VTE rivaroxabanom (75,5 % pacientov bolo pred-liečených LMWH enoxaparínom), pričom preukázali rekurenciu VTE u 3,25 % prípadov a závažné krvácanie u 5,5 % prípadov počas priemernej doby sledovania 159,9 dní [27]. Veľmi podobné výsledky priniesla aj ďalšia z publikovaných prác u pacientok s gynekologickou malignitou a CA-VTE [28] a retrospektívna analýzy pacientov s neselektovaným aktívnym onkologickým ochorením [29]. Na druhej strane však Choe et al [30] publikovali tri klinické prípady pacientov s gastrointestinálnym onkologickým ochorením a CA-VTE, u ktorých liečba rivaroxabanom neviedla ku klinickému zlepšeniu a u ktorých pri tejto liečbe došlo k progresií VTE s nutnosťou prechodu na liečbu LMWH. Na liečbe LMWH bolo u všetkých pacientov dosiahnuté klinické zlepšenie. Autori práce v závere upozornili na skutočnosť, že rivaroxaban nemusí byť dostatočne účinný v liečbe CA-VTE v niektorých skupinách onkologických pacientov. Ďalšie retrospektívne analýzy [31–33] zas pozorovali vyšší výskyt krvácavých komplikácií u pacientov s gastrointestinálnymi malignitami a CA-VTE liečených rivaroxabanom (v porovnaní s pacientmi liečenými LMWH). Tieto pozorovania však neboli potvrdené v ďalších prácach analyzujúcich alebo zahrňujúcich najmä pacientov s gastrointestinálnymi malignitami [34–38], v ktorých bola preukázaná dobrá účinnosť a bezpečnosť liečby CA-VTE rivaroxabanom a v ktorých autori zhodne konštatovali, že rivaroxaban môže ponúknuť bezpečnú a efektívnu alternatívu liečby CA-VTE pomocou LMWH. V ďalších publikovaných (prevažne retrospektívnych) prácach bola tiež potvrdená dostatočná účinnosť a dobrý bezpečnostný profil rivaroxabanu v liečbe CA-VTE u pacientov so solídnymi tumormi [39], pacientov s karcinómom pľúc [40] a pacientok s onkogynekologickým ochorením [41,42]. Navyše sa zdá, že dobrá účinnosť a akceptovaný bezpečnostný profil, v porovnaní s LMWH, zostáva zachovaný aj pri dlhodobom podávaní rivaroxabanu pacientom s CA-VTE [42,43]. Sumárne teda doteraz publikované klinické skúsenosti prevažne svedčia pre dobrú účinnosť a akceptovateľnú bezpečnosť podania rivaroxabanu v liečbe CA-VTE, aj keď je zrejme potrebné zohľadniť správy o možnom vyššom riziku krvácavých komplikácií u jedincov s gastrointestinálnymi malignitami. Je tiež potrebné uviesť, že sa jedná prevažne o informácie z retrospektívnych analýz alebo malých prospektívnych štúdií a že je zatiaľ relatívne málo údajov z väčších prospektívnych štúdií alebo z randomizovaných klinických štúdií, tieto však možno očakávať v dohľadnej dobe.
Ako jednou z prvých správ o post-marketingovom použití apixabanu v liečbe CA-VTE sa zdá byť prípad jeho úspešného použitia na liečbu rozsiahlej proximálnej hlbokej venóznej trombózy a pľúcnej embólie s nízkym klinickým rizikom u pacienta s dovtedy neznámym adenokarcinómom prostaty [44]. V ďalšej kazuistickej práci autori opísali úspešné použitie apixabanu na liečbu hlbokej venóznej trombózy a trombózy uška ľavej predsiene nereagujúcej na účinnú antikoagulačnú liečbu warfarínom u pacienta s adenokarcinómom prostaty [45]. V ďalšej, už spomínanej, pilotnej prospektívnej štúdii bola u pacientov s CA-VTE účinnosť a bezpečnosť apixabanu porovnateľná s liečbou LMWH aj pri dlhodobom podávaní [43]. Wysokinski et al [46] porovnávali účinnosť a bezpečnosť rivaroxabanu, apixabanu a LMWH u 750 pacientov s akútnou CA-VTE a zistili, že výskyt rekurencie VTE a závažného krvácania bol podobný vo všetkých sledovaných skupinách. Uvedené pozorovanie potvrdila aj retrospektívna analýza 107 prípadov CA-VTE u pacientok s onkogynekologickými ochoreniami [41]. Z uvedených prác vyplýva, že sa apixaban, aj po zohľadnení post-marketingových skúseností, zdá byť rovnako účinným, bezpečným, menej bolestivým a pre pacienta jednoduchším liekom v porovnaní s LMWH v liečbe CA-VTE.
Poslednou otázkou ostáva, aké je postavenie použitia priamych (direktných) orálnych antikoagulancií (DOAK) v liečbe CA-VTE vo svetle odporúčaní odborných spoločností. Ako prvá na pribúdajúce nové poznatky o možnom benefite týchto liekov zareagovala Medzinárodna spoločnosť pre trombózu a hemostázu (International Society on Thrombosis and Haemostasis –ISTH), ktorá vo svojom odporúčaní [47] uvádza, že v prevencii a liečbe CA-VTE je potrebná individualizácia liečby, ktorá sa má vykonať v rámci diskusie s pacientom. V liečbe akútnej CA-VTE odporúča použitie DOAK dôkazom vychádzajúcim z randomizovaných klinických štúdií (v čase vydania odporúčania edoxaban a rivaroxaban) v prípade, že sa jedná o pacientov s nízkym rizikom krvácania a nie sú u nich prítomné možné liek-liekové interakcie s prebiehajúcou systémovou onkologickou liečbou. LMWH ostáva u týchto pacientov akceptovateľnou alternatívou k liečbe DOAK. U pacientov s akútnou CA-VTE a vysokým rizikom krvácania, zahrňujúc pacientov s gastrointestinálnymi a urogenitálnymi malignitami, odporúča ISTH stále použitie LMWH ako 1. voľby liečby, pričom DOAK zostávajú akceptovateľnou alternatívou v prípade, že u konkrétneho pacienta nie sú liek-liekové interakcie s prebiehajúcou systémovou onkologickou liečbou. Následne bolo len nedávno vydané odporné odporúčanie Americkej spoločnosti pre klinickú onkológiu (American Society of Clinical Oncology – ASCO) [48]. Podľa tohto dokumentu nie je odporúčané rutinné podávanie farmakologickej profylaxie VTE všetkým pacientom s onkologickými ochoreniami, u všetkých sa však má v pravidelnom intervale prehodnocovať ich riziko VTE. U pacientov s vysokým rizikom VTE je podľa dokumentu indikovaná farmakologická profylaxia, pričom do úvahy prichádza použitie apixabanu, rivaroxabanu alebo LMWH. V iniciálnej liečbe CA-VTE ASCO odporúča použitie LMWH, UFH, fondaparínu alebo rivaroxabanu. V dlhodobej liečbe je odporúčané použitie LMWH, edoxabanu a rivaroxabanu, pričom táto liečba má trvať 6 mesiacov. Odporúčania zároveň zdôrazňujú potrebu opatrnosti pri použití DOAK u pacientov s gastrointestinálnymi a urogenitálnymi malignitami a u pacientov s vysokým rizikom slizničného krvácania, u ktorých bolo v štúdiách zachytené vyššie riziko závažného krvácania.
Záver
Posledné štúdie ukázali, že priame perorálne inhibítory Xa znižujú riziko VTE v populácii onkologických pacientov bez významného zvýšenia závažného krvácania. Aktuálne výsledky by mali povzbudiť lekárov, aby zvážili použitie primárnej tromboprofylaxie u pacientov s nádorovým ochorením liečených ambulantne pri strednom až vysokom riziku VTE, ktorí nemajú zjavné rizikové faktory krvácania. Súčasné dôkazy naznačujú, že tieto lieky sú vhodnou, účinnou a bezpečnou možnosťou liečby akútneho VTE u mnohých pacientov s rakovinou. LMWH však môže byť naďalej liečbou voľby v závislosti od prítomnosti rizikových faktorov krvácania, typu rakoviny, liekových interakcií a preferencií pacienta.
Práca bola podporená projektom Agentúry pre podporu výskumu a vývoja SR (APVV) 16-0020 a projektom Vedeckej grantovej agentúry Ministerstva školstva, vedy, výskumu a športu SR (VEGA) 1/0090/20.
This work was supported by the project of the Agency for Research and Development Support of the Slovak Republic and by the project of Scientific Grant Agency of the Ministry of Education, Science, Research and Sport of the Slovak Republic (VEGA) 1/0090/20.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.doc. MUDr. Matej Samoš, PhD.
I. interná klinika JLF UK a UN Martin
Kollárova 2
036 59 Martin
e-mail: matej.samos@gmail.com
Obdŕžané/Submitted: 18. 10. 2020
Prijaté/Accepted: 1. 1. 2021
Zdroje
1. Pabinger I, van Es N, Heinze G, Posch F, Riedl J et al. A clinical prediction model for cancer associated venous thromboembolism: a development and validation study in two independent prospective cohorts. Lancet Haematol 2018; 5 (7): e289–e298. doi: 10.1016/S2352-3026 (18) 30063-2.
2. Lyman GH, Khorana AA, Kuderer NM et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2013; 31 (17): 2189–2204. doi: 10.1200/JCO.2013.49.1118.
3. Muldera FI, van Esa N, Kraaijpoela N et al. Edoxaban for treatment of venous thromboembolism in patient groups with different types of cancer: results from the Hokusai VTE Cancer study. Thromb Res 2020; 185 : 13–19. doi: 10.1016/j.thromres.2019.11.007.
4. Raskob GE, van Es N, Verhamme P et al. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med 2018; 378 (7): 615–624. doi: 10.1056/NEJMoa1711948.
5. Corsini A, Ferri N, Proietti M et al. Edoxaban and the issue of drug-drug interactions: from pharmacology to clinical practice. Drugs 2020; 80 (11): 1065–1083. doi: 10.1007/s40265-020-01328-6.
6. Hirsh J, Ginsberg JS. Edoxaban for the treatment of venous thromboembolism in patients with cancer. N Engl J Med 2018; 378 (7): 673–674. doi: 10.1056/NEJMe1800041.
7. Kvasnicka T, Malikova I, Zenahlikova Z et al. Rivaroxaban – metabolism, pharmacologic properties and drug interactions. Curr Drug Metab 2017; 18 (7): 636–642. doi: 10.2174/1389200218666170518165443.
8. Weitz JI, Lensing AWA, Prins MH et al. Rivaroxaban or aspirin for extended treatment of venous thromboembolism. N Engl J Med 2017; 376 (13): 1211–1222. doi: 10.1056/NEJMoa1700518.
9. Bauersachs R, Khorana AA, Lee AYY et al. Cancer-associated venous thromboembolism: Treatment and prevention with rivaroxaban. Res Pract Thromb Haemost 2020; 4 (4): 532–549. doi: 10.1002/rth2.12327.
10. Young AM, Marshall A, Thirlwall J et al. Comparison of an oral Factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT-D). J Clin Oncol 2018; 36 (20): 2017–2023. doi: 10.1200/JCO.2018.78.8 034.
11. Khorana AA, Soff GA, Kakkar AK et al. Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer. N Engl J Med 2019; 380 (8): 720–728. doi: 10.1056/NEJMoa1814630.
12. Cancer associated thrombosis, a pilot treatment study using rivaroxaban (CASTA-DIVA). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02746185.
13. Mantha S, Laube E, Miao Y et al. Safe and effective use of rivaroxaban for treatment of cancer-associated venous thromboembolic disease: a prospectivecohort study. J Thromb Thrombolysis 2017; 43 (2): 166–171. doi: 10.1007/s11239-016-1429-1.
14. Direct oral anticoagulants (DOACs) versus lmwh +/ - warfarin for VTE in cancer (CANVAS). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02744092.
15. Kubisz P, Stanciakova L, Dobrotova M et al. Apixaban – metabolism, pharmacologic properties and drug interactions. Curr Drug Metab 2017; 18 (7): 609–621. doi: 10.2174/1389200218666170424151551.
16. Weycker D, Li X, Wygant GD et al. Effectiveness and safety of apixaban versus warfarin as outpatient treatment of venous thromboembolism in U.S. clinical practice. Thromb Haemost 2018; 118 (11): 1951–1961. doi: 10.1055/s-0038-1673689.
17. Levine MN, Gu C, Liebman HA et al. A randomized phase II trial of apixaban for the prevention of thromboembolism in patients with metastatic cancer. J Thromb Haemost 2012; 10 (5): 807–814. doi: 10.1111/j.1538-7836.2012.04693.x.
18. Agnelli G, Becattini C, Bauersachs R et al. Apixaban versus dalteparin for the treatment of acute venous thromboembolism in patients with cancer: the caravaggio study. Thromb Haemost 2018; 118 (9): 1668–1678. doi: 10.1055/s-0038-1668523.
19. Agnelli G, Becattini C, Meyer G et al. Apixaban for the treatment of venous thromboembolism associated with cancer. N Engl J Med 2020; 382 (17): 1599–1607. doi: 10.1056/NEJMoa1915103.
20. Ikeda S, Koga S, Yamagata Y et al. Comparison of the effects of edoxaban, an oral direct factor Xa inhibitor, on venous thromboembolism between patients with and without cancer. J Cardiol 2018; 72 (2): 120–127. doi: 10.1016/j.jjcc.2018.03.006.
21. Shimizu A, Sawada K, Shiomi M et al. Direct oral anticoagulants are effective and safe for the treatment of venous thromboembolism associated with gynecological cancers. Int J Gynaecol Obstet 2019; 147 (2): 252–257. doi: 10.1002/ijgo.12944.
22. Takama T, Fukue M, Kanaya K et al. Treatment of pulmonary thromboembolism with edoxaban in a cancer patient with borderline fulfillment of the dose reduction criteria. SAGE Open Med Case Rep 2019; 7 : 2050313X19878047. doi: 10.1177/2050313X19878047.
23. Samoš M, Bolek T, Škorňová I et al. Anti-Xa activity-guided edoxaban therapy for cancer-associated venous thromboembolism? Am J Ther 2020; [in press]. doi: 10.1097/MJT.0000000000001202.
24. Toshima H, Hisamatsu A, Kobayashi K et al. Single-drug approach with edoxaban is effective for resolving non-acute cancer-associated venous thrombosis: a single-arm retrospective analysis. Cancers (Basel) 2020; 12 (7): 1711. doi: 10.3390/cancers12071711.
25. Connell NT, Connors JM. Cost-effectiveness of edoxaban versus dalteparin for the treatment of cancer-associated thrombosis. J Thromb Thrombolysis 2019; 48 (3): 382–386. doi: 10.1007/s11239-019-01903-z.
26. Lopes DG, Tamayo A, Schipp B et al. Cost-effectiveness of edoxaban vs low-molecular-weight heparin and warfarin for cancer-associated thrombosis in Brazil. Thromb Res 2020; 196 : 4–10. doi: 10.1016/j.thromres.2020.08.014.
27. Pignataro BS, Nishinari K, Cavalcante RN et al. Oral rivaroxaban for the treatment of symptomatic venous thromboembolism in 400 patients with active cancer: a single-center experience. Clin Appl Thromb Hemost 2017; 23 (7): 883–887. doi: 10.1177/1076029616677 800.
28. Renni MJP, Araujo MLC Jr, Trugilho I et al. Rivaroxaban used in the treatment patients with gynecologic cancer and venous thromboembolism: the experience of Instituto Nacional de Câncer-Rio de Janeiro, Brazil. Int J Gynecol Cancer 2017; 27 (5): 1042–1045. doi: 10.1097/IGC.0000000000000972.
29. Nicklaus MD, Ludwig SL, Kettle JK. Recurrence of malignancy-associated venous thromboembolism among patients treated with rivaroxaban compared to enoxaparin. J Oncol Pharm Pract 2018; 24 (3): 185–189. doi: 10.1177/1078155217690922.
30. Choe HK, De Sancho MT, Kim SS et al. Low molecular weight heparin versus rivaroxaban in the treatment of venous thromboembolism in gastrointestinal malignancies. Blood Coagul Fibrinolysis 2018; 29 (2): 227–230. doi: 10.1097/MBC.0000000000000704.
31. Lee JH, Oh YM, Lee SD et al. Rivaroxaban versus low-molecular-weight heparin for venous thromboembolism in gastrointestinal and pancreatobiliary cancer. J Korean Med Sci 2019; 34 (21): e160. doi: 10.3346/jkms.2019.34.e160.
32. Recio-Boiles A, Veeravelli S, Vondrak J et al. Evaluation of the safety and effectiveness of direct oral anticoagulants and low molecular weight heparin in gastrointestinal cancer-associated venous thromboembolism. World J Gastrointest Oncol 2019; 11 (10): 866–876. doi: 10.4251/wjgo.v11.i10.866.
33. Kim JH, Seo S, Kim KP et al. Rivaroxaban versus low-molecular-weight heparin for venous thromboembolism in advanced upper gastrointestinal tract and hepatopancreatobiliary cancer. In Vivo 2020; 34 (2): 829–837. doi: 10.21873/invivo.11845.
34. Simmons B, Wysokinski W, Saadiq RA et al. Efficacy and safety of rivaroxaban compared to enoxaparin in treatment of cancer-associated venous thromboembolism. Eur J Haematol 2018; doi: 10.1111/ejh.13074.
35. Yhim HY, Choi WI, Kim SH et al. Long-term rivaroxaban for the treatment of acute venous thromboembolism in patients with active cancer in a prospective multicenter trial. Korean J Intern Med 2019; 34 (5): 1125–1135. doi: 10.3904/kjim.2018.097.
36. Søgaard M, Nielsen PB, Skjøth F et al. Risk of recurrence and bleeding in patients with cancer-associated venous thromboembolism treated with rivaroxaban: A nationwide cohort study. Cancer Med 2019; 8 (3): 1044–1053. doi: 10.1002/cam4.1997.
37. Soff GA, Mones J, Wilkins C et al. Rivaroxaban treatment of cancer-associated venous thromboembolism: Memorial Sloan Kettering Cancer Center institutional experience. Res Pract Thromb Haemost 2019; 3 (3): 349–356. doi: 10.1002/rth2.12215.
38. Faqah A, Sheikh H, Bakar MA et al. Comparative analysis of enoxaparin versus rivaroxaban in the treatment of cancer associated venous thromboembolism: experience from a tertiary care cancer centre. Thromb J 2020; 18 : 8. doi: 10.1186/s12959-020-00221-2.
39. Oh SB, Seol YM, Kim HJ et al. Retrospective evaluation of the efficacy and safety of rivaroxaban in patients with cancer-associated venous thromboembolism: a single-center study. Medicine (Baltimore) 2019; 98 (30): e16514. doi: 10.1097/MD.0000000000016514.
40. Lee JH, Hyun DG, Choi CM et al. A retrospective study on efficacy and safety of rivaroxaban and dalteparin for long-term treatment of venous thromboembolism in patients with lung cancer. Respiration 2019; 98 (3): 203–211. doi: 10.1159/000499895.
41. Shimizu A, Sawada K, Shiomi M et al. Direct oral anticoagulants are effective and safe for the treatment of venous thromboembolism associated with gynecological cancers. Int J Gynaecol Obstet 2019; 147 (2): 252–257. doi: 10.1002/ijgo.12944.
42. Lee JH, Lee JH, Jo KW et al. Comparison of rivaroxaban and dalteparin for the long-term treatment of venous thromboembolism in patients with gynecologic cancers. J Gynecol Oncol 2020; 31 (1): e10. doi: 10.3802/jgo.2020.31. e10.
43. Stepien K, Nowak K, Zalewski J et al. Extended treatment with non-vitamin K antagonist oral anticoagulants versus low-molecular-weight heparins in cancer patients following venous thromboembolism. A pilot study. Vascul Pharmacol 2019; 120 : 106567. doi: 10.1016/j.vph.2019.106567.
44. García-Fernández-Bravo I, Demelo-Rodríguez P, Ordieres-Ortega L et al. Cancer associated phlegmasia cerulea dolens successfully treated with apixaban. Blood Res 2018; 53 (1): 90–92. doi: 10.5045/br.2018.53.1.90.
45. Koga M, Sugimoto A, Furo M et al. Apixaban for the treatment of cancer-associated venous thromboembolism and left atrial appendage thrombus refractory to optimal anticoagulation with warfarin: a case report. Eur Heart J Case Rep 2018; 2 (4): yty135. doi: 10.1093/ehjcr/yty135.
46. Wysokinski WE, Houghton DE, Casanegra AI et al. Comparison of apixaban to rivaroxaban and enoxaparin in acute cancer-associated venous thromboembolism. Am J Hematol 2019; 94 (11): 1185–1192. doi: 10.1002/ajh.25604.
47. Khorana AA, Noble S, Lee AYY et al. Role of direct oral anticoagulants in the treatment of cancer-associated venous thromboembolism: guidance from the SSC of the ISTH. J Thromb Haemost 2018; 16 (9): 1891–1894. doi: 10.1111/jth.14219.
48. Key NS, Khorana AA, Kuderer NM et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO clinical practice guideline update. J Clin Oncol 2020; 38 (5): 496–520. doi: 10.1200/JCO.19.01 461.
49. Chao TF, Chen SA, Ruff CT et al. Clinical outcomes, edoxaban concentration, and anti-factor Xa activity of Asian patients with atrial fibrillation compared with non--Asians in the ENGAGE AF-TIMI 48 trial. Eur Heart J 2019; 40 (19): 1518–1527. doi: 10.1093/eurheartj/ehy807.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Editorial
- Základní informace pro rozpoznávání psychických poruch vyvolaných maligním onemocněním
- Antineoplastické, radiosenzibilizující a radioprotektivní vlastnosti kurkuminu
- Cytoredukce a hypertermická intraperitoneální chemoterapie v léčbě peritoneálních metastáz kolorektálního karcinomu v České republice v roce 2018
- Trombóza asociovaná s malignitou – liečba a prevencia priamymi inhibítormi faktora Xa
- PET somatostatinových receptorů nad rámec neuroendokrinních nádorů gastrointestinálního traktu – přehled literatury
- Využití buněčných exozomů jako nového nosiče v genové terapii karcinomu prsu
- Anizokorie jako nežádoucí účinek léčby paklitaxelem
- Informace z České onkologické společnosti
- Vzácný případ gastroezofageálního karcinomu v 24letého muže s achalázií komplikovanou pooperpační aortoezofageální píštělí v důsledku zavedení stentu a časné lokální rekurence
- Myofibroblastický nádor jícnu – kazuistika, dlouhodobý follow-up a přehled literatury
- Antimalarika jako dvousečná zbraň u pacientů s rakovinou a infekcí COVID-19
- Molekulární testování u karcinomu endometria
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Základní informace pro rozpoznávání psychických poruch vyvolaných maligním onemocněním
- Anizokorie jako nežádoucí účinek léčby paklitaxelem
- PET somatostatinových receptorů nad rámec neuroendokrinních nádorů gastrointestinálního traktu – přehled literatury
- Trombóza asociovaná s malignitou – liečba a prevencia priamymi inhibítormi faktora Xa
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




