-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní nádory rekta
Rectal Neuroendocrine Tumours
Rectal neuroendocrine tumours (carcinoids) belong to the hindgut carcinoid group, according to older classification. They are not associated with carcinoid syndrome. Colonoscopy is a gold standard for detecting rectal carcinoids. Endosonography is important for assessing rectal carcinoid growth. CT colonography and 111In-octreotide scanning is required for staging if residual or metastatic disease is suspected. Serum chromogranin A and acid phosphatase are necessary biochemical markers. Local resection is sufficient for small tumours, anterior resection for rectal tumours > 2cm is appropriate. There is no evidence base for adjuvant therapy. Patients with rectal carcinoids < 2cm have a very good prognosis with long term survival.
Key words:
carcinoid – rectal cancer – chromogranin A – OctreoScan – endosonography – therapy
Autoři: O. Louthan
Působiště autorů: IV. interní klinika 1. lékařské fakulty UK a VFN, Praha
Vyšlo v časopise: Klin Onkol 2009; 22(5): 195-201
Kategorie: Přehledy
Souhrn
Rektální neuroendokrinní tumory, dle starší nomenklatury zvané rektální karcinoidy, nevyvolávají karcinoidový syndrom. Kolonoskopie je zlatým standardem pro diagnostiku těchto tumorů. Endosonografie je významná metoda pro hodnocení hloubky růstu, CT kolonografie a 111In-octreoscan pro staging nádoru. Minimálními požadavky pro biochemickou diagnostiku jsou sérový chromogranin A a kyselá fosfatáza. Pro malé tumory je postačující metodou lokální resekce, pro nádory > 2cm je indikována přední resekce. Nebyl prokázán benefit adjuvantní léčby. Pacienti s rektálními karcinoidy < 2cm mají velmi dobrou prognózu s dlouhodobým přežíváním.
Klíčová slova:
karcinoid – nádory rekta – chromogranin A – octreoscan – endosonografie – léčbaÚvod
Neuroendokrinní nádory (NET) rekta jsou podle starší terminologie Williamse a Sandlera z roku 1963 [1] řazeny k tzv. hindgut karcinoidům, což odkazuje na fakt, že část tlustého střeva distálně od středního úseku colon transversum až po rektum vznikla ze zadní části embryonálního střeva. Rektální karcinoidy jsou nejčastějšími hindgut karcinoidy a představují asi 1% všech anorektálních neoplazií.
Podle dat SEER (Surveillance Epidemiology and End Results) z let 1992–1999 tvoří rektální karcinoidy 27,44% všech gastrointestinálních karcinoidů, což představuje nárůst v porovnání se staršími údaji z let 1973–1991, kdy rektální karcinoidy tvořily 15,33% gastrointestinálních karcinoidů [2–3]. Otázkou zůstává vliv omezených diagnostických možností ve starším období a dřívější malá povědomost o této entitě. Rektální karcinoidy se vyskytují u poměrně mladé populace, medián věku v době diagnózy činí 56,2 let. Postihují stejně často muže jako ženy. V porovnání s tím jsou NET proximální části tlustého střeva diagnostikovány ve vyšším věku, nejčastěji u mužů v sedmé dekádě, u žen jsou NET tlustého střeva diagnostikovány nejčastěji v páté dekádě [4]. Většinou bývají zjišťovány náhodně při rutinní sigmoideoskopii.
Endokrinně funkční nádory se v rektu a v proximální části tlustého střeva vyskytují velmi vzácně, neboť nádorové buňky neobsahují substance schopné vyvolat klinicky zjistitelné endokrinní projevy ve smyslu karcinoidového syndromu (např. téměř neobsahují serotonin, typický pro NET tenkého střeva). Na rozdíl od tenkého střeva nebývají NET v tlustém střevě multifokální. Je však nutno uvažovat o adenokarcinomu tlustého střeva jako o nádorové duplicitě u osob z karcinomových rodin, zejména u jedinců starších 40 let.
Klinicko patologický staging a WHO klasifikace
Základní rozdělení je shodné s jinými neuroendokrinními nádory (tab. 1).
Tab. 1. WHO klasifikace neuroendokrinních nádorů. 
Termín „benigní“ je některými patology považován v souvislosti s karcinoidy za sporný, neboť MKN-O klasifikace uvádí pro pátou pozici morfologického kódu s hodnotou „/1“ termín „nejisté, zda benigní, nebo maligní“.
ENETS návrh TNM klasifikace
TNM klasifikace existuje v návrhu, diskutuje se o ní a byla prezentována na konferenci ENETS (European Neuroendocrine Tumor Society) v Paříži v březnu 2008 (tab. 2, 3).
Tab. 2. Návrh TNM klasifikace. 
Tab. 3. Staging neuroendokrinních tumorů rekta. 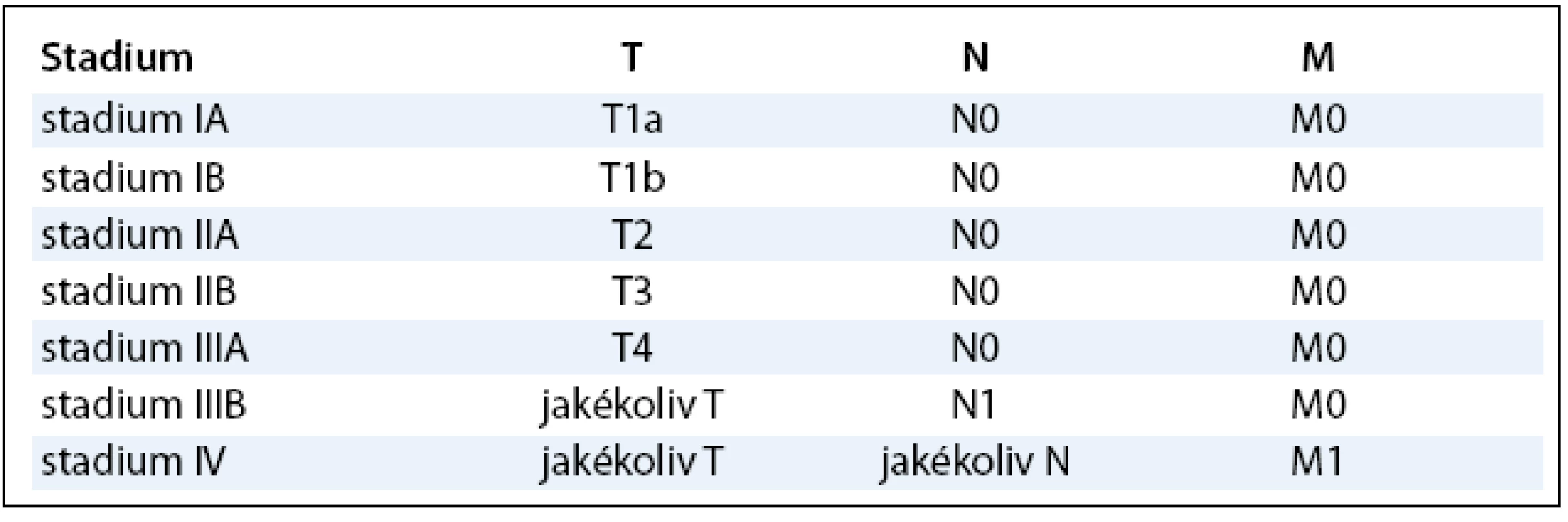
Biologické vlastnosti a prognóza
Prognóza karcinoidů rekta je relativně dobrá, neboť očekávané pětileté přežití dosahuje podle databáze SEER díky biologickým vlastnostem, dřívějšímu nástupu symptomů a včasnější diagnóze v průměru 80%. V době diagnózy je 75 až 85% karcinoidů rekta lokalizovaných. Vzdálené metastázy se vyskytují v 1,7 až 8,1% případů. Při lokalizované formě je pětileté přežití 84–90,8%. Při postižení regionálních uzlin však pětileté přežití klesá na 36,3–48,9% a na 20,6–32,3% u metastazujících forem, které jsou ovšem vzácné. S tím kontrastuje prognóza karcinoidů proximální části tlustého střeva, tedy céka, colon ascendens a proximální části colon transversum, která je naopak poměrně nepříznivá, neboť pětileté přežití NET v proximální lokalizaci tlustého střeva se pohybuje mezi 40 a 70%. Pro srovnání celkové pětileté přežití u všech gastrointestinálních karcinoidů činí asi 67% (tab. 4).
Tab. 4. Patologické a biochemické charakteristiky. 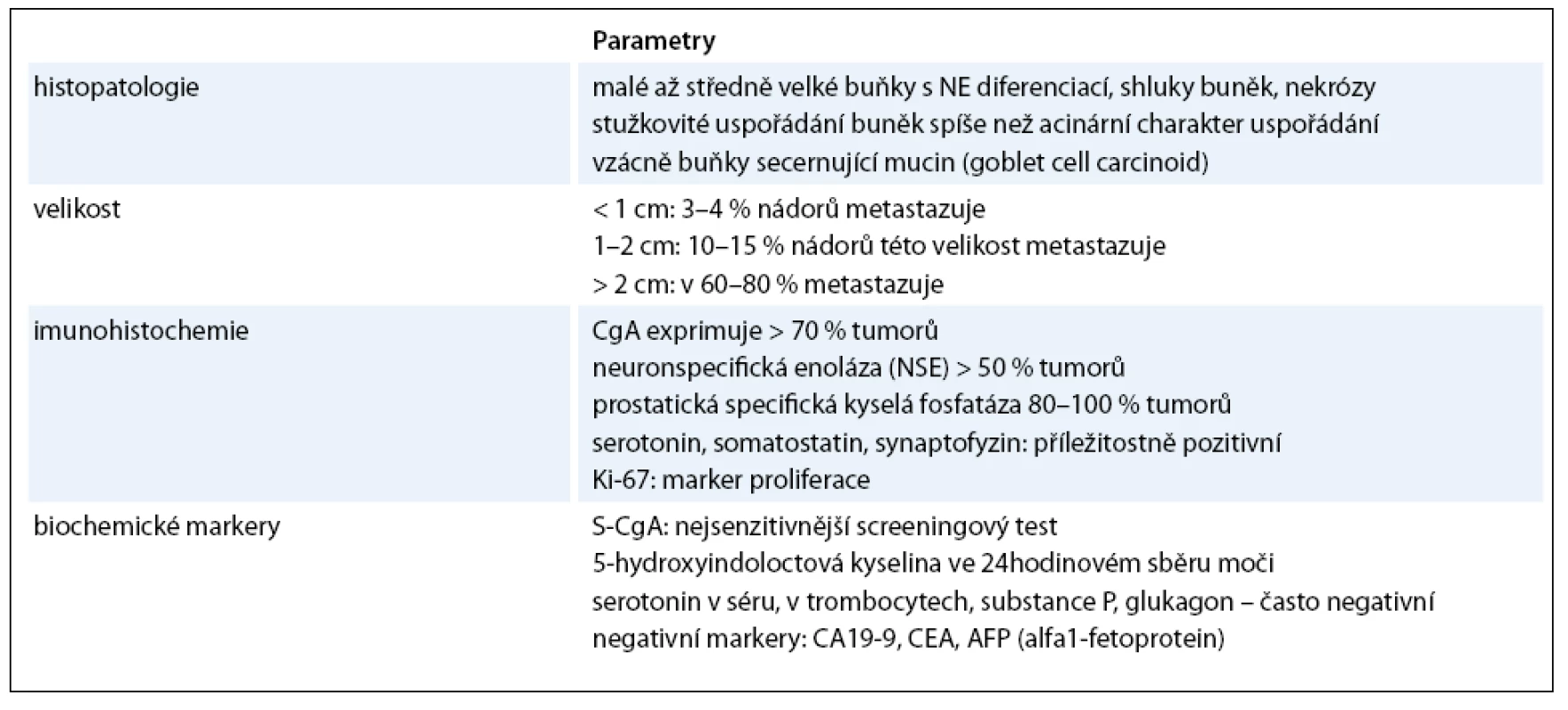
Hlavními faktory ovlivňujícími prognózu NET rekta je velikost tumoru a histologický nález. Rektální tumory < 1cm metastazují jen výjimečně, tumory velké 1–2cm mají riziko metastazování do lymfatických uzlin asi v 5%. Faktory zvyšující riziko metastazování jsou velikost nádoru > 2cm, špatná diferenciace, invaze do muscularis mucosae, angioinvaze, perineurální invaze, invaze do lymfatického systému, angiogeneze, přítomnost buněčných atypií, vyšší mitotický a proliferační index podle Ki-67 a staging nádoru. Tumory mají tendenci metastazovat do regionálních lymfatických uzlin, do jater a vzácně do skeletu.
Patologie a genetika
V rámci dobře diferencovaných NET tlustého střeva a rekta existují dva typy [9]: tumory obsahující EC buňky a tumory obsahující L buňky.
NET v proximální části tlustého střeva jsou většinou tvořeny EC buňkami. Rektální NET jsou naproti tomu tvořeny především L buňkami, obsahujícími peptidy blízké glicentinu, glukagonu a peptidu PYY a jejich prekurzory, serotonin je přítomný vzácně. Další peptidy, jako synaptofyzin a chromogranin A, jsou vyšetřovány rutinně imunohistochemicky.
Rektální karcinoidy vyrůstají z hlouběji uložených částí slizničních žlázek. Mají vzhled hladkých, okrouhlých submukózních uzlů anebo fokálních ložisek ztluštění submukózy normální či žlutavé barvy. Jsou velké od několika milimetrů do několika centimetrů. Nacházejí se ve vzdálenosti 4–20cm od linea dentata na přední či laterální stěně rekta.
Histologie: Dobře diferencované neuroendokrinní tumory (WHO skupina 1) [5] tvoří uniformní buňky s malým počtem mitóz, uspořádané jako podslizniční shluky nebo pruhy s omezenou invazí do lymfatik, bez produkce mucinu, bez angioinvaze, perineurální invaze či prorůstání za muscularis propria [6]. Mitotický index Ki67 je nízký, nepřesahuje 2% [7–8].
Podobný obraz je u dobře diferencovaných neuroendokrinních karcinomů (WHO skupina 2), jež však mají vyšší mitotický index, vykazují invazi do lymfatického systému, angioinvazi a hlubší invazi do střevní stěny. Tento typ nádoru tvoří trabekulární buněčné formace. V porovnání s tím nádorové buňky u dobře diferencovaných neuroendokrinních tumorů proximální části tlustého střeva tvoří solidní formace.
Málo diferencované malobuněčné neuroendokrinní karcinomy (WHO skupina 3) mají solidní strukturu s centrálními nekrózami, buněčnou atypií, vysoký mitotický a proliferační index Ki67 (vyšší než 10%, ale nezřídka i nad 50%), vykazují invazi do střevní stěny, lymfatik, angioinvazi [6] a perineurální invazi. Bývá prokazován mucin, enteroglukagon a hormony příbuzné pankreatickému polypeptidu, ale nikoli serotonin. Buňky mohou vykazovat pozitivitu barvení na neuron-specifickou enolázu nebo PGP 9.5. Dále bývá typicky přítomen synaptofyzin v malých vesikulích a chromogranin A v sekrečních granulích. U málo diferencovaných NET je též vhodný marker p53. V 80–100% NET rekta je exprimována prostatická specifická kyselá fosfatáza, lze jí užít jako onkomarker. Specializované laboratoře mohou stanovit somatostatinové receptory subtyp 2A (existuje celkem 5 subtypů: SSTR1 až SSTR5). Choriogonadotropin (β-hCG) může mít vztah k malignímu potenciálu nádoru.
Minimální histopatologický konsenzus: Histologická klasifikace vychází z WHO kritérií, v rámci minimálních požadavků na imunohistochemické vyšetření NET je nutno provést vyšetření chromograninu, synaptofyzinu a vyšetření proliferačního indexu Ki67 [8–10].
Genetické vyšetření: Genetické anomálie nejsou popisovány, genetická vyšetření se rutinně neprovádějí. Neuroendokrinní tumory rekta a tlustého střeva se prakticky vůbec nevyskytují v rámci mnohočetné adenomatózy (tab. 5).
Tab. 5. Pětileté přežití u rektálních neuroendokrinních tumorů podle SEER 1973–1999. 
Klinické projevy
Asi ve 40% jsou NET rekta náhodně zjištěny při endoskopickém vyšetření provedeném z různých důvodů. Jindy se tumor manifestuje přítomností krve ve stolici, rektálním syndromem (tenesmus, rektální dyskomfort nebo bolest), vzácně projevy střevní obstrukce. NET rekta jsou endokrinně prakticky vždy němé, nevyvolávají karcinoidový syndrom.
Podmínkou pro vznik karcinoidového syndromu by mimo přítomnost jaterních metastáz byla přítomnost enterochromafinních buněk s produkcí serotoninu, ale nádory v této lokalizaci serotonin prakticky neobsahují. Proto metastatická nemoc může být i delší dobu klinicky němá, později se manifestuje hepatomegalií, bolestmi břicha v pravém horním kvadrantu, nechutenstvím, hubnutím, slabostí, karcinoidový syndrom nebývá přítomen [11].
Diagnostika
Laboratorní vyšetření
Kyselina 5-hydroxyindoloctová (5-HIOK) ve 24hodinovém sběru moči je většinou normální. U malých primárních nádorů je sérový chromogranin A v mezích normy, u větších primárních nádorů a u metastatické nemoci bývá sérový chromogranin A (S-CgA) zvýšen. Stupeň jeho navýšení může odrážet rozsah nádorového postižení. Tumory vykazují pozitivitu prostata-specifické kyselé fosfatázy a β-hCG. Může být zvýšený i pankreatický polypeptid a enteroglukagon. Minimálním požadavkem pro vyšetření je dle ENETS vyšetření S-CgA a kyselé fosfatázy [12].
Endoskopie
Většina lézí je v rektu diagnostikována endoskopicky. Ložiska lze je odstranit polypektomií s histologickým potvrzením diagnózy. Kolonoskopie je zlatým standardem pro diagnózu, staging a bližší určení kolorektálních NET. V rámci stagingu je třeba vyloučit přítomnost synchronních karcinomů. Všechny polypy je nutno odstranit anebo, v případě nemožnosti kompletního odstranění, bioptovat a označit pro budoucí chirurgické či endoskopické snesení. Centrální vklesliny sliznice nebo ulcerace jsou známkami možného maligního potenciálu.
Irrigografie, CT kolonografie
CT kolonografie může prokázat infiltraci perirektálního tuku, perirektální fascie anebo infiltraci perirektálních a pararektálních lymfatických uzlin. Pozitivní nález musí být ověřen kolonoskopicky a potvrzen histologickým vyšetřením. Irigografie má doplňkový význam.
Endorektální endosonografie
Endorektální endosonografie je užitečná pro předoperační vyšetření rektálních karcinoidů. Vyšetření může ukázat velikost nádoru, hloubku invaze a případné postižení pararektálních lymfatických uzlin [13].
Transabdominální ultrazvuk
Nemá větší přínos pro diagnostiku primárního tumoru, může však detekovat případné jaterní metastázy a usnadnit jejich biopsii.
Počítačová tomografie (CT) a magnetická rezonance (MR)
Obě tyto modality jsou senzitivnější nežli ultrazvuk. Víceřezové (multislice) trifázické CT je nejužitečnější pro staging, pokud jde o detekci případných lézí hrudníku či břicha. Podle některých autorů je MR nadřazena CT, pokud jde o detekci jaterních metastáz, ale jiní obě metody považují za srovnatelné. Každý rektální tumor, který nebyl kompletně odstraněn při endoskopii, musí být vyšetřen endosonograficky a pomocí CT či MR s posouzením lokálního šíření do okolních pánevních struktur a s posouzením resekability.
111In-octreoscan
Senzitivita octreoscanu pro detekci primárního rektálního nádoru není dosud přesně známa. Vyšetření je zásadní pro staging a pro detekci jaterních metastáz. Dediferencované NET s malou expresí somatostatinových receptorů nemusí akumulovat radionuklid, nádorová ložiska zde nemusí být proto vizualizována. Pozitivita octreoscanu, podmíněná přítomností somatostatinových receptorů na povrchu nádorových buněk, predikuje i možnou odpověď na případnou léčbu analogy octreotidu u pokročilých forem. Octreoscan je možno na vybavených pracovištích využít intraoperačně při detekci malých nádorů anebo k detekci reziduálních metastáz do lymfatických uzlin [14]. Vhodné, leč velmi málo dostupné vyšetření pro diferencovaný NET je 68gallium DOTA octreotate.
Pozitronová emisní tomografie (PET)
Málo diferencované rychle rostoucí tumory lze vizualizovat pomocí 18-fluorodeoxyglukózy. Dobře diferencované NET mají nízký metabolický obrat, a proto nemusí být tímto radionuklidem zobrazeny.
Poznámky ke stagingu: Je li rektální tumor malý, s rozměry < 10mm a s nízkým proliferačním indexem Ki67, není další staging zpravidla nutný. Pokud byla kolonoskopie neúplná, je třeba provést doplňující CT kolonografii. Minimální požadavky na detekci NET tlustého střeva zahrnují kolonoskopii s biopsií a s kontrastním CT vyšetřením břicha a malé pánve (schéma 1).
Schéma 1. Algoritmus diagnostiky NET rekta. 
Terapie
Chirurgická léčba
Lokalizovaný nález
Jediný kurativní přístup je radikální odstranění lokalizovaného nádoru. Malé rektální karcinoidy většinou nemetastazují, a proto endoskopické odstranění či metodu transanální endoskopické mikrochirurgie (TEM) lze považovat za kurativní léčebné postupy [15–16]. TEM je minimálně invazivní mikrochirurgická technika umožňující odstraňovat nádory ve vzdálenosti 4–18cm od anu [17].
Léze menší než < 1cm metastazují vzácně, u < 3% případů v dlouhodobém sledování. Tyto malé léze představují asi 80% všech případů rektálních karcinoidů. Mohou být odstraněny kompletně endoskopicky nebo transanální resekcí [18]. Podmínkou je absence invaze do muscularis propria, absence centrální indurace či ulcerace [19] potvrzená endosonograficky. V případě endosonograficky potvrzené lokální invaze nebývá standardní polypektomie dostatečným opatřením. Transanální resekce je možná u výše situovaných lézí a umožňuje resekci celé vrstvy sliznice a svaloviny [20]. Přední resekce je dle některých autorů zbytečně razantní, s nepříznivým poměrem rizika vůči benefitu.
Tumory o velikosti 1–2cm představují asi 10% případů karcinoidů rekta. Další vývoj je nejistý, k metastazování dochází v 10–15%. Proto jsou i poněkud rozporné názory na operační postupy. Většinou se doporučuje široká excize s vyloučením invaze do svaloviny střevní stěny. Někteří doporučují lokální či radikální chirurgický výkon [20–21], většinou ale tumory do 2cm velikosti mají nízký mitotický index, nevykazují invazi přes lamina propria, a proto je možno tumory odstranit lokální resekcí [22–23]. V úvahu tedy připadá endoskopické odstranění, transanální excize vs přední resekce podle konkrétních okolností.
V rozhodnutí může pomoci histologické a histochemické vyšetření nádorové tkáně a endosonografické vyšetření nádorové léze. Některé studie neprokázaly prospěch z agresivních léčebných postupů, ovšem u high grade tumorů je nutné uvážit extenzivnější výkon [21,23–24].
Léze větší než 2cm představují necelých 10% případů NET rekta. Mají významně vyšší metastatický potenciál pohybující se mezi 60 a 80%, s častou přítomností invaze muscularis propria. Chirurgická léčba je v principu podobná jako u adenokarcinomu [21–23]. V praxi se používá totální mezorektální excise s kurativním léčebným záměrem, přední resekce. Vliv na přežití není dosud znám. Lokální odstranění primárního NET rekta u generalizovaného nádoru může mít paliativní efekt. Lokoregionální resekce u radikálně inoperabilních forem může mít rovněž paliativní účinek při ovlivnění lokálních symptomů a pánevního postižení, ovšem bez zlepšení přežití [25].
Paliativní léčba u pokročilých forem onemocnění
Vodítkem v rozhodovacím procesu u paliativní péče je kvalita života pacienta. NET metastazují většinou do jater. Léčba v podstatě zahrnuje postupy používané u generalizovaného onemocnění NET jiné lokalizace v zažívacím traktu: (chemo-)embolizace, chirurgická cytoredukce, resekce jaterních metastáz, radiofrekvenční ablace [26].
V porovnání s NET tenkého střeva a proximální částí tlustého střeva je desmoplastická reakce u generalizovaného NET rekta málo častá, a proto zde problémy se strangulací střevních kliček adhezemi či ischemické komplikace většinou není třeba řešit.
Bioterapie
I když rektální NET exprimují somatostatinové receptoty, nejsou analoga paušálně indikována. Hlavní indikací k aplikaci analog je karcinoidový syndrom, ten však není u rektálních karcinoidů častý. V některých případech se zahajuje aplikace analog se snahou docílit tumoristatický efekt. Taková léčba by měla probíhat v rámci kontrolované klinické studie, v principu se to týká i interferonu alfa [27].
Systémová chemoterapie
Není u dobře diferencovaných NET rekta indikována, výjimečně se u progredujících neoplazií doporučuje 5-fluorouracil se streptozotocinem, ten však v ČR není běžně dostupný. Navíc procento léčebných odpovědí je nízké – < 25%. U rychle progredujících, málo diferencovaných NET se aplikuje kombinace cisplatiny s etopozidem. Léčebná odpověď je > 50%, ale procento časných relapsů je značné. Nově se v rámci klinického výzkumu aplikují antiangiogenetické látky či inhibitory mTOR (mammalian target of rapamycin) neboli rapaloga (analoga rapamycinu), např. everolimus, v kombinaci s analogy somatostatinu. Intracelulární protein mTOR hraje ústřední roli v řízení buněčného růstu a proteosyntéze. Jeho inhibicí ve spojení s dalším léčebným zásahem, např. aplikací analoga somatostatinu, může být docíleno tumoristatického efektu nádoru. U karcinoidů rekta však nejsou s touto kombinací větší klinické zkušenosti.
Peptidová receptorová radionuklidová terapie (PRRT)
Tak jako u NET jiných lokalizací přichází v úvahu u radikálně inoperabilních nádorů s pozitivitou octreoscanu. Používají se čisté beta zářiče 90Yttrium nebo 177Lutetium navázané na somatostatinová analoga octerotid či octreotate [28–29]. Na rozdíl od generalizovaných karcinoidů tenkého střeva však u NET rekta není s touto léčbou dostatek zkušeností. V úvahu dále přichází cílené ozáření jaterních metastáz metodou SIRT (selective internal radiation therapy) se zavedením mikrosfér pryskyřice s navázaným 90Yttriem do větví arteria hepatica zásobujícím jaterní metastázy. Tato metoda se rovněž zavádí do klinického použití, je však cenově nákladná a není ve světě většinou hrazena pojišťovnami. Pozitivita octreoscanu pro realizaci léčby touto modalitou není nutná.
Adjuvantní terapie
Dle dosavadních zkušeností není indikována. Lze uvažovat o adjuvantní chemoterapii u málo diferencovaných tumorů, není li jisté, zda chirurgický výkon byl dostatečně radikální [23] (schéma 2).
Schéma 2. Algoritmus terapie u NET rekta. 
Kontroly po chirurgickém nebo endoskopickém odstranění tumoru (dle ENETS):
Pokud je chirurgický výkon radikální, jsou výsledky dlouhodobého přežívání velmi dobré i u větších nádorů.
Dispenzarizace pacientů by měla být trvalá i u příznivých forem NET rekta s ohledem na fakt, že vznik metastatické nemoci bývá popisován po 5–10 i více letech, i když ENETS doporučuje ponechat tumory o velikosti < 1cm bez dalších kontrol a tumory o velikosti < 2cm jen v případě rizikových faktorů (angioinvaze, perineurální růst, invaze do muscularis mucosae, atypie v histologii).
Frekvence kontrol
- a) U nemocných s nižším rizikem se provádí octreoscan a sérové markery v prvním roce a dále ročně.
- b) U ostatních případů každých 4–6 měsíců první rok, dále alespoň 1krát ročně.
V rámci kontrol se provádí endoskopická vyšetření, dle potřeby rektální endosonografie a vyšetření onkomarkerů. Z markerů jde o vyšetření sérového chromograninu A a kyselé fosfatázy v séru. Jiné onkomarkery mohou být zvýšené, ale v rutinní praxi se jejich vyšetření neprovádí. 5-HIOK ve 24hodinovém sběru moči je většinou u rektální NET negativní, a proto ji není třeba v rámci kontrol většinou provádět. Při restagingu nebo podezření na metastatickou nemoc je nutno provést CT či MR a octreoscan.
Závěr
Rektální neuroendokrinní nádory (karcinoidy) jsou poměrně vzácné. Mají maligní potenciál, jež je zřetelně nižší nežli u karcinoidů proximální části tlustého střeva. U rektálních karcinoidů nebývá přítomen karcinoidový syndrom. Většina tumorů je diagnostikována endoskopicky, lokální staging se provádí endosonograficky. Vzdálené metastázy lze detekovat obvyklými zobrazovacími metodami, u NET má pak zvláštní význam octreoscan. Kurativní léčbou je radikální chirurgické odstranění a u malých nádorů endoskopické odstranění. Paliativní léčba spočívá v ablační terapii, jako jsou embolizace nádoru, radiofrekvenční ablace, chirurgická cytoredukce či resekce jaterních metastáz. S terapií analogy somatostatinu či s chemoterapií není větší zkušenost vzhledem k ojedinělým případům generalizace rektálních NET.
Článek byl vytvořen v rámci výzkumného záměru MŠMT 00216200808.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Oldřich Louthan
IV. interní klinika
1. lékařské fakulty UK a VFN v Praze
U nemocnice 2
128 08 Praha 2
e-mail: louthan@post.cz
Zdroje
1. Williams ED, Sandler M. The classification of carcinoid tumours. Lancet 1963; 281 : 238–239.
2. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128 : 1717–1751.
3. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13 715 carcinoid tumours. Cancer 2003; 97 : 934–959.
4. Jetmore AB, Ray JE, Gathright JB et al. Rectal carcinoids: the most frequent carcinoid tumor. Dis Colon Rectum 1992; 35 : 717–725.
5. Capella C, Heitz PU, Hofler H et al. Revised classification of neuroendocrine tumours of the lung, pancreas and gut. Virchows Arch 1995; 425 : 547–560.
6. Onogawa S, Tanaka S, Oka S et al. Clinical significance of angiogenesis in rectal carcinoid tumors. Oncol Rep 2002; 9 : 489–494.
7. Shimizu T, Tanaka S, Haruma K et al. Growth characteristics of rectal carcinoid tumors. Oncology 2000; 59 : 229–237.
8. Hotta K, Shimoda T, Nakanishi Y et al. Usefulness Ki-67 for predicting the metastatic potential of rectal carcinoids. Pathol Int 2006; 56 : 591–596.
9. Solcia E, Klöppel G, Sobin LH. Histological typing of endocrine tumours. Springer-Verlag 2000.
10. Modlin IM, Öberg IK. A Century of Advances in Neuroendocrine Tumor Biology and Treatment. Published by Felsenstein C.C.C.P.: 464.
11. Öberg K. Neuroendocrine gastrointestinal tumours. Annals of Oncology 1996; 7 : 453–463.
12. Öberg K. Carcinoid Tumors: Current Concepts in Diagnosis and Treatment. The Oncologist 1998; 3 : 339–345.
13. Matsumoto T, Iida M, Suekane H et al. Endoscopic ultrasonography in rectal carcinoid tumors: contribution to selection of therapy. Gastrointest Endosc 1991; 37 : 539–542.
14. Banzo J, Vidal-Sicat S, Prats E et al. In-111 DTPA octreotide scintigraphy and intraoperative gamma probe detection in the diagnosis and treatment of residual lymph node metastases of a rectal carcinoid tumor. Clin Nucl Med 2005; 30 : 308–311.
15. Matsushita M, Takakuwa H, Nishio A. Management of rectal carcinoid tumors. Gastrointest Endosc 2003; 58 : 641.
16. Kinoshita T, Kanehira E, Omura K et al. Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor. Surg Endosc 2007; 21 : 970–974.
17. Anděl P, Dostalík J, Pelikán A et al. Transanální endoskopická mikrochirurgie ve FN Ostrava. Čes a Slov Gastroent a Hepatol 2007; 61(5): 264–268.
18. Onozato Y, Kakizaki S, Ishihara H et al. Endoscopic submucosal dissection for rectal tumors. Endoscopy 2007; 39 : 423–427.
19. Shirouzou K, Isomoto H, Kakegawa T et al. Treatment of rectal carcinoid tumors. Am J Surg 1990; 160 : 262–265.
20. Schindl M, Niederle B, Hafner M et al. Stage-dependent therapy of rectal carcinoid tumors. World J Surg 1998; 22 : 628–633.
21. Koura AN, Giacco GG, Curley SA et al. Carcinoid tumors of the rectum: effect of size, histopathology, and surgical treatment on metastasis free survival. Cancer 1997; 79 : 1294–1298.
22. Loftus JP, van Heerden JA. Surgical management of gastrointestinal carcinoid tumours. Adv Surg 1995; 28 : 317–336.
23. Ahlman H, Wängberg B, Jansson S et al. Interventional Treatment of Gastrointestinal Neuroendocrine Tumours. Digestion 2000; 62 (Suppl 1): 59–68.
24. Ramage JK, Goretzki PE, Manfredi R et al. Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumours: Well Differentiated Colon and Rectum Tumour/Carcinoma. Neuroendocrinology 2008; 87 : 31–39.
25. O’Toole D, Maire F, Ruszniewski P. Ablative therapies for liver metastases of digestive endocrine tumours. Endocr Relat Cancer 2003; 10 : 463–468.
26. Öberg K. Established Clinical Use of Octreotide and Lanreotide in Oncology. Chemotherapy 2001; 47 : 40–53.
27. Van Essen M, Krenning EP, De Jong M et al. Peptide Receptor Radionuclide Therapy with radiolabelled somatostatin analogues in patients with somatostatin receptor positive tumours. Acta Oncol 2007; 46 : 723–734.
28. Coldwell D, Kennedy AS, Van Echo DA. Comparative side effects of yttrium-90 based intra-arterial brachytherapy. J Clin Oncol 2004; 22 : 3760.
29. Otte A, Mueller-Brand J, Dellas S et al. Yttrium-90-labelled somatostatin analogue for cancer treatment. The Lancet 1998; 351 : 417–418.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2009 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Neuroendokrinní nádory rekta
- DNA a mikroRNA čipové technologie v diagnostice a predikci u pacientů s renálním karcinomem
- Proteomická analýza nádorových buněk
- Studie evaporace vybraných cytostatik a propustnosti ochranných rukavic v rámci výzkumu profesní zátěže zdravotnických pracovníků exponovaných cytotoxickým protinádorovým léčivům (projekt CYTO)
- Polymorfizmus –2548 G/A v genu pro leptin u pacientek s endometriálním karcinomem
- Profily nízkomolekulárního proteomového spektra získané pomocí hmotnostní spektrometrie SELDI-TOF v sérech pacientů s diseminovaným maligním melanomem: pilotní studie
- Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty
- Úvaha nad vývojem screeningu kolorektálního karcinomu
- Pohled na vývoj onkologie ve 3. tisíciletí
- Zápis ze schůze výboru České onkologické společnosti dne 8. 9. 2009 v Liberci
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní nádory rekta
- Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty
- Studie evaporace vybraných cytostatik a propustnosti ochranných rukavic v rámci výzkumu profesní zátěže zdravotnických pracovníků exponovaných cytotoxickým protinádorovým léčivům (projekt CYTO)
- Proteomická analýza nádorových buněk
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



