-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTrastuzumab v liečbe karcinómu prsníka: mechanizmy účinku a rezistencie
Trastuzumab in the breast cancer treatment: efficacy and resistance mechanisms
Trastuzumab, a humanized monoclonal antibody against the HER-2 receptor, was the first targeted therapy for HER-2 positive breast cancer. The treatment of HER-2 positive breast cancer in monotherapy, but mainly in combination with cytostatics trastuzumab, showed significant efficacy and increased the time to progression/relapse and overall survival. On the other hand, despite it being administered to only a selected patient population, the response rate varies in range and duration due to the primary or acquired tumor resistance to trastuzumab. Several mechanisms contributing to the drug resistance are presumed and overcoming strategies are in development. In connection with the drug resistance there are the mechanisms of trastuzumab’s action on tumor cells and the search for feasible biomarkers in order to predict the response of trastuzumab‑based targeted therapies. Furthermore, we present here the actual possibilities to overcome primary or acquired trastuzumab resistance.
Key words:
trastuzumab – breast cancer – oncogene protein HER-2 – mechanism of action – drug resistance
Autoři: P. Grell 1,2; M. Svoboda 1,2
; M. Šimičková 1; P. Fabian 1; R. Vyzula 1
Působiště autorů: Masarykův onkologický ústav, Brno 2LF MU, Brno 1
Vyšlo v časopise: Klin Onkol 2009; 22(2): 45-51
Kategorie: Přehledy
Souhrn
Trastuzumab, humanizovaná monoklonálna protilátka proti HER-2 receptoru, bol prvou cielenou liečbou pre pacientky s HER-2 pozitívnym karcinómom prsníka. Samostatne, ale hlavne v kombinácii s chemoterapiou trastuzumab zvyšuje liečebnú odpoveď, predlžuje čas do progresie/relapsu ochorenia i celkové prežitie pacientok. Na strane druhej, i napriek tomu, že je trastuzumab podávaný úzkej vyselektovanej skupine pacientok, odpoveď na túto cielenú liečbu je variabilná, a to ako v rozsahu, tak i v dĺžke trvania. Príčinou je existencia primárnej a prípadne vznik sekundárnej rezistencie ochorenia voči tejto protilátke. Predpokladá sa existencia niekoľkých možných mechanizmov rezistencie a vyvíjajú sa stratégie na ich prekonanie. S tým úzko súvisia mechanizmy pôsobenia trastuzumabu na nádorovú bunku a možnosti predikcie odpovedi na túto liečbu. V článku ďalej poukážeme na aktuálne možnosti prekonania primárnej a indukovanej rezistencie k trastuzumabu.
Kľúčové slová:
trastuzumab – karcinóm prsníka – proteín HER-2 – mechanizmy účinku – rezistenciaÚvod
U približne 15–25% pacientok vykazuje karcinóm prsníka nadmernú expresiu HER-2 receptoru alebo amplifikáciu génu (ďalej jen HER-2 pozitívne karcinómy). HER-2 pozitivita je spojená s vysokou a časnou incidenciou relapsov ochorenia, vysokou mortalitou, častým metastatickým postihnutím centrálneho nervového systému a so vznikom sekundárnej rezistencie na protinádorovú terapiu [1].
HER2 receptor
HER-2 patrí spolu s EGFR (HER-1), HER-3 a HER-4 do rodiny ľudských receptorov pre epidermálne rastové faktory. Gén pre HER-2, nazývaný aj HER-2/neu, sa nachádza na chromozóme 17q12. HER-2 je transmembránový receptor pozostávajúci z extracelulárnej domény, krátkeho transmembránového úseku a intracelulárnej domény, ktorá vykazuje tyrozín-kinázovú aktivitu. HER-2 ako jediný z rodiny HER nemá ligand vazäbnú doménu. Normálna bunka prsníka obsahuje na svojom povrchu približne 20 000 HER-2 receptorov, nádorová bunka pritom obsahuje 500 000 až 2 000 000 receptorov, teda niekoľkonásobne viac [2]. Onkogénny potenciál HER-2, teda schopnosť meniť fenotyp bunky na malígny, bol prvý krát popísaný pred 20 rokmi, a to schopnosťou transformovať normálne fibroblasty na bunky s nádorovými vlastnosťami [3].
K aktivácii HER-2 receptoru dochádza pri heterodimerizácii HER-2 s ostatnými receptormi HER skupiny, predovšetkým s HER-3, a pri nadmernej expresii i procesom homodimerizácie [4]. Odlišný typ aktivácie je spôsobený štiepením (tzv. cleavage), ku ktorému vo zvýšenej miere dochádza pri nadmernej expresii receptoru. V tomto prípade podlieha extracelulárna doména receptoru proteolýze za prítomnosti metaloproteináz a vzniká skrátená forma receptoru p95HER-2, ktorá vykazuje konštitutívnu tyrozín-kinázovú aktivitu [5]. Aktiváciou HER-2 dochádza k stimulácii predilekčne dvoch onkogénnych signálnych dráh, PI3K/Akt a Ras/MAPK, a následne k regulácii rôznych bunečných funkcií, ako je apoptóza, prežívanie bunky, bunečný rast, adhézia buniek, migrácia, diferenciácia, schopnosť metastázovania, rezistencia na terapiu a ďalšie [6].
Tieto skutočnosti spolu s klinickým významom HER-2 pozitivity viedli k hľadaniu cielene liečby proti HER-2 receptoru.
Mechanizmy účinku trastuzumabu
Trastuzumab je humanizovaná monoklonálna protilátka proti HER-2 receptoru. V preklinických štúdiách bol testovaný panel rôznych anti‑HER-2 protilátok. Najvyššiu afinitu preukázala protilátka 4D5, ktorá bola neskôr vyselektovaná k procesu humanizácie. Následne bola v roku 1990 vytvorená prvá klinicky použiteľná rekombinantná humanizovaná monoklonálna protilátka, a to naviazaním variabilnej časti väzbovej domény myšej protilátky na molekulu ľudského imunoglobulínu rady IgG1 [7]. Aj keď klinický význam trastuzumabu v liečbe HER-2 pozitívnych nádorov prsníka je evidentný, presný mechanizmus účinku trastuzumabu nie je úplne objasnený a predpokladá sa niekoľko možností.
Inhibícia štepenia extracelulárnej časti HER-2
Pri nadmernej expresii HER-2 dochádza na povrchu bunky k proteolýze receptoru, pričom vzniká skrátená forma HER-2 receptoru – p95HER-2, ktorá navyše vykazuje permanentnú tyrozín-kinázovú aktivitu [5]. Pri tomto procese sa zároveň odštepuje extracelulárna časť HER-2 (HER-2 ECD), ktorá preniká do krvného obehu, kde môžeme stanovovať jej hladinu. Liečba trastuzumabom spôsobuje, že dochádza k priamej inhibícii proteolýzy HER-2, a to pravdepodobne spôsobom, kedy trastuzumab stéricky blokuje miesto, na ktorom pomocou metaloproteináz rodiny ADAM dochádza k procesu štiepenia [8]. S inhibíciou proteolýzy dochádza zároveň k poklesu hladiny sérovej HER-2 ECD. Ako sme aj my poukázali, tento pokles počas liečby pozitívne koreluje s klinickou odpoveďou a pacientky, u ktorých do troch mesiacov dochádza k normalizácii HER-2 ECD, majú dlhší čas do progresie ochorenia. Odpoveď na terapiu trastuzumabom a dĺžku jej trvania viac než iniciálna sérová hladina HER-2 ECD ovplyvňuje typ jej dynamiky v priebehu liečby [9].
Inhibícia signálnych dráh HER-2 receptoru: PI3K/Akt a Ras/MAPK
Po stimulácii HER-2 receptoru dochádza k aktivácii hlavne dvoch základných bunečných signálnych dráh: PI3K/Akt a Ras/MAPK. Zo súčasných poznatkov vyplýva, že v súvislosti s účinkom trastuzumabu má zásadné postavenie PI3K/Akt signálna dráha [10,11]. Akt kináza patrí medzi širokú skupinu cAMP dependentných serínových-treonínových kináz. Akt reguluje rozmanité bunečné funkcie cestou sprostredkovania signálu od bunečného povrchu k jadru a cytoplazme. Deje sa tak pomocou fosforylácie rôznych bunečných substrátov. Sú známe 3 izoformy Akt a dnes je zrejmé, že majú rôzne, aj keď čiastočne spoločné funkcie [12–17]. Aktivácia Akt je mnohostupňový proces, ktorý začína na bunečnom povrchu. Konformačnou zmenou HER-2 na povrchu bunky dochádza k aktivácii jeho intracelulárnej tyrozín-kinázovej domény. To spôsobuje presun PI3K (fosfatidylinozitol-3-kináza) k bunečnej membráne a následne premenu PIP2 na PIP3 (fosfatidyl-inozitol-bisfosfát, resp. trisfosfát). Hladina PIP3 je prísne kontrolovaná pomocou rôznych fosfatáz, predovšetkým PTEN. PIP3 sa následne podieľa na aktivácii Akt. K plnej aktivácii Akt dochádza fosforyláciou na dvoch rôznych miestach Thr308 a Ser473. Thr308 je aktivovaný pomocou PDK1, ďalšej serínovej-treonínovej kinázy, za prítomnosti PIP3 [18]. O kináze zodpovednej za fosforyláciu Ser473 sa dlho viedli spory, ale pravdepodobne sa jedná o mTOR-rictor komplex [19–21]. V momente, keď je Akt plne aktívna, presúva sa od bunečnej membrány do cytoplazmy, a ako bolo preukázané neskôr, aj do jadra [22]. V oboch bunečných kompartmentoch ovplyvňuje špecifické cieľové štruktúry, a tým i rôzne bunečné funkcie. Ako ukazujú naše vedecké práce, expresia, aktivita a kompartmentalizácia jednotlivých izoforiem Akt môže mať vplyv na efekt trastuzumabu [23].
Jeden z možných mechanizmov účinku trastuzumabu je inhibícia fosforylácie PTEN (pomocou inhibície Src), a tým výrazné zvýšenie aktivity tejto fosfatázy. PTEN inhibuje PI3K, čo má za následok zníženú tvorbu PIP3 a následne pokles aktivácie Akt. Naopak, deregulácia PTEN v zmysle straty funkcie je spojená s rezistenciou na trastuzumab [24]. Trastuzumab zatiaľ nie príliš objasneným mechanizmom zvyšuje hladinu a indukuje p27kip a spôsobuje takmer kompletnú translokáciu p27kip do jadra bunky, kde dochádza k interakcii medzi p27kip a Cdk2, čo má za následok zastavenie bunečného cyklu a nástup procesu apoptózy [11].
Imunitne sprostredkovaná odpoveď
Trastuzumab je IgG1 monoklonálna protilátka s Fc doménou a podobne ako ostatné protilátky tejto skupiny je schopný vyvolať imunitnú reakciu, čo bolo demonštrované v rôznych in vivo modeloch i klinických štúdiách. Jedná sa konkrétne o bunkami sprostredkovanú cytotoxicitu závislú od protilátky (ADCC). Pre tento mechanizmus účinku je dôležitá prítomnosť NK buniek. NK bunky na svojom povrchu exprimujú receptor Fc gamma schopný interakcie s Fc doménou trastuzumabu a následne dochádza k vyvolaniu imunitnej odpovede a k lýze bunky. Myši s injektovanou bunečnou líniou karcinómu prsníka BT474 exprimujúcou HER-2 s fyziologickým imunitným systémom dosiahli väčšiu regresiu tumoru pri liečbe trastuzumabom ako myši, u ktorých bolo realizované genetické odstránenie Fc domény, aj keď i tu bol prítomný čiastočný efekt trastuzumabu [25]. Tieto výsledky boli potvrdené aj v klinickej štúdii Gennariho. Pacientky absolvovali neoadjuvatnú terapiu na báze trastuzumabu. U tých, ktoré dobre reagovali na liečbu, bol v resekáte nádoru zistený vyšší počet leukocytov a väčší rozsah ADCC aktivity ako u pacientok, u ktorých bola liečba menej efektívna [26]. Budú potrebné ďalšie klinické štúdie na hlbšie objasnenie vzťahu imunitného systému a liečby trastuzumabom. Je ale nutné poznamenať fakt, že pacienti s pokročilým nádorovým onemocnením môžu mať výrazne alterovaný imunitný systém.
Inhibícia angiogenézy
Prestavba a novotvorba ciev je dôležitý faktor pre rozvoj a progresiu nádoru. Nadmerná expresia HER-2 je úzko spojená so zvýšenou angiogenézou a in vitro i s expresiou VEGF [27]. Podanie trastuzumabu spôsobuje in vivo redukciu mikrovazálnej hustoty, normalizáciu a regresiu nádorovej vaskulatúry. Dochádza k redukcii hladiny ďalších pro‑angiogénnych molekúl ako TGF‑α, Ang-1, PAI‑1, a k indukcii TSP-1 [27]. V súčasnosti prebiehajú klinické štúdie s kombinovanou cielenou terapiou trastuzumabom a protilátkou proti VEGF – bevacizumabom.
Zníženie počtu HER-2 receptorov
Downregulácia HER-2 je proces, pri ktorom dochádza k zníženiu počtu receptorov na povrchu bunky [28]. V súčasnosti sa vedú diskusie, v akom rozsahu spôsobuje trastuzumab degradáciu HER-2 receptoru a následne jeho downreguláciu. Niektoré práce podporujú hypotézu zníženia počtu receptor ako účinok trastuzumabu [29]. Gennari na súbore pacientok sledoval expresiu HER-2 pred ukončením terapie trastuzumabom a po nej. Nebola však zistená signifikantná downregulácia HER-2 v priebehu terapie u pacientok, ktoré dosiahli odpoveď [26].
Mechanizmy rezistencie k trastuzumabu a možnosti ich ovplyvnenia
Z výsledkov klinických štúdií, či už s aplikáciou trastuzumabu v monoterapii alebo v kombinovanej liečbe s cytostatikami, vyplýva, že trastuzumab prináša benefit približne 40% liečených pacientok. U ostatných pacientok je prítomná rezistencia buď už na začiatku liečby – primárna rezistencia – alebo dôjde k jej vzniku v priebehu liečby – získaná rezistencia. Z tohto dôvodu je nutné hľadať príčiny, ktoré sú zodpovedné za prítomnosť primárnej a vznik sekundárnej rezistencie na liečbu trastuzumabom. Existujú tri základné mechanizmy vzniku rezistencie: 1. zmena farmakokinetiky trastuzumabu, 2. narušená interakcia receptor-protilátka, 3. skrížená aktivácia signálnej dráhy HER-2 receptoru inými receptormi rastových faktorov alebo zmena interakcií v samotnej HER-2 dráhe.
Zmena farmakokinetiky trastuzumabu
Klinické štúdie II. fázy preukázali, že aplikácia cytostatík v kombinovaných režimoch s trastuzumabom neovplyvňuje jeho farmakokinetiku [30]. V priebehu týchto štúdií sa však ukázalo, že vplyv na farmakokinetiku trastuzumabu môže mať vysoká koncentrácia sérovej HER-2 ECD. V súvislosti so štiepením HER-2 receptoru vyvstáva otázka, či odštiepená extracelulárna časť receptoru nesúca väzbovú doménu trastuzumabu neovplyvňuje jeho účinnosť. Štúdie s aplikáciou samotného trastuzumabu preukázali, že pri sérovej koncentrácii HER-2 ECD nad 500 μg/l dochádza k interferencii medzi HER-2 ECD a trastuzumabom, ktorá vede ku skráteniu jeho biologického polčasu [31]. Na strane druhej počet pacientok s hladinou HER-2 ECD prevyšujúcou 500 μg/l je nízky (napr. medián hladiny HER-2 ECD v našom súbore 87 pacientok liečených trastuzumabom dosahuje 25,2 μg/l a priemer 154,7 μg/l) a pri štandardnom dávkovaní trastuzumabu je dosiahnuté jeho sérovej koncentrácie vyššej než 10 000 μg/l, teda výrazne viac, aby mohlo dôjsť k ovplyvneniu efektu terapie. Absurdným prípadom zmeny farmakokinetiky a biologickej distribúcie je situácia, kedy vplyvom okolností je zabránené prieniku trastuzumabu k nádorovým bunkám. Príkladom tohto fenoménu je hematoencefalická bariéra.
Defekt interakcie receptor-protilátka
Neadekvátna expresia receptoru
Karcinóm prsníka predstavuje pomerne heterogénne onemocnenie a niekoľko klinických prác preukázalo, že v priebehu onemocnenia môže dôjsť ku zmene HER-2 statusu nádoru. Lôrincz a kol. zistili, že v dobe progresie nastala zmena fenotypu z HER-2 pozitivity do straty expresie HER-2 receptoru približne u polovice pacientok s kostnou disemináciou [32]. Ďalšie práce, vrátane našich výsledkov, však nepreukázali významnú zmenu HER-2 statusu medzi primárnym nádorom a metastatickými ložiskami v dobe progresie nemoci [33,34]. Neexistuje jasné odporučenie k prevedeniu rebiopsie v dobe progresie nádoru.
Maskovanie väzbového miesta receptoru
Pre pôsobenie trastuzumabu je potrebná interakcia s HER-2 receptorom. Ku vzniku rezistencie môže dochádzať pri poruche tejto väzby. Trastuzumab sa viaže na extracelulárnu doménu HER-2, konkrétne na C‑terminálnu časť IV. domény. Táto väzba blokuje možnosť proteolytického štiepenia HER-2 a znemožňuje interakciu s ďalšími proteínmi. Existujú však mechanizmy, ktoré môžu brániť väzbe trastuzumabu na HER-2. Jedným z popísaných mechanizmov je maskovanie väzbovej domény pomocou MUC4. MUC4 je membránovo asociovaný glykoprotein mucin‑4 a časť jeho štruktúry je zhodná s receptormi pre rastové faktory. Pri nadmernej expresii je MUC4 pomocou svojej EGF-podobnej domény schopný interakcie s HER-2 a potenciuje jeho fosforyláciu, čím dochádza k aktivácii onkogénnej HER-2 signálnej dráhy [35]. Mimo to MUC4 inhibuje schopnosť imunitného systému rozpoznať nádorovú bunku a eliminovať ju. Štúdie na bunečnej línii JIMT-1 (bunečná línia získaná od pacientok s HER-2 amplifikáciou a primárnou rezistenciou na trastuzumab) demonštrovali zníženú schopnosť väzby trastuzumabu na HER-2 v prítomnosti MUC4. Naopak, vyradením génu MUC4 sa zvýšila senzitivita buniek voči trastuzumabu [36]. Naše vlastné, zatiaľ nepublikované výsledky nepreukazujú význam expresie MUC4 vo vzťahu k rezistencii k trastuzumabu. V našom súbore 108 pacientok bola expresia MUC4 zaznamenaná iba v 5% prípadov.
Obr. 1. Mechanizmy rezistencie k trastuzumabu. EGFR rodina pozostáva zo 4 receptorov: EGFR, HER- 2, HER- 3, HER- 4. Pri hetero- alebo homodimerizácii dochádza k ich aktivácii. HER- 2 môže byť aktivovaný aj dôsledkom proteolýzy extracelulárnej časti receptoru. Aktivovaná tyrozín- kinázová intracelulárna doména ďalej vedie cestou PI3K kinázy k aktivácii HER- 2 signálnej dráhy a ovplyvneniu rôznych bunečných dejov. PTEN pôsobí ako negatívny regulátor aktivity PI3K kinázy, dereguláci a PTEN v zmysle straty funkcie je spojená s rezistenciou na trastuzumab. Membránovo asociovaný glykoproteín MUC- 4 je schopný blokovať interakciu medzi trastuzumabom a HER- 2 a pri nadmernej expresii je pomocou svojej EGF- podobnej domény schopný interakcie s HER- 2 a potenciuje jeho fosforyláciu. K aktivácii mTOR a následne s6k kinázy môže dochádzať aj HER- 2 nezávislým spôsobom. Niektoré nové látky sú schopné prekonať rezistenciu na trastuzumabu: pertuzumab (inhibítor heterodimerizácie EGFR/ HER- 2, HER- 2/ HER- 3), lapatinib (inhibítor tyrozín- kinázovej domény EGRR a HER- 2), LY294002 (inhibítor PI3K kinázy), RAD0001 (inhibítor mTOR), triciribin (inhibítor AKT). 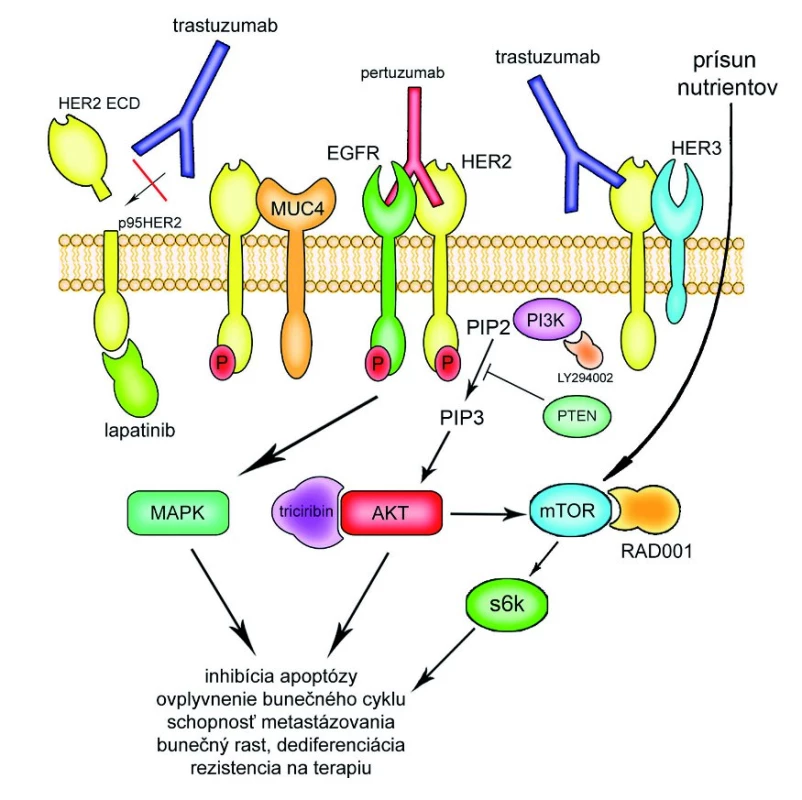
Zmena štruktúry receptoru
Ďalší potenciálny mechanizmus rezistencie na trastuzumab predstavuje zmena štruktúry receptoru a akumulácia skrátenej formy HER. Prítomnosť skrátenej formy HER-2 (označovanej ako p95HER-2 alebo C‑terminálny fragment) bola zistená v bunečných líniách nádorov prsníka a asi u 21–26% pacientok s tumorom s nadmernou expresiou HER-2 [8,37,38]. Zásadnym faktom je, že trastuzumab nie je schopný väzby s touto formou HER-2 receptoru, pretože skrátená forma HER-2 neobsahuje epitop potrebný pre väzbu trastuzumabu. Navyše, takto zmenený HER-2 receptoru vykazuje permanentnú tyrozín-kinázovú aktivitu [5]. Ku vzniku tejto formy receptoru môže dochádzať buď proteolytickým štepením extracelulárnej domény HER-2 [5] pomocou metaloproteináz, alebo alternatívnou iniciáciou translácie [39]. Biologická funkcia p95HER-2 nie je plne objasnená, ale predpokladá sa, že nadmerná expresia p95HER-2 je dôležitá pre rast a progresiu tumoru. Scaltriti et al na súbore 46 pacientok s HER-2 pozitívnym metastatickým tumorom prsníka zisťovali efekt trastuzumabu v prítomnosti takto zmenenej formy HER-2. Len jedna pacientka z deviatich (11%) so zvýšenou expresiou p95HER-2 odpovedala na liečbu trastuzumabom, pričom p95HER-2 negatívne pacientky dosiahli výrazne lepšiu odpoveď (19 z 37 pacientok reagovalo na liečbu, 51,4%, p = 0,029) [40]. Ďalej bolo preukázané, že pacientky, ktorých nádory vykazovali p95HER-2 pozitivitu, mali celkovo horšiu prognózu (5-ročné prežitie 42% vs 71%, p < 0,0001, znížený DFS p < 0,0001) [41]. Selekcia na základe stanovenia expresie p95HER-2 by mohla pomôcť identifikovať tie pacientky, u ktorých bude liečba trastuzumabom nedostatočne účinná, ale ktoré by mohli profitovať z terapie pomocou nizkomolekulárnych inhibítorov HER-2 tyrozín-kinázovej aktivity (napr. lapatinib). Lapatinib (GW572016, Tykerb®, GlaxoSmithKline) je perorálny duálny inhibítor tyrozín-kinázovej aktivity HER-2 a EGFR. Práce na bunečných líniách potvrdili efekt lapatinibu na bunkách karcinómu prsníka, ktoré exprimujú p95HER-2 a u ktorých je trastuzumab neúčinný. Dôvodom je samotná podstata účinku lapatinibu. Ten pôsobí na intracelulárnu kinázovú doménu receptoru, teda nezávisle na štepení receptoru. Scaltriti et al použili bunečnú líniu karcinómu prsníka MCF7 a pomocou transfekcie vytvorili stabilné klony exprimujúce plnú formu HER-2 a formu p95HER-2. Následne vytvorili myší xenograft tumoru a pozorovali efekt trastuzumabu a lapatinibu na rast nádoru. Nádory s úplnou formou HER-2 reagovali na liečbu ako trastuzumabom, tak lapatinibom približne v rovnakej miere. Naproti tomu nádory, ktoré exprimovali p95HER-2, boli voči trastuzumabu rezistentné, ale senzitívne k lapatinibu [40]. Efekt lapatinibu u trastuzumab rezistentných nádorov bol potvrdený aj klinickými štúdiami. V randomizovanej klinickej štúdii III. fázy u trastuzumabom predliečených pacientok lapatinib preukázal efektivitu v kombinácii s chemoterapiou. 399 pacientok bolo rozdelených do ramena s kapecitabinom a s lapatinibom alebo bez neho. Lapatinib signifikantne zlepšil odpoveď na terapiu (23,7% vs 13,9%, p = 0,017) a predĺžil čas do progresie ochorenia (6,2 vs 4,4 mesiaca, p = 0,00013), medián celkového prežitia bol v oboch ramenách približne rovnaký. Navyše, v ramene s lapatinibom bola progresia v CNS zistená u 2% pacientok oproti 6% (p = 0,045) v druhom ramene [42]. Tieto výsledky umožnili schválenie lapatinibu v kombinácii s kapecitabinom do liečby HER-2 pozitívnych pacientok, ktoré absolvovali liečbu antracyklínmi, taxánmi a trastuzumabom. Určitý efekt lapatinibu na mozgové metastatické postihnutie predbežne potvrdzuje aj štúdia EGF105084 [43]. Bude samozrejme nutné ďalej preveriť vplyv lapatinibu na disemináciu v CNS, ale tieto výsledky prinášajú mierny optimizmus v tejto otázke.
Hypoteticky by mohla ovplyvnenie väzby HER-2 a trastuzumabu zapríčiniť mutácia HER-2/neu génu spôsobujúca štrukturálnu zmenu extracelulárnej časti a následne zmenu konformácie proteínu. Zatiaľ však nebola zistená žiadna takáto mutácia. Hoci mutácia tyrozín-kinázovej domény HER-2 bola nedávno popísaná u malého percenta karcinómov prsníka, jej klinický význam je zatiaľ nejasný [44].
Skrížená aktivácia signálnej dráhy HER-2 receptoru inými receptormi rastových faktorov, alterácia v samotnej HER-2 dráhe
Rezistencia k trastuzumabu môže vzniknúť zmenou interakcii v samotnej HER-2 signálnej dráhe, prípadne alternatívnou aktiváciou HER-2 signálnej dráhy receptormi iných rastových faktorov. Ako už bolo spomenuté, HER-2 je schopný interakcie s ostatnými receptormi s HER rodiny. Trastuzumab inhibuje HER-2 závislú aktivitu, nie je však schopný ovplyvniť heterodimerizáciu medzi ostatnými HER receptormi a HER-2. Zmena expresie jednotlivých receptorov alebo ich preferenčných väzieb môže predstavovať akýsi únikový mechanizmus v prítomnosti trastuzumabu. Jednou z látok v súčasnosti testovaných v klinických štúdiách, ktorá je schopná ovplyvniť tieto interakcie, je pertuzumab (Omnitarg®, Genentech). Jedná sa rekombinantnú humanizovanú monoklonálnu protilátku proti HER-2 receptoru. Viaže sa ale na rozdielny epitop extracelulárnej časti HER-2 receptoru ako trastuzumab a je schopná brániť heterodimerizácii. Dokáže teda ovplyvniť väzbu HER-2 s EGFR, HER-3 [45] i IGF‑1R [46]. Kombinácia trastuzumabu a pertuzumabu prináša synergický efekt u trastuzumab senzitívnych bunečných líniách, nepodarilo sa však preukázať výrazný efekt pertuzumabu u buniek rezistentných k trastuzumabu [46]. Predbežné výsledky klinickej štúdie II. fáze u pacientok, ktoré dosiahli progresiu pri liečbe trastuzumabom a následne pokračovali kombináciou trastuzumab a pertuzumab, preukázali dobrú toleranciu liečby a celkovú odpoveď v rozsahu 18,2% [47]. Úloha pertuzumabu v prekonaní rezistencie na trastuzumab zostáva zatiaľ nejasná, odpoveď by snáď mohli priniesť výsledky ďalších aktuálne prebiehajúcich klinických štúdii. Ďalšou testovanou látkou blokujúcou signalizáciu z HER receptorov je canertinib (CI-1033). Na rozdiel od pertuzumabu a trastuzumabu je canertinib perorálny ireverzibilný inhibítor tyrozín-kinázovej aktivity všetkých HER receptorov (až na HER-3, ktorého intracelulárna doména je kinázovo neaktívna). V preklinických prácach bola preukázaná aktivita canertinibu na bunkách nádoru prsníka v zmysle stabilizácie až regresie tumoru. V klinickej štúdii I. fáze u karcinómu prsníka mal priaznivý terapeutický profil a prejavil miernu aktivitu [48]. Ďalšou podobnou látkou je HKI-272. Rovnako ako u canertinibu sa jedná o perorálny ireverzibilný pan-HER inhibítor. Vykazuje výraznú inhibičnú aktivitu v HER-2 pozitívnych bunečných líniách karcinómu prsníka. V súčasnosti prebieha klinické testovanie preparátu. Recentne prezentované predbežné výsledky II. fáze potvrdili dobrú znášanlivosť preparátu a aktivitu u pacientok s HER-2 pozitívnym karcinómom prsníka [49].
Alternatívna aktivácia v ďalšom priebehu signálnej dráhy prispieva k nezávislosti od procesov na bunečnej membráne, a teda aj k menšej vnímavosti na inhibíciu trastuzumabom. Táto alternatívna signalizácia je často spájaná s PTEN. PTEN je lipidová fosfatáza, ktorá negatívne reguluje hladinu PIP3, a tým aj aktiváciu Akt. V klinických prácach sa zistilo, že strata funkcie PTEN z dôvodu mutácie alebo LOH je prítomná až u 40% nádorov prsníka a je spojená so zvýšenou aktivitou PI3K/Akt signálnej dráhy [24]. Význam PTEN v rezistencii na trastuzumab bol potvrdený v klinickej štúdii so 17 HER-2 pozitívnymi pacientkami liečenými pre metastatický nádor prsníka kombináciou trastuzumab a paklitaxel. Pacientky s nízkou expresiou PTEN dosiahli výrazne nižšiu celkovú odpoveď (12,5%) ako pacientky s normálnou expresiou (88,9%, p = 0,00337) [50]. Podobné výsledky priniesla práca so 47 pacientkami (35,7% vs 66,7%, p < 0,05) [24]. Na základe týchto výsledkov sa usudzuje, že expresia PTEN by popri nadmernej expresii HER-2 mohla slúžiť ako ďalší prediktor účinnosti liečby trastuzumabom, bude však nutné potvrdiť tieto výsledky rozsiahlejšími klinickými štúdiami.
Za predpokladu, že PTEN tlmí tvorbu PIP3, a tým antagonizuje efekt PI3K kinázy, bol sledovaný efekt PI3K inhibítorov v PTEN deficitných bunkách rezistentných k trastuzumabu. Inhibítory PI3K ako LY294002 a wortmannin výrazne zvýšili efekt trastuzumabu a dokázali prekonať prítomnú rezistenciu k trastuzumabu v PTEN deficitných bunkách karcinómu prsníka [24]. Uvedenie oboch preparátov do klinickej praxe je ale zatiaľ problematické (nepriaznivá farmakokinetika u wortmanninu, výrazná dermatitída LY294002 na zvieracích modeloch). Efekt posilnenia účinku trastuzumabu cestou PTEN u rezistentných buniek bol zistený aj u proteazómového inhibítoru bortezomibu [51].
S podobným cieľom bol testovaný efekt ďalších inhibítorov jednotlivých častí HER-2 signálnej dráhy. Ako účinné sa javia inhibítory triciribin a RAD001. Triciribin je látka inhibujúca aktivitu Akt (konkrétne izoformy Akt2), ktorá predstavuje kľúčový proteín v HER-2 signálnej dráhe. Akt je schopná aktivovať mTOR, ďalší dôležitý enzým, a práve RAD001 je schopný blokovať mTOR aktivitu. Obe molekuly, triciribin i RAD001, boli spôsobilé prekonať rezistenciu k trastuzumabu v bunečných líniách karcinómu prsníka s deficitom PTEN [52]. Obe látky v súčasnosti prenikajú do klinických štúdií I. a II. fáze.
IGF signálna dráha sa môže tiež podieľať na mechanizme vzniku rezistencie. IGF‑1R (insulin‑like growth faktor 1 receptor) je transmembránový receptor, ku ktorého aktivácii dochádza väzbou ligandov ako IGF‑1 a IGF‑1L. Následne dochádza cestou fosforylácie rôznych cieľových molekúl, spoločných aj pre HER-2 signálnu dráhu, k ovplyvneniu rozmanitých bunečných funkcií, ako sú bunečný rast, proliferácia bunky, schopnosť metastázovania [53–56]. Na bunečnej línii karcinómu prsníka SKBR3 (rezistentné k trastuzumabu) bola pozorovaná heterodimerizácia IGF‑1R s HER-2 receptorom, ku ktorej ale nedochádza u trastuzumab senzitívnych buniek. Inhibícia IGF‑1R pomocou protilátky alebo tyrozin‑kinázového inhibítoru opäť vyvolala senzitivitu k trastuzumabu [46]. V klinickej praxi sa však tento mechanizmus zatiaľ nepotvrdil. Retrospektívna analýza na súbore 72 pacientok s metastatickým HER-2 pozitívnym karcinómom prsníka nepreukázala vzťah expresie IGF‑1R k žiadnej biologickej alebo klinickej charakteristike nádoru [57]. IGF‑1R bude pravdepodobne predstavovať jeden z možných mechanizmov rezistencie, ale len u určitej podskupiny pacientok. Toto konštatovanie potvrdzujú aj naše, dosiaľ nepublikované výsledky analýzy sérovej hladiny IGF‑1 a IGF‑1R.
Záver
Je evidentné, že trastuzumab priniesol výrazné zlepšenie prognózy pacientok s HER-2 pozitívnym karcinómom prsníka. Jedným z hlavných problémov zostáva rezistencia na liečbu trastuzumabom. S rozšírením indikácie trastuzumabu do adjuvantnej terapie sa otázka rezistencie stáva ešte naliehavejšou. Preklinické štúdie v poslednom období prinášajú viac pochopenia do bunečných dejov podieľajúcich sa na zlyhaní terapie trastuzumabom. Bude preto dôležité identifikovať zodpovedné molekulárne mechanizmy a biomarkery spojené s rezistenciou, čo následne umožní cielene zasiahnuť a zvýšiť efekt liečby trastuzumabom. To so sebou prináša aj potrebu racionálneho prístupu k designu klinických štúdií, čo spolu s optimálnym výberom pacientov dokáže maximalizovať efekt cielenej terapie.
Práca bola podporená grantom IGA MZ ČR: NR 8335-3.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Peter Grell
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: grell@mou.cz
Zdroje
1. Slamon DJ, Clark GM, Wong SG et al. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987; 235 : 177–182.
2. Ross JS, Fletcher JA, Bloom KJ et al. Targeted therapy in breast cancer: the HER-2/neu gene and protein. Mol Cell Proteomics 2004; 3(4): 379–398 (Review).
3. Hudziak RM, Schlessinger J, Ullrich A. Increased expression of the putative growth factor receptor p185HER2 causes transformation and tumorigenesis of NIH 3T3 cells. Proc Natl Acad Sci USA 1987; 84(20): 7159–7163.
4. Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001; 2(2): 127–137 (Review).
5. Codony-Servat J, Albanell J, Lopez-Talavera JC et al. Cleavage of the HER2 ectodomain is a pervanadate‑activable process that is inhibited by the tissue inhibitor of metalloproteases-1 in breast cancer cells. Cancer Res 1999; 59(6): 1196–1201.
6. Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer. Nat Rev Cancer 2002; 2(7): 489–501 (Review).
7. Shalaby MR, Shepard HM, Presta L et al. Development of humanized bispecific antibodies reactive with cytotoxic lymphocytes and tumor cells overexpressing the HER2 protooncogene. J Exp Med 1992; 175(1): 217–225.
8. Molina MA, Codony-Servat J, Albanell J et al. Trastuzumab (herceptin), a humanized anti‑Her2 receptor monoclonal antibody, inhibits basal and activated Her2 ectodomain cleavage in breast cancer cells. Cancer Res 2001; 61(12): 4744–4749.
9. Grell P, Petráková K, Šimíčková M et al. Serum HER-2/neu: a tumor marker for monitoring response to treatment of metastatic breast cancer with trastuzumab. 19th Meeting of European Association For Cancer Research, Budapest 2006: S207.
10. Clark AS, West K, Streicher S et al. Constitutive and inducible Akt activity promotes resistance to chemotherapy, trastuzumab, or tamoxifen in breast cancer cells. Mol Cancer Ther 2002; 1(9): 707–717.
11. Yakes FM, Chinratanalab W, Ritter CA et al. Herceptin‑induced inhibition of phosphatidylinositol-3 kinase and Akt Is required for antibody-mediated effects on p27, cyclin D1, and antitumor action. Cancer Res 2002; 62(14): 4132–4141.
12. Chen WS, Xu PZ, Gottlob K et al. Growth retardation and increased apoptosis in mice with homozygous disruption of the Akt1 gene. Genes Dev 2001; 15 : 2203–2208.
13. Cho H, Thorvaldsen JL, Chu Q et al. Akt1/PKBα is required for normal growth but dispensable for maintenance of glucose homeostasis in mice. J Biol Chem 2001; 276 : 38349–38352.
14. Cho H, Mu J, Kim JK et al. Insulin resistance and a diabetes mellitus‑like syndrome in mice lacking the protein kinase Akt2 (PKBß). Science 2001; 292 : 1728–1731.
15. Garofalo RS, Orena SJ, Rafidi K et al. Severe diabetes, age-dependent loss of adipose tissue, and mild growth deficiency in mice lacking Akt2/PKBß. J Clin Invest 2003; 112 : 197–208.
16. Easton RM, Cho H, Roovers K et al. Role for Akt3/protein kinase Bγ in attainment of normal brain size. Mol Cell Biol 2005; 25 : 1869–1878.
17. Tschopp O, Yang ZZ, Brodbeck D et al. Essential role of protein kinase Bγ (PKBγ/Akt3) in postnatal brain development but not in glucose homeostasis. Development 2005; 132 : 2943–2954.
18. Alessi DR, James SR, Downes CP et al. Characterization of a 3-phosphoinositide-dependent protein kinase which phosphorylates and activates protein kinase Balpha. Curr Biol 1997; 7(4): 261–269.
19. Troussard AA, McDonald PC, Wederell ED et al. Preferential dependence of breast cancer cells versus normal cells on integrin‑linked kinase for protein kinase B/Akt activation and cell survival. Cancer Res 2006; 66(1): 393–403.
20. Feng J, Park J, Cron P et al. Identification of a PKB/Akt hydrophobic motif Ser-473 kinase as DNA-dependent protein kinase. J Biol Chem 2004; 279(39): 41189–41196. Epub 2004 Jul 15.
21. Sarbassov DD, Guertin DA, Ali SM et al. Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex. Science 2005; 307(5712): 1098–1101.
22. Maddika S, Bay GH, Kroczak TJ et al. Akt is transferred to the nucleus of cells treated with apoptin, and it participates in apoptin‑induced cell death. Cell Prolif 2007; 40(6): 835–848.
23. Svoboda M, Grell P, Fabian P et al. Significance of Akt activation and compartmentalization for prediction of outcome in Her-2 positive breast cancer patients treated with trastuzumab (Abstrakt 4022). Breast Cancer Res Treat 2007; 106 (Suppl 1): 173.
24. Nagata Y, Lan KH, Zhou X et al. PTEN activation contributes to tumor inhibition by trastuzumab, and loss of PTEN predicts trastuzumab resistance in patients. Cancer Cell 2004; 6(2): 117–127.
25. Clynes RA, Towers TL, Presta LG et al. Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets. Nat Med 2000; 6(4): 443–446.
26. Gennari R, Menard S, Fagnoni F et al. Pilot study of the mechanism of action of preoperative trastuzumab in patients with primary operable breast tumors overexpressing HER2. Clin Cancer Res 2004; 10(17): 5650–5655.
27. Izumi Y, Xu L, di Tomaso E et al. Tumour biology: herceptin acts as an anti‑angiogenic cocktail. Nature 2002; 416(6878): 279–280.
28. Sarup JC, Johnson RM, King KL et al. Characterization of an anti‑p185HER2 monoclonal antibody that stimulates receptor function and inhibits tumor cell growth. Growth Regul 1991; 1(2): 72–82.
29. Baselga J, Albanell J, Molina MA et al. Mechanism of action of trastuzumab and scientific update. Semin Oncol 2001; 28 (Suppl 16): 4–11.
30. Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344(11): 783–792.
31. Pegram MD, Lipton A, Hayes DF et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti‑p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment. J Clin Oncol 1998; 16(8): 2659–2671.
32. Lôrincz T, Tóth J, Badalian G et al. HER-2/neu genotype of breast cancer may change in bone metastasis. Pathol Oncol Res 2006; 12(3): 149–152.
33. Gancberg D, Di Leo A, Cardoso F et al. Comparison of HER-2 status between primary breast cancer and corresponding distant metastatic sites. Ann Oncol 2002; 13(7): 1036–1043.
34. Gong Y, Booser DJ, Sneige N. Comparison of HER-2 status determined by fluorescence in situ hybridization in primary and metastatic breast carcinoma. Cancer 2005; 103(9): 1763–1769.
35. Price-Schiavi SA, Jepson S, Li P et al. Rat Muc4 (sialomucin complex) reduces binding of anti‑ErbB2 antibodies to tumor cell surfaces, a potential mechanism for herceptin resistance. Int J Cancer 2002; 99(6): 783–791.
36. Nagy P, Friedländer E, Tanner M et al. Decreased accessibility and lack of activation of ErbB2 in JIMT-1, a herceptin‑resistant, MUC4-expressing breast cancer cell line. Cancer Res 2005; 65(2): 473–482.
37. Christianson TA, Doherty JK, Lin YJ et al. NH2‑terminally truncated HER-2/neu protein: relationship with shedding of the extracellular domain and with prognostic factors in breast cancer. Cancer Res 1998; 58(22): 5123–5129.
38. Molina MA, Sáez R, Ramsey EE et al. NH(2)‑terminal truncated HER-2 protein but not full-length receptor is associated with nodal metastasis in human breast cancer. Clin Cancer Res 2002; 8(2): 347–353.
39. Anido J, Scaltriti M, Bech Serra, JJ et al. Biosynthesis of tumorigenic HER2 C‑terminal fragments by alternative initiation of translation. EMBO J 2006; 25(13): 3234–3244. Epub 2006 Jun 22.
40. Scaltriti M, Rojo F, Ocaña A et al. Expression of p95HER2, a truncated form of the HER2 receptor, and response to anti‑HER2 therapies in breast cancer. J Natl Cancer Inst 2007; 99(8): 628–638.
41. Sáez R, Molina MA, Ramsey EE et al. p95HER-2 predicts worse outcome in patients with HER-2-positive breast cancer. Clin Cancer Res 2006; 12(2): 424–431.
42. Cameron D, Casey M, Press M et al. A phase III randomized comparison of lapatinib plus capecitabine versus capecitabine alone in women with advanced breast cancer that has progressed on trastuzumab: updated efficacy and biomarker analyses. Breast Cancer Res Treat 2008: Jan 11 [Epub ahead of print].
43. Lin NU, Paul D, Dieras V et al. Lapatinib and capecitabine for the treatment of brain metastases in patients with HER2+ breast cancer – an updated analysis from EGF105084. (Abstract 6076). Breast Cancer Res Treat 2007; 106 (Suppl 1).
44. Lee JW, Soung YH, Seo SH et al. Somatic mutations of ERBB2 kinase domain in gastric, colorectal, and breast carcinomas. Clin Cancer Res 2006; 12(1): 57–61.
45. Nahta R, Hung MC, Esteva FJ. The HER-2-targeting antibodies trastuzumab and pertuzumab synergistically inhibit the survival of breast cancer cells. Cancer Res 2004; 64(7): 2343–2346.
46. Nahta R, Yuan LX, Zhang B et al. Insulin‑like growth factor-I receptor/human epidermal growth factor receptor 2 heterodimerization contributes to trastuzumab resistance of breast cancer cells. Cancer Res 2005; 65(23): 11118–11128.
47. Baselga J, Cameron D, Miles D et al. Objective response rate in a phase II multicenter trial of pertuzumab (P), a HER2 dimerization inhibiting monoclonal antibody, in combination with trastuzumab (T) in patients (pts) with HER2-positive metastatic breast cancer (MBC) which has progressed during treatment with T (Abstract 1004). Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings. Part I. Vol 25, No. 18S (June 20, Suppl).
48. Allen LF, Eiseman IA, Fry DW et al. CI-1033, an irreversible pan-erbB receptor inhibitor and its potential application for the treatment of breast cancer. Semin Oncol 2003; 30 (5 Suppl 16): 65–78.
49. Burstein H, Awada A, Badwe R et al. HKI-272, an irreversible pan erbB receptor tyrosine kinase inhibitor: preliminary phase 2 results in patients with advanced breast cancor (Abstract 6061). Breast Cancer Res Treat 2007; 106 (Suppl 1).
50. Fujita T, Doihara H, Kawasaki K et al. PTEN activity could be a predictive marker of trastuzumab efficacy in the treatment of ErbB2-overexpressing breast cancer. Br J Cancer 2006; 94(2): 247–252.
51. Fujita T, Doihara H, Washio K et al. Proteasome inhibitor bortezomib increases PTEN expression and enhances trastuzumab‑induced growth inhibition in trastuzumab‑resistant cells. Anticancer Drugs 2006; 17(4): 455–462.
52. Lu CH, Wyszomierski SL, Tseng LM et al. Preclinical testing of clinically applicable strategies for overcoming trastuzumab resistance caused by PTEN deficiency. Clin Cancer Res 2007; 13(19): 5883–5888.
53. Resnicoff M, Baserga R. The role of the insulin‑like growth factor I receptor in transformation and apoptosis. Ann N Y Acad Sci 1998; 842 : 76–81.
54. Khandwala HM, McCutcheon IE, Flyvbjerg A et al. The effects of insulin‑like growth factors on tumorigenesis and neoplastic growth. Endocr Rev 2000; 21 : 215–244.
55. O’Connor R, Fennelly C, Krause D. Regulation of survival signals from the insulin‑like growth factor-I receptor. Biochem Soc Trans 2000; 28 : 47–51.
56. Samani AA, Yakar S, LeRoith D et al. The role of the IGF system in cancer growth and metastasis: overview and recent insights. Endocr Rev 2007; 28(1): 20–47. Epub 2006 Aug 24 (Review).
57. Köstler WJ, Hudelist G, Rabitsch W et al. Insulin‑like growth factor-1 receptor (IGF‑1R) expression does not predict for resistance to trastuzumab‑based treatment in patients with Her-2/neu overexpressing metastatic breast cancer. J Cancer Res Clin Oncol 2006; 132(1): 9–18. Epub 2005 Sep 24.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2009 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Vážení čtenáři,
- Trastuzumab v liečbe karcinómu prsníka: mechanizmy účinku a rezistencie
- Epidemiologické charakteristiky nádorov testis v Slovenskej republike – retrospektívna štúdia
- Klinický význam chromozomálních změn u nádorů kostí a měkkých tkání dětí a mladistvých
- Příprava protinádorové vakcíny pro pacienty s mnohočetným myelomem na bázi dendritických buněk naložených monoklonálním imunoglobulinem
- Bevacizumab v kombinaci s kapecitabinem a irinotekanem (XELIRI) v léčbě metastatického kolorektálního karcinomu
- Jedinci v dlouhodobé remisi po ukončení léčby pro nádorové onemocnění dětského věku: vyléčení a následná péče. Prohlášení z ERICE.
- Vybrané diagnosticko léčebné problémy u vysoce maligních gliomů – závěry multidisciplinárního pracovního setkání „Winter GLIO TRACK Meeting“ 2009
- Zápis ze schůze výboru České onkologické společnosti dne 17. 2. 2009 v Ústavu radiační onkologie v Praze
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Příprava protinádorové vakcíny pro pacienty s mnohočetným myelomem na bázi dendritických buněk naložených monoklonálním imunoglobulinem
- Trastuzumab v liečbe karcinómu prsníka: mechanizmy účinku a rezistencie
- Klinický význam chromozomálních změn u nádorů kostí a měkkých tkání dětí a mladistvých
- Jedinci v dlouhodobé remisi po ukončení léčby pro nádorové onemocnění dětského věku: vyléčení a následná péče. Prohlášení z ERICE.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



