-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
The importance of transcutaneous oxygen tension monitoring in diabetic patient with complications
Monitoring of transcutaneous perfusion pressure of tissue oxygen (tcpO2) is a simple, non-invasive method performed in diagnostic process of chronic diabetic complications. Primary, tcpO2 is used as an indicator of microcirculatory function. Properly placed and fixed Clark electrode is able to detect with high accuracy partial oxygen pressure on the skin surface by polarographic system of dissolved oxygen from capillary bed through tissues to upper layers of the skin. The microcirculation function is influenced by macrocirculation, thus, tcpO2 is a suitable parameter in diagnosis of peripheral arterial obliterative disease or other vascular pathologies. Combination of tcpO2 monitoring and skin perfusion pressure by laser Doppler technique gives us information not only about nutritive capillary flow, but also about vessels which precede capillary bed. The article discusses current guidelines for measurement of tcpO2 and evaluation of the results. Also reviews the results of recent studies which are interested in the use of tcpO2 in diabetic patients.
Key words:
diabetic foot ulcer – diabetic microangiopathy – diabetic neuropathy – peripheral arterial obliterative disease – transcutaneous oxygen tension monitoring
Autoři: David Baláž; Andrea Komorníková; Peter Sabaka; Ľudovít Gašpar; Andrej Dukát
Působiště autorů: II. interná klinika LF UK a UN Bratislava, Slovenská republika, prednosta doc. MUDr. Ľudovít Gašpar, CSc.
Vyšlo v časopise: Vnitř Lék 2015; 61(2): 106-113
Kategorie: Přehledný referát
Souhrn
Transkutánne monitorovanie parciálneho tlaku tkanivového kyslíka (tcpO2) je jednoduchou neinvazívnou metódou, ktorá pomáha pri diagnóze chronických komplikácií diabetes mellitus. Primárne je metóda monitorovania tcpO2 určená na hodnotenie mikrocirkulácie. Vhodne umiestnená a fixovaná Clarkova sonda na povrchu kože nám dáva s veľkou presnosťou informáciu o parciálnom tlaku kyslíku na podklade polarografického princípu detekcie difundujúceho kyslíku z kapilárneho nutritívneho riečiska cez tkanivá do povrchových vrstiev kože. Funkcia mikrocirkulácie je ovplyvňovaná makrocirkuláciou, čo umožňuje metódu merania tcpO2 využiť v diagnostickom procese periférneho artériového obliterujúceho ochorenia alebo inej vaskulárnej patológie. Kombinácia tcpO2 a meranie perfúzneho tlaku kože technikou laserového Dopplerovho vyšetrenia nám dáva informáciu nielen o kapilárnom riečisku, ale aj o cievach, ktoré anatomicky predchádzajú kapiláry. Článok ponúka odporučenia na meranie a hodnotenie výsledkov tcpO2 a zahŕňa výsledky najnovších štúdií, ktoré sa zaoberajú možnosťami využitia monitorovania tcpO2 u pacienta s diabetes mellitus.
Kľúčové slova:
diabetická mikroangiopatia – diabetická neuropatia – nehojaci sa diabetický defekt – periférne artériové obliterujúce ochorenie – transkutánne monitorovanie tkanivového kyslíkaÚvod
Transkutánne monitorovanie parciálneho tlaku kyslíka (tcpO2) je neinvazívnou metódou na meranie kyslíkovej dodávky do buniek kožného a podkožného tkaniva, ktoré nám dáva informáciu o perfúzii nutritívneho kapilárneho riečiska. Technika merania využíva sondu s obsahom Clarkovej elektródy, ktorá sa prikladá a fixuje na kožu pacienta. TcpO2 dobre odzrkadľuje metabolický stav dolných končatín u pacienta s diabetes mellitus (DM) [1]. V klinickej praxi sa tcpO2 uplatňuje pri hodnotení stupňa ischémie dolných končatín, sledovaní priebehu ochorenia, ako aj účinnosti farmakologickej a chirurgickej liečby i kinezioterapie [2].
Odhaduje sa, že DM je zodpovedný za 50–70 % všetkých amputácií na dolnej končatine. Chronické komplikácie DM môžu viesť k tvorbe nehojaceho sa diabetického defektu (NDD) a možnej amputácii. Prítomnosť NDD na nohe predchádza 85 % všetkých amputácií u pacienta s DM [3]. Pacienti s DM majú 15–25% celoživotné riziko vzniku nehojaceho sa defektu, a preto je rýchla diagnostika a liečba komplikácií kľúčová [4].
Technika merania
Meranie tcpO2 má široké uplatnenie u pacienta s DM. Napriek jednoduchému princípu metodiky netreba zanedbať základné postupy nevyhnutné pre úspešnú realizáciu vyšetrenia a získanie valídnych výsledkov. Pacient by nemal pred vyšetrením fajčiť, konzumovať nápoje obsahujúce kofeín a alkohol. Počas vyšetrenia pacient leží vo vodorovnej polohe v miestnosti s teplotou 21–23 °C. Miesto kože, na ktoré priložíme sondu, očistíme alkoholovým roztokom a po vysušení prejdeme šetrnou lepiacou páskou na odstránenie odumretých buniek stratum corneum. Pri výraznom ochlpení je vhodná depilácia oblasti merania. Po kalibrácii sondy a aplikácii kontaktného roztoku do prstencovej adhezívnej nálepky sondu pevne upevňujeme jej aretáciou v závite (obr. 1). Pri meraniach v laterálnych a mediálnych oblastiach predkolenia kábel vychádzajúci zo sondy nikdy nesmeruje kolmo na podložku. Zabránime tým možnému vzniku artefaktov pri kontakte kábla s podložkou a znehodnoteniu merania pri neúmyselných pohyboch pacienta. Sondu neumiestňujeme na kostné prominencie, žilové pletene, klavus, zhrubnutú kožu, lokálny edém a priamo do miesta defektu. Počas merania má pacient ležať v polohe na chrbte v pokoji, bez pohybov a rozprávania, čo zbytočne predlžuje stabilizáciu výsledných hodnôt. Dolné končatiny sú v extendovanej polohe a prikryté ľahkou pokrývkou, ktorá zabraňuje lokálnej vazokonstrikcii v mieste merania. Neprikrytie dolných končatín alebo flexia v bedrovom/kolennom kĺbe môžu vyústiť k získaniu falošne nízkych výsledkov.
Obr. 1. Sonda pre meranie tcpO<sub>2</sub> 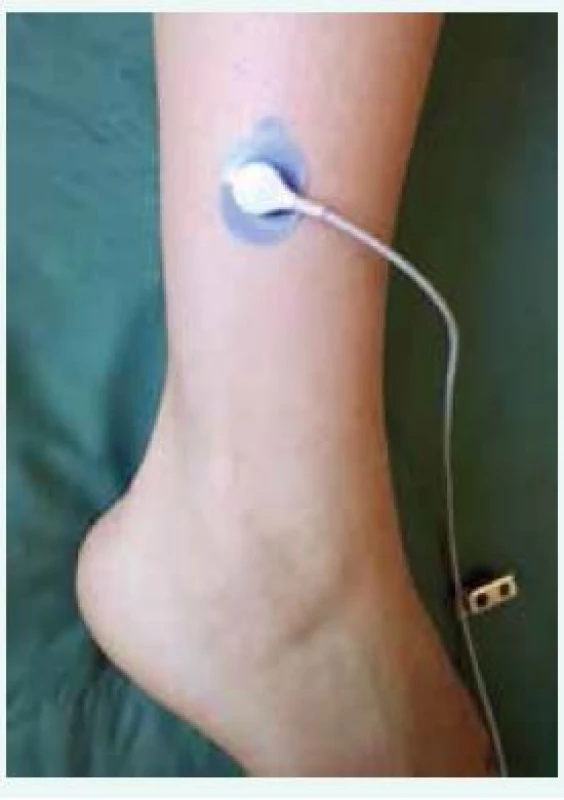
Klinický význam monitorovania tcpO2 u pacienta s DM
- diagnostika periférneho artériového obliterujúceho ochorenia – indikácia k cievnemu intervenčnému alebo rekonštrukčnému výkonu
- hodnotenie potenciálu hojenia defektu
- predchádzanie invazívneho výkonu (angiografia) s rizikom diabetickej nefropatie
- hodnotenie úspešnosti revaskularizácie
- diagnostika restenóz
- určenie amputačnej línie
- hodnotenie potenciálu hojenia amputačného pahýľu
- hodnotenie potenciálneho benefitu z hyperbarickej oxygenoterapie
- hodnotenie efektu vazodilatačnej liečby (prostaglandíny), kinezioterapie
Experimentálny význam monitorovania tcpO2 u pacienta s DM
- diagnostika diabetickej neuropatie
- posúdenie vhodnosti implantácie miechového stimulátora
- prognostický význam kardiovaskulárnych událostí
Súčasné monitorovanie pulzným oxymetrom je vhodné pre vylúčenie centrálnej artériovej hypoxémie. Zaužívané je meranie tcpO2 na referenčnom mieste, ktorým býva subklavikulárna oblasť. Pomer tcpO2 na dolnej končatine a tcpO2 v subklavikulárnej oblasti (regional perfusion index – RPI) [5] sa takisto používa ako ukazovateľ na odhalenie centrálnej artériovej hypoxémie. Časť pacientov má aj napriek neprítomnej centrálnej hypoxémii nízke hodnoty tcpO2 v oblasti referenčného miesta, preto súbežné meranie saturácie oxymetrom je presnejšie a hodnota kyslíkovej saturácie ≥ 92 % vylučuje prítomnosť artériovej hypoxémie [6,7]. Príčiny nameraných nízkych hodnôt tcpO2 vzhľadom na systémové, lokálne a technické faktory uvádza podrobne tab.
Tab. 1. Príčiny nízkych hodnôt tcpO<sub>2</sub> a patofyziologické vysvetlenie u pacienta s DM 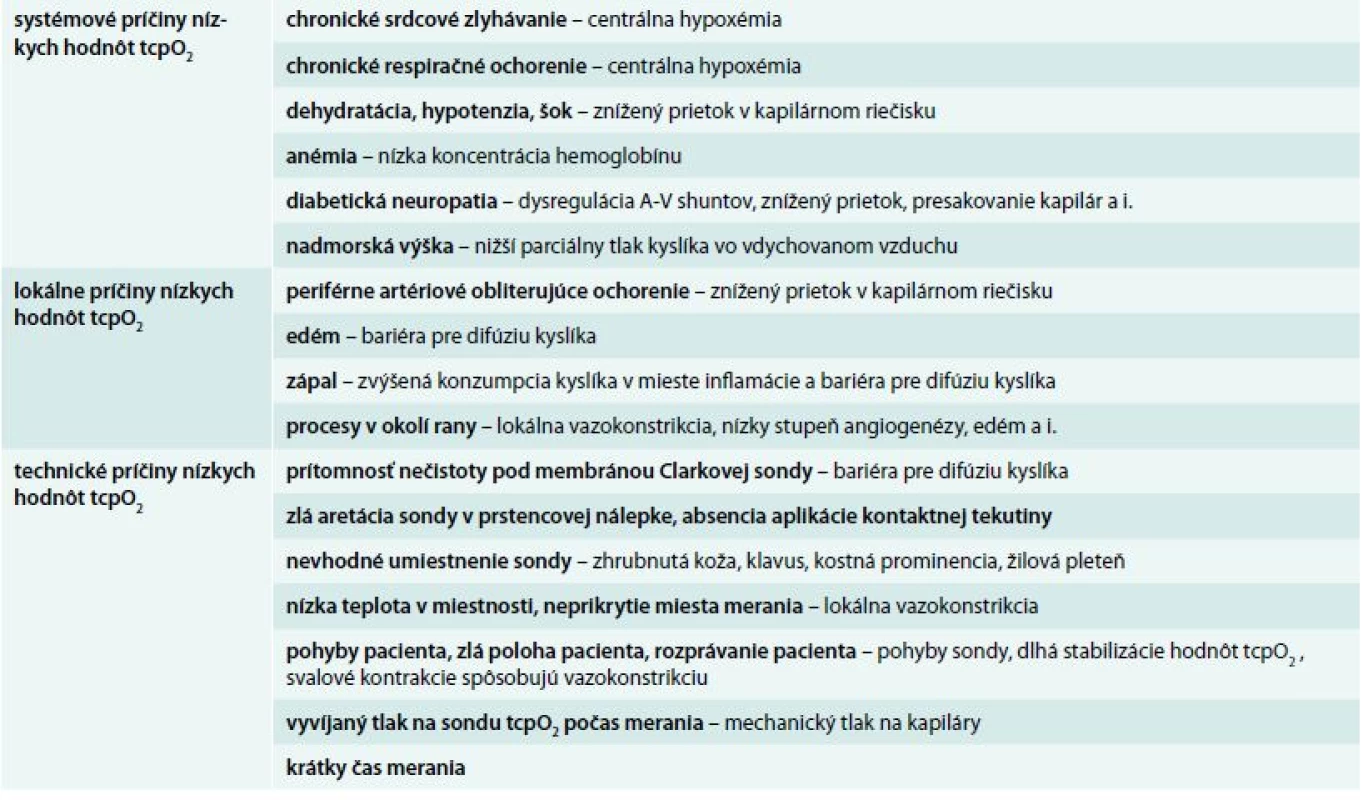
Stabilizácia hodnôt trvá približne 15–20 min, počas ktorých je samotná sonda zahriata na 44 °C. Pri tejto teplote dochádza k adekvátnej difúzii kyslíka z kapilárneho riečiska smerom k elektróde. Väčšina strojov na meranie tcpO2 umožňuje nastavenie teploty zahratia, ale 44 °C je teplota, pri ktorej nebolo pozorované poškodenie kožného krytu v zmysle pľuzgiera alebo výrazného erytému. Zahriatie na 45 °C nameria hodnoty tcpO2 približne o 2–3 % vyššie ako pri teplote 44 °C [7], ale vzhľadom na možné komplikácie sa táto teplota neodporúča u pacientov s DM.
tcpO2 – význam v najčastejších klinických situáciách
tcpO2 a periférne artériové obliterujúce ochorenie dolných končatín u pacienta s DM
Periférne artériové obliterujúce ochorenie (PAOO) je u pacienta s DM nezávislým rizikovým faktorom pre vznik chronickej nehojacej sa rany a možnej amputácie. PAOO je prítomné u približne 50 % pacientov s NDD [8]. Pacienti s NDD a PAOO majú horšiu hojivosť rany a vyššiu pravdepodobnosť amputácie v porovnaní s pacientmi s NND, ale bez PAOO, a preto je veľmi dôležité identifikovať túto vysoko rizikovú populáciu [9]. International Working Group on the Diabetic Foot (IWGDF) odporúča u všetkých pacientov s DM a NDD vyšetriť prítomnosť PAOO [10].
Menej ako 25 % diabetických pacientov s PAOO udáva intermitentné klaudikácie a pokojové bolesti [10]. Absencia bolesti spôsobuje, že 30–50 % pacientov vyhľadá odbornú pomoc v až štádiu gangrény, keď je revaskularizačný výkon na artériách dolných končatín problematický [1]. Vyšetrenie cievneho systému je nevyhnutné v prevencii progresie ochorenia do štádia bez možnosti využitia dostupných revaskularizačných techník.
Meranie členkovo-brachiálneho indexu (ABI) je v klinickej praxi po fyzikálnom vyšetrení dolných končatín bežným testom na odhalenie PAOO. Podľa svetových odporučení sa má ABI vyšetrovať u každého pacienta s DM nad 50 rokov [11]. ABI ≤ 0,9 je všeobecne uznávanou hodnotou pre diagnózu PAOO [11]. Výťažnosť ABI u pacientov s DM má však významnú limitáciu. Približne u 40 % pacientov s DM je prítomná mediokalcinóza, ktorá môže maskovať PAOO. U pacienta s DM sa nemožno spoliehať len na výslednú hodnotu ABI [12–14]. Pomocným neinvazívnym vyšetrením na hodnotenie makrocirkulácie je palcovo-brachiálny index (TBI). Pri meraní TBI sa stláčajú cievy palca, ktoré zvyčajne nie sú postihnuté mediokalcinózou [15–18]. Viaceré odporúčania svetových odborných spoločností stanovili u pacienta s DM hodnotu palcového tlaku < 50 mm Hg a TBI < 0,7 za patologickú, ktorá identifikuje prítomnosť PAOO [11,19].
Meranie segmentálnych tlakov je užitočné na lokalizáciu PAOO a je uskutočnené uložením viacerých manžiet na dolnú končatinu. Manžety vhodnej veľkosti sú umiestnené na hornú časť stehna, oblasť nad kolenom, oblasť pod kolenom a členok. Tlakový gradient > 20 mm Hg medzi vyšetrovanými segmentmi lokalizuje PAOO [20]. Ďalším neinvazívnym vyšetrením je monitorovanie pulzového objemu (pulse volume recording – PVR) pomocou segmentálneho vzduchového pletyzmografu. Zníženie pulzovej amplitúdy a vymiznutie dikrotického zárezu poukazuje na PAOO. Vyšetrenie je výhodné najmä u pacienta s DM, lebo nie je ovplyvnené mediokalcinózou [21].
Citlivosť merania tcpO2 pri diagnostike PAOO a sledovaní terapeutického efektu revaskularizačných techník je vyššia ako meranie ABI [22]. Meranie TBI alebo PVR doplnené o meranie tcpO2 zvyšuje pravdepodobnosť diagnózy PAOO, podieľa sa na indikácii intervenčných výkonov a navyše dáva nám informáciu o metabolickom stave miesta merania. Hodnota tcpO2 sa pri distálnejšom umiestnení sondy zvyčajne znižuje [23]. Fyziologická hodnota tcpO2 závisí od umiestnenia sondy, pohybuje sa v intervale 50–70 mm Hg [24]. Hodnoty tcpO2 < 50 mm Hg sú považované vo vybraných klinických situáciách (napr. pacient s DM a renálnym zlyhávaním) za hypoxické a nie je možné vylúčiť PAOO [7,25,26]. Hodnoty < 40 mm Hg sú všeobecne považované za hypoxické a spôsobujú predĺženie alebo zastavenie hojenia defektu [27–29]. Hodnoty tcpO2 < 30 mm Hg sú charakteristické u pacientov s kritickou ischémiou dolnej končatiny (pokojové bolesti, ulkus, gangréna), avšak často sa možno stretnúť aj s hodnotami < 20 mm Hg [11].
Pri meraní treba vždy zohľadniť prítomnosť edému, zápalu, dehydratácie, bolesti, či vazokonstrikcie v okolí defektu [7]. Na oddiferencovanie nízkej tcpO2 pri postihnutí makrocirkulácie od nízkej tcpO2 spôsobenej patofyziologickými procesmi v okolí rany nám slúži záťažový kyslíkový test. Pacient inhaluje cez kyslíkovú masku 100% kyslík za normobarických podmienok počas 10 min v polohe ľah na chrbte. U zdravých jedincov dýchanie 100% kyslíka zvýši hodnoty tcpO2 > 100 mm Hg. Ak pred kyslíkovým testom bola hodnota tcpO2 < 40 mm Hg a po teste bola > 100 mm Hg, môžeme povedať, že hodnota pred testom bola spôsobená lokálnou bariérou (výrazný edém, inflamácia) pre difúziu kyslíka a postihnutie makrocirkulácie je v tomto prípade menej pravdepodobné [7] (schéma).
Schéma. Využitie kyslíkového testu v diagnostike PAOO 
Pri PAOO budú hodnoty tcpO2 aj napriek inhalácii 100% kyslíka < 40 mm Hg. Pri nedostupnosti kyslíkového testu je možné využiť funkčný test s eleváciou končatiny 30–45° alebo zvesením končatiny. Pri elevácii, ktorá trvá 3 min, si všímame dynamiku hodnôt tcpO2. Pokles o > 10 mm Hg je charakteristický pre PAOO a znamená 80% pravdepodobnosť, že sa NDD nebude hojiť [30]. Pri funkčnej skúške so zvesením končatiny, zvýšenie tcpO2 > 40 mm Hg znamená 5% riziko amputácie pri PAOO [31]. Pri zvesení končatiny je dôležité zabrániť krvnej stáze v nohe, preto vyšetrovaný pri sedení dáva svoje chodidlo na podložku v tvare trojuholníka, ktorá zabraňuje nežiaducej dorzálnej flexii v členkovom kĺbe. Súčasné odporučenia uprednostňujú kyslíkový záťažový test pre svoju jednoduchosť a komplexnosť pred polohovými testami [7]. Ďalej treba zdôrazniť, že použitie funkčných testov je vhodné najmä u pacientov bez pokročilého syndrómu diabetickej nohy. U pacientov s chronickým NDD sú už pokojové hodnoty tcpO2 výrazne znížené a funkčné testy sú v týchto prípadoch neefektívne. Výnimkou je v takejto situácii kyslíkový test pri určovaní amputačnej línie alebo pri posúdení efektu hyperbarickej oxygenoterapie.
Nízke hodnoty tcpO2 nás vedú k indikácii ďalších vyšetrovacích metód, ktoré anatomicky lokalizujú prítomnú patológiu (duplexná ultrasonografia, angiografia) a dávajú tak priestor liečebným metódam (endovaskulárna intervencia, rekonštrukčná angiochirurgia). Na druhej strane, meraním tcpO2 môžeme predísť angiografickému vyšetreniu u vysoko rizikového pacienta s DM, u ktorých existuje riziko vzniku kontrastnej nefropatie.
tcpO2 a potenciál hojenia
Revaskularizácia
Od roku 1982 až 38 štúdií dokázalo, že hodnota < 40 mm Hg bola spojená s neuspokojivým hojením chronického defektu. Nárast tcpO2 na > 40 mm Hg po revaskularizácii (endovaskulárnej alebo po bypasse) je spojený so zlepšením procesu hojenia. Keďže prietok v kapilárach sa obnovuje postupne a môže stúpať v priebehu niekoľkých dní, prvé meranie tcpO2 by nemalo byť vykonané skôr ako 3 dni po revaskularizácii. Ešte vhodnejším variantom je realizovať meranie týždeň po výkone [32–35].
Skorý až okamžitý efekt revaskularizácie môžeme sledovať pomocou merania perfúzneho tlaku kože (skin perfusion pressure – SPP). Špeciálna laserová sonda sa umiestni na kožu pacienta pod tlakovú manžetu, ktorá sa nafúkne na hodnoty, keď je zastavený prietok v mikrocirkulácii (obr. 2). Manžeta sa postupne vypúšťa rýchlosťou 10 mm Hg za 5 s až po hodnotu 50 mm Hg, kedy sa vypúšťanie manžety spomalí na 5 mm Hg/15 s od tejto hodnoty [36]. Počas samotného vyšetrenia sledujeme návrat prietoku technikou laserového Dopplerovho vyšetrenia. Sonda laser Dopplera emituje laserový lúč, ktorý preniká do hĺbky 0,5–1 mm do kože, kde sa tento lúč odráža od pohybujúcich častíc (krvné elementy) a mení svoju vlnovú dĺžku na základe Dopplerovho javu. Odrazené laserové lúče sú zachytené sondou, ktorá semikvantitatívne vypočíta hodnoty prietoku v mikrocirkulácii pomocou súčinu rýchlosti a koncentrácie týchto krvných elementov [37].
Obr. 2. Meranie perfúzneho tlaku kože 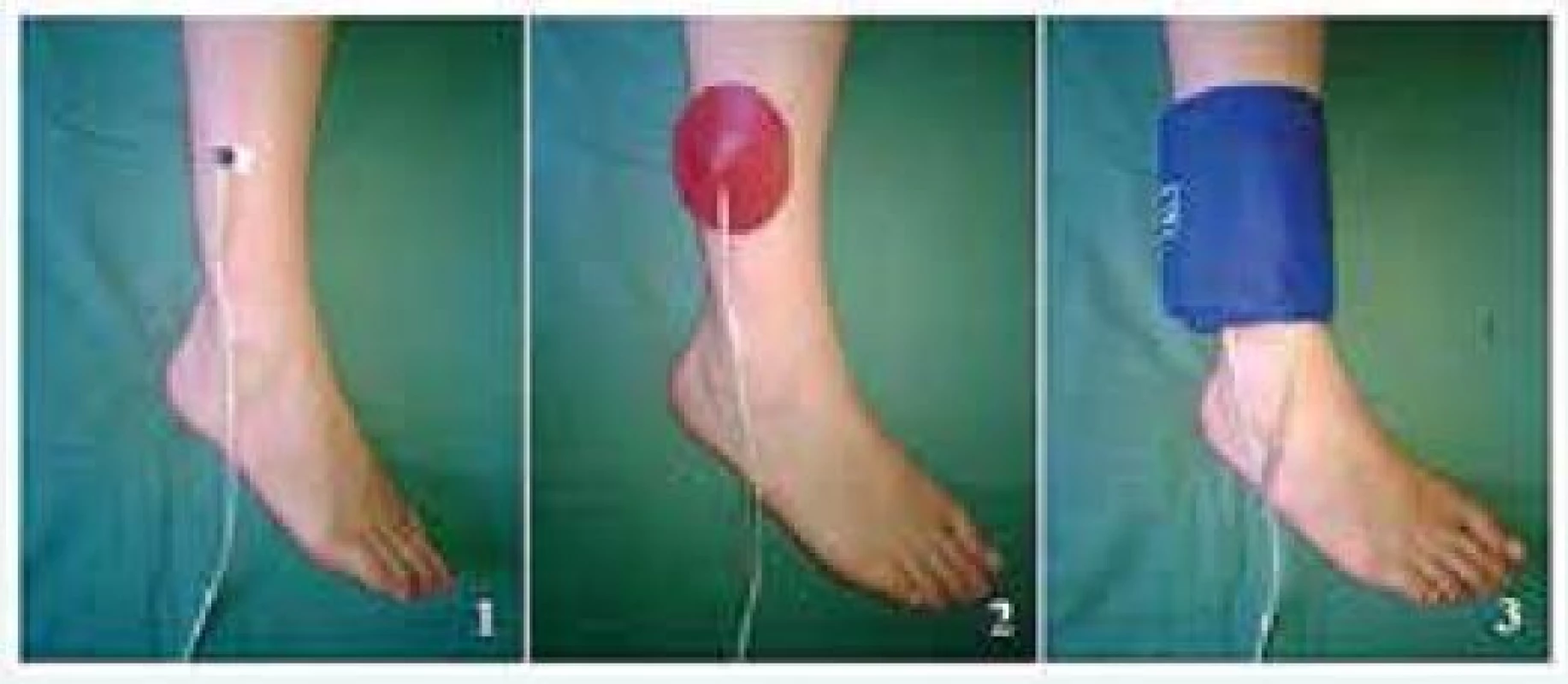
Za fyziologickú hodnotu sa považuje perfúzny tlak > 50 mm Hg. Hodnota < 30 mm Hg koreluje so zhoršenou prognózou hojenia defektov a znamená prítomnosť kritickej končatinovej ischémie [36,38]. Vyšetrenie SPP na rozdiel tcpO2 je časovo menej náročné a nie je ovplyvnené edémom, anémiou či nevhodnými anatomickými pomermi [39]. SPP priamo meria perfúziu v mikrocirkulácii a jeho kombinácia s tcpO2 je vhodná pri predikcii hojenia rany. V niektorých štúdiách bolo hodnota SPP > 30 mm Hg dokonca citlivejším prediktorom hojenia ako hodnota tcpO2 [40]. Len časté používanie a skúmanie techniky SPP na angiologických pracoviskách overí jeho potencionálnu superioritu voči tcpO2, ktorá doposiaľ nie je všeobecne akceptovaná.
Efekt perkutánnej transluminálnej angioplastiky a cievnych bypassov je často len dočasný a dochádza k recidívam klinických príznakov [41]. Význam merania tcpO2 spočíva takisto v rýchlej diagnostike restenózy v mieste predchádzajúcej vaskulárnej intervencie [38].
Hyperbarická oxygenoterapia
Hyperbarická oxygenoterapia je adjuvantnou liečebnou modalitou u pacientov s vyťaženou konzervatívnou terapiou. Pri úvahe nad indikáciou pacienta na liečbu hyperbarickým kyslíkom je vhodné vykonať meranie tcpO2 na posúdenie benefitu danej liečebnej modality [42]. Na posúdenie pozitívneho efektu z hyperbarickej oxygenoterapie je možné použiť kyslíkový test za normobarických podmienok. Hodnota tcpO2 > 35 mm Hg alebo nárast bazálnej hodnoty o > 50 % pri kyslíkovom teste sú priaznivými ukazovateľmi úspešnosti tejto liečby [7]. Vhodnejší, ale menej dostupný test je test inhalácie 100% kyslíka v hyperbarických podmienkach, kedy nárast tcpO2 > 200 mm Hg sa spája so 75% pravdepodobnosťou úspechu tejto liečby. Hodnoty < 100 mm Hg majú 89% pravdepodobnosť, že k hojeniu rany nedôjde. Treba ale poznamenať, že len jednotlivé merania tcpO2 nie sú jediné v indikácii na terapiu hyperbarickým kyslíkom, dôležitejší je komplexný pohľad na pacienta a jeho podrobné vyšetrenie.
Amputácia
Amputačná línia by sa mala určiť v najdistálnejšej oblasti s nameranou tcpO2 > 40 mm Hg v normobarických podmienkach, pretože hodnoty < 40 mm Hg majú už zvýšené riziko komplikovaného hojenia v oblasti amputácie [7,43,44]. Tento fakt nevyvracia možnosť hojenia amputačného pahýľu aj pri nižších hodnotách tcpO2 v amputačnej línii [45,46]. Gašpar et al sledovali potrebu reamputácie u pacientov s tcpO2 25–29 mm Hg [2].
Kyslíkový test v normobarických podmienkach pomáha pri rozhodovaní o amputačnej línii. Ak tcpO2 pri kyslíkovom teste nestúpne o > 10 mm Hg v porovnaní s bazálnou hodnotou, hojenie amputačného pahýľu je v 68 % nepravdepodobné. Amputačnú líniu je preto nutné umiestniť do oblasti, v ktorej po kyslíkovom teste došlo k vzostupu tcpO2 o > 10 mm Hg [7,47]. Dôležité je, že mierny nárast tcpO2 tesne nad 10 mm Hg stále poukazuje na významnú obliteráciu makrocirkulácie v oblasti amputačnej línie a amputačná rana bude vyžadovať veľké liečebné úsilie. Rozhodnutie o výške amputačnej línie je skĺbením klinického stavu pacienta, objektívnej vyšetrovacej metódy (tcpO2) a klinického zhodnotenia chirurga/angiochirurga v spolupráci s diabetológom.
tcpO2 – význam experimentálny
tcpO2 a neuroischemický defekt
Distálna symetrická senzitívno-motorická neuropatia je jednou z najčastejších mikrovaskulárnych komplikácií diabetu. Podľa veľkých európskych štúdií je neuroischemický ulkus prítomný v 50–58 % všetkých NDD a 80 % pacientov s NDD má neuropatiu [48–50]. Diabetická neuropatia je sprevádzaná viacerými abnormalitami v mikrocirkulácii nohy ako napríklad zhoršenou vazoreaktivitou – porucha axonového reflexu vedúceho k vazodilatácii, autonómnou dysreguláciou artério-venóznych shuntov, nízkou perfúziou kapilár, presakovaním kapilár, stagnáciou krvi vo venulách, hormonálnou a zápalovou aktivitou v cievnej stene. Znížená perfúzia mikrocirkuláciou je veľmi komplikovaná, neviaže sa len k poškodeniu makrocirkulácie [51]. Funkčné zmeny mikrocirkulácie pri diabetickej neuropatii môžeme nepriamo sledovať aj pomocou tcpO2 [52]. Pacienti s DM bez PAOO a bez klinických známok neuropatie mali nižšiu hodnotu tcpO2 v porovnaní s kontrolnou skupinou, čo podporuje využitie tcpO2 na odhalenie počínajúceho postihnutia mikrocirkulácie [53]. Za tento fakt môže byť zodpovedný subklinický subepidermálny edém, ktorý je výsledkom hore uvedených abnormalít mikrocirkulácie vznikajúcich vplyvom diabetickej neuropatie [54].
Štúdie vodivosti nervových vlákien sú podľa American Diabetes Association (ADA) zlatým štandardom v diagnostike diabetickej periférnej neuropatie [55]. Deng et al dokázali, že diferencia tcpO2 medzi polohou v ľahu a v sede je vyššia u pacientov s neuropatiou a môže byť vhodným diagnostickým testom pri začínajúcej neuropatii. Tento test mal vyššiu špecificitu v porovnaní so štúdiami vodivosti nervových vlákien v skorých štádiách vyvíjajúcej neuropatie. Diferencia tcpO2 medzi ležiacou a sediacou polohou bola stanovená na 19,5 mm Hg na identifikáciu neuropatie [55]. Dosiahnuté výsledky spomenutej štúdie je ale potrebné overiť v rozsiahlejších sledovaniach. Meranie tcpO2 nie je doposiaľ akceptovanou metódou na diagnostikovanie diabetickej neuropatie v klinickej praxi.
TcpO2 ako prediktívny faktor
Hodnota tcpO2 > 40 mm Hg s veľkou pravdepodobnosťou umožní spontánne hojenie defektu pri konzervatívnej terapii s výnimkou niektorých klinických stavov, ktoré vyžadujú hodnoty > 50 mm Hg. Hodnoty nižšie sa pokladajú za hypoxické a môžu komplikovať proces hojenia. Parciálny tlak kyslíka v hodnote 30–40 mm Hg je nevyhnutný pre fibroblastickú proliferáciu, fibroblastickú syntézu kolagénu a pre proliferáciu kapilár [2]. Metaanalýza 4 štúdií určila hodnoty < 20–30 mm Hg za nezávislý prediktor komplikovaného hojenia defektu [56]. Faglia et al určili hodnotu 34 mm Hg za hranicu nutnej realizácie revaskularizačného výkonu. Pacienti s hodnotami medzi 34–40 mm Hg majú stále zvýšené riziko amputácie [57]. Všeobecne akceptovaná presná hodnota tcpO2 vo vzťahu k zlej prognóze hojenia NDD však stále nebola identifikovaná.
Zmena hodnoty tcpO2 po zvesení končatiny pri posadení pacienta o > 15 mm Hg je pozitívnym prediktívnym parametrom pre účinnosť implantácie miechového stimulátora u pacientov s PAOO a ischemickými bolesťami pri nemožnosti revaskularizácie a neúspechu inej konzervatívnej liečby [58]. Takisto vzostup tcpO2 o 4–15 mm Hg počas miechovej stimulácie je priaznivým parametrom účinnosti liečby [59].
Nízke hodnoty tcpO2 môžu byť u nekomplikovaných diabetikov spojené s vyšším rizikom budúcich kardiovaskulárnych príhod. Prediktívna hodnota tcpO2 bola v tomto prípade vyššia ako hodnota ABI [60]. TcpO2 priamo reflektuje tkanivovú perfúziu, kým ABI je ovplyvnené mediokalcinózou, ktorá je často prítomná u diabetikov [1]. Toto zistenie by mohlo mať zaujímavé uplatnenie v klinickej praxi. Diabetickí pacienti s tcpO2 ≤ 46 mm Hg mali vyššie riziko kardiovaskulárnych udalostí. Hodnota tcpO2 by mohla pomôcť pri presnejšej stratifikácii kardiovaskulárneho rizika u diabetikov s relatívne nízkym kardiovaskulárnym rizikom [60]. Meranie tcpO2 pre stratifikáciu kardiovaskulárneho rizika zatiaľ nie je klinicky akceptovanou metódou a je len v rovine pilotných štúdií.
Záver
Každý diabetický pacient s defektom na nohe musí byť dôkladne angiologicky vyšetrený a len bežné meranie ABI je nedostačujúce. Pokojové tcpO2 a tcpO2 pri indikovaných funkčných testoch patria medzi základné vyšetrovacie metódy pri etiologickej diagnostike NDD. Len ojedinelé meranie alebo spoliehanie sa len na hodnoty tcpO2 bez podrobnej anamnézy, fyzikálneho vyšetrenia a poznania glykemickej kontroly diabetu je nedostačujúce a môže výrazne poškodiť pacienta. Naopak, pri zachovanom komplexnom manažmente pacienta je tcpO2 veľmi výpovednou až nevyhnutnou metódou pri rozhodovacom procese. TcpO2 zvyšuje svoju výťažnosť kombináciou s technikami merania založenými na princípe laserového Dopplerovho vyšetrenia (napr. SPP) alebo s inými neinvazívnymi vyšetreniami ako PVR. Navyše tcpO2 sa javí ako možný budúci diagnostický ukazovateľ počínajúcej neuropatie a ako potenciálny prediktívny parameter kardiovaskulárnych udalostí. Na konfirmáciu a klinické uplatnenie experimentálnych štúdií je ale potrebné rozsiahlejšie sledovanie.
MUDr. Dávid Baláž
davidbalaz87@gmail.com
II. interná klinika LF UK a UN, Bratislava, Slovenská republika
www.fmed.uniba.sk
Doručeno do redakce 22. 9. 2014
Přijato po recenzi 11. 11. 2014
Zdroje
1. Apelqvist J. Diagnostics and treatment of the diabetic foot. Endocrine 2012; 41(3): 384–397.
2. Gašpar L.Transkutánna oxymetria – použitie v diagnostike syndrómu diabetickej nohy. In: Krahulec B, Gašpar L, Štvrtinová V et al. Manažment pacienta so syndrómom diabetickej nohy. Veda: Bratislava 2013 : 141–156. ISBN 978–80–224–1293–3.
3. International Working Group on the Diabetic Foot. International consensus on the diabetic foot and practical guidelines on the management and the prevention of the diabetic foot. Amsterdam 2011. Dostupné z WWW: http://www.idf.org/bookshop nebo http://www.diabeticfoot.nl.
4. Singh N, Armstrong DG, Lipsky BA. Preventing foot ulcers in patients with diabetes. JAMA 2005; 293(2): 217–228.
5. Hauser CJ, Appel P, Shoemaker WC. Pathophysiologic classification of peripheral vascular disease by positional changes in regional transcutaneous oxygen tension. Surgery 1984; 95(6): 689–693.
6. Shah JB, Ram DM, Fredrick E et al. Determination of ideal PtcO2 measurement time in evaluation of hypoxic wound patients. Undersea Hyperb Med 2008; 35(1): 41–51.
7. Fife CE, Smart DE, Sheffield PJ et al. Transcutaneous Oximetry in Clinical Practice: Consensus statements from an expert panel based on evidence. Undersea Hyperb Med 2009; 36(1): 43–53.
8. Prompers L, Huijberts M, Apelqvist J et al. High prevalence of ischaemia, infection and serious comorbidity in patients with diabetic foot disease in Europe. Baseline results from the Eurodiale study. Diabetologia 2007; 50(1): 18–25.
9. Brownrigg JRW, Apelqvist J, Bakker K et al. Evidence-based Management of PAD & the Diabetic Foot. Eur J Vasc Endovasc Surg 2013; 45(6): 673–681.
10. Apelqvist J, Bakker K, van Houtum WH et al. International Working Group on the Diabetic Foot (IWGDF) Editorial Board. Practical guidelines on the management and prevention of the diabetic foot : Based upon the International Consensus on the Diabetic Foot (2007) Prepared by the International Working Group on the Diabetic Foot. Diabetes Metab Res Rev 2008; 24(Suppl 1): S181-S187.
11. Norgren L, Hiatt WR, Dormandy JA et al. TASC II Working Group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007; 33(Suppl 1): S1-S75.
12. Urbanova R, Jirkovska A, Woskova V et al. Transcutaneous oximetry in the diagnosis of ischemic disease of the lower extremities in diabetics. Vnitř Lék 2001; 47(5): 330–332.
13. Potier L, Abi Khalil C, Mohammedi K et al. Use and utility of ankle brachial index in patients with diabetes. Eur J Vasc Endovasc Surg 2011; 41(1): 110–116.
14. Arsenault KA, McDonald J, Devereaux PJ et al. The use of transcutaneous oximetry to predict complications of chronic wound healing: a systematic review and meta-analysis. Wound Repair Regen 2011; 19(6): 657–663.
15. Orchard TJ, Strandness DE. Assessment of peripheral vascular disease in diabetes. Report and recommendations of an international workshop sponsored by the American Diabetes Association and the American Heart Association September 18–20, 1992 New Orleans, Louisiana. Circulation 1993; 88(2): 819–828.
16. Rajagopalan S, Mukherjee D, Mohler ER. Manual of vascular diseases. Lippincott Williams and Wilkins 2005. 2 : 16. ISBN 978–0781744997.
17. Park SC, Choi CY, Ha YI et al. Utility of Toe-brachial Index for Diagnosis of Peripheral Artery Disease. Arch Plast Surg 2012; 39(3): 227–231.
18. Hyun S, Forbang NI, Allison MA et al. Ankle-brachial index, toe-brachial index, and cardiovascular mortality in persons with and without diabetes mellitus. J Vasc Surg 2014; 60(2): 390–395.
19. Hoyer C, Sandermann J, Petersen LJ. The toe-brachial index in the diagnosis of peripheral arterial disease. J Vasc Surg 2013; 58(1): 231–238.
20. Carter SA, Tate RB. The value of toe pulse waves in determination of risks for limb amputation and death in patients with peripheral arterial disease and skin ulcers or gangrene. J Vasc Surg 2001; 33(4): 708–714.
21. Anderson CA. Noninvasive assessment of lower extremity hemodynamics in individuals with diabetes mellitus. J Vasc Surg 2010; 52(3 Suppl): 76S-S80. Dostupné z DOI: <http://doi: 10.1016/j.jvs.2010.06.012>.
22. Pardo M, Alcaraz M, Bernal FL. A solution to ankle-brachial index limitations in peripheral transluminal angioplasty. Radiol Med 2013; 118(8): 1373–1378.
23. Pola P, Tondi P, Dal Lago A et al. Transcutaneous oximetry is useful in vascular pathology if a cutaneous reference map and a maximal exercise test are used. Vasc Endovas Surg 1996; 30 : 117–122.
24. Wipke-Tevis DD, Stotts NA, Williams DA et al. Tissue oxygenation, perfusion, and position in patients with venous leg ulcers. Nurs Res 2001; 50(1): 24–32.
25. Wyss CR, Matsen FA, Simmons CW et al. Transcutaneous oxygen measurements on limbs of diabetic and non-diabetic patients with peripheral vascular disease. Surgery 1984; 95(3): 339–345.
26. Padberg FT, Back TL, Thompson PN et al. Transcutaneous oxygen (TcPO2) estimates probability of healing in the ischaemic extremity. J Surg Res 1996; 60(2): 365–369.
27. White RA, Nolan L, Harley D et al. Noninvasive evaluation of peripheral vascular disease using transcutaneous oxygen tension. Am J Surg 1982; 144(1): 68–75.
28. Grolman RE, Wilkerson DK, Taylor J et al. Transcutaneous oxygen measurements predict a beneficial response to hyperbaric oxygen therapy in patients with non-healingwounds and critical limb ischaemia. Am Surg 2001; 67(11): 1072–1080.
29. Poredos P, Rakovec S, Guzic-Salobir B. Determination of amputation level in ischaemic limbs using tcPO2 measurement. Vasa 2005; 34(2): 108–112.
30. Rooke T. TcpO2 in non-invasive vascular medicine. Blood Gas News 1998; 7(2): 21–23.
31. Becker F, Raoux MH, Brenot R et al. Predictive value of tcpO2 in chronic severe ischemia of lower limbs. Int J Microcir Clin Exp 1988; 7 : 261–271.
32. Osmundson PJ, Rooke TW, Hallett JW. Effect of arterial revascularization on transcutaneous oxygen tension of the ischemic extremity. Mayo Clin Proc 1988; 63(9): 897–902.
33. Arroyo CI, Tritto VG, Buchbinder D et al. Optimal waiting period for foot salvage surgery following limb revascularization. Foot Ankle Surg 2002; 41(4): 228–232.
34. Caselli A, Latini V, Lapenna A et al. Transcutaneous oxygen tension monitoring after successful revascularization in diabetic patients with ischaemic foot ulcers. Diabet Med 2005; 22(4): 460–465.
35. Benhamou Y, Edet S, Begarin L et al. Transcutaneous oxymetry as predictive test of peripheral vascular revascularization in haemodialysis population. Nephrol Dial Transplant 2012; 27(5): 2066–2069.
36. Castronuovo JJ, Adera HM, Smiell JM et al. Skin perfusion pressure measurement is valuable in the diagnosis of critical limb ischemia. J Vasc Surg 1997; 26(4): 629–637.
37. Dietz DA, Sheffield PJ. Non-invasive wound assessment tools. In: Sheffield PJ, Fife CE (eds). Wound Care Practice.2nd ed. Best Publishing Company: Flagstaff, AZ 2007 : 129–174. ISBN 978–1930536388.
38. Tomesova J, Gruberova J, Broz P et al. Methods of skin microcirculation assessment. Vnitř Lék 2013; 59(10): 895–902.
39. Castronuovo JJ The role of skin perfusion pressure and transcutaneous partial pressure oxygen measurements in chronic critical limb ischemia. In: Mansour MA, Labropoulos N (eds) Vascular Diagnosis. Saunders: New York 2004 : 247–255. ISBN 978–0721694269.
40. Takkin L, Sample R, Moore P et al. Prediction of Wound Healing Outcome Using Skin Perfusion Pressure & Transcutaneous Oximetry. Wounds 2009; 21(11): 310–316.
41. Dubsky M, Jirkovska A, Bem R et al. Treatment of critical limb ischemia and diabetic foot disease by the use of autologous stem cells. Vnitř Lék 2011; 57(5): 451–455.
42. Cechurova D, Rusavy Z, Lacigova S et al. Transcutaneous oxygen tension in hyperbariccondition as a predictor of ischaemia in non-healing diabetic foot ulcers. Vnitř Lék 2002; 48(10): 971–975.
43. Dowd G. Predicting stump healing following amputation for peripheral vascular disease using the transcutaneous oxygen monitor. Ann R Coll Surg Engl 1987; 69(1): 31–35.
44. Arsenault KA, Al-Otaibi A, Devereaux PJ et al. The use of transcutaneous oximetry to predict healing complications of lower limb amputations: A systematic review and meta-analysis. Eur J Vasc Endovasc Surg. 2012; 43(3): 329–336.
45. Christiansen KS, Klarke M. Transcutaneous oxygen measurement in peripheral occlusive disease. An indicator of wound healing in leg amputation. J Bone Joint Surg Br 1986; 68(3): 423–426.
46. Wütschert R, Bounameaux H. Determination of Amputation Level in Ischemic Limbs: Reappraisal of the measurement of TcPO2. Diabetes Care 1997; 20(8): 1315–1318.
47. Setacci C, Ricco JB. European Society for Vascular Surgery. Guidelines for critical limb ischaemia and diabetic foot--introduction. Eur J Vasc Endovasc Surg. 2011; 42(Suppl 2):S1-S3.
48. Caputo GM, Cavanagh PR, Ulbrecht JS et al. Assessment and management of foot disease in patients with diabetes. N Engl J Med 1994; 331(13): 854–860.
49. Prompers L, Schaper N, Apelqvist J et al. Prediction of outcome in individuals with diabetic foot ulcers: focus on the differences between individuals with and without peripheral arterial disease. The EURODIALE Study. Diabetologia 2008; 51(5): 747–755.
50. Raman R, Gupta A, Krishna S et al. Prevalence and risk factors for diabetic microvascular complications in newly diagnosed type II diabetes mellitus. Sankara Nethralaya Diabetic Retinopathy Epidemiology and Molecular Genetic Study (SN-DREAMS, report 27). J Diabetes Complications 2012; 26(2): 123–128.
51. Schaper NC, Huijberts M, Pickwell K. Neurovascular control and neurogenic inflammation in diabetes. Diabetes Metab Res Rev 2008; 24(Suppl 1): S40-S44.
52. Sun PC, Kuo CD, Chi LY et al. Microcirculatory vasomotor changes are associated with severity of peripheral neuropathy in patients with type 2 diabetes. Diab Vasc Dis Res 2013; 10(3): 270–276.
53. De Meijer VE, Van’t Sant HP, Spronk S et al. Reference value of transcutaneous oxygen measurement in diabetic patients compared with nondiabetic patients. J Vasc Surg 2008; 48(2): 382–388.
54. Chao CY, Zheng YP, Cheing GL The association between skin blood flow and edema on epidermal thickness in the diabetic foot. Diabetes Technol Ther 2012; 14(7): 602–609.
55. Deng W, Dong X, Zhang Y et al. Transcutaneous oxygen pressure (TcPO₂): a novel diagnostic tool for peripheral neuropathy in type 2 diabetes patients. Diabetes Res Clin Pract 2014; 105(3):336–343.
56. Kyle AA, McDonald J, Devereaux PJ et al. The use of transcutaneous oximetry to predict complications of chronic wound healing: A systematic review and meta-analysis. Wound Repair Regen 2011; 19(6): 657–663.
57. Faglia E, Clerici G, Caminiti M et al. Predictive values of transcutaneous oxygen tension for abovethe-ankle amputation in diabetic patients with critical limb ischemia. Eur J Vasc Endovasc Surg 2007; 33(6): 731–736.
58. Chen X, Fu W, Gu W. Spinal cord stimulation for patients with inoperable chronic critical leg ischemia. World J Emerg Med 2011; 2(4): 262–266.
59. Provenzano DA, Jarzabek G, Georgevich P. The utilization of transcutaneous oxygen pressures to guide decision-making for spinal cord stimulation implantation for inoperable peripheral vascular disease: a report of two cases. Pain Physician 2008; 11(6): 909–916.
60. Gazzaruso C, Coppola A, Falcone C et al. Transcutaneous oxygen tension as a potential predictor of cardiovascular events in type 2 diabetes. Diabetes Care 2013; 36(6): 1720–1725.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Zlepšil se osud gravidit žen s pregestačním diabetes mellitus za deset let?
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
- Autoimunitní pankreatitida – diagnostický konsenzus
- Intersticiální plicní procesy a granulomatózy asociované s běžným variabilním imunodeficitem
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Nový lék je výrazně účinnější nežli inhibitory ACE u chronického srdečního selhání
- Spontánní bakteriální peritonitida
- Co jsou a co nám přinášejí biosimilars?
- Inzulinová analoga u pacientů s diabetem a renální dysfunkcí
- Súčasnosť a budúcnosť v manažmente vénových vaskulárnych chorôb
- Akromegalie a medikamentózní léčba
- Raritní případ mnohočetného myelomu: vícečetný solitární plazmocytom kostí bérců a předloktí
- Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným
- XXXIV. dny mladých internistů
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Václav Hána. Endokrinologie pro praxi.
- Hana Papežová a kol. Naléhavé stavy v psychiatrii.
- Peter Gavorník. Angiológia 2 pre všeobecných lekárov – Arteriológia.
- Autoimunitní pankreatitida – diagnostický konsenzus – editorial
- Akromegalie a medikamentózní léčba – editorial
- Kalcifikující uremická arteriolopatie – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Spontánní bakteriální peritonitida
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



