-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTachykardií indukovaná kardiomyopatie
Tachycardia-induced cardiomyopathy
Cardiomyopathy is a heterogeneous group of diseases of heart muscle accompanied with impaired cardiac function. Tachycardia-induced cardiomyopathy (TIC) is caused by prolonged tachycardia leading to dilatation and systolic dysfunction with clinical manifestation of heart failure. This state is reversible after normalization of heart rate. The diagnosis is usually made retrospectively after normalization of heart rate and recovery of left ventricular function (LVF). More than 100 years after the first documented case (described in 1913 in a young patient with atrial fibrillation and symptoms of heart failure [25]) is still limited knowledge of pathophysiological mechanisms. The most common arrhythmias responsible for the TIC include atrial fibrillation [1,2], atrial flutter [3], incessant supraventricular tachycardia [4], ventricular tachycardia (VT) [5] and frequent ventricular extrasystoles (VES) [6]. TIC detection and therapeutic intervention is crucial considering potential reversibility of tachycardia. Current options of treatment involve drug therapy and surgical or catheter ablation.
Key words:
heart failure – reversible dysfunction – tachycardia-induced cardiomyopathy
Autoři: Jan Povolný
Působiště autorů: Kardiocentrum, III. interní kardiologická klinika 3. LF UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Vyšlo v časopise: Vnitř Lék 2015; 61(1): 56-59
Kategorie: Přehledné referáty
Souhrn
Kardiomyopatie představuje heterogenní skupinu onemocnění srdečního svalu, provázenou poruchou srdeční funkce. Tachykardií indukovaná kardiomyopatie (TIC) je způsobena déle trvající tachykardií vedoucí k dilataci a systolické dysfunkci s klinickými projevy srdečního selhání, které jsou reverzibilní po normalizaci tepové frekvence. Diagnóza je obvykle stanovena retrospektivně po normalizaci tepové frekvence a následné úpravě funkce levé komory (LKS). Více než 100 let po prvním dokumentovaném případu (roku 1913 popsána u mladého nemocného s fibrilací síní a projevy srdečního selhání [25]) jsou nadále znalosti patofyziologických mechanizmů omezené. Mezi nejčastější arytmie odpovědné za TIC patří fibrilace síní [1,2], flutter síní [3], incesantní supraventrikulární tachykardie [4], komorová tachykardie (KT) [5] a frekventní komorové extrasystoly (KES) [6]. Vzhledem k potenciální reverzibilitě je proto rozpoznání TIC a včasný terapeutický zásah stěžejní. Mezi stávající možnosti léčby patří farmakoterapie a chirurgická či katetrová ablace.
Klíčová slova:
reverzibilní dysfunkce – srdeční selhání – tachykardii indukovaná kardiomyopatiePatofyziologické mechanizmy
Většina znalostí o patofyziologii vychází ze zvířecích modelů. První experimentální model založený na síňové stimulaci byl poprvé demonstrován Whiplem et al v roce 1962 [7]. Také většina dalších informací vychází z experimentálních stimulačních studií.
Změny na úrovni buněčného metabolizmu
Na buněčné úrovni dochází k poklesu kreatinu, fosfokreatinu, ATP, glykogenu, vzestupu aktivity enzymů Krebsova cyklu a snížení aktivity Na/K-ATPázy, vedoucí k poklesu buněčného metabolizmu a prohloubení oxidativního stresu s hrozící apoptózou buňky [8,9]. Mezi další možné patologické mechanizmy patří změny v aktivitě transportu vápníku v sarkoplazmatickém retikulu vedoucí ke snížené dostupnosti Ca pro myocyty s redukcí kontraktility [8,11].
Strukturální změny
Nejčastějším projevem tachykardií indukované kardiomyopatie (TIC) je dilatace levé komory srdeční (LKS) [12]. Pro dilataci je typické ztenčení stěny s minimálním nárůstem svalové hmoty. Na buněčné úrovni dochází k prodloužení myocytů a narušení struktury vláken myofibril a rozrušení vazby s bazální membránou [13]. V souvislosti s dilatací levé komory srdeční dochází k dilataci mitrálního prstence a vzniku sekundární mitrální regurgitace. Strukturální změny v srdeční stěně podporují vznik subendokardiální ischemie na podkladě pozměněné distribuce cévního zásobení vedoucího k poklesu koronární rezervy [14]. Pokles cévního zásobení a dodávky kyslíku dále akceleruje poškození srdeční stěny s progresí dysfunkce LKS.
Hemodynamické změny
Chronická stimulace komor vedla na zvířecích modelech k zvýšeným plnícím tlakům LKS, zhoršené kontraktilní funkci komory [15], sníženému srdečnímu výdeji, vzestupu systémové cévní rezistence a zvýšenému napětí stěny LKS. Mezi další mechanizmy patří změny elastických vlastností LKS. U zdravého srdce torze LKS snižuje svalové napětí stěny a recoil (frakční zkrácení pod nestresovým objemem) v časné diastole usnadňuje plnění levé komory. U stimulované komory dochází k poklesu torze spolu s poklesem recoilu [16]. V souvislosti se změnami v bazální membráně a extracelulární matrix vedoucí k odlišné geometrické orientaci [17]. Důsledkem změny geometrie dochází u stimulované komory k up-regulaci neurohumorální osy se vzestupem koncentrací sérového síňového natriuretického peptidu (ANP), reninu, aldosteronu, angiotenzinu II, epinefrinu a norepinefrinu [18].
Časový průběh a fáze zotavení
Hemodynamické důsledky jsou patrné již po 24 hod po zahájení stimulace. Některé změny, jako zvýšené plnící tlaky, zvýšené tlaky v plicnici a pokles systémového tlaku přetrvávají minimálně týden po ukončení, zatímco alterace srdečního výdeje a ejekční frakce LKS může přetrvávat i 3–5 týdnů [12,15,18]. Významné zlepšení ejekční frakce (EF) LKS je pozorováno po 24–48 hod [19]. Během 4 týdnů dochází k normalizaci hemodynamických parametrů, end-systolické a end-diastolické objemy přetrvávají zvýšené 12 týdnů po ukončení stimulace [19,20].
Fibrilace síní
Nejlépe zdokumentovanou arytmii jako příčiny TIC je chronická fibrilace síní. Fibrilace síní zvyšuje riziko srdečního selhání [21]. U určité části případů pacientů se srdečním selháním dochází k normalizaci EF po restituci sinusového rytmu. Studie sledující zlepšení funkce srdeční po elektrické kardioverzi prokázala zlepšení systolické funkce síní již po týdnu, zatím co snížená funkce levé komory srdeční spolu se zvýšenou spotřebou kyslíku přetrvávala ještě měsíc po kardioverzi. Tyto výsledky odpovídají spíše přítomnosti myopatie LKS jako příčiny případného srdečního selhání, než ztráty síňově kontraktility a AV synchronizace. Tento koncept byl prokázán u studií s pacienty s chronickou fibrilací síní a srdečním selháním, léčených neselektivní ablací AV uzlu s dependentní kardiostimulací. U nich po normalizaci frekvence komor došlo ke zlepšení funkce LKS i přes přetrvávající fibrilaci síní [16,17].
Síňová tachykardie
Zdrojem je zvýšená automaticita ektopického síňového ložiska. Dysfunkce LKS byla zaznamenána u asi 10 % pacientů se síňovou tachykardií [20]. Suverénní metodou v léčbě je v současnosti radiofrekvenční ablace, která přináší zlepšení funkce LKS u 97 % pacientů [22].
Komorová tachykardie
TIC na podkladě monomorfní komorové tachykardie (KT) je vzácnější než u supraventrikulární tachykardie. Jedná se ve většině případů o idiopatickou formu KT, vycházející nejčastěji z výtokového traktu pravé či levé komory a koronární kapsičky. Vzácně může přejít do perzistující formy, vedoucí k ireverzibilní dysfunkci LKS [5]. Studie sledující 249 pacientů bez strukturálního onemocnění s frekventní monomorfní tachykardii odhalila pouze 7 % pacientů s TIC. Ve všech případech vedla ablace k normalizaci funkce LKS.
Komorová extrasystolie
Komorová extrasystolie (KES) je rovněž spojována s rozvojem TIC. Bylo prokázáno, že četnost KES koreluje s rozsahem dysfunkce levé komory. Je uváděno, že vznik TIC je vysoce pravděpodobný u pacientů s frekvencí KES v záznamu přesahující 20–24 %. U pacientů s četností KES pod 16 % bylo riziko vzniku TIC zanedbatelné. Z pohledu absolutního počtu 20 000 KES a více koreluje s poklesem EF. Při rozdělení dle četnosti KES do 3 skupin na < 1 000 KES denně, 1 000–10 000 KES denně a > 10 000 KES denně byla pozorována prevalence dysfunkce LKS ve 4 %, 12 % a 34 % [23].
To naznačuje přítomnost dalších faktorů hrajících roli v rozvoji dysfunkce levé komory. Předpokládá se, že elektrická aktivace původem z komor způsobuje neefektivní kontrakci komor v důsledku asynchronní aktivace vedoucí následně k její remodelaci. U většiny pacientů s TIC na podkladě KES došlo po katetrové ablaci ke zlepšení funkce LKS. U 80 % pacientů došlo během 3 měsíců k úplné normalizaci či výraznému zlepšení [24]. Ke zlepšení funkce LKS není třeba naprostá absence KES. U většiny pacientů s redukcí četnosti KES o více než 80 % došlo k normalizaci EF během následujících 4 měsíců.
Také šíře QRS komplexu extrasystoly byla v nedávné studii označena za nezávislý prediktor zhoršené funkce LKS. Délka trvání QRS komplexu přesahující 150 ms představovala cut-off pacientů bez a s vývojem TIC. U pacientů s QRS přesahující ≥170 ms byla normalizace funkce LKS dokonce nepravděpodobná [24].
Závěr
Stávající znalosti mechanizmů dysfunkce LKS u TIC jsou stále omezené. Studie se zvířecími modely pomohla lépe posoudit hemodynamické a buněčné mechanizmy. Stanovení diagnózy TIC je ale vzhledem k reverzibilitě dysfunkce stěžejní. Také u pacientů s neznámou etiologií kardiomyopatie je vždy nutná úvaha o možnosti TIC s následnou adekvátní terapii od prosté kontroly rytmu po kauzální katetrovou ablaci.
Krátká kazuistika z našeho pracoviště
58letá pacientka přijata s anamnézou 14denní progredující dušnosti. Vstupně otoky dolních končetin, dušnost NYHA III. Vstupní EKG odhalilo SVT s frekvencí komor 150–160/min (obr. 1).
Obr. 1. Vstupní EKG s SVT s rychlou komorovou odezvou 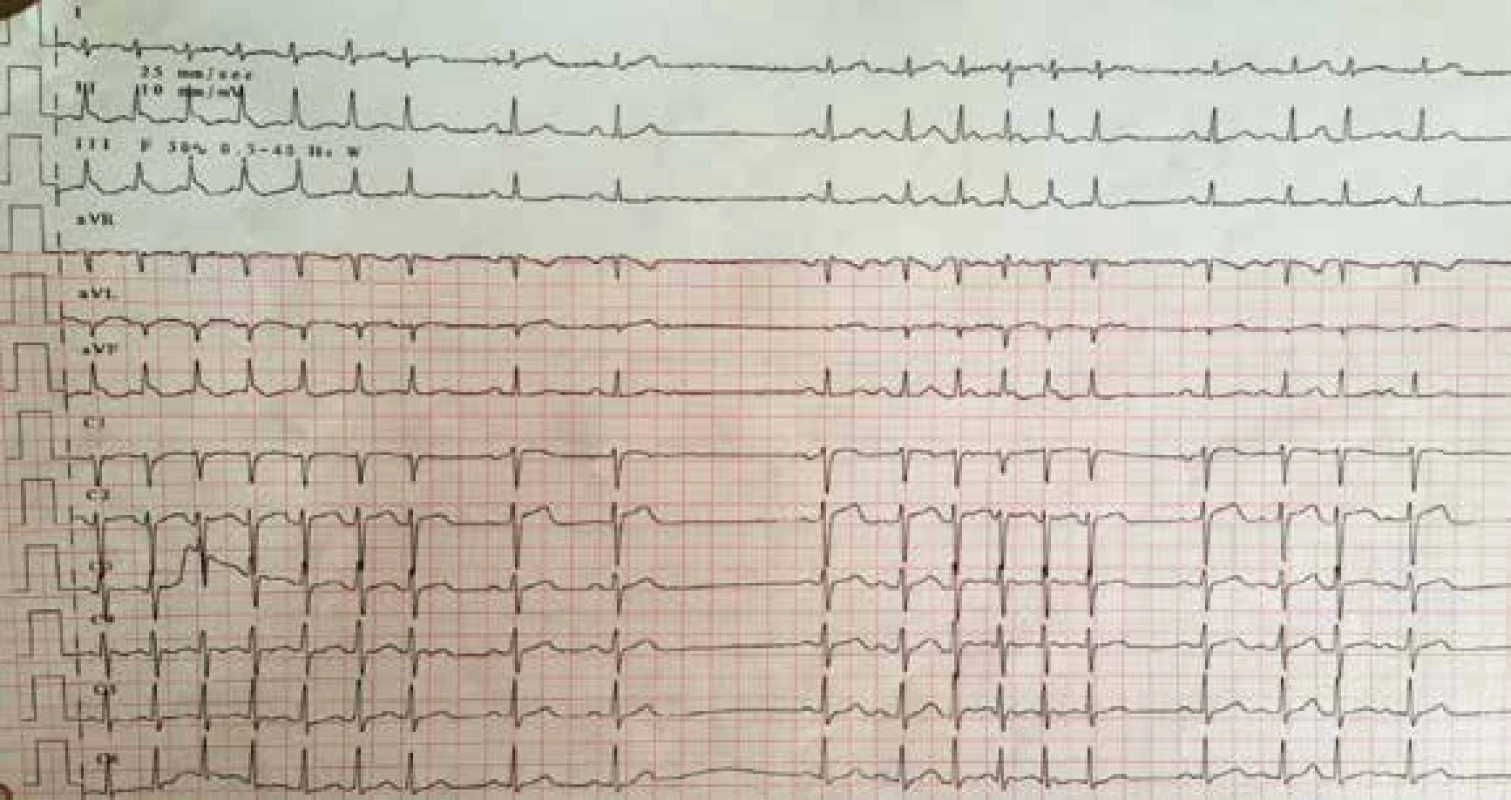
Laboratorní výsledky včetně vyšetření hormonů štítné žlázy byly bez patologie. Dle echokardiografického vyšetření v průběhu arytmie prokázána systolická dysfunkce LKS s globální hypokontraktilitou a EF maximálně 45 %. Při terapii (betablokátor, furosemid) došlo mírné regresi obtíží, doplněna CT koronarografie s nulovým kalciovým skóre, pro arytmii nebylo možné spolehlivě hodnotit koronární tepny, nicméně stenóza byla velmi málo pravděpodobná. Provedeno elektrofyziologické vyšetření s mapováním metodou CARTO (obr. 2).
Obr. 2. Záznam CARTO zachycující levou síň s fokusem tachykardie 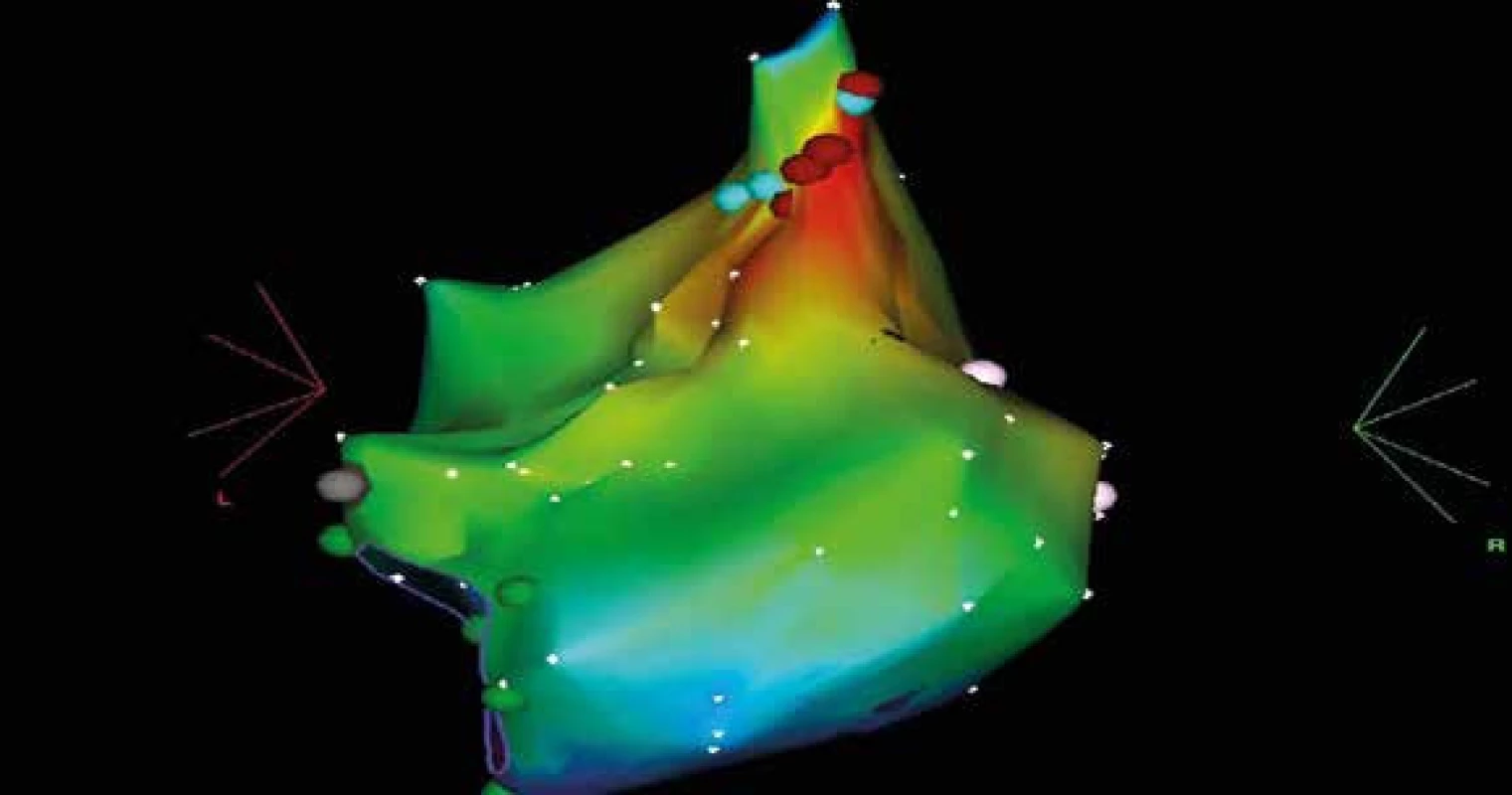
Vzhledem k místu nejčasnější aktivace šlo vs o fokální síňovou tachykardii. Za kontroly intrakardiální echokardiografie provedena transeptální punkce s izolací P horní a následně L dolní plicní žíly s následnou terminací síňových tachykardii. Kontrolní echokardiografické vyšetření s odstupem 3, 6, 10 a 14 dnů prokázalo postupnou normalizaci systolické funkce LKS. Sinusový rytmus přetrvává i v dalším sledování.
MUDr. Jan Povolný
povol@centrum.cz
Kardiocentrum, III. interní kardiologická klinika 3. LF UK a FN KV, Praha
www.fnkv.cz
Doručeno do redakce 18. 7. 2014
Přijato po recenzi 18. 9. 2014
Zdroje
1. Grogan M, Smith HC, Gersh BJ et al. Left ventricular dysfunction due to atrial fibrillation in patients initially believed to have idiopathic dilated cardiomyopathy. Am J Cardiol 1992; 69(19): 1570–1573.
2. Raymond RJ, Lee AJ, Messineo FC et al. Cardiac performance early after cardioversion from atrial fibrillation. Am Heart J 1998; 136(3): 435–442.
3. Luchsinger JA, Steinberg JS. Resolution of cardiomyopathy after ablation of atrial flutter. J Am Coll Cardiol 1998; 32(1): 205–210.
4. Cruz FE, Cheriex EC, Smeets JL et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol 1990; 16(3): 739–744.
5. Jaggarao NS, Nanda AS, Daubert JP. Ventricular tachycardia induced cardiomyopathy: improvement with radiofrequency ablation. Pacing Clin Electrophysiol 1996; 19(4 Pt 1): 505–508.
6. Chugh SS, Shen WK, Luria DM et al. First evidence of premature ventricular complex-induced cardiomyopathy: a potentially reversible cause of heart failure. J Cardiovasc Electrophysiol 2000; 11(3): 328–329.
7. Whipple GH, Sheffield LT, Woodman EG et al. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proc N Engl Cardiovasc Soc 1962; 20 : 39–40.
8. O’Brien PJ, Ianuzzo CD, Moe GW et al. Rapid ventricular pacing of dogs to heart failure: biochemical and physiological studies. Can J Physiol Pharmacol 1990; 68(1): 34–39.
9. Spinale FG, Clayton C, Tanaka R et al. Myocardial Na+, K(+) - ATPase in tachycardia induced cardiomyopathy. J Mol Cell Cardiol 1992; 24(3): 277–294.
10. Calderone A, Bouvier M, Li K et al. Dysfunction of the beta and alpha-adrenergic systems in a model of congestive heart failure. The pacing-overdrive dog. Circ Res 1991; 69(2): 332–343.
11. Perreault CL, Shannon RP, Komamura K et al. Abnormalities in intracellular calcium regulation and contractile function in myocardium from dogs with pacing-induced heart failure. J Clin Invest 1992; 89(3): 932–938.
12. Damiano jr. RJ, Tripp jr. HF, Asano T et al. Left ventricular dysfunction and dilatation resulting from chronic supraventricular tachycardia. J Thorac Cardiovasc Surg 1987; 94(1): 135–143.
13. Kajstura J, Zhang X, Liu Y et al. The cellular basis of pacing-induced dilated cardiomyopathy. Myocyte cell loss and myocyte cellular reactive hypertrophy. Circulation 1995; 92(8): 2306–2317.
14. Spinale FG, Grine RC, Tempel GE et al. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol 1992; 87(1): 65–79.
15. Ohno M, Cheng CP, Little WC. Mechanism of altered patterns of left ventricular filling during the development of congestive heart failure. Circulation 1994; 89(5): 2241–2250.
16. Tibayan FA, Lai DT, Timek TA et al. Alterations in left ventricular torsion in tachycardia-induced dilated cardiomyopathy. J Thorac Cardiovasc Surg 2002; 124(1): 43–49.
17. Zellner JL, Spinale FG, Eble DM et al. Alterations in myocyte shape and basement membrane attachment with tachycardia-induced heart failure. Circ Res 1991; 69(3): 590–600.
18. Riegger AJ, Liebau G. The renin-angiotensin-aldosterone system, antidiuretic hormone and sympathetic nerve activity in an experimental model of congestive heart failure in the dog. Clin Sci (Lond) 1982; 62(5): 465–469.
19. Howard RJ, Stopps TP, Moe GW et al. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol 1988; 66(12): 1505–1512.
20. Tomita M, Spinale FG, Crawford FA et al. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation 1991; 83(2): 635–644.
21. Stewart S, Hart CL, Hole DJ et al. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002; 113(5): 359–364.
22. Chiladakis JA, Vassilikos VP, Maounis TN et al. Successful radiofrequency catheter ablation of automatic atrial tachycardia with regression of the cardiomyopathy picture. Pacing Clin Electrophysiol 1997; 20(4 Pt 1): 953–959.
23. Baman TS, Lange DC, Ilg KJ et al. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm 2010; 7(7): 865–869.
24. Deyell MW, Park KM, Han Y et al. Predictors of recovery of left ventricular dysfunction after ablation of frequent ventricular premature depolarizations. Heart rhythm 2012; 9(9): 1465–1472.
25. Gossage AM, Braxton Hicks JA. On auricular fibrillation. QJ Med 1913; 6(4): 435–440.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Errata et corrigendaČlánek POET2 – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Překvapivě starý kostlivec ve skříni – editorial
- HevyLite™ – nová metoda detekce monoklonálních imunoglobulinů – editorial
- Errata et corrigenda
- Význam Pneumonia Severity Index u pacientů s pneumonií hospitalizovaných na jednotce intenzivní pneumologické péče
- Registr POET2: srovnání přímých ročních zdravotnických nákladů na léčbu diabetu 2. typu po zahájení léčby inzulinem NPH nebo inzulinem glargin v kombinaci s perorálními antidiabetiky v České republice
-
Úvodní slovo předsedy České internistické společnosti, profesora MUDr. Richarda Češky, CSc., FACP, FEFIM
Česká interna a časopis Vnitřní lékařství v roce 2015 - Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Studium souvislostí poruch spánku, obstrukční spánkové apnoe a vzniku a léčby arteriální hypertenze – módní vlna nebo dlouhodobý trend?
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
-
Akútne a chronické aortové choroby hrudníkovej a brušnej aorty u dospelých
Odporúčania Angiologickej sekcie Slovenskej lekárskej komory pre klasifikáciu a diagnózu chorôb aorty (AS SLK, 2014) - POET2 – editorial
- Distribuce hodnot glykovaného hemoglobinu v populaci diabetiků 2. typu: projekt Valetudo
- Vladislav Hytych, Alice Tašková, Martina Vašáková et al. Plicní chirurgie v instruktivních kazuistikách.
- Daniel Schwarz, Ladislav Dušek (eds) et al. Computer applications, systems and networks for medical education.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



