-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMonoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
Monoclonal gammopathy of undetermined significance and asymptomatic multiple myelom in the year 2014
Presence of monoclonal immunoglobulin in serum or urine is a relatively common event affecting about 3.2 % of people over 50. Isolated increase of only one type of free light chain, either κ or λ, is detected in 0.7–0.8 % of people over 50. Most people with monoclonal immunoglobulin meet the criteria of the so-called “monoclonal gammopathy of undetermined significance (MGUS)”. MGUS is defined by concentration of monoclonal immunoglobulin in serum < 30 g/l, number of plasma cells in the bone marrow < 10 % and the absence of symptoms of multiple myeloma and other lymphoproliferative diseases. A proportion of people with MGUS gradually progresses from asymptomatic into symptomatic myeloma or other malignant lymphoproliferative disease requiring treatment. Therefore, MGUS is considered to be one of the most common premalignant conditions with an average risk of transformation into malignant disease of 1 % per year. Monoclonal gammopathy of IgG and IgA subtype can develop into multiple myeloma. Light chain monoclonal gammopathy can develop not only into light chain multiple myeloma but also into AL-amyloidosis and light chain deposition disease (amorphous deposits of light chains damaging organs). IgM monoclonal gammopathy may develop into Waldenstrom macroglobulinemia or other lymphoproliferative disorder, or into rare IgM subtype of multiple myeloma. Unfortunately, people with MGUS are threatened by more than an increased risk of transformation into multiple myeloma or other severe hematologic disease. Pre-malignant clone of plasma cells in the bone marrow causes changes in the bone marrow that directly affect the person. For people with MGUS, there is an increased incidence of osteoporosis and increased fracture risk when compared to the general population. People with MGUS also have an increased risk of bacterial infections and thromboembolic complications compared with the same age population without MGUS. Clonal plasma cells, which are the basis of MGUS, may in some cases produce toxic monoclonal immunoglobulin which can damage the body’s own antibody activity by binding to specific antigens (such as cold agglutinin disease), or their deposits in organs (e.g. kidney damage) or physical properties (e.g. cryoglobulinemia). Therefore, it is recommended that this group of people is regularly checked with the aim to capture not only transformation into symptomatic multiple myeloma or another malignant disease, but also the formation of the above-mentioned complications. Moreover, it is recommended to monitor patients with asymptomatic myeloma and to initiate treatment only after symptoms of multiple myeloma are observed. In 2014, discussion of subdivision of subgroups of patients with asymptomatic myeloma with high (≥ 80 %) probability of early (within 2 years) transformation in multiple myeloma which would be beneficial for early initiation of treatment is ongoing. According to first proposals, patients with asymptomatic myeloma that meet at least one of the three conditions: more than 60 % of plasma cells in the bone marrow, ratio of free light kappa and lambda chains is greater than 100 or less than 0.01, or multiple focal lesions on whole-body MRI of the skelet. The review contains current opinions on prognostic classification and appropriate intervals and extent of control examinations.
Key words:
asymptomatic myeloma – monoclonal gammopathy of undetermined significance – PET/CT – symptomatic multiple myeloma – Waldenström macroglobulinemia
Autoři: Zdeněk Adam 1; Marta Krejčí 1; Luděk Pour 1; Eva Ševčíková 1; Andrea Křivanová 1; Zdeněk Řehák 2; Renata Koukalová 2; Zdeňka Čermáková 3; Jiří Vaníček 4; Sabina Ševčíková 5
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny, pracoviště PET Masarykova onkologického ústavu Brno, primář MUDr. Zdeněk Řehák, Ph. D. 2; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, a Katedra laboratorních metod LF MU, přednosta doc. MUDr. Milan Dastych, CSc., MBA 3; Klinika zobrazovacích metod LF MU a FN u sv. Anny Brno, přednosta as. MUDr. Jiří Vaníček, Ph. D. 4; Katedra patologické fyziologie LF MU Brno, přednostka prof. MUDr. Anna Vašků, CSc. 5
Vyšlo v časopise: Vnitř Lék 2014; 60(10): 861-879
Kategorie: Přehledné referáty
Souhrn
Přítomnost monoklonálního imunoglobulinu v séru či v moči je poměrně častý jev, postihuje 3,2 % osob ve věku > 50 let. Izolované zvýšení pouze jednoho typu volného lehkého řetězce imunoglobulinu κ či λ je detekováno u 0,7–0,8 % osob starších 50 let. Většina osob s průkazem monoklonálního imunoglobulinu splní kritéria takzvané „monoklonální gamapatie nejistého významu (MGUS)“. Ta je definována koncentrací monoklonálního imunoglobulinu v séru < 30 g/l, počtem plazmocytů v kostní dřeni < 10 % a absencí projevů mnohočetného myelomu či jiné lymfoproliferativní nemoci. U části osob s MGUS se postupně vyvine přes asymptomatický nakonec symptomatický myelom, anebo jiné maligní lymfoproliferativní onemocnění, vyžadující léčbu. Proto je MGUS považován za jeden z nejčastějších premaligních stavů s průměrných rizikem transformace v maligní chorobu 1 % za rok. Z monoklonální gamapatie typu IgG a IgA se může vyvinout mnohočetný myelom. Z monoklonální gamapatie lehkých řetězců se může vyvinout nejen mnohočetný myelom z lehkých řetězců, ale také onemocnění typu AL-amyloidózy a ligh chain deposition disease (amorfní depozita lehkých řetězců poškozující orgány). Z monoklonální gamapatie typu IgM se může vyvinout Waldenströmova makroglobulinemie nebo jiná lymfoproliferace, vzácně mnohočetný myelom typu IgM. MGUS však svého nositele neohrožuje jen zvýšeným rizikem transformace v mnohočetný myelom či jinou závažnou hematologickou chorobu. Premaligní klon plazmocytů v kostní dřeni způsobuje změny v kostní dřeni, které mají přímé dopady na postižené osoby. U osob s MGUS je častější výskyt osteoporózy a zvýšené riziko fraktur oproti průměrné populaci. Osoby s MGUS mají také zvýšené riziko bakteriálních infekcí a tromboembolických komplikací ve srovnání se stejně starou populací bez MGUS. Klonální plazmatické buňky, které jsou podkladem MGUS, mohou v některých případech produkovat pro organizmus toxický monoklonální imunoglobulin, který může poškozovat člověka svoji autoprotilátkovou aktivitou, vazbou na určité antigeny (např. nemoc chladových aglutininů), anebo svými depozity v orgánech (např. poškození ledvin) či svými fyzikálními vlastnostmi (např. kryoglobulinemie). Proto je této skupině osob doporučováno sledování, jehož cílem je včas podchytit nejen transformaci do symptomatického mnohočetného myelomu či jiné závažné maligní nemoci, ale také vznik výše zmíněných komplikací. Také pacienty s asymptomatickým myelomem je doporučeno pouze sledovat a léčbu zahájit až po zjištění některého ze symptomů mnohočetného myelomu. V roce 2014 se diskutuje vyčlenění podskupiny nemocných s asymptomatickým myelomem s vysokou (nejméně 80 %) pravděpodobností časné (do 2 let) transformace v mnohočetný myelom, pro něž je přínosné časné zahájení léčby. Dle prvních návrhů by to mohli být ti pacienti s asymptomatickým myelomem, splňují alespoň jednu ze 3 podmínek: v kostní dřeni více než 60 % plazmocytů, poměr volných lehkých řetězců κ a λ je vyšší než 100 či menší než 0,01, nebo mají vícečetná fokální ložiska na celotělovém MR zobrazení skeletu. V přehledu jsou uvedeny současné názory na prognostické členění a diskutovány vhodné intervaly a rozsah kontrolních vyšetření.
Klíčová slova:
gamapatie monoklonální nejistého významu – mnohočetný myelom asymptomatický – mnohočetný myelom symptomatický – PET-CT vyšetření – Waldenströmova makroglobulinemieÚvod
Definice termínu „monoklonální gamapatie nejistého významu“
Monoklonální imunoglobulin může být přítomen jak u mnohočetného myelomu, tak u zcela zdravých osob [1–4]. Termín monoklonální gamapatie nejistého významu (Monoclonal Gammopathy of undetermined Significance – MUGS) označuje stav, při kterém je u člověka přítomen monoklonální imunoglobulin (MIg) v koncentraci nižší než 30 g/l a v kostní dřeni jen nepatrné zmnožení počtu plazmocytů do 10 %, nejsou přítomny příznaky a nálezy odpovídající maligní krevní nemoci (mnohočetného myelomu či Waldenströmovy makroglobulinemie) a není přítomno poškození organizmu monoklonálním imunoglobulinem a příznaky maligní plazmocelulární či lymfoplazmocytární proliferace, které jsou označovány zkratkou CRAB: C – Calcium (hyperkalcemie) R – Renal failure, A – Anemia B – Bone lesions, viz blíže tab. 2.1.
Termín „benigní monoklonální gamapatie“ poprvé použil v roce 1961 Jan Waldenström pro výše uvedené případy. Změnu názvu z „benigní monoklonální gamapatie“ na „monoklonální gamapatii nejistého významu“ navrhl Kyle ve své publikaci v roce 1978. Popsal v ní sledování skupiny 241 osob s dříve nazývanou benigní monoklonální gamapatií, která se v průběhu sledování transformovala v mnohých případech v mnohočetný myelom, Waldenströmovu makroglobulinemii či AL-amyloidózu. Frekvence transformací MGUS v maligní chorobu byla v tomto souboru 1,5 % za rok. Vzhledem k této nejisté budoucnosti lidí s benigní monoklonální gamapatií navrhl Kyle používat termín „monoklonální gamapatie nejistého významu“ a tento termín byl přijat hematologickou komunitou [5,6] a je trvale používán.
Dnes v rámci rozšiřování preventivních vyšetření, která se stávají pro mnohé pracovníky povinné a podmínkou setrvání v zaměstnání, dochází stále častěji ke stanovení této diagnózy u jinak zdravých osob a tyto osoby jsou k dalšímu došetření odesílány na hematologická pracoviště. A proto považujeme za vhodné připomenout, co znamená přítomnost monoklonálního imunoglobulinu pro člověka bez příznaků jakékoliv nemoci. Pokud se monoklonální imunoglobulin již jednou prokáže, jedná se většinou o trvalou odchylku od normy. Vymizení monoklonálního imunoglobulinu v průběhu sledování je vzácné, je popsáno u 2–5 % sledovaných, obvykle s nízkou iniciální koncentrací monoklonálního imunoglobulinu [5,6].
Myelom vzniká transformací z MGUS
Dnes víme, že mnohočetný myelom nevzniká v člověku ze dne na den nebo z týdne na týden, ale že jej pravidelně předchází monoklonální gamapatie nejistého významu (MGUS). K transformaci MGUS do mnohočetného myelomu dojde jen u malé části osob s MGUS. Před rokem 2009 panoval názor, že mnohočetný myelom může vzniknout jak vývojem z MGUS, tak i zcela náhle z plného zdraví. Postupný vývoj od MGUS přes asymptomatický myelom do symptomatického myelomu dokládají 2 velké populační studie.
V rámci skríningové studie solidních nádorů byly zamrazovány vzorky krve celkem od 77 469 v té době zdravých osob. V této obrovské skupině lidí se po více letech sledování objevil mnohočetný myelom u 71 osob. K dispozici byly vzorky séra odebrané v období 2 až 10 let před manifestací mnohočetného myelomu.
Ve vzorcích odebraných 2 roky před manifestací myelomu byl monoklonální imunoglobulin přítomen ve 100 %, ve vzorcích odebraných 5 let před manifestací myelomu byl monoklonální imunoglobulin přítomen u 95 % vyšetřených, ve vzorcích odebraných 8 či více let před manifestací myelomu byl monoklonální imunoglobulin přítomný v 82,4 % případů. Tato populační studie tedy potvrdila, že všechny případy mnohočetného myelomu či Waldenströmovy nemoci předcházela přítomnost monoklonálního imunoglobulinu u asymptomatických osob, neboli MGUS [7].
Weiss v roce 2009 analyzoval séra odebraná v období 2 až 15 let před rozvojem mnohočetného myelomu. Přítomnost monoklonálního imunoglobulinu zjistil u 27 z 30 testovaných osob (90 %) [8]. Tyto 2 recentní studie prokazují, že vzniku mnohočetného myelomu předchází rozvoj MGUS. Zatím nebylo na větších souborech prokázáno, zda je také Waldenströmova makroglobulinemie vždy předcházena monoklonální gamapatií typu IgM, ale ze zkušeností víme, že tomu tak často je.
A to je důvodem, proč se těmto nemocným nabízí dlouhodobé sledování a proč se hodně pozornosti věnuje časné předpovědi transformace MGUS do symptomatického mnohočetného myelomu.
Epidemiologické údaje
Prevalence MGUS
Informace o četnosti MGUS můžeme čerpat z několika populačních studií, které proběhly v Evropě a v Severní Americe. Výsledky jsou samozřejmě vždy ovlivněny citlivostí biochemických metod, které byly použity a věkovým složením zkoumané populace. Pro přehlednost jejich výsledky uvádíme v tab. 1.
Tab. 1. Údaje o výskytu (prevalenci) monoklonálního imunoglobulinu v definované populaci 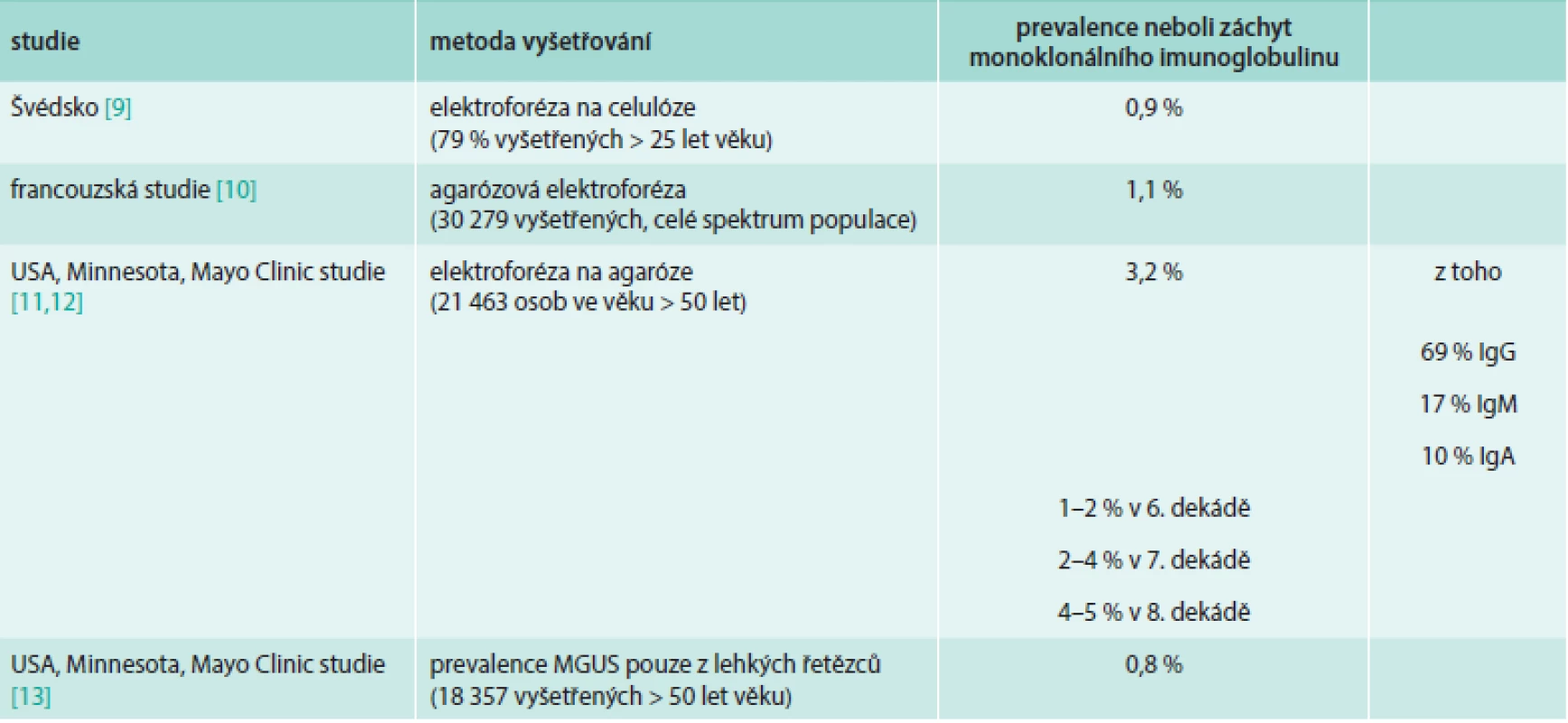
Pokud bychom očekávali stejnou, tedy 1% incidenci v ČR, tak by to byla populace čítající asi 100 000 obyvatel. Při znalosti počtu obyvatel ČR starších 50 let by byl odhad přesnější.
Pokud jsou jedinci s novým záchytem monoklonálního imunoglobulinu vyšetřeni, tak převážná většina z nich splňuje kritéria MGUS, u menší části je pak diagnostikován mnohočetný myelom, primární systémová AL-amyloidóza nebo Waldenströmova makroglobulinemie. Pouze u zlomku, obvykle do 5 % osob s přítomností monoklonálního imunoglobulinu, jsou diagnostikována jiná lymfoproliferativní onemocnění vycházející z řady B [2,11,12,14–20].
MGUS typu IgM a non-IgM
MGUS je zatím kategorizován jako jedna diagnóza. Z pohledu praxe a možného další vývoje je vhodné odlišovat 2 typy MGUS, lymfoplazmocytární (IgM-MGUS) a plazmocytární MGUS (non-IgM MGUS).
Přibližně 15–20 % ze všech monoklonálních gamapatií tvoří MGUS typu IgM, a ten má v kostní dřeni odpovídající lymfocytární či lymfoplazmocytární populaci buněk, u části z těchto osob dojde časem k transformaci do Waldenströmovy makroglobulinemie či jiné lymfoproliferace. Mnohočetný myelom typu IgM je velmi vzácný. U osob s monoklonálním imunoglobulinem typu IgM je při sledování třeba zaměřit se na jiné klinické projevy, než jsou osteolytická ložiska, protože vznik osteolytických ložisek u symptomatické Waldenströmovy makroglobulinemie či jiné lymfoproliferace je sice možný, ale spíše výjimečný.
Větší skupinu tvoří non-IgM monoklonální gamapatie s přítomností monoklonálního imunoglobulinu typu IgG, IgA nebo jenom lehkých řetězců a zcela výjimečně typu IgD nebo IgE. Non-IgM typy monoklonálních imunoglobulinů jsou tvořeny plazmocyty a mají potenciál transformovat se do mnohočetného myelomu.
Monoklonální gamapatie tvořená pouze lehkými řetězci
Klasická definice MGUS vycházela z metody elektroforetického průkazu monoklonálního imunoglobulinu, tedy kompletní molekuly monoklonálního imunoglobulinu [5,6]. Zavedením metody stanovení volných lehkých řetězců κ a λ vznikla nová jednotka, takzvaná MGUS z lehkých řetězců imunoglobulinů neboli light chain MGUS (LC-MGUS).
Je definována následovně:
- abnormální poměr volných lehkých řetězců κ a λ v séru
- zvýšení koncentrace převažujícího lehkého řetězce nad normu
- nepřítomnost monoklonálního těžkého řetězce
Prevalence LC-MGUS u osob starších 50 let je 0,8 %. Riziko transformace do maligní nemoci bylo 0,4–0,6 %/rok. Z hlediska transformace v myelom je prognóza osob s LC-MGUS příznivá, z hlediska funkce ledvin je jejich prognóza naopak nepříznivá. Poškození ledvin v nějaké formě bylo přítomno nebo se objevilo při sledování u 23 % z nich.
Osoby s LC-MGUS tvoří 19 % součtu MGUS + LC-MUGS, podobné procentové zastoupení mají i pacienti s light chain myelomem [13].
Při dostatečně intenzivní tvorbě klonálních lehkých řetězců κ nebo λ naplní alespoň část vyšetřovaných osob kategorie LC-MGUS kritéria kategorie „idiopatická Bence-Jonesova proteinurie“. Ta je definována elektroforetickým a denzitometrickým průkazem přítomnosti alespoň 0,5 g volných lehkých řetězců κ nebo λ, neboli Bence-Jonesovy bílkoviny ve vzorku moči za 24 hod [21,22].
Poměr osob se zvýšeným kreatininem mezi lidmi s Bence-Jonesovou proteinurií a klasickým MGUS byl 43 % vs 18 %. Také anémie byla častější u pacientů s Bence-Jonesovou proteinurií (42 %) oproti 16 % u pacientů s klasickým MGUS [21]. Pro monoklonální gamapatii typu lehkých řetězců není stanoven prognostický index. Pokud však poměr volných lehkých řetězců κ/λ je vyšší než 100 či menší než 0,01, tak se to považuje za vysoké riziko časné maligní transformace. Dalšími nepříznivými faktory pro light chain MGUS je snížená koncentrace imunoglobulinů a masivní nález volných lehkých řetězců v moči za 24 hod.
Osoby se zvýšeným rizikem výskytu MGUS
Zvýšený výskyt MGUS, 2–3krát oproti průměrné populaci, byl zjištěn u těch osob, které měly v první příbuzenecké linii někoho s mnohočetným myelomem či MGUS [23–25]. Dále vyšší riziko bylo u osob pracujících s pesticidy [26].
Zvýšené riziko bylo zjištěné také u lidí, kteří mají či měli některou z autoimunitních chorob, např. perniciózní anémii, ale také revmatoidní artritidu či Sjögrenův syndrom [27].
Diagnostika a diferenciální diagnostika stavů s přítomným monoklonálním imunoglobulinem
Monoklonální gamapatie nejistého významu typu IgG, IgA a monoklonální gamapatie tvořená pouze lehkými řetězci
Monoklonální gamapatii nejistého významu typu IgG a vzácněji IgA a monoklonální gamapatii tvořenou pouze lehkými volnými řetězci imunoglobulinů je nutno odlišit od mnohočetného myelomu dle přijatých kritérií. Kritéria všech monoklonálních gamapatií z roku 2010 shrnují tab. 2.1, 2.2 a 2.3 [28–32].

CRAB – Calcium (hyperkalcemie) Renal failure Anemia Bone lesions – MIg – monoklonální imunoglobulin 
FLC – volné lehké řetězce (free light chain – v biochemických výsledcích z laboratoří se užívá právě tato anglická zkratka) 
Pozn.: WHO kritéria krevních chorob z roku 2008 vyžadují pro splnění diagnózy pouze průkaz infiltrace kostní dřeně lymfoplazmocytárním lymfomem bez specifikace procentuálního zastoupení lymfoplazmocytárních buněk. Na rozdíl od mnohočetného myelomu u Waldenströmovy makroglobulinemie i jiná publikovaná mezinárodní kritéria neuvádějí 10% hranici pro infiltrace kostní dřeně lymfoplazmocyrárním lymfomem, vyžadují jen průkaz infiltrace kostní dřeně lymfoplazmocytárními buňkami. Zásadní parametr kritérií IMWG je počet plazmatických buněk, aniž by bylo uvedeno, zda je to výsledek z aspirátu či histologického hodnocení válečku kostní dřeně získaného trepanobiopsií. Ze zkušenosti víme, že v aspirátu kostní dřeně je díky naředění aspirované kostní dřeně periferní krví a díky nerovnoměrnému rozložení plazmocytů v kostní dřeni vždy menší počet plazmocytů, než nalezne patolog v histologickém hodnocení válečku kostní dřeně. Odborníci na cytologickou diagnostiku uvádějí, že počet plazmocytů při cytologickém hodnocení hodně závisí na provedení odběru a nátěru aspirátu kostní dřeně na sklíčko [33]. A tak může být při hodnocení aspirátu kostní dřeně pod 10 % plazmocytů, zatímco patolog již při hodnocení kostní dřeně stanoví jejich počet podstatně výše než 10 %. Tím chceme jen zdůraznit nutnost komplexního pohledu a neulpívání na dílčích vyšetřeních.
MGUS typu IgM
V případě monoklonální gamapatie typu IgM je odlišení MGUS typu IgM od asymptomatické formy Waldenströmovy makroglobulinemie na většině pracovišť možné pouze s pomocí trepanobiopsie. Pokud histologické vyšetření potvrdí infiltraci kostní dřeně malými lymfocyty, lymfoplazmocyty a plazmocyty, ať již ve formě difuzní, nebo intersticiální, či nodulární, s imunofenotypem, který odpovídá lymfoplazmocytárnímu lymfomu (Surface Ig+ CD5- CD10- CD19+ CD20+ CD23-), tak je nutno stav hodnotit jako asymptomatickou, případně symptomatickou Waldenströmovu makroglobulinemii [34–37].
V případě IgM gamapatie nestačí pro odlišení MGUS typu IgM a asymptomatické či symptomatické formy Waldenströmovy makroglobulinemie aspirace kostní dřeně s pouhým cytologickým hodnocením kostní dřeně. Dle našich zkušeností ani flowcytometrie nevede vždy ke stanovení diagnózy. Ta v našich podmínkách zatím spočívá stále na histologickém a imunohistochemickém vyšetření válečku kostní dřeně získaného trepanobiopsií.
U Waldenströmovy makroglobulinemie nekoreluje na rozdíl od mnohočetného myelomu míra infiltrace kostní dřeně s koncentrací monoklonálního imunoglobulinu typu IgM, To je zřejmě způsobeno tím, že pro tuto nemoc je patognomická infiltrace klonálními lymfocyty, lymfoplazmocyty a plazmocyty ve variabilním poměru, přičemž produkce monoklonálního imunoglobulinu probíhá dominantně v klonálních plazmocytech.
Nicméně odlišení asymptomatické formy Waldenströmovy makroglobulinemie oproti MGUS typu IgM nemá žádnou další konsekvenci, takže je přijatelné odložit histologické vyšetření kostní dřeně na pozdější dobu, kdy budeme již z nějakých klinických důvodů uvažovat o symptomatické nemoci, neboli nemoci vyžadující léčbu a budeme potřebovat přesnou diagnózu.
Riziko progrese pro MGUS typu IgM lze odvodit z výsledků sledování 213 osob na Mayo Clinic. V průběhu sledování se MGUS u 29 (14 %) osob transformoval do lymfomu (Waldenströmovy makroglobulinemie). Kumulativní pravděpodobnost progrese byla 10 % po 5 letech, 18 % po 10 letech a 24 % po 15 letech, takže přibližně riziko transformace bylo 1,5 % za rok. Nezávislými prognostickými faktory pro progresi byla míra zvýšení koncentrace monoklonálního imunoglobulinu typu IgM a míra snížení albuminu při stanovení diagnózy.
Pokud bylo však splněno kritérium asymptomatické (doutnající) Waldenströmovy makroglobulinemie, tak bylo riziko transformace vyšší, 6 % v průběhu 1. roku, 39 % v průběhu prvních 3 let, 59 % v průběhu 6 let a 65 % v průběhu 10 let. Prognostickými faktory byly míra infiltrace kostní dřeně, koncentrace monoklonálního imunoglobulinu typu IgM a koncentrace hemoglobinu [38].
Jiné lymfoproliferace provázené přítomností monoklonálního imunoglobulinu
Přítomnost monoklonální gamapatie je často popisována u lymfoproliferativních chorob vycházejících z B linie [39]. Nejčastěji je monoklonální imunoglobulin přítomný u těchto lymfoproliferací: chronická B-lymfocytární leukemie, lymfom marginální zóny, folikulární lymfom, lymfom z plášťových buněk (mantle cell lymphoma), difuzní velkobuněčný B lymfom, ale také angioimunoblastický T buněčný lymfom. V těchto případech však bývá monoklonální imunoglobulin nejčastěji typu IgM [39].
Chceme upozornit na relativně častější souběh mnohočetného myelomu a chronické B-lymfocytární leukemie (B-CLL). Občas se vyskytnou nemocní, sledovaní pro asymptomatickou formu B-CLL léčení pro bolesti zad analgetiky, u nichž se opožděně prokáže souběžná přítomnost mnohočetného myelomu s mnohočetnými osteolytickými ložisky. U pacientů s chronickou B-lymfocytární leukémií mohou být přítomné klonální volné lehké řetězce κ nebo λ a mohou být příčinou anurie po nevhodném nitrožilním podání kontrastní látky. Přítomnost volných lehkých řetězců je u chronické lymfatické leukemie považována za nepříznivé prognostické znamení [40].
Obecně však platí, že u nízce agresivních lymfoproliferací bývá výskyt monoklonálního imunoglobulinu častější než je tomu i velmi agresivních lymfoproliferací. Občas může být přítomna nízká koncentrace monoklonálního imunoglobulinu u nemocných hyperkalcemií a s vysoce agresivním lymfomem.
Choroby asociované s monoklonálním imunoglobulinem
Monoklonální imunoglobulin ve většině případů nepoškozuje svého nositele vazbou na určité orgány či tkáně. K tomu dochází pouze u minority osob s přítomností monoklonálního imunoglobulinu. Nejznámějším důsledkem poškození tkání monoklonálním imunoglobulinem, přesněji řečeno, volnými lehkými řetězci imunoglobulinů, je AL-amyloidóza, při níž dochází k tvorbě lineárních depozit lehkých řetězců ve formě amyloidu.
Podobnou, ale ještě vzácnější chorobou, jsou neamyloidová depozita lehkých řetězců (light chain deposition disease), u těchto chorob dochází k ukládání lehkých řetězců v orgánech (ledviny, srdce) ve formě amorfních depozit.
K poškození tkání dochází také v případech, v nichž má imunoglobulin charakter kryoglobulinu. Tyto výše uvedené nemoci bychom mohli klasifikovat jako poškození organizmu monoklonálním imunoglobulinem díky jeho fyzikálních vlastnostem.
K poškození však může dojít také vazbou monoklonálního imunoglobulinu na určité antigeny. Dobře prokazatelné je poškození typu anémie s chladovými aglutininy (cold aglutinin disease), což způsobují obvykle imunoglobuliny typu IgM. Velmi nepříjemnou komplikací je poškození nervů vazbou monoklonálního imunoglobulinu na antigeny nervových vláken, tzv. neuropatie, způsobená monoklonálním imunoglobulinem [41], nebo monoklonálním imunoglobulinem způsobený pemphigus, tzv. IgA pemphigus. Všechny tyto stavy odvisí od biologických a fyzikálních vlastností monoklonálního imunoglobulinu a nezávisí na formě plazmocelulární proliferace, která jej produkuje. V případě, že biologická aktivita plazmocelulární proliferace je benigní, jako při MGUS, a přitom monoklonální imunoglobulin poškozuje organizmus, nazýváme tyto stavy speciálními termíny a řadíme je do skupiny zvané „monoclonal imunoglobulin releated disorders“ čili nemoci způsobené monoklonálním imunoglobulinem. Nejčastější zástupce uvádí tab. 3, v literární databázi Medline lze však nalézt i další vzácně se vyskytující.
Tab. 2. Přehled nemocí, které mohou způsobit molekuly monoklonálního imunoglobulinu 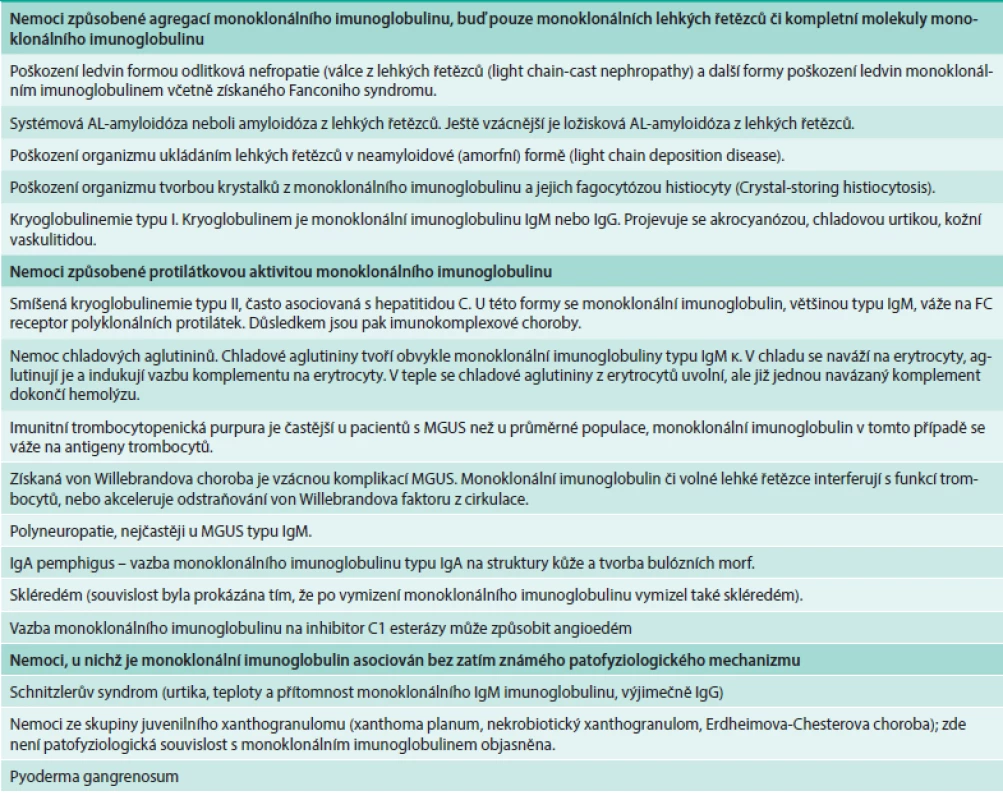
Častější přítomnost monoklonálního imunoglobulinu u některých chorob
Zvýšená prevalence monoklonálního imunoglobulinu bez jasné evidence patologické role monoklonálního imunoglobulinu byla popsána u chorob pojiva (revmatoidní artritida, Sjögrenův syndrom) [42], systémový lupus erythematodes, skleroderma, polymyositis a u Bechtěrevovy nemoci [43]. Dále se popisuje zvýšená prevalence monoklonální gamapatie u pacientů s hepatitidou C a smíšenou kryoglobulinemií [44].
Monoklonální imunoglobulin je častěji detekován u osob s HIV, než je tomu u osob bez přítomnosti HIV infekce [45]. Stejně tak u pacientů po transplantaci orgánů je vyšší výskyt monoklonálního imunoglobulinu [46].
Také u hematologických autoimunitních chorob je častější přítomnost monoklonálního imunoglobulinu (získaná von Willebrandova choroba, lupus anticoagulans, perniciózní anémie, pure red cell aplasia) [47].
Riziko transformace MGUS v mnohočetný myelom
Osoby s MGUS typu IgG a IgA mají zvýšené riziko vzniku mnohočetného myelomu oproti průměrné populaci. V případě MGUS typu IgM zase zvýšené riziko vzniku Waldenströmovy makroglobulinemie a výjimečně jiných typů lymfoproliferativních chorob. Může vzniknout i myelom typu IgM, ale ten je velmi vzácný, podstatně vzácnější než Waldenströmova makroglobulinemie.
Kumulativní riziko progrese do myelomu či jiné maligní lymfoproliferace se samozřejmě bude v každém sledovaném souboru lišit. Kyle v roce 2002 popsal 10 % transformací v průběhu 10 let, 21 % transformací v průběhu 20 let a 26 % transformací v průběhu 25 let [12].
Celkové riziko progrese vychází na 1 % ročně [47,48].
Poslední zhodnocení rizika ze souboru Mayo Clinic uvádí na 17 % transformací v průběhu 10 let, 34 % transformací v průběhu 20 let a 39 % transformací v průběhu 25 let [49]. Jedinci s MGUS typu IgA a IgM mají vyšší riziko progrese než jedinci s monoklonálním imunoglobulinem typu IgG [12,50]. I další studie jen potvrdily, že IgA MGUS je spojen s vyšším rizikem transformace než ostatní typy [51–53].
Studie také potvrdily asociaci mezi koncentrací monoklonálního imunoglobulinu a rizikem transformace. Relativní riziko transformace po 10 letech bylo 6 % při koncentraci MIg do 5 g/l, 7 % při koncentrace MIg do 10 g/l, 11 % při koncentrace MIg do 15 g/l, 20 % při koncentraci MIg do 20 g/l, 24 % při koncentraci MIg do 25 g/l a 34 % při koncentrace MIg do 30 g/l [12].
Dále bylo prokázáno, že míra infiltrace kostní dřeně plazmocyty také souvisí s mírou rizika [50]. Stejně tak zvýšená angiogeneze v kostí dřeni zvyšuje míru rizika [54,57]. Zvýšený počet cirkulujících plazmocytů také znamenal zvýšení rizika transformace [55,56].
Z dalších výsledků, které mají nepopiratelnou prognostickou informaci, je celotělové MR skeletu. Jedinci s četnými fokálními ložisky ve skeletu při celotělovém MR zobrazení mají kratší interval do transformace než jedinci bez tohoto nálezu [58].
Mayo Clinic prognostický index pro MGUS
Zvýšená koncentrace monoklonálních lehkých řetězců κ či λ bývá přítomna u 31 % osob s přítomnou kompletní molekulou monoklonálního imunoglobulinu, ve 21 % typu κ a 10 % typu λ. Pouze abnormální poměr κ a λ řetězců byl potvrzen u 33 % osob s MGUS [12]. Riziko transformace bylo signifikantně vyšší u osob majících v séru kompletní molekulu monoklonálního imunoglobulinu a k tomu navíc abnormální poměr FLC κ/λ, než u osob s normálním poměrem κ/λ [59].
Na základě těchto faktů byl navržen jednoduchý stratifikační model pro míru rizika, který zohledňuje 3 rizikové faktory uvedené v tab. 4.
Tab. 3. Mayo Clinic model stratifikace osob s MGUS s kompletní molekulou monoklonálního imunoglobulinu v séru [59]. ![Mayo Clinic model stratifikace osob s MGUS s kompletní molekulou monoklonálního imunoglobulinu v séru [59].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0420b328cbbe9ef37bf835f57024a8f2.png)
Asi jen 30–40 % jedinců s MGUS má snížené koncentrace polyklonálních imunoglobulinů [12,51,60], zatímco u myelomu je snížená koncentrace polyklonálních imunoglobulinů u více než u 90 % pacientů s myelomem [61].
Zajímavé je, že imunoparéza (snížení koncentrace funkčních – polyklonálních – gamaglobulinů v séru) neměla v některých studiích prediktivní hodnotu. Nové poznatky toto však mírně mění. Bylo flowcytometricky prokázáno, že suprese neklonálních plazmocytů v kostní dření je nepříznivý prognostický faktor, a že toto snížení počtu neklonálních plazmocytů způsobuje sníženou koncentrací polyklonálních imunoglobulinů.
Když byla použita nová metodika k vyhodnocování suprese funkčních (polyklonálních) imunoglobulinů (metoda stanovení párů těžkých a lehkých řetězců), tak prokázal Pika v roce 2012 a později další, že suprese alternativního páru imunoglobulinu koreluje s mírou rizikovosti MGUS výrazněji, než suprese hladin polyklonálních imunoglobulinů, a tedy že suprese nepostiženého imunoglobulinu je další nezávislý rizikový faktor [62–64].
A zatím nebyly definovány cytogenetické změny, které by měly prognostický význam vzhledem k riziku transformace.
MGUS se stabilní nebo kontinuálně vzrůstající koncentrací monoklonálního imunoglobulinu
Španělská myelomová skupina sledovala 359 osob s MGUS. Když se v průběhu 3letého sledování neustále zvyšovala koncentrace monoklonálního imunoglobulinu, tento typ MGUS nazvali „evolving MGUS“ čili vyvíjející se MGUS. Když byla stabilní koncentrace monoklonálního imunoglobulinu, tak tuto situaci označili jako „non-evolving MGUS“, čili nevyvíjející se MGUS. Pouze 29 z uvedeného souboru splnilo kritéria evolving MGUS. Po 10letém sledování zjistili transformaci do myelomu u 55 % osob s evolving typem MGUS a jen u 10 % non-evolving typem MGUS. Po 20 letech došlo k transformaci 80 % evolving typů MGUS a jen u 13 % non-evolving typů MGUS [65]. Protože díky dlouhodobě narůstající koncentraci monoklonálního imunoglobulinu je zde evidentní přechod MGUS přes asymptomatický myelom do symptomatického myelomu, tak někteří autoři navrhli pro tento typ MGUS název časný mnohočetný myelom (early myeloma) [65].
Multiparametrická průtoková cytometrie
Další prognostická kritéria pro progresi byla založena na multiparametrické průtokové cytometrii kostní dřeně a stanovení poměru klonálních ku neklonálním plazmocytům v kostní dřeni [66,67]. Zavedení těchto kritérií však vyžaduje erudované flowcytometrické pracoviště, a proto se jim nedostalo tak širokého uplatnění, jako jednodušším kritériím z Mayo Clinic.
Další rizika provázející jedince s MGUS
Zvýšené riziko vzniku osteoporózy a patologických kostních fraktur
Osoby s MGUS mají sníženou kostní denzitu ve srovnání se stejně starou populací. To vysvětluje zvýšené riziko fraktur u jedinců s MGUS. Melton uvádí 2,7krát zvýšené riziko fraktury ve srovnání s průměrnou populací a podobně i další citované práce [68–72]. Vysvětluje se to zvýšenou aktivitou osteoklastů a abnormálně vysokou intenzitou resorpce kostí [73,74]. Populační studie potvrdily, že u osob s MGUS je vyšší výskyt fraktur obratlů, fraktur krčku femuru a vyšší výskyt osteoporózy [75–77]. Proto je u osob s MGUS zvýšená prevalence osteoporózy 3,6 %, zatímco u osob bez MGUS je pouze 2,0 % [78]. U pacientů s již vzniklou osteoporotickou frakturou dosahuje prevalence monoklonální gamapatie dokonce 15 % [79]!
Tato fakta jsou důvodem pro vyšetření kostní denzity a pro včasné zahájení odpovídající anitresorpční či antiosteoporotické léčby u jedinců s prokázanou osteoporózou.
Zvýšené riziko tromboembolizmu
Další studie popisují zvýšené riziko venózního tromboembolizmu u osob s MGUS [80,81]. Kristenson v roce 2008 uvedl, že riziko tromboembolizmu bylo u pacientů s MGUS vyšší 3,3krát ve srovnání s průměrnou populací [82]. A podobně zvýšené riziko potvrdili i další [83]. Ale v medicíně často nevychází fakta jednoznačně, a tak je k dispozici i práce nepotvrzující zvýšené riziko tromboembolizmu [75].
Zvýšené riziko infekcí
Dle velké populační studie obsahující 5 326 lidí s MGUS a 20 161 kontrolních osob bylo zjištěno, že riziko bakteriální infekce je u osob s MGUS 2krát zvýšené. Příčinou je snížení tvorby funkčních imunoglobulinů a byl i prokázán snížený počet CD4+ a CD8+ T buněk ve srovnání s osobami bez MGUS [84].
Riziko vzniku dalších maligních chorob
Jedinci s MGUS mají zvýšená také další rizika, např. vznik myelodysplastického syndromu. Riziko vzniku MDS mají osoby s MGUS 2,4krát vyšší než průměrná populace [85].
MGUS a transplantace solidních orgánů
Považovat či nepovažovat monoklonální gamapatii nejistého významu za rizikový faktor při rozhodování o provedení transplantace některého z orgánů? Na toto téma je málo analýz. Největší z nich hodnotila 1 593 pacientů po transplantaci některého orgánu s následující imunosupresivní léčbou. Autoři svoji analýzu uzavírají konstatováním, že přítomnost monoklonální gamapatie nepředstavuje kontraindikaci orgánové transplantace a proto ani není nutné po přítomnosti monoklonálního imunoglobulinu před transplantací cíleně pátrat. Pokud je monoklonální imunoglobulin při MGUS nalezen, nepředstavuje kontraindikaci [86]. I ostatní autoři se shodují na tom, že MGUS nepředstavuje riziko pro provedení orgánové transplantace [87–89].
Nicméně je třeba intenzivním vyšetřením potvrdit, že se jedná o MGUS, a nikoliv o mnohočetný myelom.
Zvýšený výskyt neuropatií u osob s MGUS
U 10 % pacientů s prokázanou neuropatií se podaří prokázat přítomnost monoklonálního imunoglobulinu, což je podstatně vyšší frekvence, než v běžné populaci. A vyšší výskyt neuropatií mezi osobami s MGUS byl prokázán i v populační studii [75].
Polyneuropatie je nejčastěji (v 60 %) asociována s monoklonálním imunoglobulinem typu IgM, ve 30 % s monoklonálním imunoglobulinem typu IgG a jen v 10 % s monoklonálním imunoglobulinem typu IgA.
U pacientů s neuropatií a monoklonálním imunoglobulinem typu IgM byl prokázány protilátky proti glykoproteinům myelinu. Tuto protilátkovou aktivitu se však nedaří prokazovat u neuropatií při monoklonálním imunoglobulinu typu IgG anebo IgA. Léčba neuropatie při monoklonální gamapatii je zatím málo uspokojivá, i když se postupuje dle publikovaných doporučení [90].
Vliv MGUS na celkové přežití
Ve studii z Mayo Clinic (USA) měli osoby s prokázaným MGUS průměrné přežití 8,1 roku, zatímco odpovídající populace bez MGUS měla přežití 11,8 roku. Nedlouhé přežití obou skupin souvisí s vyšším věkem osob při stanovení diagnózy MGUS, neboť jak známo, čím vyšší věková kategorie, tím vyšší incidence MGUS. Příčinou zvýšené mortality není jenom transformace v mnohočetný myelom a další maligní lymfoproliferativní nemoci, ale také zvýšený počet úmrtí na myeloidní malignity, solidní tumory, bakteriální infekce, nemoci srdce, jater a také nádory a záněty ledvin [12].
Vyšetření u jedinců se zjištěným MGUS
Rozsah vstupního vyšetření v závislosti na rizikových faktorech
MUGS může být zjištěn buď v rámci preventivního vyšetření u zcela zdravých osob, nebo při cíleném vyšetření u zdravé osoby se zvýšenou sedimentací erytrocytů či z dalších klinických důvodů. Pokud se prokáže přítomnost monoklonálního imunoglobulinu, je vhodné doplnit celé spektrum laboratorních vyšetření proveditelných z periferní krve a vlastně stanovit tak míru rizikovosti MGUS Vhodný rozsah vstupních laboratorních vyšetření je uveden v tab. 5.
Tab. 4. Základní vyšetření pro všechny nemocné s MGUS a doplňující vyšetření pro nemocné se zvýšeným rizikem transformace. 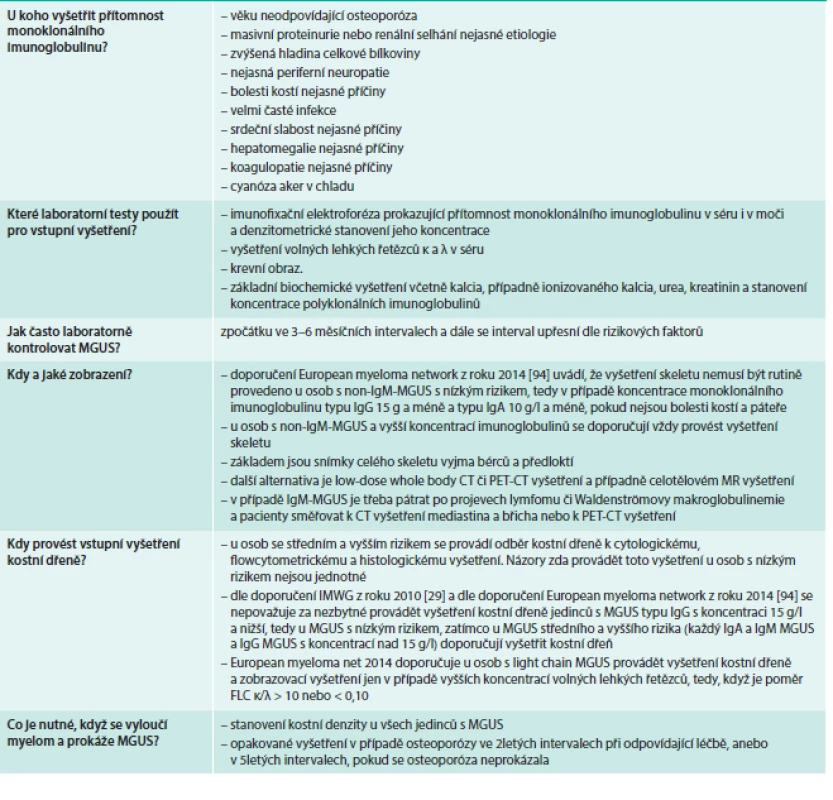
Rozhodnutí, zda provádět vyšetření kostní dřeně, se pak odvíjí od míry rizikovosti nemocného, u osob s nejnižším rizikem není nezbytné, u jedinců se středním a vyšším rizikem je vyšetření kostní dřeně obligátní.
Riziko průkazu více než 10 % plazmocytů v kostní dřeni a riziko nálezu osteolýzy při nízkých koncentracích monoklonálního imunoglobulinu (do 5 g/l, do 10 g/l a do 15 g/l) zobrazuje tab. 6.
Tab. 5. Riziko histologického průkazu více než 10 % infiltrace kostní dřeně a riziko osteolýzy prokazatelné RTG snímky u asymptomatických osob s nízkou koncentrací monoklonálního imunoglobulinu typu IgG a IgA. Data jsou odvozena z retrospektivní studie 2 282 osob, sledovaných v letech 1974–2010. Proto zde nejsou zahrnuty volné lehké řetězce [111]. ![Riziko histologického průkazu více než 10 % infiltrace kostní dřeně a riziko osteolýzy prokazatelné RTG snímky u asymptomatických osob s nízkou koncentrací monoklonálního imunoglobulinu typu IgG a IgA. Data jsou odvozena z retrospektivní studie 2 282 osob, sledovaných v letech 1974–2010. Proto zde nejsou zahrnuty volné lehké řetězce [111].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/86218b01d422ae95b4a2112d3338bc45.png)
MIg – monoklonální imunoglobulin Ale i u pacienta s velmi nízkou koncentrací monoklonálního imunoglobulinu je nutné provést vyšetření kostní dřeně, pokud je přítomna nějaká nevysvětlená odchylka od normy, např. anémie, nebo zhoršená funkce ledvin, nebo hyperkalcemie, anebo osteolytické ložisko či osteoporóza.
Rozhodnutí o rozsahu zobrazovacích vyšetření se odvíjí od typu monoklonálního imunoglobulinu. V případě monoklonálního imunoglobulinu typu IgG, IgA a volných lehkých řetězců je zobrazení skeletu nezbytné jen v případech středního a vysokého rizika transformace v mnohočetný myelom anebo, když vyšetřovaná osoba má bolesti páteře či dlouhých kostí.
V případě monoklonálního imunoglobulinu typu IgM se zobrazovací metody zaměřují spíše na přítomnost lymfadenopatie a organomegalie než na hledání osteolytických ložisek, protože mnohem pravděpodobnější je transformace do Waldenströmovy makroglobulinemie či jiné lymfoproliferace než do mnohočetného myelomu typu IgM. Výjimečně ale mohou být osteolytická ložiska mohou být také u pacientů s Waldenströmovou makroglobulinemií. U všech lidí s MGUS by se měla vyšetřit kostní denzitometrie [91–93].
Monitorování
Cílem monitorování je včas odhalit transformaci v maligní chorobu, dříve než způsobí těžké poškození organizmu a včas podat léčbu. Velmi důležité je zjištění, že u 10 % osob v průběhu sledování sice zůstává stabilní koncentrace kompletní molekuly monoklonálního imunoglobulinu v séru, ale jako první signál transformace do symptomatického myelomu se začne zvyšovat koncentrace volného lehkého řetězce λ či κ. Celkem u 54 z 520 sledovaných osob došlo k transformaci v symptomatický mnohočetný myelom a tuto transformaci signalizovaly zvyšující se hladiny klonálního volného lehkého řetězce λ nebo κ v séru při stabilní koncentraci kompletní molekuly monoklonálního imunoglobulinu v séru. Tento fenomén nazvali FLC-escape [92]. Je to alternativa již dávno popsanému fenoménu „Bence Jones escape“, což bylo pojmenování pro progresi nemoci při sice stabilní koncentraci kompletní molekuly monoklonálního imunoglobulinu v séru, ale zvyšující se odpadů Bence-Jonesovy bílkoviny neboli volných lehkých řetězců, kdy se objevila nová lytická kostní ložiska, anémie, nebo renální insuficience při vzestupu produkce volných lehkých řetězců [93].
Proto je důležité sledovat nejen laboratorní testy, ale také si všímat potíží nemocného a klinicky jej vždy vyšetřit. Frekvence kontrol v 1. roce bývá po 3–4 měsících. Teprve po roce sledování a vyhodnocení vývoje monoklonálního imunoglobulinu lze doporučit pro osoby s nejnižším rizikem (viz tab. 5) prodloužení intervalu kontrolu kontrol až na 1–2 roky v případě absence jakýchkoliv zdravotních potíží [29,94]. Sledované jedince je však nutné poučit, aby v případě jakéhokoliv nového zdravotního problému ihned přišli k vyšetření, jehož cílem je najít odpověď na otázku, zda nový zdravotní problém má či nemá souvislost s monoklonální gamapatií.
Pokud je přímen monoklonální IgG ve vyšší koncentraci než 15 g/l, nebo jde o monoklonální imunoglobulin typu IgA či IgM, nebo pokud je abnormální poměr FLC, tak se doporučuje ponechat intervaly kontrol po 1. roce v 6měsíčních intervalech. Při delších intervalech je riziko pozdního rozpoznání transformace v symptomatický mnohočetný myelomu. Názory na intervaly kontroly jistě kolísají, jako vhodnou orientaci považujeme doporučení pro sledování zveřejněné International Myeloma Working Group (IMWG) z roku 2010 a European myeloma network z roku 2014, uvedené v tab. 7 [29,94]. Vzhledem k četnější osteoporóze u všech lidí s MGUS se doporučuje při stanovení diagnózy i vyšetření kostní denzity a její opakování v závislosti na výsledku prvního vyšetření [91].
Tab. 6. International Myeloma Working Group doporučení pro sledování osob s MGUS a symptomatickým myelomem [29,94]. ![International Myeloma Working Group doporučení pro sledování osob s MGUS a symptomatickým myelomem [29,94].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fd1977c92b0a0f2e8959f030fe17f54f.png)
Kontrolní zobrazovací vyšetření
Kontrolní zobrazovací vyšetření se doporučuje provádět pouze v případech, když si sledovaný jedinec stěžuje na nové bolesti či uvádí jiné příznaky, jejichž původ by mohl být v postižení skeletu anebo v případech, v nichž je velmi nápadný vzestup koncentrace monoklonálního imunoglobulinu, který by mohl odpovídat transformaci. Při vzniku nových kostních bolestí, které by mohly odpovídat vzniku osteolytických ložisek, by se při negativním nálezu na snímcích skeletu měla provést i další senzitivnější vyšetření [95].
RTG snímky
Klasickým vyšetřením je předozadní a boční snímek lebky, snímek krční, hrudní a bederní páteře, snímky femorů a humerů, snímek hrudníku zaměřený na žebra a lopatky a snímek pánve. Fakt je, že osteolytické ložisko se stane zřetelným až po vymizení nejméně 30 % kostní substance v objemu ložiska [95].
Zobrazení magnetickou rezonancí
Zobrazení magnetickou rezonancí (MRI) je metoda, která zobrazuje změny v kostní dřeni. Ložiska myelomových buněk v kostní dřeni lze excelentně zobrazit pomocí magnetické rezonance, nicméně podobný MR obraz mohou vyvolat i jiné změny v kostní dřeni, takže změny signálu v oblasti kostní dřeně nemají vždy jednoduchou interpretaci [95]. Změny signálu při MRI vyšetření způsobují třeba i hemangiomy ve skeletu. Patologický signál v oblasti kostní dřeně detekuje infiltraci kostní dřeně mnohočetným myelomem, ale nevypovídá o tom, zda v ložisku s patologickým signálem již vznikla či nevznikla osteolýza [95].
Jedinci s asymptomatickým myelomem a abnormálním nálezem na MRI skeletu měli medián intervalu do přechodu v symptomatický myelom 16 měsíců, zatímco jedinci s asymptomatickým myelom a normálním MR zobrazením měli medián intervalu do přechodu v symptomatický myelom 43 měsíců [96]. Mariette prokázal, že ze 17 osob s asymptomatickým myelomem a s abnormálním MR obrazem progredovalo do symptomatického myelomu 8 z nich při mediánu sledování 25 měsíců [97].
Podobně Hillengass publikovat zkušenosti s celotělovým MR skeletu u jedinců s MGUS. Medián sledování byl 4,8 roku. Prokázal, že patologický obraz kostní dřeně je negativním prognostickým faktorem [98]. Výše uvedenými fakty chceme ilustrovat obtížnost interpretace MR nálezu a fakt, že drobná změny signálu v kostní dřeni neznamená již osteolýzu, i když je možná. Informaci, zda v oblasti patologického signálu je již jasná osteolýza, poskytne CT cílené zobrazení, jak ilustrují publikované obrázky.
Prognóza nemocného se však zásadně negativně změní, pokud MR již prokáže extramedulární propagaci myelomu třeba intraspinálně či extraspinálně.
Zobrazení magnetickou rezonancí se považuji za obligátní při předpokládané diagnóze solitárního plazmocytomu, pro vyhodnocení bolestivého místa skeletu k detekci mimokostního šíření plazmocelulárního infiltrátu, při podezření na míšní kompresi a případně k odlišení komprese obratle na základně prosté osteoporózy od komprese obratle při infiltraci myelomem.
CT zobrazení skeletu
CT zobrazení velmi přesně detekuje změny struktury hydroxyapatitové struktury kosti a ze všech vyšetření nejlépe odhaluje osteolýzu. Používá se tedy cíleně na suspektní části skeletu, kde klasický RTG snímek neprokázal osteolýzu [95].
Nízkodávkové celotělové CT
Nové CT přístroje umožnují celotělové CT zobrazení s nížší dávkou záření, takzvané low dose whole body CT. Toto vyšetření se zvažuje jako alternativa klasického snímkování skeletu. Tato metoda mnohem citlivěji odhaluje osteolytická ložiska ve skeletu ve srovnání s klasickými RTG snímky. Další výhodou je rychlost provedení a podstatně menší manipulace ve srovnání s klasickým RTG. Nevýhodou je přece jenom o něco větší celková dávka záření ve srovnání s klasickým snímkováním [99,100].
PET-CT vyšetření
PET-CT zobrazení přináší informace jak o struktuře hydroxyapatitové části skeletu – tedy o rozvoji osteolytických ložisek díky low dose CT komponentě vyšetření, tak informuje o aktivitě patologických infiltrátů ve skeletu i mimo něj díky PET komponentě vyšetření. Někdy PET-CT detekuje další, zatím zkryté nádorové onemocnění [101,102].
Přínos jednotlivých vyšetření ukazují obr. 1–4, jejich přednosti shrnuje tab. 8.
Obr. 1. PET CT zobrazení – forma MIP obraz (maximum intensity projections). Biodistribuce FDG ve snímané oblasti, mimo fyziologickou aktivitu (v mozkové kůře, patrových tonsilách, ledvinách a močovém měchýři) se zobrazují četná hypermetabolická ložiska ve skeletu od kalvy až po pánevní kosti 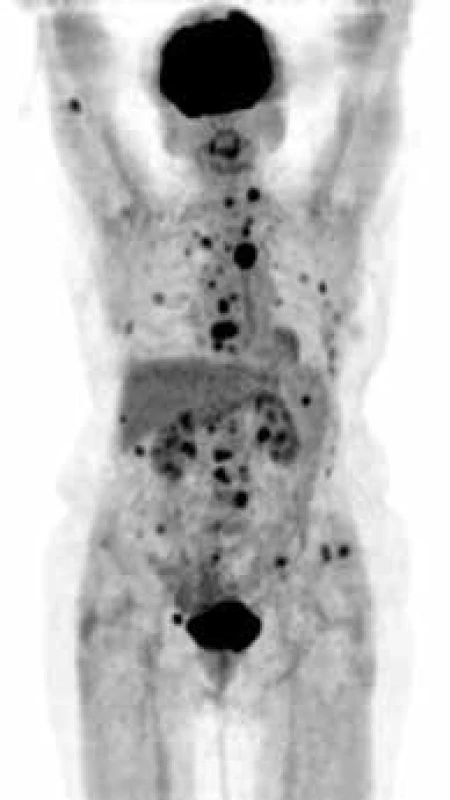
Obr. 2. V levé lopatě kyčelní v LD CT obrazu evidentní osteolytická léze bez metabolického korelátu v PET obrazu, v pravé lopatě kyčelní naopak 2 drobná ložiska akumulace FDG bez jednoznačného korelátu v LD CT obrazu 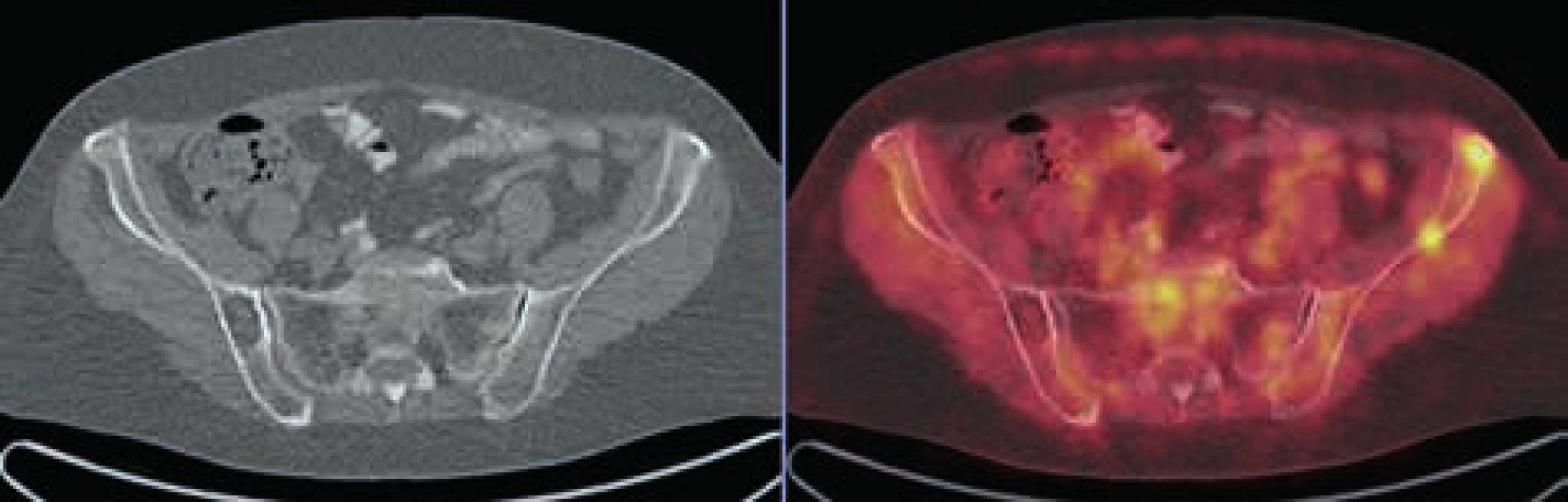
Obr. 3. Osteolytické ložisko v levé polovině sterna vykazuje pozitivitu v PET obrazu 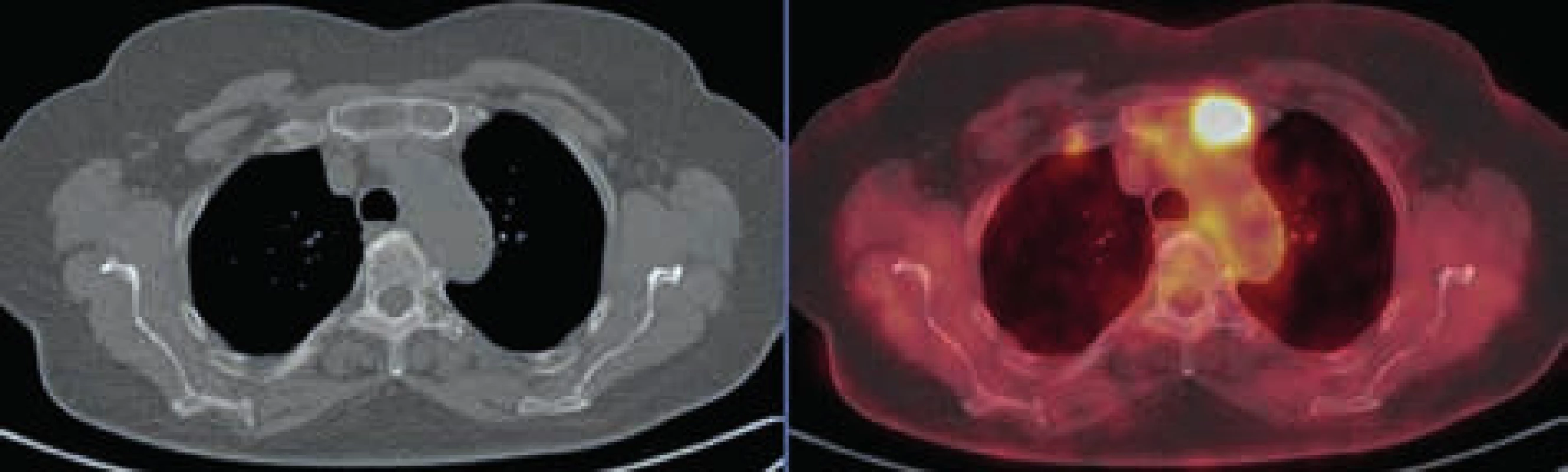
Tab. 7. Zobrazovací techniky. O struktuře hydroxypatitové struktury skeletu informují klasické snímky skeletu anebo CT vyšetření, o změnách v kostní dřeni informuje MRI vyšetření a PET vyšetření 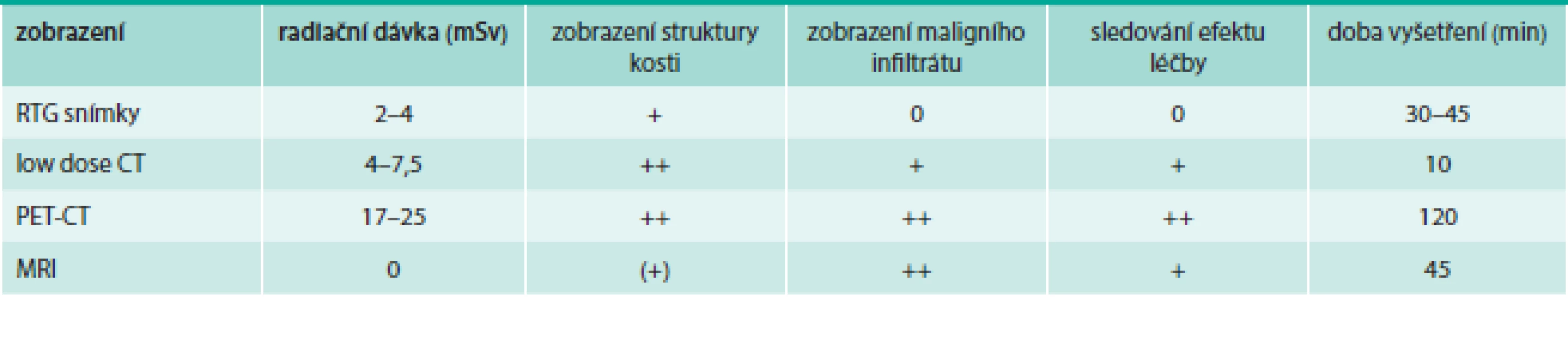
Kostní denzitometrie u osob s MGUS
Kostní denzitometrie se v případně průkazu osteoporózy doporučuje v 2letých intervalech, v případně neprokázání osteoporózy považují autoři za vhodné udělat kontrolní kostní denzitometrii po 5 letech [91].
Přínos sledování
Důkaz, že je opravdu sledování přínosem, byl zveřejněn teprve v roce 2013 na sjezdu Americké hematologické společnosti. V rámci švédské studie bylo sledováno 14 798 osob s mnohočetným myelomem diagnostikovaným v letech 1976–2005. Z toho u 394 pacientů předcházela diagnóza MGUS. Medián celkového přežití byl delší u pacientů, u nichž předcházelo sledování pro MGUS. Pacienti dříve sledovaní pro MGUS měli po transformaci do myelomu přežití s mediánem 2,8 roku; (95% CI 2,6–3,3). Pacienti, u nichž byl myelom diagnostikován až při symptomech, bez toho, že by se dříve u nich vědělo o přítomnosti monoklonálního imunoglobulinu, měli přežití kratší, medián byl jen 2,1 roku (95% CI 2,1–2,2). Zdůrazňujeme, že se jednalo o populační studii, do níž byli zařazeni naprosto všichni diagnostikovaní nemocní, tedy i nemocní velmi staří, což vysvětluje, proč jsou mediány přežití kratší, než je obvyklé z klinických studií, které reportují přežití skupin pacientů vybraných dle vstupních kritérií studie, takže selektované populace.
Tato švédská studie prokázala, že předchozí znalost přítomnosti monoklonálního imunoglobulinu a pravidelné sledování vede i k lepším výsledkům léčby při transformaci v mnohočetný myelom. Švédští autoři proto navrhují zvážit screening přítomnosti monoklonálního imunoglobulinu u osob starších 50 let [103].
Podobně kolektiv autorů z Mayo Clinic analyzoval dopad optimálního sledování osob s MGUS na časnost záchytu a prognózu. Při rozdělení nemocných do skupiny optimálně sledované a neoptimálně sledované nenalezli žádný rozdíl v celkovém přežití [104].
Asymptomatický myelom
Prognostický index pro asymptomatický myelom
Osoby s asymptomatickým myelomem nemají žádné potíže jako osoby s MGUS a do konce roku 2013 platilo, že mimo klinické studie není v této skupině indikována protimyelomová léčba. Pro pacienty s asymptomatickým myelomem platí vše, co bylo uvedeno o jedincích s MGUS, pouze jejich riziko přechodu v symptomatický mnohočetný myelom je vyšší.
Pro stanovení diagnózy asymptomatického (doutnajícího) myelomu je dostačující, pokud je koncentrace monoklonálního imunoglobulinu rovna 30 g/l a vyšší, anebo pokud v kostní dřeni je nalezeno 10 % plazmocytů a více. Riziko transformace v symptomatický myelom se dále navyšuje, pokud jsou splněny obě dvě podmínky a pokud jsou navíc přítomny mimo kompletní molekulu monoklonálního imunoglobulinu i volné lehké řetězce κ nebo λ. Z těchto 3 parametrů byl vytvořen jednoduchý prognostický index pro odhad rizika transformace v symptomatický mnohočetný myelom [105], tak jak jej uvádí tab. 9. Pro průkaz kostních ložisek se dnes upřednostňuje při podezření plynoucí z anamnézy provést i při normálním RTG nálezu cílené MRI, případně celotělové MRI, či low-dose CT skeletu a v případě, že tato vyšetření nestačí zodpovědět položenou otázku, tak PET-CT vyšetření.
Tab. 8. Prognostický index pro nemocné s asymptomatickým myelomem získaný analýzou souboru 276 sledovaných osob [93]. ![Prognostický index pro nemocné s asymptomatickým myelomem získaný analýzou souboru 276 sledovaných osob [93].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6783a8a2128132c3eea288590041e0c2.png)
Uvedený index však neumožní identifikovat ty nemocné, u nichž by byla vhodná léčba. Při zvýšení hranice počtu plazmatických buněk v kostní dřeni nad 60 % byla definována podskupina pacientů s doutnajícím myelomem, v níž u 95 % osob došlo k progresi do symptomatického myelomu do 2 let [106,107].
Jedním z jistých známek progrese asymptomatického myelomu do symptomatického je také klesající koncentrace hemoglobinu [108].
Vyčlenění vysoce rizikové skupiny vhodné k léčbě
Koncem roku 2013 byl na sjezdu Americké hematologické společnosti (ASH) zveřejněn a později publikován in extenso revoluční názor autorů z Mayo Clinic, který mění předchozí pohled na asymptomatický myelom a vyčleňuje z něj velmi malou podskupinu s vysokým rizikem transformace v průběhu 2 let, u níž doporučují zahájit standardní léčbu myelomu. A tendo názor byl zveřejněn sjezdu Evropské hematologické společnosti v Miláně v roce 2014.
U pacientů s asymptomatickým (doutnajícím) myelomem, u nichž nejsou přítomny žádné klinické známky odpovídající těm, které jsou shrnuty v akronymu CRAB, a kteří mají jeden či více z níže uvedených rizikových faktorů, doporučují podat léčbu jako u klasického symptomatického myelomu:
- pacientům, kteří mají v kostní dřeni přítomno 60 % a více plazmocytů, kteří mají 90% riziko progrese do 2 let
- pacientům, u nichž je poměr volného lehkého řetězce κ/λ 100 a více, nebo 0,01 a méně. Zde je riziko 80% riziko progrese do 2 let
- pacientům, u nichž celotělové MRI vyšetření prokázalo více než 1 fokální ložisko v axiálním skeletu, přičemž autoři považují PET-CT vyšetření jako vhodnou alternativu celotělového MRI, zde je 70% riziko progrese do symptomatického myelom do 2 let, a proto se autoři domnívají, že pro tyto nemocné je výhodnější léčbu podat, než je dále sledovat [109]
Ostatní pacienty, spadající do kategorie asymptomatického myelomu, doporučují zatím sledovat, případně zařadit do klinických studií testujících přínos léčby u těchto jinak zdravých osob.
Při sledování a hodnocení, zda se jedná o symptomatický či asymptomatický myelom, je však nutné nezaměřit se pouze na příznaky označené akronymem CRAB, ale i na případné vzácnější příznaky mnohočetného myelomu, které mohou být také indikací k zahájení léčby (příznaky spinální komprese, či komprese průběhu nervu případnou expanzí extramedulárního myelomu, hyperviskózní syndrom, AL-amyloidóza při mnohočetném myelomu, koagulační poruchy ať již ve formě krvácivé, tak ve formě tromboembolické, systémové příznaky jako horečka nejasné etiologie, úbytek hmotnosti, časté bakteriální infekce – více než 2 závažné bakteriální infekce v průběhu posledních 12 měsíců, symptomy kryoglobulinemie). Při sledování pacientů a rozhodování, zda splňuje kritéria symptomatického či asymptomatického myelomu, je třeba proto nesoustředit se pouze na splnění kritérií CRAB, ale vnímat, zda nejsou přítomny i jiné klinicky závažné symptomy mnohočetného myelomu [110].
Očekávaný vývoj
Víme, že pokročilý symptomatický myelom je stále řazen do skupiny převážně nevyléčitelných nemocí a ani nové léky s tím nic zásadního neudělaly, i když prodloužily průměrné přežití pacientů a zvýšily míru léčebné odezvy i jejich hloubku.
A tak je pochopitelné, že se výzkumné týmy se snaží zjistit, zda nebudou lepší výsledky, když se podá léčba ještě před rozvinutím symptomatické choroby s nevratným poškozením orgánů. Znamená to podat léčbu ještě v době asymptomatického myelomu, kdy se osoby s touto odchylkou cítí zcela zdravé a chtějí žít plnohodnotný život. Znamená to dát jim na jedné straně naději, že se choroba nikdy neprobudí a na straně druhé je zatížit nežádoucími účinky léčby v době, kdy nepociťují žádné zdravotní potíže.
Kolektiv z Mayo Clinic již definoval podskupinu z jednotky zvané asymptomatický myelom, když již je indikováno zahájení léčby. Domníváme se, že je vhodné, aby kritéria vysoce rizikového asymptomatického myelomu byla ověřena i dalšími pracovními skupinami, než budou přijata jako standardní indikace k léčbě.
Četné klinické experimentální studie jdou ještě dále a nabízejí léčbu naprosto všem osobám s asymptomatickým myelomem. Zda tento postup bude přínosem, se ale dozvíme až za více let, protože argumentem pro podobný postup nemůže být jen délka trvání remise a míra léčebné odezvy, ale hlavním argumentem musí být srovnání celkového přežití u osob se zahájenou léčbou v době asyptomatického myelomu s celkovým přežitím při oddálení zahájení léčby až při symptomech nemoci. Tato otázka byla samozřejmě již řešena dříve v době, kdy byla k dispozici jen klasická cytostatika, a výsledkem bylo, že časné zahájení léčby neprodloužilo celkové přežití. Z toho bylo odvozeno současné pravidlo, zahajovat léčbu mnohočetného myelomu až jsou zřetelné symptomy nemoci [97].
Autoři současných studií testují, zda toto pravidlo z doby klasických cytostatik ztratilo svoji platnost v době nových velmi účinných léčiv.
Závěry pro praxi
- Vyšetření přítomnosti monoklonálního imunoglobulinu a jeho koncentrace a vyšetření koncentrace volných lehkých řetězců κ a λ v séru je nutné u každé nejasné bolesti páteře a jiných kostí, při poškození funkce ledvin, při zvýšené celkové bílkovině nad normu a při jakýchkoliv zdravotních problémech, u nichž neznáme příčinu.
- Prokázaný monoklonální imunoglobulin je důvodem k došetření na odborném hematologickém pracovišti a obvykle i k dalšímu sledování vývoje jeho koncentrace s cílem odhalit včas transformaci v maligní onemocnění. Intervaly sledování se upřesní dle prognostických znaků.
- V případě, že se neprokáže maligní onemocnění, ale prokáže se poškození organizmu monoklonálním imunoglobulinem, je také indikována léčba podobně jako u mnohočetného myelomu.
- Při zjištění monoklonální gamapatie nejistého významu je doporučeno provést také vyšetření denzity kostí metodou DEXA a její sledování, protože osoby s MGUS mají zvýšené riziko vzniku osteoporózy.
- Do roku 2013 platilo pravidlo, že osoby s monoklonální gamapatií a osoby s asymptomatickým myelomem nedostávaly žádnou protimyelomovu léčbu. V roce 2014 byla ze skupiny osob s asymptomatickým myelomem vyčleněna podskupina s vysokou pravděpodobností transformace v mnohočetný myelom v průběhu dalších 2 let. Pokud se tato prognostická kritéria potvrdí i další pracovní skupiny, stanou se indikací k podání léčby.
Text byl vytvořen v souvislosti s následujícími granty: NT13190–3/2012, NT14310–3/2013, NT12215–4/2011 NT 12215–4/2011, NT12215, MZ ČR-RVO (FNBr, 65269705) a dále OP VaVpl – RECAMO, CZ.1.05/2.1.00/03.0101, MZ ČR -RVO (MOÚ 00209805), MUNI/A/0830/2013, NT12130 a NT 14575.
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 11. 3. 2014
Přijato po recenzi 30. 6. 2014
Zdroje
1. Sčudla V, Pika T, Budíkova M et al. The relationship between some soluble osteogenic markers, angiogenic cytokines/other biological parameters and the stages of multiple myeloma evaluated according to the Durie-Salmon and International Prognostic Indexstratification systems. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2009; 153(4): 275–282.
2. Ščudla V, Petrová P, Minařík J et al. Příspěvek k hodnocení sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a v jednotlivých klinických stadiích mnohočetného myelomu. Vnitř Lék 2010; 56(6): 591–601.
3. Ščudla V, Budíková M, Petrová P et al. Česká myelomová skupina. Analýza hladin vybraných sérových markerů u monoklonální gamapatie nejistého významu a u mnohočetného myelomu. Klin Onkol 2010; 23(3): 171–181.
4. Ščudla V, Budíková M, Pika T et al. Srovnání hladin vybraných biomarkerů u monoklonální gamapatie nejistého významu a u mnohočetného myelomu. Čas Lék Česk 2009; 148(7): 315–322.
5. Kyle RA. Monoclonal gammopathy of undetermined significance. Natural history in 241 cases. Am J Med 1978; 64(5): 814–826.
6. Kyle RA. Monoclonal gammopathy of uncertain significance; natural history in 241 cases. Mayo Clinic Proceedings 1978; 64(5): 814–826.
7. Landgren O, Kyle RA, Pfeiffer R et al. Monoclonal gammopathy of undetermines significance consistently precedens multiple myeloma: a prospective study. Blood 2009; 113(22): 5412–5417.
8. Weiss BM, Abadie J, Verma P et al. A monoclonal gammopathy precedens multiple myeloma in most patients. Blood 2009; 113(22): 5418–5422.
9. Axelsson U, Bachmann R,Hällén J. Frequency of pathological proteins (M-components) in 6,995 sera from an adult population. Acta Med Scand 1966; 179(2): 235–247.
10. Saleun JP, Vicariot M, Deroff P et al. Monoclonal gammopathies in the adult population of Finistère, France. J Clin Pathol 1982; 35(1): 63–68.
11. Kyle RA, Therneau TM, Rajkumar SV et al. Prevalence of monoclonal gammopathy of undetermined significance. N Engl J Med 2006; 354(13): 1362–1369.
12. Kyle RA, Therneau TM, Rajkumar SV et al. A long - term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002; 346(8): 564–569.
13. Dispensieri A, Katzman JA, Kyle RA et al. Prevalence and risk of progression of light-chain monoclonal gammopathy of undetermined significance: a retrospective population based cohort study. Lancet 2010; 375(9727): 1721–1728.
14. Tichý M, Maisnar V. Laboratorní průkaz monoklonálního imunoglobulinu. Vnitř Lék 2006; 52(Suppl 2): S41-S45.
15. Ščudla V, Herman M, Minařík J et al. Přínos celotělové magnetické resonance pro diagnózu monoklonální gamapatie nejistého významu, mnohočetého myelomu a stanovení Durie-Salmon Plus. Vnitř Lék 2011; 57(1): 52–60.
16. Mysliveček M, Bačovský J, Ščudla V et al. 18F-FDG PET/CT a 99mTc-MIBI scintigrafie při hodnocení pacientů s mnohočetným myelomem a monoklonální gamapatií nejistého významu: srovnání metod. Klin Onkol 2010; 23(5): 325–331.
17. Mecl J, Benáková H, Nohejlová A et al. Detekce lehkých řetězců, nová metoda diagnostiky krevních chorob. Čas Lék Česk 2007; 146(2): 159–162.
18. Ščudla V, Budíková M, Pika T et al. Česká myelomová skupina. Srovnání sérových hladin vybraných biologických parametrů u monoklonální gamapatie nejistého významu a mnohočetného myelomu. Vnitř Lék 2006; 52(3): 232–240.
19. Tichý M, Rehácek V, Maisnar V et al. Monoklonální gamapatie v sérii 1683 dárců plazmy. Čas Lék Česk 2004; 143(6): 401–404.
20. Maisnar V, Tousková M, Malý J et al. Význam vybraných laboratorních ukazatelů pro diferenciální diagnostiku a sledování aktivity mnohočetného myelomu. Vnitř Lék 2002; 48(4): 290–297.
21. Mian M, Franz I, Wasle I et al. “Idiopathic Bence-Jones proteinuria”: a new characterization of an old entity. Ann Hematol 2013; 92(9): 1263–1270.
22. Maisnar V, Tichy M, Stulik J et al. The problems of proteinuria measurement in urine with presence of Bence Jones protein. Clin Biochem 2011; 44(5–6): 403–405.
23. Vachon CM, Kyle RA Therneau TM et al. Increased risk of monoclonal gammopathy in first degree relatives of patients with multiple myeloma or monoclonal gammopathy of undetermined significance Blood 2009; 114 : 785–790.
24. Langren P. Kristinsson SY, Goldin LR et al. Risk of plasma cell and lymphoproliferative disorders among 14621 first-degree relatives of 4458 patients with monoclonal gammopathy of undetermined significance in Sweden. Blood 2009; 114(4): 791–795.
25. Greenberg AJ, Rajkumar SV, Larson DR et al. Increased prevalence of light chain monoclonal gammopathy of undetermined significance in first degrese relativem of individuals with multiple myeloma. Brit J Haematol 2012; 157(4): 472–475.
26. Landgren O, Kyle RA, Hoppin JA et al. Pesticide exposure and risk of monoclonal gammopathy on undetermined significance in the Agricultural Health Study. Blood 2009; 113(25): 6386–6391.
27. McShane CM, Murray LJ, Landgren O et al. Prior autoimmune disease and risk of monoclonal gammopathy of undetermined significance and multiple myeloma: a systematic review. Cancer Epidemiol Biomarkers Prev 2014; 23(2): 332–342.
28. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121(5): 749–757.
29. Kyle RA, Durie BG, Rajkumar SV et al. International Myeloma Working Group. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24(6): 1121–1127.
30. Rajkumar SV, Kyle RA, Baudi FK. Advances in the diagnosis, classification, risk stratification, and management of monoclonal gammopathy of undetermined significance: implications for recategorizing disease entities in the presence of evolving scientific evidence. Mayo Clin Proc 2010; 85(10): 945–948.
31. Mian M, Franz I, Wasle I et al. “Idiopathic Bence-Jones proteinuria”: a new characterization of an old entity. Ann Hematol 2013; 92(9): 1263–1270.
32. Fernández de Larrea C, Kyle RA, Durie BG et al. International Myeloma Working Group. Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group. Leukemia 2013; 27(4): 780–791.
33. Ščudla V. Diagnostický význam a úskalí hodnocení roztěrového preparátu kostní dřeni u mnohočetného myelomu. Vnitř Lék 2006; 52(Suppl 2): S55-S65.
34. Banwait R, O’Regan K, Campigotto F et al. The role of 18F-FDG PET/CT imaging in Waldenstrom macroglobulinemia. Am J Hematol 2011; 86(7): 567–572.
35. Gertz MA. Waldenström macroglobulinemia: 2013 update on diagnosis, risk stratification, and management. Am J Hematol 2013; 88(8): 703–711.
36. Shaheen SP, Talwalkar SS, Lin P et al. Waldenström macroglobulinemia: a review of the entity and its differential diagnosis. Adv Anat Pathol 2012; 19(1): 11–27.
37. Owen RG, Pratt G, Auer RL et al. Guidelines on the diagnosis and manageěent of Waldenström macroglobulinaemia. Br J Haematol 2014; 165(3): 316–333.
38. Kyle RA, Therneau TM, Dispenzieri A et al. Immunoglobulin m monoclonal gammopathy of undetermined significance and smoldering Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2013; 13(2): 184–186.
39. Lin P, Hao S, Handy BC et al. Lymphoid neoplasms associated with IgM paraprotein: a study of 382 patients. Amer J Clin Pathol 2005; 123(2): 200–205.
40. Adam Z, Štěpánková S, Sirotková A et al. Selhání ledvin u pacientky s chronickou B-lymfoctární leukémií (B-CLL) vzniklé na podkladě tvorby odlitkových válců v tubulech ledvin z monoklonálních lehkých řetězců (casth nephropathy). Přínos stanovení volných lehkých řetězců imunoglobulinů pro časnou diagnostiku této komplikace. Vnitř Lék 2011; 57(2): 214–221.
41. Merlini G, Stone MJ. Dangerous small B-cell clones. Blood 2006; 108(8): 2520–2530.
42. Hardiman KL, Horn S, Manoharan A et al. Rheumatic autoantibodies in the sera of patients with paraproteins. Clin Exp Rheumatol 1994; 12(4): 363–368.
43. Daoud MS, Lust JA, Kyle RA et al. Monoclonal gammopathies and associated skin disorders. J Amer Acad Dermatos 1999; 40(4): 507–535.
44. Idilman R, Colantoni A, De Maria N et al. Lymphoproliferative disorders in chronic hepatitis C. J Viral Hepat 2004; 11(4): 302–309.
45. Amara S, Dezube BJ, Cooley TP et al. HIV-associated monoclonal gammopathy: a retrospective analysis of 25 patients. Clin Infect Dis 2006; 43(9): 1198–1205.
46. Caforio AL, Gambino A, Belloni Fortina A et al. Monoclonal gammopathy in heart transplantation: risk factor analysis and relevance of immunosuppressive load. Transplant Proc 2001; 33(1–2): 1583–1584.
47. Kyle RA, Rajkumar SV et al. Monoclonal gammopathy of undetermined significance. Brit J Haematol 2006; 134(6): 573–589.
48. Rajkumar SV, Kyle RA, Therneau TM et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106(3): 812–817.
49. Kyle RA, Thernau TM, Rajkumar SV et al. Long term follow up of 241 patients with monoclonal gammopathy of undetermined significance. The original Mayo Clinic series 25 years later. Mayo Clin Proc 2004; 79(7): 859–866.
50. Cesana C, Klersy C, Barbarano L et al. Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. J Clin Oncol 2002; 20(6): 1625–1634.
51. Blade J, Lopez-Guillermo A, Rozman C et al. Malignant transformation and life expectancy in monoclonal gammopathy of undetermined significance. Brit J Haematol 1992; 81(3): 391–394.
52. Gregersen H, Mellemkjær L, Ibsen JS et al. The impact of M-component type and immunoglobulin concentration on the risk of malignant transformation in patients with monoclonal gammopathy of undetermined significance. Haematologica 2001; 86(11): 1172–1179.
53. Rosiñol L, Cibeira MT, Montoto S et al. Monoclonal gammopathy of undetermined significance: predictors of malignant transformation and recognition of an evolving type characterized by a progressive increase in M protein size. Mayo Clinic Proc 2007; 82(4): 428–834.
54. Rajkumar SV, Mesa AM, Fonseca R et al. P.R. Bone marrow angiogenesis in 400 patients with monoclonal gammopathy of undetermined significance multiple myeloma and primary amyloidosis. Clin Cancer Res 2002; 8(7): 2210–2216.
55. Kumar S, Rajkumar SV, Kyle RA et al. Prognostic value of circulating plasma cells in monoclonal gammopathy of undetermined significance. J Clin Oncol 2005; 23(24): 5668–5674.
56. Pérez-Persona E, Vidriales MB, Mateo G et al. New criteria to identify risk of progression in monoclonal gammopathy of uncertain significance and smoldering multiple myeloma based on multiparameter flow cytometry analysis of bone marrow plasma cells. Blood 2007; 110(7): 2586–2592.
57. Rajkumar SV, Lacy MQ, Kyle RA. Monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. Blood Rev 2007; 21(5): 255–265.
58. Hillengass HJ, Weber MA, Kilk K et al. Prognostic significance or whole body MRI in patients with monoclonal gammopathy of undetermined significance. Leukemia 2014; 28(1):174–178.
59. Rajkumar SV, Kyle RA, Therneau TM et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106(3): 812–817.
60. Baldini L, Guffanti A, Cesana BM et al. Role of different hematologic variables in defining the risk of malignant transformation in monoclonal gammopathy. Blood1996; 87(3): 912–918.
61. Kyle RA, Gertz MA, Witzig TE et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clinic Proc 2003; 78(1): 21–33.
62. Pika T, Lochman P, Klencová M et al. Suprese alternativního páru imunoglobulinu koreluje s mírou rizikovosti MGUS výraznějši nežli suprese hladin polyklonálních imunoglobulinů – dílčí výsledky vyšetření HevyLite u MGUS. Klin Biochem Metab 2012; 20(41): 63–71.
63. Katzman JA, Clark R, Kyle RA et al. Suppression of uninvolved imunoglobulin defined by haevy/light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27(1): 208–212.
64. Espiño M, Medina S, Blanchard MJ et al. Involved/uninvolved immunoglobulin ratio identifies monoclonal gammopathy of undetermined significance patients at high risk of progression to multiple myeloma. Br J Haematol 2014; 164(5): 752–755.
65. Rosinol L, Cibeira MG, Montoto S et al. Monoclonal gammopathy of undetermined significance: predictors of malignant transformation and recognition of an evolving type characterized by a progressive increase in M protein size. Mayo Clin Proc 2007; 82(4): 428–434.
66. Perez Persona E, Vidriales MG, et al. New criteria to identify risk of progression in monoclonal gammopathy of undetermined significance and smoldering myeloma based on multiparameter flow cytometriy analysis of bone marrow plasma cells. Blood 2007; 110(7): 2586–2592.
67. Bladé J, Dimopoulos M, Rosiñol L et al. Smoldering (asymptomatic) multiple myeloma: current diagnostic criteria, new predictors of outcome, and follow-up recommendations. J Clin Oncol 2010; 28(4): 690–697.
68. Dizdar O, Erman M, Cankurtaran M at al. Lower bone mineral density in geriatric patients with monoclonal gammopathy of undetermined significance. Ann Hematol 2008; 87(1): 57–60.
69. Pepe J, Petrucci MT, Nofroni I et al. Lumbar bone mineral density as the major factor determining increased prevalence of vertebral fractures in monoclonal gammopathy of uncertain significance. Brit J Haematol 2006; 134(5): 485–490.
70. Melton LJ, Rajkumar SV, Khosla S et al. Fracture risk in monoclonal gammopathy of undetermined significance. J Bone Miner Res 2004; 19(1): 25–30.
71. Gregersen H, Jensen P, Gislum M et al. Fracture risk in patients with monoclonal gammopathy of undetermined significance. Brit J Haematol 2006; 135(1): 62–67.
72. Pepe J, Petrucci MT, Mascia ML et al. The effects of alendronate treatment in osteoporotic patients affected by monoclonal gammopathy of undetermined significance. Calcif Tissue Int 2008; 82(6): 418–426.
73. Jakob C, Zavrsky I, Heider U et al. Bone resorption parameters [carboxy-terminal telopeptide of type-I collagen (ICTP), amino-terminal collagen type-I telopeptide (NTx), and deoxypyridinoline (Dpd)] in MGUS and multiple myeloma. Eur J Haematol 2002; 69(1): 37–42.
74. Politou M, Termos E, Anagnostopoulos A et al. Role of receptor activator of nuclear factor-kappa B ligand (RANKL), osteoprotegerin and macrophage protein 1-alpha (MIP-1a) in monoclonal gammopathy of undetermined significance (MGUS). Brit J Haematol 2004; 126(5): 686 - 689.
75. Bida JP, Kyle RA, Therneau TM et al. Disease association with monoclonal gammopathy of undetermined significance. A population based study of 17398 patients. Mayo Clin Proc 2009; 84(8): 685–693.
76. Farr JN, Zhang W, Kumar SK et al. Altered cortical microarchitecture in patients with monoclonal gammopathy of undetermined significance. Blood 2014; 123(5): 647–649.
77. Kristinsson SY, Tang M, Pfeiffer RM et al. Monoclonal gammopathy of undetermined significance and risk of skeletal fractures: a population-based study. Blood 2010; 116(15): 2651–2655.
78. Abrahamsen B, Andersen J, Christensen SS et al. Utility of testing for monoclonal bands in serum of patients with suspected osteoporosis. Brit Med J 2005; 330(7495): 818.
79. Golombic T, Diamond T et al. Prevalence of monoclonal gammopathy of undetermined significance /myeloma in patients with ace osteoporotic vertebral fracture. Annal Haematol 2008; 120(2): 87–90.
80. Srkalovic G, Cameron M, Rybicki L et al. Monoclonal gammopathy of undetermined significance and multiple myeloma are associated with an increased incidence of venothromboembolic disease. Cancer 2004; 101(3): 558–566.
81. Sallah S, Husain A, Wan J et al. The risk of venous thromboembolic disease in patients with monoclonal gammopathy of undetermined significance. Annals of Oncology 2004; 15(10): 1490–1494.
82. Kristinsson SA, Fars TR, Grindley G et al. Deep vein trombosis after monoclonal gammopathy of undetermined significance and multiple myeloma. Blood 2008; 112(9): 3582–3586.
83. Gregersen H, Norgaard M, Severinsen MT at al. Monoclonal gammopathy of undetermined significance and risk of venous trombembolism. Eur J Haematol 2011; 86(2): 129–134.
84. Kristinsson SY, Tang M, Phfeiffer RM et al. Monoclonal gammopathy of undetermined significance and risk of infections. A population based study. Haematologica 2012; 97(6): 854–858.
85. Roeker LE, Larson DR, Kyle RA et al. Risk of acute leukemia and myelodysplastic syndromes in patients with monoclonal gammopathy of undetermined significance (MGUS). A population-based study of 17315 patients. Leukemia 2013; 27(6): 1391–1393.
86. Jimenez-Zepeda VH, Heilman RL, Engel RA et al. Monoclonal gammopathy of undetermined significance does not affect outcomes in patients undergoing solid organ transplants. Transplantation 2011; 92(5): 570–574.
87. Redfield RR, Naji A. Progression of monoclonal gammopathy of undetermined significance to multiple myeloma in a solid organ transplant. Transplantation 2011; 92(12): e65-e66.
88. Rostaing L, Modesto A, Abbal M et al. Long-term follow-up of monoclonal gammopathy of undetermined significance in transplant patients. Am J Nephrol 1994; 14(3): 187–191.
89. Chakalarovski C, Lang P, Buisson C et al. Monoclonal immunoglobulins in patients with renal transplants: characterization, evolution and risk factors. Transpl Int 1992; 5(Suppl 1): S23-S25.
90. Hadden RD, Nobile-Orazio E, Sommer C et al. European Federation of Neurological Societies/Peripheral Nerve Society guideline on management of paraproteinaemic demyelinating neuropathies: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society. Eur J Neurol 2006; 13(8): 809–818.
91. Berenson JR, Anderson KC, Aureol RA et al. Monoclonal gammopathy of undetermined significance: a consensus statement. Brit J Haematol 2010; 150(1): 28–38.
92. Brioli A, Giles H, Pawlyn C et al. Serum free immunoglobulin light chain evaluation as a marker of impact from intraclonal heterogeneity on myeloma outcome. Blood 2014; 123(22): 3414–3419.
93. Kyle RA, Therneau TM, Rajkumar SV et al. Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clin Proc 2004; 79(7): 859–866.
94. van de Donk NW, Palumbo A, Johnsen HE et al. The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. Haematologica 2014; 99(6): 984–996.
95. Dimopoulos M, Termos E, Comenzo RL et al. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques and monitoring multiple myeloma. Leukemia 2009; 23(9): 1549–1556.
96. Moulopoulos LA, Dimopoulos MA, Smith TL et al. Prognostic significance of magnetic resonance imaging in patients with asymptomatic myeloma. J Clin Oncol 1995; 13(1): 251–256.
97. Mariette X, Zagdanski AM, Guermazi A et al. Prognostic value of vertebral lesions detected by magnetic resonance imaging stage I multiple myeloma. Br J Haematol 1999; 104(4): 723–729.
98. Hillengass J, Weber MA, Kilk K et al. Prognostic significance of whole-body MRI in patients with monoclonal gammopathy of undetermined significance. Leukemia 2014; 28(1): 174–178.
99. Minařík J, Hrbek J, Pika T et al. Srovnání přínosu konvenčního RTG, celotělové magnetické rezonance a celotělového nízkodávkového CT v diagnostice myelomové kostní nemoci. Osteol Bulletin 2013; 18(4): 143–147.
100. Minařík J, Hrbek J, Pika T et al. Pilotní hodnocení nízkodávkovné výpočetní tomografie (LD CT) u nemocných s mnohočetným myelomem, srovnání s konvenční radiografií a celotělovou magnetickou rezonancí. Olomoucké hematologické dny 2014. Sborník abstrakt. Dostupné z WWW: <http://www.olhemdny.cz/files/2014/abstrakta_2014.pdf>.
101. Caers J, Withofs N, Hillengass J et al. The role of positron emission tomography-computed tomography and magnetic resonance imaging in diagnosis and follow up of multiple myeloma. Haematologica2014; 99(4): 629–637.
102. Adam Z, Bolcak K, Stanicek J et al. Fluorodeoxyglucose positron emission tomography in multiple myeloma, solitary plasmocytoma and monoclonal gammapathy of unknown significance. Neoplasma 2007; 54(6): 536–640.
103. Sigurdardottir EE, Turesson I, Lund SH et al. Multiple Myeloma Patients With Prior Knowledge Of MGUS Have a Better Survival Compared To Multiple Myeloma Patients Without Prior Knowledge Of MGUS. Blood 2013; 122(21): 1984.
104. Bianchi G, Kyle RA, Colin L et al. Impact of optimal follow up of monoclonal gammopathy of undetermined significance, on early diagnosis and prevention of myeloma related complications. Blood 2010; 116(12): 2019–2025.
105. Dispenzieri A, Kyle RA, Katzmann JA et al. Immunoglobulin free light chain ratio is and independent riskt factor for progression of smoldering myeloma (asymptomatic) multiple myeloma. Blood 2008; 111(2): 758–789.
106. Rajkumar SV, Larson D, Kyle RA et al. Diagnosis of smoldering multiple myeloma. N Engl J Med 2011; 365(5): 474–475.
107. Rajkumar SV, Kyle RA. Haematological cancer: Treatment of smoldering multiple myeloma. Nat Rev Clin Oncol 2013; 10(10): 554–555.
108. Bladé J, Dimopoulos M, Rosinol L et al. Smoldering (asymptomatic) multiple myeloma. Current diagnostic kriteria new predictors of outcome and follow up recommendation. J Clin Oncol 2010; 28(4): 690–697.
109. Dispenzieri A, Stewart AK, Chanan-Khan A et al. Smoldering multiple myeloma requiring treatment: time for a new definition? Blood 2013; 122(26): 4172–4181.
110. Talamo G, Farroq U, Zangar M et al. Beyond the CRAB symptoms: a study of presenting clinical manifestations of multiple myeloma. Clin Lymphoma Myeloma Leuk 2010; 10(6): 464–468.
111. Mangiacavalli S, Cocito F, Pochintesta L et al. Monoclonal gammopathy of undetermined significance: a new proposal of work up. Eur J Haematol 2013; 91(4): 356–360.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let – editorial
- Czech TAVI Registry. Potrebujeme registre? – editorial
- Léčba obezity u osob s diabetem 2. typu – editorial
- Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
- Infekční endokarditidy v okrese Tábor v letech 2009–2013
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
- Uživatelské výstupy z národního registru katetrových implantací aortální chlopně (Czech TAVI Registry): možnosti analytických výstupů založených na databázovém systému TrialDB2
- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Plicní hypertenze – patofyziologické mechanizmy
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Asociace aterotrombózy a trombofilie – genetické aspekty
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Dna a kardiovaskulární riziko
- Jak se mění možnosti léčby obézních diabetiků 2. typu
- Aktualizované stanovisko České společnosti pro hypertenzi k provádění renálních denervací u rezistentní hypertenze
- Jiří Gallo. Osteoartróza. Průvodce pro každodenní praxi.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Dna a kardiovaskulární riziko
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




